Anti-inflammation Activity Evaluation of Apigenin-O-Glycosides and Apigenin-C-Glycosides
-
摘要: 目的:评价2种芹菜素黄酮氧苷(芹菜素-7-O-β-D-吡喃葡萄糖苷和5-O-β-D-吡喃葡萄糖苷芹菜甙元)和2种芹菜素黄酮碳苷(牡荆素和异牡荆素)的抗炎活性。方法:采用Western Blot法测定芹菜素黄酮苷在炎性细胞THP-1中的蛋白变化,采用酶联免疫法和实时荧光定量聚合酶链式反应法分析细胞中细胞因子变化。结果:4种芹菜素黄酮苷均能极显著抑制IL-10 mRNA的上升(P<0.01),且牡荆素、异牡荆素能够极显著地抑制环氧合酶-2酶活力(P<0.01),此外,异牡荆素还通过极显著抑制白细胞介素1β(P<0.01)和白细胞介素6(P<0.01)发挥了更有效的抗炎作用,而芹菜素-7-O-β-D-吡喃葡萄糖苷极显著抑制了肿瘤怀素因子TNF-α的表达(P<0.01),5-O-β-D-吡喃葡萄糖苷芹菜甙元则对除IL-10外的其余几种细胞因子无抑制作用;进一步的研究发现,8位碳苷取代形成的芹菜素黄酮苷(即异牡荆素)对核转录因子P65(核转录因子κB(nuclear factor κB,NF-κB)亚基之一)的核移位抑制作用显著强于其余3种芹菜素黄酮苷的抑制作用(P<0.01)。但异牡荆素未通过抑制上游调控蛋白IκBα(α Inhibitor of κB,κB抑制因子α亚基)、IKKβ(IκB Kinase β,IκB激酶β亚基)而抑制NF-κB蛋白家族P65蛋白。结论:芹菜素黄酮碳苷尤其是异牡荆素在THP-1炎性细胞模型中具有更好的抗炎活性作用,但异牡荆素的抗炎作用并非通过IκBα依赖型的NF-κB信号通路实现。Abstract: Objective: The anti-inflammatory activities of apigenin-7-O-β-D-glucopyranoside, apigenin 5-O-glucoside, vitexin and isovitexin were evaluated. Methods: Changes of protein in THP-1 cells pretreated with flavonoids were measured by Western blot test. The differences of cytokines were analyzed by enzyme-linked immunosorbent assay and fluorescence quantitative polymerase chain reaction. Results: It showed that all the flavonoids tested could repress the gene expression of IL-10 (P<0.01). Vitexin and isovitexin inhibited the production of cyclooxygenase-2 as well (P<0.01). What’s more, isovitexin significantly suppressed the increases of interleukin-1β (P<0.01) and interleukin-6 (P<0.01). Apigenin-7-O-β-D-glucopyranoside only significantly inhibited TNF-α (P<0.01). Apart from IL-10 mRNA, apigenin 5-O-glucoside displayed no anti-inflammatory effects according to the other results of cytokine analyses. Furthermore, the structure of apigenin-C-glycoside substituted at position 8, namely isovitexin showed the strongest inhibition on nuclear translocation of P65 (P<0.01). However, this suppression effect of isovitexin on P65 was not through inhibiting upstream regulation proteins such as IκBα and IKKβ. Conclusion: In a word, compared with apigenin-O-glycosides, apigenin-C-glycosides especially isovitexin had a better anti-inflammatory activity based on cell line THP-1. But the anti-inflamamtion of isovitexin was not IκBα -dependent NF- κB signal pathway.
-
Keywords:
- anti-inflammatory /
- flavonoid /
- flavone-O-glycosides /
- flavone-C-glycosides /
- isovitexin
-
黄酮类化合物广泛存在于蔬菜、水果等植物性食品原料中。自然界存在的黄酮类化合物多以黄酮苷的形式存在,即黄酮苷元与糖类结合形成了糖苷键,据此黄酮类化合物可分为黄酮氧苷和黄酮碳苷:黄酮苷元上氧原子与糖链以C-O链接形成黄酮-O-糖苷;黄酮苷元上碳原子与糖链以C-C链接形成黄酮-C-糖苷[1]。在黄酮类化合物中,黄酮氧苷较黄酮碳苷类化合物常见,例如芹菜素-7-O-β-D-吡喃葡萄糖即大波斯菊苷[2-3]及5-O-β-D-吡喃葡萄糖苷芹菜甙元等。而随着质谱等鉴别技术的发展,近年来越来越多的黄酮碳苷被发现,黄酮碳苷的C-糖苷取代常发生在黄酮苷元母核结构的C6位或C8位,如牡荆素和异牡荆素是芹菜素-C-糖苷同分异构体,夏佛塔苷、异夏佛塔苷是葡萄糖和阿拉伯糖两种不同的糖基配体与芹菜素苷元形成的芹菜素6,8-双-C-糖苷同分异构体[4]。黄酮类化合物一般具有较低的毒性和广泛的生物活性。
芹菜素黄酮苷元可以通过抑制NF-κB信号通路发挥抗炎活性[5-6],其形成的芹菜素黄酮苷也显示出较好的抗炎作用。芹菜素黄酮碳苷天然存在于清热解毒的植物性材料中,如箬叶[7]、三叶青[8]、绿豆衣[9]、莲子心[4],基于脂多糖(lipopolysaccharide,LPS)刺激建立小鼠巨噬细胞RAW264.7炎性细胞模型发现此类植物提取物具有炎性抑制作用[9-10]。除此之外,芹菜素-7-O-β-D-吡喃葡萄糖苷可通过抑制炎性和氧化应激反应减轻LPS诱导的急性中耳炎[11]。然而关于5-O-β-D-吡喃葡萄糖苷芹菜甙元是否具有抗炎活性尚不明确,芹菜素形成的几种O-糖苷、C-糖苷同分异构体的活性差异亦尚未见报道。动物模型是常用的体内活性评价模型,但动物模型实验样品量消耗大,无法针对重要作用靶点进行单一信号通路的研究与确认,因此单一的细胞系模型更有助于评价黄酮类化合物的抗炎活性及作用机制。
THP-1是人髓系白血病单核细胞,具有与原代单核细胞相似的表型和功能特征,以及稳定的遗传能力[12-13]。LPS刺激佛波酯(phorbol 12-myristate13-acetate,PMA)分化的THP-1细胞是常用的人源性炎性细胞模型,以之建立模型,可以有效评价活性成分的抗炎作用,并分析其可能的作用机制[14]。本研究将以THP-1单核巨噬细胞建立炎性细胞模型,以4种芹菜素-单-C/O-黄酮苷同分异构体(见表1):牡荆素、异牡荆素、芹菜素-7-O-β-D-吡喃葡萄糖苷、5-O-β-D-吡喃葡萄糖苷芹菜甙元为研究对象,评价4种同分异构体的抗炎活性差异,为植物性食品原料膳食摄入芹菜素黄酮苷及营养特性提供指导。
表 1 芹菜素及其4种黄酮苷化学结构Table 1. Structure of apigenin and 4 apigenin glycosides黄酮类化合物 母核结构 R5 R6 R7 R8 apigenin OH H OH H api-5-O-glu Oglc H OH H api-7-O-glu OH H Oglc H vitexin OH H OH Cglc isovitexin OH Cglc OH H 注:芹菜素:apigenin;5-O-β-D-吡喃葡萄糖苷芹菜甙元:apigenin 5-O-glucoside,简写为api-5-O-glu(氧苷);芹菜素-7-O-β-D-吡喃葡萄糖苷:apigenin-7-O-β-D-glucopyranoside,简写为api-7-O-glu(氧苷);牡荆素:vitexin(碳苷);异牡荆素:isovitexin(碳苷)。 1. 材料与方法
1.1 材料与仪器
THP-1单核巨噬细胞实验室保存 上海细胞库;5-O-β-D-吡喃葡萄糖苷芹菜甙元、芹菜素-7-O-β-D-吡喃葡萄糖苷、牡荆素、异牡荆素 均为HPLC纯度≥98%,上海源叶生物科技有限公司;RPMI培养基 美国hyclone公司;胎牛血清 澳大利亚AusGeneX公司;GNM15140青链霉素溶液(100X) 杭州吉诺生物医药技术有限公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、脂多糖(lipopolysaccharide,LPS,L-4391)、豆蔻佛波醇乙酯(phorbol 12-myristate13-acetate,PMA)、β-巯基乙醇 美国Sigma公司;高纯总RNA提取试剂盒 北京艾德莱生物科技有限公司;浆蛋白与核蛋白提取试剂盒、Weatern Blot分析试剂 美国AspenTech公司;PrimeScriptTM reagent Kit with gDNA Eraser反转录试剂盒、PCR SYBR Premix Ex TaqTM Ⅱ荧光定量试剂盒 TaKaRa公司;细胞因子酶联免疫试剂盒 欣博盛生物科技有限公司;所有分析用试剂均为国产分析纯。
Multifuge X1R高速冷冻离心机、全波长读数仪 Thermo Fisher Scientific公司;ECLIPSE TS100倒置显微镜 日本尼康公司;DYY-8C凝胶电泳仪 北京六一仪器厂;细胞培养板 美国Corning公司;细胞培养瓶 德国Greiner公司;MG96G PCR仪 杭州朗基科学仪器有限公司;ChemiDoc MP凝胶成像系统 美国BIO LEGEND公司;qTOWER2.2荧光定量PCR仪 德国Analytik jena公司;AX-Ⅱ暗匣 广东粤华医疗器械厂有限公司;LiDE110 DYY-6C扫描仪 日本Canon公司;0.45μm PVDF膜 美国Millipore公司;柯达医用X射线胶片 美国Kodak公司。
1.2 实验方法
1.2.1 细胞培养
THP-1单核巨噬细胞以RPMI完全培养基培养,RPMI完全培养基由10% FBS、100 U/mL青霉素、100 μg/mL链霉素、0.1 μmol/L的β巯基乙醇组成,细胞于含5% CO2,90%湿度,37 ℃条件下的CO2恒温培养箱进行悬浮培养,每24 h于倒置显微镜下观察,当密度达到70%~80%左右时进行分瓶传代[14]。
1.2.2 MTT试验
采用MTT法[15]测定黄酮类化合物对THP-1单核巨噬细胞的毒性作用。
设置3个组别:实验组,稀释细胞悬液,加入PMA试剂(终浓度为0.1 μmol/L),接种100 μL细胞到96孔板中,使其密度为3×104个/孔,细胞培养板放入CO2培养箱培养。12 h后细胞贴壁完全,去上清液,以温热的PBS轻轻清洗细胞,去PBS,加入新鲜RPMI完全培养基,静息24 h。以不含血清的RPMI培养液分别配制浓度为5 μmol/L的api-5-O-glu、api-7-O-glu、vitexin、isovitexin溶液,去细胞上清液,以温热的PBS轻轻洗涤细胞,去PBS,分别加入配制好的黄酮类化合物溶液。空白组,不接种细胞,加入100 μL RPMI完全培养基培养到细胞孔板中,且以不含血清的RPMI培养液代替黄酮类化合物溶液处理细胞孔板。正常组(CK组),THP-1细胞接种量同样品组,且以不含血清的RPMI培养液代替黄酮类化合物溶液处理细胞孔板。样品组与2个空白组均设8个平行。
给药完成后,细胞孔板放入CO2培养箱中培养,24 h后取出去细胞上清液,加入配制好的MTT溶液(浓度为0.5 mg/mL),放回CO2培养箱中避光孵育3~4 h。去MTT溶液,以150 μL二甲亚砜溶解细胞中甲瓒结晶,于37℃震荡孵育10 min,在酶标仪上读取490 nm处吸光值。
计算细胞存活率,公式如下:
细胞存活率(%)=AT−ANAC−AN×100 式中:AT:样品组在490 nm处的吸光值;AN:空白组在490 nm处的吸光值;AC:正常组(CK组)在490 nm处的吸光值。
1.2.3 Western Blot法检测细胞中环氧合酶-2(cyclooxygenase-2,COX-2)含量
设置3个组别:实验组:稀释细胞悬液,接种2 mL细胞到6孔板中,使其密度为1.5×107个/孔,待细胞覆盖孔板底部80%~90%时,加入PMA试剂(终浓度为0.1 μmol/L),放入CO2培养箱中培养。12 h后细胞贴壁完全,去上清液,以温热的PBS轻轻清洗细胞,去PBS,加入新鲜RPMI完全培养基,静息24 h。以不含血清的RPMI培养液分别配制浓度为5 μmol/L的api-5-O-glu、api-7-O-glu、vitexin、isovitexin溶液,去细胞上清液,以温热的PBS轻轻洗涤细胞,去PBS,分别加入配制好的黄酮类化合物溶液。模型组(LPS组),THP-1细胞接种量同样品组,且以不含血清的RPMI培养液代替黄酮类化合物溶液处理细胞孔板。正常组(CK组),THP-1细胞接种量同样品组,且以不含血清的RPMI培养液代替黄酮类化合物处理细胞孔板。各组别均设3个平行。
给药完成后,细胞孔板放入CO2培养箱中培养。3 h后取出,正常组(CK组)不加脂多糖,实验组和模型组(LPS组)加入脂多糖,使LPS终浓度为1 μg/mL,将6孔板放回培养箱中继续培养30 min。以RPMI裂解液裂解细胞收集细胞总蛋白样品,并采用WB法测定总蛋白中COX-2含量[16],以内参计算各组别COX-2的相对表达量。
COX-2的相对表达量=COX-2的灰度值GAPDH的灰度值 1.2.4 酶联免疫吸附检测细胞上清液细胞因子的含量
设置3个组别,各组别设置同1.2.3,但细胞接种密度为5×106个/孔,每孔接种2 mL细胞悬液到12孔板中,待实验组和模型组加入脂多糖后,将孔板放回细胞培养箱中培养12 h。收集细胞上清液,依据酶联免疫法试剂盒说明书测定细胞上清液中细胞因子含量。
1.2.5 实时荧光定量PCR法检测细胞中细胞因子mRNA的含量
实验组别设置和细胞处理同1.2.4。以Trizol试剂裂解去上清液的细胞,收集细胞裂解液。采用实时荧光定量PCR法测定细胞中细胞因子 mRNA的相对含量,即以2−ΔΔC(T)法计算各组别相对模型组(LPS组)的细胞因子mRNA扩增倍数[17]。
样品中RNA提取、反转录、定量方法分别按试剂盒说明书操作。
各指标引物信息见表2:
表 2 荧光定量PCR法检测细胞因子及内参引物信息Table 2. Primer information of cytokines and internal primers in fluorescence quantitative PCR引物名称 引物序列(5' to 3') GAPDH-F GAGTCAACGGATTTGGTCGT GAPDH-R TTGATTTTGGAGGGATCTCG TNF-F TCCTTCAGACACCCTCAACC TNF-R AGGCCCCAGTTTGAATTCTT IL-6-F GTTTGAGGGGGTAACAGCAA IL-6-R GCTAACTGCAGAGGGTGAGG IL-1β-F GCTGTGCAGGAGATCACAGA IL-1β-R GGGCTCCATAAAGTCACCAA IL-8-F AAGACATACTCCAAACCTTTCCACC IL-8-R CAATAATTTCTGTGTTGGCGCA IL-10-F GTTCTTTGGGGAGCCAACAG IL-10-R GCTCCCTGGTTTCTCTTCCT 1.2.6 Western Blot法检测细胞质、细胞核P65含量
设置3个组别,各组别设置同1.2.3,但细胞接种密度为5×106个/孔,每孔接种5 mL细胞悬液到直径6 cm的细胞培养皿中。待细胞孔板中实验组和模型组加入脂多糖并放回培养箱中培养30 min后,按试剂盒说明分别收集提取细胞质与细胞核蛋白样品,采用WB法测定样品中P65含量[18],以内参计算各组别P65的相对表达量,计算方式同COX-2。
1.2.7 Western Blot法检测细胞中IκBα、IKKβ的变化
设置3个组别,各组别设置同1.2.3,但细胞接种密度为1×107个/孔,每孔接种2 mL细胞悬液到6孔板中。待细胞孔板中实验组和模型组加入脂多糖并放回培养箱培养30 min后,以RPMI裂解液裂解细胞,收集细胞裂解液,采用WB法测定总蛋白中IκBα、IKKβ、P-IκBα、P-IKKβ含量[18],以内参计算各组别IκBα、IKKβ、P-IκBα、P-IKKβ的相对表达量,计算方式同COX-2。
1.3 数据处理
实验结果表示为平均值±标准差,采用软件SAS 8.0进行LSD多重比较分析数据显著性,P<0.05表明差异显著,P<0.01表明差异极显著。
2. 结果与分析
2.1 黄酮类化合物对TPH-1单核巨噬细胞的毒性作用
前期研究表明,在基于脂多糖刺激RAW264.7小鼠巨噬细胞建立的炎性细胞模型中,浓度为5 μmol/L的4种芹菜素黄酮苷同分异构体对COX-2酶mRNA的表达就具有显著的差异性抑制作用(P<0.05),其中,芹菜素-7-O-β-D-吡喃葡萄糖苷、牡荆素对COX-2酶mRNA的表达显示出更好的抑制活性[19]。本研究将进一步探究4种同分异构体在5 μmol/L浓度下的抗炎活性差异及机理。如表3所示,与CK组相比,5 μmol/L的芹菜素-7-O-β-D-吡喃葡萄糖苷、5-O-β-D-吡喃葡萄糖苷芹菜甙元、牡荆素、异牡荆素处理下,细胞存活率无显著性差异(P>0.05),表明上述化合物对THP-1单核巨噬细胞均无细胞毒性作用。
表 3 黄酮类化合物对THP-1单核巨噬细胞的毒性作用Table 3. Toxicity of flavonoids on THP-1 macrophage cells组别 细胞存活率(%) CK 100.00±9.60 api-5-O-glu 103.49±10.27 api-7-O-glu 105.77±5.56 vitexin 97.70±10.40 isovitexin 108.97±11.63 2.2 黄酮类化合物对THP-1单核巨噬细胞炎性模型中COX-2调控作用
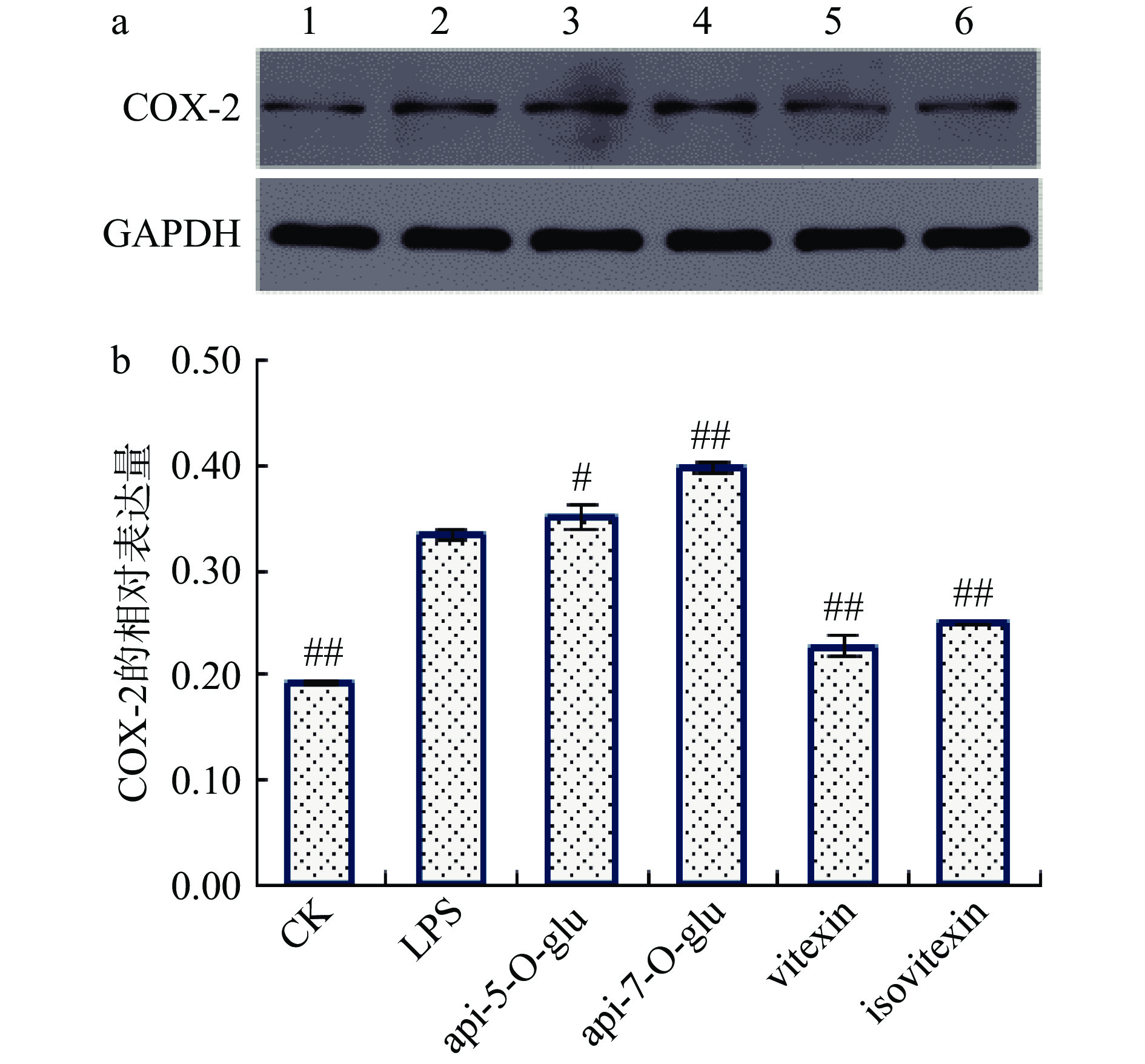
如图1所示,LPS作用后,THP-1单核巨噬细胞炎性模型中COX-2的表达极显著上升(P<0.01),COX-2是NF-κB核转录因子调控的下游表达产物,在特定组织器官发生炎性反应时被诱导产生,具有快速应答炎性反应的特质,是炎性反应中常用的评价指标[20]。
![]() 图 1 4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞中COX-2的影响注:a:各组别THP-1单核巨噬细胞中COX-2的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:COX-2相对模型组(LPS组)灰度值,#表示与模型组(LPS组)相比差异显著,P<0.05,##表示与模型组(LPS组)相比差异极显著,P<0.01;图2、图3同。Figure 1. Influence of 4 apigenin glycosides on COX-2 in THP-1 macrophage cell lines stimulated by LPS
图 1 4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞中COX-2的影响注:a:各组别THP-1单核巨噬细胞中COX-2的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:COX-2相对模型组(LPS组)灰度值,#表示与模型组(LPS组)相比差异显著,P<0.05,##表示与模型组(LPS组)相比差异极显著,P<0.01;图2、图3同。Figure 1. Influence of 4 apigenin glycosides on COX-2 in THP-1 macrophage cell lines stimulated by LPS芹菜素等多种黄酮类化合物可以作用于巨噬细胞并对COX-2显示较好的抑制效果[21-23]。在本研究中,牡荆素和异牡荆素均能够极显著地抑制COX-2酶在蛋白水平上的表达(P<0.01),且牡荆素的抑制作用显著优于异牡荆素(P<0.05)。而在笔者前期的研究中[19],RAW264.7小鼠巨噬细胞中,牡荆素显示出较异牡荆素更好的COX-2酶mRNA活性0.05),表明在抑制COX-2基因的转录和蛋白的表达方面,C6位碳苷取代的牡荆素碳强于C8位碳苷取代的异牡荆素。
2.3 黄酮类化合物对THP-1单核巨噬细胞炎性模型细胞因子的影响
表4表明1 μg/mL的LPS刺激PMA分化后的THP-1后,细胞内TNF-α在蛋白水平和基因水平的表达极显著增强(P<0.01)。脂多糖是诱导细胞产生炎性反应的较强刺激物[24],细胞内肿瘤坏死因子TNF-α含量显著提高是判断炎性发生的重要标志之一[25]。此外,脂多糖还可以促进细胞中细胞因子的表达。本实验中,LPS刺激使IL-1β(Interleukin 1β,白细胞介素1β)的含量极显著增加(P<0.01),同时LPS还极显著增强了IL-6(Interleukin 6,白细胞介素6)的含量(P<0.01),极显著增加了IL-8(Interleukin 8,白细胞介素8)和IL-10(Interleukin 10,白细胞介素10)mRNA的表达(P<0.01)。
表 4 4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞中细胞因子的影响Table 4. Influence of 4 apigenin glycosides on cytokines in THP-1 macrophage cell lines stimulated by LPS组别
指标CK LPS api-5-O-glu api-7-O-glu vitexin isovitexin TNF-α含量(μmol/L) 529.13±11.53## 14929.70±1179.75 12527.68±705.79 11078.30±742.53# 13416.03±2648.90 14559.75±164.51 TNF-α mRNA相对含量 0.05±0.03## 1.00±0.07 1.07±0.28 0.91±0.11 0.61±0.14# 0.89±0.18 IL-1β含量(μmol/L) 62.94±3.50## 502.37±8.71 620.17±8.37## 475.02±35.86 531.23±29.90 330.20±9.10## IL-1β mRNA相对含量 4.42±0.54## 1.00±0.18 0.85±0.13 0.77±0.11 1.14±0.24 0.90±0.28 IL-6含量(μmol/L) 0.04±0.38## 91.94±20.82 72.79±10.56 73.45±0.39 57.07±4.42## 55.40±8.00## IL-6 mRNA相对含量 0.95±0.07 1.00±0.21 0.87±0.27 1.05±0.04 1.27±0.22 1.10±0.02 IL-8含量(μmol/L) − − − − − − IL-8 mRNA相对含量 0.09±0.01## 1.00±0.06 0.83±0.11 1.05±0.08 1.43±0.37# 0.48±0.12## IL-10含量(μmol/L) − − − − − − IL-10 mRNA相对含量 0.34±0.04## 1.00±0.14 0.36±0.01## 0.56±0.07## 0.44±0.07## 0.57±0.08## 注:同行#表示各指标与模型组(LPS组)相比差异显著,P<0.05;同行##表示各指标与模型组(LPS组)相比差异极显著,P<0.01;-表示未测出。 与LPS组相比,2种芹菜素黄酮碳苷对细胞炎性因子的抑制作用强于2种芹菜素黄酮氧苷。4种黄酮苷均可显著降低IL-10 mRNA的含量(P<0.01),但5-O-β-D-吡喃葡萄糖苷芹菜甙元对除IL-10 mRNA外其余各指标无显著抑制作用(P>0.05);而芹菜素-7-O-β-D-吡喃葡萄糖苷对TNF-α的产生有显著抑制作用(P<0.05);此外,牡荆素可以极显著抑制IL-6的表达(P<0.01)和TNF-α mRNA的相对含量(P<0.05);异牡荆素可以极显著抑制IL-1β和IL-6蛋白的表达(P<0.01)、IL-8基因的转录(P<0.01)。综上,基于对多种细胞因子的抑制作用,异牡荆素相较于其他3种芹菜素黄酮苷显示出最好的抗炎活性。
值得注意的是,当作用浓度为5μmol/L时,5-O-β-D-吡喃葡萄糖苷芹菜甙元促进了巨噬细胞中IL-1β表达升高。脂多糖是革兰氏阴性细菌外膜的主要组成部分,可以引起强烈的炎性反应,实验以1 μg/mL脂多糖刺激TPH-1单核巨噬细胞建立了炎性细胞模型。IL-1β是一种主要由单核巨噬细胞分泌的多效性细胞因子,作为炎症反应经典的促炎因子,在低浓度时IL-1β可以通过级联反应放大炎症反应,而局部高浓度的IL-1β则主要发挥内分泌调节作用,可以增强宿主巨噬细胞杀伤病原微生物的能力和游走能力[25]。实验浓度下的5-O-β-D-吡喃葡萄糖苷芹菜甙元对IL-1β分泌的促进作用可能由此增强宿主细胞抵御病原微生物的能力。
2.4 黄酮类化合物对THP-1单核巨噬细胞炎性模型中P65调控作用
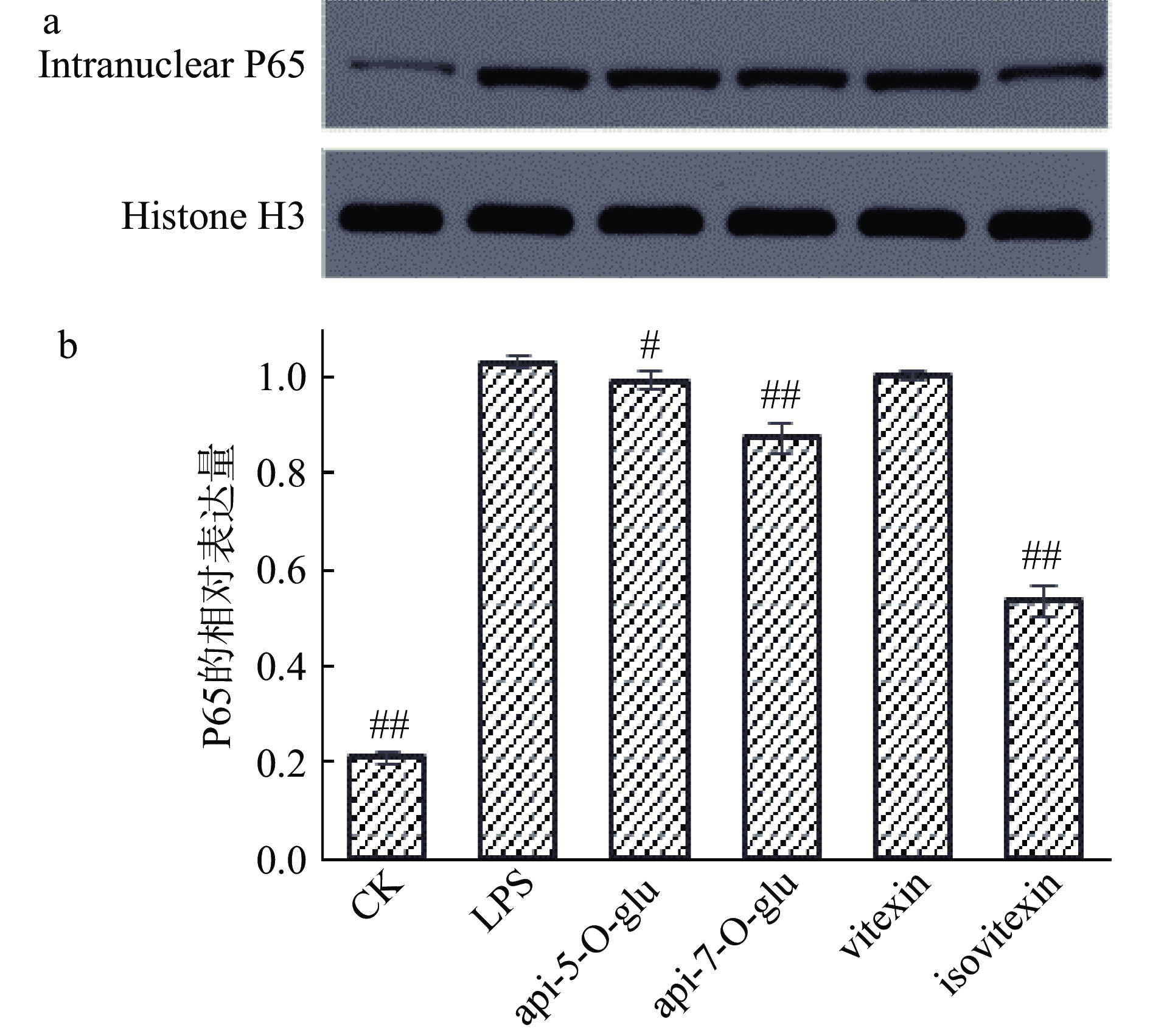
NF-κB蛋白家族迅速进入细胞核并启动各种κB依赖性基因的表达,如细胞因子TNF-α、IL-6和IL-1β,同时细胞因子可以反馈调控NF-κB[26]。P65是NF-κB蛋白家族的重要成员,具有重要的结构转录激活域(transcription activation domain,TAD),TAD结构的存在对于细胞因子基因表达是必不可少的[27]。
通过计算P65蛋白对内参的相对含量,分析4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞核和细胞质中P65的影响。脂多糖作用30 min后,细胞核P65较大程度地增加(见图2b)。芹菜素-7-O-β-D-吡喃葡萄糖苷与8位碳苷取代形成的异牡荆素均极显著地抑制了P65的核移位作用(P<0.01),即细胞核内P65含量显著下降,异牡荆素的8位碳苷取代强于7位氧苷取代的抑制作用(P<0.01),可能由此异牡荆素对P65核转录因子调控的下游炎性指标如IL-1β、IL-6、IL-8、IL-10发挥了较强的抑制作用。
2.5 黄酮类化合物对THP-1单核巨噬细胞炎性模型P-IκBα、P-IKKβ信号通路的调控作用
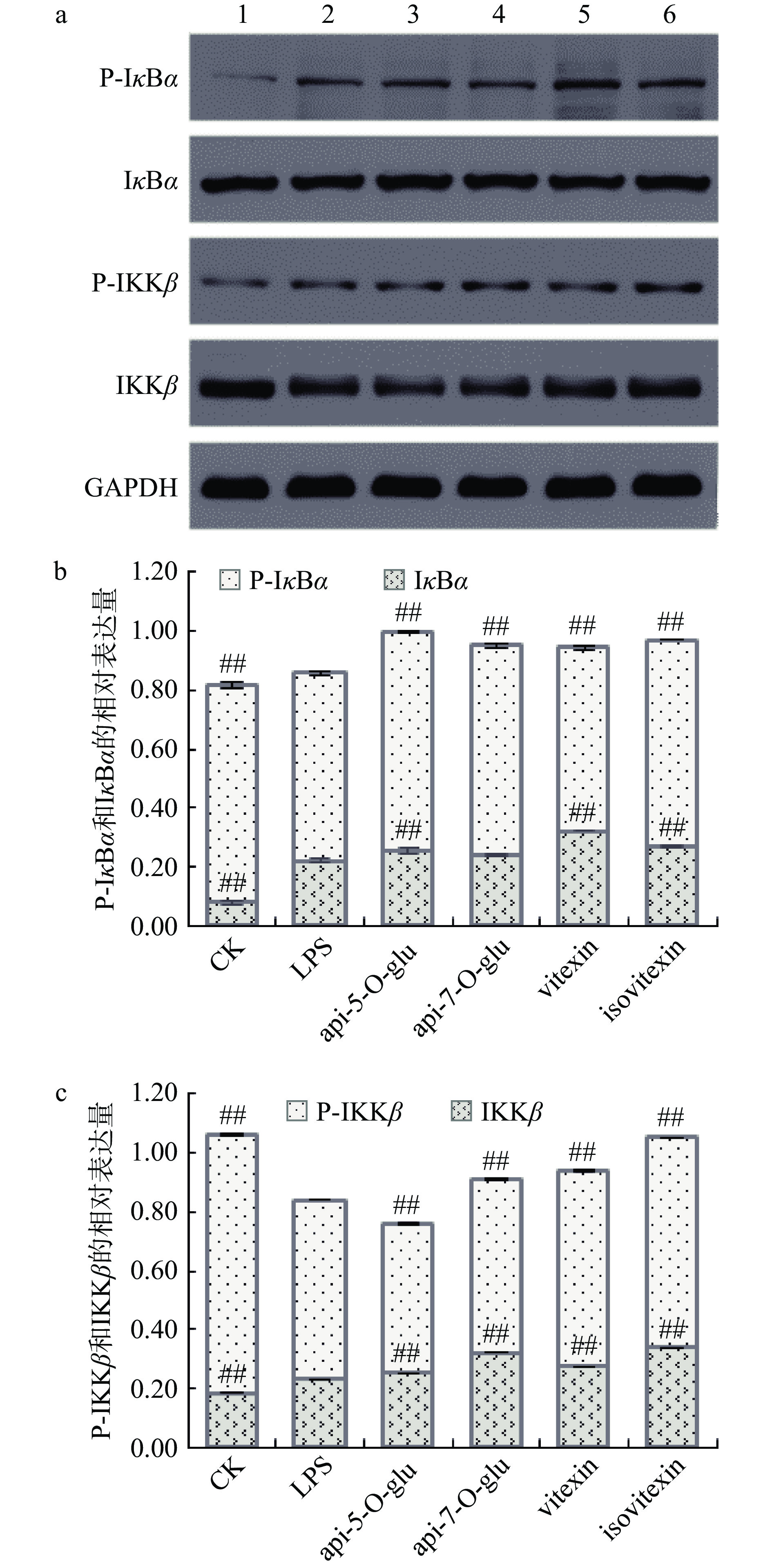
通过计算相对表达量分析黄酮类化合物对脂多糖刺激下THP-1单核巨噬细胞中IκBα和IKKβ变化。脂多糖作用30 min后促进细胞内IκBα和IKKβ发生磷酸化反应(分别以P-IκBα、P-IKKβ进行定量)(见图3b、图3c)。5 μmol/L芹菜素-7-O-β-D-吡喃葡萄糖苷预处理后,对IκBα的磷酸化无显著影响(P>0.05),5 μmol/L 5-O-β-D-吡喃葡萄糖苷芹菜甙元、牡荆素、异牡荆素则在一定程度上促进了IκBα的磷酸化,4种黄酮类化合物均极显著促进了IκBα总表达量的增加(P<0.01)。5 μmol/L 5-O-β-D-吡喃葡萄糖苷芹菜甙元预处理后,极显著抑制了IKKβ的表达(P<0.01),但4种黄酮类化合物均在一定程度上极显著地促进了IKKβ的磷酸化(P<0.01)。这表明4种黄酮类化合物的预处理未对LPS刺激THP-1单核巨噬细胞下IκBα和IKKβ的磷酸化反应发挥抑制作用。因此,4种芹菜素黄酮苷并非通过直接抑制IκBα和IKKβ的磷酸化作用而抑制COX-2或炎性因子。
![]() 图 3 黄酮类化合物对脂多糖刺激下THP-1单核巨噬细胞IκBα、IKKβ的影响注:a:各组别THP-1单核巨噬细胞中P-IκBα、IκBα、P-IKKβ、IKKβ的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:P-IκBα、IκBα相对模型组(LPS组)灰度值;c:P-IKKβ、IKKβ相对模型组(LPS组)灰度值。Figure 3. Effects of flavonoids on IκBα and IKKβ of THP-1 mononuclear macrophages stimulated by LPS
图 3 黄酮类化合物对脂多糖刺激下THP-1单核巨噬细胞IκBα、IKKβ的影响注:a:各组别THP-1单核巨噬细胞中P-IκBα、IκBα、P-IKKβ、IKKβ的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:P-IκBα、IκBα相对模型组(LPS组)灰度值;c:P-IKKβ、IKKβ相对模型组(LPS组)灰度值。Figure 3. Effects of flavonoids on IκBα and IKKβ of THP-1 mononuclear macrophages stimulated by LPS3. 讨 论
黄酮类化合物为机体组织利用并发挥不同生理活性的过程中,第一步反应即为吸收。大量研究表明黄酮类化合物在肠道的主要吸收方式为被动扩散[28-30],而分子结构的多样性与其吸收存在本质联系,多项研究表明糖苷取代位置及数目的不同会影响黄酮类化合物的肠吸收。本团队前期关于黄酮类化合物的转运摄入实验结果表明芹菜素苷元的吸收率显著高于牡荆素和异牡荆素[31-32]。而Chen等[33]在对异戊二烯基取代的黄酮类化合物的研究表明,当有两个或两个以上的糖基取代环上羟基时,黄酮类化合物肠吸收显著降低;减少一个糖基后能在一定程度上增加黄酮类化合物的吸收,但无糖基取代的黄酮苷元吸收却并未如预期中得以提高,原因在于苷元水溶性差(<0.5 μg/mL)。而黄酮碳苷是一类极性相对较大的黄酮类化合物,在水溶液中具有较好的溶解性,这可能是其本研究中芹菜素黄酮碳苷较其氧苷同分异构体发挥更好抗炎活性的原因之一。
黄酮苷一般会经过水解代谢为黄酮苷元后,进一步在机体中被吸收利用[34],吸收利用度和其在体内的作用时间也是导致不同结构黄酮苷发挥不同生物活性的原因之一。研究表明:牡荆素、异牡荆素等黄酮碳苷在大鼠体内吸收较好,吸收迅速,给药5 min均可检出,1~2 h血药浓度达到峰浓度,但两者的吸收率相差不大,分别为5.82%与5.53%[35]。但牡荆素摄入后可快速消除,广泛分布于各组织,肝、肾组织浓度最高,主要通过肝脏和肾脏代谢排泄[36]。异牡荆素与牡荆素的消除速度不同,灌胃给药牡异荆素消除较牡荆素慢,静脉给药异牡荆素的消除速度也显著慢于牡荆素,表明C-8位的碳苷取代导致了异牡荆素可在机体存留更长时间[37]。因此,尽管牡荆素与异牡荆素具有相近的吸收率,然而异牡荆素在机体内具有更慢的消除速度即更长的作用时间,这可能使其抗炎活性强于牡荆素。
黄酮类化合物对巨噬细胞炎性反应的抑制活性主要在于抑制NF-κB信号通路[38]。IKKβ对NF-κB信号通路经典途径的激活发挥着不可取代的作用,在典型的NF-κB信号通路经典途径中,IKKβ与IκBα的Ser32和Ser36磷酸化存在充分必要条件关系,然而IκBα磷酸化对于NF-κB信号通路经典途径并不是必须的[29]。本研究中异牡荆素通过极显著地降低了NF-κB蛋白家族中P65核转录因子发生核移位作用(P<0.01),进而极显著地抑制了下游炎性指标COX-2、IL-1β、IL-6的表达(P<0.01),发挥了较强的抗炎作用。但异牡荆素对P65的抑制作用并非是通过对上游调控蛋白IKKβ和IκBα的抑制而实现的,这表明其对巨噬细胞中炎性反应的抑制活性并非依赖于IκBα磷酸化的NF-κB信号通路。后续可对IkBα上游通路中AKT、PDK1、PI3K等蛋白的表达进行检测分析,探究异牡荆素的抗炎机制。
4. 结 论
研究基于THP-1单核巨噬细胞评价了2种芹菜素黄酮氧苷和2种芹菜素黄酮碳苷的抗炎活性,结果显示芹菜素黄酮碳苷相对其黄酮氧苷具有更好的抗炎活性,尤其异牡荆素极显著抑制了COX-2、IL-1β和IL-6(P<0.01)的表达,极显著抑制核转录因子P65的入核(P<0.01),发挥了最强的抗炎作用,但异牡荆素未通过抑制IκBα、IKKβ而抑制NF-κB蛋白家族P65的核移位作用,即在人源的THP-1单核巨噬细胞炎性模型中,异牡荆素对抗炎活性并非是通过IκBα依赖的NF-κB信号通路实现。
-
图 1 4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞中COX-2的影响
注:a:各组别THP-1单核巨噬细胞中COX-2的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:COX-2相对模型组(LPS组)灰度值,#表示与模型组(LPS组)相比差异显著,P<0.05,##表示与模型组(LPS组)相比差异极显著,P<0.01;图2、图3同。
Figure 1. Influence of 4 apigenin glycosides on COX-2 in THP-1 macrophage cell lines stimulated by LPS
图 3 黄酮类化合物对脂多糖刺激下THP-1单核巨噬细胞IκBα、IKKβ的影响
注:a:各组别THP-1单核巨噬细胞中P-IκBα、IκBα、P-IKKβ、IKKβ的免疫蛋白印记(Western Blot)图,左起1~6依次表示CK组、LPS组、api-5-O-glu组、api-7-O-glu组、vitexin组、isovitexin组;b:P-IκBα、IκBα相对模型组(LPS组)灰度值;c:P-IKKβ、IKKβ相对模型组(LPS组)灰度值。
Figure 3. Effects of flavonoids on IκBα and IKKβ of THP-1 mononuclear macrophages stimulated by LPS
表 1 芹菜素及其4种黄酮苷化学结构
Table 1 Structure of apigenin and 4 apigenin glycosides
黄酮类化合物 母核结构 R5 R6 R7 R8 apigenin OH H OH H api-5-O-glu Oglc H OH H api-7-O-glu OH H Oglc H vitexin OH H OH Cglc isovitexin OH Cglc OH H 注:芹菜素:apigenin;5-O-β-D-吡喃葡萄糖苷芹菜甙元:apigenin 5-O-glucoside,简写为api-5-O-glu(氧苷);芹菜素-7-O-β-D-吡喃葡萄糖苷:apigenin-7-O-β-D-glucopyranoside,简写为api-7-O-glu(氧苷);牡荆素:vitexin(碳苷);异牡荆素:isovitexin(碳苷)。 表 2 荧光定量PCR法检测细胞因子及内参引物信息
Table 2 Primer information of cytokines and internal primers in fluorescence quantitative PCR
引物名称 引物序列(5' to 3') GAPDH-F GAGTCAACGGATTTGGTCGT GAPDH-R TTGATTTTGGAGGGATCTCG TNF-F TCCTTCAGACACCCTCAACC TNF-R AGGCCCCAGTTTGAATTCTT IL-6-F GTTTGAGGGGGTAACAGCAA IL-6-R GCTAACTGCAGAGGGTGAGG IL-1β-F GCTGTGCAGGAGATCACAGA IL-1β-R GGGCTCCATAAAGTCACCAA IL-8-F AAGACATACTCCAAACCTTTCCACC IL-8-R CAATAATTTCTGTGTTGGCGCA IL-10-F GTTCTTTGGGGAGCCAACAG IL-10-R GCTCCCTGGTTTCTCTTCCT 表 3 黄酮类化合物对THP-1单核巨噬细胞的毒性作用
Table 3 Toxicity of flavonoids on THP-1 macrophage cells
组别 细胞存活率(%) CK 100.00±9.60 api-5-O-glu 103.49±10.27 api-7-O-glu 105.77±5.56 vitexin 97.70±10.40 isovitexin 108.97±11.63 表 4 4种芹菜素黄酮苷对脂多糖刺激下THP-1单核巨噬细胞中细胞因子的影响
Table 4 Influence of 4 apigenin glycosides on cytokines in THP-1 macrophage cell lines stimulated by LPS
组别
指标CK LPS api-5-O-glu api-7-O-glu vitexin isovitexin TNF-α含量(μmol/L) 529.13±11.53## 14929.70±1179.75 12527.68±705.79 11078.30±742.53# 13416.03±2648.90 14559.75±164.51 TNF-α mRNA相对含量 0.05±0.03## 1.00±0.07 1.07±0.28 0.91±0.11 0.61±0.14# 0.89±0.18 IL-1β含量(μmol/L) 62.94±3.50## 502.37±8.71 620.17±8.37## 475.02±35.86 531.23±29.90 330.20±9.10## IL-1β mRNA相对含量 4.42±0.54## 1.00±0.18 0.85±0.13 0.77±0.11 1.14±0.24 0.90±0.28 IL-6含量(μmol/L) 0.04±0.38## 91.94±20.82 72.79±10.56 73.45±0.39 57.07±4.42## 55.40±8.00## IL-6 mRNA相对含量 0.95±0.07 1.00±0.21 0.87±0.27 1.05±0.04 1.27±0.22 1.10±0.02 IL-8含量(μmol/L) − − − − − − IL-8 mRNA相对含量 0.09±0.01## 1.00±0.06 0.83±0.11 1.05±0.08 1.43±0.37# 0.48±0.12## IL-10含量(μmol/L) − − − − − − IL-10 mRNA相对含量 0.34±0.04## 1.00±0.14 0.36±0.01## 0.56±0.07## 0.44±0.07## 0.57±0.08## 注:同行#表示各指标与模型组(LPS组)相比差异显著,P<0.05;同行##表示各指标与模型组(LPS组)相比差异极显著,P<0.01;-表示未测出。 -
[1] 韩公羽, 沈企华, 韩绍雯. 植物药黄酮成分与生理生化活性[M]. 北京: 中国书籍出版社, 2010: 38−45 HAN G Y, SHEN Q H, HAN S W. Flavonoids and physiological and biochemical activities of plant drugs[M]. Beijing: China Book Press, 2010: 38−45.
[2] 谢凡, 吴迎春, 李医明, 等. 葎草药材的质量标准研究[J]. 中国中药杂志,2014(20):3986−3990. [XE F, WU Y C, LI Y M, et al. Study on quality standard for Humulus scandens[J]. China Journal of Chinese Materia Medica,2014(20):3986−3990. XE F, WU Y C, LI Y M, et al. Study on quality standard for Humulus scandens[J]. China Journal of Chinese Materia Medica, 2014(20): 3986-3990.
[3] 刘细桥, 董俊兴. 中药地锦草芹菜素糖苷类化合物[J]. 药学学报,2009,44(5):496−499. [LIU X Q, DONG J X. Apigenin glycosides from Euphorbia humifusa Wild[J]. Acta Pharmaceutica Sinica,2009,44(5):496−499. doi: 10.3321/j.issn:0513-4870.2009.05.010 LIU X Q, DONG J X. Apigenin glycosides from Euphorbia humifusa Wild[J]. Acta Pharmaceutica Sinica, 2009, 44(05): 496-499. doi: 10.3321/j.issn:0513-4870.2009.05.010
[4] 李慧, 潘思轶, 徐晓云. 莲子心水提物中黄酮类化合物的结构及其对RAW264.7小鼠巨噬细胞NO生成的影响[J]. 中国食品学报,2018,18(2):44−54. [LI H, PAN S Y, XU X Y. Structures of flavones in lotus plumule water extract and the effect on RAW264.7 mouse ’ macrophage producing NO[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(2):44−54. LI H, PAN S Y, XU X Y. Structures of flavones in lotus plumule water extract and the effect on RAW264.7 mouse’ macrophage producing NO[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 018(2): 44-54.
[5] NICHOLAS C, BATRA S, VARGO M A, et al. Apigenin blocks lipopolysaccharide-induced lethality in vivo and proinflammatory cytokines expression by inactivating NF-kappaB through the suppression of P65 phosphorylation[J]. Journal of Immunology,2007,179(10):7121−7127. doi: 10.4049/jimmunol.179.10.7121
[6] CARDENAS H, ARANGO D, NICHOLAS C, et al. Dietary apigenin exerts immune-regulatory activity in vivo by reducing NF-κB activity, halting leukocyte infiltration and restoring normal metabolic function[J]. International Journal of Molecular Sciences,2016,17:323. doi: 10.3390/ijms17030323
[7] 朱理, 陈召桂, 何剑飞, 等. 箬叶中4种黄酮苷的同步HPLC检测[J]. 食品与生物技术学报,2016,35(6):657−659. [ZHU L, CHEN Z G, HE J F, et al. Simultaneous determination of 4 flavonoid glycosides in Indocalmus leaf by HPLC[J]. Journal of Food Science and Biotechnology,2016,35(6):657−659. doi: 10.3969/j.issn.1673-1689.2016.06.015 ZHU L, CHEN Z G, HE J F, et al. Simultaneous determination of 4 flavonoid glycosides in Indocalmus leaf by HPLC[J]. Journal of Food Science and Biotechnology, 2016, 35(6): 657-659. doi: 10.3969/j.issn.1673-1689.2016.06.015
[8] 邓思珊, 刘洪旭, 马丽红, 等. 三叶青叶黄酮类化学成分的UPLC-MS/MS定性分析及HPLC含量测定[J]. 中国医药导报,2018,15(33):86−90,94. [DENG S S, LIU H X, MA L H, et al. UPLC-MS/MS qualitative analysis and HPLC determination of flavonoids in leaves of Tetrastigma hemsleyanum[J]. China Medical Herald,2018,15(33):86−90,94. DENG S S, LIU H X, MA L H, et al. UPLC-MS/MS qualitative analysis and HPLC determination of flavonoids in leaves of Tetrastigma hemsleyanum[J]. China Medical Herald, 2018, 15(33): 86-90, 94.
[9] 董银卯, 唐冬雁, 何聪芬, 等. 绿豆芽中异黄酮类成分提取工艺的优化及含量测定[J]. 安徽农业科学,2011(10):5746−5747. [DONG Y M, TANG D Y, HE C F, et al. Optimization of extraction process of isoflavonoids from mung bean sprout and determination of its content[J]. Journal of Anhui Agricultural Sciences,2011(10):5746−5747. doi: 10.3969/j.issn.0517-6611.2011.10.029 DONG Y M, TANG D Y, HE C F, et al. Optimization of extraction process of isoflavonoids from mung bean sprout and determination of its content[J]. Journal of Anhui Agricultural Sciences, 2011(10): 5746-5747. doi: 10.3969/j.issn.0517-6611.2011.10.029
[10] 庞晨. 发芽绿豆皮抗炎活性分析及其作用方式[D]. 武汉: 华中农业大学, 2018: 44−50 PANG C. Study on the anti-inflammatory activity of germinated mung bean hull and its mode of action[D]. Wuhan: Huazhong Agricultural University, 2018: 44−50.
[11] GUO H, LI M, XU L J. Apigetrin treatment attenuates LPS-induced acute otitis media though suppressing inflammation and oxidative stress[J]. Biomedicine & Pharmacotherapy,2019,109:1978−1987.
[12] CHANPUT W, MES J J, WICHERS H J. THP-1 cell line: An in vitro cell model for immune modulation approach[J]. International Immunopharmacology,2014,23(1):37−45. doi: 10.1016/j.intimp.2014.08.002
[13] SHIRATORI H, FEINWEBER C, LUCKHARDT S, et al. THP-1 and human peripheral blood mononuclear cell-derived macrophages differ in their capacity to polarize in vitro[J]. Molecular Immunology,2017,88:58−68. doi: 10.1016/j.molimm.2017.05.027
[14] LUND M E, TO J, O'BRIEN B A, et al. The choice of phorbol 12-myristate 13-acetate differentiation protocol influences the response of THP-1 macrophages to a pro-inflammatory stimulus[J]. Journal of Immunological Methods,2016,430:64−70. doi: 10.1016/j.jim.2016.01.012
[15] ZHENG L T, OCK J, KWON B M, et al. Suppressive effects of flavonoid fisetin on lipopolysaccharide-induced microglial activation and neurotoxicity[J]. International Immunopharmacology,2008,8(3):484−494. doi: 10.1016/j.intimp.2007.12.012
[16] LI X C, SONG M F, FENG S, et al. Fragile X-related protein 1 (FXR1) regulates cyclooxygenase-2 (COX-2) expression at the maternal-fetal interface[J]. Reproduction, Fertility and Development,2018,30(11):1566−1574. doi: 10.1071/RD18037
[17] CHANPUT W, KRUEYOS N, RITTHIRUANGDEJ P. Anti-oxidative assays as markers for anti-inflammatory activity of flavonoids[J]. International Immunopharmacology,2016,40:170−175. doi: 10.1016/j.intimp.2016.08.038
[18] KAN X, LIU B, GUO W, et al. Myricetin relieves LPS-induced mastitis by inhibiting inflammatory response and repairing the blood-milk barrier[J]. Journal of Cellular Physiology,2019,234(9):16252−16262. doi: 10.1002/jcp.28288
[19] LI H, PAN S Y, XU X Y. Structure characteristics of flavonoids for cyclooxygenase-2 mRNA inhibition in lipopolysaccharide-induced inflammatory macrophages[J]. European Journal of Pharmacology,2019,856:172416. doi: 10.1016/j.ejphar.2019.172416
[20] DUBOIS R N, ABRAMSON S B, CROFFORD L, et al. Cyclooxygenase in biology and disease[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,1998,12(12):1063−1073. doi: 10.1096/fasebj.12.12.1063
[21] WANG L, TU Y C, LIAN T W, et al. Distinctive antioxidant and antiinflammatory effects of flavonols[J]. Journal of Agricultural & Food Chemistry,2006,54(26):9798−9804.
[22] HA S K, LEE P, PARK J A, et al. Apigenin inhibits the production of NO and PGE2 in microglia and inhibits neuronal cell death in a middle cerebral artery occlusion-induced focal ischemia mice model[J]. Neurochemistry International,2008,52(4):878−886.
[23] HUANG Z, WANG C, WEI L, et al. Resveratrol inhibits EMMPRIN expression via P38 and ERK1/2 pathways in PMA-induced THP-1 cells[J]. Biochemical and Biophysical Research Communications,2008,374(3):517−521. doi: 10.1016/j.bbrc.2008.07.058
[24] OLSZEWSKI M B, GROOT A J, DASTYCH J, et al. TNF trafficking to human mast cell granules: Mature chain-dependent endocytosis[J]. Journal of Immunology,2007,178(9):5701−5709. doi: 10.4049/jimmunol.178.9.5701
[25] PETKOVIC A B, MATIC S M, STAMATOVIC N V, et al. Proinflammatory cytokines (IL-1 beta and TNF-alpha) and chemokines (IL-8 and MIP-1 alpha) as markers of pen-implant tissue condition[J]. International Journal of Oral and Maxillofacial Surgery,2010,39(5):478−485. doi: 10.1016/j.ijom.2010.01.014
[26] BARNES P J, KARIN M. Nuclear factor-kappaB: A pivotal transcription factor in chronic inflammatory diseases[J]. N Engl J Med,1997,336(15):1066−1071. doi: 10.1056/NEJM199704103361506
[27] HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell,2008,132(3):344−362. doi: 10.1016/j.cell.2008.01.020
[28] KAEKO M, SUMIE S, SAYURI M, et al. Unique uptake and transport of isoflavone aglycones by human intestinal Caco-2 cells: Comparison of isoflavonoids and flavonoids[J]. Journal of Nutrition,2002(7):1956−1961.
[29] 陈丙銮, 李松林, 李萍, 等. 黄酮类化合物在Caco-2细胞模型中的吸收规律[J]. 中国天然药物,2006,4(4):299−302. [CHEN B L, LI S L, LI P, et al. The uptake characteristics of flavonoids in the Caco-2 model system[J]. Chinese Journal of Natural Medicines,2006,4(4):299−302. CHEN B L, LI S L, LI P, et al. The uptake characteristics of flavonoids in the Caco-2 model system[J]. Chinese Journal of Natural Medicines, 2006, 4(4): 299-302.
[30] 周乐, 赵晓莉, 狄留庆, 等. 黄酮类化合物口服吸收与代谢特征及其规律分析[J]. 中草药,2013,44(16):2313−2320. [ZHOU L, ZHAO X L, DI L Q, et al. Oral absorption of flavonoids and analysis of their metabolism characteristics and law[J]. Chinese Traditional and Herbal Drugs,2013,44(16):2313−2320. ZHOU L, ZHAO X L, DI L Q, et al. Oral absorption of flavonoids and analysis of their metabolism characteristics and law[J]. Chinese Traditional and Herbal Drugs, 2013, 44(16): 2313-2320.
[31] FANG Y J, CAO W W, LIANG F Q, et al. Structure affinity relationship and docking studies of flavonoids as substrates of multidrug-resistant associated protein 2 (MRP2) in MDCK/MRP2 cells[J]. Food Chemistry,2019,291:101−109. doi: 10.1016/j.foodchem.2019.03.111
[32] FANG Y J, XIA M M, LIANG F Q, et al. Establishment and use of human mouth epidermal carcinoma (KB) cells overexpressing P-glycoprotein to characterize structure requirements for flavonoids transported by the efflux transporter[J]. Journal of Agricultural and Food Chemistry,2019,67(8):2350−2360. doi: 10.1021/acs.jafc.9b00039
[33] CHEN Y, ZHAO Y H, JIA X B, et al. Intestinal absorption mechanisms of prenylated flavonoids present in the heat-processed Epimedium koreanum Nakai (Yin Yanghuo)[J]. Pharmaceutical Research,2008,25(9):2190−2199. doi: 10.1007/s11095-008-9602-7
[34] 李军茂, 何明珍, 冯育林, 等. 木犀草素及木犀草苷在大鼠体内的代谢研究[J]. 中药新药与临床药理,2017,28(1):61−68. [LI J M, HE M Z, FENG Y L, et al. In vivo studies on metabolism of luteolin and luteoloside in rats[J]. Traditional Chinese Drug Research and Clinical Pharmacology,2017,28(1):61−68. LI J M, HE M Z, FENG Y L, et al. In vivo studies on metabolism of luteolin and luteoloside in rats[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2017, 28(1): 61-68.
[35] 白岩. 绿豆化学成分及其质量控制与药动学研究[D]. 沈阳: 沈阳药科大学, 2017: 104−116 BAI Y. Constituents, quality control, and pharmacokinetics study on the mung bean (Vigna radiate L.)[D]. Shenyang: Shenyang Pharmaceutical University, 2017: 104−116.
[36] 童成亮, 刘晓东. 牡荆素在大鼠体内的药代动力学[J]. 中国药科大学学报,2007,38(1):65−68. [TONG C L, LIU X D. Pharmacokinetics of vitexin in rats[J]. Journal of China Pharmaceutical University,2007,38(1):65−68. doi: 10.3321/j.issn:1000-5048.2007.01.016 TONG C L, LIU X D. Pharmacokinetics of vitexin in rats[J]. Journal of China Pharmaceutical University, 2007, 38(1): 65-68. doi: 10.3321/j.issn:1000-5048.2007.01.016
[37] BAI Y, ZHANG Q, WANG B, et al. Plasma pharmacokinetics, bioavailability and tissue distribution of four C-glycosyl flavones from mung bean (Vigna radiata L.) seeds extracts in rat by UHPLC-MS/MS[J]. Journal of Agricultural & Food Chemistry,2017,65(27):5570−5580.
[38] GONZÁLEZ R, BALLESTER I, LÓPEZ-POSADAS R, SUAREZ M D, et al. Effects of flavonoids and other polyphenols on inflammation[J]. Critical Reviews in Food Science and Nutrtion,2011,51:331−362. doi: 10.1080/10408390903584094
-
期刊类型引用(3)
1. 王玉净,都治香,张霞,王旭,王娜. 沙棘黄酮通过调控TLR4/NF-κB信号通路改善大鼠多囊卵巢综合征的作用. 食品工业科技. 2024(16): 340-347 .  本站查看
本站查看
2. 王杰,常晨城,杨彦达,郭丽丽,张景萍,付绍印,石彩霞,张文广. 黄酮在反刍动物生产中的应用研究进展. 饲料研究. 2023(12): 144-147 .  百度学术
百度学术
3. 陈美庆,朱卫丰,管咏梅,冯育林,张艳丽,景秀村,彭万钱,欧阳辉,李琼. 基于UPLC-Q-TOF-MS/MS技术分析葛根配方颗粒的化学成分. 中国实验方剂学杂志. 2023(19): 176-186 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:



