Antioxidant and Alcohol Dehydrogenase Activating Activities of Corn Glycopeptide by Ultrafiltration Membrane Classification
-
摘要: 以玉米醇溶蛋白源玉米肽为研究对象,采用D-氨基葡萄糖和转谷氨酰胺酶对其进行酶法糖基化修饰制备玉米糖肽,然后利用截断分子质量为5、3和1 ku的超滤膜对玉米糖肽进行顺次分级分离,获得分子量>5、3~5、1~3和<1 ku四个组分。通过测定各组分的抗氧化和乙醇脱氢酶激活活性,表征分子量对玉米糖肽体外生物活性的影响。结果表明:清除DPPH自由基的玉米糖肽组分的分子量分布在1~5 ku范围内;螯合亚铁离子、清除超氧阴离子自由基、还原力和激活乙醇脱氢酶的玉米糖肽组分的分子量集中在1~3 ku范围内,在浓度为2 mg/mL时,相应的活力分别为83.22%、59.39%、2.248和37.92%;而分子量<5 ku的玉米糖肽组分均具有清除羟基自由基的活性,说明超滤膜分级对玉米糖肽的生物活性影响较大,可以依据玉米糖肽的生物活性选择超滤组分。Abstract: In the present work, corn peptides from zein were modified by D-glucosamine under transglutaminase to produce corn glycopeptides, and then the corn glycopeptides were fractionated sequentially using ultrafiltration membranes with molecular weight cut-off 5、3 and 1 ku, and four components with molecular weight >5, 3~5, 1~3 and <1 ku were obtained. The effect of molecular weight on the biological activities of corn glycopeptide was characterized by measuring the antioxidant and alcohol dehydrogenase activating activities of each molecular weight component. The results showed that the molecular weight distribution of the corn glycopeptides that had the ability to scavenge DPPH free radicals was in the range of 1~5 ku. At a concentration of 2 mg/mL, the corresponding activities were 83.22%, 59.39%, 2.248 and 37.92%, respectively. However, all corn glycopeptides components with molecular weight <5 ku had the activity of scavenging hydroxyl radicals, indicating that the biological activities of corn glycopeptides were greatly affected by the ultrafiltration membrane classification, and they could be selected according to the biological activities of corn glycopeptides.
-
转谷氨酰胺酶(Transglutaminase,TGase),全称为蛋白质-谷氨酰胺-γ-谷氨酰转移酶,依据酰基供体的不同,可以催化三种类型反应:交联(蛋白质/肽分子中的赖氨酸残基)、酰基转移(即酶法糖基化,含有伯氨基团的糖)和脱酰胺(水分子),这三种反应均可以用于改善蛋白质的功能性质[1-4]。与美拉德反应相比,TGase途径的酶法糖基化反应条件更温和,产物更安全,因此,TGase催化的酶法糖基化反应已经应用于多种蛋白质/多肽的改性中,接糖量(即糖基化反应的效率)一般在1.01~371.86 mg D-氨基葡萄糖/g蛋白范围内[5-10]。
玉米醇溶蛋白含有高比例的谷氨酰胺、缺少赖氨酸的氨基酸特点,导致其是TGase催化的酶法糖基化反应的优势原料。但是,当采用D-氨基葡萄糖对玉米醇溶蛋白进行糖基化修饰时,D-氨基葡萄糖的接入量仅为11.34±0.21 mg/g蛋白[11]。玉米醇溶蛋白质在水相中的溶解度低,且一些反应基团深埋在蛋白分子内部,影响了底物蛋白与氨基糖之间的相互作用,导致氨基糖的导入量较低。玉米糖肽是玉米醇溶蛋白先经蛋白酶水解获得的低分子量玉米肽,再在TGase催化下与氨基糖共价结合的产物。与玉米醇溶蛋白相比,玉米糖肽的糖基化效率显著增加,且具有更高的抗氧化活性及乙醇脱氢酶激活活性[12-13],是具有开发潜力的生物功能因子。
食源性蛋白肽的分子质量大小与其生物活性有关,且大多数功能性活性肽存在于复杂的基质混合物中,该混合物含有大量不同大小、构象和净电荷的水解蛋白质组分且浓度低[14],因此,有必要在工业规模上分离和浓缩特定肽,并明确肽的基本性质如分子量大小与其生物活性之间的关系,为肽的制备和富集指明方向。超滤是一种膜过滤法,其借助压力或浓度梯度使样品通过半透膜进行分离,这种分离方法已在实验室研究和工业生产中广泛应用于从粗蛋白水解物中纯化和浓缩低分子量活性肽[15]。
本实验采用截断分子量为5、3和1 ku的超滤膜对玉米糖肽进行顺次分级分离,获得分子量为>5、5~3、3~1和<1 ku四个组分,通过测定各分子量组分的抗氧化和乙醇脱氢酶激活活性,表征分子量对玉米糖肽生物活性的影响,为玉米糖肽作为功能性食品应用于食品工业奠定理论基础。
1. 材料与方法
1.1 材料与仪器
硫代巴比妥酸、菲洛嗪、D-氨基葡萄糖盐酸盐 上海生工生物工程有限公司;碱性蛋白酶Alcalase 酶活力6.28×105 U/mL,丹麦诺维信公司;DPPH自由基、2-脱氧-D-核糖、玉米醇溶蛋白 Sigma公司;Tgase 酶活力1000 U/g,泰兴市一鸣生物制品有限公司;乙醇脱氢酶、氧化型辅酶Ⅰ(NAD+) 上海宝曼生物科技有限公司;其他试剂均为国产分析纯。
DF-I集热式磁力加热搅拌器 常州荣华仪器制造有限公司;SHZ-A恒温水浴振荡器 上海跃进医疗器械厂;TU1901紫外可见分光光度计 北京普析通用仪器有限责任公司;PB-10 pH计 赛多利斯科学仪器(北京)有限公司;NDA701杜马斯定氮仪 意大利VELP公司;LD-53真空冷冻干燥机 美国MILLROCk公司;AKTAFWXS膜过滤系统、5000、3000和1000 nmwc Hollow Fiber Cartridge,美国GE公司。
1.2 实验方法
1.2.1 玉米糖肽的制备
采用前期实验确定的工艺条件制备玉米糖肽[16],在该工艺条件下制备的玉米糖肽,采用红外光谱测定确认D-氨基葡萄糖与玉米肽之间发生酶法糖基化反应。玉米醇溶蛋白用蒸馏水配成底物质量浓度为5%(w/v)的悬浮液,按酶与底物的质量比3%加入碱性蛋白酶Alcalase,在初始pH8.5、温度60 ℃条件下酶解2 h。在酶解过程中,不断加入1.0 mol/L NaOH使pH保持在8.5。酶解结束后,反应液放入沸水浴中灭酶15 min,冷却至室温后将pH调至7.0,4000 r/min离心10 min,收集上清液经冷冻干燥后获得玉米肽。将制备的玉米肽配成质量浓度为3%(w/v)的溶液,按玉米肽与D-氨基葡萄糖的质量比1:3加入D-氨基葡萄糖,用2 mol/L NaOH调节pH至7.7,按加酶量55 U/g蛋白加入TGase,在44 ℃恒温水浴振荡器中糖基化反应7 h后,将反应物立即放入85 ℃水浴中灭酶5 min。冷却至室温,4000 r/min离心10 min,收集上清液过截断分子质量300 Da的纳滤膜,透过液经冷冻干燥后获得玉米糖肽混合物。
1.2.2 玉米糖肽的超滤分级分离
将一定体积的玉米糖肽溶液注入超滤分离装置的储槽中,在泵提供的动力下,样品溶液经微滤后进入截断分子量为5 ku的超滤膜中,样品溶液中分子量<5 ku的小分子物质经中空纤维膜的内壁渗透出来成为渗透液,分子量>5 ku的大分子物质得以保留并得到浓缩,返回到储槽中,如此反复循环,收集分子量>5和<5 ku的分子量组分。将分子量<5 ku的渗透液再顺次通过3和1 ku的超滤膜,共获得分子量为>5、5~3、3~1和<1 ku四个组分。
1.2.3 蛋白质含量的测定
总蛋白质含量参照NY/T 2007-2011杜马斯燃烧法进行测定,可溶性蛋白含量采用Folin-酚法测定[17],并按公式(1)计算蛋白质回收率。在空白管中加入0.5 mL蒸馏水,在样品管中加入0.1 mL样液和0.4 mL蒸馏水,分别加入2.5 mL Folin-酚甲液,混匀后静置10 min,再分别加入0.25 mL Folin-酚乙液,迅速摇匀并静置30 min,最后在640 nm下测定吸光值,根据牛血清白蛋白标准曲线(y=0.0044x+0.0026, R2=0.999)计算出可溶性蛋白含量(mg/mL)。
蛋白质回收率(%)=超滤组分的蛋白质总量(mg)超滤前的蛋白质总量(mg)×100 (1) 1.2.4 抗氧化活性的测定
用DPPH、羟基和超氧阴离子自由基清除活性,以及亚铁离子螯合能力和还原力表征玉米糖肽的抗氧化活性,参照Wang等[18]描述的方法进行测定。
1.2.4.1 DPPH自由基清除活性
将空白组、对照组和样品组的相应反应液加入到试管中,摇匀后避光反应30 min,分别测量517 nm处的吸光度值A0、Aj 和Ai,根据公式(2)计算DPPH自由基清除率。
DPPH自由基清除率(%)=(1−Ai−AjA0)×100 (2) 1.2.4.2 羟基自由基清除活性
采用2-脱氧-D-核糖法测定。将相应反应液加入到试管中,摇匀后将所有试管置于37 ℃恒温水浴振荡器中反应1 h。水浴后向各试管中分别加入1 mL 2.0%硫代巴比妥酸溶液,1 mL 2.0%三氯乙酸溶液,振荡摇匀后再将所有试管放入沸水中处理30 min,取出后立即流水冷却至室温,最后在532 nm处分别测定空白组、对照组和样品组的吸光度值A0、Aj 和Ai,根据公式(3)计算羟基自由基清除率。
羟基自由基清除率(%)=(Ai−AjAi−A0)×100 (3) 1.2.4.3 还原力
在10 mL离心管中分别加入2 mL待测样品溶液、2 mL磷酸盐缓冲液(pH6.6,0.2 mol/L)和2 mL铁氰化钾溶液(1%,w/v),振荡均匀,50 ℃水浴20 min;加入2 mL 10% (w/v)三氯乙酸溶液,振荡均匀后4000 r/min 离心10 min;取上清液2 mL,加入2 mL蒸馏水和0.4 mL 0.1% (w/v) FeCl3溶液,振荡均匀,50 ℃水浴10 min,最后在700 nm处进行比色。
1.2.4.4 亚铁离子螯合能力
将相应反应液加入到试管中,振荡均匀后室温下静置10 min,此时样品中的抗氧化成分与亚铁离子螯合,减少563 nm处有强吸收的鲜红色菲洛嗪亚铁化合物的形成量。最后在563 nm波长处分别测定对照组和样品组的吸光度值A0、Aj,根据公式(4)计算亚铁离子螯合率。
亚铁离子清除率(%)=(Aj−A0A0)×100 (4) 1.2.4.5 超氧阴离子自由基清除活性
采用邻苯三酚自氧化法测定。将对照组和样品组的相应反应液加入到试管中,反应30 s后于325 nm处作时间扫描,反应4 min,记反应速率分别为ODA(A/min)和ODB(A/min),根据公式(5)计算超氧阴离子自由基清除率。
超氧阴离子自由基清除率(%)=(1−ODBODA)×100 (5) 1.2.5 乙醇脱氢酶激活能力的测定
采用瓦勒-霍赫的酶法进行测定[19],略有修改。按表1加入各种相应反应液到10 mL带盖离心管中,振荡混合均匀后放入25 ℃水浴锅中,盖盖温浴5 min后立即加入0.1 mL、0.25 U/mL乙醇脱氢酶,摇匀后于340 nm处进行时间扫描,反应时间5 min,取反应最初的线性部分作图,斜率记为Kp。对于对照组,用0.1 mL蒸馏水代替样品,斜率记为Kc。对于空白组,以0.5 mL蒸馏水代替11.5%乙醇溶液。按公式(6)计算待测样品的乙醇脱氢酶激活率。
表 1 乙醇脱氢酶激活率测定时的反应体系Table 1. Reaction system for determining alcohol dehydrogenase activation rate组别 样液
(mL)pH8.8焦磷酸钠
(mL)NAD+
(mL)11.5%乙醇
(mL)H2O
(mL)空白组 − 3 2 − 1 对照组 − 3 2 1 0.2 样品组 0.2 3 2 1 − 乙醇脱氢酶激活率(%)=(Kp−KcKc)×100 (6) 1.3 数据处理
除超滤膜分级实验外,所有实验均平行3次,数据用平均值±标准差的方式表示。试验数据采用Microsoft Excel 2010和SPSS 19.0进行单因素方差分析,采用LSD法进行组间多重比较,P<0.05为差异显著性水平。
2. 结果与分析
2.1 超滤膜分级对玉米糖肽蛋白质回收率的影响
通过Folin-酚法测定玉米糖肽各超滤分级组分的蛋白质含量,计算蛋白质回收率,结果如表2所示。由表2可以看出,玉米糖肽经3种超滤膜顺次分级分离后,蛋白质的总回收率为81.37%,说明经超滤膜顺次分级时玉米糖肽和膜之间发生相互作用,玉米糖肽在超滤膜表面形成沉积物,导致总蛋白质损失18.63%,这与Vallee等研究结果一致[20]。在四个分子量组分中,分子量<3 ku的组分占44.57%,而分子量>5 ku的组分占17.29%,比糖基化修饰前增加9.33%(玉米肽中分子量>5 ku的组分占7.96%),其原因可能是在TGase的催化下,玉米肽与D-氨基葡萄糖发生共价结合以及玉米肽分子之间发生分子内交联反应生成大分子物质而导致的[16]。
表 2 超滤膜分级后玉米糖肽的蛋白质回收率Table 2. Protein recovery rate of corn glycopeptides after ultrafiltration membrane classification组分 体积
(mL)蛋白质含量
(mg/mL)蛋白质总量
(mg)回收率
(%)超滤前 750 40.74 18333 − >5 ku 45 25.37 3171.25 17.29 3~5 ku 120 29.81 3577.2 19.51 1~3 ku 320 17.32 5542.4 30.23 <1 ku 200 13.15 2630 14.34 2.2 超滤膜分级对玉米糖肽抗氧化活性的影响
2.2.1 DPPH自由基清除活性
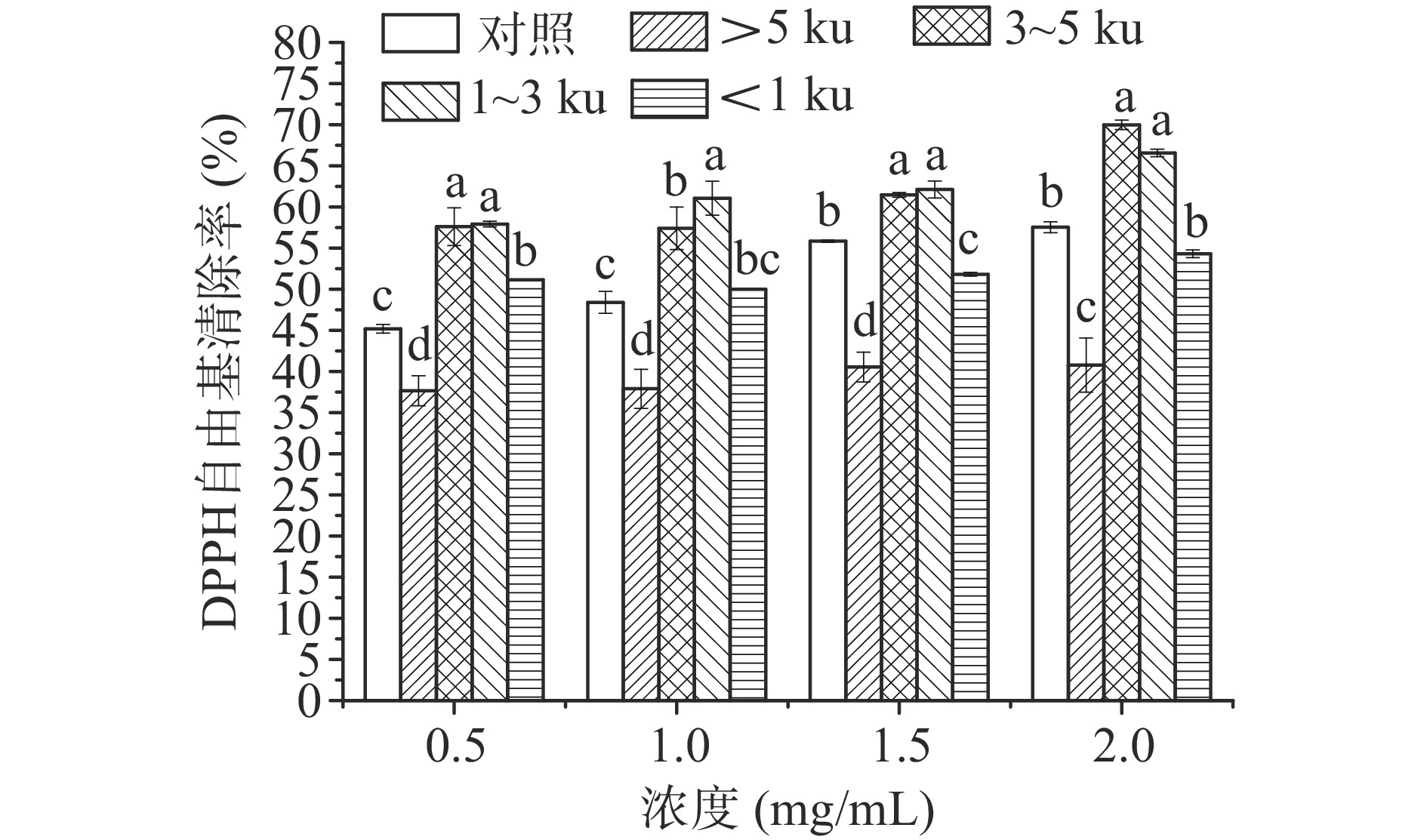
在不同浓度条件下,研究分子量对玉米糖肽DPPH自由基清除活性的影响,结果如图1所示。
如图1所示,各分子量组分的DPPH自由基清除能力均具有剂量依赖性。经超滤膜分级后,与对照组相比,分子量>5 ku的组分对DPPH自由基的清除能力显著降低(P<0.05),而分子量3~5和1~3 ku组分的DPPH自由基清除能力显著增加(P<0.05),且显著高于分子量<1 ku组分,说明超滤膜分级对具有清除DPPH自由基能力的玉米糖肽组分起到富集的作用,且在玉米糖肽分子中,具有清除DPPH自由基能力的组分的分子量集中在1~5 ku范围内。Bamdad等研究了大麦醇溶蛋白酶解产物的抗氧化活性,发现中等大小的肽可能在抗氧化活性中起重要作用[21]。Sabeena-Farvin等发现,与较低分子量组分相比,分子量>30 和10~30 ku高分子量水解物显示出更显著的DPPH自由基清除活性[22]。Xia等也发现大分子量肽具有比小分子量肽更好的DPPH自由基清除活性[23]。在本研究中,分子量为1~5 ku的玉米糖肽组分可能具有最佳的扩散性和供电子能力,有利于玉米糖肽与DPPH自由基结合并将其清除。分子量>5 ku的组分,主要由大分子量肽段组成,其反应扩散率低可能会限制DPPH自由基的清除,而分子量<1 ku的组分由于其亲水性的积累不利于与脂溶性DPPH自由基结合,导致DPPH自由基清除活性较低。因此,具有清除DPPH自由基活性的玉米糖肽组分的分子量主要集中在1~5 ku范围内。
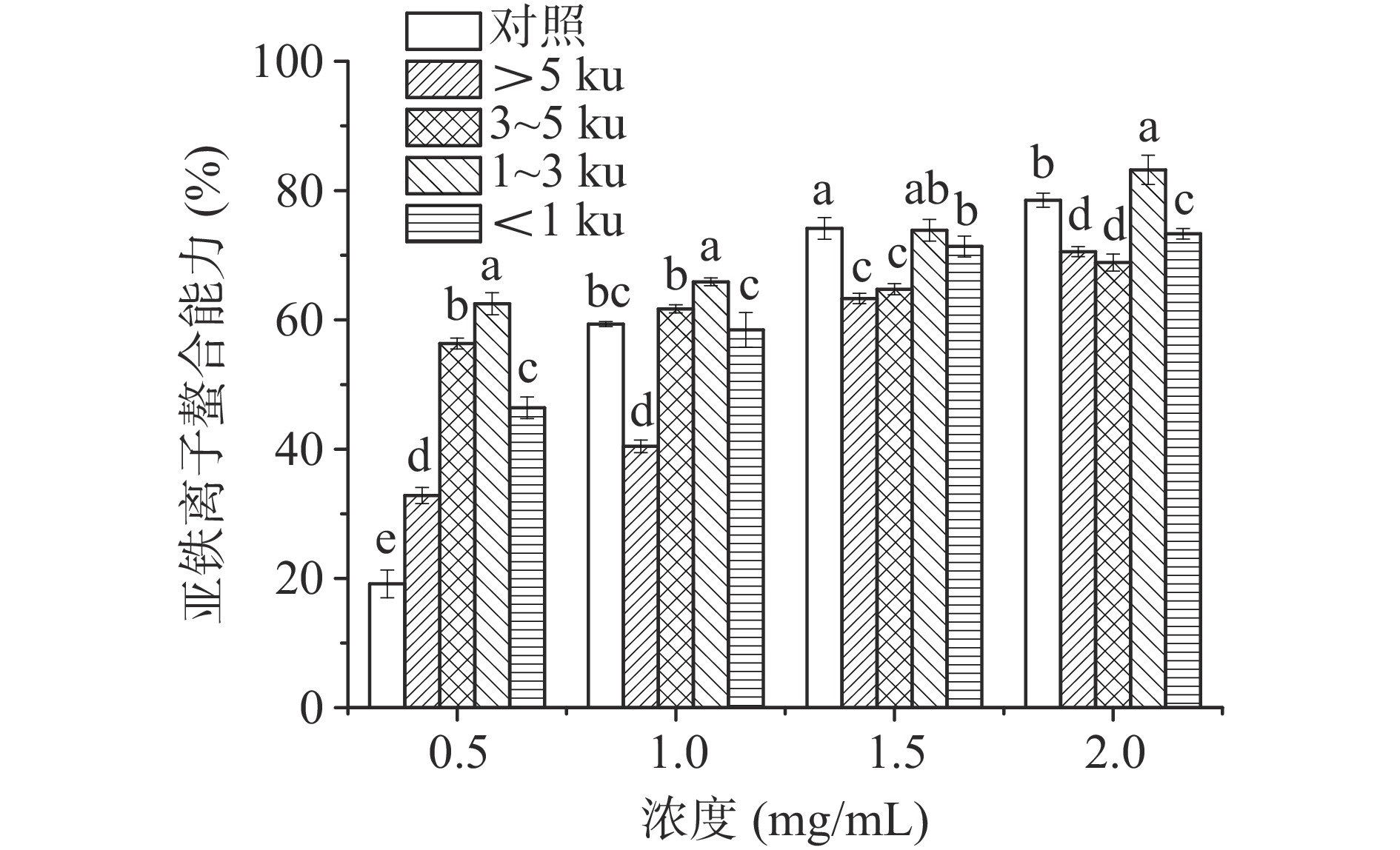
2.2.2 亚铁离子螯合能力
在不同浓度条件下,研究分子量对玉米糖肽亚铁离子螯合能力的影响,结果如图2所示。在0.5~2.0 mg/mL浓度范围内,在四个分子量组分中,1~3 ku组分具有最强的亚铁离子螯合能力,在浓度为2 mg/mL时,螯合率为83.22%,比对照组和分子量>5、3~5和<1 ku的组分分别高4.71%、12.68%、14.35%和9.91%,说明玉米糖肽分子中具有亚铁离子螯合能力的多肽组分的分子量主要集中在1~3 ku范围内。研究发现,肽类螯合亚铁离子是通过其氨基酸的电荷性质和形成的捕获亚铁离子的结构完成[24-25]。与其他分子量段组分相比,分子量1~3 ku的玉米糖肽组分中可能具有更多的亚铁离子结合位点,包括玉米肽分子上共价结合的D-氨基葡萄糖的多羟基结构、以及Asp、Glu、His和Arg等残基等,同时,较大分子量的玉米糖肽还可能通过形成“笼子”似的结构以捕获金属离子,故亚铁离子螯合能力最强;而分子量>5 ku组分由于其分子较大,螯合亚铁离子的活性位点可能埋藏存在于其分子内部,且反应扩散率低等因素均会限制其对亚铁离子的螯合作用。
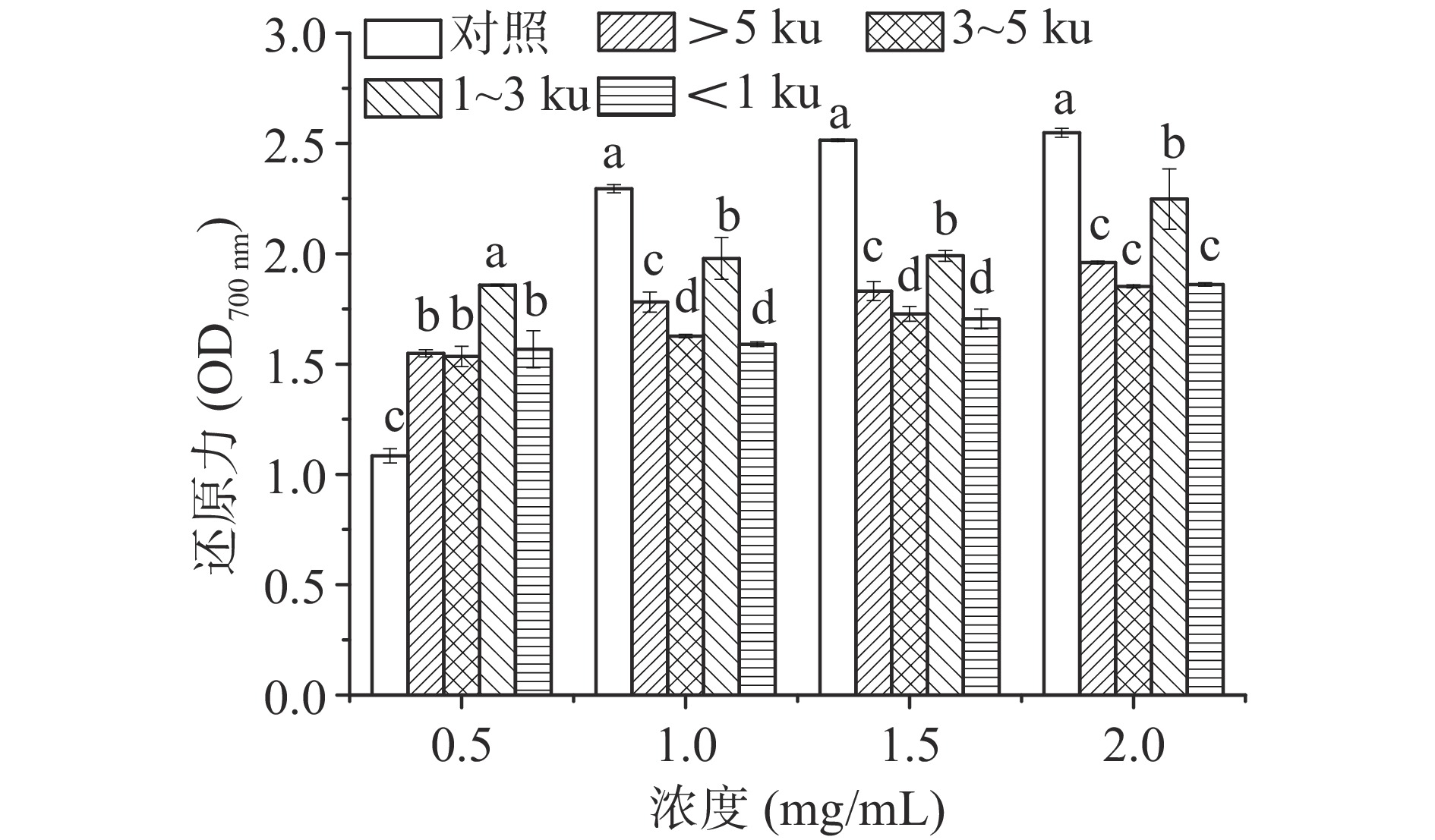
2.2.3 还原力
在不同浓度条件下,研究分子量对玉米糖肽还原力的影响,结果如图3所示。除0.5 mg/mL浓度外,经超滤膜分级后,玉米糖肽的还原力均显著降低(P<0.05),分析可能是因为玉米糖肽对Fe3+的还原能力是各分子量组分的协同效果。在0.5~2.0 mg/mL浓度范围内,在四个分子量组分中,分子量1~3 ku组分具有最强的还原能力,在浓度为2 mg/mL时,还原力为2.248,分别比分子量>5、3~5和<1~3 ku的组分高0.288、0.396和0.387。孙常雁等研究了乳清蛋白肽美拉德反应产物的抗氧化活性,发现分子量为0.8~5 ku的中分子量组分具有最高的还原能力[26],与本实验结果一致。在不同分子量组分中,玉米糖肽发挥还原能力的组分主要集中在1~3 ku分子量范围内,可能是由于该分子量组分具有较小的空间位阻,从而具有较好的供电子能力,可将Fe3+还原为Fe2+,Fe2+进一步发生Perl’s Prussian反应从而表现出还原能力。
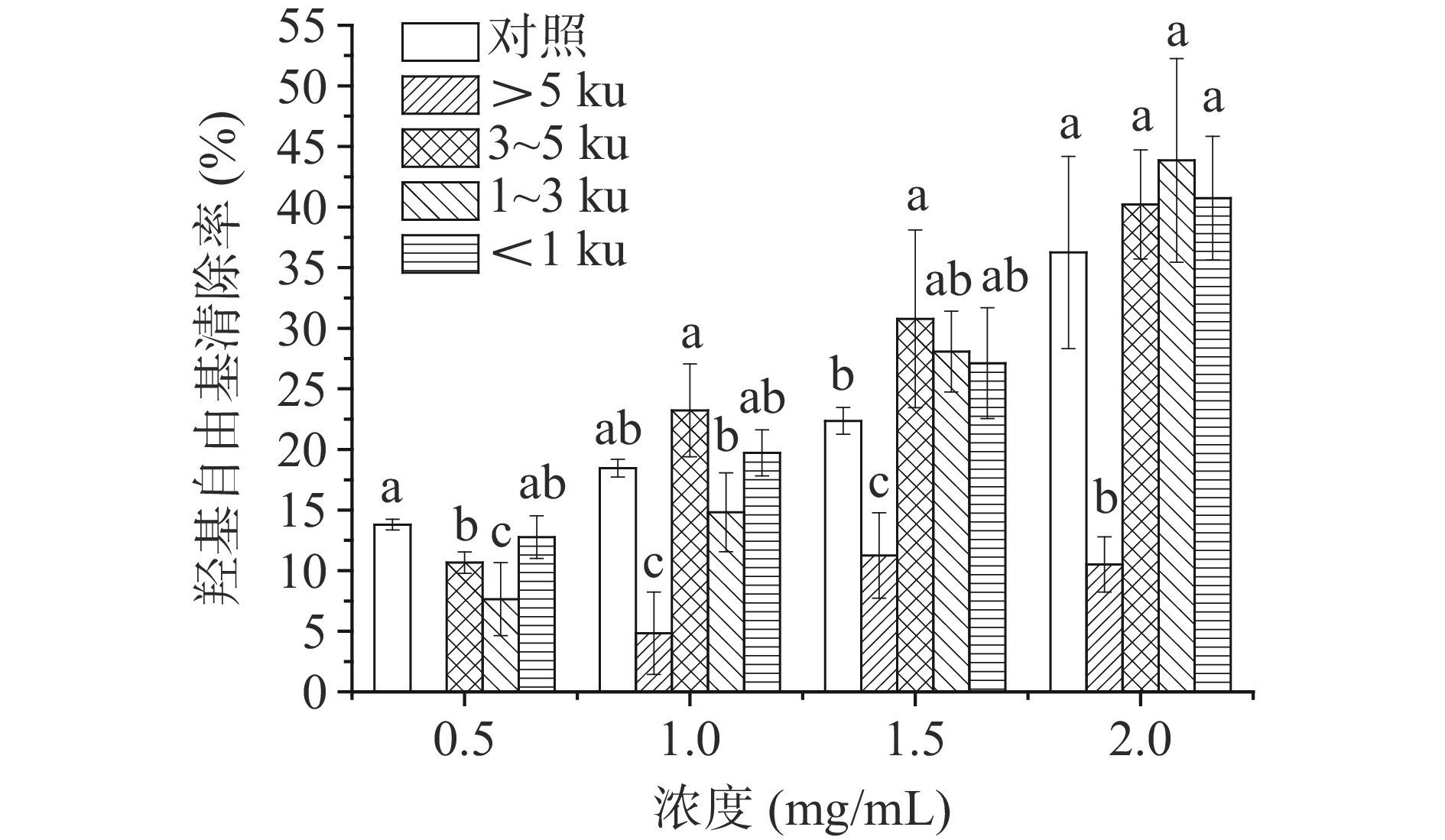
2.2.4 羟基自由基清除活性
在不同浓度下,研究分子量对玉米糖肽羟基自由基清除活性的影响,结果如图4所示。在浓度为0.5 mg/mL时,分子量对玉米糖肽的羟基自由基清除能力影响较大,随着分子量的减小,玉米糖肽对羟基自由基的清除能力逐渐增强,即小分子质量的玉米糖肽具有最高的羟基自由基清除能力;当浓度逐渐增大时,分子量对玉米糖肽羟基自由基清除能力的影响逐渐减弱,在浓度为1~2 mg/mL时,分子量3~5、1~3和<1 ku三个组分的羟基自由基清除率间差异不显著(P>0.05)。在浓度低时,小分子量样品的扩散系数较大,易于向羟基自由基供氢而将其清除,而大分子量样品由于其较大的空间位阻,不利于向羟基自由基供氢,进而清除能力降低;在样品浓度高时,样品的扩散系数降低,不同分子量样品间的空间位阻差异被抵消,进而导致不同分子量样品清除羟基自由基的能力间无显著性差异[27],这些结果也表明玉米糖肽的抗氧化活性不仅取决于其分子量,还取决于糖肽组分的疏水性等特性[20]。
另一方面,高分子质量分子通常具有较大的分子体积,这使得它们难以穿透细胞膜。酪蛋白或胶原蛋白水解物通过Caco-2细胞时也已经证明具有分子量依赖性的渗透性,即小分子量肽可以优先通过肽转运蛋白或细胞旁途径路渗透[28]。因此,小分子量玉米糖肽能够更好地穿透细胞膜,然后被转运到细胞核中以结合并激活转录因子,即比大分子量玉米糖肽更具有在细胞内发挥抗氧化活性的潜力。
2.2.5 超氧阴离子自由基清除活性
在不同浓度下,研究分子量对玉米糖肽超氧阴离子自由基清除活性的影响,结果如图5所示。分子量对玉米糖肽的超氧阴离子自由基清除能力影响较大,与对照组相比,分子量<5和3~5 ku组分的超氧阴离子自由基的清除能力显著降低,分子量1~3 ku组分的清除率显著增加(P<0.05),而分子量<1 ku组分的清除能力对照组相当(除0.5 mg/mL浓度外),说明玉米糖肽中清除超氧阴离子自由基的组分主要集中在分子量1~3 ku。Yu等研究了不同分子量豆粕水解产物的美拉德反应产物的抗氧化活性时,发现分子量1~3 ku组分具有最高的抗氧化活性[29]。其原因可能是肽的抗氧化活性和其氨基酸的序列、组成、结构紧密相关。超滤分级将玉米糖肽分成不同量级的组分,而分子量1~3 ku玉米糖肽组分中含有对邻苯三酚自氧化速率具有较好抑制作用的组分最多,具有最佳的供电子能力,进而对超氧阴离子自由基的清除能力最强,这与王静等研究结果一致[30]。
2.3 超滤膜分级对玉米糖肽乙醇脱氢酶激活活性的影响
在不同浓度下,研究分子量对玉米糖肽乙醇脱氢酶激活率的影响,结果如图6所示。在浓度0.5 mg/mL时,与对照组相比,不同的分子量对玉米糖肽的乙醇脱氢酶激活率没有显著性影响(P>0.05),在浓度1.0~2.0 mg/mL范围内,除分子量1~3 ku组分的乙醇脱氢酶激活率显著增加外,其余三个分子量组分与对照组相比均无显著性差异(P>0.05,除1.5 mg/mL浓度下<1 ku组分外),说明玉米糖肽分子中具有乙醇脱氢酶激活的活性组分主要集中在分子量1~3 ku范围内,原因可能有以下两个方面:一是分子量1~3 ku组分中含有高比例的丙氨酸和亮氨酸,能够稳定反应体系中的NAD+,从而增强了乙醇脱氢酶的活性;二是乙醇脱氢酶激活活性与肽段的分子量大小、反应体系的抗氧化能力有关[31-32],分子量1~3 ku玉米糖肽的抗氧化能力最强(图1~图5),可以保持乙醇脱氢酶的稳定性,故对乙醇脱氢酶具有最高的激活活性。
3. 结论
食源性蛋白肽的分子质量大小与其生物活性有关。玉米肽酶法糖基化修饰的产物-玉米糖肽经过截断分子质量为5、3和1 ku的超滤膜顺次分级分离,获得分子量>5、5~3、3~1和<1 ku四个组分。经超滤膜顺次分离后,玉米糖肽的抗氧化和乙醇脱氢酶激活活性主要集中1~3 ku范围内,且呈剂量依赖性。因此,在制备玉米糖肽时,可以选用超滤膜对活性组分进行分离和富集。在此基础上,还需要从分子结构和疏水性方面探索玉米糖肽的生物活性,为玉米糖肽的生产及工业应用提供参考。
-
表 1 乙醇脱氢酶激活率测定时的反应体系
Table 1 Reaction system for determining alcohol dehydrogenase activation rate
组别 样液
(mL)pH8.8焦磷酸钠
(mL)NAD+
(mL)11.5%乙醇
(mL)H2O
(mL)空白组 − 3 2 − 1 对照组 − 3 2 1 0.2 样品组 0.2 3 2 1 − 表 2 超滤膜分级后玉米糖肽的蛋白质回收率
Table 2 Protein recovery rate of corn glycopeptides after ultrafiltration membrane classification
组分 体积
(mL)蛋白质含量
(mg/mL)蛋白质总量
(mg)回收率
(%)超滤前 750 40.74 18333 − >5 ku 45 25.37 3171.25 17.29 3~5 ku 120 29.81 3577.2 19.51 1~3 ku 320 17.32 5542.4 30.23 <1 ku 200 13.15 2630 14.34 -
[1] ZHANG Q, LI L, LAN Q Y, et al. Protein glycosylation: A promising way to modify the functional properties and extend the application in food system[J]. Critical Reviews in Food Science and Nutrition,2018,59:2506−2533.
[2] D’ELETTO M, FARRACE M G, PIACENTINI M, et al. Assessing the catalytic activity of transglutaminases in the context of autophagic responses[J]. Molecular Characterization of Autophagic Responses, 2017, Part A: 511−520.
[3] CHOBERT J M, BRIAND L, GUÉGUEN J, et al. Recent advances in enzymatic modifications of food proteins for improving their functional properties[J]. Food/Nahrung,1996,40(4):177−182. doi: 10.1002/food.19960400403
[4] SAVOCA M, TONOLI E, ATOBATELE A, et al. Biocatalysis by transglutaminases: A review of biotechnological applications[J]. Micromachines,2018,9(11):562. doi: 10.3390/mi9110562
[5] FU M, ZHAO X H. Modified properties of a glycated and cross-linked soy protein isolate by transglutaminase and an oligochitosan of 5 kDa[J]. Journal of the Science of Food & Agriculture,2016,97(1):58−64.
[6] 张英蕾, 尹彦洋, 姚鑫淼, 等. 转谷氨酰胺酶催化的糖基化修饰对黑豆蛋白抗氧化活性的影响[J]. 中国食品添加剂,2019,30(2):77−84. [ZHANG Y L, YIN Y Y, YAO X M, et al. Research of the effect of EGBSP catalyzed by transglutaminase on black bean antioxidant activity[J]. China Food Additives,2019,30(2):77−84. doi: 10.3969/j.issn.1006-2513.2019.02.005 ZHANG Y L, YIN Y Y, YAO X M, et al. Research of the effect of EGBSP catalyzed by transglutaminase on black bean antioxidant activity[J]. China Food Additives, 2019, 30(2): 77-84 doi: 10.3969/j.issn.1006-2513.2019.02.005
[7] ZHU C Y, WANG X P, ZHAO X H. Property modification of caseinate responsible to transglutaminase- induced glycosylation and crosslinking in the presence of a degraded chitosan[J]. Food Science & Biotechnology,2015,24(3):843−850.
[8] CHEN L, ULLAH N, LI C Y, et al. Incorporated glucosamine adversely affects the emulsifying properties of whey protein isolate polymerized by transglutaminase[J]. Journal of Dairy Science,2017,100(5):3413−3423. doi: 10.3168/jds.2016-12071
[9] COLAS B, CAER D, FOURNIER E. Transglutaminase-catalyzed glycosylation of vegetable proteins. Effect on solubility of pea legumin and wheat gliadins[J]. Journal of Agricultural and Food Chemistry,1993,41(11):1811−1815. doi: 10.1021/jf00035a001
[10] 王长远, 全越, 李玉琼, 等. 燕麦麸皮球蛋白的糖基化结构修饰及功能性变化[J]. 食品科学,2017,38(9):143−148. [WANG C Y, QUAN Y, LI Y Q, et al. Structural modification of oat bran globulin by glycosylation and change in its functional properties[J]. Food Science,2017,38(9):143−148. doi: 10.7506/spkx1002-6630-201709023 WANG C Y, QUAN Y, LI Y Q, et al. Structural modification of oat bran globulin by glycosylation and change in its functional properties[J]. Food Science, 2017, 38(9): 143-148 doi: 10.7506/spkx1002-6630-201709023
[11] 周利敏, 刘晓兰, 刘玥, 等. TGase催化玉米醇溶蛋白糖基化改性[J]. 食品科学,2014,35(24):15−19. [ZHOU L M, LIU X L, LIU Y, et al. TGase-catalyzed glycosylation of zein[J]. Food Science,2014,35(24):15−19. doi: 10.7506/spkx1002-6630-201424003 ZHOU LM, LIU XL, LIU Y, et al. TGase-Catalyzed Glycosylation of Zein[J]. Food Science, 2014, 35(24): 15-19. doi: 10.7506/spkx1002-6630-201424003
[12] 王晓杰, 刘晓兰, 丛万锁, 等. 玉米六肽的酶法糖基化修饰对产物生物活性的影响[J]. 中国酿造,2018,37(3):78−83. [WANG X J, LIU X L, CONG W S, et al. Effect of transglutaminase catalyzed glycosylation reaction on the biological activity of corn hexapeptide[J]. China Brewing,2018,37(3):78−83. doi: 10.11882/j.issn.0254-5071.2018.03.017 WANG X J, LIU X L, CONG W S, et al. Effect of transglutaminase catalyzed glycosylation reaction on the biological activity of corn hexapeptide[J]. China Brewing, 2018, 37(3): 78-83. doi: 10.11882/j.issn.0254-5071.2018.03.017
[13] WANG X J, LIU X L, ZHENG X Q, et al. Preparation of corn glycopeptides and evaluation of their antagonistic effects on alcohol-induced liver injury in rats[J]. Journal of Functional Foods,2020,66:103776. doi: 10.1016/j.jff.2019.103776
[14] CHEN L H, LI D N, ZHU C C, et al. Characterisation of antioxidant peptides from enzymatic hydrolysate of golden melon seeds protein[J]. International Journal of Food Science and Technology, 2021, 56(11): 5904−5912.
[15] PAN X, ZHAO Y Q, HU F Y, et al. Preparation and identification of antioxidant peptides from protein hydrolysate of skate (Raja porosa) cartilage[J]. Journal of Functional Foods,2016,25:220−230. doi: 10.1016/j.jff.2016.06.008
[16] 王晓杰, 刘晓兰, 石彦国. 玉米肽的酶法糖基化修饰及产物溶解性的研究[J]. 中国油脂,2019,44(11):70−74. [WANG X J, LIU X L, SHI Y G. Enzymatic glycosylation of corn peptide and solubility of glycosylated product[J]. China Oils and Fats,2019,44(11):70−74. WANG X J, LIU X L, SHI Y G. Enzymatic glycosylation of corn peptide and solubility of glycosylated product[J]. China Oils and Fats, 2019, 44(11): 70-74
[17] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193:264−275.
[18] WANG X J, ZHENG X Q, KOPPARAPU N K, et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J]. Process Biochemistry,2014,49(9):1562−1569. doi: 10.1016/j.procbio.2014.05.014
[19] CENTENARO G S, SALAS-MELLADO M, PIRES C, et al. Fractionation of protein hydrolysates of fish and chicken using membrane ultrafiltration: Investigation of antioxidant activity[J]. Appl Biochem Biotechnol,2014,172(6):2877−2893. doi: 10.1007/s12010-014-0732-6
[20] VALLEE B L, HOCH F L. Zinc: A component of yeast alcohol dehydrogenase[J]. Proceedings of the National Academy of Sciences of the United States of America,1955,41(6):327−328. doi: 10.1073/pnas.41.6.327
[21] BAMDAD F, WU J, CHEN L. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science,2011,54:20−28. doi: 10.1016/j.jcs.2011.01.006
[22] SABEENA-FARVIN K H, BARON C P, NIELSEN N S, et al. Antioxidant activity of yoghurt peptides: Part 1. In vitro assays and evaluation in x-3 enriched milk[J]. Food Chemistry,2010,123:1081−1089. doi: 10.1016/j.foodchem.2010.05.067
[23] XIA Y, BAMDAD F, GÄNZLE M, et al. Fractionation and characterization of antioxidant peptides derived from barley glutelin by enzymatic hydrolysis[J]. Food Chemistry,2012,134:1509−1518. doi: 10.1016/j.foodchem.2012.03.063
[24] SAIGA A I, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry,2003,51(12):3661−3667. doi: 10.1021/jf021156g
[25] 杨玉蓉, 李安平, 钟政昌, 等. 桃仁多肽螯合亚铁的结构表征及体外模拟消化[J]. 中国食品学报,2020,20(2):61−69. [YANG Y R, LI A P, ZHONG Z C, et al. Structural characterization and in vitro simulated digestion of peach kernel peptide-ferrous complex[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(2):61−69. doi: 10.16429/j.1009-7848.2020.02.008 YANG Y R, LI A P, ZHONG Z C, et al. Structural characterization and in vitro simulated digestion of peach kernel peptide-ferrous complex[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(2): 61-69. doi: 10.16429/j.1009-7848.2020.02.008
[26] 孙常雁, 李德海, 刘骞, 等. 超滤分级研究乳清蛋白肽美拉德反应产物的抗氧化活性的影响[J]. 中国乳品工业,2014,42(2):4−8. [SUN C Y, LI D H, LIU Q, et al. Antioxidant capacity of Maillard reaction products formed by whey protein isolate hydrolysate and glucose model system as influenced by ultrafiltration[J]. China Dairy Industry,2014,42(2):4−8. doi: 10.3969/j.issn.1001-2230.2014.02.001 SUN C Y, LI D H, LIU Q, et al. Antioxidant capacity of Maillard reaction products formed by whey protein isolate hydrolysate and glucose model system as influenced by ultrafiltration[J]. China Dairy Industry, 2014, 42(2): 4-8. doi: 10.3969/j.issn.1001-2230.2014.02.001
[27] SUÁREZ-JIMÉNEZ G M, BURGOS-HERNÁNDEZ A, TORRES-ARREOLA W, et al. Bioactive peptides from collagen hydrolysates from squid (Dosidicus gigas) by-products fractionated by ultrafiltration[J]. International Journal of Food Science and Technology,2019,54:1054−1061. doi: 10.1111/ijfs.13984
[28] SHIMIZU K, SATO M, ZHANG Y, et al. Molecular size of collagen peptide reverses the permeability of Caco-2 cells[J]. Bioscience, Biotechnology, and Biochemistry,2010,74:1123−1125. doi: 10.1271/bbb.100015
[29] YU M, HE S D, TANG M M, et al. Antioxidant activity and sensory characteristics of Maillard reaction products derived from different peptide fractions of soybean meal hydrolysate[J]. Food Chemistry,2018,243:249−257. doi: 10.1016/j.foodchem.2017.09.139
[30] 王静, 陈晨, 李楠楠, 等. 米发糕胃肠水解物抗氧化性及肽段差异性分析[J]. 中国粮油学报,2020,35(7):8−14. [WANG J, CHEN C, LI N N, et al. Difference analysis of antioxidant activity and hydrolyzed peptides of gastrointestinal hydrolysates of fermented rice cake[J]. Journal of the Chinese Cereals and Oils Association,2020,35(7):8−14. WANG J, CHEN C, LI N N, et al. Difference analysis of antioxidant activity and hydrolyzed peptides of gastrointestinal hydrolysates of fermented rice cake[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(7): 8-14.
[31] CROW J P, BECKMAN J S, MCCORD J M. Sensitivity of the essential zinc-thiolate moiety of yeast alcohol dehydrogenase to hypochlorite and peroxynitrite[J]. Biochemistry,1995,34(11):3544−3552. doi: 10.1021/bi00011a008
[32] MEN L, WANG Y. The oxidation of yeast alcohol dehydrogenase-1 by hydrogen peroxide in vitro[J]. Journal of Proteome Research,2007,6(1):216−225. doi: 10.1021/pr0603809
-
期刊类型引用(2)
1. 冯明,黄恒,邓福昌,陆俊致,李叶红,梁琼,黄华莉,胡俊杰,蒋慧敏,王金兴,肖鹏,杨小淦,梁兴伟,曾俊. 茉莉花渣对广西黑山羊生长性能及血清生化、抗氧化和免疫指标的影响. 黑龙江畜牧兽医. 2023(10): 109-114 .  百度学术
百度学术
2. 王金兴,黄恒,陆俊致,李叶红,梁琼,黄世洋,黄华莉,曾俊. 茉莉花渣的活性物质、生物学功能及其在畜禽生产中的应用. 饲料研究. 2023(20): 178-181 .  百度学术
百度学术
其他类型引用(4)










 下载:
下载:



 下载:
下载:



