Screening of Bacillus subtilis and Optimization of Liquid Fermentation Conditions for Nattokinase Production
-
摘要: 为了提高现有纳豆激酶产量,促进其工业化生产与应用,本文从不同产地的鲜纳豆中分离出枯草芽孢杆菌,先后通过菌落形态初筛与酪蛋白平板复筛,选出水解圈与菌落比值较大的菌株,测定其发酵液中纳豆激酶酶活,选定一株酶活相对较高的菌株X3。通过系统16S rDNA测序鉴定和系统发育树对比,确定X3菌株为枯草芽孢杆菌。在单因素试验的基础上,设计响应面试验,优化纳豆激酶摇瓶液态发酵条件,确定了X3菌株液态发酵的最佳条件为:温度34 ℃,初始pH6.5,接种量2%,装瓶量20%,发酵时间30 h。在该条件下,发酵生产的纳豆激酶酶活为393.095 U/mL,且与购买的纳豆激酶相比具有更高的酶活。本试验为后续工业化生产奠定了一定基础。Abstract: In order to improve the yield of nattokinase and promote its industrial production and application, Bacillus subtilis was isolated from fresh natto from different producing areas, and the strain with larger ratio of hydrolysis circle to colony was selected through preliminary screening of colony morphology and re-screening of casein plate, and the nattokinase activity in its fermentation broth was measured, and a strain X3 with relatively high enzyme activity was selected. X3 strain was identified as Bacillus subtilis by systematic 16S rDNA sequencing and phylogenetic tree comparison. On the basis of single factor experiment, response surface methodology was designed to optimize the liquid fermentation conditions of nattokinase in shake flask, and the optimum conditions for liquid fermentation of X3 strain were determined as follows: temperature 34 ℃, initial pH6.5, inoculation amount 2%, bottling amount 20%, fermentation time 30 h. Under these conditions, the enzyme activity of nattokinase produced by fermentation was 393.095 U/mL, which was higher than that of nattokinase purchased. This experiment laid a certain foundation for the subsequent industrial production.
-
血栓栓塞与心肌梗死、脑卒中和静脉血栓栓塞症这三大类心血管疾病密切相关,在现代人的不合理膳食和老龄化两种形势下,心脑血管疾病可以发生在任何年龄、时间,会给人们带来严重的健康威胁[1]。纳豆激酶是1980年日本须见洋行教授在研究血栓溶解时发现的一种能高效溶解人体血栓的碱性丝氨酸蛋白酶[2-4],这种酶主要由芽孢杆菌(Bacillus)和假单胞菌(Pseudomonas sp.
)在发酵时产生,目前大多数产纳豆激酶的菌株都是从发酵食品中分离出来的[5-6]。有研究发现纳豆激酶可通过四种途径来达到溶栓作用[7-10],与当前治疗血栓的药物如尿激酶、链激酶等相比,这种酶溶栓效果更加明显,且没有毒副作用[11]。另外纳豆激酶还有抗高血压、降血脂、抗血小板、改善血液循环的作用[12-15],在维持甲状腺健康方面也起着重要作用[16],并被证明可以作为一种哮喘替代治疗方案[17]。但目前纳豆激酶的产量较低,限制了其的大范围应用[18],在现有研究中,有学者通过菌种筛选与诱变[19]、培养基优化[20]、发酵工艺优化[21]等来提高纳豆激酶产量,都达到了一定效果。 纳豆激酶主要通过固态发酵和液态发酵两种方式来制备的。耿晓然等[22]采用纳豆芽孢杆菌和酿酒酵母混合发酵纳豆,纳豆激酶活力可高达1473.37 U/g。吴昱含等[23]采用液态发酵豆粕产纳豆激酶,酶活可高达4429.6 U/mL。传统上纳豆激酶是以黄豆为主要发酵基质的固态发酵方式获得的,但在进行大规模的固态发酵过程中会存在染菌等问题,不同批次间的产量差异也较大[24],商业上制备出的纳豆激酶活性目前只能达到20~100 FU/g[25]。相比下液态发酵有生产工艺简单、成本低和易于放大等优势[26]。因此筛选出一株产酶活较高的菌株,并优化其液态发酵工艺以得到该菌株最佳的产酶条件,为工业化生产奠定基础是很有必要的。
本研究主要以市面上不同产地的鲜纳豆为原料,从中筛出产酶活较高的菌株并进行16S rDNA鉴定,进行摇瓶液态发酵。采用单因素试验与响应面分析法获得了生产纳豆激酶最佳的摇瓶液态发酵工艺,为以后扩大发酵生产提供了理论依据。
1. 材料与方法
1.1 材料与仪器
滨莉纳豆 北海道水产食品株式会社;山水纳豆 本场株式会社;燕京纳豆 北京燕京中发生物技术有限公司;生鲜纳豆 豆童食品(山东)有限公司;御城纳豆 大连美屋食品有限公司;纳豆激酶(1000 FU/mL)、纤维蛋白原、凝血酶 生化试剂,源叶生物科技有限公司;琼脂糖 生化试剂,上海如吉生物科技发展有限公司;蛋白胨、琼脂粉、福林酚试剂 生化试剂,国药集团化学试剂有限公司;酵母浸粉、牛肉膏 生化试剂,北京双旋微生物培养基制品厂;碳酸钠、三氯乙酸 分析纯,上海展云化工有限公司;酪氨酸 分析标准品,上海源叶生物科技有限公司;酪蛋白 生化试剂,上海阿拉丁生化科技股份有限公司。
Frontier5000多功能台式离心机 奥豪斯国际贸易(上海)有限公司;Evolution220紫外一可见光分光光度计 赛默飞世尔科技(中国)有限公司;BXM-30立式压力蒸汽灭菌器 上海博迅医疗生物仪器股份有限公司;HZ150L恒温培养摇床 武汉瑞华仪器设备有限责任公司。
1.2 实验方法
1.2.1 菌株筛选
称取样品10 g,倒入90 mL灭菌生理盐水,在37 ℃,200 r/min的摇床中浸泡振荡30 min,使样品中所带的菌均匀分布于溶液中,随后在80 ℃水浴中加热10 min,以除去其中部分杂菌,之后在冰水浴中冷却至室温。用灭菌移液枪取上述溶液1 mL,进行稀释,取10−7~10−9稀释梯度菌液100 μL,涂布到LB培养基上,于37 ℃培养箱培养24 h。根据枯草芽孢杆菌菌落挑选标准[27],从平板中挑取符合标准的菌株在LB培养基平板上划线纯化3代,用灭菌牙签蘸取少许,点植于酪蛋白培养基上,继续培养24 h,测量三次不同方向透明圈(C)及菌落直径(H),将C/H比值较大的菌落在酪蛋白培养基上连续划线纯化后进行斜面保存。
1.2.2 酶活测定
挑取一环斜面保存的菌种,接种于LB液体培养基中,在37 ℃、200 r/min的条件下活化10 h,此时的菌液即种子液。按2%接种量取种子液接种至LB液体培养基中,在37 ℃、200 r/min的条件下培养24 h,将菌液于4 ℃条件下,6000 r/min冷冻离心20 min,将上清液置于4 ℃冰箱中暂时保存,此时上清液即粗酶液。酶活的测定采用郑丹妮等[28]的方法。
1.2.3 菌株的鉴定
将菌液送至武汉擎科创新生物科技有限公司提取基因组DNA,通过16S rRNA序列对菌株进行鉴定,采用通用引物27F(AGTTTGATCMTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT)进行扩增。扩增程序:98 ℃预变性2 min,98 ℃变性10 s,退火温度为57 ℃,复性30 s,72 ℃延伸5 min,进行35个循环。PCR产物的测序结果经BLAST(NCBI)对比分析。
1.2.4 生长曲线的测定
按2%的接种量将种子液接种于液体LB培养基中,在37 ℃,200 r/min的条件下发酵,每2 h取1次样,测定OD660 nm处的吸光度,直至30 h。以发酵时间为横坐标,OD660 nm值为纵坐标绘制生长曲线。
1.2.5 纳豆激酶液态发酵条件优化
1.2.5.1 单因素实验
1.2.5.2 发酵温度选择
固定接种量为2%、初始pH7.0、装瓶量为20%,于22、27、32、37、42 ℃温度下,以200 r/min的转速培养24 h,制备粗酶液,测定纳豆激酶活力。每组实验重复三次,实验结果取均值。
1.2.5.3 初始pH选择
固定温度32 ℃、接种量2%、装瓶量为20%,LB液体培养基初始pH为6.0、6.5、7.0、7.5、8.0,以200 r/min的转速培养24 h,制备粗酶液,测定纳豆激酶活力。每组实验重复三次,实验结果取均值。
1.2.5.4 接种量选择
固定在温度32 ℃、初始pH6.5、装瓶量为20%,接种量为1%、2%、3%、4%、5%,以200 r/min的转速培养24 h,制备粗酶液,测定纳豆激酶活力。每组实验重复三次,实验结果取均值。
1.2.5.5 装瓶量选择
固定温度32 ℃、初始pH6.5、接种量为2%,装瓶量为10%、20%、30%、40%、50%,以200 r/min的转速培养24 h,制备粗酶液,测定纳豆激酶活力。每组实验重复三次,实验结果取均值。
1.2.5.6 发酵时间选择
固定温度32 ℃、初始pH6.5、接种量为2%、装瓶量为20%,以200 r/min的转速培养12、18、24、30、36 h,制备粗酶液,测定纳豆激酶活力。每组实验重复三次,实验结果取均值。
1.2.6 响应面法优化纳豆激酶摇瓶液态发酵条件
在单因素实验的基础上,通过Box-Behnken实验设计法,选定温度、初始pH、接种量、装瓶量、发酵时间5个因素作为目标变量,纳豆激酶酶活为响应值,设计五因素三水平的响应面试验,试验因素及水平如表1所示。
表 1 响应面试验因素水平设计Table 1. Factors and levels in response surface design水平 因素 A温度(℃) B初始pH C接种量(%) D装瓶量(%) E发酵时间(h) −1 27 6 1 10 18 0 32 6.5 2 20 24 1 37 7 3 30 30 1.2.7 纤维蛋白平板验证
将经过优化得到的最佳发酵条件下产生的发酵液按1.2.1中的方法制备粗酶液,参考纤维蛋白平板法[29],比较由最佳发酵条件下产生的上清液与购买的纳豆激酶酶活大小。
1.3 数据处理
采用Origin 8.5与Design Expert 8.0.6进行数据分析。
2. 结果与分析
2.1 枯草芽孢杆菌筛选结果
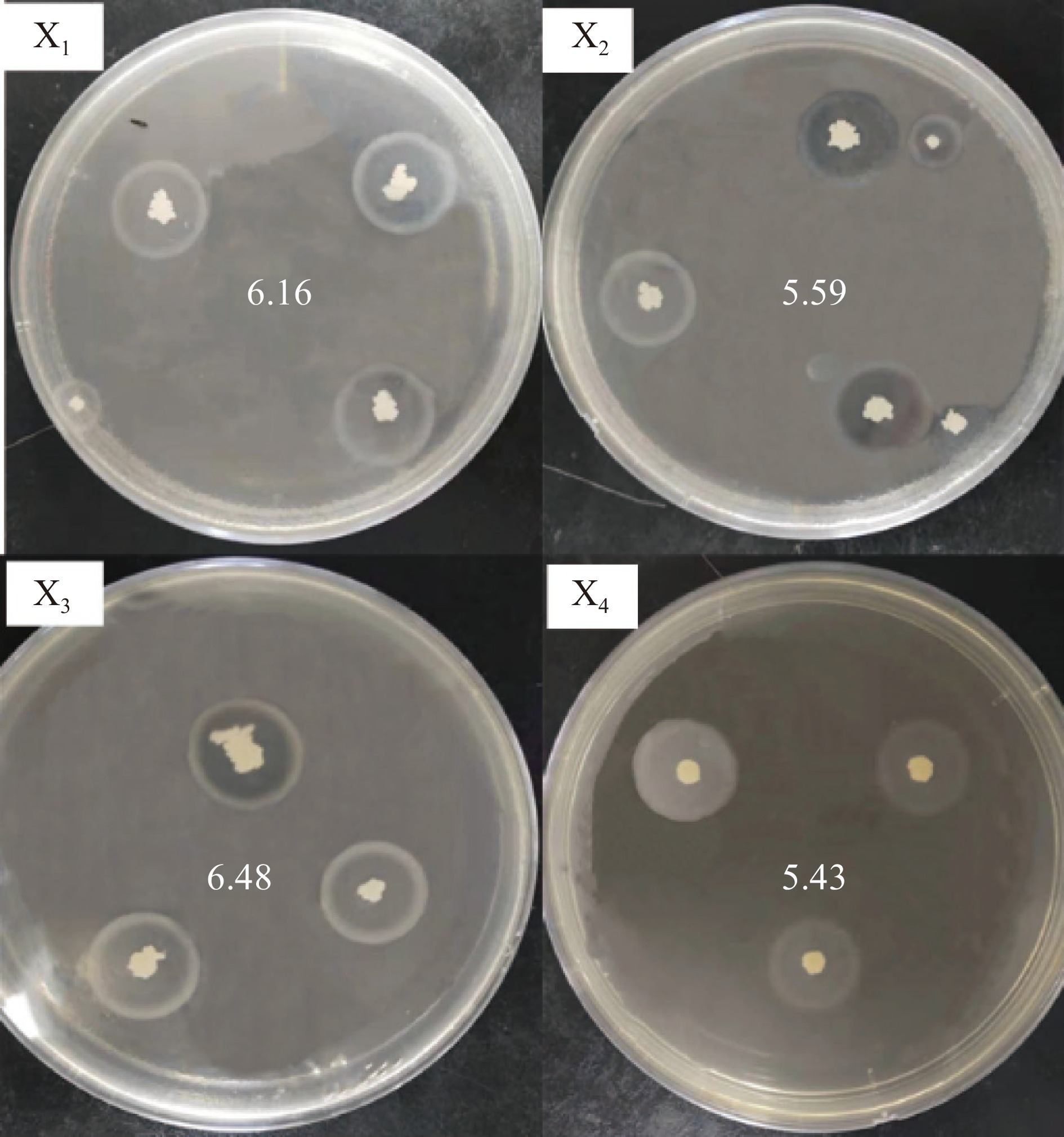
根据菌落形态初筛选出符合的菌株,将其点植在酪蛋白培养基上,通过对比C/H值大小,最终选出四株菌株,如表2,其水解圈如图1。
表 2 菌株来源以及水解圈与菌落的比值Table 2. Strain source and ratio of hydrolysis circle to colony菌株 X1(燕京纳豆) X2(山水纳豆) X3(滨莉纳豆) X4(御城纳豆) C(mm) 15.4 14.32 13.72 16.28 H(mm) 2.5 2.56 2.12 3 C/H比值 6.16 5.59 6.48 5.43 2.2 酶活测定
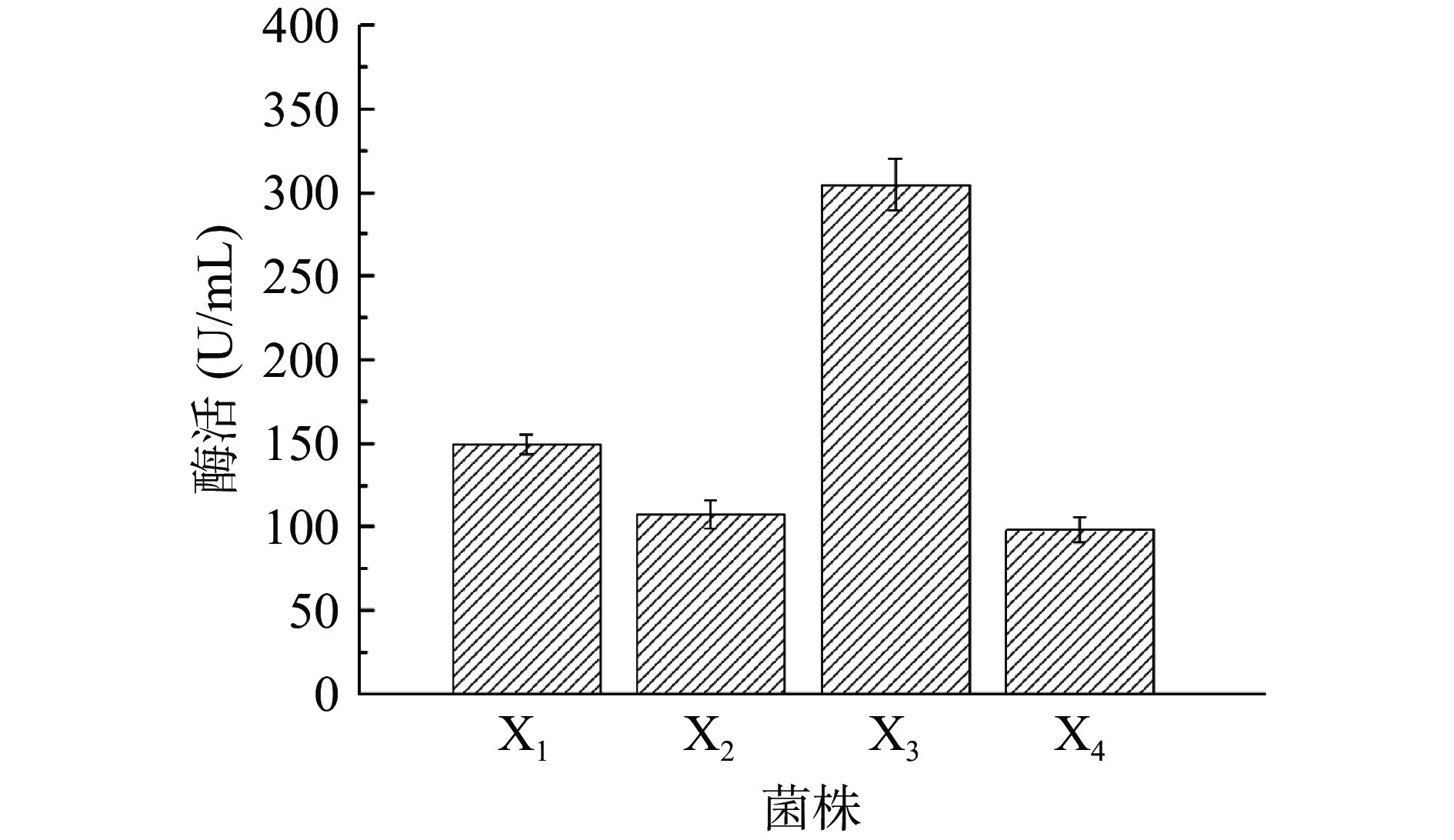
将上述四株菌株经过液态发酵后,测定发酵液中纳豆激酶的酶活,其中X3菌株的酶活可达304.98 U/mL,远高于其他菌株,最终选定X3菌株为目标菌株进行下一步实验(图2)。
2.3 16S rDNA鉴定
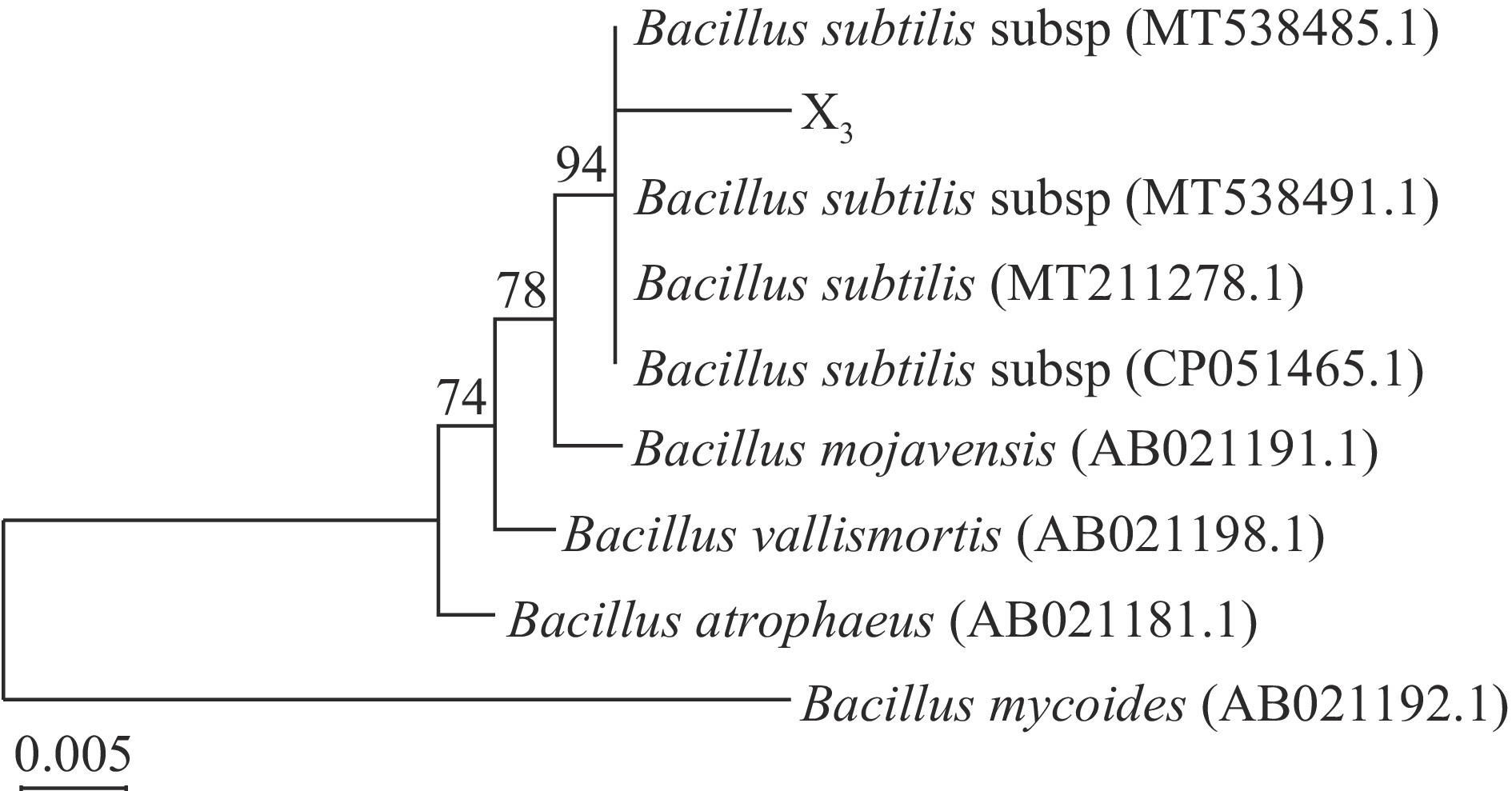
根据16S rDNA序列测定结果,经BLAST对比,结果显示X3菌株的16S rDNA序列与芽孢杆菌属(Bacillus)不同种高度相似,同源性可高达94%。利用MEGA软件构建系统发育树,由图3可知,X3菌株与枯草芽孢杆菌的相似性非常高,可表明此菌株为枯草芽孢杆菌。
2.4 X3菌株生长曲线
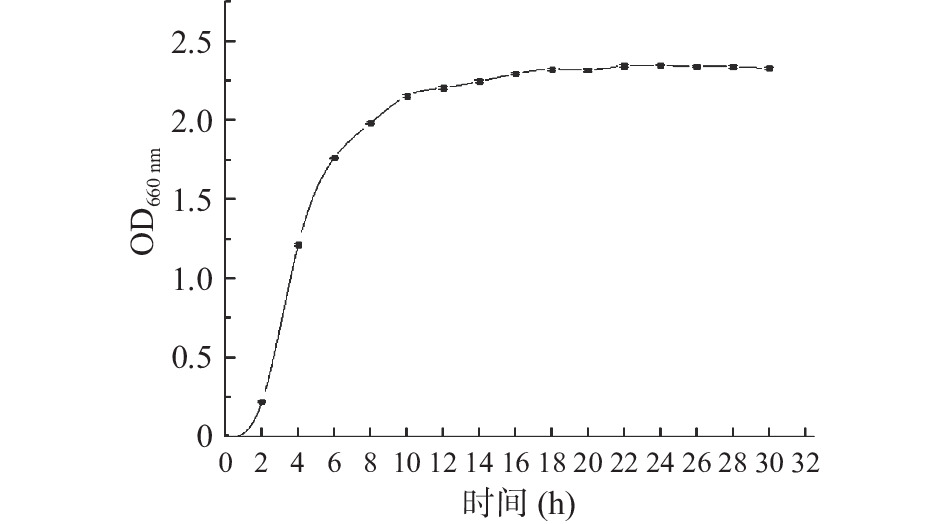
如图4所示,X3菌株在12 h后就处于生长稳定期。一般选用对数期的枯草芽孢杆菌菌液作为种子液进行发酵培养,此时菌株生命力极旺盛,前期发酵生长所需时间短,生产能力也较强。因此选取培养10 h作为X3菌株液态发酵生产纳豆激酶最佳接种时间。
2.5 单因素实验
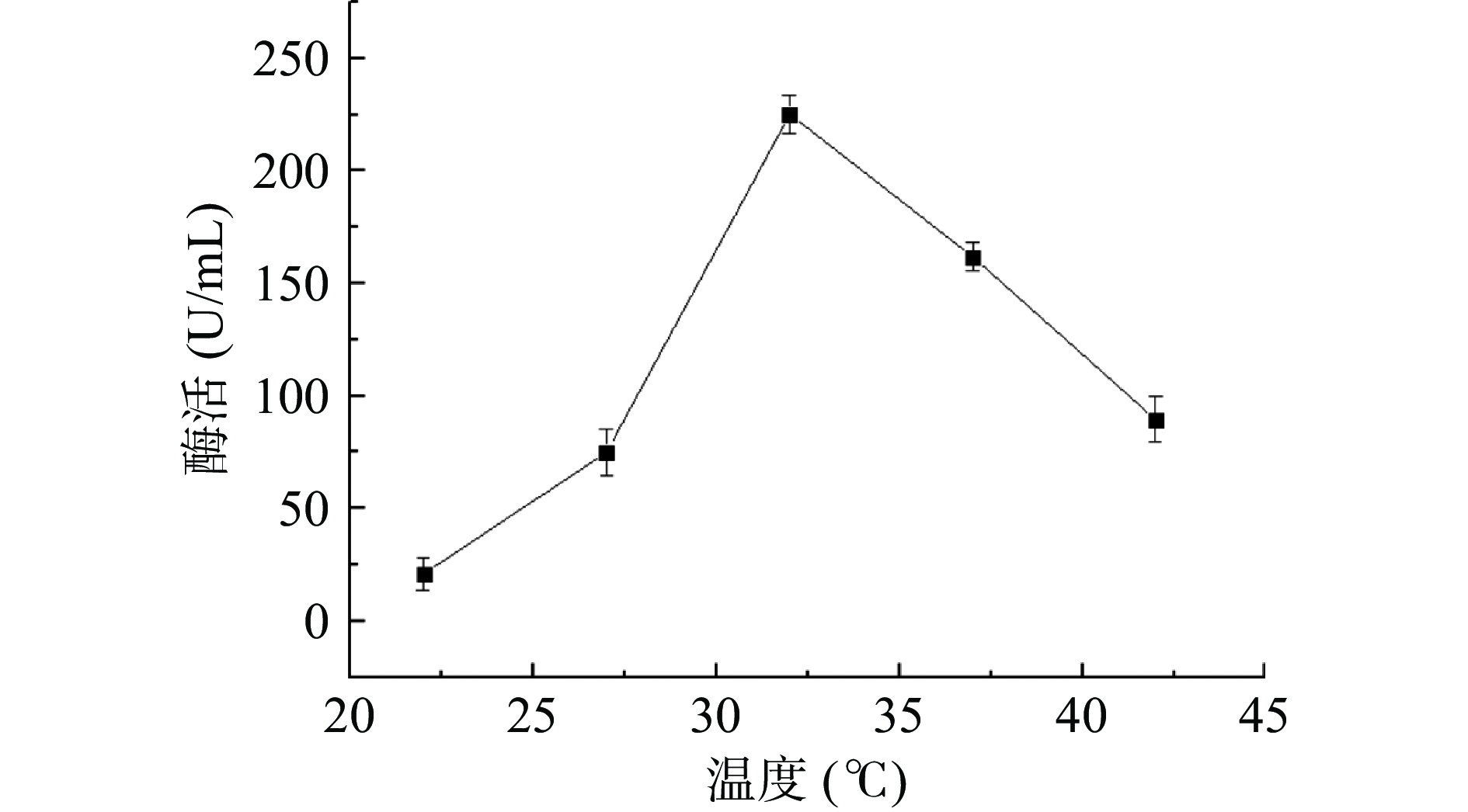
2.5.1 发酵温度
由图5可知,当其他发酵条件不变,发酵温度在27~42 ℃时,该菌株产生的纳豆激酶酶活相对较高。随着发酵温度的不断升高,纳豆激酶酶活先增加后下降,温度为32 ℃时,纳豆激酶酶活达到最高,可能是因为温度过高或者过低,不适于菌株生长繁殖,最终形成芽孢,停止产酶。因此选择32 ℃为纳豆激酶液态发酵温度。
2.5.2 初始pH
由图6可知,当其他发酵条件不变,初始pH在6~7时,该菌株产生的纳豆激酶酶活相对较高。随着pH的不断升高,纳豆激酶酶活先增加后下降,pH为6.5时,纳豆激酶酶活达到最高,可能是因为pH过高或者过低,不利于菌株生长繁殖,最终形成芽孢,停止产酶。因此选择纳豆激酶液态发酵初始pH为6.5。
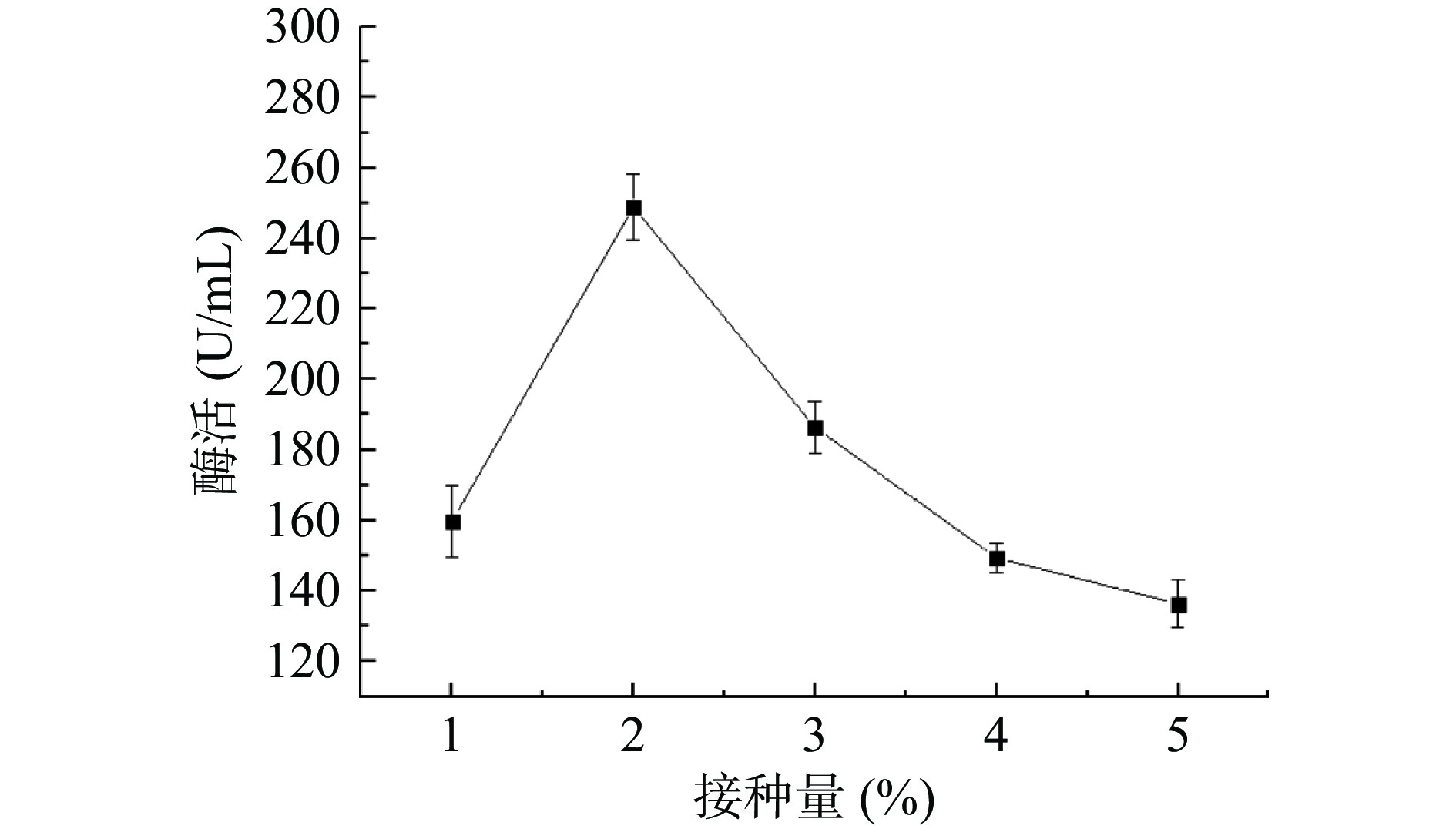
2.5.3 接种量
由图7可知,当其他发酵条件不变时,接种量在1%~3%时,该菌株产生的纳豆激酶酶活相对较高。随着接种量的不断增加,纳豆激酶酶活先增加后下降,当接种量增加至2%时,纳豆激酶酶活达到最高,这是可能因为菌体数量过少时,产酶能力不足;菌体数量过多时,发酵液中的营养物质及氧气缺乏,不利于菌体生长,最终形成芽孢,停止产酶。因此选择纳豆激酶液态发酵接种量为2%。
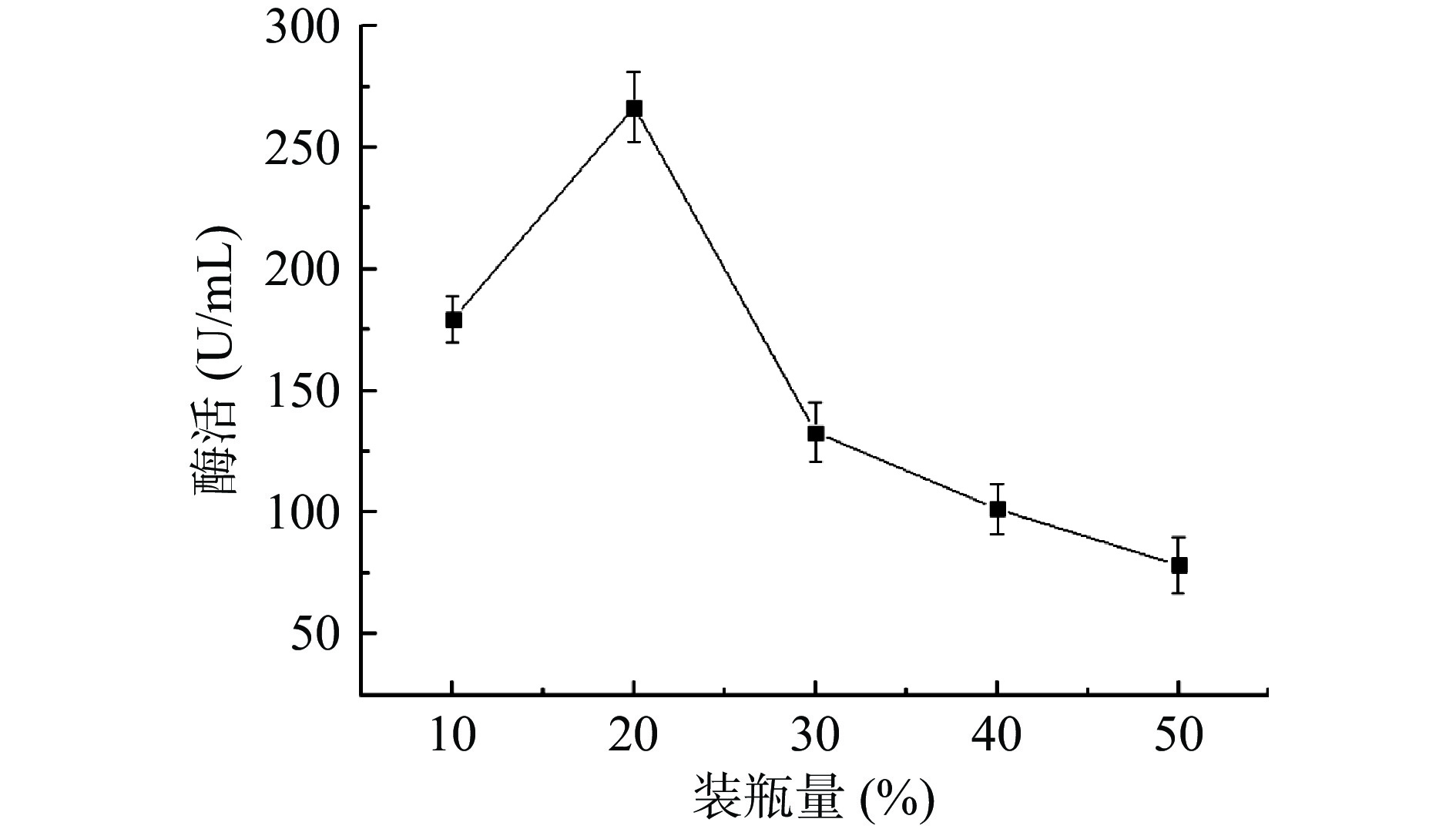
2.5.4 装瓶量
由图8可知,当其他发酵条件不变时,装瓶量在10%~30%时,该菌株产生的纳豆激酶酶活相对较高。随着装瓶量的不断增加,纳豆激酶酶活先增加后下降,当装瓶量增加至20%时,纳豆激酶酶活达到最高,这可能是因为装瓶量过少时,营养物质缺乏,不足以支撑菌株的生长繁殖,最终形成芽孢,停止产酶;当装瓶量过多时,会导致发酵液被稀释,导致测得的酶活较低。因此选择为纳豆激酶液态发酵装瓶量为20%。
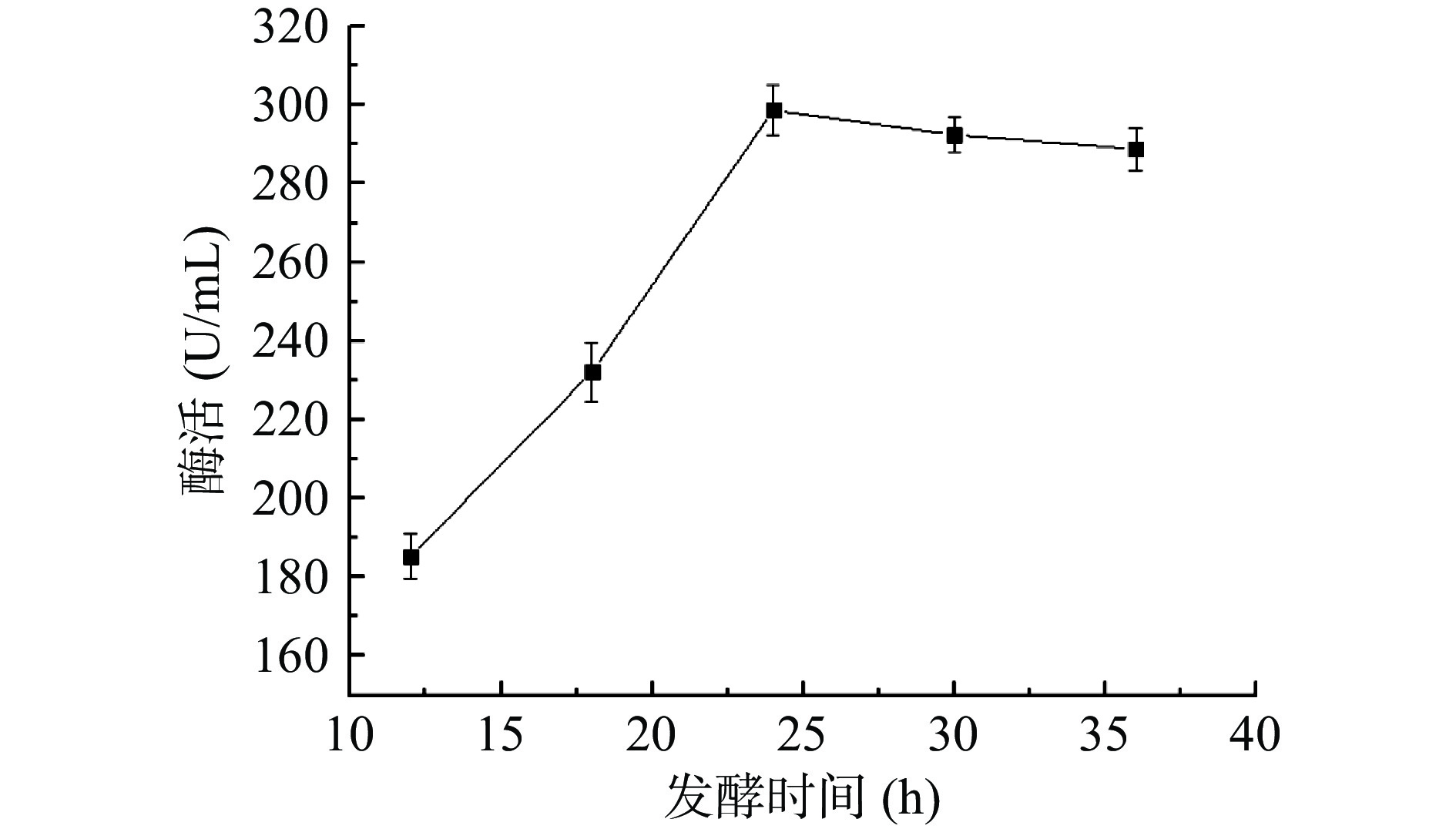
2.5.5 发酵时间
由图9可知,当其他发酵条件不变时,随着发酵时间的不断增加,纳豆激酶酶活持续上升,于24 h时趋于平稳,这可能是因为发酵一定时间后,氧气及营养物质缺乏,不足以支撑菌体生长繁殖,最终形成芽孢,停止产酶。因此选择纳豆激酶液态发酵时间为24 h。
2.6 响应面分析法优化纳豆激酶液态发酵条件
2.6.1 分析因素选择及分析方法
根据单因素实验结果,采用五因素三水平响应面法来确定纳豆激酶液态发酵条件工艺,实验设计及结果见表3。
表 3 响应面试验方案及结果Table 3. Scheme and experimental results of response surface design试验序号 A B C D E 酶活(U/mL) 1 0 0 −1 0 1 310.4 2 −1 −1 0 0 0 233.1 3 1 0 −1 0 0 236.8 4 0 0 −1 0 −1 260.3 5 −1 0 0 0 1 272.1 6 0 0 0 0 0 312.5 7 0 −1 1 0 0 225.1 8 1 0 1 0 0 160.5 9 −1 0 1 0 0 246.8 10 0 1 0 −1 0 206.1 11 −1 1 0 0 0 189.2 12 0 0 0 0 0 311.0 13 0 0 0 1 −1 281.7 14 −1 0 −1 0 0 159.0 15 0 0 0 −1 1 326.7 16 0 −1 0 −1 0 174.2 17 0 0 1 1 0 222.3 18 0 1 0 0 1 327.4 19 0 1 1 0 0 242.4 20 0 0 1 −1 0 195.0 21 1 0 0 1 0 277.1 22 0 0 0 0 0 339.8 23 0 0 0 0 0 329.1 24 0 −1 0 1 0 214.5 25 0 −1 −1 0 0 215.9 26 0 0 −1 1 0 243.3 27 0 0 1 0 −1 283.6 28 1 1 0 0 0 290.3 29 0 −1 0 0 1 293.6 30 1 −1 0 0 0 250.1 31 0 1 0 0 −1 291.0 32 0 0 1 0 1 331.8 33 0 0 0 1 1 305.0 34 −1 0 0 1 0 170.2 35 −1 0 0 −1 0 187.2 36 −1 0 0 0 −1 253.9 37 0 1 −1 0 0 227.4 38 0 0 0 −1 −1 278.6 39 1 0 0 0 1 314.7 40 1 0 0 0 −1 230.5 41 0 0 0 0 0 359.8 42 0 −1 0 0 −1 256.2 43 0 1 0 1 0 210.1 44 1 0 0 −1 0 236.5 45 0 0 −1 −1 0 193.1 46 0 0 0 0 0 328.5 2.6.2 模型建立及显著性分析
利用Design-Expert 8.0.6软件对表3中的数据进行多元回归拟合分析,得到以纳豆激酶活力为响应值(Y)的回归模型方程为:Y=−9472.71387+101.88372A+2335.42074B+488.54922C+30.83368D−31.28521E+8.40324AB−8.20550AC+0.28786AD+0.54881AE+2.89644BC−1.81553BD−0.081176BE−0.57201CD−0.078209CE−0.10302DE−2.42908A2−196.67179B2−56.91148C2−0.59589D2+0.41811E2,对试验数据进行方差分析,结果见表4。
表 4 响应面方差分析Table 4. Analysis of variance of response surface methodology变异来源 平方和 自由度 方差 F Prob >F 显著性 模型 1.13E+05 20 5664.1 9.38 < 0.0001 ** A 5073.45 1 5073.45 8.4 0.0077 ** B 915.06 1 915.06 1.52 0.2298 − C 235.56 1 235.56 0.39 0.5379 − D 1003.8 1 1003.8 1.66 0.2091 − E 7472.6 1 7472.6 12.38 0.0017 ** AB 1765.36 1 1765.36 2.92 0.0997 − AC 6733.03 1 6733.03 11.15 0.0026 ** AD 828.66 1 828.66 1.37 0.2524 − AE 1084.31 1 1084.31 1.8 0.1923 − BC 8.39 1 8.39 0.014 0.9071 − BD 329.62 1 329.62 0.55 0.4669 − BE 0.24 1 0.24 3.93E-04 0.9843 − CD 130.88 1 130.88 0.22 0.6455 − CE 0.88 1 0.88 1.46E-03 0.9698 − DE 152.83 1 152.83 0.25 0.6193 − A2 32184.17 1 32184.17 53.3 < 0.0001 ** B2 21098.07 1 21098.07 34.94 < 0.0001 ** C2 28266.9 1 28266.9 46.82 < 0.0001 ** D2 30989.71 1 30989.71 51.33 < 0.0001 ** E2 1977.31 1 1977.31 3.27 0.0824 − 残差 15094.61 25 603.78 失拟 13440.83 20 672.04 2.03 0.2218 − 净误差 1653.78 5 330.76 总离差 1.28E+05 45 注:*表示显著(P<0.05),**表示极显著(P<0.01),“−”表示不显著。 由方差分析表所示,响应面回归模型极显著(P<0.01),模型失拟项不显著(P=0.2218>0.05),且模型的决定系数R2为88.24%,表明模型选择适当,且可信度较高,模型与实验拟合良好,试验误差小,因此可以用此模型进行分析与预测。
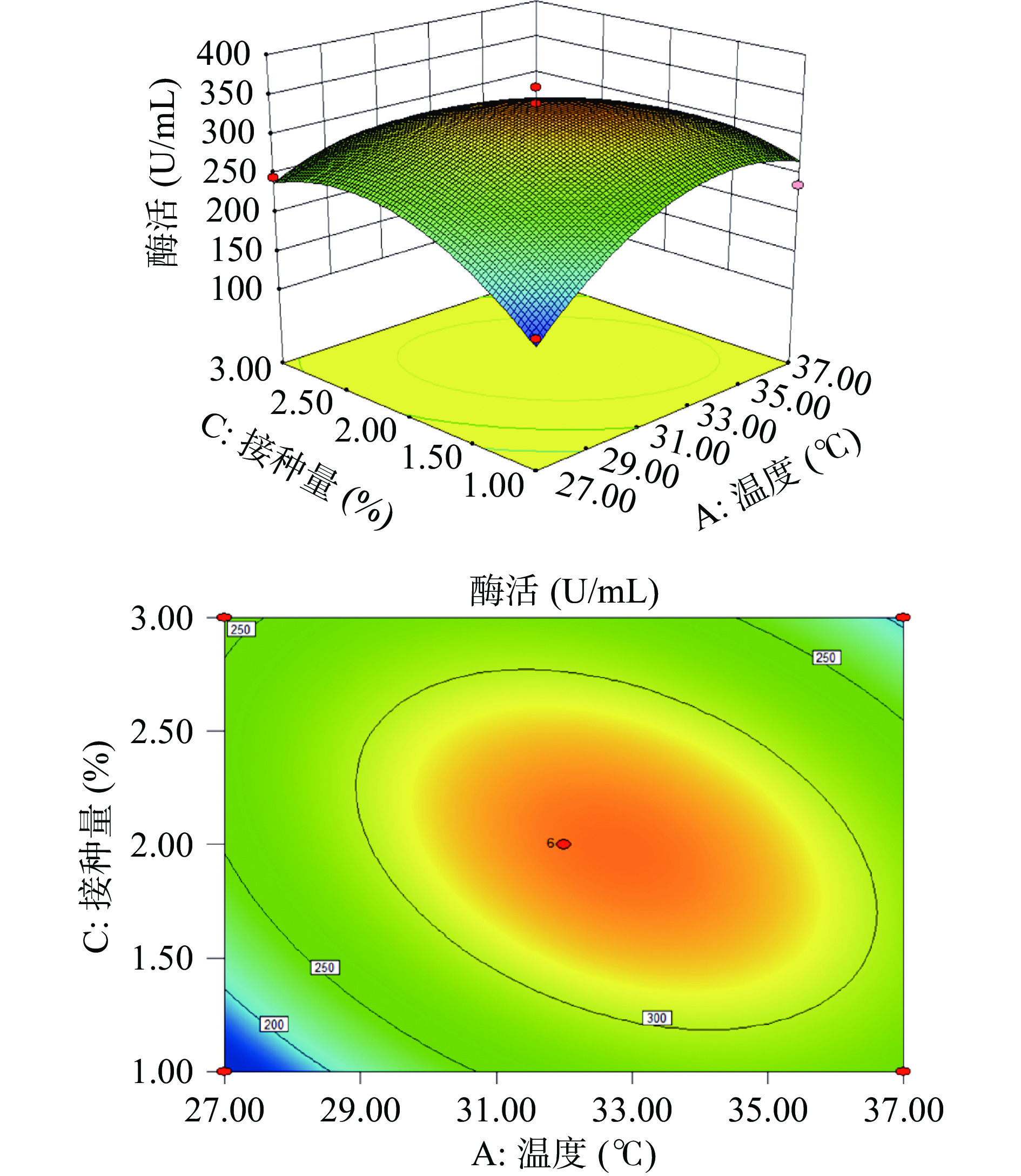
根据表4中的F值大小,可以看出五个因素对纳豆激酶酶活影响的主次顺序为:发酵时间>温度>装瓶量>初始pH>接种量,根据P值,可以看出温度A、发酵时间E、温度与接种量的交互作用AC以及A2、B2、C2、D2对纳豆激酶酶活的影响是极显著的(P<0.01)。因素B、C、D的P值均大于0.05,表明初始pH、接种量以及装瓶量对纳豆激酶酶活无显著影响。
2.6.3 响应面优化及验证试验
利用Design Expert 8.0.6软件,作出各因素间的交互作用对纳豆激酶酶活影响的响应面曲面图及等高线图,如图10。可以看出,温度与接种量间的交互作用对纳豆激酶酶活的影响呈现抛物面型关系,出现极大值,另外两因素间的交互作用的等高线呈椭圆形,表明影响显著。根据模型拟合出最佳发酵条件:温度33.73 ℃,初始pH为6.57,接种量1.91%,装瓶量20.49%,发酵时间30.00 h,在该条件下预测值为373.101 U/mL。
2.6.4 回归模型的验证试验
考虑操作的方便性,将上述发酵条件调整为:温度34 ℃,初始pH6.5,接种量2%,装瓶量20%,发酵时间30 h,进行验证试验。在此条件下的纳豆激酶酶活为393.095 U/mL,与预测值373.101 U/mL相近。由此可见,可以利用响应面分析法对纳豆激酶液态发酵条件进行优化。
2.6.5 纤维蛋白平板验证
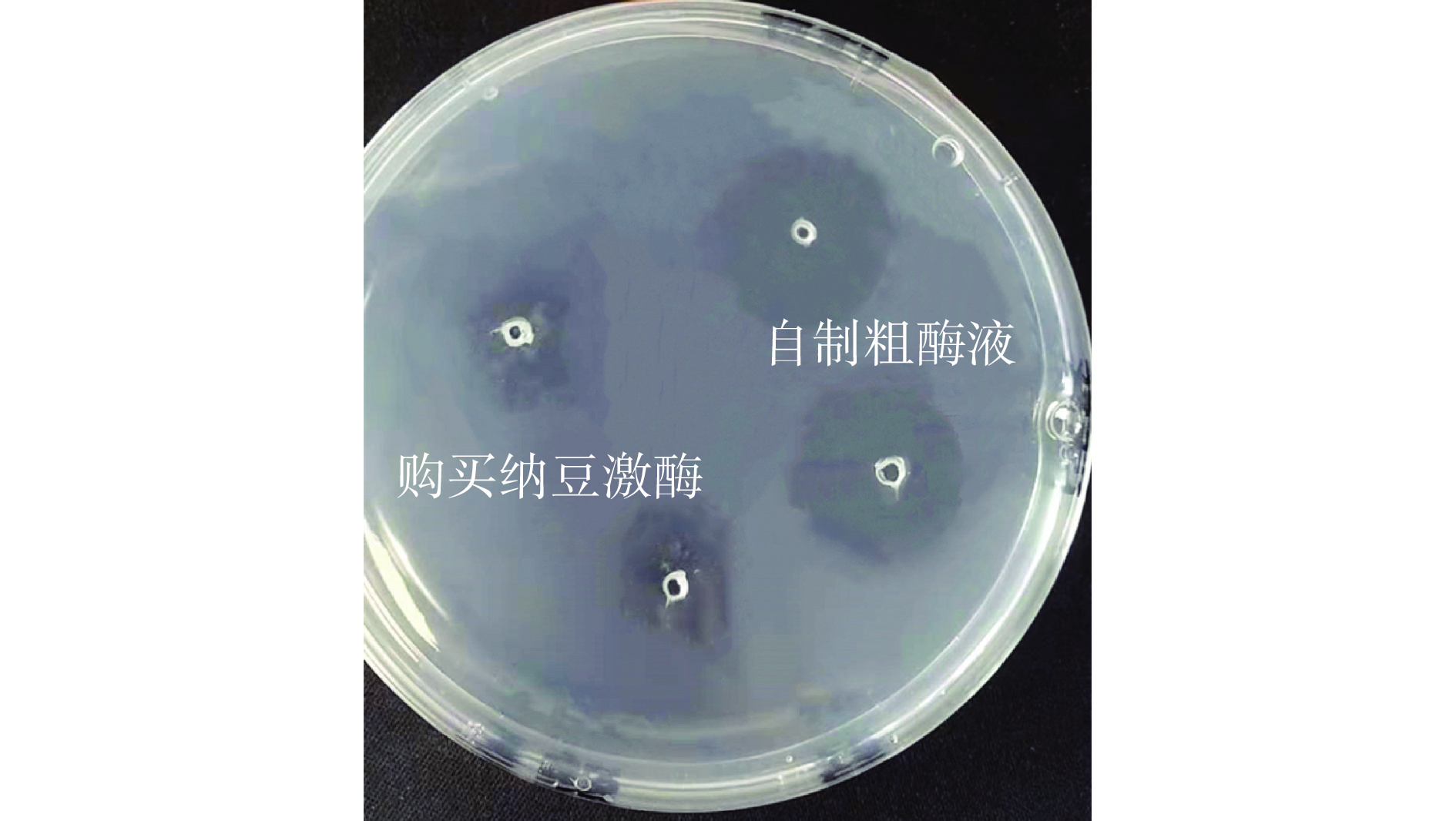
纤维蛋白平板法一般用来测定纤溶酶活性大小,由于该方法相对来说耗时长且价格较高,最终采用该方法来进行验证试验。将自制粗酶液与购买的纳豆激酶(1000 FU/mL)分别取10 μL滴入平板中,18 h后平板中的溶解圈大小如图11所示,溶解圈的面积越大,表明样品溶解血栓的能力越强,酶活也就越高,由此可以看出自制粗酶液中含有纤溶酶,根据上述试验,可以证明它是纳豆激酶,且该纳豆激酶酶活比购买的纳豆激酶更高,在一定程度上表明了该试验的可行性。
3. 结论
本研究以五种产地不同的发酵豆制品为原料,最终从一种日本滨莉纳豆中筛选出了一种产酶活较高的X3菌株,并对其进行液态发酵工艺优化,在单因素实验基础上,设计响应面试验,以纳豆激酶酶活为指标,得到的最佳发酵条件为:温度34 ℃,初始pH6.5,接种量2%,装瓶量20%,发酵时间30 h。在该条件下液态发酵所产生的酶活力为393.095 U/mL,与购买的纳豆激酶在纤维蛋白平板上溶解圈大小进行比较,具有更高的酶活。且与庞远祥等[30]筛选出的菌株发酵制备的纳豆激酶酶活204.52 U/mL相比,酶活力相对更高,本试验为后续相关实验及产业化生产奠定了一定基础。
-
表 1 响应面试验因素水平设计
Table 1 Factors and levels in response surface design
水平 因素 A温度(℃) B初始pH C接种量(%) D装瓶量(%) E发酵时间(h) −1 27 6 1 10 18 0 32 6.5 2 20 24 1 37 7 3 30 30 表 2 菌株来源以及水解圈与菌落的比值
Table 2 Strain source and ratio of hydrolysis circle to colony
菌株 X1(燕京纳豆) X2(山水纳豆) X3(滨莉纳豆) X4(御城纳豆) C(mm) 15.4 14.32 13.72 16.28 H(mm) 2.5 2.56 2.12 3 C/H比值 6.16 5.59 6.48 5.43 表 3 响应面试验方案及结果
Table 3 Scheme and experimental results of response surface design
试验序号 A B C D E 酶活(U/mL) 1 0 0 −1 0 1 310.4 2 −1 −1 0 0 0 233.1 3 1 0 −1 0 0 236.8 4 0 0 −1 0 −1 260.3 5 −1 0 0 0 1 272.1 6 0 0 0 0 0 312.5 7 0 −1 1 0 0 225.1 8 1 0 1 0 0 160.5 9 −1 0 1 0 0 246.8 10 0 1 0 −1 0 206.1 11 −1 1 0 0 0 189.2 12 0 0 0 0 0 311.0 13 0 0 0 1 −1 281.7 14 −1 0 −1 0 0 159.0 15 0 0 0 −1 1 326.7 16 0 −1 0 −1 0 174.2 17 0 0 1 1 0 222.3 18 0 1 0 0 1 327.4 19 0 1 1 0 0 242.4 20 0 0 1 −1 0 195.0 21 1 0 0 1 0 277.1 22 0 0 0 0 0 339.8 23 0 0 0 0 0 329.1 24 0 −1 0 1 0 214.5 25 0 −1 −1 0 0 215.9 26 0 0 −1 1 0 243.3 27 0 0 1 0 −1 283.6 28 1 1 0 0 0 290.3 29 0 −1 0 0 1 293.6 30 1 −1 0 0 0 250.1 31 0 1 0 0 −1 291.0 32 0 0 1 0 1 331.8 33 0 0 0 1 1 305.0 34 −1 0 0 1 0 170.2 35 −1 0 0 −1 0 187.2 36 −1 0 0 0 −1 253.9 37 0 1 −1 0 0 227.4 38 0 0 0 −1 −1 278.6 39 1 0 0 0 1 314.7 40 1 0 0 0 −1 230.5 41 0 0 0 0 0 359.8 42 0 −1 0 0 −1 256.2 43 0 1 0 1 0 210.1 44 1 0 0 −1 0 236.5 45 0 0 −1 −1 0 193.1 46 0 0 0 0 0 328.5 表 4 响应面方差分析
Table 4 Analysis of variance of response surface methodology
变异来源 平方和 自由度 方差 F Prob >F 显著性 模型 1.13E+05 20 5664.1 9.38 < 0.0001 ** A 5073.45 1 5073.45 8.4 0.0077 ** B 915.06 1 915.06 1.52 0.2298 − C 235.56 1 235.56 0.39 0.5379 − D 1003.8 1 1003.8 1.66 0.2091 − E 7472.6 1 7472.6 12.38 0.0017 ** AB 1765.36 1 1765.36 2.92 0.0997 − AC 6733.03 1 6733.03 11.15 0.0026 ** AD 828.66 1 828.66 1.37 0.2524 − AE 1084.31 1 1084.31 1.8 0.1923 − BC 8.39 1 8.39 0.014 0.9071 − BD 329.62 1 329.62 0.55 0.4669 − BE 0.24 1 0.24 3.93E-04 0.9843 − CD 130.88 1 130.88 0.22 0.6455 − CE 0.88 1 0.88 1.46E-03 0.9698 − DE 152.83 1 152.83 0.25 0.6193 − A2 32184.17 1 32184.17 53.3 < 0.0001 ** B2 21098.07 1 21098.07 34.94 < 0.0001 ** C2 28266.9 1 28266.9 46.82 < 0.0001 ** D2 30989.71 1 30989.71 51.33 < 0.0001 ** E2 1977.31 1 1977.31 3.27 0.0824 − 残差 15094.61 25 603.78 失拟 13440.83 20 672.04 2.03 0.2218 − 净误差 1653.78 5 330.76 总离差 1.28E+05 45 注:*表示显著(P<0.05),**表示极显著(P<0.01),“−”表示不显著。 -
[1] ZHOU X Q, LIU L Z, ZENG X R. Research progress on the utilisation of embedding technology and suitable delivery systems for improving the bioavailability of nattokinase: A review[J/OL]. Food Structure, 2021. https://doi.org/10.1016/J.FOOSTR.2021.100219.
[2] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia,1987,43(10):1110. doi: 10.1007/BF01956052
[3] MILNER M, MAKISE K. Natto and its active ingredient nattokinase: A potent and safe thrombolytic agent[J]. Alternative & Complementary Therapies,2002,8(3):157−164.
[4] WENG Y Q, YAO J, SPARKS S, et al. Nattokinase: An oral antithrombotic agent for the prevention of cardiovascular disease[J]. International Journal of Molecular Sciences,2017,18(3):523. doi: 10.3390/ijms18030523
[5] CHANDRASEKARAN S D, VAITHILINGAM M, SHANKER R, et al. Exploring the in vitro thrombolytic activity of nattokinase from a new strain Pseudomonas aeruginosa CMSS[J]. Jundishapur Journal of Microbiology,2015,8(10):e23567.
[6] VAITHILINGAM M, CHANDRASEKARAN S D, GUPTA S, et al. Extraction of nattokinase enzyme from Bacillus cereus isolated from rust[J]. National Academy Science Letters,2016,39(4):263−267. doi: 10.1007/s40009-016-0476-7
[7] FUJITA M, ITO Y, HONG K. Characterization of nattokinase-degraded products from human fibrinogen or cross-linked fibrin[J]. Fibrinolysis,1995,9(3):157−164. doi: 10.1016/S0268-9499(95)80005-0
[8] YUKI Y, NAKAGAWA T, FUJITA M, et al. A sandwich enzyme-linked immunosorbent assay for nattokinase[J]. Bioscience, Biotechnology, and Biochemistry,1994,58(2):366−370. doi: 10.1271/bbb.58.366
[9] SUMI H, HAMADA H, NAKANISHI K, et al. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J]. ActaHaematologica,1990,84(3):139−143.
[10] URANO T, IHARA H, UMEMURA K, et al. The profibrinolytic enzyme subtilisin NAT purified from Bacillus subtilis cleaves and inactivates plasminogen activator inhibitor type 1[J]. Journal of Biological Chemistry,2001,276(27):24690−24696. doi: 10.1074/jbc.M101751200
[11] CAI D, WEI X, QIU Y, et al. High-level expression of nattoki-nase in Bacillus licheniformis by manipulating signal peptide and signal peptidase[J]. Journal of Applied Microbiology,2016,121(3):704. doi: 10.1111/jam.13175
[12] YOO H J, KIM M, KIM M, et al. The effects of natokinase supplementation on collagen-epinephrine closure time, pro-thrombin time and activated partial thromboplastin time in nondiabetic and hypercholesterolemic subjects[J]. Food Funct,2019,10(5):2888−2893. doi: 10.1039/C8FO02324G
[13] 杨敏, 梅余霞, 梁运祥. 纳豆激酶粗提液抗血栓作用的研究[J]. 食品科技,2013,38(9):197−200. [YANG M, MEI Y X, LIANG Y X. Study on antithrombotic effect of nattokinase crude extract[J]. Food Science and Technology,2013,38(9):197−200. [14] KUROSAWA Y, NIRENGI S, HOMMA T, et al. A single-dose of oral nattokinase potentiates thrombolysis and anti-coagulation profiles[J]. Scientific Reports,2015,5:11601. doi: 10.1038/srep11601
[15] JANG J Y, KIM T S, CAI J, et al. Nattokinase improves blood flow by inhibiting platelet aggregation and thrombus formation[J]. Laboratory Animal Research,2013,29(4):221−225. doi: 10.5625/lar.2013.29.4.221
[16] JAYACHANDRAN M, XU B. An insight into the health benefits of fermented soy products[J]. Food Chemistry,2019,271(JAN.15):362−371.
[17] TAKABAYASHI T, MOTO Y, SAKASHITA M, et al. Nattokinase, profibrinolytic enzyme, effectively shrinks the nasal polyp tissue and decreases viscosity of mucus[J]. Allergology International,2017,66(4):594−602. doi: 10.1016/j.alit.2017.03.007
[18] 姚明静,杨杨,范婧,等.纳豆激酶的微生物生产及其生理功能的研究进展[J/OL].食品工业科技:1−19[2021-10-28]. https://doi.org/10.13386/j.issn1002-0306.2021070016. YAO M J, YANG Y, FANG J, et al. Research progress on microbial production and physiological function of nattokinase[J/OL]. Science and Technology of Food Industry, 1−19[2021-10-28]. https://doi.org/10.13386/j.issn1002-0306.2021070016.
[19] 巩涛, 魏传军, 安明理, 等. 1株纳豆激酶高产菌株的分离·筛选与复合诱变研究[J]. 安徽农业科学,2021,49(15):159−161. [GONG T, WEI C J, AN M L, et al. Isolation, screening and compound mutagenesis of a nattokinase-producing strain[J]. Journal of Anhui Agricultural Sciences,2021,49(15):159−161. doi: 10.3969/j.issn.0517-6611.2021.15.042 [20] 满丽莉, 向殿军. 传统发酵豆制品中纳豆激酶产生菌的筛选及发酵培养基的优化[J]. 中国调味品,2019,44(6):44−49. [MAN L L, XIANG D J. Screening of nattokinase producing bacteria from traditional fermented bean products and optimization of fermentation medium[J]. China Condiment,2019,44(6):44−49. doi: 10.3969/j.issn.1000-9973.2019.06.010 [21] 于江淼, 王家林, 张海粟. 黑纳豆固态发酵工艺优化的研究[J]. 中国调味品,2020,45(3):101−106. [YU J M, WANG J L, ZHANG H L. Study on optimization of solid-state fermentation process of black natto[J]. China Condiment,2020,45(3):101−106. doi: 10.3969/j.issn.1000-9973.2020.03.022 [22] 耿晓然, 徐慧, 卢鑫, 等. 响应面法优化纳豆混合发酵工艺的研究[J]. 河北农业大学学报,2020,43(1):96−103. [GENG X H, XU H, LU X, et al. Optimization of mixed fermentation of natto with response surface methodology[J]. Journal of Hebei Agricultural University,2020,43(1):96−103. [23] 吴昱含, 郭大鹏, 李帅鹏, 等. 液态发酵豆粕制备纳豆激酶方法的优化[J]. 生物资源,2017,39(4):308−313. [WU Y H, GUO D P, LI S P, et al. Optimization of preparation method of nattokinase from fermented soybean meal[J]. Biotic Resources,2017,39(4):308−313. [24] 陈丽娟, 沙长青, 奚新伟, 等. 国外纳豆激酶的开发现状[J]. 生物技术,2003(3):44−45. [CHEN L J, SHA C Q, XI X W, et al. Development status of nattokinase abroad[J]. Biotechnology,2003(3):44−45. doi: 10.3969/j.issn.1004-311X.2003.03.030 [25] PAGNONCELLI M G B, FERNANDES M J, RODRIGUES C, et al. Nattokinases[M]. Current Developments in Biotechnology and Bioengineering, 2017: 509−526.
[26] 吴燕, 梁向峰, 刘会洲, 等. 纳豆激酶分批补料发酵的研究[J]. 食品与发酵工业,2018,44(1):126−132. [WU Y, LIANG X F, LIU H Z, et al. Study on fed-batch fermentation of nattokinase[J]. Food and Fermentation Industries,2018,44(1):126−132. [27] OZAWA K, YAGU-UCLI K, YAMANAKA K, et al. Antagonistic effects of Bscillus natto and Steptococcus faecalis on growth of Candida albicans[J]. Microbiol Immunos,1979,23(12):1147−1156. doi: 10.1111/j.1348-0421.1979.tb00547.x
[28] 郑丹妮, 王梦颖, 胡艺涵, 等. 双菌混合发酵纳豆工艺优化[J]. 食品与机械,2020,36(12):183−188. [ZHENG D N, WANG M Y, HU Y H, et al. Optimization of natto fermentation process with double bacteria[J]. Food & Machinery,2020,36(12):183−188. [29] 程云. 纳豆激酶的酶学特性及其微胶囊的制备研究[D]. 哈尔滨: 哈尔滨工业大学, 2015 CHENG Y. Studies on enzymatic properties of nattokinase and preparation of microcapsules[D]. Harbin: Harbin Institute of Technology, 2015.
[30] 庞远祥, 谢远红, 金君华, 等. 低嘌呤、高纳豆激酶活性枯草芽孢杆菌SH21筛选及发酵条件优化[J]. 食品与发酵工业,2021,47(11):194−199. [PANG Y X, XIE Y H, JIN J H, et al. Isolation and optimization of Bacillus subtilis SH21 for low purine and high nattokinase activity[J]. Food and Fermentation Industries,2021,47(11):194−199. -
期刊类型引用(3)
1. 郭新颖. 柱前衍生-高效液相色谱法测定鱼类中组胺. 化学分析计量. 2024(01): 12-16 .  百度学术
百度学术
2. 王建凤,冯月超,王颖,刘艳,周阳,刘佳. 鱼露中章鱼胺含量分析及衍生化产物结构推断. 分析仪器. 2024(04): 64-69 .  百度学术
百度学术
3. 卢竹阳,邵彪,王琳琳,许晶晶,张霞,李玲玉,沈蕾. 冷藏时间对大黄鱼、鲳鱼中生物胺含量变化的影响. 肉类研究. 2024(11): 41-46 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:

 下载:
下载:



