Research Progress on Biotransformation of Lactic Acid Bacteria on Active Ingredients from Homologous Plants of Medicine and Food
-
摘要: 随着人们对营养与健康意识的不断提高,植物基食品尤其是药食同源类植物近年来受到极大关注,其主要活性物质包括皂苷、黄酮、多糖及挥发油等,而作为传统及现代食品发酵工业中常用发酵剂菌种的乳酸菌,属于人体肠道内固有有益微生物,具有良好的生物转化及促进人体健康的作用。因此,利用具有高安全性的乳酸菌发酵转化药食同源植物以产生更多活性物质来提高功效已成为研究热点之一。本文从生物转化作用及转化机制的角度,重点阐述了乳酸菌对药食同源植物皂苷、黄酮及多糖类化合物的生物转化作用,旨在为乳酸菌生物转化药食同源植物活性成分的相关研究及其产品开发提供思路。Abstract: People’s awareness about nutrition and health is increasing in the world. Plant-based foods, especially medicine-food homologous plants, have been received great attention in recent years, and the main active substances included saponins, flavonoids, polysaccharides and volatile oils. As a starter culture in the traditional and modern fermentation industry, lactic acid bacteria are inherently beneficial microorganisms in the human intestinal tract, and exhibit good biotransformation effects and health benefits. Therefore, lactic acid bacteria with high-safety are selected to ferment and transform medicine-food homologous plant to produce more active substances and improve functional efficacy, which becomes one of the research hotspots. In this paper, the biotransformation effect of lactic acid bacteria on the saponins, flavonoids and polysaccharides in medicine-food homologous plants are mainly discussed and reviewed from the aspects of biotransformation effect and mechanism. This review would provide ideas for the research and product development of medicine-food homologous plants biotransformed by lactic acid bacteria.
-
Keywords:
- lactic acid bacteria /
- flavonoids /
- saponins /
- polysaccharides /
- biotransformation
-
乳酸菌(lactic acid bacteria,LAB)是一类能够利用可发酵糖产生大量乳酸的细菌的通称,在人类生活中具有悠久的安全食用史,属于一般公认为安全(generally recognized as safe,GRAS)的食品级微生物[1]。随着科技的发展,乳酸菌已不单单应用于食品中,在药物生产、医疗等领域也得到了广泛的应用[2]。例如,临床上已有用于治疗腹泻、便秘的乳酸菌制剂,如乳酸菌素片、金双歧等。此外,由于乳酸菌的发酵作用,其在生物转化药食同源原料有效成分方面也展现出了积极作用,乳酸菌对活性物质的转化作用主要体现在三个方面:a.乳酸菌通过自身代谢产生特定酶系,后者破坏植物细胞壁促使活性成分的释放;b.乳酸菌通过酶作用于前体物质生成活性成分;c.乳酸菌通过酶促作用对活性成分进行修饰,产生活性更高的衍生物。
药食同源原料,既可作为药品又可作为食品,兼具食品属性与药用价值于一身。其中,以药食同源植物性原料种类居多,如人参、枸杞、葛根、铁皮石斛、槐花、当归、山药、枳椇子、覆盆子、桑葚等,皂苷、黄酮、多糖、蛋白质或挥发油等为其主要活性物质,这些活性成分的含量高低直接决定着其功效大小,因此,探寻提高活性物质含量的有效途径已成为药食同源产品开发及加工的研究热点之一。随着药食同源酵素产品的不断出现,微生物的作用逐渐凸显,而乳酸菌因安全性高,使其在生物转化药食同源原料方面展现出了明显优势。例如,乳酸菌发酵怀山药后可提高其抗氧化能力[3],且活性成分尿囊素含量明显提高[4];发酵人参可明显提高其功效,如改善酒精性肝损伤[5]、调节肠道菌群及免疫作用[6]等,这些增效作用可能与稀有皂苷的生成有关[7-8];发酵葛根水提液可提高其抗氧化活性,增强解酒效果,并对小鼠酒精性肝损伤有保护作用[9];发酵刺五加叶可明显提高刺五加叶总皂苷含量[10];发酵桑葚后抑菌性能得以显著提升,且可产生20种新的香气成分[11]。
鉴于此,本文分别从乳酸菌对药食同源植物主要活性成分黄酮类化合物、皂苷类化合物以及多糖类化合物等的生物转化作用及机制进行综述,以期为乳酸菌发酵药食同源植物的研究提供参考。
1. 乳酸菌对黄酮类化合物的生物转化
黄酮类化合物是一种重要的功能成分,广泛存在于植物中,是迄今为止种类最为丰富的次生代谢物之一。研究表明,黄酮有抗氧化、降血糖、降胆固醇等功效[12]。但在生产中依然存在产率低下,生物利用率不高等问题,以往研究聚焦的关键是如何提高提取率,学者们将精力集中在摸索最优提取工艺上[13]。随着生命科学的发展,生物转化法成为了近年研究的热点,为研究者们提供了新思路。黄酮类化合物因化学结构中含有一个邻二酚基团,一个2-3碳双键以及3位和5位的羟基,这样的结构能有效分散电子,使其能更好地接受电子,从而达到抗氧化的目的[14]。植物中存在的黄酮大多都是连接有糖基的结合型黄酮,而这类黄酮在人体内利用率低,且不易吸收,有报道表明结合类的黄酮需要经肠道菌群的转化后变为苷元的游离型黄酮才能被人体吸收[15]。因此,作为人体肠道固有菌群的益生乳酸菌,因其安全性高而成为生物转化黄酮类化合物研究的新热点。
1.1 乳酸菌对黄酮类化合物的生物转化作用
国内外学者对乳酸菌生物转化药食同源植物黄酮类化合物进行了一系列研究,并发现乳酸菌通过生物转化可提高其黄酮类化合物含量进而提高其生物活性。马利华[16]研究发现,乳酸菌按3%接种至10%的槐花培养液中,发酵12 h后,黄酮类化合物(槲皮素)含量明显增高,由发酵前的1.8217 mg/kg增长为3.1684 mg/kg,增加了73.9%。王楠[17]发现枳椇的植物乳杆菌发酵产物中,总黄酮含量均高于枳椇水提物,并且枳椇乳酸菌发酵物DPPH与ABTS自由基清除能力均高于未发酵的枳椇水提物,由此说明乳酸菌可以提高黄酮含量并提高枳椇水提物的抗氧化活性。刘梦培等[18]分别使用植物乳杆菌和酵母菌对杜仲雄花的黄酮转化进行了考察,加菌量为4%,于38 ℃条件下恒温发酵,植物乳杆菌发酵的杜仲雄花总黄酮含量大幅度增长,在第5 d到达峰值,达6.0 mg/mL,增幅70%,而酿酒酵母发酵杜仲花提取物总黄酮含量增幅不大,发酵第2 d时增幅最大,仅为7.5%,相比之下植物乳杆菌表现出明显的优势。王惠等[19]使用副干酪乳杆菌YJ1发酵红树莓汁,结果表明发酵后的总黄酮和总酚含量分别提高了23%和18.58%,DPPH和羟基自由基的清除能力分别提高了22.92%和15.63%。上述报道均表明乳酸菌以药食同源植物为发酵底物,可提高其总黄酮含量进而增强其抗氧化能力。
随着研究的深入,学者们发现使用复合菌株对药食同源植物进行发酵,其发酵效果往往高于单菌株。黄振勇等[20]考察了植物乳杆菌、保加利亚乳杆菌两个菌种对铁皮石斛的转化能力,发现植物乳杆菌发酵液比未发酵原汁黄酮含量提高了9.02%,保加利亚乳杆菌发酵液相比于未发酵原汁其黄酮含量并没有显著提高,随后将两株菌以1:1混合发酵,总黄酮含量从发酵前的1.265%提高到1.669%,提高了31.87%,混合后的发酵效果优于单菌株的发酵效果。在混合菌种的选择方面,LIU等[21]以枸杞为发酵底物,同样采用混合菌种发酵,但不局限于乳酸菌,而是将乳酸菌与其他细菌混合发酵,分别考察了三种混合菌株:SLV(鼠李糖乳杆菌、罗伊氏乳杆菌和贝莱斯芽孢杆菌),SZP(鼠李糖乳杆菌、植物乳杆菌和地衣芽孢杆菌)和SZVP(鼠李糖乳杆菌、植物乳杆菌、贝莱斯芽孢杆菌和地衣芽孢杆菌)对枸杞中总黄酮含量的影响,发现三种混合菌株发酵后总黄酮含量均有明显提升,其中以SLV发酵后黄酮含量最高,SLV、SZP和SZVP发酵果汁样品中游离态芦丁的浓度分别增加了1.35、1.29和3.10倍,在枸杞原浆中结合型芦丁的含量较低,这可能是由于(多)酚氧化酶在发酵过程中解聚了高分子量酚类物质所致[22]。由此表明,药食同源植物经乳酸菌发酵后,可显著提高其黄酮类化合物含量,进而增强其抗氧化活性。
1.2 乳酸菌生物转化黄酮的机制
大量实验证明乳酸菌通过发酵能有效增加药食同源植物的黄酮含量,其在发酵过程中有多种酶参与转化,如葡糖苷酶、淀粉酶、纤维素酶、几丁质酶等,这些酶具有分解植物细胞壁组分的作用,从而利于有效成分的提取[12]。乳酸菌发酵过程中有大量乳酸的产生,pH的降低可能会改变植物细胞的通透性从而使产物更容易渗出[23]。目前关于黄酮的乳酸菌转化机制并没有详细地报道,但乳酸菌转化黄酮已明确的代谢途径有两种:一种是基于其糖基水解酶活性,将黄酮糖苷转化为相应的糖苷配基;一种是基于其酯酶活性,降解没食子酸甲酯,单宁或酚酸酯[24]。游离态黄酮较结合态黄酮更易被人体吸收,因此将结合型黄酮的糖基水解可有效提高黄酮的生物利用度。研究发现可转化黄酮的乳酸菌菌株中通常具有较强的β-葡萄糖苷酶活性,该酶在结合型黄酮转化为游离型黄酮的过程中起重要作用。
研究人员进一步研究了乳酸菌的β-葡萄糖苷酶活性与活菌数间的关系,分别考察了5株乳酸菌,即嗜酸乳杆菌BCRC 10695、保加利亚乳杆菌BCRC 10696、干酪乳杆菌BCRC 14080、嗜热链球菌ATCC BAA-250和嗜热链球菌BCRC 13680,发现活菌数与β-葡萄糖苷酶活性并无统计学的对应关系[25]。由此说明,单纯依靠活菌数对乳酸菌的生物转化功能进行评价是不准确的,应该考量其关键酶的活性。一项关于粘膜乳杆菌β-葡萄糖苷酶编码基因的研究[26]显示主要来自两段序列:P508_0152和P508_0913,将二者克隆到质粒pNZ:TuR中,发现携带P508_0913序列的质粒表现出良好的酶活性,而携带P508_0152序列的质粒没有酶活性,并将二者分别用于亚麻籽提取物的转化,发现携带P508_0913序列的质粒可将亚麻籽提取物中的开环异落叶松树脂酚二葡萄糖苷(SDG)转化为开环异落叶松树脂酚(SECO),而携带P508_0152的质粒并不能完成转化,因此推测序列P508_0152为影响β-葡萄糖苷酶的重要序列。综上所述乳酸菌将结合型黄酮转化为更易人体吸收的游离型黄酮,β-葡萄糖苷酶起到了关键作用。
2. 乳酸菌对皂苷类化合物的生物转化
皂苷类化合物是广泛存在于植物中的一种重要功效成分,具有改善记忆、保护神经系统、抗炎、抗肿瘤等作用[27]。目前,研究最为深入的是人参皂苷,迄今已发现182种人参皂苷,50多种人参皂苷已被鉴定,主要分为人参二醇型皂苷(PPD)、人参三醇型皂苷(PPT)和齐墩果烷型皂苷(oleanolic saponins)[28]。研究人员发现了一种天然含量极低的皂苷,并将其称之为稀有皂苷,其在人参花和人参果中含量仅为0.02%和0.04%,而在人参常用的药用部位主根、须根、芦头中几乎不存在[29],这类皂苷在药理上有良好的抗肿瘤活性,且由于糖基被水解而使其更容易被人体肠道吸收利用。因此,如何有效地将皂苷转化为稀有皂苷已成为医药领域的研究热点。天然皂苷可以通过物理(加热)、化学(酸解)、微生物转化等过程水解产生糖苷、二级糖苷或其衍生物。相比之下,微生物转化因其特异性强、条件温和、副产物少等特点,逐渐成为大规模生产活性次生皂苷的主要方法[30]。
2.1 乳酸菌对皂苷的生物转化作用
皂苷是多种药用植物最重要的药效物质,已报道可转化皂苷的常见微生物有霉菌、酵母菌和细菌,而对于微生物转化而言,代谢产物的安全性至关重要。因此,作为益生菌主要来源的乳酸菌,因其在食品、医药领域广泛安全的使用史,受到极大关注。具有皂苷生物转化活性的乳酸菌中,以植物乳杆菌研究报道居多。屈青松等[31]发现在人参粉末匀浆中加入8%的植物乳杆菌,28 ℃恒温发酵36 h后,发酵样品中各人参皂苷的含量均有一定的提高,人参皂苷Rg1、Re、Rb1、Rc、Rd分别提高了69%、62%、73%、34%、64%。陈旸等[32]重点考察了人参皂苷Rb的转化情况,使用植物乳杆菌种子液加入到人参提取液中,35 ℃恒温发酵2 d,结果发现发酵后的样品中人参皂苷Rb含量提高了4.864 mg/g。除此之外,肠膜明串珠菌、发酵乳杆菌、长双歧杆菌等在皂苷转化方面也起到了积极作用。研究者使用从泡菜中分离的一株肠膜明串珠菌DC102发酵人参皂苷Rb1,发现人参皂苷Rb1含量明显降低,而绞股蓝皂苷XVII含量明显增高[33]。JUNG等[8]以人参作为底物,分别使用德氏乳杆菌保加利亚亚种、发酵乳杆菌、长双歧杆菌和肠膜明串珠菌进行混合发酵,发酵5 d后人参皂苷的含量均有明显升高。KIM等[34]筛选到一株可以转化产生稀有人参皂苷CK的高活性短乳杆菌,转化率可达到34.7%,由此说明乳酸菌发酵后可产生药用价值更高且自身难以合成的稀有人参皂苷CK。BAE等[35]采用乳酸菌制备稀有人参皂苷CK,发现采用植物乳杆菌KK-1和发酵乳杆菌KK-2混合发酵比单菌株发酵效果更好,混合发酵的转化率达41%。
2.2 乳酸菌生物转化皂苷的机制
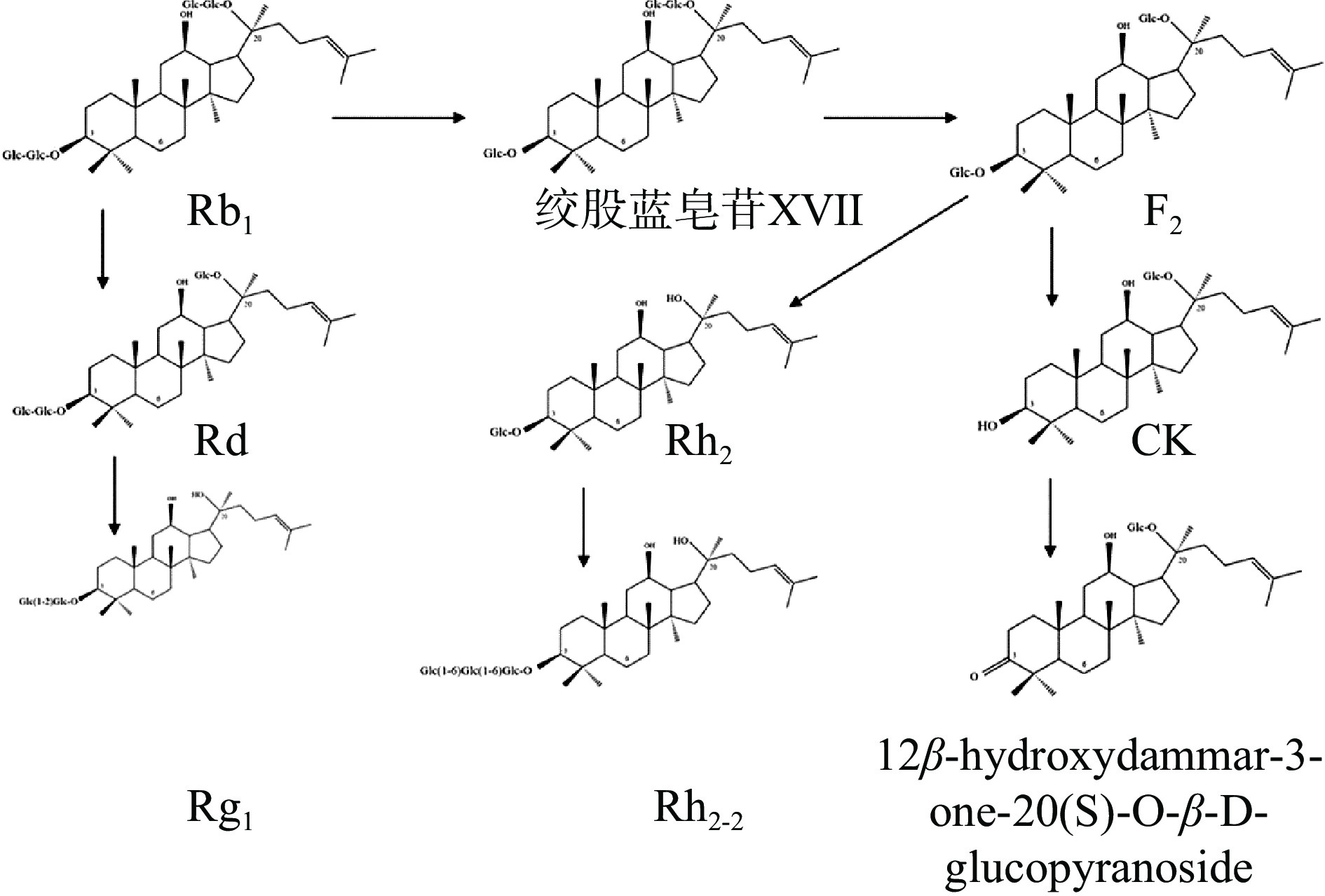
绞股蓝皂苷是葫芦科植物绞股蓝最主要的有效成分,其水解产物大部分与人参皂苷的水解产物相同[26]。一般反应的起始底物为以Rb1为代表的原人参二醇型人参皂苷(PPD),通过乳酸菌实现各个皂苷单体之间的转化,如Rb1 C20位上脱去一分子葡萄糖可转化为Rd,C3未脱去一分子葡萄糖可转化为绞股蓝皂苷XVII,后者在C20位继续脱去一分子葡萄糖可转化为人参皂苷F2,F2的C3位继续脱去一分子葡萄糖可生成人参皂苷CK,具体转化过程如图1所示。
研究人员利用肠膜明串珠菌DC102发酵人参皂苷Rb1,发现人参皂苷Rb1和发酵产物绞股蓝皂苷XVII、人参皂苷Rd、人参皂苷F2和CK的浓度随反应时间呈规律性变化,反应24 h后人参皂苷Rb1同时转化为绞股蓝皂苷XVII和人参皂苷Rd,大部分人参皂苷Rb1在反应48 h后已分解为绞股蓝皂苷XVII、人参皂苷Rd和人参皂苷F2,从48 h时到72 h,所有中间体都连续转化为CK[33]。人参主要药用部位所含的皂苷大多是以Rb1、Rb2、Rb、Rc为代表的原人参二醇型人参皂苷(PPD),这些皂苷的主要特征是在C-3、C-20上连接一个或多个糖基。研究者通过基因库筛选出多个糖基转移酶基因,将其重组后可使用简单的葡萄糖通过MEV途径由2,3-(S)氧化角鲨烯生成PPD[36]。人参稀有皂苷如F2、CK等在C-3、C-20上的糖基较PPD少,且进一步研究发现其在抗炎、抗癌等方面有着广泛的活性。研究人员考察了多种人参皂苷对人肝癌细胞生长的抑制作用,发现人参皂苷抑制HepG2和SMMC7721肝癌细胞增殖的作用随着糖基数目的减少而增强,PPD型人参皂苷仅有轻微的抑制作用,而人参皂苷CK在40 μmol/L浓度下有明显的抑癌活性[37],故以人参皂苷CK为代表的人参稀有皂苷具有更高的抗癌活性,药用价值更高。但由于C-20空间受阻其化学合成困难,而乳酸菌发酵的过程可以对C-3、C-20位上的糖基进行水解,从而使大规模生产变为可能。研究者使用Rb1为转化底物,使用副食物乳杆菌LH4发酵72 h后,发现88%的Rb1转化成了CK,并推测其转化过程为:Rb1→绞股蓝皂苷XVII、Rd→F2→CK。另一项研究发现乳酸菌在Rb1转化为Rd的过程中,水解C-20上葡萄糖的酶可能是β-葡萄糖苷酶,研究人员将短乳杆菌来源的多个β-葡萄糖苷酶进行了克隆,并在大肠杆菌中表达,发现表达bgy2(糖基水解酶家族3)的BL21能够特异性水解C-20位上的葡萄糖,有着明显的转化能力[38]。SIDDIQI等[39]从泡菜中分离了一株乳杆菌EMML 3041,鉴定出12种糖苷水解酶,选取其中7种进行重组克隆表达,并以Rb1为底物进行发酵,发现重组酶(BglL.gin-952)最终产物中有大量Rg3存在,说明该酶对C-20上的葡萄糖有较高的选择性,而且转化率较为理想,50 g Rb1共产出30 g Rg3,并进一步明确了该酶为糖苷水解酶家族3成员。CK与F2化学结构十分相近,差异仅是CK的C-3位置上无糖基。研究表明,CK较F2有更好的抗癌等药理活性,药用价值更高。研究人员将短乳杆菌中的β-葡萄糖苷酶基因(bgy2)在大肠杆菌中表达,以F2为原料进行转化,发现产生大量CK,转化率可观,摩尔转化率达到91%,说明相比于C-20内侧糖基,bgy2对C-3糖基的选择性更高,此外,在研究绞股蓝皂苷XVII转化为CK的过程中,短乳杆菌中的β-葡萄糖苷酶基因(bgy1)被克隆表达在大肠杆菌BL21(DE3)中,发酵底物为绞股蓝皂苷XVII,使用LC-MS分析其发酵产物发现绞股蓝皂苷XVII是绞股蓝皂苷LXXV转换为CK的中间产物[40],说明bgy1水解过程首先是C-3的外部葡萄糖,然后是C-20的内部葡萄糖部分水解成绞股蓝皂苷LXXV或同时进行。CHI等[41]使用双歧杆菌Int57的细胞全酶进行发酵发现2 mU双歧杆菌Int57酶在24 h内可将Rb1转化为Rd或F2,当发酵时间延长至48 h时,发酵产物并未像预期那样得到大量CK,而是发现大量新的代谢产物,分析后发现其为Rh2,说明以F2为底物有可能得到除CK外的其他产物。
人参皂苷Rh2具有许多药理活性,例如抗癌、抗糖尿病、抗炎和抗肥胖特性。研究者从鼠李糖乳杆菌中克隆1224 bp基因序列的糖基转移酶(GTs),以0.5 mmol/L Rh2为底物,发酵后发现两种新的代谢产物,代谢物1的转化率为45.2%,而代谢物2的产率为9.3%,通过核磁共振等方法发现均为新化合物,代谢物1命名为葡糖基人参皂苷Rh2(Rh2-1),代谢物2命名为二葡糖基人参皂苷Rh2(Rh2-2)[42],Rh2-1与Rh2的区别为在C-3位上以C6→1的方式多一个外侧葡萄糖,Rh2-2是在Rh2-1的基础上以同样的方式多一个外侧葡萄糖,并且Rh2-1在多种癌细胞系中有降低癌细胞活力、诱导细胞凋亡和减少血管增生的药理效果,目前临床效果相似的化合物是Rg3[43],而通过鼠巨噬细胞(RAW264.7)、肺癌细胞(A549)、前脂肪细胞(3T3-L1)和黑色素瘤(B16BL6)细胞系进行细胞毒性测定,发现Rh2-1的毒性较Rg3低,可能是因为其不同的C3位上葡萄糖的连接方式导致的(Rg3为C2→1)。JIN等[44]发现乳酸菌对人参皂苷的修饰不只在糖基的水解或转移上,其以泡菜源短乳杆菌DCY65-1为受试菌株,提取粗酶后分别以CK和F1为底物进行48 h发酵,发现CK与F1发酵后均发生了C-3处的羟基酮化,这些结果表明菌株DCY65-1在羟基类固醇脱氢酶的作用下对人参皂苷C-3处-OH表现出强大的酮脱羧酶活性,但是这两个代谢产物的药理特性并未见详细报道。
3. 乳酸菌对多糖类化合物的生物转化作用
多糖类成分在自然界广泛存在,也是药食同源植物有效成分之一,如葛根、茯苓、当归等。药理研究表明,多糖可以提高动物生长性能、抗氧化力及机体免疫力等[45]。目前,关于乳酸菌转化多糖的研究报道较少。研究显示,乳酸菌发酵药食同源植物后,其多糖成分明显提升,体外增强免疫力效果也较为良好[46]。包智影[47]使用一株植物乳杆菌对黄精进行发酵,黄精水提物多糖含量约20%,而发酵后多糖含量增加至33.11%,发酵后多糖对肥胖小鼠总甘油三酯和低密度脂蛋白胆固醇两项指标有更好的治疗效果(水提物分别降低了23.07%和10.09%,而发酵物分别降低了26.48%和37.70%)。多糖的生物活性受其分子质量和组成的影响。WAN等[48]利用植物乳酸菌发酵胡萝卜汁,发现发酵胡萝卜汁表现出了更好的降糖效果,且发酵胡萝卜汁中水溶性多糖的分子量降低,表明其多糖构成在发酵后已经发生了改变。ZHANG等[49]选用一株植物乳杆菌对芦笋进行发酵,发现发酵前后的多糖组成存在明显的差异,发酵液中鼠李糖、半乳糖、葡萄糖醛酸的比例分别提高了46.70%、114.09%、12.75%,同时发现发酵液表现出了更好的抗炎效果,50 mg/kg/d的发酵液可显著上调T-bet的水平,而芦笋原汁达到相同效果则需要200 mg/kg/d的剂量。在一项发酵乳杆菌发酵龙眼的研究中,同样发现了发酵前后多糖组成的改变,发酵前后样品中单糖组成具有明显的差异,发酵后葡萄糖的摩尔比减少了38.71%,而半乳糖和阿拉伯糖增加了11.28%和11.80%,通过改变多糖的组分构成,发酵后的多糖具有更好的免疫调节能力,这可能与多糖的单糖组成与细胞表面受体(如甘露糖受体)的识别有关[50]。由此说明,乳酸菌发酵药食同源植物可通过改变其多糖成分的组成结构,进而提高其生物活性,但其改变多糖组成的机制尚不清楚,仍有待于进一步深入研究。
某些药食同源植物多糖具有益生元作用,因此乳酸菌与多糖之间存在着双向作用关系。梁海艳[51]对添加人参多糖的乳酸菌进行培养,添加量分别为0.1%、0.3%、0.5%、0.7%、0.9%,随着人参多糖添加量的增加,乳酸菌活菌数明显提高,当人参多糖添加量为0.9%时,其活菌数为空白对照的144.44倍。值得注意的是,某些乳酸菌在生长过程中,具有分泌产生胞外多糖(EPS)的能力,其主要存在于细胞壁外的粘液或荚膜多糖中[52]。培养基中加入枸杞多糖,可明显提高嗜酸乳杆菌NCFM和德氏乳杆菌LB-1的黏附率,同时发现二者产生的胞外多糖中含有半乳糖、甘露糖和葡萄糖,而枸杞多糖同样含有这些成分,由此推测乳酸菌可能是通过转化枸杞多糖为单糖后又重新合成了其自身的胞外多糖成分[53]。因此,乳酸菌以药食同源植物为发酵底物,发酵产物中多糖成分的增加是来源于植物多糖还是乳酸菌自身代谢产生尚无相关报道,仍需更深入的研究加以鉴别。
4. 乳酸菌对其他活性物质的生物转化作用
乳酸菌除了对黄酮、皂苷、多糖类化合物有生物转化作用外,对原儿茶酸与共轭亚油酸(CLA)等也有良好的转化效果。原儿茶酸具有抗氧化、预防心血管疾病等生物活性。研究人员利用鼠李糖乳杆菌YYJP-2对紫薯花青素进行转化,发现转化后的原儿茶酸含量可达2.27~3.3 mg/mL,转化物的DPPH清除率高于对照组,表现出了良好的抗氧化活性[54]。CLA是含有共轭双键的十八碳二烯酸的总称,具有抗癌、抗动脉粥样硬化、抑制炎症、抑制肥胖、抑制糖尿病、促进生长、促进骨骼形成等作用[55]。乳酸菌具有转化亚油酸生成c9,t11-CLA、t10,c12-CLA或t9,t11-CLA的能力[56-57]。研究人员以富含亚油酸的红花籽油、蓖麻油等药食同源植物油脂为发酵底物,成功转化生成了CLA,例如,利用植物乳杆菌转化红花籽油生成了c9,t11-CLA[58],发酵转化蓖麻油,37 ℃培养20 h后CLA产量可达406 μg/mL,其中c9,t11-CLA和t10,c12-CLA分别占56.55%和43.45%[59],这种转化作用可能与亚油酸异构酶有关[60]。γ-氨基丁酸(GABA)是大脑中最丰富的抑制性神经递质,具有抗抑郁、降血压、降胆固醇等方面的活性[61]。研究人员利用戊糖乳杆菌F064A发酵桑葚,发酵48 h后其GABA含量达到(3.31±0.06)mg/mL[62];利用短乳杆菌GABA100发酵黑树莓汁,其GABA含量可达到27.6 mg/mL[63],这主要归因于乳酸菌产生的谷氨酸脱羧酶(GAD)活性,将发酵原料中的L-谷氨酸脱羧转化为GABA[64]。
5. 展望
生物转化一直是国内外学者研究的热点课题,其以高效、环保、经济等突出的优势表现出无限的潜力。乳酸菌作为健康人体肠道固有的有益菌群,且具有悠久的人类食用安全史,除了自身具有诸多的益生功能外,在生物转化植物有效成分方面起到了积极作用,并且相比于其他菌种展现出了绝对的安全优势。目前,乳酸菌生物转化药食同源植物活性物质的途径、关键酶以及副产物等仍是工业生物转化过程中亟待解决的关键问题。乳酸菌生物转化黄酮和多糖类化合物的机制尚未明确,尤其是多糖类化合物的转化存在植物多糖与乳酸菌胞外多糖共存的情况,皂苷类化合物的转化关键酶依然有部分缺失,同时乳酸菌在生物转化药食同源植物方面尚未大规模应用于实际生产。随着组学技术的成熟及研究的深入,乳酸菌生物转化植物活性物质的代谢途径将逐渐被揭示,这将为其发酵药食同源植物进而开发兼具益生乳酸菌与药食同源植物活性成分于一身的保健食品提供重要的理论依据。在大健康背景下,益生菌发酵药食同源植物产品具有广阔的应用前景。
-
[1] ZAFAR H, SAIER M H J. Comparative genomics of the transport proteins of ten Lactobacillus strains[J]. Genes(Basel),2020,21(10):1234−1241.
[2] CHEON M J, LIM S M, LEE N K, et al. Probiotic properties and neuroprotective effects of Lactobacillus buchneri KU200793 isolated from Korean fermented foods[J]. International Journal of Molecular Sciences,2020,21(4):1227−1233. doi: 10.3390/ijms21041227
[3] 郑苗, 何佳, 吕丹丹, 等. 复合乳酸菌发酵怀山药工艺及其抗氧化活性[J]. 中国酿造,2018,37(2):106−110. [ZHENG M, HE J, LV D D. Optimization of fermentation process of Chinese yam by compound lactic acid bacteria and its antioxidant activity[J]. China Brewing,2018,37(2):106−110. doi: 10.11882/j.issn.0254-5071.2018.02.022 [4] 郑苗, 何佳, 吕丹丹, 等. 怀山药乳酸菌饮品发酵工艺及其活性成分的研究[J]. 食品科技,2018,43(7):104−110. [ZHENG M, HE J, LV D D, et al. Study on fermentation technology and active components of Chinese yam Lactobacillus beverage[J]. Food Science and Technology,2018,43(7):104−110. [5] YOU Y, LIU Y L, AI Z Y, et al. Lactobacillus fermentum KP-3-fermented ginseng ameliorates alcohol-induced liver disease in C57BL/6N mice through the AMPK and MAPK pathways[J]. Food & Function,2020,11(11):9801−9809.
[6] QU Q, YANG F, ZHAO C, et al. Effects of fermented ginseng on the gut microbiota and immunity of rats with antibiotic-associated diarrhea[J]. Journal of Ethnopharmacology,2021,267:113594. doi: 10.1016/j.jep.2020.113594
[7] JANG S H, PARK J, KIM S H, et al. Oral administration of red ginseng powder fermented with probiotic alleviates the severity of dextran-sulfate sodium-induced colitis in a mouse model[J]. Chi-nese Journal of Natural Medicines,2017,15(3):192−201. doi: 10.1016/S1875-5364(17)30035-3
[8] JUNG J, JANG H J, EOM S J, et al. Fermentation of red ginseng extract by the probiotic Lactobacillus plantarum KCCM 11613P: Ginsenoside conversion and antioxidant effects[J]. Journal of Ginseng Research,2019,43(1):20−26. doi: 10.1016/j.jgr.2017.07.004
[9] 陈艳艳, 于波, 潘黛安, 等. 乳杆菌发酵葛根水提液工艺研究及其解酒功效探讨[J]. 中国酿造,2020,39(8):182−186. [CHEN Y Y, YU B, PAN D A, et al. Fermentation technology of water extract of Pueraria lobata by Lactobacillus and its alleviating hang-over effect[J]. China Brewing,2020,39(8):182−186. doi: 10.11882/j.issn.0254-5071.2020.08.034 [10] 国立东, 李秀萍, 张焕, 等. 一株酸面团源乳酸菌的益生特性及其对刺五加叶总皂苷的影响[J]. 食品工业科技,2021,42(14):121−126. [GUO L D, LI X P, ZHANG H, et al. The probiotic properties of a strain of sourdough-derived lactic acid bacteria and its effect on the total saponins of Acanthopanax senticosus lea-ves[J]. Science and Technology of Food Industry,2021,42(14):121−126. [11] 苏能能, 关倩倩, 彭珍, 等. 乳酸菌发酵对桑葚浆品质及抑菌性能的影响[J]. 食品与发酵工业,2018,44(9):117−124. [SU N N, GUAN Q Q, PENG Z, et al. Effects of lactic acid bacteria on quality and antibacterial properties of mulberry puree[J]. Food and Fermentation Industries,2018,44(9):117−124. [12] DEGRAIN A, MANHIVI V, REMIZE F, et al. Effect of lactic acid fermentation on color, phenolic compounds and antioxidant activity in African nightshade[J]. Microorganisms,2020,30(9):1324.
[13] GONG W, HUANG Y, JI A, et al. Optimisation of saponin extraction conditions with Camellia sinensis var. assamica seed and its application for a natural detergent[J]. Journal of the Science of Food and Agriculture,2018,98(6):2312−2319. doi: 10.1002/jsfa.8721
[14] HURJ S, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry,2014,160:346−356. doi: 10.1016/j.foodchem.2014.03.112
[15] QIAO H, ZHANG X, SHI H, et al. Assessment of the physicochemical properties and bacterial composition of Lactobacillus plantarum and Enterococcus faecium-fermentedAstragalus membranaceus using single molecule, real-time sequencing technology[J]. Scientific Reports,2018,8(1):11862. doi: 10.1038/s41598-018-30288-x
[16] 马利华. 乳酸菌发酵对槐花营养及抗氧化性的影响[J]. 食品工业科技,2009,30(5):200−202,207. [MA L H. Effect of Lac-tobacillus fermentation on nutrients and function of Sophra japonica[J]. Science and Technology of Food Industry,2009,30(5):200−202,207. [17] 王楠. 枳椇乳酸菌发酵饮料对小鼠酒精肝损伤的保护作用[D]. 杨凌: 西北农林科技大学, 2016. WANG N. Effect of lactic acid-fermented beverage from peduncles of Hovenia dulcis on alcohol-induced liver damage in mice[D]. Yangling: Northwest A&F University, 2016.
[18] 刘梦培, 李佳, 纵伟, 等. 乳酸菌和酵母菌发酵对杜仲雄花茶汁品质及抗氧化活性的影响[J]. 中国酿造,2020,39(5):71−76. [LIU M P, LI J, ZONG W, et al. Effects of lactic acid bacteria and yeast fermentation on the quality and antioxidant activity of male Eucommia ulmoides flower tea juice[J]. China Brewing,2020,39(5):71−76. doi: 10.11882/j.issn.0254-5071.2020.05.014 [19] 王惠, 赵国群, 冯风琴, 等. 发酵红树莓汁乳酸菌的筛选及抗氧化活性研究[J]. 中国酿造,2020,38(5):105−109. [WANG H, ZHAO G Q, FENG F Q, et al. Screening of lactic acid bacteria and antioxidant activity of fermented red raspberry juice[J]. China Brewing,2020,38(5):105−109. doi: 10.11882/j.issn.0254-5071.2020.05.020 [20] 黄振勇, 张娥珍, 淡明, 等. 乳酸菌发酵对铁皮石斛活性物质含量及其抗氧化能力的影响[J]. 热带作物学报,2020,41(3):572−578. [HUANG Z Y, ZHANG E Z, DAN M, et al. Effects of Lactobacillus fermentation on active substance and antioxidant activity of Dendrobium candidum[J]. Chinese Journal of Tropical Crops,2020,41(3):572−578. doi: 10.3969/j.issn.1000-2561.2020.03.021 [21] LIU Y, CHENG H, LIU H, et al. Fermentation by multiple bacterial strains improves the production of bioactive compounds and antioxidant activity of Goji juice[J]. Molecules,2019,24(19):3519. doi: 10.3390/molecules24193519
[22] KWAW E, MA Y, TCHABO W, et al. Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Chemistry,2018,250:148−154. doi: 10.1016/j.foodchem.2018.01.009
[23] YE J, HUANG L, TEREFE N S, et al. Fermentation-based biotransformation of glucosinolates, phenolics and sugars in retorted broccoli puree by lactic acid bacteria[J]. Food Chemistry,2019,286:616−623. doi: 10.1016/j.foodchem.2019.02.030
[24] HECTOR R, JOSE A C, JOSE M L, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009,132:79−90. doi: 10.1016/j.ijfoodmicro.2009.03.025
[25] LIU W S, YANG CY, FANG T J. Strategic ultrasound-induced stress response of lactic acid bacteria on enhancement of β-glucosidase activity for bioconversion of isoflavones in soymilk[J]. Journal of Microbiological Methods,2018,148:145−150. doi: 10.1016/j.mimet.2018.04.006
[26] GAYA P, PEIROTEN A, LANDETE J M. Expression of a β-glucosidase in bacteria with biotechnological interest confers them the ability to deglycosylate lignans and flavonoids in vegetal foods[J]. Applied Microbiology and Biotechnology,2020,104(11):4903−4913. doi: 10.1007/s00253-020-10588-x
[27] 孙莹莹, 刘玥, 陈可冀. 人参皂苷的心血管药理效应: 进展与思考[J]. 中国科学(生命科学),2016,46:771−778. [SUN Y Y, LIU Y, CHEN K J. Roles and mechanisms of ginsenoside on cardiovascular diseases: Progress and perspectives[J]. Scientia Sinica (Vitae),2016,46:771−778. doi: 10.1360/05scls-2015-0279 [28] DEL H J, HERRERA T, FORNARI T, et al. The gastrointestinal behavior of saponins and its significance for their bioavailability and bioactivities[J]. Journal of Functional Foods,2018,40:484−497. doi: 10.1016/j.jff.2017.11.032
[29] BAI L, GAO J, WEI F, et al. Therapeutic potential of ginsenosides as an adjuvant treatment for diabetes[J]. Frontiers in Pharmacology,2018,5(9):423.
[30] HARALAMPIDIS K, TROJANOWSKA M, OSBOURN A E. Biosynthesis of triterpenoid saponins in plants[J]. Advances in Biochemical Engineering/Biotechnology,2002,75:31−49.
[31] 屈青松, 林峰, 赵崇研, 等. 发酵乳杆菌发酵人参工艺优化及人参皂苷抗氧化活性测定[J]. 中成药,2020,42(10):2738−2743. [QU Q S, LIN F, ZHAO C Y, et al. Lactobacillus fermentum fermentation process optimization of ginseng and determination of ginsenoside antioxidant activity[J]. Chinese Traditional Patent Medicine,2020,42(10):2738−2743. doi: 10.3969/j.issn.1001-1528.2020.10.038 [32] 陈旸, 王义, 孙亮, 等. 植物乳杆菌发酵转化人参皂苷的研究[J]. 中国中药杂志,2014,39(8):1435−1440. [CHEN Y, WANG Y, SUN L, et al. Study on fermentation and transformation of ginsenosides by Lactobacillus plantarum[J]. China Journal of Chinese Materia Medica,2014,39(8):1435−1440. [33] QUAN L H, PIAO J Y, MIN J W, et al. Biotransformation of ginsenoside Rb1 to prosapogenins, gypenoside XVII, ginsenoside Rd, ginsenoside F2, and compound K by Leuconostoc mesenteroides DC102[J]. Journal of Ginseng Research,2011,35(3):344−351. doi: 10.5142/jgr.2011.35.3.344
[34] KIM B H, LEE S Y, CHO H J, et al. pBiotransformation of Korean Panax ginseng by pectinex[J]. Biological and Pharmaceutical Bulletin,2006,29(12):2472−2478. doi: 10.1248/bpb.29.2472
[35] BAE E A, KIM N Y, HAN M J, et al. Transformation of ginsenoside to compound K(IH-901) by lactic acid bacteria of human intestine[J]. Journal of Microbiology and Biotechnology,2003,13(1):9−14.
[36] TANSAKUL P, SHIBUYA M, KUSHIRO T, et al. Dammarenediol-II synthase, the first dedicated enzyme for ginsenoside biosynthesis, in Panax ginseng[J]. Federation of European Bioche-mical Societies,2006,580(22):5143−5149. doi: 10.1016/j.febslet.2006.08.044
[37] 刘江梅. 32种人参皂苷抑制肝癌细胞HepG2和SMMC7721增殖作用的构效关系[D]. 南昌: 南昌大学, 2021. LIU J M. Structure-activity relationship of 32 ginsenosides inhibiting the proliferation of hepatoma cells HepG2 and SMMC7721[D]. Nanchang: Nanchang University, 2021.
[38] YAN X, FAN Y, WEI W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast[J]. Cell Re-search,2014,24(6):770−773. doi: 10.1038/cr.2014.28
[39] SIDDIQI M Z, SRINIVASAN S, PARK H Y, et al. Exploration and characterization of novel glycoside hydrolases from the whole genome of Lactobacillus ginsenosidimutans and enriched production of minor ginsenoside Rg3(S) by a recombinant enzymatic process[J]. Biomolecules,2020,10(2):288. doi: 10.3390/biom10020288
[40] ZHONG F L, DONG W W, WU S, et al. Biotransformation of gypenoside XVII to compound K by a recombinant β-glucosidase[J]. Biotechnology Techniques,2016,38(7):1187−1193.
[41] CHI H, KIM D H, JI G E. Transformation of ginsenosides Rb2 and Rc from Panax ginseng by food microorganisms[J]. Biological & Pharmaceutical Bulletin,2005,28(11):2102−2105.
[42] WANG D D, KIM Y J, BAEK N I, et al. Glycosyltransformation of ginsenoside Rh2 into two novel ginsenosides using recombinant glycosyltransferase from Lactobacillus rhamnosus and its in vitro applications[J]. Journal of Ginseng Research,2021,45(1):48−57. doi: 10.1016/j.jgr.2019.11.004
[43] 陈明伟, 倪磊, 赵小革, 等. 人参皂苷Rg3对肿瘤血管生长调控因子蛋白表达抑制作用的研究[J]. 中国中药杂志,2005,30(5):357−360. [CHENG M W, NI L, ZHAO X G, et al. Ginsenoside Rg3 regulates tumor blood vessel growth study on the inhibitory effect of factor protein expression[J]. China Journal of Chinese Materia Medica,2005,30(5):357−360. doi: 10.3321/j.issn:1001-5302.2005.05.010 [44] JIN Y, JUNG S Y, KIM Y J, et al. Microbial ketonization of ginsenosides F1 and C-K by Lactobacillus brevis[J]. Antonie Van Leeuwenhoek,2014,106(6):1215−1221. doi: 10.1007/s10482-014-0291-4
[45] 杨玲, 胡睿智, 夏嗣廷, 等. 植物多糖的功能性研究进展及其在动物生产中的应用[J]. 动物营养学报,2019,31(6):2534−2543. [YANG L, HU R Z, XIA S T, et al. Research progress on the functionality of plant polysaccharides and their application in animal production[J]. Chinese Journal of Animal Nutrition,2019,31(6):2534−2543. [46] 边亚彬. 发酵黄芪多糖的制备及其对小鼠树突状细胞成熟相关信号通路的影响[D]. 北京: 中国农业科学院, 2017. BIAN Y B. Preparation of fermented Astragalus polysaccharides and its effect on the signaling pathway of murine bone marrow-derived dendritic cells maturation in vitro[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[47] 包智影. 微生物法提取黄精多糖及其降脂功能的研究[D]. 哈尔滨: 东北林业大学, 2011. BAO Z Y. Preparation of Polygonatum sibiricum polysaccharide by microbial method and its lipid-lowering function[D]. Harbin: Northeast Forestry University, 2011.
[48] WAN Y J, SHI H F, XU R, et al. Origin of hypoglycemic benefits of probiotic-fermented carrot pulp[J]. Journal of Agricultural and Food Chemistry,2019,67(3):895−904. doi: 10.1021/acs.jafc.8b06976
[49] ZHANG Z H, FAN S T, HUANG D F, et al. Effect of Lactobacillus plantarum NCU116 fermentation on asparagus officinalis polysaccharide: Characterization, antioxidative, and immunoregulatory activities[J]. Journal of Agricultural and Food Chemistry,2018,66(41):10703−10711. doi: 10.1021/acs.jafc.8b03220
[50] HUANG F, HONG R, ZHANG R, et al. Physicochemical and biological properties of longan pulp polysaccharides modified by Lactobacillus fermentum fermentation[J]. International Journal of Biological Macromolecules,2019,15(125):232−237.
[51] 梁海艳. 人参多糖对乳酸菌发酵特性的影响及应用[D]. 长春: 吉林大学, 2013. LIANG H Y. Effect of ginseng polysaccharide on the fermentation characteristics of lactic acid bacteria and its application[D]. Changchun: Jilin University, 2013.
[52] YI Y J, LIM J M, GU S, et al. Potential use of lactic acid bacteria Leuconostoc mesenteroides as a probiotic for the removal of Pb(II) toxicity[J]. Journal of Microbiology,2017,55(4):296−303. doi: 10.1007/s12275-017-6642-x
[53] 王嘉悦. 枸杞多糖与益生菌粘附特性关系的研究[D]. 北京: 北京林业大学, 2019. WANG J Y. Study of adhesion characteristics of Lycium barbarum polysaccharides and the probiotics[D]. Beijing: Beijing Forestry University, 2019.
[54] 李汉荣. 益生菌生物转化紫薯花青素及应用研究[D]. 广州: 华南农业大学, 2017. LI H R. Probiotics biotransformation of purple sweet potato anthocyanins and the application in yogurt fermentation[D]. Guangzhou: South China Agricultural University, 2017.
[55] CHEN C, LU Y, YU H, et al. Influence of 4 lactic acid bacteria on the flavor profile of fermented apple juice[J]. Food Bioscience,2019,27:30−36. doi: 10.1016/j.fbio.2018.11.006
[56] PALACHUM W, CHOORIT W, CHISTI Y. Accumulation of conjugated linoleic acid in Lactobacillus plantarum WU-P19 is enhanced by induction with linoleic acid and chitosan treatment[J]. Annals of Microbiology,2018,68:611−624. doi: 10.1007/s13213-018-1368-5
[57] 赵微, 张峰, 张和平, 等. 植物乳杆菌p-8转化亚油酸为共轭亚油酸的分析[J]. 食品科学,2021,42(10):94−103. [ZHAO W, ZHANG F, ZHANG H P, et al. Analysis of the transformation of linoleic acid into conjugated linoleic acid by Lactobacillus plantarum p-8[J]. Food Science,2021,42(10):94−103. doi: 10.7506/spkx1002-6630-20200225-273 [58] YANG H S, HUH C K. Efficient conversion of conjugated linoleic acid c9, t11 by Lactobacillus fermentation from vegetable oil to generate fermented milk with high CLA content[J]. Korean Jour-nal of Food Preservation,2018,25(4):482−489. doi: 10.11002/kjfp.2018.25.4.482
[59] KHASKHELI A A, TALPUR F N, CEBECI A A, et al. One-pot conjugated linoleic acid production from castor oil by Rhizopus oryzae lipase and resting cells of Lactobacillus plantarum[J]. Bioscience, Biotechnology, and Biochemistry,2017,81(10):2002−2008. doi: 10.1080/09168451.2017.1356218
[60] LEE N K, PAIK H D. Bioconversion using lactic acid bacteria: Ginsenosides, GABA, and phenolic compounds[J]. Journal of Microbiology and Biotechnology,2017,27(5):869−877. doi: 10.4014/jmb.1612.12005
[61] 高鹤. 双歧杆菌生物转化共轭亚油酸的机制研究[D]. 无锡: 江南大学, 2020. GAO H. Mechanism for conjugated linoleic acid transformation by bifidobacterial[D]. Wuxi: Jiangnan Univer-sity, 2020.
[62] KANKLAI J, SOMWONG T C, RUNGSIRIVANICH P, et al. Screening of GABA-producing lactic acid bacteria from Thai fermented foods and probiotic potential of Levilactobacillus brevis F064A for GABA-fermented mulberry juice production[J]. Microorganisms,2020,9(1):33. doi: 10.3390/microorganisms9010033
[63] KIM J Y, LEE M Y, JI G E, et al. Production of gamma-aminobutyric acid in black raspberry juice during fermentation by Lactobacillus brevis GABA100[J]. International Journal of Food Microbiology,2009,130(1):12−16. doi: 10.1016/j.ijfoodmicro.2008.12.028
[64] YOGESWARA I B A, MANEERAT S, HALTRICH D. Glutamate decarboxylase from lactic acid bacteria-a key enzyme in GABA synthesis[J]. Microorganisms,2020,8(12):1923. doi: 10.3390/microorganisms8121923
-
期刊类型引用(6)
1. 杨琳,江蓉倩,张杭颖,李树玉,武马璐,张君诚. 五指毛桃水提液制备泡腾片工艺优化. 食品工业科技. 2024(08): 200-207 .  本站查看
本站查看
2. 王江,马彩珍,李甜,霍彦雄,张亮亮,吴子健,徐建国. 野生接骨木果含片的制备及其抗氧化、抗运动疲劳作用研究. 保鲜与加工. 2024(05): 69-76 .  百度学术
百度学术
3. 许甜,吴萌,葛世辉,陈君,李赛,王智森. 沙棘果、叶的研究进展. 今日药学. 2024(06): 466-472 .  百度学术
百度学术
4. 冯思思,张喜瑞,于梦言,徐玉孟,李梓诺,李嘉慧,孙万萌,王璐,梁彬,孙婵婵. 黑蒜泡腾片的制备工艺优化及其对肠道微生态的影响. 食品与发酵工业. 2024(19): 49-55+86 .  百度学术
百度学术
5. 王媛媛,冯勇荣,孙青占,吕兆林. 不同产地沙棘叶茶品质分析及综合评价. 食品与发酵工业. 2024(24): 331-338 .  百度学术
百度学术
6. 王菲,沈卉芳,王瑶,沈鑫婷,郑先哲,姚鑫淼. 葡萄籽原花青素泡腾片的制备工艺优化及品质分析. 食品工业. 2024(12): 48-53 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:



