Optimization of Preparation Process for Nanostructured Lipid Carrier of CBD Broad-Spectrum Oil by Response Surface Methodology
-
摘要: 采用薄膜-超声法,以大豆卵磷脂和胆固醇为固体酯对大麻二酚(CBD)广谱油进行包埋,以包封率为评价指标制备CBD广谱油纳米脂质载体(CBD-NLC),经单因素实验分析磷脂与胆固醇质量比、CBD广谱油的质量浓度、缓冲溶液pH、旋蒸温度、超声时间对CBD-NLC包封率的影响,并通过响应面试验对影响较大的4个因素进行优化,确定制备CBD-NLC的最佳工艺。结果表明,最佳制备工艺为磷脂与胆固醇质量比3.4:1、CBD广谱油的质量浓度9.5%、缓冲溶液的pH7.3、旋蒸温度39.1 ℃、超声时间30 min。在此制备工艺条件下,CBD-NLC包封率为(91.3%±0.37%),平均粒径为(94.0±0.4)nm,分散性指数PDI为(0.213±0.017),Zeta电位为(−45.0±0.8)mV。CBD-NLC悬浊液色泽为淡黄色,分散均一性和稳定性好,为后续CBD广谱油的深度开发和应用奠定基础。Abstract: CBD-NLC was prepared by film ultrasonic method with soybean phospholipid and cholesterol as solid esters. The effects of mass ratio of phospholipid to cholesterol, mass concentration of CBD broad-spectrum oil, pH value of buffer solution, rotary evaporation temperature and ultrasonic time on the encapsulation efficiency of CBD-NLC were analyzed by single factor experiment, The four factors which have great influence on the preparation of CBD-NLC were optimized by response surface test. The results showed that the optimum preparation conditions were as follows: the mass ratio of phospholipid to cholesterol was 3.4:1, the mass concentration of CBD broad-spectrum oil was 9.5%, the pH of buffer solution was 7.3, the rotary evaporation temperature was 39.1 ℃, and the ultrasonic time was 30 min. The results showed that the encapsulation efficiency of CBD-NLC was (91.3%±0.37%), the particle size was (94.0±0.4) nm, the PDI was (0.213±0.017), the zeta potential was (−45.0±0.8) mV. The color of CBD-NLC suspension is light yellow, with good dispersion uniformity and stability, which lays a foundation for the further development and application of CBD broad-spectrum oil.
-
大麻二酚(Cannabidiol, CBD),分子式C21H30O2,几乎不溶于水,溶于乙醇、甲醇、乙醚、苯、石油醚等有机溶剂。具有神经保护、抗痉挛、抗焦虑等多种生物活性,食用含有CBD的食品能给人带来愉悦感[1-2]。由于大麻二酚在中枢神经系统中具有多种潜在的作用靶点,因此CBD可用于神经系统疾病如癫痫、帕金森病、多发性硬化症及其他神经系统疾病的治疗[3-4]。近年来的研究表明,CBD还具有杀菌抗炎、镇痛、抗氧化、改善学习记忆等作用,在药品、食品、保健品和化妆品等领域具有广阔的开发应用前景[5-6]。随着CBD的价值逐渐被开发,各国对大麻政策逐渐放宽,目前全球已有3个国家(乌拉圭、加拿大和美国的部分州)将大麻合法化,超过50个国家宣布CBD合法[7]。我国也允许在云南和黑龙江两省合法种植工业大麻,规定药用大麻(CBD含量高)和工业大麻(CBD含量低)中四氢大麻酚含量低于0.3%即合法[8]。随着CBD研究的深入和相关产品的研发,未来在中国市场出现的可能性极大。
世界范围内已经开展多项有关CBD的临床研究,研究方向偏向治疗神经系统疾病,抗癫痫及镇痛抗炎等药理方面[9]。国外市场已经出现CBD饼干、CBD巧克力、CBD糖果等食品以及CBD保健油、CBD胶囊、CBD糖浆等保健品[10-11]。国内对于CBD的研究偏向于其功效[12]、提取[13]和检测方面[14]。大麻二酚(CBD)广谱油是一种将全谱油CBD中的致幻成分四氢大麻酚去除后的固态油状物质,成分主要为CBD,占CBD广谱油含量的56%;其余成分为大麻萜酚和大麻环萜酚。CBD广谱油因其不溶水性往往使其应用范围有所限制,可能是结构中含有苯酚易被空气中的氧气氧化为苯醌的缘故,又存在易氧化、稳定性较差等缺点,难以有效发挥其生理功效[15]。纳米脂质载体为包埋、改善溶解性提供了良好的载体体系[16],可以解决CBD广谱油不溶水性的问题,还能使CBD不易被氧化,提高其稳定性和生物利用率[17]。目前国内外对制备CBD广谱油纳米脂质载体方面的研究未见报道。
油脂类纳米脂质载体的制备方法主要有乙醇注入法、薄膜-超声法、超声法、熔融乳化-超声法等。同其他制备方法相比,薄膜-超声法具备成本低,制备的脂质体形状大小均匀等优点[18]。葛彦[19]利用薄膜-超声法以磷脂和胆固醇为固体酯成功制备了茶树精油纳米脂质体,包封率达到(97.81%±0.33%)。因此本研究采用薄膜-超声法,以具有极性的磷脂,同时掺入起调节膜中磷脂凝聚结构作用的胆固醇作为固体酯,对大麻二酚(CBD)广谱油进行包埋,以包封率为评价指标制备CBD-NLC,并用响应面法优化CBD-NLC的制备工艺,以期为后续CBD广谱油的深度开发和应用奠定基础。
1. 材料与方法
1.1 材料与仪器
CBD广谱油 哈尔滨汉博科技开发有限公司;CBD标准溶液(1.0 mg/mL in methanol) 武汉中昌国标物科技有限公司;辛癸酸甘油酯、大豆卵磷脂、胆固醇 山东优索化工科技有限公司;其他试剂均为分析纯。
PHS-3G型pH计量仪 上海仪电科学仪器股份有限公司;Agilent1260高效液相色谱仪 安捷伦科技有限公司;AUY220电子天平 SHIMADZU/日本岛津;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;HWS-26型电热恒温水浴锅 济南启科仪器设备有限公司;WB-2000旋转蒸发器 上海力辰邦西仪器科技有限公司;SHZ-D(Ⅲ)循环水式多用真空泵 郑州长城科工贸有限公司;Zetasizer NanoZS90激光粒度测定仪 英国Malvern公司。
1.2 实验方法
1.2.1 CBD-NLC的制备
方法参考文献[20],称取不同质量比的磷脂和胆固醇于烧杯中,保证磷脂和胆固醇固体酯的总量为100 mg,将占总脂相不同比例的CBD广谱油加入其中,再加入200 mL石油醚,进行超声溶解(250 W,20 min),将溶解后的溶液倒入100 mL的圆底烧瓶中,再置于旋转蒸发仪上,转速设置为20 r/min,再旋转蒸发除去石油醚,圆底烧瓶内壁形成一层脂质薄膜,再加入30 mL不同pH的磷酸盐缓冲溶液,使用同样的旋蒸条件洗脱薄膜,得到初脂质体;将初脂质体转移到烧杯中以250 W功率继续超声一定时间后,静置2 h,即得纳米脂质载体。
1.2.2 单因素实验
1.2.2.1 磷脂与胆固醇质量比对CBD-NLC包封率的影响
参考葛彦[19]以薄膜水化超声法制备茶树精油纳米脂质体的磷脂与胆固醇质量比。选择占总脂相比5%的CBD广谱油,旋转蒸发温度40 ℃,磷酸盐缓冲溶液pH7.2,超声时间20 min条件。选取磷脂与胆固醇质量比1:1、2:1、3:1、4:1、5:1、6:1探究对CBD-NLC包封率的影响。
1.2.2.2 CBD广谱油的质量浓度对CBD-NLC包封率的影响
参考林云伟[18]以超声法制备南极磷虾油基纳米结构脂质载体的磷虾油占总脂相比。选择磷脂与胆固醇质量比3:1,旋转蒸发温度40 ℃,磷酸盐缓冲溶液pH7.2,超声时间20 min条件。选取CBD广谱油的质量浓度5%、10%、15%、20%、25%、30%探究CBD广谱油的质量浓度对CBD-NLC包封率的影响。
1.2.2.3 缓冲溶液pH对CBD-NLC包封率的影响
参考任惠丽[20]利用薄膜超声法制备三丁酸甘油酯纳米脂质体缓冲溶液PBS的pH。选择磷脂与胆固醇质量比3:1,旋转蒸发温度40 ℃,占总脂相比10%的CBD广谱油,超声时间20 min条件。选取缓冲溶液的pH6.0、6.4、6.8、7.2、7.6、8.0、8.4探究缓冲溶液的pH对CBD-NLC包封率的影响。
1.2.2.4 旋蒸温度对CBD-NLC包封率的影响
参考杨芳[21]利用薄膜分散法结合动态高压微射流技术制备樟树籽油脂质体的旋转蒸发温度。选择磷脂与胆固醇质量比3:1,磷酸盐缓冲溶液pH7.2,占总脂相比10%的CBD广谱油,超声时间20 min条件。选取旋蒸温度20、30、40、50、60 ℃探究旋蒸温度对CBD-NLC包封率的影响。
1.2.2.5 超声时间对CBD-NLC包封率的影响
参考KAROLLINE等[22]制备西番莲籽油纳米结构脂质载体的超声时间。选择磷脂与胆固醇质量比3:1,磷酸盐缓冲溶液pH7.2,占总脂相比10%的CBD广谱油,旋转蒸发温度40 ℃条件。选取超声时间10、20、30、40、50、60 min探究超声时间对CBD-NLC包封率的影响。
1.2.3 响应面试验
参考文献[23-25],在单因素设计的基础上,以CBD广谱油纳米脂质载体包封率(Y)为响应值,选取磷脂与胆固醇质量比(A)、CBD广谱油的质量浓度(B)、缓冲溶液pH(C)和旋蒸温度(D)这四种影响较大的因素为自变量,采用4因素3水平响应面试验设计,以确定CBD广谱油纳米脂质载体制备的最佳工艺(见表1)。
表 1 响应面试验设计因素与水平Table 1. Design factors and levels of response surface test水平 因素 A 磷脂和胆固醇
质量比B CBD广谱油
浓度(%)C 缓冲溶液
pHD 旋蒸温
度(℃)−1 2:1 5 6.8 30 0 3:1 10 7.2 40 1 4:1 15 7.6 50 1.2.4 CBD-NLC包封率的计算
1.2.4.1 标准曲线的制作
以CBD广谱油中的主要成分CBD作为指标,利用高效液相色谱测定CBD含量。用甲醇配制浓度为20、40、60、80、100 μg/mL的CBD标准溶液,在波长为220 nm处进样分析并绘制标准曲线[26]。在波长220 nm下,各大麻素出峰时间不同,可以实现CBD和其他大麻素的分离[27-28]。
1.2.4.2 CBD-NLC包封率的计算
采用有机溶剂萃取法[29]测定CBD-NLC的包封率。制备前,记录加入CBD广谱油的含量m1,制备后,将CBD-NLC用缓冲溶液定容到50 mL容量瓶中,取其中10 mL加入20 mL正己烷,3次萃取游离的CBD,将上层有机相合并置于烧杯中并用氮气吹出正己烷,再用甲醇定容于10 mL容量瓶中进入高效液相色谱分析,在波长为220 nm处测定其峰面积以确定游离CBD含量m2,利用以下公式计算包封率。
CBD−NLC的包封率(%)=m1−m256% m1×100 (1) 式中:m1表示最初加入的CBD广谱油的质量,mg;m2表示制备脂质体后游离CBD质量,mg;56%表示CBD占CBD广谱油的含量百分比。
m2=c×v (2) 式中:c表示由液相色谱峰面积值带入CBD标曲后得到的游离CBD的浓度,mg/mL;v表示用缓冲溶液定容后CBD-NLC的体积,mL。
1.2.5 液相色谱条件
1.2.5.1 磷酸缓冲溶液的配制
分别配制A液(取6.8 g磷酸二氢钾,用蒸馏水定溶于500 mL容量瓶中)、B液(取6.8 g磷酸氢二钠,用蒸馏水定溶于500 mL容量瓶中),通过不同的混合比例配置pH为6.0、6.4、6.8、7.2、7.6、8.0、8.4的缓冲溶液。
1.2.5.2 色谱条件
参照文献[26],色谱柱:Agilent ZORBAX Eclipse Plus C18色谱柱;流动相:V(乙腈)∶V(KH2PO4)=75:25,其中,KH2PO4的pH为4.0;流速:1.0 mL/min;柱温:25 ℃;进样量:10 μL;等度洗脱;检测波长为220 nm。
1.2.5.3 CBD标准曲线的绘制
以浓度为20、40、60、80、100 μg/mL绘制的CBD标准曲线回归方程为y=170.77x+423.44,R2=0.9996,CBD广谱油在50~250 μg/mL范围内线性关系良好。
1.2.6 CBD-NLC粒径、PDI、Zeta电位的测定
用移液管取1 mL以最佳工艺条件制备好的CBD-NLC样品于样品池中,用Zetasizer Nano ZS90激光粒度测定仪检测其在室温时的粒径Size、分散系数PDI和Zeta电位值;每个样品测量三次取平均值。
1.3 数据处理
所得数据均为三次重复试验的平均值±标准差,利用SPSS进行单因素方差分析,采用Design Expert 8.0.6进行响应面优化试验设计,利用Origin 2018绘图。
2. 结果与分析
2.1 单因素实验
2.1.1 磷脂和胆固醇质量比对CBD-NLC包封率的影响
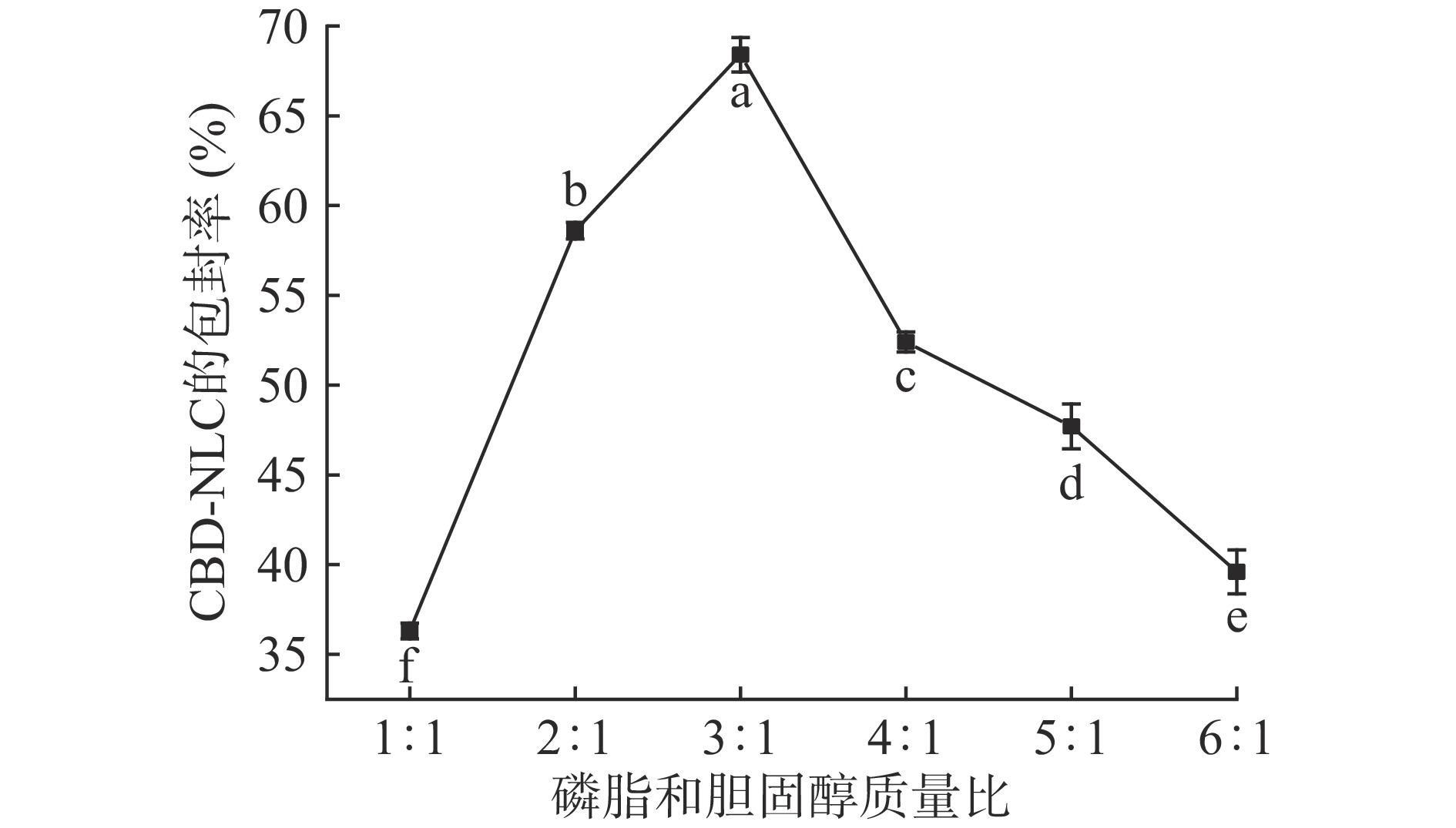
磷脂和胆固醇质量比对CBD-NLC包封率的影响结果见图1。
由图1可知,随着磷脂和胆固醇质量比的增大,CBD-NLC包封率先增大后减小。磷脂和胆固醇质量比小于3:1时,随着磷脂和胆固醇质量比的增加,包封率逐渐增大,可能是因为随着磷脂的增加,磷脂中更多的疏水基团可以很好地覆盖在油滴表面将其包裹[30],从而导致包封率增大,磷脂和胆固醇质量比为3:1时,CBD-NLC包封率达到最大值,为(68.4%±0.96%),磷脂和胆固醇质量比大于3:1时,磷脂含量达到一定程度后,随着磷脂和胆固醇质量比的增加,磷脂的疏水基团和CBD广谱油的结合达到饱和,导致包裹的油脂和磷脂出现聚集现象[31],包封率反而逐渐减小,且胆固醇是类脂膜的重要组分[32],磷脂和胆固醇质量比过大,固醇含量较少,脂质体成膜困难,包封率减小。由SPSS软件单因素方差分析可知,磷脂和胆固醇质量比的影响都存在显著差异(P<0.05)。因此,磷脂和胆固醇质量比3∶1为单因素最优实验条件,选择质量比2:1~4:1作为响应面优化试验条件。
2.1.2 CBD广谱油质量浓度对CBD-NLC包封率的影响
CBD广谱油质量浓度对CBD-NLC包封率的影响结果见图2。
由图2可知,随着CBD广谱油质量浓度的增加,CBD-NLC的包封率先增大后减小。包封率增大的原因是液体脂比较少时,纳米结构脂质载体刚性较强,不能起到良好的包埋作用[33];在质量浓度为10%时,CBD-NLC包封率达到最大值,为(81.3%±1.13%),质量浓度大于10%后,包封率逐渐减少,可能是因为随着液体脂的增加,体系粘度增加,纳米结构脂质载体刚性变弱,相互作用力变小,固体脂对液体脂的包埋能力减小,从而导致包封率逐渐减少[34]。由SPSS软件单因素方差分析可知,CBD广谱油质量浓度为5%、10%、15%、20%和30%时存在显著性差异(P<0.05),质量浓度为20%和25%差异不显著(P>0.05),质量浓度为25%和30%差异不显著(P>0.05)。因此,选择CBD广谱油质量浓度10%作为单因素最优实验条件,选择质量浓度为5%~15%作为响应面优化试验条件。
2.1.3 缓冲溶液pH对CBD-NLC包封率的影响
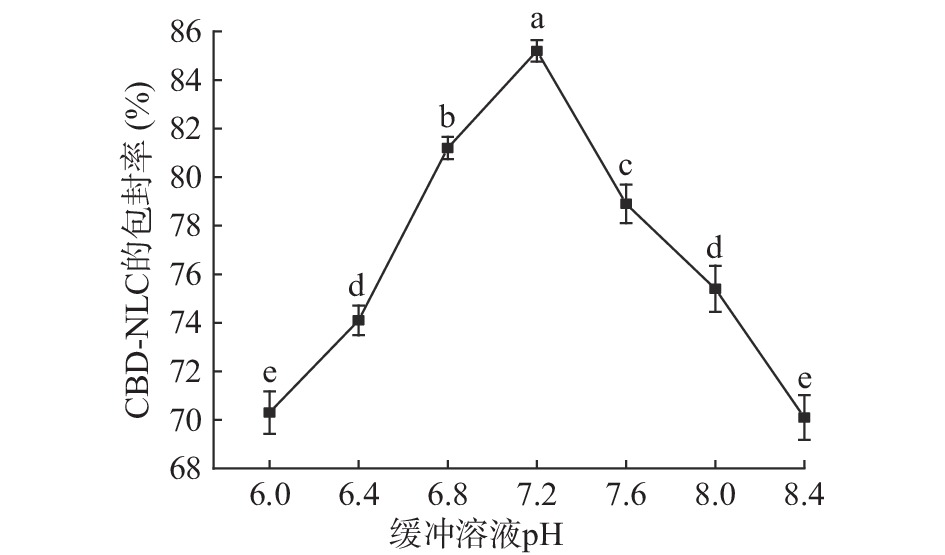
缓冲溶液pH对CBD-NLC包封率的影响结果见图3。
由图3可知,随着缓冲溶液pH的增大,包封率先增大后减小。在pH为7.2时,CBD-NLC包封率达到最大值,为(85.2%±0.44%)。原因是磷脂分子的头部亲水端为磷脂酰胆碱,既有带正电的胆碱部分,还有带负电的磷脂酰部分,同时还存在磷酸酯基等带有不同极性头部的杂质分子[19],这些极性电荷的数量随pH的变化而变化,也代表了脂质体对水化介质中离子吸附能力的强弱,若磷脂-胆固醇薄膜吸附电荷过多,脂质体会发生聚沉,从而降低包封率[35]。由SPSS软件单因素方差分析可知,缓冲溶液pH为6.4、6.8、7.2、7.6和8.4时存在显著性差异(P<0.05),pH为6.0和8.4差异不显著(P>0.05),pH为6.4和8.0差异不显著(P>0.05)。因此,选择缓冲溶液pH7.2作为单因素最优实验条件,选择缓冲溶液pH6.8~7.6作为响应面优化试验条件。
2.1.4 旋蒸温度对CBD-NLC包封率的影响
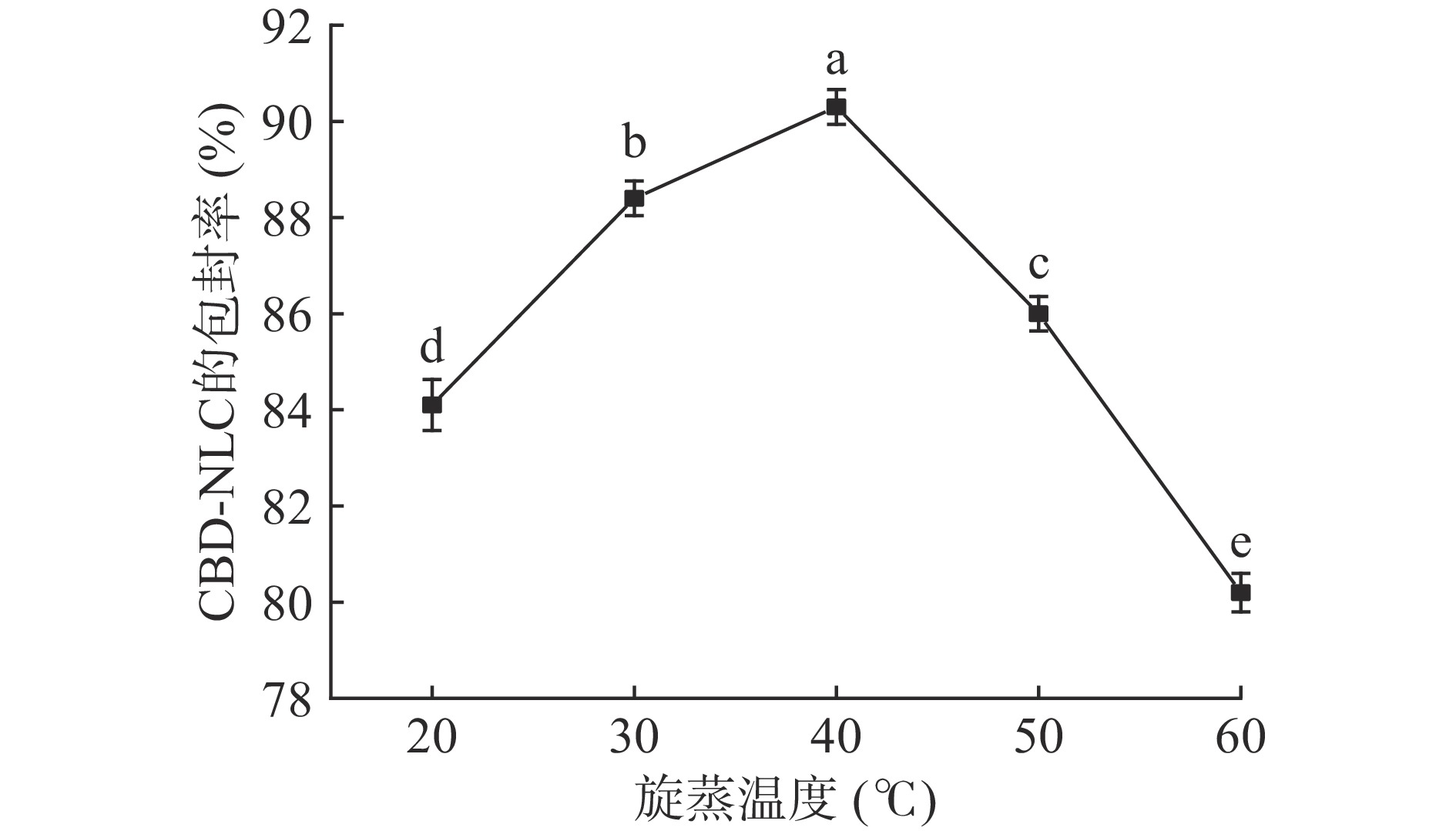
旋蒸温度对CBD-NLC包封率的影响结果见图4。
由图4可知,随着旋蒸温度的增加,CBD-NLC包封率同样是先增大后减小。旋蒸温度与脂质体膜的物理性质密切相关,温度过低,脂质体成膜速度缓慢,制备的薄膜致密性差且易泄露,从而导致包封率低[36],在40 ℃时达到最大,为(90.3%±0.36%)。但温度过高,磷脂氧化加速,脂质体膜的渗透性变强,CBD广谱油从薄膜中流失,反而使包封率降低[21]。由SPSS软件单因素方差分析可知,旋蒸温度的影响都存在显著性差异(P<0.05)。因此,选择旋蒸温度40 ℃作为单因素最优实验条件,选择旋蒸温度为30~50 ℃作为响应面优化试验条件。
2.1.5 超声时间对CBD-NLC包封率的影响
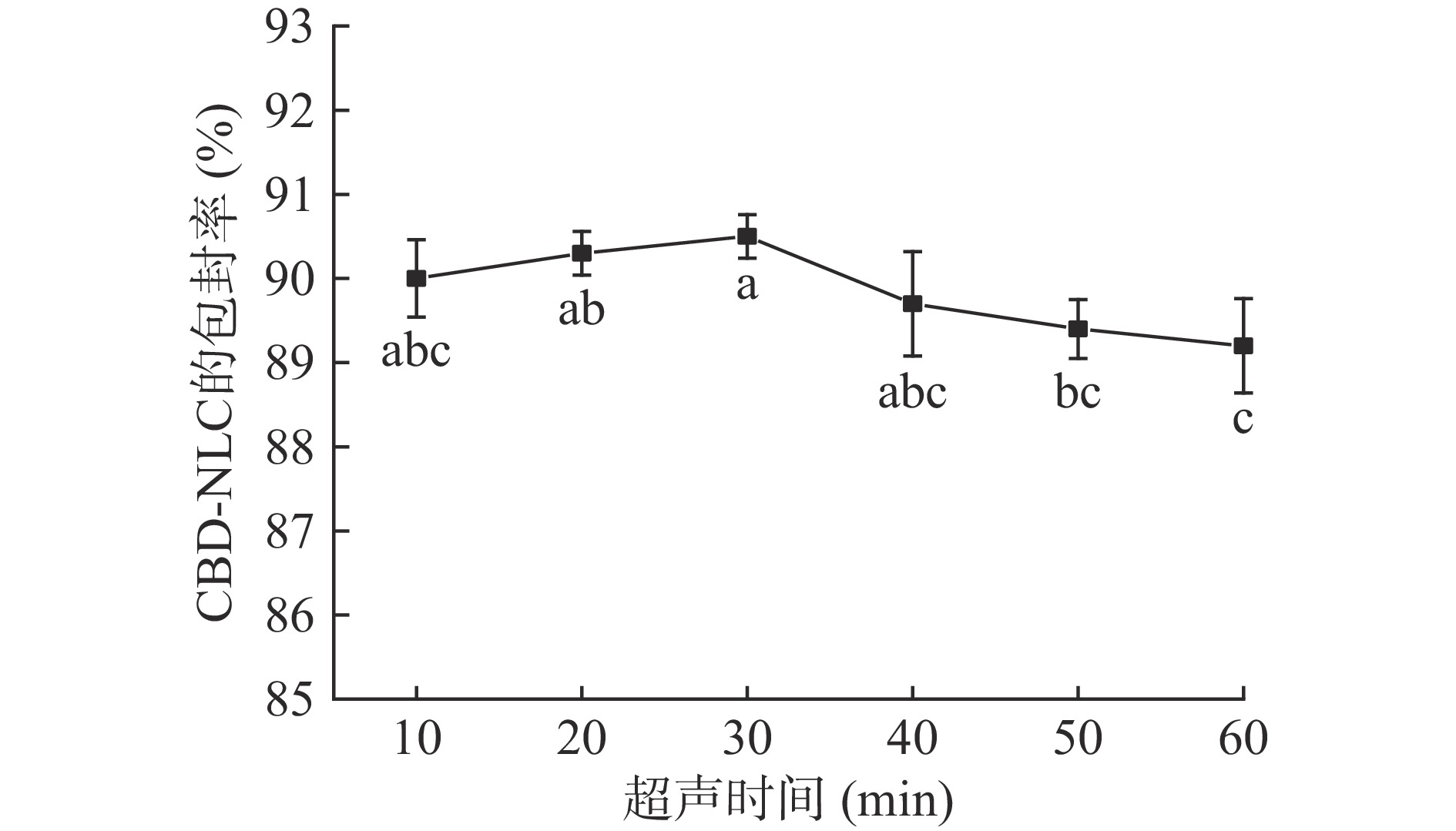
超声时间对CBD-NLC包封率的影响结果见图5。
由图5可知,随着超声时间的增加,CBD-NLC包封率同样是先增大后减小,但变化不大,最小值和最大值只相差1.4%,超声时间30 min,包封率最大为(90.5%±0.26%)。由SPSS软件单因素方差分析可知,超声时间为30 min分别和50、60 min时存在显著性差异(P<0.05),超声时间为20 min和60 min时存在显著性差异(P<0.05),其余差异均不显著(P>0.05)。因此,选择超声时间30 min作为单因素最优实验条件,不选择超声时间作为响应面优化试验条件。
2.2 CBD-NLC的制备响应面优化试验
根据单因素实验结果,选择影响较大的4个因素磷脂和胆固醇质量比(A)、CBD广谱油质量浓度(B)、缓冲溶液pH(C)、旋蒸温度(D)进行4因素3水平的响应面试验设计,试验结果见表2。
表 2 响应面试验设计及结果Table 2. Response surface test design and results实验号 因素 包封率(%) A B C D Y 1 −1 0 −1 0 83.2 2 0 1 0 −1 80.3 3 1 −1 0 0 82.9 4 0 1 0 1 81.4 5 1 0 1 0 92.0 6 0 −1 1 0 84.8 7 1 1 0 0 81.6 8 −1 0 1 0 85.2 9 0 0 −1 1 87.8 10 1 0 0 −1 89.1 11 1 0 −1 0 90.7 12 0 1 −1 0 80.0 13 0 0 0 0 92.3 14 1 0 0 1 90.1 15 0 0 0 0 90.6 16 0 −1 0 1 83.4 17 −1 −1 0 0 84.2 18 0 0 0 0 91.8 19 0 −1 0 −1 84.4 20 −1 1 0 0 81.1 21 0 0 0 0 92.1 22 0 0 −1 −1 87.9 23 −1 0 0 −1 87.4 24 0 0 1 1 85.7 25 0 0 1 −1 89.9 26 0 1 1 0 81.2 27 −1 0 0 1 86.5 28 0 0 0 0 90.4 29 0 −1 −1 0 83.8 对表2试验数据进行二次多项回归拟合,获得CBD-NLC包封率(Y)的综合评分对磷脂和胆固醇质量比(A)、CBD广谱油质量浓度(B)、缓冲溶液pH(C)、旋蒸温度(D)的多元回归方程为:
Y=91.44+1.57A−1.49B+0.45C−0.34D+0.45AB−0.18AC+0.48AD+0.05BC+0.53BD−1.02CD−1.66A2−7.27B2−1.89C2−1.67D2。
该模型的方差分析见表3。
表 3 回归模型方差分析Table 3. Analysis of variance of regression model变异源 平方和 自由度 均方 F值 P 显著性 模型 412.65 14 29.47 10.81 <0.0001 ** A 29.45 1 29.45 10.80 0.0054 ** B 26.70 1 26.70 9.79 0.0074 ** C 2.43 1 2.43 0.89 0.3612 D 1.40 1 1.40 0.51 0.4853 AB 0.81 1 0.81 0.30 0.5943 AC 0.12 1 0.12 0.045 0.8352 AD 0.90 1 0.90 0.33 0.5742 BC 0.01 1 0.01 3.668E-003 0.9526 BD 1.10 1 1.10 0.40 0.5351 CD 4.20 1 4.20 1.54 0.2348 A2 17.91 1 17.91 6.57 0.0225 * B2 343.22 1 343.22 125.88 <0.0001 ** C2 23.09 1 23.09 8.47 0.0114 * D2 18.18 1 18.18 6.67 0.0217 * 残差误差 38.17 14 2.73 失拟项 35.08 10 3.51 4.54 0.0790 纯误差 3.09 4 0.77 总和 450.82 28 R2=0.9153 RAdj2=0.8307 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。 由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),模型决定系数R2=0.9153,结果说明模型具有较高拟合度和相关性,模型的实验预测值能够很好的反映实际值,达到对CBD-NLC包封率进行分析和预测[37-38]。一次项A、B及二次项B2对结果的影响达到极显著水平(P<0.01),二次项A2、C2、D2对结果的影响达到显著水平(P<0.05)。各因素对CBD-NLC包封率的影响顺序分别是:磷脂和胆固醇质量比(A)>CBD广谱油质量浓度(B)>缓冲溶液pH(C)>旋蒸温度(D)。
各因素对CBD-NLC的包封率交互作用结果如图6所示。
图6反映了各两因素的交互关系,等高线图中的因素AB、BD、CD等高线趋于椭圆形,说明因素AB、BD、CD交互作用对CBD-NLC包封率的交互影响程度相对其他各两因素较强,因素AC、AD、BC等高线趋于圆形,说明对CBD-NLC包封率的交互影响程度较弱,与方差分析的结果保持一致。模型预测的最佳工艺条件为:磷脂与胆固醇质量比3.4:1、CBD广谱油的质量浓度9.5%、缓冲溶液的pH7.3、旋蒸温度39.1 ℃、超声时间30 min,所得CBD-NLC包封率为91.9%,高于单因素实验的最大值。由此证明,应用响应面法优化CBD广谱油纳米脂质体的制备工艺较为理想。
2.3 最佳工艺条件试验验证
为验证回归模型最佳工艺条件预测值与试验真实值之间的拟合程度,选择预测的最佳工艺条件进行试验验证。将因素选定为磷脂与胆固醇质量比3.4:1、CBD广谱油的质量浓度9.5%、缓冲溶液的pH7.3、旋蒸温度39.1 ℃、超声时间30 min,进行3组平行试验,得出CBD-NLC包封率为(91.3%±0.37%),本次试验与回归模型预测值(91.9%)之间的相对误差为0.65%。因此用回归模型和响应面法优化得到的制备CBD-NLC的最佳工艺条件的回归模型是符合实际的,制备的CBD-NLC悬浊液色泽为淡黄色,可以溶于水相,包封率大于90%,较其他学者采用薄膜-超声法制备的纳米脂质载体相比,包封率相对较高,对今后制备CBD-NLC条件的选择具有一定的指导意义。
2.4 CBD-NLC粒径、PDI、Zeta电位的测定
选择最佳工艺条件,进行3组平行试验,得到CBD-NLC平均粒径为(94.0±0.4)nm,粒径符合小单层囊泡脂质体尺度要求(20~100 nm)[19];研究表明PDI越小,体系分散均一性越好,CBD-NLC的PDI为(0.213±0.017),体系的分散均一性好;体系能够稳定存在所需的Zeta电位至少是±30 mV,结合静电斥力和空间位阻的情况,电位±20 mV是保证微粒稳定存在而不聚集的最低界限[39],CBD-NLC的Zeta电位为(−45.0±0.8)mV,体系稳定性好。
3. 结论
本研究采用薄膜-超声法制备CBD广谱油纳米脂质载体,得到最佳制备工艺为磷脂与胆固醇质量比3.4:1、CBD广谱油的质量浓度9.5%、缓冲溶液的pH7.3、旋蒸温度39.1 ℃、超声时间30 min。在此制备工艺条件下,CBD广谱油纳米脂质体包封率为(91.3%±0.37%),较其他学者采用薄膜-超声法制备的纳米脂质载体相比,包封率较高,脂质体质量较好。CBD-NLC悬浊液色泽为淡黄色,可以溶于水相,粒径为(94.0±0.4)nm,粒径符合小单层囊泡脂质体的尺度要求(20~100 nm),PDI为(0.213±0.017),Zeta电位为(−45.0±0.8)mV,整个CBD广谱油纳米脂质载体体系具有良好的分散均一性和稳定性。CBD广谱油纳米脂质载体的制备为后续CBD广谱油的深度开发和应用奠定基础,推动CBD食品、药品、保健品等相关产品的开发。但本研究未将CBD-NLC实际应用于食品中,未研究CBD-NLC在动物试验中大麻二酚CBD的功能特性,缺乏实践性,望今后的研究能够深入解决这个问题。
-
表 1 响应面试验设计因素与水平
Table 1 Design factors and levels of response surface test
水平 因素 A 磷脂和胆固醇
质量比B CBD广谱油
浓度(%)C 缓冲溶液
pHD 旋蒸温
度(℃)−1 2:1 5 6.8 30 0 3:1 10 7.2 40 1 4:1 15 7.6 50 表 2 响应面试验设计及结果
Table 2 Response surface test design and results
实验号 因素 包封率(%) A B C D Y 1 −1 0 −1 0 83.2 2 0 1 0 −1 80.3 3 1 −1 0 0 82.9 4 0 1 0 1 81.4 5 1 0 1 0 92.0 6 0 −1 1 0 84.8 7 1 1 0 0 81.6 8 −1 0 1 0 85.2 9 0 0 −1 1 87.8 10 1 0 0 −1 89.1 11 1 0 −1 0 90.7 12 0 1 −1 0 80.0 13 0 0 0 0 92.3 14 1 0 0 1 90.1 15 0 0 0 0 90.6 16 0 −1 0 1 83.4 17 −1 −1 0 0 84.2 18 0 0 0 0 91.8 19 0 −1 0 −1 84.4 20 −1 1 0 0 81.1 21 0 0 0 0 92.1 22 0 0 −1 −1 87.9 23 −1 0 0 −1 87.4 24 0 0 1 1 85.7 25 0 0 1 −1 89.9 26 0 1 1 0 81.2 27 −1 0 0 1 86.5 28 0 0 0 0 90.4 29 0 −1 −1 0 83.8 表 3 回归模型方差分析
Table 3 Analysis of variance of regression model
变异源 平方和 自由度 均方 F值 P 显著性 模型 412.65 14 29.47 10.81 <0.0001 ** A 29.45 1 29.45 10.80 0.0054 ** B 26.70 1 26.70 9.79 0.0074 ** C 2.43 1 2.43 0.89 0.3612 D 1.40 1 1.40 0.51 0.4853 AB 0.81 1 0.81 0.30 0.5943 AC 0.12 1 0.12 0.045 0.8352 AD 0.90 1 0.90 0.33 0.5742 BC 0.01 1 0.01 3.668E-003 0.9526 BD 1.10 1 1.10 0.40 0.5351 CD 4.20 1 4.20 1.54 0.2348 A2 17.91 1 17.91 6.57 0.0225 * B2 343.22 1 343.22 125.88 <0.0001 ** C2 23.09 1 23.09 8.47 0.0114 * D2 18.18 1 18.18 6.67 0.0217 * 残差误差 38.17 14 2.73 失拟项 35.08 10 3.51 4.54 0.0790 纯误差 3.09 4 0.77 总和 450.82 28 R2=0.9153 RAdj2=0.8307 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。 -
[1] 孔剑梅, 沈琰. 工业大麻花叶提取大麻二酚工艺技术综述[J]. 云南化工,2019,46(8):1−4. [KONG J M, SHEN Y. Review on extraction technology of cannabinol from industrial hemp leaves[J]. Yunnan Chemical Industry,2019,46(8):1−4. doi: 10.3969/j.issn.1004-275X.2019.08.001 [2] BURSTEIN S. Cannabidiol(CBD) and its analogs: A review of their effects on inflammation[J]. Bioorganic and Medicinal Chemistry,2015,23(7):1377−1385. doi: 10.1016/j.bmc.2015.01.059
[3] BRIDGEMAN M B, ABAZIA D T. Medicinal cannabis: History, pharmacology, and implications for the acute care setting[J]. A Peer-Reviewed Journal for Formulary Management,2017,42(3):180−188.
[4] 吴军, 于海波. 大麻二酚在神经精神疾病中的作用与分子机制研究进展[J]. 药学学报,2020,55(12):2800−2810. [WU J, YU H B. Research progress on the role and molecular mechanism of cannabinol in neuropsychiatric diseases[J]. Journal of Pharmacy,2020,55(12):2800−2810. [5] 郭蓉, 陈璇, 郭鸿彦. 四氢大麻酚和大麻二酚的药理研究进展[J]. 天然产物研究与开发,2017,29(8):1449−1453. [GUO R, CHEN X, GUO H Y. Pharmacological research progress of tetrahydrocannabinol and cannabinol[J]. Research and Development of Natural Products,2017,29(8):1449−1453. [6] MECHOULAM R, PETERS M, MURILLO R E, et al. Cannabidiol-recent advances[J]. Chemistry and Biodiversity,2007,4(8):1678−1692. doi: 10.1002/cbdv.200790147
[7] 蒋鸿雁, 张瑞林, 曹艳, 等. 大麻二酚在医学上的应用前景[J]. 昆明医科大学学报,2021,42(2):147−152. [JIANG H Y, ZHANG R L, CAO Y, et al. Application prospect of cannabinoid in medicine[J]. Journal of Kunming Medical University,2021,42(2):147−152. [8] 张际庆, 陈士林, 尉广飞, 等. 高大麻二酚(CBD)含量药用大麻的新品种选育及生产[J]. 中国中药杂志,2019,44(21):4772−4780. [ZHANG J Q, CHEN S L, WEI G F, et al. Breeding and production of new varieties of medicinal marijuana with high content of bisphenol(CBD)[J]. Chinese Journal of Traditional Chinese Medicine,2019,44(21):4772−4780. [9] 宁康, 董林林, 李孟芝, 等. 非精神活性药用大麻的应用及开发[J]. 中国实验方剂学杂志,2020,26(8):228−240. [NING K, DONG L L, LI M Z, et al. Application and development of non psychoactive medicinal hemp[J]. Chinese Journal of Experimental Prescriptions,2020,26(8):228−240. [10] SUNDAY A M, ROTIMI E A. A comparative study of the structural and functional properties of isolated hemp seed(Cannabis sativa L.) albumin and globulin fractions[J]. Food Hydrocolloids,2015,43:743−752. doi: 10.1016/j.foodhyd.2014.08.001
[11] 魏承厚, 牛德宝, 任二芳, 等. 火麻仁的产品开发与综合利用进展研究[J]. 食品工业,2019,40(2):267−270. [WEI C G, NIU D B, REN E F, et al. Research on product development and comprehensive utilization of hemp seed[J]. Food Industry,2019,40(2):267−270. [12] 王语聪, 谢智鑫, 杨文敏, 等. 汉麻叶中大麻二酚的分离纯化及其抗抑郁功能[J]. 精细化工, 2021, 38(4): 795−800,805. WANG Y C, XIE Z X, YANG W M, et al. Separation and purification of cannabinoid from hemp leaves and its antidepressant function [J]. Fine Chemical Industry, 2021, 38(4): 795−800,805.
[13] 高哲, 张志军, 李晓君, 等. 火麻叶中大麻二酚的热回流法提取工艺研究[J]. 中国油脂,2019,44(3):107−111. [GAO Z, ZHANG Z J, LI X J, et al. Study on the extraction process of cannabinol from hemp leaves by thermal reflux[J]. China Oil,2019,44(3):107−111. [14] 周莹, 陈念念, 韩丽, 等. UPLC-MS/MS同时测定四种食品基质中痕量四氢大麻酚、大麻二酚和大麻酚[J]. 现代食品科技, 2019, 35(12): 315−321, 301. ZHOU Y, CHEN N N, HAN L, et al. Simultaneous determination of trace tetrahydrocannabinol, cannabidiol and cannabinol in four food matrices by UPLC-MS/MS[J]. Modern Food Science and Technology, 2019, 35(12): 315−321, 301.
[15] AMIN M R, ALI D W. Pharmacology of medical cannabis[J]. Advances in Experimental Medicine and Biology,2019,1162(5):151−165.
[16] 高艺敏, 张震, 陈佩敏, 等. 乳化挥发法和薄膜-超声法制备阿魏酸固体脂质纳米粒工艺比较[J]. 食品与发酵工业,2019,45(6):127−132. [GAO Y M, ZHANG Z, CHEN P M, et al. Comparison of preparation processes of ferulic acid solid lipid nanoparticles by emulsion evaporation method and film ultrasonic method[J]. Food and Fermentation Industry,2019,45(6):127−132. [17] CHEE C C, ZAFARIZAL A B, SIAW K C, et al. Formulation and characterization of novel nanostructured lipid carriers with photoprotective properties made from carnauba wax, beeswax, pumpkin seed oil, and UV filters[J]. Journal of the American Oil Chemists' Society,2020,97(5):531−542. doi: 10.1002/aocs.12340
[18] 林云伟. 南极磷虾油基纳米结构脂质载体的制备及性质研究[D]. 广州: 华南理工大学, 2020. LIN Y W. Preparation and properties of Antarctic krill oil-based nanostructured lipid carriers[D]. Guangzhou: South China University of Technology, 2020.
[19] 葛彦. 茶树精油脂质体/壳聚糖缓释抗菌材料的制备及性能研究[D]. 无锡: 江南大学, 2015. GE Y. Preparation and properties of tea tree essential oil liposome/chitosan sustained-release antibacterial material[D]. Wuxi: Jiangnan University, 2015.
[20] 任惠丽. 三丁酸甘油酯纳米脂质体的制备及其性质研究[D]. 郑州: 河南工业大学, 2017. REN H L. Preparation and properties of triglyceride nanoliposomes[D]. Zhengzhou: Henan University of Technology, 2017.
[21] 杨芳. 樟树籽油纳米脂质体制备工艺及其性质的研究[D]. 南昌: 南昌大学, 2013. YANG F. Study on preparation technology and properties of camphor seed oil nano lipids[D]. Nanchang: Nanchang University, 2013.
[22] KAROLLINE K, VERA S, RENATA S, et al. Design and characterization of nanostructured lipid carriers(NLC) and nanostructured lipid carrier-based hydrogels containing Passiflora edulis seeds oil[J]. International Journal of Pharmaceutics,2021,600:120444. doi: 10.1016/j.ijpharm.2021.120444
[23] DANIEL J L, RUSSELL G, DALE S. An experimental methodology for response surface optimization methods[J]. Journal of Global Optimization,2012,53(4):699−736. doi: 10.1007/s10898-011-9732-z
[24] 梁浩, 钱玺丞, 杜晓静, 等. 响应面优化羟丙基-β-环糊精对血根碱的包合工艺[J]. 食品工业科技,2020,41(18):182−186. [LIANG H, QIAN X C, DU X J, et al. Response surface optimization of hydroxypropyl-β-Inclusion process of sanguinarine with cyclodextrin[J]. Food Industry Science and Technology,2020,41(18):182−186. [25] 杨孝辉, 郭君. 响应面法优化超高压提取枸杞多糖工艺[J]. 食品工业科技,2020,41(17):187−192. [YANG X H, GUO J. Optimization of ultra-high pressure extraction process of Lycium barbarum polysaccharides by response surface methodology[J]. Food Industry Science and Technology,2020,41(17):187−192. [26] 傅强, 舒智, 邓轲, 等. 反相HPLC法同时测定大麻植物中的三种有效成分[J]. 法医学杂志,2016,32(4):261−263. [FU Q, SHU Z, DENG K, et al. Simultaneous determination of three active components in cannabis plants by RP-HPLC[J]. Journal of Forensic Medicine,2016,32(4):261−263. doi: 10.3969/j.issn.1004-5619.2016.04.006 [27] AIZPURUA O O, OMAR J, NAVARRO P, et al. Identification and quantification of cannabinoids in Cannabis sativa L. plants by high performance liquid chromatography-mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2014,406(29):7549−7560. doi: 10.1007/s00216-014-8177-x
[28] 刘胜贵, 马海悦, 李智高, 等. HPLC法测定工业大麻花叶中的CBD和THC的含量[J]. 云南化工,2020,47(5):62−64. [LIU S G, MA H Y, LI Z G, et al. Determination of CBD and THC in industrial hemp leaves by HPLC[J]. Yunnan Chemical Industry,2020,47(5):62−64. doi: 10.3969/j.issn.1004-275X.2020.05.025 [29] 熊文慧, 姜欣, 孙清瑞, 等. 高顺式占比番茄红素纳米结构脂质载体的制备及贮藏稳定性研究[J]. 中国油脂,2019,44(9):29−35. [XIONG W H, JIANG X, SUN Q R, et al. Preparation and storage stability of high CIS lycopene nanostructured lipid carrier[J]. China Oil,2019,44(9):29−35. [30] 吴劲轩, 夏文银, 夏川林, 等. 磷脂与食品中蛋白质相互作用机制及对蛋白质特性的影响研究进展[J]. 食品工业科技,2020,41(17):345−351. [WU J X, XIA W Y, XIA C L, et al. Research progress on the interaction mechanism between phospholipids and proteins in food and its influence on protein properties[J]. Food Industry Science and Technology,2020,41(17):345−351. [31] 李秋慧, 齐宝坤, 隋晓楠, 等. 大豆分离蛋白-磷脂复合乳化体系乳化及氧化稳定性研究[J]. 中国食品学报,2016,16(5):46−52. [LI Q H, QI B K, SUI X N, et al. Study on emulsification and oxidation stability of soybean protein isolate phospholipid composite emulsification system[J]. Chinese Journal of Food,2016,16(5):46−52. [32] 杨贝贝, 曹栋, 耿亚男, 等. 植物甾醇与胆固醇对脂质体膜性质的影响[J]. 食品工业科技, 2013, 34(7): 77−81, 85. YANG B B, CAO D, GENG Y N, et al. Effects of phytosterols and cholesterol on liposome membrane properties[J]. Food Industry Science and Technology, 2013, 34(7): 77−81, 85.
[33] PORNPUTTAPITAK W, PANTAKITCHAROENKUL J, TEERANACHAIDEEKUL V, et al. Effect of oil content on physiochemical characteristics of γ-Oryzanol-loaded nanostructured lipid carriers[J]. Journal of Oleo Science,2019,68(8):699−707. doi: 10.5650/jos.ess18127
[34] YAN X J, ZHANG W K, CHENG X L, et al. Preparation of simvastatin loaded nanostructured lipid carriers and its therapeutic effect on patients with severe acute lung injury[J]. Journal of Nanoscience and Nanotechnology,2021,21(2):1184−1189. doi: 10.1166/jnn.2021.18648
[35] 王欢, 冯红霞, 张雅娜, 等. 大豆分离蛋白-磷脂复合乳化体系的制备及pH对其影响的研究[J]. 食品工业科技, 2013, 34(24): 159−162, 176. WANG H, FENG H X, ZHANG Y N, et al. Preparation of soy protein isolate phospholipid composite emulsion system and the effect of pH on it[J]. Food Industry Science and Technology, 2013, 34(24): 159−162, 176.
[36] 林琳, 代娅婕, 纪悦, 等. 茶树油/β-环糊精纳米脂质体的制备及其在牛肉抗菌中的应用研究[J]. 中国食品添加剂,2017(11):123−127. [LIN L, DAI Y J, JI Y, et al. Tea tree oil/β-Preparation of cyclodextrin nanoliposomes and their application in beef antibacterial[J]. China Food Additives,2017(11):123−127. doi: 10.3969/j.issn.1006-2513.2017.11.013 [37] XUE H Y, LI J R, LIU Y G, et al. Optimization of the ultrafiltration-assisted extraction of Chinese yam polysaccharide using response surface methodology and its biological activity[J]. International Journal of Biological Macromolecules,2019,121:1186−1193. doi: 10.1016/j.ijbiomac.2018.10.126
[38] 祁百巍, 陈炼红. 响应面优化广西红蓝草红色素提取工艺及其特性研究[J]. 中国调味品,2021,46(5):151−160. [QI B W, CHEN L H. Response surface methodology optimization of extraction process and characteristics of red pigment from Guangxi red and blue grass[J]. Chinese Condiments,2021,46(5):151−160. doi: 10.3969/j.issn.1000-9973.2021.05.032 [39] PARICHEHR F, AHMAD S B, VICIT R E, et al. Preparation and characterization of palm oil in water microemulsion for application in the food industry[J]. British Food Journal,2020,122(10):3077−3088. doi: 10.1108/BFJ-01-2020-0018
-
期刊类型引用(1)
1. 岳忠孝,侯东辉,张瑞栋,于欣宇,冯耐红. 响应面法优化小米红枣溶豆的加工工艺. 山西农业科学. 2023(11): 1331-1338 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:




 下载:
下载:



