Optimization of Brevibacillin Fermentation Medium with Brevibacillus laterosporus by Response Surface Methodology
-
摘要: 对侧孢短芽孢杆菌fmb70-24产短杆菌素的发酵培养基进行优化。在单因素实验的基础上利用Plackett-Burman设计对影响短杆菌素含量的6个主要因素进行评价,筛选出具有显著效应的因素为镁离子、牛肉浸膏和蔗糖,并利用爬坡试验确定响应面试验的最佳区域,设计三因素三水平的Box-Behnken试验得到侧孢短芽孢杆菌产短杆菌素的最适培养基配方为:蔗糖28.65 g/L、牛肉浸膏17.04 g/L、镁离子13.01 g/L、胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L,以该培养基进行发酵验证,短杆菌素含量为457.87±5.12 µg/mL,与理论最大值462.94 µg/mL较为接近,较初始发酵培养基提高了34.6%。Abstract: The fermentation medium of brevibacillin by Brevibacillus laterosporus was optimized. Six main factors which affected brevibacillin production were evaluated by Placket-burman design. Three significant factors, sucrose, beef extract and Mg2+, were selected and the optimal area of the response surface was determined by the steepest climbing experimental; the optimal medium components were obtained by using a three-factor and three-level Box-Behnken experiment. The optimal medium components for B. laterosporus producing brevibacillin were: Sucrose 28.65 g/L, beef extract 17.04 g/L, Mg2+13.01 g/L, tryptone 10 g/L, yeast extract 5 g/L, NaCl 10 g/L. Under this optimum condition the yield of brevibacillin was 457.87±5.12 µg/mL, which was 34.6% higher that before optimization, and it was very close to the maximum value 462.94 µg/mL predicted by the theory.
-
短杆菌素(Brevibacillin)是由侧孢短芽孢杆菌(Brevibacillus laterosporus)产生的一种线性抗菌脂肽,良好的抑菌活性使其可与一些抗生素相媲美[1-2],同时具有良好的热稳定性和酸碱稳定性[3],是潜在的新型生物防腐剂。目前对于其菌体及代谢产物的应用主要集中在农业[4]及环境[5]等行业,宁亚维等[6]将侧孢短芽孢杆菌的抗菌肽brevilaterin与各种食品添加剂协同使用,结果表明协同使用可增加对食源性致病菌的广谱抑菌。本实验室前期从南京土壤中筛选出一株侧孢短芽孢杆菌,发现其发酵液中低剂量的短杆菌素即可有效杀死脱脂牛奶中的金黄色葡萄球菌和单增李斯特菌,具有替代食品防腐剂保鲜剂的潜力[7-8]。并且在生姜的生防试验中侧孢短芽孢杆菌可显著抑制群结腐霉对生姜的侵染[9]。然而其较低的发酵产量却无法应用于大规模的工业化生产,目前没有对于合成短杆菌素完整的特异性调控路径的报道,因此采用优化培养基提高菌体密度的方法来提高短杆菌素的含量是行之有效的手段。但是对于优化发酵培养基提高侧孢短芽孢杆菌产短杆菌素含量的研究参考文献较少。
微生物生长繁殖过程中产生的次级代谢产物的含量不仅与微生物自身的代谢过程及遗传信息有关,培养基的主要组成成分[10-11]及发酵条件[12-13]也会影响次级代谢产物的生物合成。前期通过基因组改组筛选出一株高产短杆菌素的融合菌株命名为fmb70-24,并在此基础上,拟通过响应面试验优化融合菌株的发酵条件进一步提高短杆菌素的含量,为短杆菌素应用于工业化生产提供理论基础和方法。
基于Plackett-Burman试验筛选出的显著因子考察不同因子之间的交互影响作用[14-15],解决多变量的问题,合理使用响应面优化发酵工艺可以有效提高生产效益[16-17],成为生产过程中解决问题的有效方式,因此广泛运用于化学[18]、生物[19]、食品[20-21]等各个领域。
1. 材料与方法
1.1 材料与仪器
侧孢短芽孢杆菌fmb70-24(B. laterosporus fmb70-24) 南京农业大学酶工程实验室;胰蛋白胨、酵母提取物、氯化钠、葡萄糖、果糖、麦芽糖、蔗糖、牛肉浸膏、硫酸铵、酵母膏、玉米浆、氯化钙、氯化钾、氯化镁 分析纯,国药集团化学试剂。
SX-700高压蒸汽灭菌锅 日本TOMY公司;SW-CJ-IBU超净工作台 苏净集团安泰公司;DIONEX3000高效液相色谱仪 美国DIONEX公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 培养基配制
初始发酵/种子培养基[7]:胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0 g/L,蒸馏水1000 mL,pH7.0,121 ℃灭菌20 min。
1.2.2 菌种的培养及发酵
1.2.2.1 菌种的培养
将甘油管中的菌种按2%的接种量接种至50 mL/250 mL液体培养基中,37 ℃,180 r/min摇床培养24 h后,然后按照相同的接种量转接至50 mL/250 mL培养基中相同条件下培养24 h至对数后期。
1.2.2.2 菌种的发酵
将活化后的种子培养液按2%的接种量接种至50 mL/250 mL发酵培养基中,30 ℃下180 r/min摇床发酵培养24 h。
1.2.3 培养基成分考察的单因素实验
试验前期已优化Luria-Bertani(LB)培养基中胰蛋白胨最佳添加量为15 g/L,酵母提取物的最佳添加量为5 g/L,氯化钠的最佳添加量为10 g/L。在此基础上以侧孢短芽孢杆菌fmb70-24为试验菌株,初始发酵培养基(LB培养基)作为对照,优化培养基的碳源、氮源和无机盐离子,并使用HPLC检测发酵液中短杆菌素的含量。
碳源:在初始发酵培养基中分别添加10 g/L的葡萄糖、蔗糖、果糖或麦芽糖。比较短杆菌素的含量,以含量最高的碳源为最佳碳源,对其添加量进行优化,添加量分别设为10.0、20.0、30.0、40.0和50.0 g/L。
氮源:在初始发酵培养基中分别添加10 g/L的硫酸铵、牛肉膏、酵母膏或玉米浆。比较短杆菌素的含量,以含量最高的氮源为最佳氮源,对其添加量进行优化,添加量分别设为10.0、20.0、30.0、40.0和50.0 g/L。
无机盐离子:在初始发酵培养基的基础上分别添加10 g/L的氯化钙、氯化镁或氯化钾。比较短杆菌素的含量,以含量最高的无机盐离子为最佳离子,对其添加量进行优化,添加量分别设为5.0、10.0、20.0、30.0和40.0 g/L。
1.2.4 响应面优化试验设计
1.2.4.1 Plackett-Burman(PB)试验
选取影响短杆菌素含量的6个主要培养基组分为自变量,发酵液中短杆菌素含量为响应值,选用N=11的Plackett-Burman设计,并设计5个空白作为误差分析项。每个因素选取高(+1)低(−1)2个水平,筛选影响显著的因子[22-23]。PB试验设计见表1。
表 1 PB设计因子、水平及编码Table 1. Factors, levels and codes of PB design编码 因素 水平 −1 +1 X1 蔗糖(g/L) 30 40 X2 牛肉浸膏(g/L) 20 30 X3 镁离子(g/L) 15 30 X4 胰蛋白胨(g/L) 10 15 X5 氯化钠(g/L) 5 10 X6 酵母提取物(g/L) 5 10 1.2.4.2 最陡爬坡试验确定响应面中心点
通过最陡爬坡试验尽可能逼近短杆菌素含量的最大区域,确定此时培养基主要组分的浓度,建立响应面拟合方程的最优模型。最陡爬坡试验的爬坡方向及步长主要通过PB试验得到的3个显著影响因子的系数值确定,因素系数值为正值选取高水平,负值选取低水平,设计试验找出短杆菌素含量的最大值时显著因子的浓度,作为Box-Behnken试验的起始中心点。
1.2.4.3 Box-Behnken(BB)设计
利用响应面试验可评价显著因子之间的交互作用[13],以PB试验筛选出的三个显著因子作为自变量,发酵液中短杆菌素的含量为响应值,设计三因素三水平的响应面试验,建立多元二次回归数学方程来拟合自变量与响应值之间的函数关系,获得短杆菌素含量的最佳培养基配方。BBD试验设计见表2。
表 2 Box-Behnken因素编码及水平设计Table 2. Factors, levels and codes of Box-Behnken design因素 变量编号 水平 −1 0 +1 蔗糖(g/L) A 24 28 32 牛肉浸膏(g/L) B 14 18 22 镁离子(g/L) C 10 12.5 15 1.2.4.4 验证试验
通过响应面试验获得的理论最佳培养条件进行发酵24 h验证,得到的短杆菌素含量平均值与理论最大值进行比较,验证实验模型的可靠性。
1.2.4.5 发酵液中短杆菌素的测定
取发酵液1 mL在离心机中12000×g离心2 min,上清液即为发酵液,HPLC测定发酵液中短杆菌素的含量。
HPLC检测短杆菌素含量方法[7]:Biobasic C18(250 mm×4.6 mm) 柱;进样量:20 µL;柱温:25 ℃;检测波长:210 nm;流速:0.6 mL/min;溶剂A:乙腈(ACN,含0.1%三氟乙酸,TFA);溶剂B:水(含0.1%TFA);洗脱条件如表3所示。
表 3 分析型HPLC洗脱条件Table 3. Elution condition of HPLC时间(min) 流动相A(%) 流动相B(%) 0 30 70 5 30 70 20 70 30 23 30 70 对侧孢短芽孢杆菌次级代谢产物短杆菌素的不同同系物进行积分,从而得到不同浓度样品的峰面积,做出峰面积-短杆菌素浓度标准曲线,后续试验以此计算短杆菌素的含量。
brevibacillin V峰面积(x)与浓度(y)的标准方程为:y=0.0867x−4.9292(R2=0.99916)。
brevibacillin峰面积(x)与浓度(y)的标准方程为:y=0.1548x−0.273(R2=0.99955)。
1.3 数据处理
本研究中所有的试验均进行3次重复,数据使用IBM SPSS Statistics 22的单因素ANOVA进行显著性分析(P<0.05),使用Origin 2018进行数据绘图,Design-Expert.V8.0.6进行响应面试验设计及分析。
2. 结果与分析
2.1 碳源、氮源及无机盐对发酵短杆菌素的影响
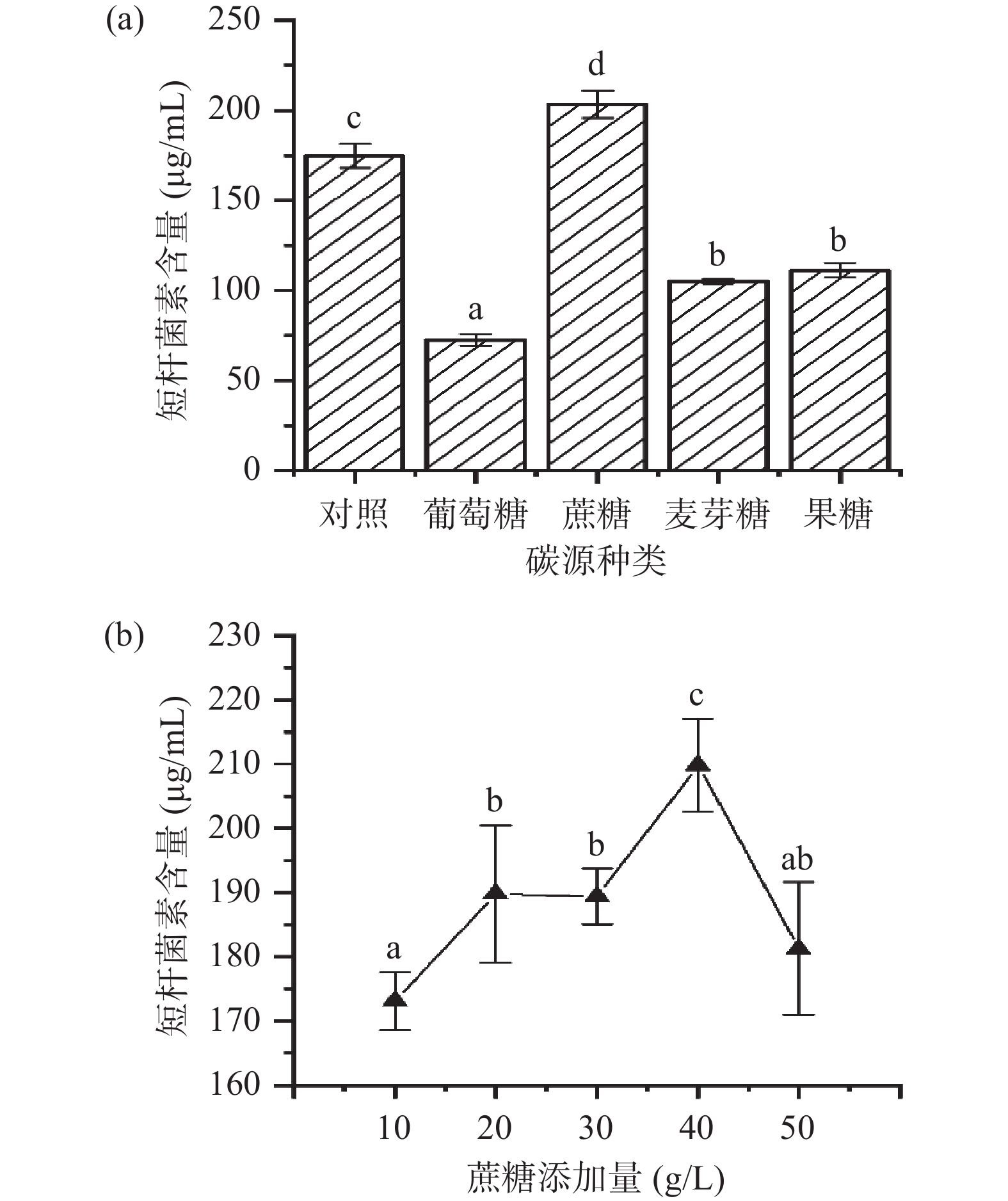
2.1.1 碳源的影响
在初始发酵培养基的基础上进行碳源的优化,分别以葡萄糖、蔗糖、麦芽糖及果糖作为碳源进行优化,结果如图1所示。试验结果显示,在不同种类的供试碳源中,蔗糖的添加可以促进发酵液中短杆菌素的含量,并且当蔗糖的添加量为40.0 g/L时,短杆菌素的含量达到最高,是对照组含量的1.12倍,所以选择添加量为40.0 g/L的蔗糖作为最佳碳源。
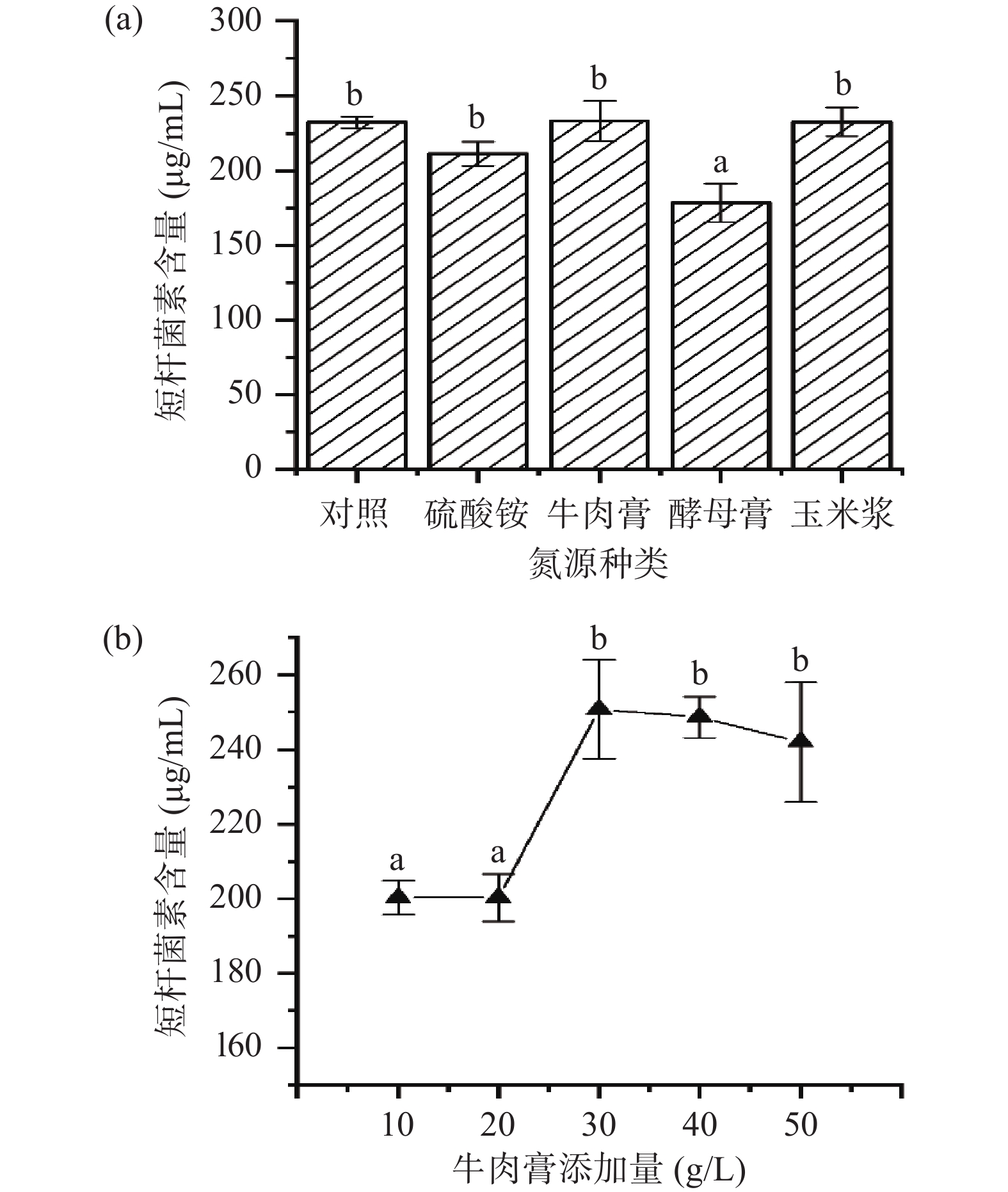
2.1.2 氮源的影响
在初始发酵培养基的基础上进行氮源的优化,分别以硫酸铵、牛肉膏、酵母膏及玉米浆作为氮源进行优化,结果如图2所示。试验结果显示,在不同种类的供试氮源中,牛肉膏的添加可以促进发酵液中短杆菌素的含量,并且当牛肉膏的添加量为30.0 g/L时,短杆菌素的含量达到最高,是对照组含量的1.2倍,考虑到后续工业化生产的经济效益,所以选择添加量为30.0 g/L的牛肉膏作为最佳氮源。
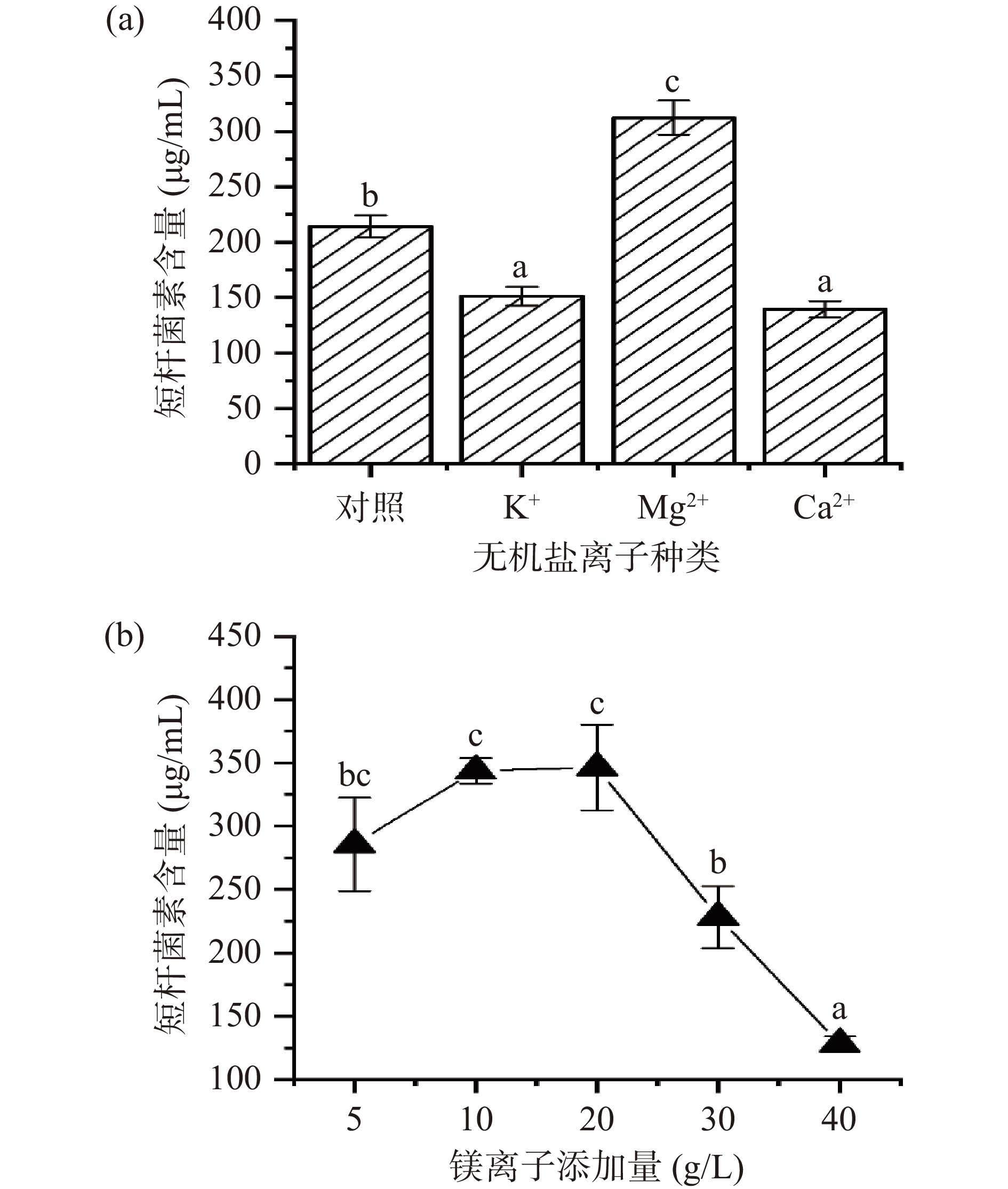
2.1.3 无机盐的影响
无机盐离子作为酶的重要组成成分、激活剂及抑制剂,可以参与微生物代谢的不同阶段,影响微生物的次级代谢产物[24]。在初始发酵培养基的基础上进行无机盐离子的优化,分别以钾离子、镁离子及钙离子作为无机盐离子进行优化,结果如图3所示。试验结果显示,在不同种类的供试无机盐离子中,镁离子的添加可以促进发酵液中短杆菌素的含量,当发酵培养基中镁离子的添加量分别为10.0 g/L和20.0 g/L时,短杆菌素的含量并不具有显著性的差异,且考虑到发酵环境各种因素存在会影响发酵结果,因此选择添加量为10.0 g/L的镁离子作为最佳无机盐离子。
2.2 Plackett-Burman设计筛选影响短杆菌素含量的显著因素
可能影响发酵液中短杆菌素含量的因素主要包括胰蛋白胨、酵母提取物、氯化钠、蔗糖、牛肉浸膏、镁离子等,利用PB试验对这6个因素进行全面考察,筛选影响显著的因素。PB试验结果见表4,各因素之间的水平及效应评价见表5。由试验结果可知,该试验模型P=0.0026<0.05,说明该试验模型影响显著,决定系数为R2=0.9585,矫正系数为R2Adj=0.9086,两者较为接近,说明该模型对于试验的重复性较好,因素水平设计合理。各因素对短杆菌素含量的影响显著性大小排序为:镁离子>牛肉浸膏>蔗糖>氯化钠>胰蛋白胨>酵母提取物,其中镁离子的添加对于短杆菌素含量的增加具有极显著影响(P<0.01)。因此,选择镁离子、蔗糖和牛肉浸膏作为主要影响因素进行下一步试验。
表 4 Plackett-Burman的试验设计及结果Table 4. Experimental design of Plackett-Burman and corresponding results序号 X1 X2 X3 X4 X5 X6 X7 X8 X9 X10 X11 短杆菌素含量(µg/mL) 1 1 1 −1 1 1 1 −1 −1 −1 1 −1 95.57±4.38 2 −1 1 1 −1 1 1 1 −1 −1 −1 1 90.89±9.32 3 1 −1 1 1 −1 1 1 1 −1 −1 −1 64.63±5.22 4 −1 1 −1 1 1 −1 1 1 1 −1 −1 218.43±10.43 5 −1 −1 1 −1 1 1 −1 1 1 1 −1 63.11±7.76 6 −1 −1 −1 1 −1 1 1 −1 1 1 1 338.53±8.34 7 1 −1 −1 −1 1 −1 1 1 −1 1 1 320.19±11.32 8 1 1 −1 −1 −1 1 −1 1 1 −1 1 227.94±6.43 9 1 1 1 −1 −1 −1 1 −1 1 −1 1 70.57±6.99 10 −1 1 1 1 −1 −1 −1 1 −1 1 1 71.51±3.43 11 1 −1 1 1 1 −1 −1 −1 1 −1 1 65.13±8.44 12 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 432.42±7.11 表 5 Plackett-Burman设计的各因素水平及效应评价Table 5. Factors, levels and effect estimates of Plackett-Burman design标号 因素 系数估计 P值 影响顺序 X1 蔗糖(g/L) −30.95 0.0430* 3 X2 牛肉浸膏(g/L) −42.47 0.0140* 2 X3 镁离子(g/L) −100.56 0.0003** 1 X4 胰蛋白胨(g/L) −29.32 0.0510 5 X5 氯化钠(g/L) −29.40 0.0506 X6 酵母提取物(g/L) −24.85 0.0828 6 注: R2=0.9585;R2Adj=0.9086;**差异极显著(P<0.01);*差异显著(P<0.05)。 2.3 最陡爬坡试验确定响应面试验中心点
通过PB试验筛选出前三个对于侧孢短芽孢杆菌产短杆菌素影响较为显著的因子,分别为蔗糖、牛肉浸膏及镁离子,以此为基础进行最陡爬坡试验确定响应面试验中心点。由于三个显著因子对于短杆菌素合成的效应系数均为负值,因此选择低水平进行爬坡试验,试验结果见表6。从表中可看出,第二组试验的短杆菌素的含量达到最高,因此选择第二组试验的每个因子的水平作为响应面试验的中心点,即蔗糖28 g/L、牛肉浸膏18 g/L、镁离子12.5 g/L。
表 6 最陡爬坡试验结果Table 6. Results of steep climbing experimental试验标号 因素 短杆菌素含量(µg/mL) 蔗糖
(g/L)牛肉浸膏
(g/L)镁离子
(g/L)1 30 20 15 289.07±8.56 2 28 18 12.5 382.13±6.60 3 26 16 10 320.48±10.12 4 24 14 8 301.84±9.18 5 22 12 6 258.76±9.25 6 20 10 4 254.12±4.17 7 18 8 2 237.48±5.61 8 16 6 1 203.23±8.87 2.4 BBD响应面优化培养基配方
根据Plackett-Burman试验结果,运用Box-Behnken Design试验对影响侧孢短芽孢杆菌产短杆菌素的三个主要因素进行进一步优化,表7为Box-Behnken Design试验设计及结果,利用Design-Expert 8.06软件对Box-Behnken Design的试验结果进行回归分析,得到的回归方程Y=448.80+11.58A−81.55B+32.16C−4.14AB−5.46AC−57.51BC−35.32A2−193.29B2−110.77C2,其中,Y代表短杆菌素的含量,A、B、C分别代表蔗糖含量、牛肉浸膏含量与镁离子含量的编码值[25]。
表 7 Box-Behnken设计及结果Table 7. Design and result of Box-Behnken编号 A B C 短杆菌素含量(µg/mL) 1 −1 −1 0 307.90±13.64 2 0 −1 1 304.99±14.15 3 0 1 1 74.75±7.26 4 −1 1 0 105.22±10.63 5 1 0 −1 298.49±9.83 6 0 −1 −1 99.72±8.27 7 1 0 1 325.96±4.97 8 −1 0 1 317.85±4.22 9 0 0 0 417.69±6.50 10 0 0 0 491.36±17.92 11 1 1 0 124.19±1.72 12 1 −1 0 343.45±12.43 13 0 0 0 416.61±17.77 14 0 1 −1 99.51±6.95 15 −1 0 −1 268.52±21.38 16 0 0 0 479.16±13.06 17 0 0 0 439.18±15.26 由表8方差分析可知,该模型的F值为22.10,P<0.01,说明该模型极显著,失拟项F值为1.65,P>0.05,失拟项不显著,模型的决定系数R2=0.9660,说明该模型具有良好得相关性,模型的校正决定系数R2Adj=0.9223,与R2较为接近,说明该模型的拟合度高。其中,B、B2、C2对短杆菌素的影响极显著(P<0.01),BC对短杆菌素含量的影响显著(P<0.05)。
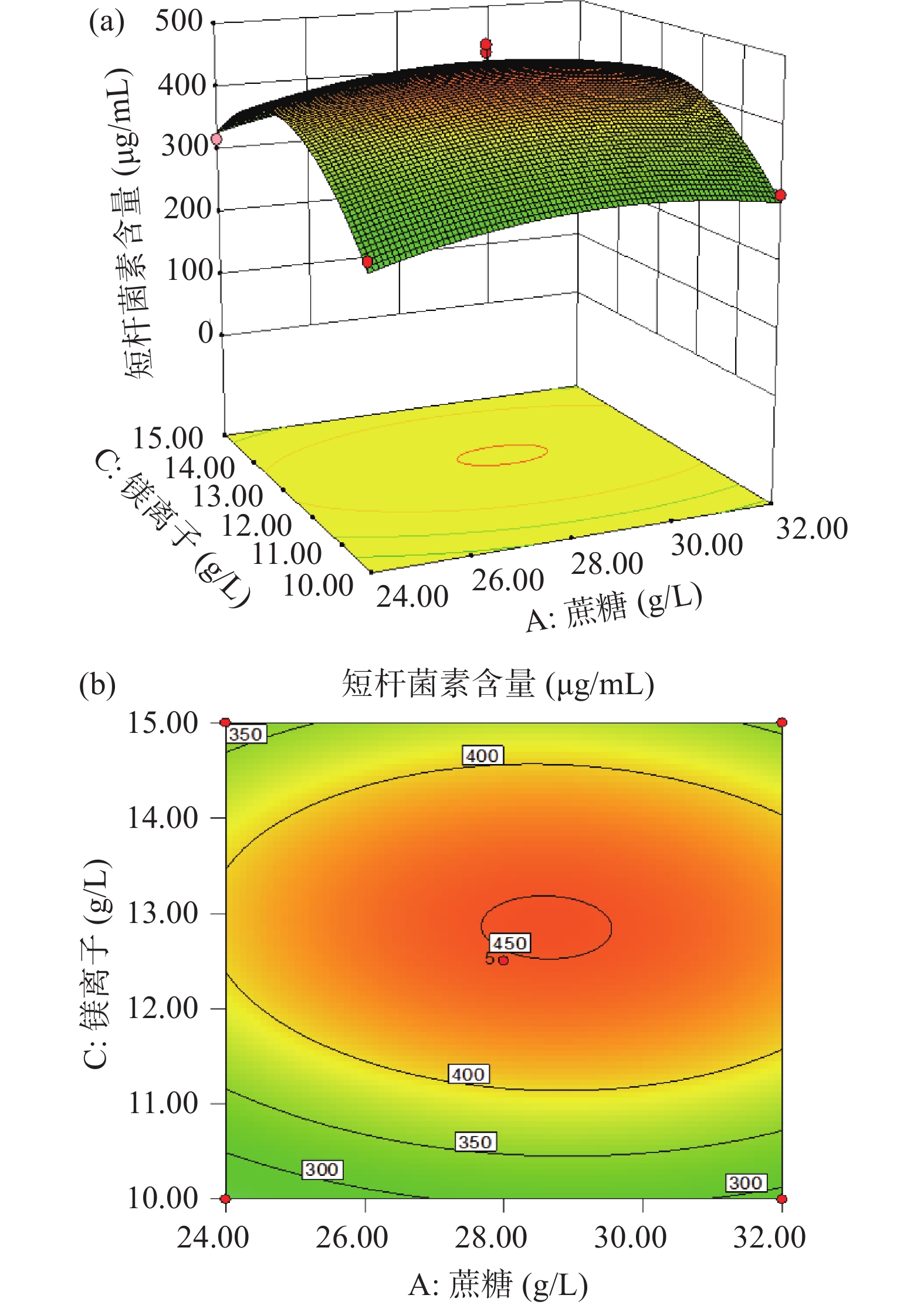
表 8 回归模型的方差分析Table 8. Analysis of variance for the proposed quadratic polynomial model来源 平方和 自由度 均方 F值 P值 显著性 模型 3.066E+005 9 34064.50 22.10 0.0002 ** A-蔗糖 1071.87 1 1071.87 0.70 0.4319 B-牛肉浸膏 53204.67 1 53204.67 34.51 0.0006 ** C-镁离子 8275.49 1 8275.49 5.37 0.0536 AB 68.71 1 68.71 0.045 0.8388 AC 119.44 1 119.44 0.077 0.7888 BC 13227.66 1 13227.66 8.58 0.0220 * A2 5253.19 1 5253.19 3.41 0.1074 B2 1.573E+005 1 1.573E+005 102.04 < 0.0001 ** C2 51664.72 1 51664.72 33.51 0.0007 ** 残差 10791.32 7 1541.62 失拟项 5962.11 3 1987.37 1.65 0.3137 纯误差 4829.22 4 1207.30 总和 3.174E+005 16 注:R2=0.9660,R2Adj=0.9223 ;**差异极显著(P<0.01);*差异显著(P<0.05)。 根据获得的二次回归方程及试验方差分析结果,借助Design-Expert.V8.0.6软件可绘制不同组合因子之间的等高线图和响应面分析图(图4~图6),进而更加直观地观察因子之间的交互作用对短杆菌素含量的影响。其中等高线图中越接近圆形表示两因子之间交互作用不显著,椭圆形表示交互作用显著[26-27]。由响应曲面图可知,随着各因素浓度的增加,发酵液中短杆菌素的含量呈现先增加后减少的趋势,由图6可看出,镁离子含量的变化对于短杆菌素含量的影响较蔗糖和牛肉浸膏更大。该响应面图说明不同因素之间存在交互作用,共同影响着侧孢短芽孢杆菌产短杆菌素的生物合成,并且牛肉浸膏含量与镁离子含量之间的交互作用比较显著。
2.5 发酵验证模型
利用Design Expert软件进行分析后,得到培养基组分中各显著因子的最优浓度为:蔗糖含量28.65 g/L、牛肉浸膏含量17.04 g/L、镁离子含量13.01 g/L。在此基础上重复3次试验,测得短杆菌素含量的平均值为457.87±5.12 µg/mL,与预测值462.94 µg/mL偏差1.09%,表明该模型能够很好地预测实际的短杆菌素的含量情况,较初始发酵培养基短杆菌素含量(340.5±16.35 µg/mL)提高34.6%。
3. 讨论与结论
本研究利用PB试验对影响短杆菌素含量的六个因素进行筛选试验,试验结果显示镁离子、牛肉浸膏及蔗糖的含量对于短杆菌素的含量影响显著(P<0.05),并且镁离子的添加可明显提高发酵液中短杆菌素的含量,在糖酵解等途径中镁离子可以作为激活剂,辅助次级代谢产物的生物合成[28],从而促进短杆菌素含量的增加。也有相关研究可表明在发酵培养基中添加镁离子可促进微生物次级代谢物的合成[29],Wang等[30]研究了海洋来源真菌Ascotricha ZJ-M-5的次级代谢产物,结果表明镁离子是石竹烯型倍半萜类化合物ascotrichol生物合成的必要条件。通过最陡爬坡试验逼近了短杆菌素含量最大值区域。在此基础上利用Box-Behnken Design试验对以上三个因素进行进一步优化,建立以短杆菌素含量为响应值的二次回归模型,最终获得侧孢短芽孢杆菌fmb70-24产短杆菌素的最适培养基配方为:蔗糖28.65 g/L、牛肉浸膏17.04 g/L、镁离子13.01 g/L、胰蛋白胨10 g/L、氯化钠10 g/L、酵母提取物5 g/L、菌种接种量2%,发酵条件为发酵温度30 ℃、摇床转速180 r/min、发酵时间24 h、初始培养基pH自然,优化后发酵液中短杆菌素含量较未优化提高34.6%,为短杆菌素的工业化生产应用提供理论基础和技术支持。
-
表 1 PB设计因子、水平及编码
Table 1 Factors, levels and codes of PB design
编码 因素 水平 −1 +1 X1 蔗糖(g/L) 30 40 X2 牛肉浸膏(g/L) 20 30 X3 镁离子(g/L) 15 30 X4 胰蛋白胨(g/L) 10 15 X5 氯化钠(g/L) 5 10 X6 酵母提取物(g/L) 5 10 表 2 Box-Behnken因素编码及水平设计
Table 2 Factors, levels and codes of Box-Behnken design
因素 变量编号 水平 −1 0 +1 蔗糖(g/L) A 24 28 32 牛肉浸膏(g/L) B 14 18 22 镁离子(g/L) C 10 12.5 15 表 3 分析型HPLC洗脱条件
Table 3 Elution condition of HPLC
时间(min) 流动相A(%) 流动相B(%) 0 30 70 5 30 70 20 70 30 23 30 70 表 4 Plackett-Burman的试验设计及结果
Table 4 Experimental design of Plackett-Burman and corresponding results
序号 X1 X2 X3 X4 X5 X6 X7 X8 X9 X10 X11 短杆菌素含量(µg/mL) 1 1 1 −1 1 1 1 −1 −1 −1 1 −1 95.57±4.38 2 −1 1 1 −1 1 1 1 −1 −1 −1 1 90.89±9.32 3 1 −1 1 1 −1 1 1 1 −1 −1 −1 64.63±5.22 4 −1 1 −1 1 1 −1 1 1 1 −1 −1 218.43±10.43 5 −1 −1 1 −1 1 1 −1 1 1 1 −1 63.11±7.76 6 −1 −1 −1 1 −1 1 1 −1 1 1 1 338.53±8.34 7 1 −1 −1 −1 1 −1 1 1 −1 1 1 320.19±11.32 8 1 1 −1 −1 −1 1 −1 1 1 −1 1 227.94±6.43 9 1 1 1 −1 −1 −1 1 −1 1 −1 1 70.57±6.99 10 −1 1 1 1 −1 −1 −1 1 −1 1 1 71.51±3.43 11 1 −1 1 1 1 −1 −1 −1 1 −1 1 65.13±8.44 12 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 −1 432.42±7.11 表 5 Plackett-Burman设计的各因素水平及效应评价
Table 5 Factors, levels and effect estimates of Plackett-Burman design
标号 因素 系数估计 P值 影响顺序 X1 蔗糖(g/L) −30.95 0.0430* 3 X2 牛肉浸膏(g/L) −42.47 0.0140* 2 X3 镁离子(g/L) −100.56 0.0003** 1 X4 胰蛋白胨(g/L) −29.32 0.0510 5 X5 氯化钠(g/L) −29.40 0.0506 X6 酵母提取物(g/L) −24.85 0.0828 6 注: R2=0.9585;R2Adj=0.9086;**差异极显著(P<0.01);*差异显著(P<0.05)。 表 6 最陡爬坡试验结果
Table 6 Results of steep climbing experimental
试验标号 因素 短杆菌素含量(µg/mL) 蔗糖
(g/L)牛肉浸膏
(g/L)镁离子
(g/L)1 30 20 15 289.07±8.56 2 28 18 12.5 382.13±6.60 3 26 16 10 320.48±10.12 4 24 14 8 301.84±9.18 5 22 12 6 258.76±9.25 6 20 10 4 254.12±4.17 7 18 8 2 237.48±5.61 8 16 6 1 203.23±8.87 表 7 Box-Behnken设计及结果
Table 7 Design and result of Box-Behnken
编号 A B C 短杆菌素含量(µg/mL) 1 −1 −1 0 307.90±13.64 2 0 −1 1 304.99±14.15 3 0 1 1 74.75±7.26 4 −1 1 0 105.22±10.63 5 1 0 −1 298.49±9.83 6 0 −1 −1 99.72±8.27 7 1 0 1 325.96±4.97 8 −1 0 1 317.85±4.22 9 0 0 0 417.69±6.50 10 0 0 0 491.36±17.92 11 1 1 0 124.19±1.72 12 1 −1 0 343.45±12.43 13 0 0 0 416.61±17.77 14 0 1 −1 99.51±6.95 15 −1 0 −1 268.52±21.38 16 0 0 0 479.16±13.06 17 0 0 0 439.18±15.26 表 8 回归模型的方差分析
Table 8 Analysis of variance for the proposed quadratic polynomial model
来源 平方和 自由度 均方 F值 P值 显著性 模型 3.066E+005 9 34064.50 22.10 0.0002 ** A-蔗糖 1071.87 1 1071.87 0.70 0.4319 B-牛肉浸膏 53204.67 1 53204.67 34.51 0.0006 ** C-镁离子 8275.49 1 8275.49 5.37 0.0536 AB 68.71 1 68.71 0.045 0.8388 AC 119.44 1 119.44 0.077 0.7888 BC 13227.66 1 13227.66 8.58 0.0220 * A2 5253.19 1 5253.19 3.41 0.1074 B2 1.573E+005 1 1.573E+005 102.04 < 0.0001 ** C2 51664.72 1 51664.72 33.51 0.0007 ** 残差 10791.32 7 1541.62 失拟项 5962.11 3 1987.37 1.65 0.3137 纯误差 4829.22 4 1207.30 总和 3.174E+005 16 注:R2=0.9660,R2Adj=0.9223 ;**差异极显著(P<0.01);*差异显著(P<0.05)。 -
[1] YANG X, HUANG E, YUAN C, et al. Isolation and structural elucidation of brevibacillin, an antimicrobial lipopeptide from Brevibacillus laterosporus combating drug-resistant gram-positive bacteria[J]. Applied & Environmental Microbiology,2016,82(9):2763−2772.
[2] YANG X, HUANG E, YOUSEF A E. Brevibacillin, a cationic lipopeptide that binds to lipoteichoic acid and subsequently disrupts cytoplasmic membrane of Staphylococcus aureus[J]. Microbiological Research,2017,195:18−23. doi: 10.1016/j.micres.2016.11.002
[3] 马俊美. 侧孢短芽孢杆菌抗菌肽的结构及其特性研究[D]. 石家庄: 河北科技大学, 2015. MA J M. Research on structure and characterization of antimicrobial peptides from Brevibacillus laterosporus[D]. ShiJiaZhuang: Hebei University of Science and Technology, 2015.
[4] 王允祥, 吕凤霞, 陆兆新. 杯伞发酵培养基的响应曲面法优化研究[J]. 南京农业大学学报,2004,27(3):89−94. [WANG Y X, LV F X, LU Z X, et al. Optimization of cultivation medium Clitocybe sp. AS 5.112 for the extracellular polysaccharide production and mycelial growth by response surface methodology[J]. Journal of Nanjing Agricultural University,2004,27(3):89−94. [5] 肖培英, 顾欣燕, 闫辉敏, 等. 侧孢短芽孢杆菌MES818, 菌剂, 制备方法及应用: 中国, 110964671A[P]. 2020-04-07. XIAO P Y, GU X X, YAN H M, et al. Brevibacillus laterosporus MES818, and microbial agent and preparation method and application thereof: China, 110964671A[P]. 2020-04-07.
[6] 宁亚维, 李文蕾, 苏丹, 等. 抗菌肽brevilaterin与食品防腐剂联用对食源性致病菌的抑制[J]. 食品与发酵工业,2019,45(23):1−7. [NING Y W, LI W L, SU D, et al. Combination of antimicrobial peptide brevilaterin with food addities against fbod-borne pathogenic bacteria[J]. Food and Fermentation Industries,2019,45(23):1−7. [7] WU Y B, ZHOU L B, LV F X, et al. Discovery of a novel antimicrobial llipopeptide, brevibacillin V, from Brevibacillus laterosporus FMB70 and its application on the preservation of skim milk[J]. Journal of Agricultural and Food Chemistry,2019,67(45):12452−12460. doi: 10.1021/acs.jafc.9b04113
[8] 陆兆新, 吴宇博, 李金良, 等. 一种侧孢短芽孢杆菌, 抗菌脂肽及其在农业与食品上的应用: 中国, 110577910A[P]. 2019-12-17. LU Z X, WU Y B, LI J L, et al. Brevibacillus laterosporus, antibacterial lipopeptide and application thereof to agriculture and food: China, 110577910A[P]. 2019-12-17.
[9] 李明通, 孟凡强, 周立邦, 等. 生姜根腐病的病原菌鉴定及抗菌脂肽的防治效果[J]. 南京农业大学学报,2020,43(6):1134−1142. [LI M T, MENG F Q, ZHOU L B, et al. Identification of the pathogen of ginger root rot and the control effeciency of antifungal lipopeptides[J]. Journal of Nanjing Agricultural University,2020,43(6):1134−1142. doi: 10.7685/jnau.202002009 [10] 李兴玉, 毛自朝, 吴毅歆, 等. 不同培养基对Bacillus subtilis XF-1产脂肽抗生素的影响[J]. 内蒙古农业大学学报:自然科学版,2014,35(6):49−53. [LI X Y, MAO Z C, WU Y X, et al. Effects of different media on cyclic lipopeptides produced by Bacillus subtilis XF-1[J]. Journal of Inner Mongolia Agricultural University(Natural Sxience Edition),2014,35(6):49−53. [11] HOU D, HE X. Isolation and screening of Oenococcus oeni and its medium optimization[J]. Agricultural Biotechnology,2021,10(1):114−119.
[12] 田莉, 卢轶男, 朱建, 等. 产纳豆激酶的枯草芽孢杆菌基因工程菌发酵条件的响应面优化[J]. 武汉工程大学学报,2018,40(6):33−40. [TIAN L, LU Y N, ZHU J, et al. Optimization of fermentation conditions for nattokinase production by genetically engineered Bacillus subtilis using response surface methodology[J]. Journal of Wuhan Institute of Technology,2018,40(6):33−40. [13] 刘诗宇, 陈浩, 王棋, 等. 生防细菌X33的鉴定及产抑菌活性物质培养条件优化研究[J]. 黑龙江八一农垦大学学报,2020,32(6):20−28. [LIU S Y, CHEN H, WANG Q, et al. Identification of biocontrol bacteria X33 and optimization of culture conditions for antibacterial protein[J]. Journal of Heilongjiang Bayi Agricultural University,2020,32(6):20−28. doi: 10.3969/j.issn.1002-2090.2020.06.004 [14] WAGHMODE T R, KURADE M B, KAGALKAR A N, et al. Differential fate of metabolism of a disperse dye by microorganisms Galactomyces geotrichum and Brevibacillus laterosporus and their consortium GG-BL[J]. Journal of Environmental Sciences,2012,24(7):1295−1304. doi: 10.1016/S1001-0742(11)60899-1
[15] YAN L B, ZHANG Z L, ZHANG Y, et al. Improvement of tacrolimus production in Streptomyces tsukubaensis by mutagenesis and optimization of fermentation medium using Plackett-Burman design combined with response surface methodology[J]. Biotechnology Letters, 2021.
[16] 刘志祥, 曾超珍. 响应面法在发酵培养基优化中的应用[J]. 北方园艺,2009(2):127−129. [LIU Z X, ZENG C Z. The application of response surface method in optimization of fermentation medium[J]. Northern Horticulture,2009(2):127−129. [17] 袁辉林, 康丽华, 马海滨. 响应曲面法及其在微生物发酵工艺优化中的应用[J]. 安徽农业科学,2011,39(16):9498−9500,9502. [YUAN H L, KANG L H, MA H B. Response surface method and its application in the microbial fermentation process optimization[J]. Anhui Agricultural Science,2011,39(16):9498−9500,9502. doi: 10.3969/j.issn.0517-6611.2011.16.012 [18] 李春海. 微生物发酵工业优化研究进展分析[J]. 数字化用户,2016(46):118−119. [LI C H. Research progress of industrial optimization of microbial fermentation[J]. Digitization User,2016(46):118−119. doi: 10.3969/j.issn.1009-0843.2016.46.113 [19] FARD N, ZARGHI M H, SALEHIN M, et al. Application of Box-behnken design (BBD) to optimizing COD removal from fresh leachate using combination of ultrasound and ultraviolet[J]. Journal of Environmental Treatment Techniques,2020,8(3):861−869.
[20] LIU X, MU T, SUN H, et al. Optimisation of aqueous two-phase extraction of anthocyanins from purple sweet potatoes by response surface methodology[J]. Food Chemistry,2013,141(3):3034−3041. doi: 10.1016/j.foodchem.2013.05.119
[21] KUMARAN J, POULOSE S, JOSEPH V, et al. Enhanced biomass production and proximate composition of marine microalga Nannochloropsis oceanica by optimization of medium composition and culture conditions using response surface methodology[J]. Animal Feed Science and Technology,2021,271:1−15.
[22] 陈晨, 钱林, 于稳欠, 等. 利用响应面分析法优化深绿木霉Tr16液体发酵产孢培养基研究[J]. 安徽农业科学,2020,48(10):117−120. [CHEN C, QION L, YU W Q, et al. Optimization the culture medium of liquid fermentation for spore production of Trichoderma atroviride strain Tr16 by utilizing response surface analysis method (RSAM)[J]. Anhui Agricultural Science,2020,48(10):117−120. doi: 10.3969/j.issn.0517-6611.2020.10.031 [23] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索,2015,34(8):41−45. [LI L, ZHANG Q, HE Q, et al. Application of response surface methodology in experiment design and optimization[J]. Research and exploration in laboratory,2015,34(8):41−45. doi: 10.3969/j.issn.1006-7167.2015.08.011 [24] MANSON A R. Response surface methodology[J]. Technometrics,2008,15(4):936−938.
[25] 贾永亮. 镁离子添加提高抗癌药物安丝菌素P-3产量的研究[D]. 上海: 华东理工大学, 2011. JIA Y L. Enhanced production of ansamitocin P-3 by addition of Mg2+ in fermentation of Actinosynnema pretiosum[D]. Shanghai: East China University of Science and Technology, 2011.
[26] SHANOCK L R, BARAN B E, GENTRY W A, et al. Polynomial regression with response surface analysis: a powerful approach for examining moderation and overcoming limitations of difference scores[J]. Journal of Business & Psychology,2010,25(4):543−554.
[27] 蔡亚慧, 王青, 王文玉, 等. 暹罗芽孢杆菌LW-1产γ-聚谷氨酸发酵培养基的优化[J]. 食品工业科技,2021,42(16):163−170. [CAI Y H, WANG Q, WANG W Y, et al. Optimization of fermentation medium for γ-polyglutamic acid production by Bacillus siamese LW-1[J]. Science and Technology of Food Industry,2021,42(16):163−170. [28] DOBSON L F, O'SHEA D G. Antagonistic effect of divalent cations Ca2+ and Mg2+ on the morphological development of Streptomyces hygroscopicus var. geldanus[J]. Applied Microbiology & Biotechnology,2008,81(1):119−126.
[29] 潘丽军, 付萍, 郑志, 等. 米根霉乙醇脱氢酶突变株的筛选及其锌镁离子的调控研究[J]. 微生物学报,2006,46(4):586−590. [PAN L J, FU P, ZHENG Z, et al. Screening of a low alcohol dehydrogenase activity mutant of Rhizopus oryzae and regulation of Zn2+ and Mg2+[J]. Journal of Microbiology,2006,46(4):586−590. doi: 10.3321/j.issn:0001-6209.2006.04.017 [30] 王文静, 李丹毅, 谢磊睿, 等. 海洋来源真菌Ascotricha sp. J-M-5次级代谢化学多样性初探[C]// 海口: 中国药学会海洋药物专业委员会第十一届海洋药物学术年会论文集, 2013: 71−74. WANG W J, LI D Y, XIE L R, et al. Preliminary exploration into the chemo-diversity of secondary metabolism of a marine-derived fungus Ascotricha sp. ZJ-M-5[C]// Haikou: Proceedings of the 11th Annual Meeting of marine drugs, marine drug committee, Chinese Pharmaceutical Association, 2013: 71−74
-
期刊类型引用(13)
1. 谢耀慧,李成义,冯慧敏,贾妙婷,魏小成. 中药活性成分微生物发酵研究进展. 中成药. 2025(01): 182-187 .  百度学术
百度学术
2. 李萌,曾婷婷,杨金初,徐永明,李欢,马林,饶智. 冠突散囊菌GT-1固态发酵对低次烟叶品质的影响. 陕西科技大学学报. 2024(03): 38-45 .  百度学术
百度学术
3. 赵千慧,周慧玲,秦洋. 冠突散囊菌对高粱酒酿造过程糖化效率的促进作用与原理. 食品与发酵工业. 2024(15): 72-78 .  百度学术
百度学术
4. 吴云迪,刘谢缘,李利君,倪辉. 过氧化氢酶对白芽奇兰茶叶香气成分转化的影响. 食品科学. 2024(22): 164-172 .  百度学术
百度学术
5. 王莹,贾敏,程文婷,袁亚娟. 不同均质时间和稀释液对茯砖茶中冠突散囊菌计数的影响研究. 中外食品工业. 2024(14): 37-39 .  百度学术
百度学术
6. 谢宁轩,张文刚,党斌,郑万财,杨希娟. 冠突散囊菌发酵对青稞多酚组成及其体外抗氧化及糖脂代谢酶抑制活性的影响. 食品与发酵工业. 2024(23): 87-94 .  百度学术
百度学术
7. 冯璞阳,白亚妮,冯志珍,秦涛,陈卫锋. 冠突散囊菌散茶发花工艺提高茯茶品质研究进展. 茶叶. 2023(01): 9-12 .  百度学术
百度学术
8. 尹家全,刘歆旖,王兰,刘素纯. 冠突散囊菌发酵罗汉果渣过程中功能性成分及抗氧化活性的变化. 现代食品科技. 2023(04): 88-95 .  百度学术
百度学术
9. 肖咪,刘利敏,李鹏程,薛宏坤,邹先伟,唐劲天,苏彦奇,蔡旭. 冠突散囊菌发酵湖北海棠茶过程中主要成分及活性研究. 食品科技. 2022(01): 79-86 .  百度学术
百度学术
10. 吉巧琳,陈鑫,莫海英,蔡国磊,杨海英,杜刚. 茯茶中冠突曲霉的分离及比较基因组研究. 食品科技. 2022(05): 21-26 .  百度学术
百度学术
11. 刘璐,袁亚宏,岳田利. 葛根降血压茶的制备及对自发性高血压大鼠的降压作用. 食品与机械. 2022(07): 213-219 .  百度学术
百度学术
12. 党旭辉,周秦羽,刘梦圆,甘汉文,张犇,刘锦,李敏,覃丽,肖文军. 黑茶金花体外抗氧化及降血脂活性研究. 食品安全质量检测学报. 2022(24): 7927-7933 .  百度学术
百度学术
13. 赵敏晶. 茯茶品牌的发展路径探索. 炎黄地理. 2022(11): 53-55 .  百度学术
百度学术
其他类型引用(10)





 下载:
下载:


 下载:
下载:



