Study on the Functional Properties and Antioxidant Activities of Different Enzymatic Hydrolysates of Ziziphi Spinosae Semen Protein
-
摘要: 以酸枣仁为原料,采用碱提酸沉法对酸枣仁蛋白进行提取,用三种不同蛋白酶(碱性蛋白酶、中性蛋白酶和木瓜蛋白酶)对酸枣仁蛋白进行酶解,得到三种酶解物,研究不同酸枣仁蛋白酶解物的功能特性和抗氧化活性。结果表明,与酸枣仁蛋白相比,不同酸枣仁蛋白酶解物的溶解性、持油性、起泡性及其稳定性、乳化性及其稳定性均具有不同程度地提高,其中,木瓜蛋白酶解物的溶解性、持油性、起泡性和乳化性最强,碱性蛋白酶解物的起泡稳定性和乳化稳定性最强;体外抗氧化研究表明,相比于酸枣仁蛋白,不同蛋白酶所得酶解产物的抗氧化活性均明显提高,其中,碱性蛋白酶酶解物的DPPH清除能力、羟基自由基清除能力、超氧阴离子清除率和ABTS自由基清除能力均高于其他酶解产物,当质量浓度为2.5 mg/mL时,DPPH自由基清除率最高为95.87%、超氧阴离子自由基率为44.77%、ABTS自由基清除率为90.84%、羟基自由基清除率为47.77%。本研究表明,酸枣仁蛋白酶解物具有较好的食品加工性能,其抗氧化活性明显增高,可以作为一种潜在的蛋白质资源应用到食品中,为酸枣仁蛋白酶解物在食品行业中的应用提供理论依据。Abstract: Using Ziziphi Spinosae semen as raw material, Ziziphi Spinosae semen protein was extracted by alkali extraction and acid precipitation method. The Ziziphi Spinosae semen protein was hydrolyzed by three different proteases (alkaline protease, neutral protease and papain). The functional properties and antioxidant activity of enzymatic hydrolysates from Ziziphi Spinosae semen protein were studied. The results showed that the solubility, oil holding capacity, foaming capacity and stability, emulsifying capacity and stability of protein hydrolysates from different Ziziphi Spinosae semen were improved in different degrees compared with protein hydrolysates from Ziziphi Spinosae semen, among them, papain hydrolysate had the strongest solubility, oil holding, foaming and emulsifying properties, and alkaline protease hydrolysate had the strongest foaming and emulsifying stability. In vitro antioxidant studies showed that compared with of Ziziphi Spinosae semen protein, the antioxidant activities of enzymatic hydrolysates obtained by different proteases were significantly improved, the alkaline protease DPPH scavenging ability, hydroxyl radical scavenging ability, super oxygen anion clearance and ABTS+ radical scavenging ability were higher than those of other enzymatic hydrolysates, when the mass concentration was 2.5 mg/mL, the highest DPPH radical scavenging rate was 95.83%, the superoxide anion radical scavenging rate was 44.77%, the ABTS radical scavenging rate was 90.84%, and the hydroxyl radical scavenging rate was 44.77%. Therefore, this study shows that the enzymatic hydrolysate of Ziziphi Spinosae semen protein has good food processing performance, and its antioxidant activity is significantly increased, protein sources can be used as a potential protein resource in food, and provides a theoretical basis for the application of Ziziphi Spinosae semen protease hydrolysate in food industry.
-
神农本草经记载的酸枣仁,为鼠李科植物酸枣(Ziziphus jujube Mill.)的干燥成熟种子,是我国临床应用的传统中药,主产于河北、陕西、辽宁、河南等地。酸枣仁性味酸、甘平微温,具有养肝、宁心安神、敛汗生津的功效,主治虚烦不眠,惊悸怔祌,烦渴虚汗等症[1]。酸枣仁中富含多种有效成分,主要为黄酮、生物碱、皂苷、挥发油、蛋白质等,其中,蛋白质占其干重的40%,约含有18种人体所需氨基酸。酸枣仁具有良好的食品功能特性,是理想的功能产品和植物蛋白来源[2]。前期研究发现,酸枣仁蛋白具有一定的抗氧化、抗疲劳以及增强免疫功能等生物活性[3]。但经实验及文献研究发现,由于蛋白质复杂的空间结构以及较大的分子质量,导致酸枣仁蛋白的部分性质较一般(如溶解性、抗氧化性等),绝大部分不能够被人体摄入利用,营养价值得不到充分地发挥[4]。相关研究表明,多肽具有大分子蛋白质和游离氨基酸所不具备的生物学活性,且更容易被人体吸收,逐渐成为近年来食品领域的研究热点。
酶解法是国内外生产多肽的主要方法,是一种酶促降解蛋白达到提取、改性目的的方法,具有反应条件温和、副产物少等优点,还可以进一步通过分离纯化得到具有多种理想功能特性和高营养的多肽。随着研究的不断深入,从不同蛋白酶解产物中分离得到的多肽在人体调节中起到了重要作用,具有降血压、抗氧化、降胆固醇、降血糖、调节免疫等生理功能,可以作为潜在的食品添加剂,提高食品的营养价值,大大改善了食品的品质[5]。近年来,关于蛋白水解物的研究已有许多报道,研究证明水解物都具有较好的功能特性和生物活性。有研究表明,不同的蛋白酶解产物可产生不同的理化性质、功能特性以及生物活性,阎震等[6]用多种蛋白酶对牡丹籽蛋白进行酶解处理,所得的不同蛋白酶解产物理化性质及抗氧化活性均具有差异,其中,碱性蛋白酶解产物具有更高的水解度、更小的粒径以及更强的体外抗氧化活性。这是由于不同种类的蛋白酶在蛋白质链中有不同的活性位点和切割位点。
目前,有关酸枣仁蛋白酶解产物的研究较少,而不同蛋白酶处理酸枣仁蛋白的研究尚未发现。赵节昌[7]关于酶解酸枣仁蛋白制备抗氧化肽的研究结果表明,酸枣仁蛋白酶解物具有良好的DPPH自由基清除活性,但对其他的功能特性和抗氧化活性尚无研究。因此,本研究以酸枣仁蛋白为原料,采用木瓜蛋白酶、中性蛋白酶、碱性蛋白酶分别对酸枣仁蛋白进行酶解,并对不同酸枣仁蛋白酶解产物的功能特性和体外抗氧化活性进行研究,以期得到具有良好功能特性及抗氧化活性的蛋白酶解产物,为酸枣仁这种药食同源中药材在食品及保健食品行业中的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
酸枣仁药材 长春中医药大学附属医院;碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、木瓜蛋白酶(0.5~2 U/mg) 购于上海源叶生物科技有限公司;十二烷基硫酸钠(SDS) 美国 sigma公司;考马斯亮蓝R-250、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 北京索莱宝科技有限公司;其他试剂均为分析纯。
HX-400A型高速中药粉碎机 浙江省永康市溪岸五金药具厂;Y50型养生破壁机 中山市奥英斯电器有限公司;HH-6型数显恒温水浴锅 金坛市佳美仪器有限公司;DF-101S型集热式磁力搅拌器 金坛市医疗器械厂;SCIENTZ-50F型冷冻干燥机 宁波新芝冻干设备股份有限公司;PowerPac Basic型蛋白电泳装置 BIO-RAD;UV-1700型紫外分光光度计、2010A型高效液相色谱仪 日本岛津(中国)有限公司;S220-K-CN型台式pH计 梅特勒—托利多国际贸易(上海)有限公司;AB265-S型电子分析天平 梅特勒—托利多国际贸易(上海)有限公司;Centrifuge 5840 R型高速离心机 德国eppendorf公司。
1.2 实验方法
1.2.1 酸枣仁蛋白的提取
取适量酸枣仁药材,粉碎后过60目筛,置于5倍体积的石油醚中搅拌脱脂24 h,在3000 r/min室温下离心10 min除去石油醚,沉淀放置在通风橱中干燥,过60目筛。取均一的脱脂酸枣仁粉末150 g,按料液比1:20(g/mL)加入3000 mL蒸馏水溶解,配制1 mol/L NaOH溶液调节pH10,在55 ℃恒温水浴锅中搅拌50 min,冷却放凉后4000 r/min离心20 min,取上清液进行酸沉,用1 mol/L盐酸溶液调节pH4,4 ℃静置2 h,继续4000 r/min离心10 min,沉淀加水用养生破壁机复溶,用1 mol/L NaOH溶液调至中性,装袋透析48 h,期间每2 h换一次水,−80 ℃冻干得酸枣仁蛋白[8]。
1.2.2 酸枣仁蛋白的酶解
取蒸馏水100 mL,加入酸枣仁蛋白5 g,溶解制成5%的蛋白溶液,分别在各酶的最适条件下进行酶解,具体条件见表1。将蛋白溶液置于55 ℃水浴锅中保温放置,用1 mol/L NaOH溶液、1 mol/L HCl溶液调节pH至酶最适pH后,分别加入不同种类的蛋白酶0.1 g(酶与底物比为2%),酶解过程中每隔20 min用1 mol/L NaOH溶液维持反应体系的pH,酶解时间为3 h,结束后沸水灭酶10 min,冷却至室温,8000 r/min离心10 min,取上清液冷冻干燥,−20 ℃保存备用[9]。
表 1 不同蛋白酶最适温度和最适pHTable 1. Optimum temperature and pH of different proteases酶种类 最适温度(℃) 最适pH 碱性蛋白酶 55 8.5 中性蛋白酶 50 6.5 木瓜蛋白酶 65 6.0 1.2.3 水解度的测定
总氮含量:采用GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法进行测定。氨态氮含量:采用GB 5009.235-2016《食品安全国家标准食品中氨基酸态氮的测定》中的酸度计法进行测定[10]。称量5.0 g试样于50 mL烧杯中,用水分数次洗入100 mL容量瓶中,加水至刻度,混匀后吸取20.0 mL置于200 mL烧杯中,加60 mL水,开动磁力搅拌器,用氢氧化钠标准溶液[c(NaOH)=0.050 mol/L]滴定至酸度计指示pH为8.2,记下消耗氢氧化钠标准滴定溶液的毫升数,可计算总酸含量。加入10.0 mL甲醛溶液,混匀。再用氢氧化钠标准滴定溶液继续滴定至pH为9.2,记下消耗氢氧化钠标准滴定溶液的毫升数。同时取80 mL水,先用氢氧化钠标准溶液调节至pH为8.2,再加入10.0mL甲醛溶液,用氢氧化钠标准滴定溶液滴定至pH为9.2,做试剂空白试验。
水解度(DH,%)=氨态氮含量总氮含量×100 1.2.4 多肽含量的测定
采用福林酚法[11]对三种蛋白酶解产物中的多肽含量进行测定。配制福林酚试剂甲、试剂乙。分别取样品溶液1.3 mL,加水稀释并定容至100 mL,得多肽含量大约为0.14 mg/mL的供试品溶液,待测。取1 mL样品溶液(约合20~250 μg多肽)加入5 mL试剂甲混匀,于20~25 ℃放置10 min,再加0.5 mL试剂乙(Folin-酚),立即摇匀,在20~25 ℃保温30 min然后于500 nm处比色,以1 mL水代替样品作空白对照。测定后,可以在标准曲线中查出未知样品的浓度。取0.2 mL样品溶液(约含5~100 μg多肽)加入1 mL试剂甲(选用0.3~0.5 cm直径的小试管)混匀,10 min后,加入0.1 mL试剂乙,立即混匀,30 min后比色。
1.2.5 SDS-PAGE电泳分析
十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳使用12.5%分离凝胶和5%浓缩凝胶,酸枣仁蛋白或酶解物和上样缓冲液以1:1的比例混合,混合溶液在100 ℃加热5 min。待其冷却至室温后,向凝胶中加入10 μL混合溶液上样。用Bio-Rad电泳仪进行SDS-PAGE电泳[12],样品在70 V下运行30 min,在140 V下运行1 h。凝胶在考马斯亮蓝R250中染色,并在脱色溶液(冰醋酸:甲醇:水=20:60:120)中脱色。最后,所得凝胶在凝胶成像仪中拍照成像。
1.2.6 溶解性的测定
加蒸馏水于酶解物中配制成0.1%的溶液,分别调节溶液pH(2~10),离心15 min(5000 r/min),取上清液补足至1 mL,用福林酚法分别测定上清液和样品溶液中的多肽含量。
溶解度(%)=上清液中多肽含量样品中多肽含量×100 1.2.7 持水性、持油性测定
持水性:取酸枣仁蛋白酶解产物0.5 g,置于10 mL离心管中,加入10 mL蒸馏水,混匀,放置室温25 ℃下30 min,4000 r/min离心20 min,去除上清称量刻度离心管的质量。
持水性(g/g)=m2−m1m0 式中:m0:样品质量(g),m1:样品质量+离心管质量(g),m2:离心管质量+去除上清液的样品质量。
持油性:在10 mL离心管中加入0.5 g酶解物,3 mL大豆色拉油,充分混匀样品与色拉油,在室温条件下放置30 min,4000 r/min离心20 min,弃去上层未被吸附的色拉油,称量质量。
持油力(g/g)=m2−m1m0 式中:m0:样品质量(g),m1:离心管质量+样品质量(g),m2:离心管质量+吸油后的样品质量(g)。
1.2.8 起泡性及其泡沫稳定性
称50 mL 1%的样品溶液,分别调pH(2~10),记体积V0,置于10000 r/min高速分散器中1 min,记总体积V1,30 min后记总体积V2。
起泡性(%)=V1−V0V0×100 起泡稳定性(%)=V2−V0V1−V0×100 1.2.9 乳化性及其稳定性
配制9 mL 1%的蛋白及样品溶液,分别调节pH(2、4、6、8、10、12),加入3 mL大豆色拉油,10000 r/min均质2 min,搅打成均一的乳化液,取50 mL于试管中,加入5 mL 0.1% SDS溶液,设置500 nm测吸光值A1,30 min后测吸光度A2[13]。
乳化性(EAI,m2/g)=2×2.303×A1×DΦ×c×L×10000×100 乳化稳定性(ESI,%)=A1×ΔtA1−A2×100 式中:Φ:油相的体积分数(%);D:稀释倍数;c:酸枣仁蛋白酶解产物质量浓度(g/mL);t:时间(min);L:光程(1 cm);2.303表示ln10。
1.2.10 抗氧化活性的测定
1.2.10.1 DPPH自由基清除率测定
加蒸馏水于一定质量的酶解物中配制成不同质量浓度的溶液;分别吸取1 mL样品溶液与DPPH溶液混匀,室温下避光反应30 min,测定517 nm处吸光度;以1 mL蒸馏水代替样品溶液作为空白对照组,以0.5 mL蒸馏水+0.5 mL 95%乙醇混合溶液代替DPPH溶液作为样品对照组[14],以维生素C、谷胱甘肽为阳性对照组,并按下式计算DPPH自由基清除率。
S(%)=A0−A1+A2A0×100 式中:S:DPPH自由基清除率(%);A0:空白对照组吸光值;A1:样品组吸光值;A2:样品对照组吸光值。
1.2.10.2 ABTS自由基清除率测定
将5 mL浓度为7.4 mmol/L的ABTS溶液与88 μL 2.6 mmol/L的过硫酸钾溶液混匀,静置12~16 h,配制成ABTS+储备液。取ABTS+储备液0.4 mL,用pH7.4的PBS溶液稀释,使734 nm处吸光度为0.7±0.02,制成ABTS+工作液[15]。分别将200 μL ABTS+工作液与10 μL不同浓度的样品溶液混匀,室温避光反应6 min,测定734 nm处吸光度值。用10 μL PBS溶液代替样品溶液作为空白对照组,以维生素C、谷胱甘肽为样品对照组,按下式计算ABTS自由基清除率。
S(%)=A0−A1+A2A0×100 式中:S:ABTS自由基清除率(%);A0:空白对照组吸光值;A1:样品组吸光值;A2:样品对照组吸光值。
1.2.10.3 超氧阴离子清除率测定
采用邻苯三酚自氧化法[16]。将5 mL Tris-HCl缓冲溶液(0.05 mol/L,pH 8.2)和0.5 mL不同浓度样品溶液混合,于25 ℃水浴中反应20 min,然后加入在25 ℃下预热0.5 mL邻苯三酚溶液(7 mmol/L)。每隔10 s在325 nm处测定混合物的吸光度,即为实验组A1。以0.3 mL蒸馏水代替邻苯三酚溶液作为样品对照组A2,以0.1 mL蒸溜水代替样品液作为空白对照组A0。并于420 nm处测定吸光度值,蒸馏水调0。按下式计算超氧阴离子的清除率:
S(%)=A0−A1+A2A0×100 式中:S:超氧阴离子清除率(%);A0:为空白对照组吸光值;A1:样品组吸光值;A2:样品对照组吸光值。
1.2.10.4 羟基自由基清除率的测定
将1.0 mL样品溶液与FeSO4(1.0 mL,2 mmol/L)及水杨酸乙醇溶液(1.0 mL,6 mmol/L)混合。随后,向溶液中添加1.0 mL H2O2(6 mmol/L),37 ℃水浴反应1 h后,在510 nm处立即测定吸光度[17]。1 mL蒸馏水代替H2O2,测定吸光度值作为样品对照组;1 mL蒸馏水代替样品溶液作为空白对照;以照维生素C代替样品作为样品阳性对照组,按下式计算羟基自由基的清除率:
S(%)=A0−A1+A2A0×100 式中:S:羟基自由基清除率,%;A0:空白对照组吸光值;A1:样品组吸光值;A2:样品对照组吸光值。
1.3 数据处理
所有试验平行测定3次,结果取平均值,使用Origin 2019和SPSS 20.0软件进行数据处理。
2. 结果与分析
2.1 水解度(DH)的测定
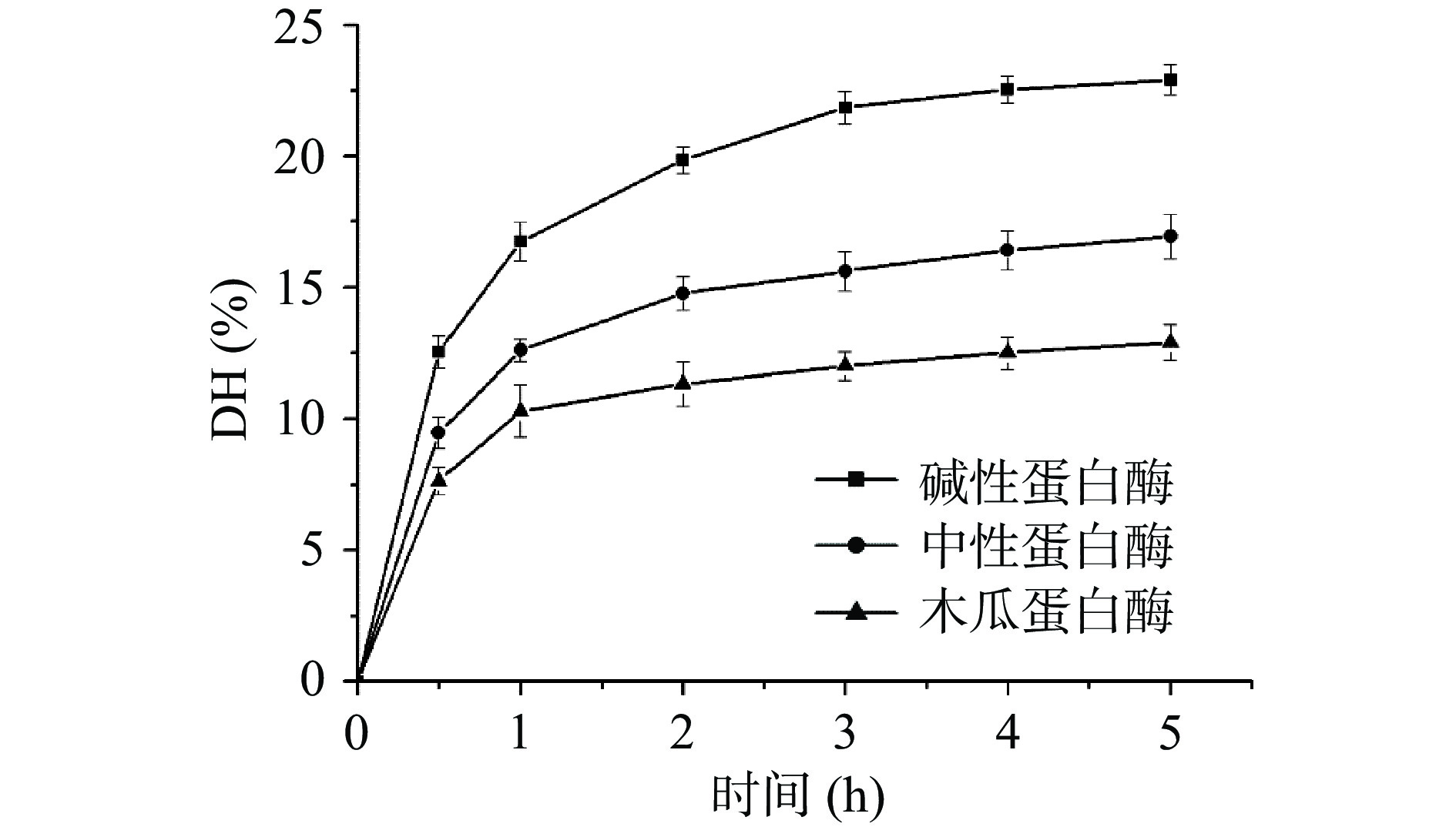
酶解法作为常用的蛋白质改性方法,现已得到广泛地应用,其中,蛋白酶种类是影响酶解过程的一个重要因素,蛋白酶能够将蛋白质水解成为小分子肽类和氨基酸[18]。由于蛋白酶具有底物专一性,不同种类的蛋白酶,其酶切位点也不相同,进而可导致酶解产物的理化性质及生物活性不同[19]。酸枣仁蛋白不同蛋白酶解产物的水解度测定结果如图1所示,不同酸枣仁蛋白酶解产物的水解度随着时间的延长而增大。反应开始的前3 h内,不同酶解产物的水解度增长速率较快,当反应时间超过3 h后,增长趋势较为平缓,所以后续实验均采用了3 h作为水解的最适时间。实验结果表明,相比于中性蛋白酶解产物(16.94%)及木瓜蛋白酶解产物(12.89%),碱性蛋白酶解产物具有更高的水解度(22.91%),可能是由于碱性蛋白酶是一种内切蛋白酶,具有更多的催化位点来切断蛋白质中的肽键,使得酶解反应更加完全[20]。
2.2 电泳结果分析
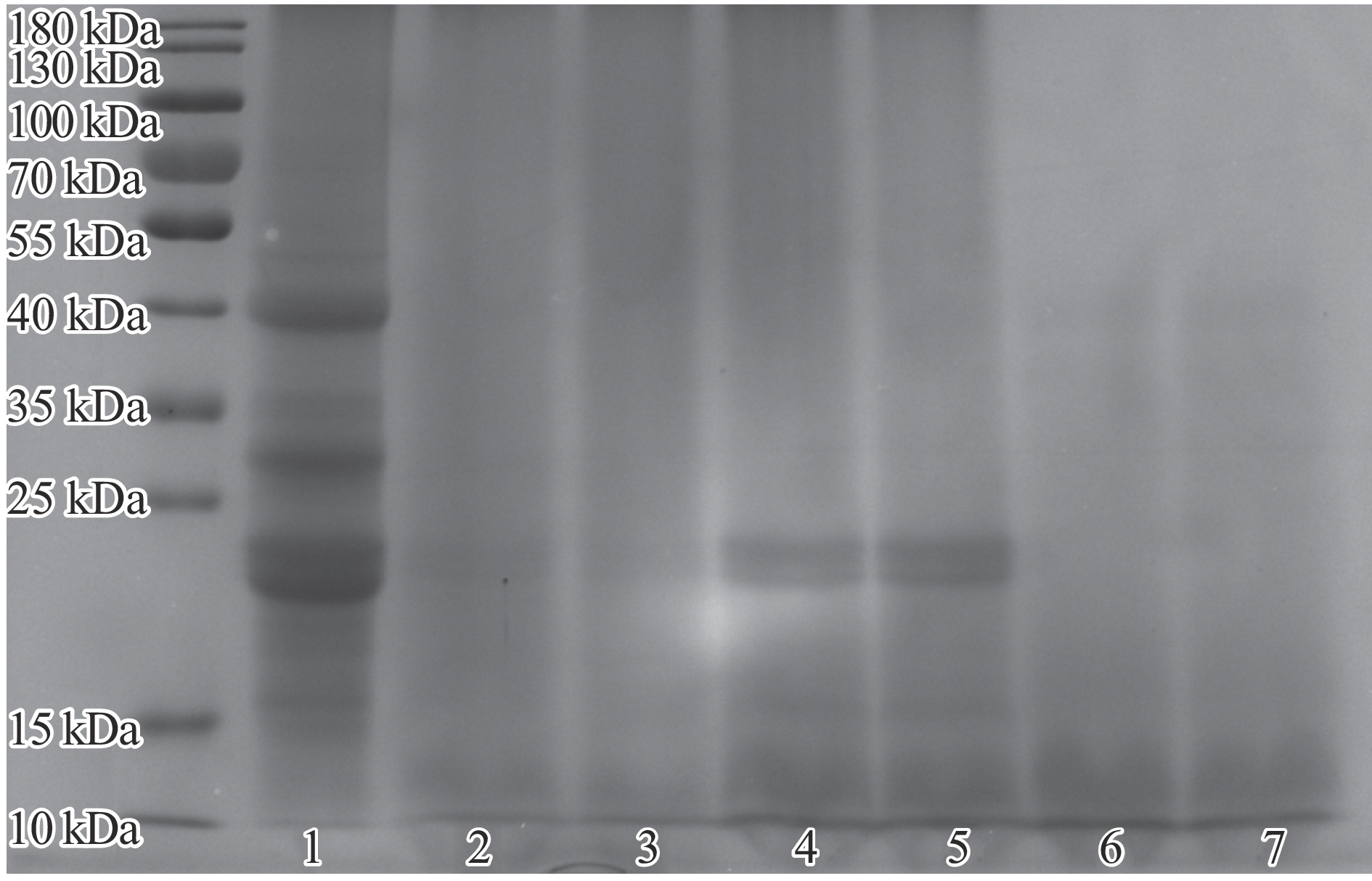
SDS-PAGE通常用于蛋白质分子量和亚基组成分析。在还原条件下酸枣仁蛋白及其不同酶解产物的电泳图如图2所示。结果表明,酸枣仁蛋白主要由10~40 kDa(15、20、25、35、40 kDa)范围内的五条主要低分子量亚基组成。经不同蛋白酶处理后,不同蛋白酶解物的条带转移到低分子量范围,条带主要分布在15 kDa以下,表明酶解后分子量较大的蛋白亚基被降解,产生分子量较小的片段。其中,中性蛋白酶解产物及木瓜蛋白酶解产物在22 kDa处仍具有一定的蛋白条带,而碱性蛋白酶解产物中未发现此情况,进一步结合水解度测定结果分析,表明碱性蛋白酶可使水解反应更完全,产生更多具有小分子量的肽段。
2.3 不同酸枣仁蛋白酶解产物的溶解性
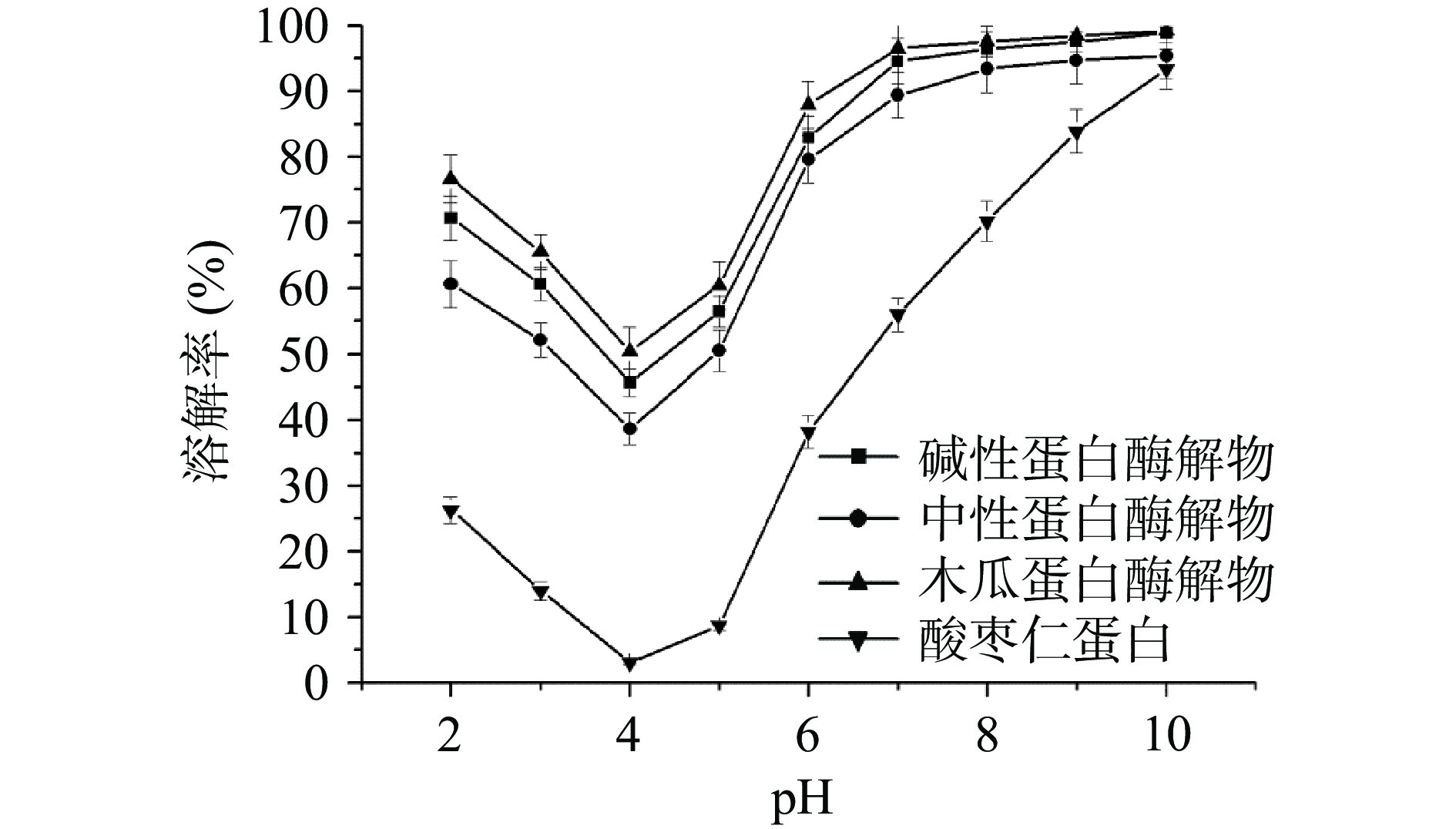
3种酶解产物在不同pH条件下的溶解性由图3所示,结果表明,木瓜蛋白酶解产物的溶解度最大,其次是碱性蛋白酶解产物,最后是中性蛋白酶解产物,这可能是由于不同酶解产物其氨基酸序列及所得到的肽段长度存在一定的差异而导致的。3种酶解物在pH2~10范围内的溶解性均高于酸枣仁蛋白,这可能是由于酶解后,肽键断裂形成了部分更小的肽段以及部分亲水性基团,进而导致其溶解性增强[21]。当pH为4时,木瓜蛋白酶解物、中性蛋白酶解物、碱性蛋白酶解物的溶解度最小,达到了酸枣仁蛋白的等电点,分子聚合,溶解性降低[22]。随着pH升高,不同蛋白酶解产物的溶解性逐渐增强。以上研究表明酸枣仁蛋白酶解产物具有很好的溶解性。
2.4 不同酸枣仁蛋白酶解产物的持水性和持油性
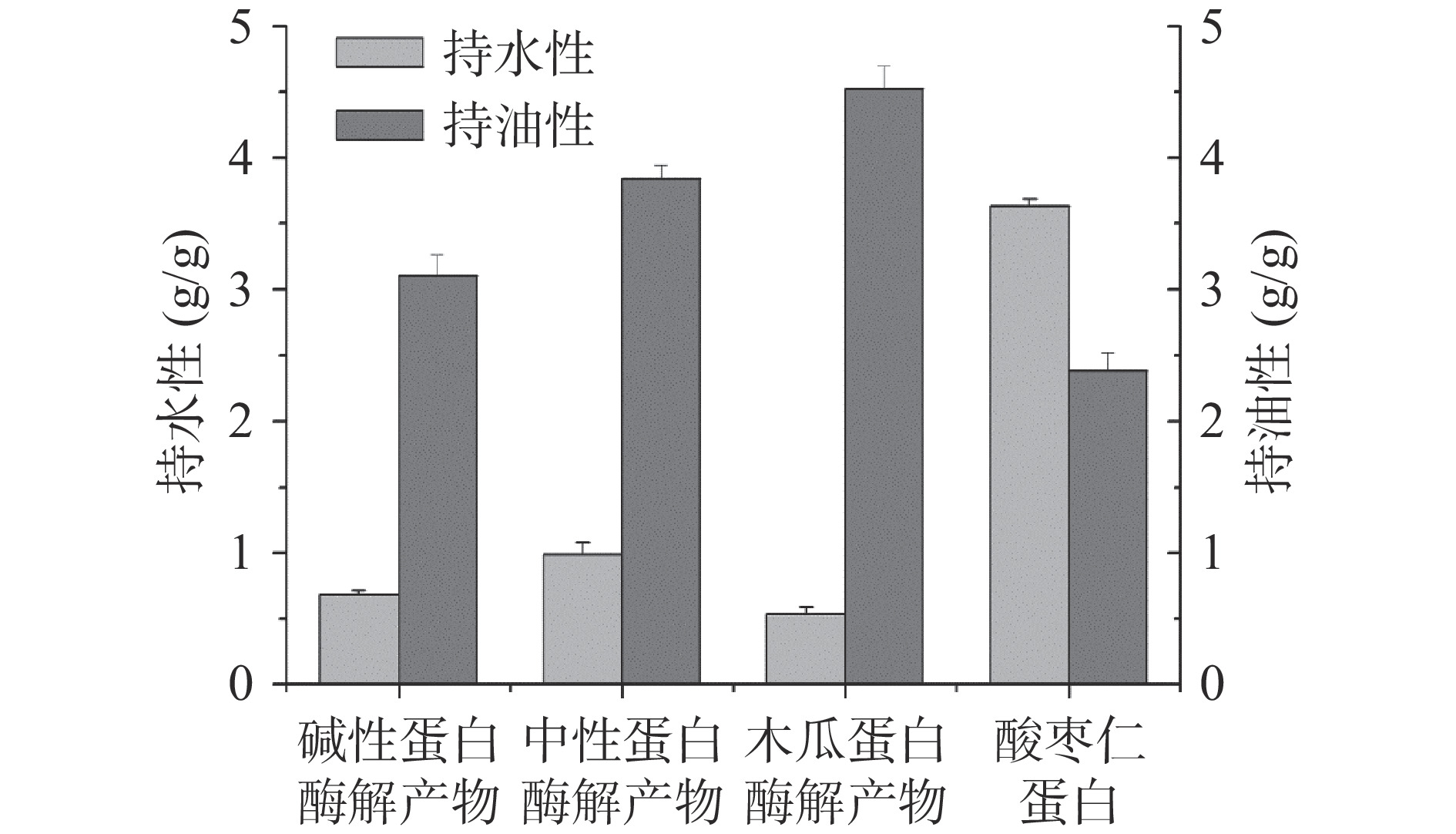
3种不同酸枣仁蛋白酶解产物的持水性和持油性如图4所示,相比于酸枣仁蛋白,持水性明显降低,这可能与酶解产物本身的溶解性有较大关系,酶解后溶解性明显增强,导致其对水的吸附能力变差,进而降低了持水性[23]。此外,由图4可知,相比于酸枣仁蛋白,不同的酸枣仁蛋白酶解产物持油性均有明显提升,由于不同种类蛋白酶的作用位点不同,酶解获得的多肽片段也不相同,表现出的功能特性存在差异,其中,木瓜蛋白酶的持油性最大,这是由于酶解使得蛋白质的空间结构被破坏,部分亲脂基团外露,影响了木瓜蛋白酶的构象和催化活性,进而影响其与底物的结合和催化,通过疏水作用增强蛋白质与油脂的结合能力,进一步增强了持油能力[24]。
2.5 不同酸枣仁蛋白酶解产物的起泡性和起泡稳定性
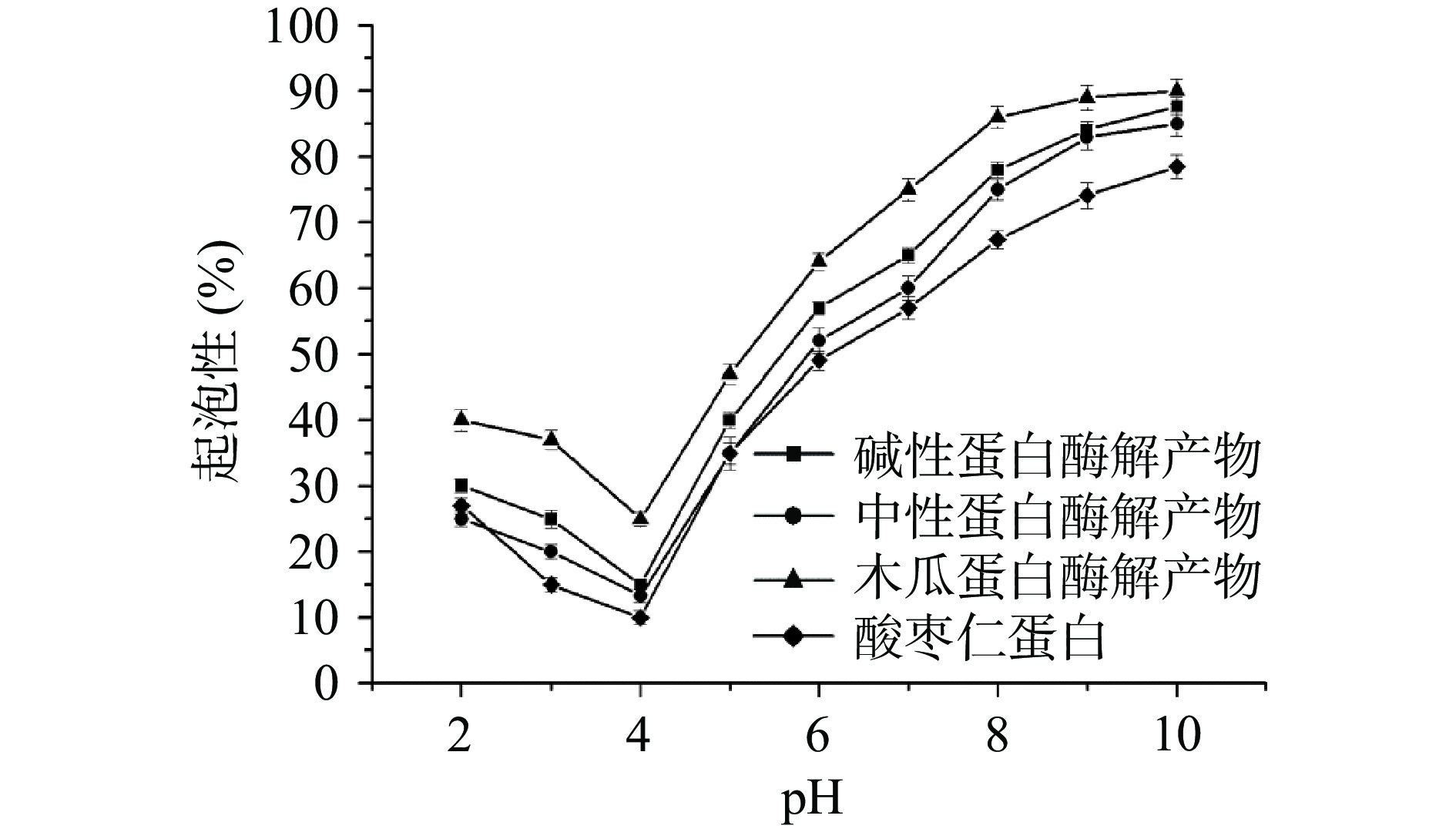
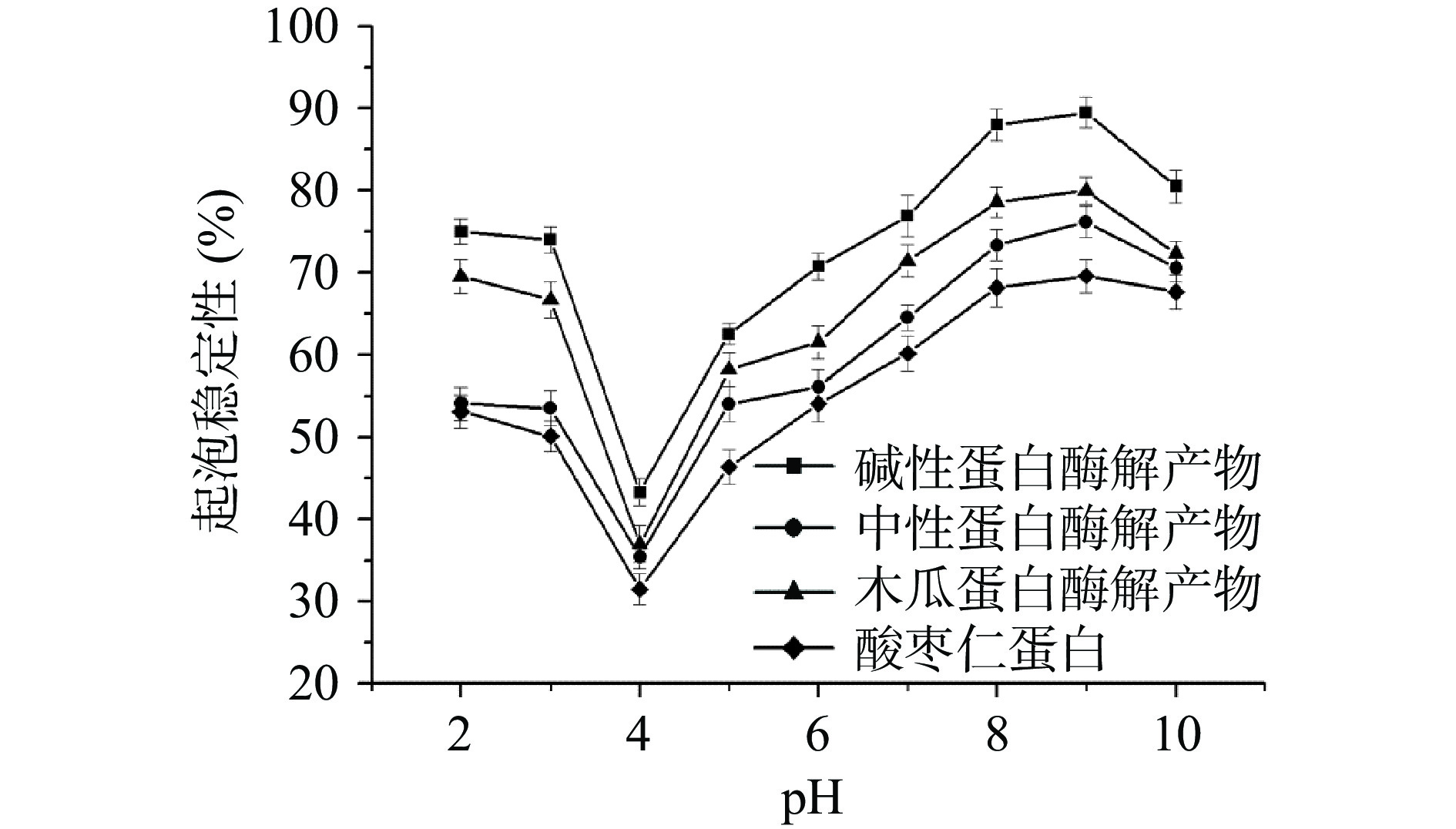
3种不同酸枣仁蛋白酶解产物的起泡性和起泡稳定性如图5、图6所示,不同酸枣仁蛋白酶解产物的起泡性强弱为:木瓜蛋白酶解产物>碱性蛋白酶解产物>中性蛋白酶解产物。和酸枣仁蛋白相比,酶解产物的起泡性明显提升,因为酶解产物的溶解性明显增强,溶液的分散性增加,进一步增强了其起泡性能[25]。酸枣仁蛋白及其酶解产物在pH(2~10)范围内,起泡性先减弱后增强,在pH4时最低,此时达到了蛋白质的等电点,溶解性较差,分散在溶液中的蛋白质较少,进一步导致其起泡性较差,随着pH的逐渐升高,不同酸枣仁蛋白酶解产物的溶解性逐渐增强,其起泡性也随之增强。以上研究结果表明,不同酸枣仁蛋白酶解产物均具有良好起泡性能,可将其添加到泡沫型食品中,增添食品的风味,减少化学起泡剂的使用[26]。
2.6 不同酸枣仁蛋白酶解物的乳化性和乳化稳定性
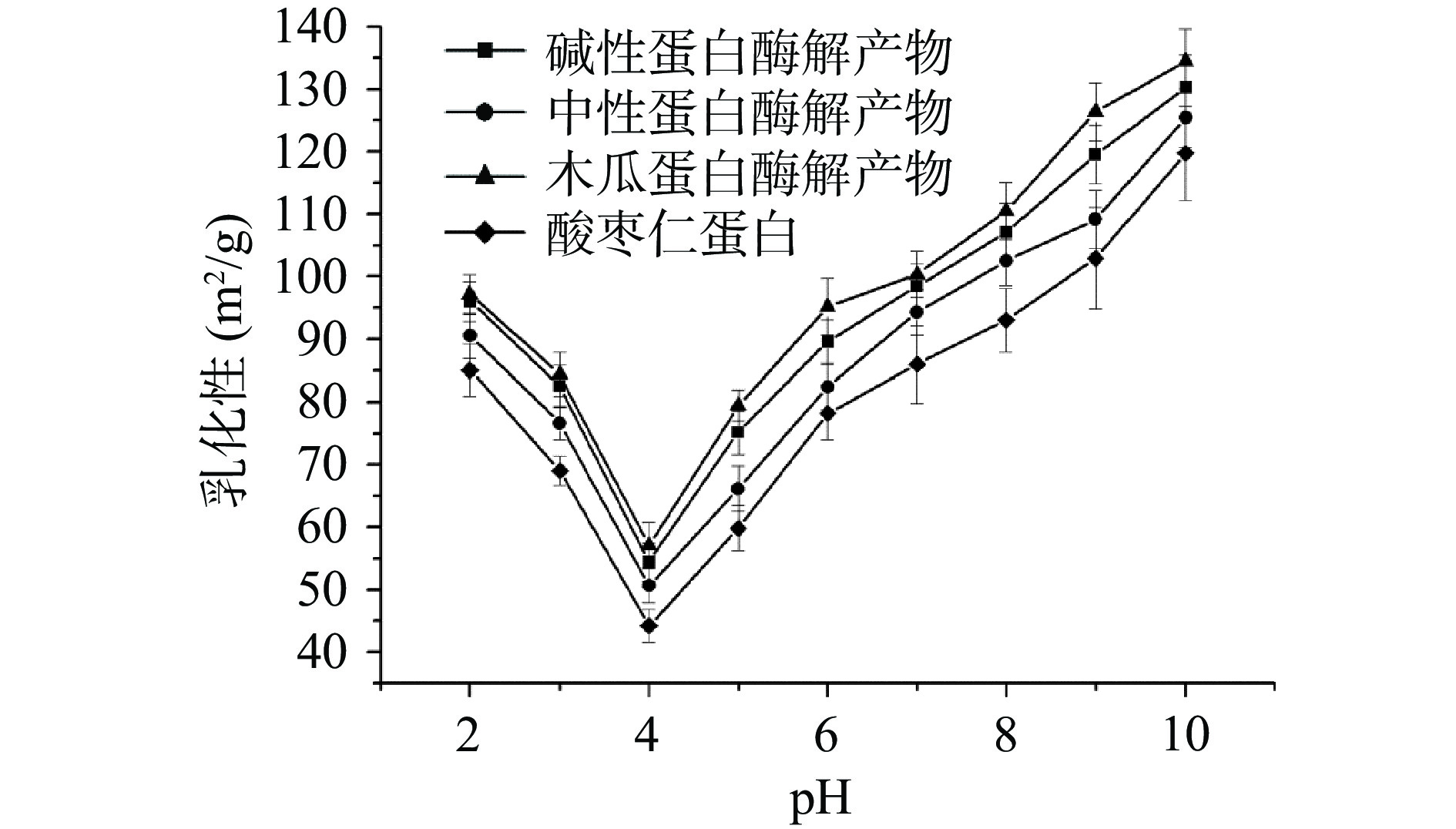
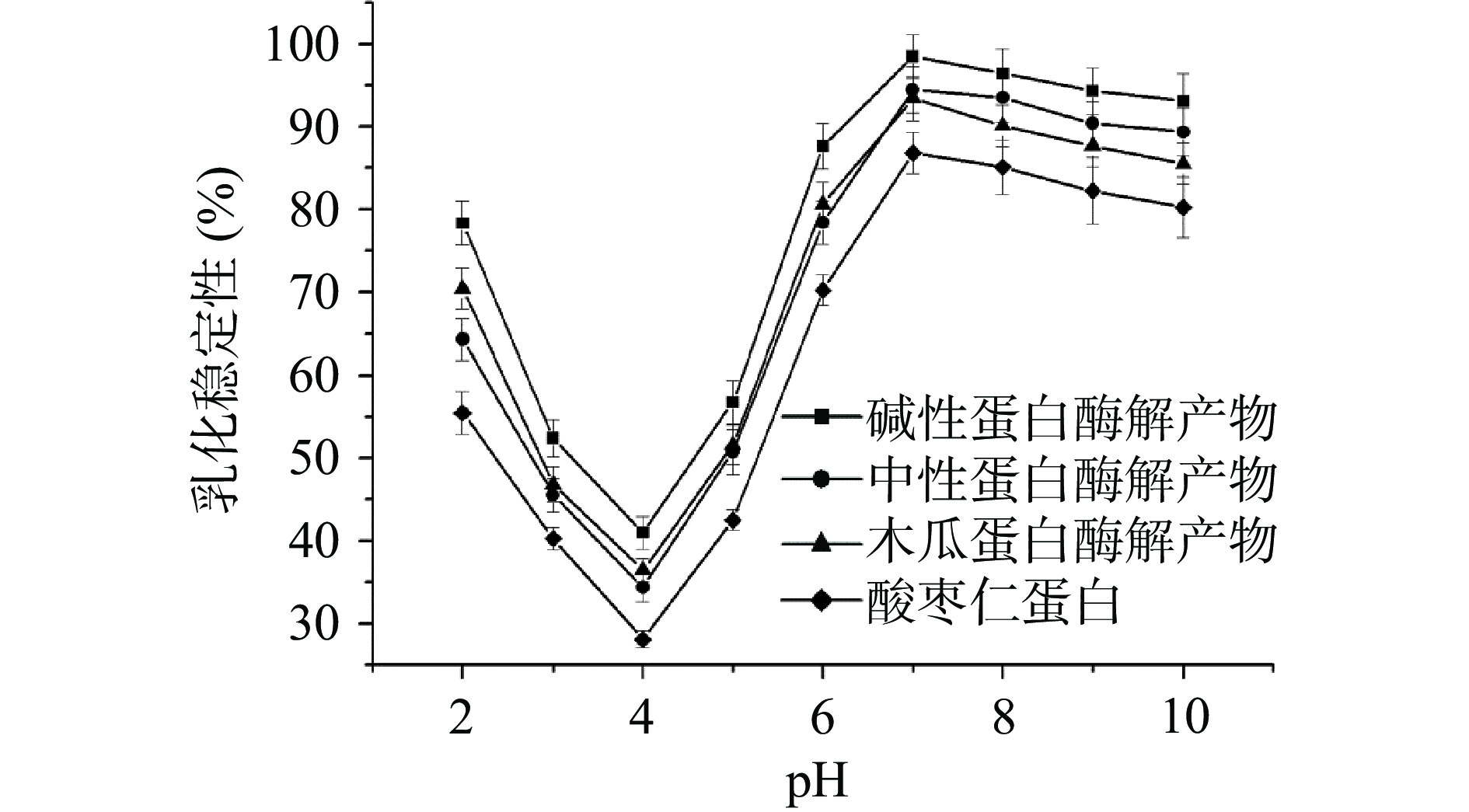
不同酸枣仁蛋白酶解物的乳化性及其稳定性如图7、图8所示。由图可知,相比于酸枣仁蛋白,木瓜蛋白酶解产物、中性蛋白酶解产物及碱性蛋白酶解物乳化性和乳化稳定性均有明显提升,这可能是由于酶解过程中,蛋白质中的疏水性残基进一步暴露,增强了与油的结合能力,使得蛋白质更快更多的与油水界面吸附,增强了乳化性[27]。研究表明,木瓜蛋白酶解产物的乳化性略高于碱性蛋白酶解产物及中性蛋白酶解产物,这可能与其溶解度有关,溶解度高的酶解产物,溶液中蛋白质分子含量较高,与油水界面接触吸附的能力就越强,导致其乳化性较强[28],碱性蛋白酶的乳化稳定性强于中性蛋白酶和木瓜蛋白酶解物。以上研究结果表明,酶解后可进一步提高酸枣仁蛋白的乳化性能,所得的酶解产物具有较好的食品功能特性。
2.7 酸枣仁蛋白酶解物的体外抗氧化活性
2.7.1 DPPH自由基清除能力
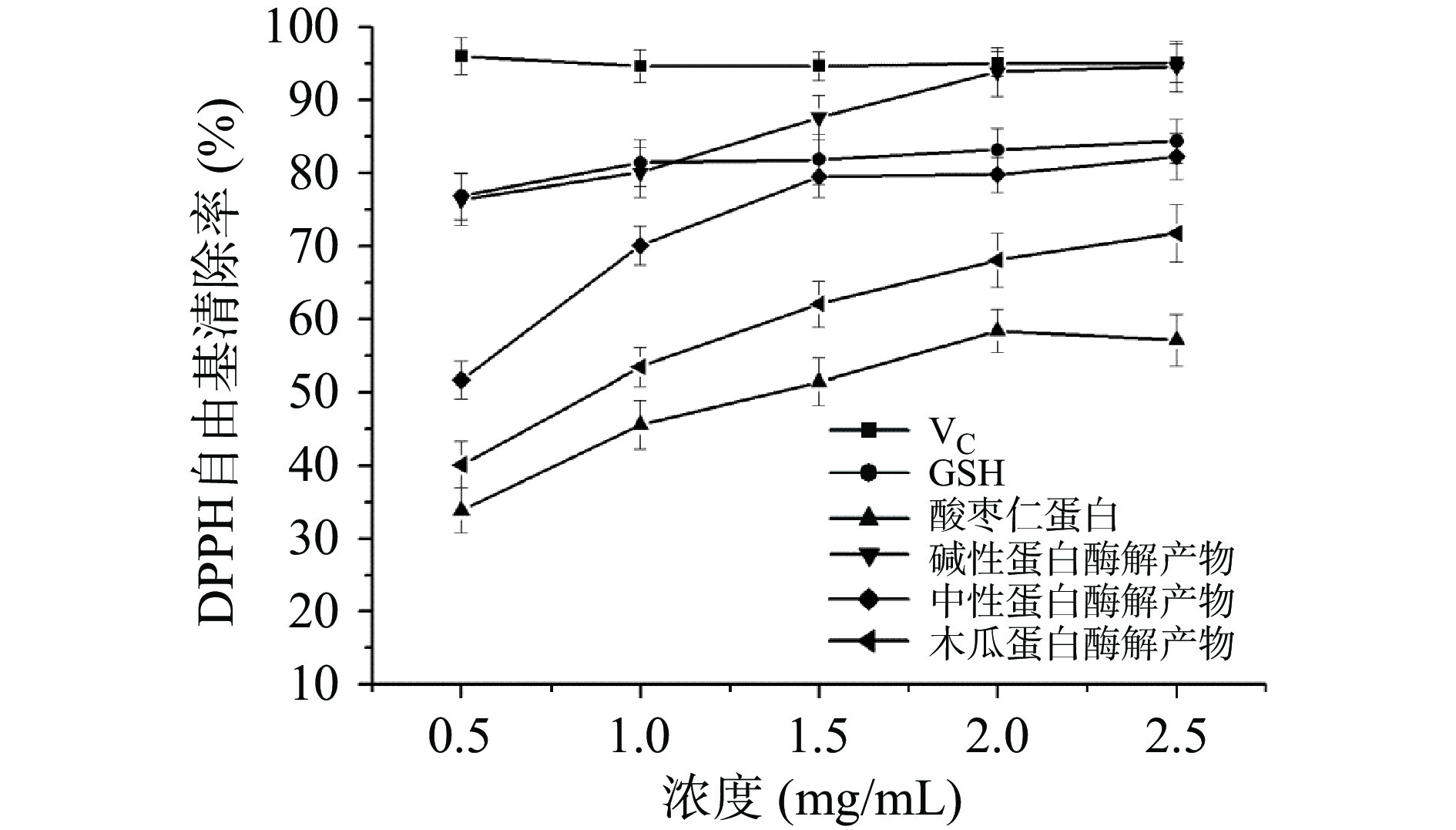
不同酸枣仁蛋白酶解物的DPPH自由基清除能力由图9所示,当质量浓度在0.5~2.5 mg/mL范围内,酸枣仁蛋白及其不同酶解产物的DPPH自由基清除能力随浓度不断的增加而不断增强,不同酸枣仁蛋白酶解产物的DPPH自由基清除能力均明显高于酸枣仁蛋白。相同质量浓度时,碱性蛋白酶解物的DPPH清除能力最强,其次是中性蛋白酶解产物,木瓜蛋白酶解物的清除能力最弱,当浓度为2.5 mg/mL时,碱性蛋白酶解产物的清除能力可高达95.87%,逐渐接近于阳性对照组VC的清除能力,且高于常见的抗氧化肽谷胱甘肽(GSH)的清除能力。这是由于碱性蛋白酶酶解时,碱性蛋白酶解物中的疏水性氨基酸含量较高,脂溶性的DPPH与其更好的结合,对DPPH的清除能力明显增强[29]。以上研究结果表明酸枣仁蛋白酶解产物具有很强的DPPH自由基清除活性。
2.7.2 ABTS自由基清除能力
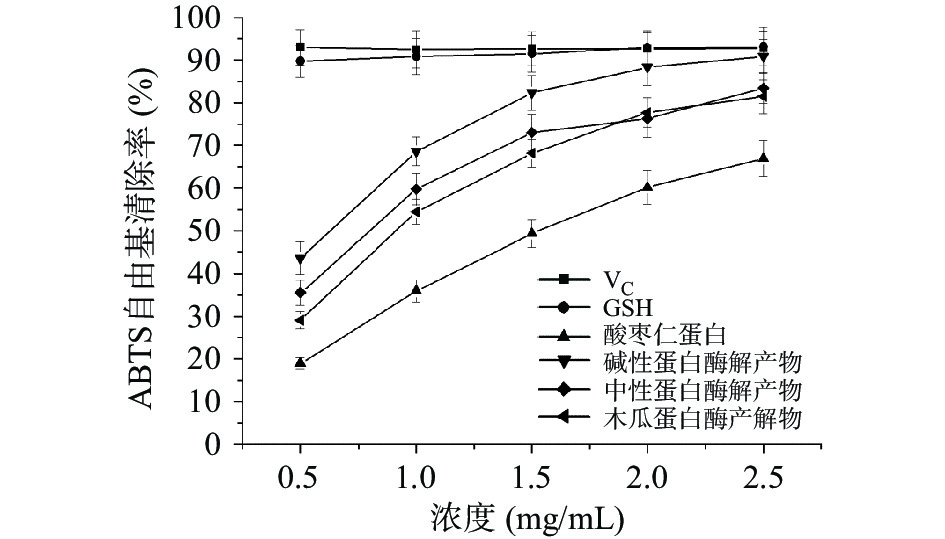
不同酸枣仁蛋白酶解物的ABTS自由基清除能力如图10所示,当质量浓度为0.5~2.5 mg/mL范围内时,酸枣仁蛋白及其酶解物对ABTS自由基清除活性随质量浓度的增加而增强。结果表明,不同酶解产物的ABTS自由基清除能力均明显增强。在相同质量浓度下,碱性蛋白酶酶解后的蛋白酶解物对ABTS自由基清除率明显高于酸性蛋白酶和中性蛋白酶处理的蛋白酶解物。当质量浓度为2.5 mg/mL时,对ABTS自由基清除率最高达到90.84%,接近于阳性对照组VC及GSH的清除能力,表明碱性蛋白酶解物具有较强的ABTS自由基清除能力,可作为一种潜在的抗氧化剂[30]。
2.7.3 超氧阴离子自由基清除能力
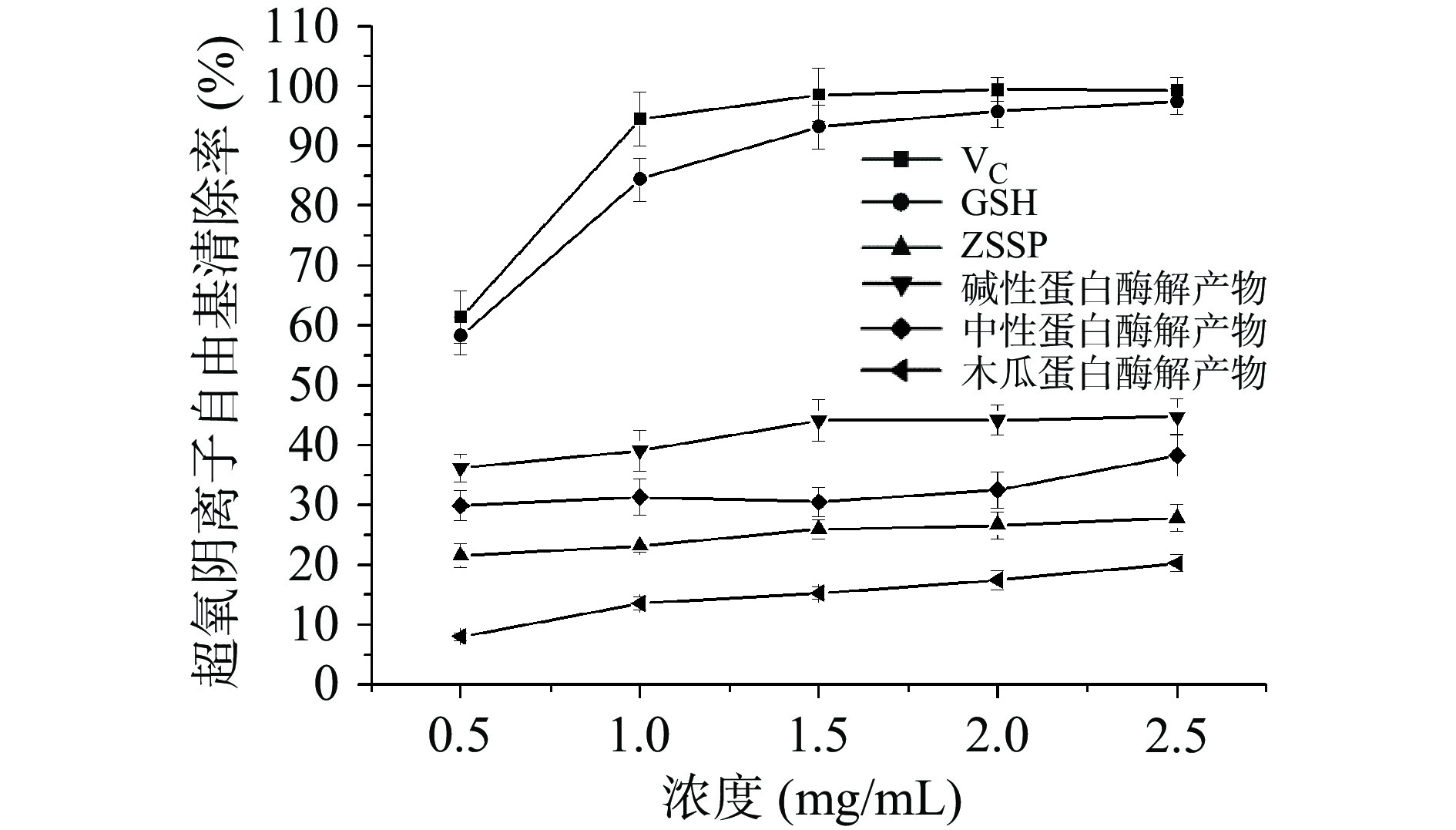
不同酸枣仁蛋白酶解物超氧阴离子自由基清除能力如图11所示,当质量浓度为0.5~2.5 mg/mL范围时,酸枣仁蛋白及其酶解产物对超氧阴离子的清除活性与样品浓度呈正相关,均在2.5 mg/mL时具有最高的清除活性。其中碱性蛋白酶解产物的超氧阴离子自由基清除效果最好,其次是中性蛋白酶,木瓜蛋白酶解产物最差。相比于酸枣仁蛋白,不同酸枣仁蛋白酶解产物的自由基清除活性均具有明显提升,表明酶解处理可明显提高蛋白质的抗氧化性。当质量浓度为2.5 mg/mL时,碱性蛋白酶酶解物的超氧阴离子清除率最高为44.77%,中性蛋白酶解产物超氧阴离子清除率为38.35%,木瓜蛋白酶解产物超氧阴离子清除率为20.33%。其中碱性蛋白酶解物清除效果好与其产生大量的疏水性氨基酸与自由基结合从而产生良好的抗氧化效果有关[31]。
2.7.4 羟基自由基清除能力
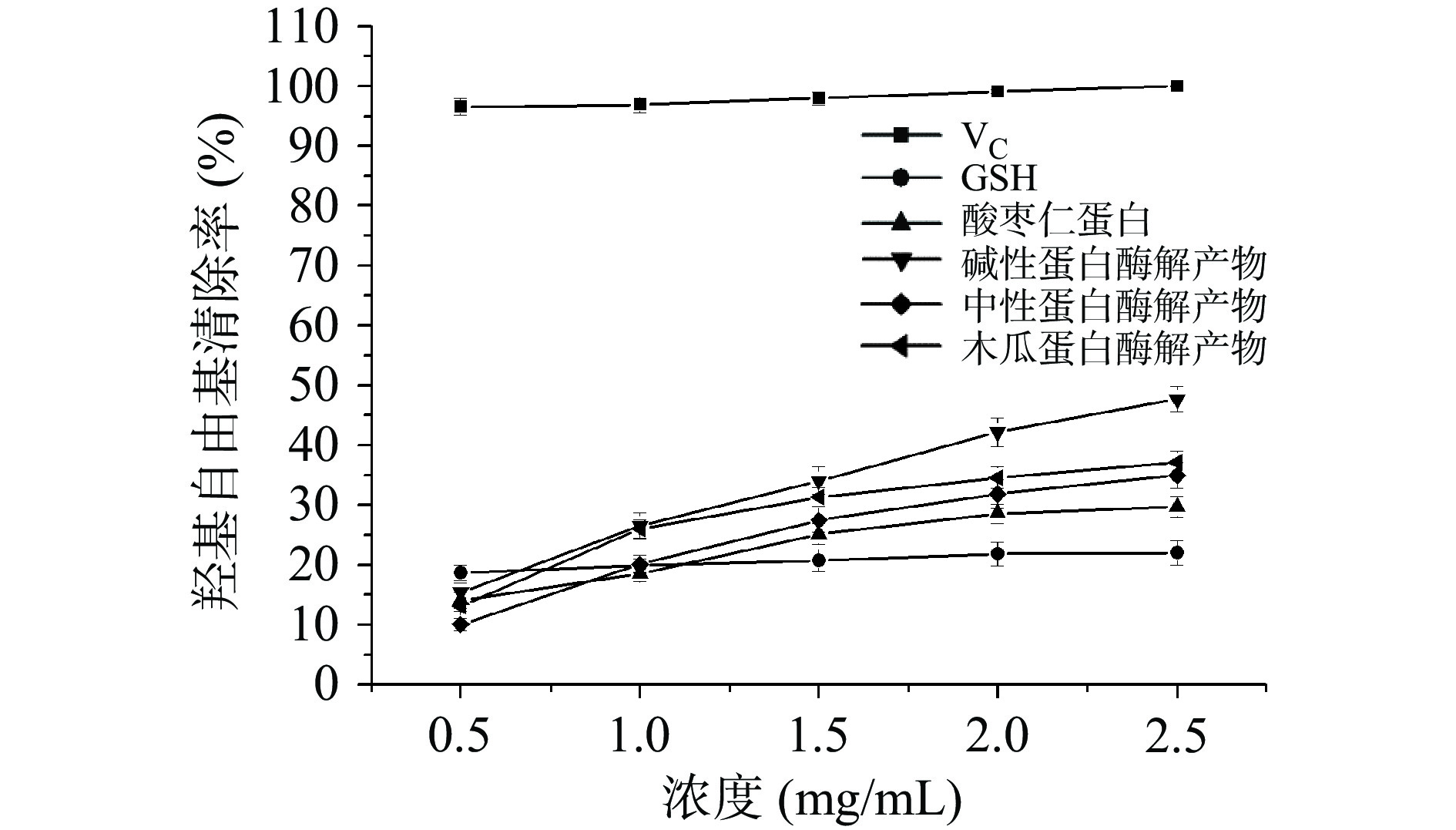
3种酸枣仁蛋白酶解物的羟基自由基清除能力如图12所示,在0.5~2.5 mg/mL范围内,羟基自由基的清除能力与不同酸枣仁蛋白酶解产物的质量浓度呈正比关系,即随着质量浓度的增加,羟基自由基的清除能力越强。实验结果表明,酸枣仁蛋白经不同蛋白酶处理后,不同酸枣仁蛋白酶解产物的羟基自由基清除活性明显增强。3种蛋白酶解产物中,碱性蛋白酶解产物的羟基自由基清除能力最强,为47.77%;其次是木瓜蛋白酶解产物,为37.16%,中性蛋白酶解产物的羟基自由基清除能力最差,为35.04%。以上研究结果表明,不同酸枣仁蛋白酶解产物均具有一定的羟基自由基清除能力,其中碱性蛋白酶解产物效果最好。
3. 结论
本研究以酸枣仁蛋白为原料,采用不同蛋白酶对其进行酶解处理,得到三种不同蛋白酶解产物。并对不同酸枣仁蛋白酶解产物的功能特性及体外抗氧化活性进行比较研究。SDS-PAGE电泳结果表明,酶解处理后,其分子量分布有所变化,由高分子量分布向低分子量分布转变,其中,碱性蛋白酶解产物的变化最为明显。功能特性研究表明,相比于酸枣仁蛋白,持水性有所降低,不同蛋白酶解产物的溶解性、吸油性、起泡性、乳化性及乳化稳定性均具有不同程度地提高,功能特性在一定温度和pH范围内保持良好。体外抗氧化活性结果表明,与酸枣仁蛋白相比,不同酸枣仁蛋白酶解物的体外抗氧化活性均具有不同程度地提升,其中经碱性蛋白酶酶解的产物DPPH、ABTS、超氧阴离子自由基等清除能力均强于中性蛋白酶解产物及木瓜蛋白酶解产物,表明酶解大大提高了酸枣仁的体外抗氧化能力,以上研究表明所得的酸枣仁蛋白酶解产物具有较好的功能特性以及体外抗氧化活性,可作为一种潜在的抗氧化剂应用于食品及保健食品加工行业中,有助于发挥酸枣仁药材自身最大的利用价值,为酸枣仁蛋白酶解产物的应用提供了一定的理论依据。
-
表 1 不同蛋白酶最适温度和最适pH
Table 1 Optimum temperature and pH of different proteases
酶种类 最适温度(℃) 最适pH 碱性蛋白酶 55 8.5 中性蛋白酶 50 6.5 木瓜蛋白酶 65 6.0 -
[1] 袁杨杨, 孙从永, 徐希明, 等. 酸枣仁活性成分药理作用机制的研究进展[J]. 中国药师,2017,20(9):1622−1627. [YUAN Y Y, SUN C Y, XU X M, et al. Research progress on pharmacological mechanism of active components from Ziziphi spinosae semen[J]. China Pharm,2017,20(9):1622−1627. doi: 10.3969/j.issn.1008-049X.2017.09.028 [2] 谭云龙, 孙晖, 王喜军, 等. 酸枣仁化学成分及其药理作用研究进展[J]. 时珍国医国药,2014,25(1):186−188. [TAN Y L, SUN H, WANG X J, et al. Research progress on chemical constituents and pharmacological effects of Ziziphi spinosae semen[J]. Shi Zhen, Traditional Chinese Medicine,2014,25(1):186−188. [3] ZHANG H Y, SHAO S, YAN M M, et al. Structural, physicochemical and functional properties of Semen Ziziphi spinosae protein[J]. Rsc Advances,2020,10:29555−29566. doi: 10.1039/D0RA03731A
[4] 陈丹阳, 韩涛, 杜斌, 等. 酶解蚕豆蛋白制备多肽酒及其抗氧化研究[J]. 中国粮油学报,2017,27(12):22−27. [CHEN D Y, HAN T, DU B, et al. Preparation of polypeptide wine by enzymatic hydrolysis of broad bean protein and its antioxidant activity[J]. Chinese Journal of Cereals and Oils,2017,27(12):22−27. [5] 姚余祥, 张九亮, 何慧, 等. 鹰嘴豆江胆固醇肽的制备及活性[J]. 中国粮油学报,2015,30(1):33−38. [YAO Y X, ZHANG J L, HE H, et al. Preparation and activity of chickpea cholesterol peptide[J]. Chinese Journal of Cereals and Oils,2015,30(1):33−38. [6] 阎震, 郭溆, 张金宝, 等. 酶解牡丹籽粕蛋白制备抗氧化肽的工艺优化[J]. 食品工业科技,2018,39(7):168−174, 180. [YAN Z, GUO X, ZHANG J B, et al. Optimization of process for preparation of antioxidant peptides by enzymatic hydrolysis of protein prepared from peony seed meal[J]. Science and Technology of Food Industry,2018,39(7):168−174, 180. [7] 赵节昌. 酶解酸枣仁蛋白制备抗氧化肽的研究[J]. 食品工业科技,2014,35(3):249−252, 257. [ZHAO J C. Preparation of antioxidant peptides by enzymatic hydrolysis of jujube kernel protein[J]. Food Industry Science and Technology,2014,35(3):249−252, 257. [8] 郑志强, 李宝林, 郝利民, 等. 不同蛋白酶对小麦蛋白酶解物抗氧化活性的影响[J]. 食品科学,2017,38(7):161−166. [ZHENG Z Q, LI B L, HAO L M, et al. Effects of different proteases on antioxidant activity of wheat protein hydrolysates[J]. Food Science,2017,38(7):161−166. doi: 10.7506/spkx1002-6630-201707026 [9] WANG K D, TIAN Y P, ZHOU N D, et al. Studies on fermentation optimization, stability and application of prolyl aminopeptidase fromBacillus subtilis[J]. Process Biochem,2018,74(11):10−20.
[10] 国家食品药品监督管理总局. GB 5009.124-2016. 食品安全国家标准 食品中氨基酸的测定[S]. 北京:中国出版社, 2016. State Food and Drug Administration. GB 5009. 124-2016. National food safety standard. Determination of amino acids in foods[S]. Beijing: China Stadards Press, 2016.
[11] 高英, 俞玉忠. 福林酚法测定脑蛋白水解物溶液中的多肽含量[J]. 海峡药学,2004(6):57−58. [GAO Y, YU Y Z. Determination of polypeptide content in brain protein hydrolysate solution by Folin phenol method[J]. Strait Pharmacy,2004(6):57−58. doi: 10.3969/j.issn.1006-3765.2004.06.030 [12] 刘颖, 刘丽宅, 于晓红, 等. 限制性酶解乳清蛋白功能特性研究[J]. 食品工业科技,2017,38(4):127−131. [LIU Y, LIU L Z, YU X H, et al. Functional properties of restricted enzymolysis whey protein[J]. Food Industry Technology,2017,38(4):127−131. [13] LATORRES J M, RIOS D G, SAGGIOMO G, et al. Functional and antioxidant properties of protein hydrolysates obtained from white shrimp (Latopenaeus vannamea)[J]. Journal of Food Science and Technology,2018,55(2):721−729. doi: 10.1007/s13197-017-2983-z
[14] 李晓娇, 郜玉钢, 张连学, 等. 奇亚籽化学成分、药理作用及产品开发的研究进展[J]. 粮食与油脂,2018,31(5):13−15. [LI X J, GAO Y G, ZHANG L X, et al. Research progress on chemical composition, pharmacological action and product development of Qiya seed[J]. Food and Oil,2018,31(5):13−15. [15] PANDHARE G R, KATKE S D. Studies on preparation of chia seed fortified cookies[J]. Contemporary Research in India,2018,8(1):25−28.
[16] 张丽霞, 顾振新, 周剑忠, 等. 双酶水解麦胚制备抗氧化肽的工艺优化[J]. 江苏农业学报,2010,26(3):601−606. [ZHANG L X, GU Z X, ZHOU J M, et al. Optimization of preparation of antioxidant peptides from wheat germ by double enzyme hydrolysis[J]. Journal of Jiang Su Agriculture,2010,26(3):601−606. doi: 10.3969/j.issn.1000-4440.2010.03.030 [17] 陈建双, 李佳欣, 杨洋, 等. 山药水提物提取工艺优化及抗氧化活性分析[J]. 粮食与油脂,2021,34(6):155−159. [CHEN J S, LI J X, YANG Y, et al. Optimization of water extract process from yam and its antioxidant activity analysis[J]. Cereals & Oils,2021,34(6):155−159. doi: 10.7506/spkx1002-6630-20180626-484 [18] 盛彩虹, 刘烨, 刘大川, 等. 紫苏分离蛋白功能性研究[J]. 食品科学,2011,32(17):137−140. [SHENG C H, LIU Y, LIU D C, et al. Functional study of Perilla protein isolate[J]. Food Science,2011,32(17):137−140. [19] 熊拯, 陈敏娥, 张炳亮. 油菜籽粨蛋白质提取工艺及功能性研究[J]. 粮油食品科技,2013,21(1):21−30. [XIONG Z, CHEN M E, ZHANG B L. Study on extraction technology and function of rapeseed protein[J]. Cereals, Oils and Food Science and Technology,2013,21(1):21−30. [20] DONG Z Y, LI M Y, TIAN G, et al. Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J]. Food Chemistry,2019,299:125103. doi: 10.1016/j.foodchem.2019.125103
[21] 范宁宇, 阚欢, 许善午, 等. 中性蛋白酶水解核桃蛋白工艺[J]. 食品研究与开发,2011,32(11):78−81. [FAN N N, KAN H, XU S N, et al. Hydrolysis of walnut protein by neutral protease[J]. Food Research and Development,2011,32(11):78−81. doi: 10.3969/j.issn.1005-6521.2011.11.023 [22] 赵晨煊, 李瑞婷. 文冠果油籽蛋白的分离及其酶解产物抗氧化性研究[J]. 农产品加工,2020,20:20−25. [ZHAO C X, LI R T. Isolation of Xanthoceras sorbifolia oleifera protein and study on the antioxidant activity of its enzymatic hydrolysates[J]. Processing of Agricultural Products,2020,20:20−25. [23] SARBON N M, BADII F, HOWELL N K. Purification and characterization of antioxidative peptides derived from chicken skin gelatin hydrolysate[J]. Food Hydrocolloids,2018,85:311−320. doi: 10.1016/j.foodhyd.2018.06.048
[24] 刘淳, 张海英, 韩涛, 等. Alcalase碱性蛋白酶酶解蚕豆蛋白的研究[J]. 中国粮油学报,2011,26(12):29−33. [LIU C, ZHANG H Y, HAN T, et al. Study on enzymatic hydrolysis of broad bean protein by Alcalase alkaline protease[J]. Chinese Journal of Cereals and Oils,2011,26(12):29−33. [25] 田杰, 柴莎莎, 胡传荣, 何东平. 风味蛋白酶酶解大豆分离蛋白及对其功能特性影响研究[J]. 中国油脂,2015,40(10):11−14. [TIAN J, CHAI S S, HU C R, et al. Enzymatic hydrolysis of soybean protein isolate by flavourzyme and its effect on its functional properties[J]. Chinese Journal of Oil and Fat,2015,40(10):11−14. doi: 10.3969/j.issn.1003-7969.2015.10.003 [26] ZHONG C, SUN L C, YAN L J, et al. Production, optimisation and characterisation of angiotensin converting enzyme inhibitory petides from sea cucumber (Stichopus japonicus) gonad[J]. Food Function,2018,9(1):594−603. doi: 10.1039/C7FO01388D
[27] 陈金玉, 曲金萍, 张坤生, 等. 酶解制备苦荞蛋白抗氧化肽及其分离纯化研究[J]. 食品研究与开发,2020,41(12):14−20. [CHEN J Y, QU J P, ZHANG K S, et al. Preparation of antioxidant peptides from tartary buckwheat protein by enzymatic hydrolysis and its separation and purification[J]. Food Research and Development,2020,41(12):14−20. [28] DU M, XIE J, GONG B, et al. Extraction, physicochemical characteristics and functional properties of mung bean protein[J]. Food Hydrocolloids,2017,21:131−140.
[29] 李琴, 张海生, 许珊, 等. 绿豆抗氧化活性肽的制备及其抗氧化活性研究[J]. 江西农业大学学报,2013,35(5):1063−1069. [LI Q, ZHANG H S, XU S, et al. Preparation and antioxidant activity of antioxidant peptides from mung bean[J]. Journal of Jiangxi Agricultural University,2013,35(5):1063−1069. doi: 10.3969/j.issn.1000-2286.2013.05.029 [30] 张然, 严文慧, 齐斌. 核桃蛋白酶解产物的特性研究[J]. 食品科学,2011,32(1):23−26. [ZHANG R, YAN W H, QI B. Study on the properties of walnut protein hydrolysate[J]. Food Science,2011,32(1):23−26. [31] SARMADI B H, ISMAIL A. Antioxidant peptides from food proteins a review[J]. Food Science,2008,29(11):72−76.
-
期刊类型引用(6)
1. 江婷,费博,庞会娜,张双,董红影,张红印,严铭铭,邵帅. 葛根蛋白及其酶解物的体外抗氧化活性和功能特性. 食品研究与开发. 2024(01): 51-59 .  百度学术
百度学术
2. 翟晓娜,胡龙彪,李媛媛,周新群,王萍,梁亮,胡雪芳,张志民,裴海生. 超微粉碎辅助制备菜籽饼活性肽工艺优化及其抗氧化活性分析. 食品工业科技. 2024(12): 189-197 .  本站查看
本站查看
3. 冯瑞,黄达荣,钟碧銮,张宇,梁结桦,唐晓姝,陈雪梅,田柬昕. 白玉花胶消化液理化性质及抗氧化活性研究. 食品与机械. 2024(12): 137-145 .  百度学术
百度学术
4. 刘智慧,吴舒妍,谢思玲,郭淑贤,王琴,肖更生,刘袆帆. 佛手瓜多肽对板栗贮藏期间品质的影响. 食品安全质量检测学报. 2023(13): 17-24 .  百度学术
百度学术
5. 周文文,刘晖,徐志佳,肖凤琴,李波,杨亦柳,李光哲,严铭铭. 酸枣仁不同极性部位成分含量与抗氧化活性及其相关性分析. 食品工业科技. 2023(16): 288-296 .  本站查看
本站查看
6. 郑岚,梁洁,赵永雷,马耀宏,刘庆艾,黄金栋,公维丽,杨俊慧. 独瓣、多瓣黑蒜发酵前后成分及抗氧化活性的分析. 食品与发酵工业. 2022(16): 95-102 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:












 下载:
下载:



