Effect of Cooking Treatment on Cell Structure and Digestive Characteristics of Whole Potato Flour
-
摘要: 本文以新鲜马铃薯为原料,研究了蒸煮时间对马铃薯全粉的细胞结构、游离淀粉含量、理化性质及消化特性等的影响。结果表明:随着蒸煮时间的延长,马铃薯蒸煮悬浊液电导率从24 μm/cm提高到1285 μm/cm,全粉碘蓝值(BVI)从8.31增大到19.00,这表明马铃薯全粉中细胞的破损率提高,破损程度增大,胞内物质的释放量及游离淀粉含量增多;全粉外观颜色淡黄,无褐变发黑现象;淀粉颗粒热损伤加剧,全粉黏度增大,糊化难度降低,消化率升高,快消化淀粉(RDS)含量从46.39%增加到70.74%,抗消化淀粉(RS)含量从29.08%减少到11.60%。本研究实验结果证实马铃薯全粉的功能特性与蒸煮时间密切相关,这将为马铃薯全粉的制备及后续产品的开发提供理论参考。Abstract: In this paper, the effects of cooking time on cell structure, free-starch content, physicochemical properties and digestive characteristics of the whole potato powder were studied. The result showed that: With the extension of cooking time, the conductivity of potato cooking suspension increased from 24 μm/cm to 1285 μm/cm, and the iodine blue value (BVI) increased from 8.31 to 19.00, which indicated that after cooking pretreatment, the cell breakage rate and damage degree of whole potato meal increased, and the release amount of intracellular substances and the content of free-starch increased. The colors of whole potato flour was light yellow without browning and blackening. The heat damage of starch particles increased, the viscosity of whole starch increased. The whole potato powder was more easier to gelatinize, and its digestibility increased. The content of fast digestible starch(RDS) increased from 46.39% to 70.74%, and the content of resistant starch(RS) decreased from 29.08% to 11.60%. In summary, the results showed that the functional characteristics of potato powder were closely related to its cooking time, which would provide theoretical reference for the preparation of potato powder and the development of subsequent products.
-
Keywords:
- whole potato flour /
- cooking process /
- cell breakage /
- free starch /
- digestibility
-
马铃薯是全球第四大粮食作物,仅次于小麦、水稻和玉米。我国是马铃薯产量最大的国家,但加工率仅为10%,远低于世界平均水平[1]。马铃薯中除了淀粉外,还含有丰富的膳食纤维、蛋白质、多种维生素和无机盐,其中,赖氨酸含量高于大米和小麦[2-3]。马铃薯中还存在具有抗氧化、抗癌和抗高血压的单宁和类黄酮等对人体健康有益的植物活性物质[4-5]。
新鲜马铃薯的水分含量高达79.5%[6],储存和运输中易造成发芽或腐烂,导致对人体健康有害的龙葵素含量上升[7],严重制约马铃薯产业化发展。为了延长马铃薯的储存周期及扩大生产用途,将马铃薯脱水加工成全粉是一种最常用的方法[8]。马铃薯全粉复水后仍具有新鲜马铃薯泥的特殊香味和口感[9],既可以直接作为烹调用品,也可以作为食品深加工的原材料。而且,新鲜的马铃薯富含多酚氧化酶(PPO),切分后多酚类物质经过酶促反应氧化成褐色的醌类化合物,导致全粉色泽发暗。因此,在马铃薯全粉的制备过程中,为了保证产品色泽鲜亮,采用可钝化多酚氧化酶活性的沸水蒸煮是必不可少的预处理方式[10]。
研究表明,在蒸煮过程中,产生的热损伤可能会破坏马铃薯细胞结构的完整性和淀粉的结晶结构[11]。ZACHARIE等[12]发现常压蒸煮使离体淀粉消化率显著提高(12.3%);PIECYK等[13]和HSU等[14]研究了蒸煮对淀粉消化率的影响,发现热处理后快消化淀粉(RDS)含量显著升高,慢消化淀粉(SDS)和抗消化淀粉(RS)降低;KYRIACOU等[15]发现进行长时间的水热处理会造成马铃薯块茎上发生明显的热损害,从而导致淀粉消化率提高;ROVALINO-CORDOVA等[16]发现降低细胞完整性可提高淀粉体外消化的速率,但不影响消化程度,说明细胞壁是限制消化酶与淀粉接触的一种可渗透的屏障。现在对马铃薯全粉的研究大多集中在马铃薯淀粉的理化性质和加工特性上,而针对细胞结构破损程度对其营养特性影响的研究却较少。在马铃薯全粉制备的过程中,细胞结构完整性是影响全粉质量的重要因素[17]。
本实验研究了不同蒸煮时间产生的热损伤对马铃薯全粉微观结构和营养特性的影响,分析了马铃薯全粉消化特性与细胞破损程度之间的关系,为马铃薯全粉的制备及产品开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜马铃薯“荷兰” 市售;碘、碘化钾、无水葡萄糖 分析纯,天津化学试剂厂;胃蛋白酶(1:3000)、α-淀粉酶(4000 U/g)、葡萄糖苷酶(100000 U/g) 大连美仑生物技术有限公司;3,5-三硝基水杨酸试剂(DNS试剂) 北京索莱宝科技有限公司。
LGJ-12立式真空冷冻干燥机 广州乔跃电子有限公司;OLYMPUS BX50光学显微镜 北京中显恒业仪器仪表有限公司;H-9500扫描电镜 日本日立公司;DDS-307A电导率仪 上海安亭科学仪器厂;CR-400色彩色差计 日本柯尼卡美能达公司;RVA快速粘度仪 珀金埃尔默企业管理(上海)有限公司;DELTA 320型pH计 梅特勒-托利多仪器(上海)有限公司;UV-1200S型紫外可见分光光度计 翱艺仪器(上海)有限公司。
1.2 实验方法
1.2.1 马铃薯全粉的制备
新鲜马铃薯→清洗→去皮→切分→蒸煮→冷冻干燥→粉碎→筛分→马铃薯全粉。
选取无出芽、无损伤的新鲜马铃薯,清洗干净后去皮,切分成边长1 cm的立方块,用洁净的水冲洗后放入沸水中蒸煮熟化,蒸煮时间分别为5、10、15、20、30、40 min。把蒸煮后的薯块捣泥,均匀的铺在培养皿中,−18 ℃预冷冻12 h后,放入真空干燥机中冷阱温度−50 ℃、真空度1 Pa冷冻干燥24 h,经粉碎机粉碎后过100目筛,编号T-1、T-2、T-3、T-4、T-5、T-6备用。另制备未蒸煮处理的马铃薯生粉,编号T-0。
1.2.2 微观结构分析
光学显微镜:甘油和蒸馏水(1:1)配制成组织分散液,吸取一滴分散液于载玻片上,用牙签轻轻地刮取蒸煮后的马铃薯,均匀地涂抹在分散液中,盖上盖玻片,固定在载物台上寻找视野进行观察。
扫描电镜(SEM):用导电胶带将样品粉末固定在载物台上,真空喷金处理后在5.00 kV加速电压下进行扫描拍照。
1.2.3 电导率测定
新鲜的马铃薯清洗去皮切分成边长1 cm的立方块,冲洗掉表面游离淀粉,沥干,取马铃薯20 g,放入80 mL沸腾的去离子水中,分别蒸煮5、10、15、20、30、40 min,取蒸煮后的悬浊液,冷却至25 ℃,测量其电导率。
1.2.4 碘蓝值(BVI)测定
参照沈存宽等[18]的方法。准确称取2.50 g马铃薯全粉(干基)溶解到50 mL预热至(66±1)℃蒸馏水中,保持(66±1)℃振荡5 min,静置1 min后过滤,滤液保持在(66±1)℃。比色管中加入0.02 mol/L的碘标准溶液1 mL,随即吸取1 mL滤液于比色管,混合均匀后转移至棕色容量瓶中,准确定容至50 mL。0.02 mol/L的碘标准溶液1 mL定容至50 mL为空白样,在650 nm处测吸光值A650,计算碘蓝值BVI。
(1) 式中,A650为溶液在650 nm处的吸光值。
1.2.5 色差测定
采用CR-400色彩色差计,对不同熟化时间的马铃薯全粉的色泽进行测定分析。L*值表示明暗度(黑白),越大则样品越白亮;a*值表示红绿色,值越大则样品越偏红,反之偏绿;b*值表示蓝黄色,值越大表示样品越偏黄,反之偏蓝;a*和b*值共同决定马铃薯全粉的色调。重复测量5次。
1.2.6 糊化特性测定
采用快速粘度仪RVA测定。准确称取2.0 g马铃薯全粉,加入25 mL蒸馏水混合均匀。测定参数为:50 ℃下保持60 s,以12 ℃/min的速度升温至95 ℃,保持150 s,再以12 ℃/min的速度降温至50 ℃,保持120 s。起始10 s内搅拌器速度960 r/min,而后保持在160 r/min。记录样品黏度变化曲线。
1.2.7 葡萄糖标准曲线
参照赵凯等[19]的方法,采用3,5-二硝基水杨酸试剂(DNS)比色法绘制葡萄糖标准曲线。准确称取干燥至恒重的无水葡萄糖0.100 g,配置1.0 mg/mL的葡萄糖标准溶液。分别取0.00、0.20、0.40、0.60、0.80、1.00、1.20 mL葡萄糖标准溶液于试管中,并加入DNS试剂1.5 mL,沸水浴5 min,取出后冷却至室温,移入容量瓶定容至25 mL,在540 nm波长处测吸光值,得到线性回归方程为y=0.5038x−0.013,R2=0.99812。
1.2.8 体外消化和营养片段
参照GOÑI等[20]的方法略作调整。准确称取过100目筛的马铃薯冻干全粉100 mg于50 mL具塞比色管中,加入20 mL磷酸盐缓冲液(PBS),用HCl(1 mol/L)调整pH1.5,加入0.2 mL胃蛋白酶(115 U/mL),摇匀,在37 ℃水浴恒温振荡器中振荡30 min,取出冷却至室温,用NaOH(1 mol/L)调整pH6.9后加入1 mL α-淀粉酶(110 U/mL)溶液,用磷酸盐缓冲液定容至50 mL。继续37 ℃恒温水浴振荡,分别在0、20、40、60、90、120 min取混合液1 mL,沸水浴5 min使酶失活,冷却至室温后加入3 mL醋酸钠缓冲液(0.4 mol/L,pH4.75),再加入20 μL葡萄糖淀粉酶(110 U/mL),55 ℃恒温水浴振荡45 min。用DNS法测定葡萄糖含量。参照GB 5009.9-2016《食品安全国家标准 食品中淀粉的测定》测定总淀粉含量,计算淀粉的水解率和RDS、SDS、RS含量。
(2) (3) (4) (5) 式中,G0、G20、G120分别表示样品在0、20和120 min时水解产物的葡萄糖含量(%),TS表示样品中总淀粉含量(%)。
1.3 数据处理
数据采用SPSS26软件进行统计分析,显著性P<0.05,采用Origin 2018软件进行作图。所有样品均重复测量三次取其平均值。
2. 结果与分析
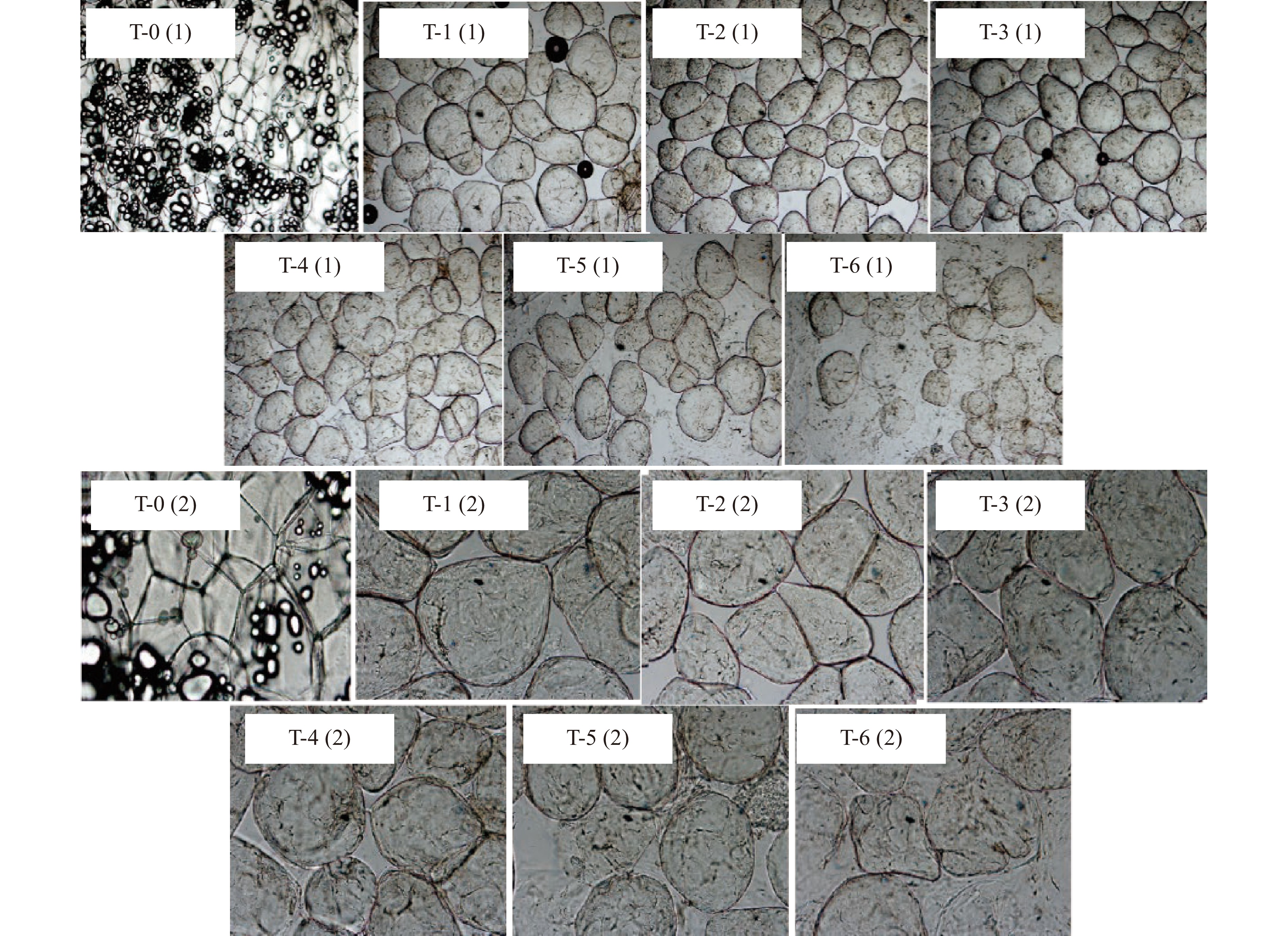
2.1 不同蒸煮时间的马铃薯全粉细胞结构
图1是光学显微镜下马铃薯细胞显微结构,可以观察到细胞结构随着蒸煮时间的延长发生明显变化。未经蒸煮处理时,马铃薯细胞壁完整且呈现清晰的多边形轮廓,细胞由胞间层紧密粘连在一起。对马铃薯分别进行5、10和15 min蒸煮处理后,其细胞结构仍然保持完整,但失去了紧密的堆积结构,这可能是由于构成胞间层的主要成分果胶多糖在蒸煮过程中溶出,导致相邻细胞失去粘连而造成细胞分离[21]。随着蒸煮时间增加到40 min时,可以明显地观察到细胞破损数量增多、破损程度增大,并且胞内物质大量溶出。这可能是由于随着蒸煮时间的延长,细胞壁中的果胶被分解溶出,细胞壁强度消减,进而导致细胞壁解体;此外,蒸煮过程中胞内淀粉颗粒溶胀,体积急剧增大,可膨胀至原始体积的50~100倍,对细胞壁产生的膨胀压从细胞内部促使细胞壁破裂[22]。由此可见,适当的蒸煮有利于细胞分散而不导致细胞破损,对马铃薯全粉的制备有积极影响。
2.2 不同蒸煮时间下马铃薯全粉的微观结构
图2为SEM观察的马铃薯全粉的微观结构。可以看出,未经蒸煮处理的马铃薯全粉中淀粉颗粒清晰可见,呈规则的椭圆状,但表面附着有细小颗粒,这可能是蛋白质等物质黏附在淀粉颗粒表面造成的[23]。从蒸煮并经冷冻干燥处理后的马铃薯全粉微观结构中可以看出,颗粒表面粗糙皱缩,这可能是由于马铃薯块茎在蒸煮处理后再经冷冻干燥处理造成细胞壁失去水分所致。随着蒸煮时间的延长,颗粒表面碎片化程度增加,直至颗粒崩解呈现出无规则的碎片状,这可能是由于蒸煮过程中高水分加热环境下淀粉颗粒吸水溶胀、体积增大,随着蒸煮时间的持续延长,在热损伤和淀粉膨胀压的共同作用下,细胞壁破损,淀粉颗粒物质溶出并继续膨胀,导致颗粒崩解碎片化严重[24]。与其他样品相比,未经过蒸煮处理和蒸煮处理5 min的马铃薯全粉中淀粉颗粒结构基本完整,这表明缩短蒸煮时间有利于保持马铃薯淀粉颗粒结构完整性并降低糊化度,从而保留马铃薯全粉深加工的性能。
2.3 蒸煮处理对马铃薯电导率的影响
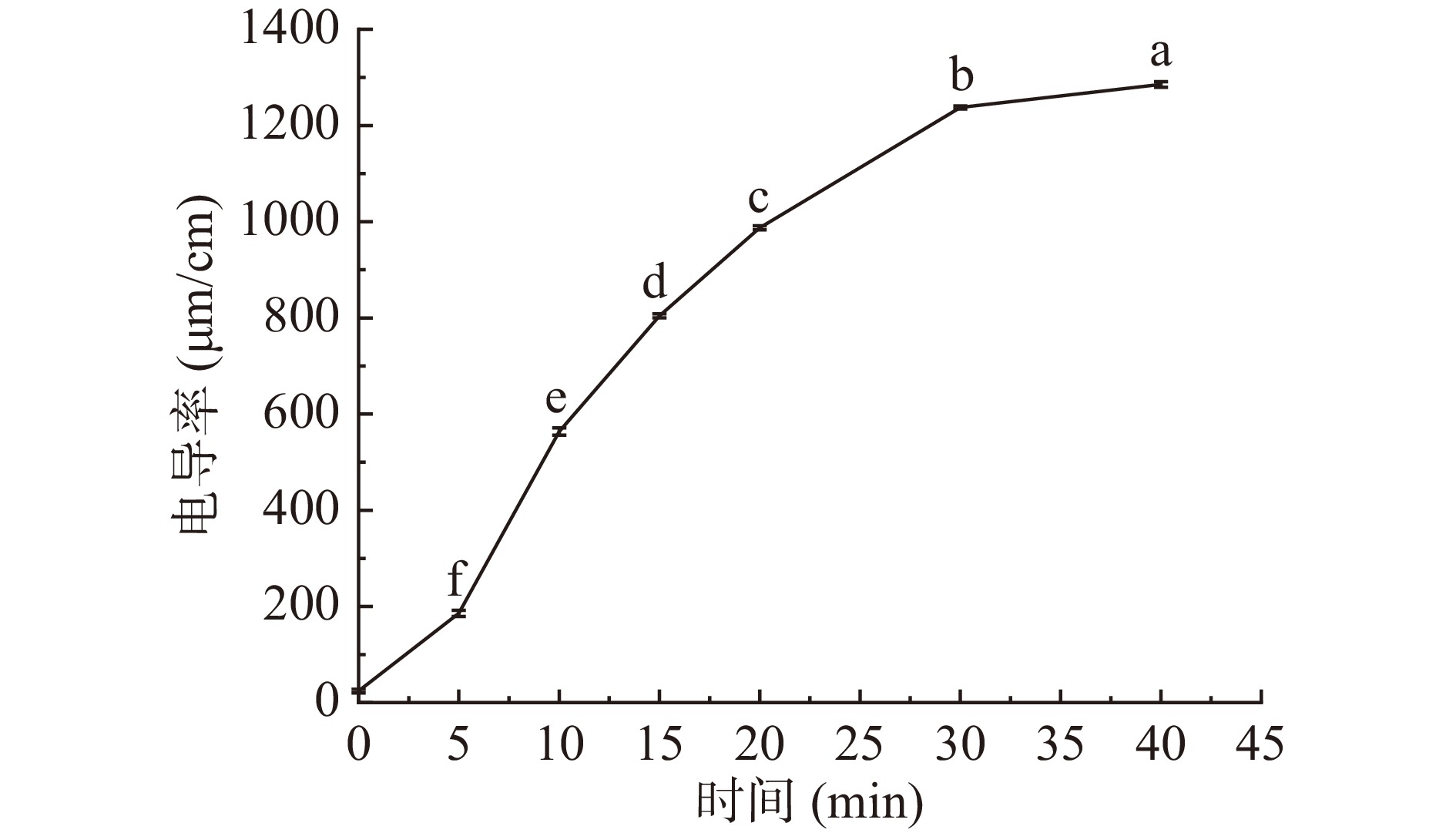
图3展示了马铃薯蒸煮悬浊液在25 ℃时的电导率随蒸煮时间变化的规律。随着蒸煮时间的延长,马铃薯蒸煮后的悬浊液电导率显著(P<0.05)上升,直至平缓,这可能是由于在蒸煮初期细胞膜上的蛋白质在水热环境中变性,失去选择透过性,导致胞内小分子如钠离子、钾离子等释放,从而使蒸煮悬浊液具有一定的导电性;随着蒸煮时间的持续延长,细胞壁中的果胶溶出纤维素崩解,细胞结构完全被破坏,胞内物质淀粉、蛋白质、核酸等随细胞液流出,导致悬浊液电导率显著(P<0.05)增大[25]。由此可见,随着蒸煮时间的延长,细胞破损程度逐渐加重、数量增多,导致胞内溶出物质如游离淀粉量也随之增加,因此,电导率也随之升高。
![]() 图 3 蒸煮时间对电导率的影响注:不同小写字母表示差异显著(P<0.05);图4同。Figure 3. Effect of cooking time on electrical conductivity
图 3 蒸煮时间对电导率的影响注:不同小写字母表示差异显著(P<0.05);图4同。Figure 3. Effect of cooking time on electrical conductivity2.4 蒸煮处理对马铃薯全粉BVI的影响
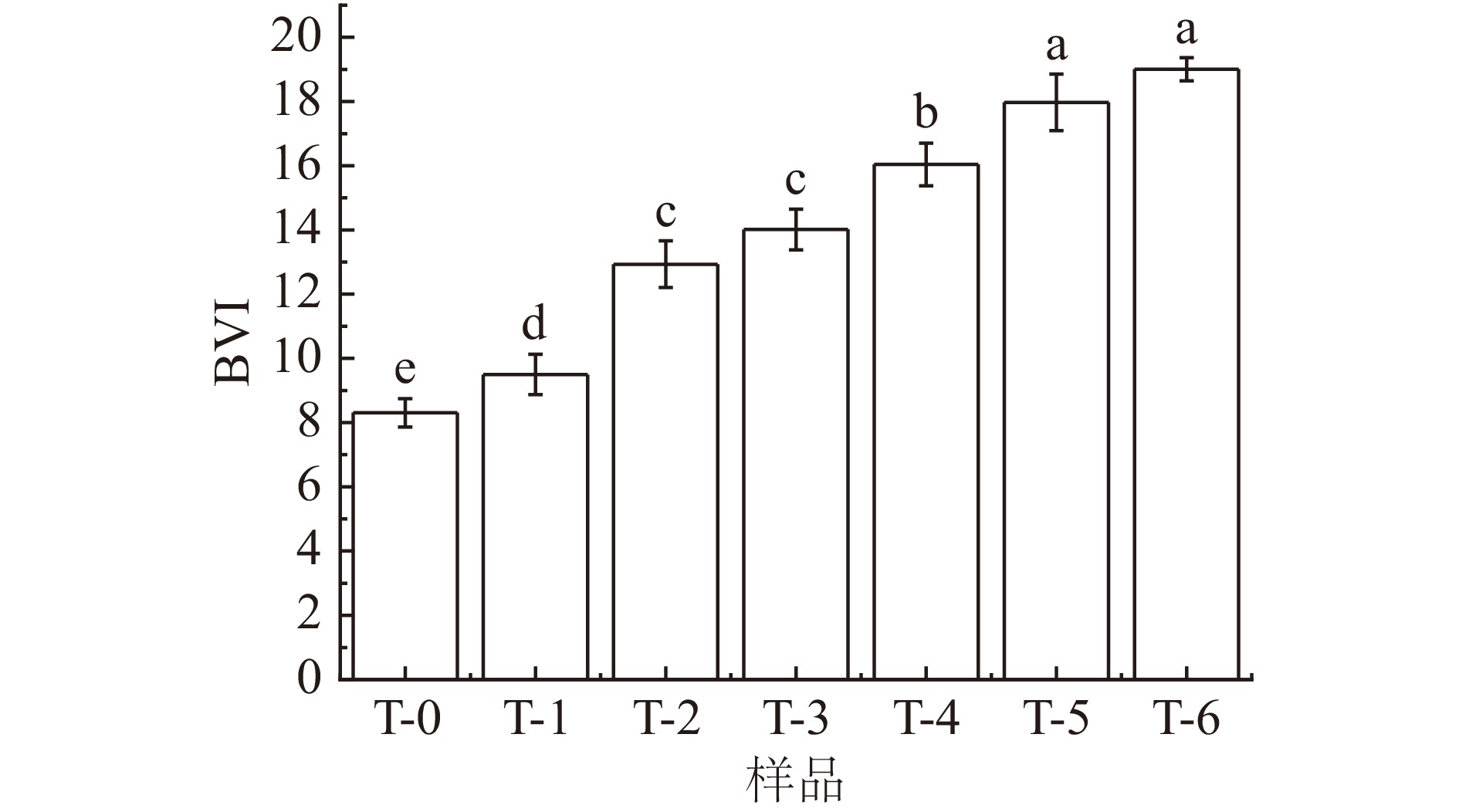
图4展示了马铃薯全粉的碘蓝值(BVI)随蒸煮时间变化的规律。碘蓝值的大小可反映游离淀粉的含量[26],碘蓝值越大表明游离淀粉含量越高,进而表明马铃薯细胞结构破损程度越大[27]。马铃薯生粉碘蓝值最低,而随着蒸煮时间的增加,碘蓝值大小随之逐渐升高,结合光学显微镜图像和电导率测定结果可以推测,蒸煮处理能够造成马铃薯细胞结构破损,从而引起胞内淀粉释放。因此,蒸煮时间越久、碘蓝值越大,也就意味着全粉中所含的游离淀粉数量越高,细胞结构破损越严重,马铃薯全粉的营养和风味物质存留度越低[28],这对马铃薯全粉后续加工及产品品质也会造成不利影响。
2.5 蒸煮处理对马铃薯全粉色差的影响
表1展示了马铃薯全粉的色差随蒸煮时间的变化规律。蒸煮处理的马铃薯全粉L*值显著(P<0.05)高于生粉,表明马铃薯全粉经过蒸煮后变得更加鲜亮。马铃薯全粉a*值均为负值而b*值均为正值,并在蒸煮时间为20 min时,马铃薯全粉的L*值、b*值最大且a*值最小。这可能是由于鲜薯中富含PPO,马铃薯去皮切分后组织中的多酚类物质暴露在空气中,多酚在有氧状态下发生酶促褐变生成醌及其聚合物,导致马铃薯全粉色泽发黑[29]。但蒸煮处理钝化PPO的活性,酶促褐变无法进行,所以蒸煮处理的马铃薯全粉色泽鲜亮,颜色淡黄偏白。当蒸煮时间过长时,全粉的亮度又有所下降,这可能是在长时间水热环境中淀粉与其他物质如蛋白质等发生反应所致。综上,在熟化处理20 min后冻干制备的马铃薯全粉色泽明亮、颜色淡黄,与鲜薯颜色最为接近。
表 1 蒸煮时间对马铃薯全粉色差值的影响Table 1. Effect of cooking time on colors of whole potato flour样品 L* a* b* T-0 83.65±0.98c −1.65±0.05d 17.18±0.39d T-1 91.70±0.68b −3.47±0.03c 18.70±0.22c T-2 91.65±0.29b −3.79±0.06a 19.61±0.30b T-3 92.39±0.61b −3.65±0.04b 19.81±0.24b T-4 93.45±0.75a −3.95±0.16a 21.05±0.64a T-5 92.41±0.22b −3.19±0.03c 17.17±0.33d T-6 92.39±0.62b −3.28±0.11c 17.51±0.65d 注:同列不同字母表示差异显著(P<0.05);表2同。 2.6 蒸煮处理对马铃薯全粉糊化特性的影响
由图5可知,马铃薯生全粉黏度最低,峰值时间最长,峰值黏度和最终黏度都明显低于蒸煮处理后的马铃薯全粉。这可能是由于生粉中细胞的完整度较好,细胞壁作为保护屏障抑制了胞内淀粉颗粒的溶胀,导致淀粉的糊化难度加大,糊化时间增长,糊化黏度保持在一个较小的范围。随着蒸煮时间的延长,马铃薯全粉的峰值黏度升高,糊化温度降低,糊化时间缩短,这表明蒸煮处理后淀粉颗粒黏度更大,且更易于发生糊化。这可能是由于蒸煮过程中淀粉发生了一定程度的预糊化,淀粉颗粒吸水溶胀,水分子进入颗粒内部的结晶区,淀粉分子内化学键断裂,原来紧密排列的结晶区变为疏松的无定形区,颗粒体积膨胀,这是一个不可逆的过程,冷冻干燥时淀粉颗粒中水分不会完全排出恢复到原来的结晶结构,从而导致马铃薯全粉复水时黏度增加,糊化难度减弱。因此,冻干后的全粉再次处于水热环境中时,更容易发生糊化。
2.7 蒸煮时间对马铃薯全粉体外淀粉消化率的影响
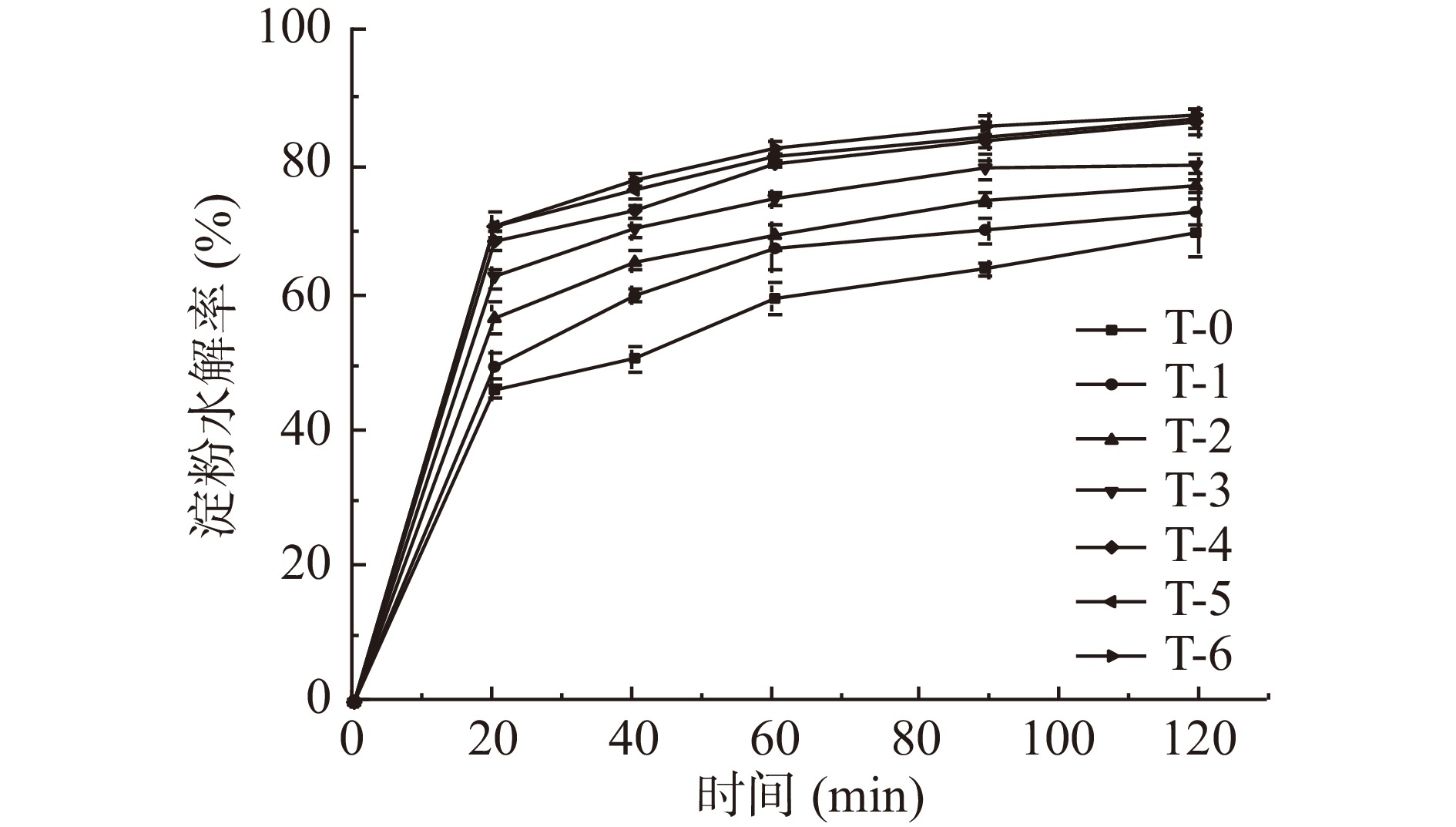
图6为不同蒸煮时间马铃薯全粉的淀粉水解率曲线。未经过蒸煮处理的马铃薯生粉在各时间点水解速率明显低于经过蒸煮处理的马铃薯全粉,这可能是由于蒸煮过程中热损伤使细胞结构破损,且淀粉颗粒发生了不同程度的预糊化。在蒸煮处理的样品中,蒸煮5 min的马铃薯全粉体外淀粉消化率最低,随着蒸煮时间的延长,淀粉水解速率逐渐加快。这可能是由于适当的蒸煮处理在分解胞间层中的果胶的同时还能保持细胞壁的完整性,完整的细胞壁和细胞膜延缓了淀粉的溶胀,此外,细胞的完整性阻碍了消化酶和淀粉的接触,进而限制了马铃薯全粉的水解速率[30]。但随着蒸煮时间的延长,细胞结构在水热作用下破损程度加剧,淀粉颗粒暴露并发生预糊化反应,加快其消化速率[31]。
表2为不同蒸煮时间马铃薯全粉的RDS、SDS、RS变化情况。随着蒸煮时间的延长,RDS逐渐增多,RS逐渐减少。这可能是因为蒸煮时间较短的马铃薯全粉细胞结构保持相对完整,破损率低,释放的游离淀粉较少,淀粉预糊化程度低,同时完整的细胞结构能够有效保护淀粉颗粒,限制消化酶和淀粉的接触[32]。而随着蒸煮时间的延长,细胞结构会由于热损伤造成细胞壁破裂,淀粉颗粒从胞内溶出,失去了保护其不被淀粉酶接触的屏障;且淀粉颗粒在长时间的蒸煮过程中溶胀糊化,体积膨胀,由结晶区向无定形区发生不可逆的转化,从而导致马铃薯全粉消化速率加快,RDS含量增多,RS含量减少。由此可见,合理控制蒸煮时间对马铃薯全粉的消化特性有很大的影响。
表 2 马铃薯全粉RDS、SDS、RS含量Table 2. RDS、SDS and RS content of whole potato flour样品 RDS(%) SDS(%) RS(%) T-0 46.39±1.43e 24.53±4.91a 29.08±3.50a T-1 49.84±2.50d 24.18±4.06a 25.98±2.28a T-2 57.04±2.02c 20.84±1.07ab 22.11±1.08b T-3 63.27±1.39b 17.69±2.78b 19.05±1.42b T-4 68.48±1.21a 18.91±3.15ab 12.61±2.07c T-5 70.68±1.89a 17.15±2.79b 12.17±1.16c T-6 70.74±0.64a 17.66±1.23b 11.60±0.78c 3. 结论
本实验光学显微镜观察与电导率和碘蓝值测定发现,适当地蒸煮有利于细胞分散,但随着蒸煮时间的延长,细胞破损程度增强,破损率增大,胞内物质释放增多;通过SEM观察发现,随着蒸煮时间的延长,颗粒表面孔洞和裂痕增多,热损伤加剧;通过色差测定发现,蒸煮处理能有效抑制马铃薯全粉褐变;RVA结果表明,蒸煮处理可降低马铃薯全粉的糊化难度,提高黏度;体外消化率结果表明,随着蒸煮时间的延长,马铃薯全粉的消化率升高,RDS增多,RS减少。本实验研究结果表明,马铃薯全粉的功能特性和消化特性与蒸煮处理时间密切相关,这将为马铃薯全粉的制备及后续产品的开发提供理论参考。
-
图 3 蒸煮时间对电导率的影响
注:不同小写字母表示差异显著(P<0.05);图4同。
Figure 3. Effect of cooking time on electrical conductivity
表 1 蒸煮时间对马铃薯全粉色差值的影响
Table 1 Effect of cooking time on colors of whole potato flour
样品 L* a* b* T-0 83.65±0.98c −1.65±0.05d 17.18±0.39d T-1 91.70±0.68b −3.47±0.03c 18.70±0.22c T-2 91.65±0.29b −3.79±0.06a 19.61±0.30b T-3 92.39±0.61b −3.65±0.04b 19.81±0.24b T-4 93.45±0.75a −3.95±0.16a 21.05±0.64a T-5 92.41±0.22b −3.19±0.03c 17.17±0.33d T-6 92.39±0.62b −3.28±0.11c 17.51±0.65d 注:同列不同字母表示差异显著(P<0.05);表2同。 表 2 马铃薯全粉RDS、SDS、RS含量
Table 2 RDS、SDS and RS content of whole potato flour
样品 RDS(%) SDS(%) RS(%) T-0 46.39±1.43e 24.53±4.91a 29.08±3.50a T-1 49.84±2.50d 24.18±4.06a 25.98±2.28a T-2 57.04±2.02c 20.84±1.07ab 22.11±1.08b T-3 63.27±1.39b 17.69±2.78b 19.05±1.42b T-4 68.48±1.21a 18.91±3.15ab 12.61±2.07c T-5 70.68±1.89a 17.15±2.79b 12.17±1.16c T-6 70.74±0.64a 17.66±1.23b 11.60±0.78c -
[1] ZHANG Ke, TIAN Yang, LIU Chenglong, et al. Effects of temperature and shear on the structural, thermal and pasting properties of different potato flour[J]. BMC Chemistry,2020,14(1):1−8. doi: 10.1186/s13065-019-0657-9
[2] 张雅媛, 卫萍, 孙健, 等. 广西冬作马铃薯品种全粉基本特性比较[J]. 食品与发酵工业,2016,42(12):62−67. [ZHANG Yayuan, WEI Ping, SUN Jian, et al. Comparison of characteristics of winter potatoes of Guangxi[J]. Food and Fermentation Industries,2016,42(12):62−67. [3] DILEEP K, TAIHUA M, MENGMEI M. Effects of potato flour on dough properties and quality of potato-wheat-yogurt pie bread[J]. Nutrition & Food Science,2019,50(5):885−901.
[4] EZEKIEL R, SINGH N, SHARMA S, et al. Beneficial phytochemicals in potato-a review[J]. Food Research International,2013,50(2):487−496. doi: 10.1016/j.foodres.2011.04.025
[5] AUSTIN D L, TURNER N D, MCDONOUGH C M, et al. Effects of brans from specialty sorghum varieties on in vitro starch digestibility of soft and hard sorghum endosperm porridges[J]. Cereal Chemistry,2012,89(4):190−197. doi: 10.1094/CCHEM-12-11-0151
[6] ZAHEER K, AKHTAR M H. Recent advances in potato production, usage, nutrition-a review[J]. Critical Reviews in Food Science & Nutrition,2016,56(5):47−49.
[7] TILAHUN S, AN H S, HWANG I G, et al. Prediction of α-solanine and α-chaconine in potato tubers from hunter color values and VIS/NIR spectra[J]. Journal of Food Quality,2020,11(17):1−9.
[8] 赵月, 吕美, 杨华. 辽宁省主栽品种马铃薯块茎和马铃薯全粉的品质分析[J]. 粮油食品科技,2020,153(1):77−82. [ZHAO Yue, LV Mei, YANG Hua. Quality analysis of potato tuber and potato granules of main cultivars in Liaoning province[J]. Science and Technology of Cereals, Oils and Foods,2020,153(1):77−82. [9] 崔璐璐, 林长彬, 徐怀德, 等. 紫马铃薯全粉加工技术研究[J]. 食品工业科技,2014,35(5):221−224. [CUI Lulu, LIN Changbin, XU Huaide, et al. Study on the processing technology for purple potato granules[J]. Science and Technology of Food Industry,2014,35(5):221−224. [10] 王清, 王蒂. 温度, pH对马铃薯多酚氧化酶活性的影响[J]. 中国马铃薯,2003,17(3):157−161. [WANG Qing, WANG Di. Effect of temperature and pH on activity of polyphenol oxidase in potato[J]. Chinese Potato Journal,2003,17(3):157−161. doi: 10.3969/j.issn.1672-3635.2003.03.006 [11] DING L, HUANG Q, LI H, et al. Controlled gelatinization of potato parenchyma cells under excess water condition: Structural andin vitro digestion properties of starch[J]. Food & Function,2019,10(9):1−30.
[12] ZACHARIE B, SIMARD R E. Effects of soaking, cooking and fermentation on composition, in vitro starch digestibility and nutritive value of common beans[J]. Plant Foods for Human Nutrition,1995,48(4):349−365. doi: 10.1007/BF01088494
[13] PIECYK M, DRUŻYŃSKA B, WOROBIEJ E, et al. Effect of hydrothermal treatment of runner bean (Phaseolus coccineus) seeds and starch isolation on starch digestibility[J]. Food Research International,2013,50(1):428−437. doi: 10.1016/j.foodres.2012.11.003
[14] HSU R J C, CHEN H J, LU S, et al. Effects of cooking, retrogradation and drying on starch digestibility in instant rice making[J]. Journal of Cereal Science,2015,65:154−161. doi: 10.1016/j.jcs.2015.05.015
[15] KYRIACOU M C, GERASOPOULOS D, SIOMOS A S, et al. Impact of hot water treatment on sprouting, membrane permeability, sugar content and chip colour of reconditioned potato tubers following long-term cold storage[J]. Journal of the Science of Food and Agriculture,2008,88(15):2682−2687. doi: 10.1002/jsfa.3392
[16] ROVALINO-CORDOVA A M, FOGLIANO V, CAPUANO E. A closer look to cell structural barriers affecting starch digestibility in beans[J]. Carbohydrate Polymers,2018,181:994−1002. doi: 10.1016/j.carbpol.2017.11.050
[17] 魏海香, 梁宝东, 薛丽萍, 等. 预处理对菱角全粉中细胞破碎与淀粉理化性质影响[J]. 食品科技,2017,42(4):243−250. [WEI Haixiang, LIANG Baodong, XUE Liping, et al. Effect of pretreatments on cell disruption and its starch physicochemical properties of water chestnut powders[J]. Food Science and Technology,2017,42(4):243−250. [18] 沈存宽, 王莉, 王韧, 等. 不同干燥工艺对马铃薯全粉理化性质的影响[J]. 食品与发酵工业,2016,42(10):117−121. [SHEN Cunkuan, WANG Li, WANG Ren, et al. Influence of drying processes on physicochemical properties of potato powder[J]. Food and Fermentation Industries,2016,42(10):117−121. [19] 赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008,29(8):534−536. [ZHAO Kai, XU Pengju, GU Guangye. Study on determination of reducing sugar content using 3, 5-Dinitrosalicylic Acid method[J]. Food Science,2008,29(8):534−536. doi: 10.3321/j.issn:1002-6630.2008.08.127 [20] GOÑI I, GARCIA-ALONSO A, SAURA-CALIXTO F. A starch hydrolysis procedure to estimate glycemic index[J]. Nutrition Research,1997,17(3):427−437. doi: 10.1016/S0271-5317(97)00010-9
[21] 熊玮彦. 蒸煮和湿热处理对杂豆细胞内淀粉结构及体外消化性的影响机制研究[D]. 广州: 华南理工大学, 2018. XIONG Weiyan. Mechanism for the structure features and digestion properties of starches in intact legume cells influenced by cooking and heat-moisture process[D]. Guangzhou: South China University of Technology, 2018.
[22] JONGSUTJARITTAM N, CHAROENREIN S. Influence of waxy rice flour substitution for wheat flour on characteristics of batter and freeze-thawed cake[J]. Carbohydrate Polymers,2013,97(2):306−314. doi: 10.1016/j.carbpol.2013.04.087
[23] 杨娟, 程力, 洪雁, 等. 不同工艺制备的马铃薯全粉理化性质比较[J]. 食品与生物技术学报,2019,038(8):148−154. [YANG Juan, CHENG Li, HONG Yan, et al. Effect of different preparation process on physicochemical properties of potato powder[J]. Journal of Food Science and Biotechnology,2019,038(8):148−154. [24] HU Chun, XIONG Zhouyi, XIONG Hangou, et al. Effects of granule size on physicochemical and digestive properties of potato powder[J]. Journal of the Science of Food and Agriculture,2020,100(10):4005−4011. doi: 10.1002/jsfa.10445
[25] 党通州, 罗剑飞, 林炜铁. 基于电导率快速测定豆类细胞破壁率方法的研究[J]. 现代食品科技,2018,34(2):129−133,31. [DANG Tongzhou, LUO Jianfei, LIN Weitie. Rapid determination of wall-broken rate of beans cells based on conductivity[J]. Modern Food Science and Technology,2018,34(2):129−133,31. [26] 田鑫, 夏冬, 戴理民, 等. 不同品种马铃薯雪花全粉品质特性与分子结构表征[J]. 食品工业科技,2017(13):7−12. [TIAN Xin, XIA Dong, DAI Limin, et al. Research on quality characteristics and molecular structure characterization of different varieties of potato flakes[J]. Science and Technology of Food Industry,2017(13):7−12. [27] 吴卫国, 谭兴和, 熊兴耀, 等. 不同工艺和马铃薯品种对马铃薯颗粒全粉品质的影响[J]. 中国粮油学报,2006,21(6):98−102. [WU Weiguo, TAN Xinghe, XIONG Xingyao, et al. Processing technology and potato varieties vs property of potato granules[J]. Journal of the Chinese Cereals and Oils Association,2006,21(6):98−102. doi: 10.3321/j.issn:1003-0174.2006.06.024 [28] 何继文. 甘薯全粉护色及降低游离淀粉率技术研究[D]. 无锡: 江南大学, 2014. HE Jiwen. Studies on color protecting and reducing free starch rate technology during sweet potato flour processing[D]. Wuxi: Jiangnan University, 2014.
[29] 马梦苹, 张来林, 王彦波, 等. 马铃薯全粉和小麦粉基本特性的对比研究[J]. 河南工业大学学报(自然科学版),2016,37(6):52−56. [MA Mengping, ZHANG Lailin, WANG Yanbo, et al. Comparative study on basic characteristics of potato flour and wheat flour[J]. Journal of Henan University of Technology (Natural Science Edition),2016,37(6):52−56. [30] EDWARDS C H, RYDEN P, MANDALARI G, et al. Structure-function studies of chickpea and durum wheat uncover mechanisms by which cell wall properties influence starch bioaccessibility[J]. Nature Food,2021,2(2):118−126. doi: 10.1038/s43016-021-00230-y
[31] OGAWA Y, DONLAO N, THUENGTUNG S, et al. Impact of food structure and cell matrix on digestibility of plant-based food[J]. Current Opinion in Food Science,2018,19:36−41.
[32] SUSHIL D, BHATTARAI R R, GORHAM J, et al. Intactness of cell wall structure controls the in vitro digestion of starch in legumes[J]. Food & Function,2016,7(3):1367−1379.
-
期刊类型引用(3)
1. 路晓,李文钊,徐艳朋,李玉爽,王智珍,张亚旭,刘馨阳,阮美娟. 不同预处理对六种药食同源食材加工特性及其饼干品质影响研究. 食品与发酵工业. 2024(12): 258-265 .  百度学术
百度学术
2. 邱心茹,张源,蒋远帅,高文慧,刘友雪,衣春颖,李悦,孔峰. 鸡骨粉理化性质及其对全麦饼干品质的影响. 食品科技. 2024(06): 147-152 .  百度学术
百度学术
3. 傅新征,林思琦,罗培轩. 响应面法优化超声波辅助酸酶法制备荸荠抗性淀粉工艺. 湖北民族大学学报(自然科学版). 2024(04): 551-558 .  百度学术
百度学术
其他类型引用(5)






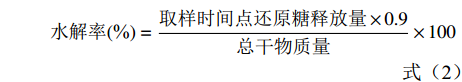
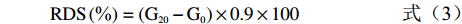
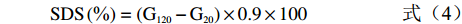

 下载:
下载:


 下载:
下载:
