Identification of Antioxidant Components and Tyrosinase Specific Inhibitors from Osmanthus fragrans Flower by Using Online UPLC-ABTS+·-assay and UF- LC-MS Technology
-
摘要: 目的:研究桂花水提物的抗氧化活性及酪氨酸酶抑制活性,并初步研究其活性化学成分。方法:以DPPH·清除能力、ABTS+·清除能力和FRAP这3种抗氧化活性评价指标来衡量桂花水提物及其化合物的抗氧化能力;采用超高效液相-ABTS+·-质谱(UPLC-PDA-QDa-ABTS+·)在线法对桂花中的抗氧化活性成分进行定性鉴别,同时采用超滤亲和-液质联用技术(Ultra-filtration affinity-liquid chromatography spectrometry, UF-LC-MS),筛选桂花中的酪氨酸酶抑制剂。用H2O2致皮肤成纤维细胞氧化损伤模型,评价桂花水提物及其化合物对皮肤成纤维细胞的氧化应激保护作用。结果:桂花水提物清除DPPH·及ABTS+·的半数有效浓度(EC50)值分别为37.66和38.32 μg/mL。当桂花浓度达到2 mg/mL时,FRAP值可高达3.17。桂花水提物抑制酪氨酸酶双酚酶的EC50为595.9 μg/mL。通过UPLC-Triple-TOF/MS分析,初步鉴定了桂花水提物中28种化学成分。采用UPLC-PDA-QDa-ABTS+·在线法及UF-LC-MS技术,快速筛选出桂花提取物中5种具有较好抗氧化作用并兼具显著酪氨酸酶结合率的化学成分,鉴定其中主要的活性成分为毛蕊花糖苷。体外抗氧化和酪氨酸酶实验,验证了毛蕊花糖苷具有显著抗氧化活性及酪氨酸酶抑制活性。毛蕊花糖苷清除DPPH·及ABTS+·的EC50值分别为10.27和14.96 μg/mL。当毛蕊花糖苷浓度达到1 mg/mL时,FRAP值可高达4.22。毛蕊花糖苷对酪氨酸酶单酚酶的EC50为477.5 μg/mL,对双酚酶的抑制活性几乎没有。利用H2O2致皮肤成纤维细胞氧化损伤模型,进一步验证桂花提取物及毛蕊花糖苷对皮肤成纤维细胞氧化损伤具有显著保护作用。结论:桂花水提物及其主要活性成分毛蕊花糖苷具有很好的体外抗氧化能力、酪氨酸酶抑制活性及氧化应激保护能力。Abstract: Objective: To investigate and analyze antioxidant activities and tyrosinase inhibition of the aqueous extract of Osmanthus fragrans flower (O. fragrans), as well as its active ingredients. Methods: In this study, antioxidant activities of extract of O. fragrans were carried out by using DPPH·, ABTS+· radical scavenging assays and total antioxidant activity (FRAP). Qualitative analysis of major active components was performed by UPLC-PDA-QDa-ABTS+· online method and UF-LC-MS method were used to qualitatively identify the antioxidant components and tyrosinase inhibitors from O. fragrans extract respectively. Oxidative damage model of skin fibroblasts induced by H2O2 was used to evaluate the protective effect of oxidative stress of O. fragrans aqueous extract and its chemical components. Results: Aqueous extract of O. fragrans had good scavenging effect on DPPH· and ABTS+· free radical in vitro, and its EC50 values of free radical scavenging effect on DPPH· and ABTS+· were 37.66, 38.32 μg/mL, respectively. When the concentration of O. fragrans extract reached 2 mg/mL, FRAP value could be as high as 3.17. The EC50 of tyrosinase diphenoloxidase inhibition of O. fragrans extract was 595.9 μg/mL. Through analysis of UPLC-Triple-TOF/MS, a total of 28 chemical compositions were preliminarily identified. Five antioxidant active compounds which also greatly combined with tyrosinase were screened out from O. fragrans extract by simultaneously using UPLC-PDA-QDa-ABTS+· online method and UF-LC-MS method. Among them, the main active ingredient was verbascoside. Antioxidant and tyrosinase assay showed that verbascoside had significant antioxidant activity and tyrosinase inhibitory activity. EC50 values of verbascoside of scavenging effect on DPPH· and ABTS+· were 10.27, 14.96 μg/mL, respectively. When the concentration of verbascoside was 1 mg/mL, FRAP value could be up to 4.22. The EC50 of tyrosinase monophenoloxidase inhibition of verbascoside was 477.5 μg/mL, but with little diphenoloxidase inhibitiory effect. The oxidative damage model induced by H2O2 was used to further verify the significant protective effects of O. fragrans extract and verbascoside on oxidative damage of skin fibroblasts. Conclusion: The aqueous extract of O. fragrans and its main active component, verbascoside, had good antioxidant activity, tyrosinase inhibitory activity and oxidative stress protection ability.
-
Keywords:
- Osmanthus fragrans Lour. /
- verbascoside /
- UPLC-ABTS+· /
- online antioxidation /
- UF-LC-MS /
- tyrosinase inhibitors
-
桂花(Osmanthus fragrans Lour.)属木犀科(Oleaceae)木犀属(Osmanthus)植物,又名金粟、九里香,是我国十大传统名花之一[1],具有观赏、食用价值,有“全营养食品”之称[2]。桂花在我国有悠久的食用历史,以“食”、“药”等方式融入养生保健,至今还流行各式桂花饮、桂花酒、桂花糕点等[3]。据《本草纲目》记载,桂花能“治百病、养精神、和颜色,为诸药先聘通使,久服轻身不老,面生光华、媚好如童子”,具有延缓衰老的作用[4]。文献研究表明,桂花中的次生代谢产物丰富,主要含有苯乙醇苷、黄酮、苯丙素、三萜等多种成分[5]。其中,又以毛蕊花糖苷含量最为丰富[6-7]。
药食同源植物的活性成分研究一直是研究热点,传统方法是将活性成分分离后再逐一进行活性测定,耗时耗力,且易出现活性丢失现象[8]。近年,高效液相色谱-ABTS+·在线抗氧化检测技术已被广泛应用于天然产物中抗氧化剂的分离和鉴定[9-10],将活性分析与现代分析仪器结合,如甘小娜等[11]成功运用此技术筛选了藤茶中的抗氧化物质。然而,目前抗氧化活性筛选鲜少有超高效液相(UPLC)的在线抗氧化运用。超滤亲和-质谱联用技术(UF-LC-MS)是将超滤技术与质谱技术相结合的一种高效药物筛选方法[12-13],以酶为靶点成功应用于复杂体系中活性成分的发现和鉴定[14-15],如SONG等[16]采用UF-LC-MS从菊花中筛选了黄嘌呤氧化酶抑制剂。然而,国内外对酪氨酸酶的超滤亲和应用鲜少有报道。酪氨酸酶(Tyrosinase)是一种含铜氧化还原酶,与动物体黑色素的合成、抗氧化、保护皮肤和果蔬的褐变密切相关,可通过抑制其活性达到美白褪黑和保鲜果蔬的目的 [17-18]。
本实验探究了桂花水提物的抗氧化活性及抑制酪氨酸酶的活性。且采用UPLC-PDA-QDa-ABTS+·法筛选桂花中抗氧化剂,同时利用UF-LC-MS技术,快速筛选桂花中酪氨酸酶抑制剂。此外,对桂花活性成分的抗氧化能力及酪氨酸酶的抑制性进行了验证,并进一步评价了桂花及其活性成分对皮肤成纤维细胞氧化损伤的保护作用。本文初步揭示了桂花抗氧化和美白活性药效物质基础,并为桂花开发的抗氧化功能食品、预防食物酶促褐变以及口服美容保健功能产品提供一定的参考。
1. 材料与方法
1.1 材料与仪器
桂花 购自广西桂林,由本单位孙帅博士鉴定为木犀科木犀属植物,存样于安利(中国)研发中心中药材标本库;甲醇、乙腈(色谱纯) 德国Merck公司;乙醇(分析纯) GENERAL-REAGENT 公司;甲酸(色谱纯) 美国Honeywell 公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、过硫酸钾(K2(SO4)2)、PBS(C8020) Adamas Reagent公司;酪氨酸酶(9002-10-2)、二甲基亚砜DMSO(#D4540) 美国Sigma公司;毛蕊花糖苷(Batch NO.7335; CAS 61276-17-3;纯度99.8%) 上海诗丹德生物技术有限公司;B16细胞株 中国科学院上海细胞生物所;DMEM高糖培养基(11965084)、胎牛血清FBS(10099141C)、青霉素-链霉素(10000 U/mL) PS(10378016)、0.25%胰酶细胞消化液(R001100) 美国Gibco公司;MTT试剂盒(G020-1-2) 南京建成公司;活性氧检测试剂盒(S0033S) 上海碧云天公司;其他试剂 均购自上海泰坦科技股份有限公司;超滤离心管(10 kDa) 美国Microcon公司;超纯水 自制,美国密理博Milli-Q超纯水机。
Acquity/H Class超高效液相色谱仪(配PDA-检测器,串联QDa-质谱仪) 美国Waters公司;液质联用系统:Agilent 1290 UPLC超高效液相色谱仪 安捷伦科技有限公司;串联AB Sciex Triple TOF® 4600高分辨质谱 SCIEX公司; Milli-Q 超纯水系统 上海技舟化工科技有限公司;XS2051/10万分之一电子天平、MS3002S型电子分析天平 梅特勒-托利多国际贸易有限公司;WF-600EHT型超声波清洗机 宁波海曙五方超声设备有限公司;RWB3220CY-2高速冷冻离心机 德国Eppendorf公司;SH-PG-010恒温水浴锅 美国Thermo公司;FlexStation 3多功能酶标仪 美国Molecular公司。
1.2 实验方法
1.2.1 桂花水提物的制备
桂花粉碎,准确称取20.0 g,加入240 mL蒸馏水,100 ℃回流提取2次,每次1 h,滤过后合并滤液,用旋转蒸发仪真空浓缩至小体积,浓缩液用冻干机低温干燥。冻干后−20 ℃保存备用。准确称取桂花水提物冻干粉10 mg,加入蒸馏水5 mL,配制成2 mg/mL的桂花溶液,并用蒸馏水稀释到低浓度。
1.2.2 体外抗氧化活性测定
1.2.2.1 DPPH· 清除能力测定
参考文献方法[19]。精密称取DPPH粉末4 mg,加入100 mL无水乙醇,4 ℃保存备用,自由基溶液有效期为1 d,使用时用无水乙醇调节至吸光值0.8(517 nm波长),即为DPPH液。取100 μL样品溶液,加入100 μL的DPPH液,充分混合均匀,在避光条件下室温反应30 min,测A517,每个样品重复3 次。Trolex作为阳性对照,乙醇作为空白对照。
DPPH⋅清除率(%)=(1−A1/A0)×100 式中:A1为样品组A517值;A0为空白对照组A517值。
1.2.2.2 ABTS+·清除能力测定
参考文献[20],精密称取ABTS粉末约50 mg,加适量PBS溶液溶解;精密称取过硫酸钾粉末约50 mg,加入10 mL PBS溶解;取适量过硫酸钾溶液加入ABTS 溶液中,混匀,即得ABTS终浓度为3.6 nmol/L,过硫酸钾终浓度为1.2 nmol/L;室温避光反应过夜(12~16 h),于4 ℃保存备用(有效期为2 d),使用时用PBS调节至所需吸光度(729 nm 波长下吸光度为0.8±0.02)。
将100 μL不同浓度的样品溶液与200 μL底物溶液混合,孵育10 min后测A734。每个样品重复3次。Trolex作为阳性对照,PBS作为空白对照。计算ABTS+·清除率。
ABTS+⋅清除率(%)=(1−A1/A0)×100 式中:A1 为样品组A734值;A0 为空白对照组A734 值。
1.2.2.3 总抗氧化能力(FRAP法)测定
准确移取样品溶液,与180 μL FRAP工作液(按照试剂盒操作步骤配制)混合均匀后,37 ℃下孵育5 min后测定A593。每个样品平行重复3 次。具体操作方法和计算公式均参照碧云天总抗氧化能力检测试剂盒(FRAP)法。
1.2.3 酪氨酸酶抑制实验
1.2.3.1 酪氨酸酶的单酚氧化酶活力测定
酪氨酸酶单酚氧化酶测定参考文献[21]并对方法进行细微调整。以酪氨酸为底物,熊果苷为阳性对照,测定样品对酪氨酸酶单酚氧化酶的抑制活性。试验分为空白组、阳性对照组、样品组和背景组(n=3)。空白组不加样品,背景组不加酪氨酸酶液。其余组依次加入50 μL的L-酪氨酸(0.5 mmol/L)及100 μL样品液,混匀后37 ℃孵育5 min。随后加入100 μL酪氨酸酶溶液(250 U/mL),混匀后37 ℃孵育15 min,于475 nm处测定吸光度值。抑制率计算公式如下:
抑制率(%)=[1−A1−A2A3−A4]×100 式中:A1:样品溶液加酶的吸光值;样品对照组A2:50 µL PBS替代50 µL酪氨酸酶;空白组A3:100 µL PBS替代100 µL样品溶液;空白对照组A4:100 µL PBS替代100 µL样品溶液,并用100 µL PBS替代100 µL酪氨酸酶。
1.2.3.2 酪氨酸酶的双酚氧化酶活力测定
酪氨酸酶双酚氧化酶测定参考文献[22]并对方法进行了细微的调整。以多巴为底物,熊果苷为阳性对照,测定样品对酪氨酸酶双酚氧化酶的抑制活性。试验分为空白组、阳性对照组、样品组和背景组(n=3)。空白组不加样品,背景组不加酪氨酸酶液。其余组依次加入50 μL的多巴溶液(0.5 mmol/L)及100 μL样品液,混匀后37 ℃孵育5 min。随后加入100 μL酪氨酸酶溶液(100 U/mL),混匀后37 ℃孵育5 min,于475 nm处测定吸光度值;抑制率计算公式同1.2.3.1。
1.2.4 桂花中化学成分的UPLC-Triple-TOF/MS分析
色谱条件:Waters ACQUITY HSS T3 (2.1×100 mm, 1.8 µm);柱温:30 ℃;进样量:1 μL;流动相A:0.1%甲酸水溶液,流动相B:乙腈;流速:0.3 mL/min。梯度洗脱程序:0~10 min,90%~80% A;10~15 min,80%~70% A;15~21 min,70%~50% A; 21~23 min,50%~20% A; 23~25 min,20%~10% A; 25~28 min,10%~90% A。
质谱条件:离子源为ESI源;一级质谱参数为扫描范围:50~1700;雾化气(kPa):345 ;气帘气(kPa):240;离子源电压(V):5000;离子源温度(℃):500;去簇电压(V):100;碰撞能(eV):10。二级质谱参数为扫描范围:100~1500 m/z;去簇电压(V):100;碰撞能(eV):40;碰撞电压摆幅(eV):20。
1.2.5 桂花在线抗氧化活性筛选
UPLC-QDa-ABTS+·在线鉴别桂花中的抗氧化成分装置流程见图1[18]。Line A:样品溶液经色谱柱分离后,进入柱后反应模块,与柱后反应体系泵入的PBS 缓冲液混合后先后流经PDA检测器和Qda检测器,即可得到化合物在330 nm下的正吸收峰图及质谱图。Line B:将柱后体系中的溶剂置换成ABTS+·,ABTS+·在729 nm处有最大吸收。当抗氧化剂存在时,ABTS+·转变成结构稳定的ABTS,其在729 nm的吸收消失[23]。以相同的条件进样,供试品溶液经分离后与柱后反应体系泵入的ABTS+·混合并反应后进入PDA检测器,即可得到由于自由基的清除作用而形成的负吸收峰[24]。
UPLC条件:检测波长:330 nm/729 nm;进样量:2 μL;其余条件均与1.2.4中色谱条件相同。
质谱条件:离子源:电喷雾离子源(ESI);负离子检测模式;雾化器:N2;锥孔电压(CV):15 V;质量扫描范围:100~800 m/z。柱后反应系统条件:反应环体积:1 mL;柱后流动相:PBS/ABTS+·溶液;流速:0.5 mL/min;柱后反应模块温度:37 ℃。
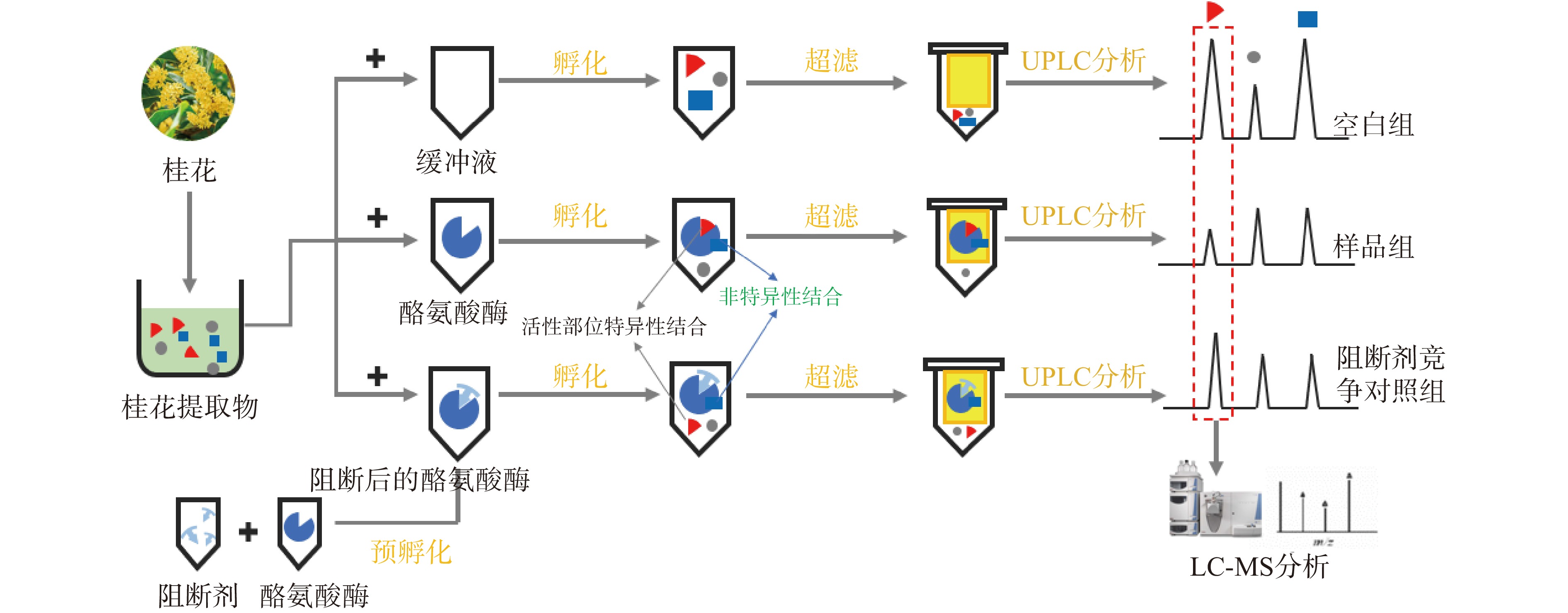
1.2.6 超滤亲和技术筛选桂花中酪氨酸酶抑制剂
如图2所示,参考文献[25],试验分为空白对照组、样品组和阻断性竞争样品对照组。空白组使用PBS替代酶;样品组使用PBS代替竞争性配体与酶预孵化;对照组加入50 µL 竞争性配体与250 µL酪氨酸酶溶液(500 U/mL)预孵化,置于37 ℃恒温水浴锅中预孵化30 min。将溶液转移至超滤离心管中12000 r/min的速度常温离心15 min,向滤膜中加入PBS清洗3次,彻底洗去未结合的配体。舍弃离心液后,依次往离心管中加入桂花水溶液(10 mg/mL,50 µL)和250 µL PBS溶液,37 ℃下继续孵育30 min,于12000 r/min的高速离心15 min,向滤膜中加入300 µL PBS,离心清洗2次。收集过滤液,混匀后UPLC-MS分析。竞争性配体溶液为500 μg/mL白藜芦醇。
1.2.7 成纤维细胞活性氧检测
1.2.7.1 人皮肤成纤维细胞培养
人皮肤成纤维细胞HS27培养于含有10% FBS的DMEM高糖培养基中(含100 U/mL青霉素,100 μg/mL链霉素),置CO2孵箱,于37 ℃、5% CO2、饱和湿度环境下。每2~3 d用0.25%胰酶消化,以1:3~1:5传代。当细胞生长状态稳定,呈对数生长期时,用于实验。
1.2.7.2 MTT法测定化合物对细胞活性的影响
参考文献[26],当细胞生长至对数期时,消化制成细胞悬液。每孔100 μL,密度为5×104个/mL,接种于96孔板中。培养24 h,待细胞贴壁后,弃去培养液。实验分为空白组:只含培养基;对照组:加培养基正常培养细胞;测试组:含不同浓度桂花水提物溶液的培养基培养细胞。培养48 h后,每孔加MTT溶液50 μL,继续培养4 h,弃去上清液,每孔加DMSO 150 μL,振荡20 min,酶标仪于570 nm处测定各孔的吸光度。
按照公式计算细胞存活率:
细胞存活率(%)=(测试组A570值−空白组A570值)/(对照组A570值−空白组A570值)×100
1.2.7.3 细胞抗氧化能力测定
参考文献[27],细胞培养同上,当细胞生长至对数期时,消化制成细胞悬液,以每孔体积2 mL,密度1×105 个/mL,接种于6孔板中。待细胞贴壁24 h后,弃去培养液,PBS洗涤两次。加药作用24 h后,每孔加H2O2(叔丁基过氧化氢终浓度500 μmol/L),孵育30 min。孵育结束后吸弃孔液,用PBS清洗1次。按照1:1000用无血清培养液稀释DCFH-DA,使其终浓度为10 μmol/L。每孔中加入1mL稀释好的DCFH-DA。37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,以除去为进入细胞内的DCFH-DA。0.05%胰酶消化细胞,4 ℃预冷1.5 mL PBS离心洗涤一次,离心后用150 μL PBS重悬细胞,过滤成单细胞,用流式细胞仪检测。实验分为空白组:无样品,无H2O2,无探针;阴性对照组:无样品,无H2O2,有探针;模型组:无样品,有H2O2,有探针;阳性对照组:阳性药物,有H2O2,有探针;样品组:有样品,有H2O2,有探针。阳性药物为200 μg/mL Trolex。
1.3 数据处理
采用GraphPad Prism 6.0 软件对实验数据进行分析,数据结果以均值±标准差(
ˉx ±s)表示,组间比较采用单因素方差分析,组间两两比较采用t 检验分析。P<0.01为差异具有统计学意义。2. 结果与分析
2.1 桂花的抗氧化活性及抑制酪氨酸酶活性
2.1.1 桂花提取物的抗氧化活性
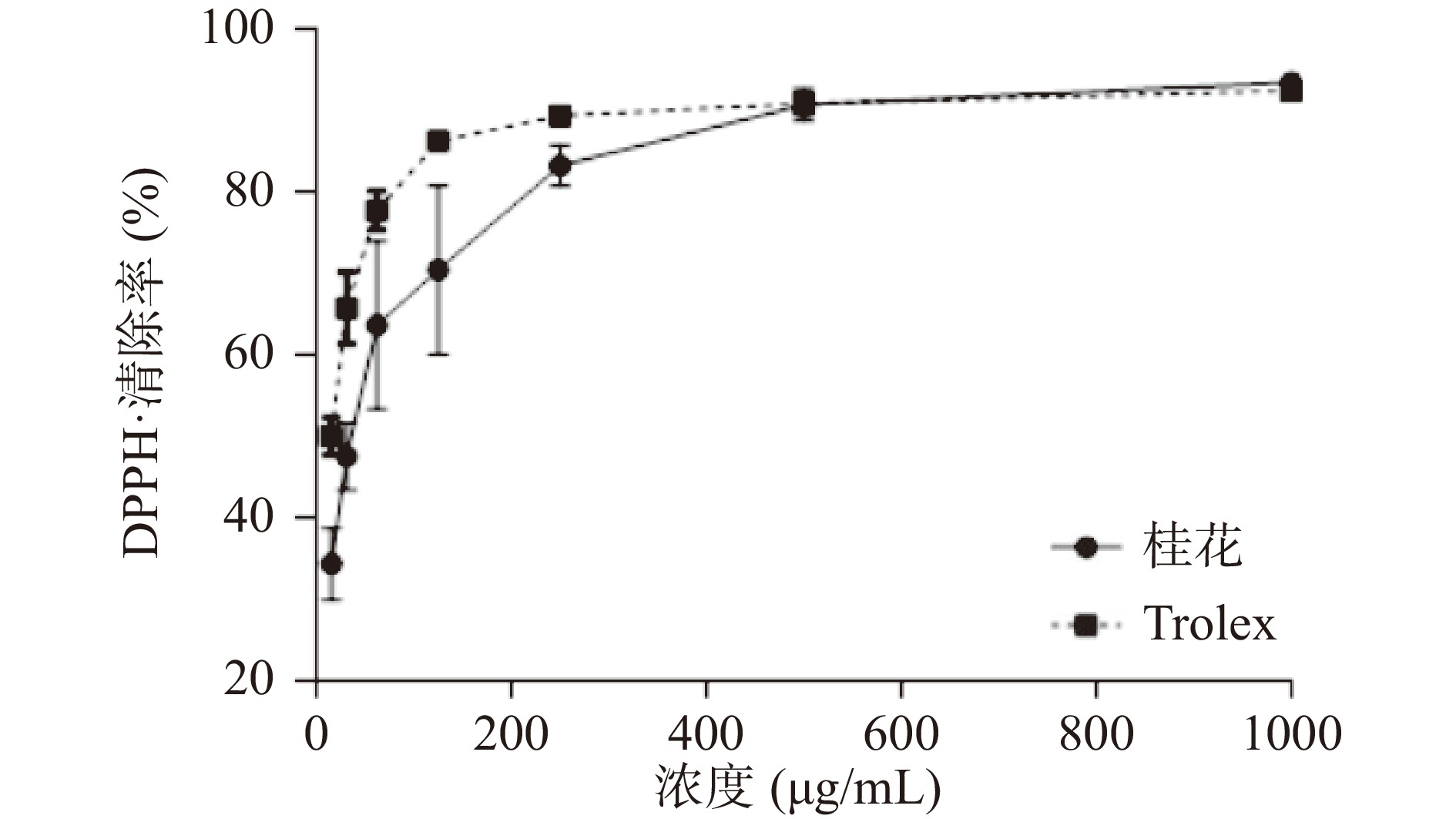
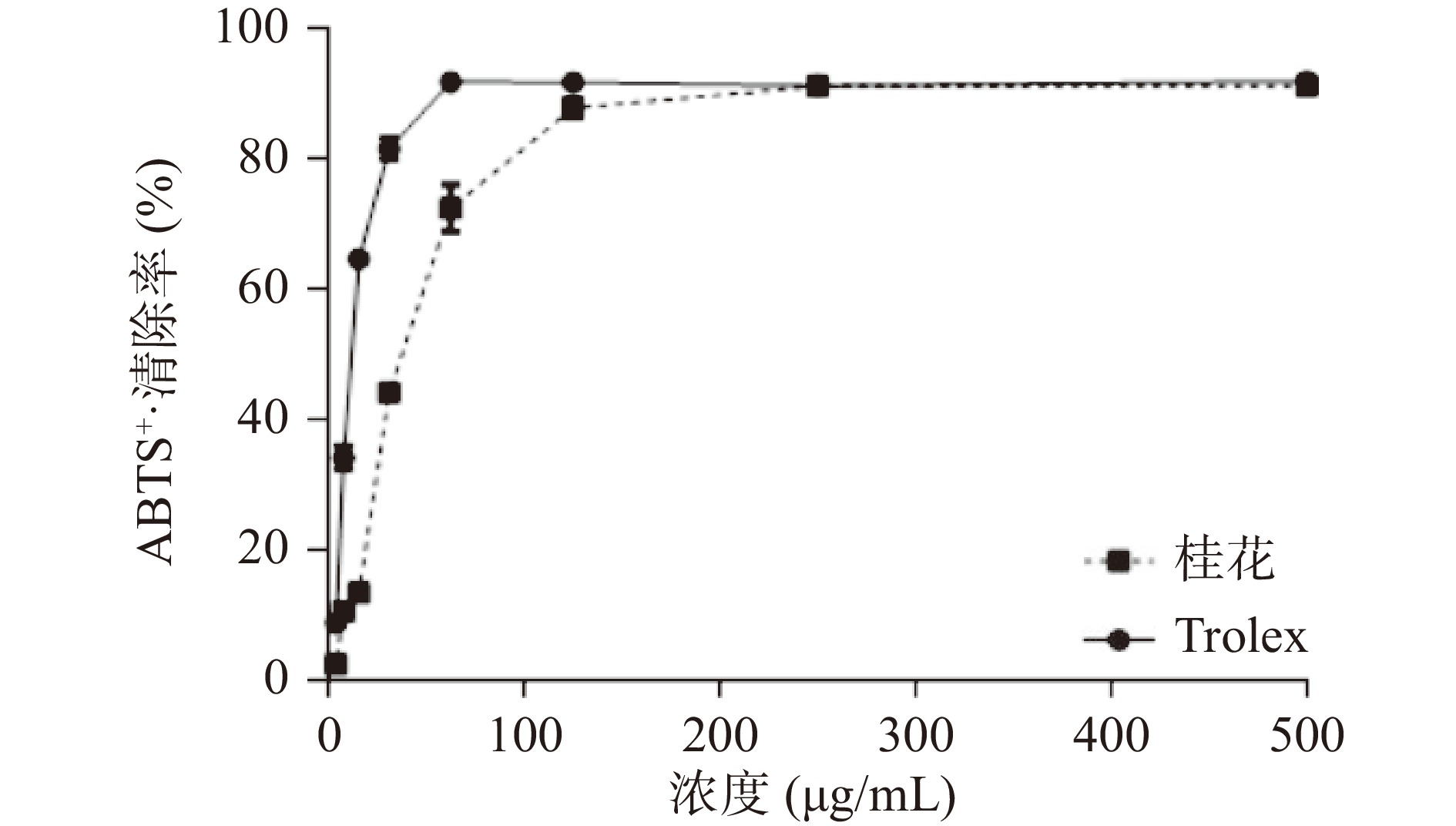
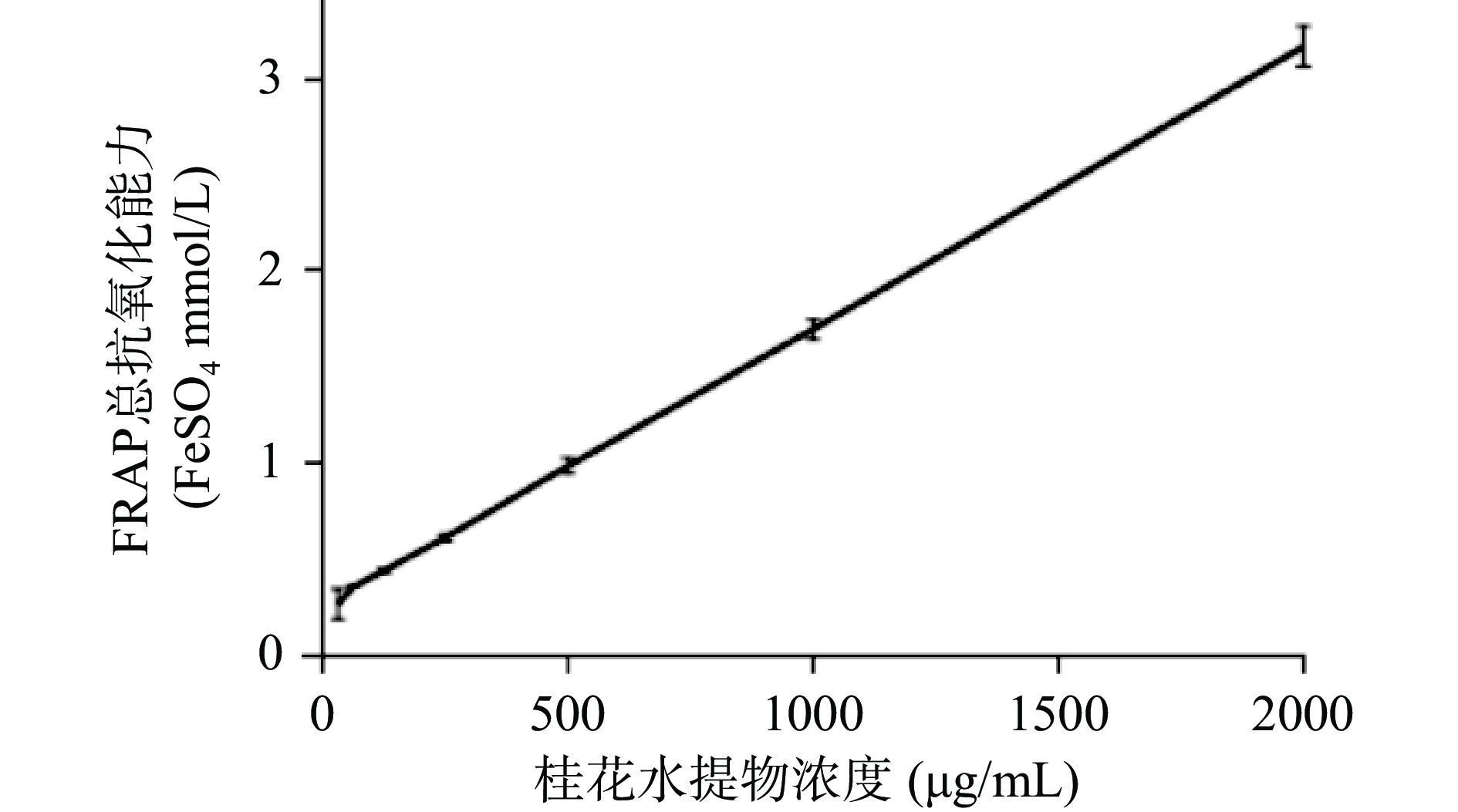
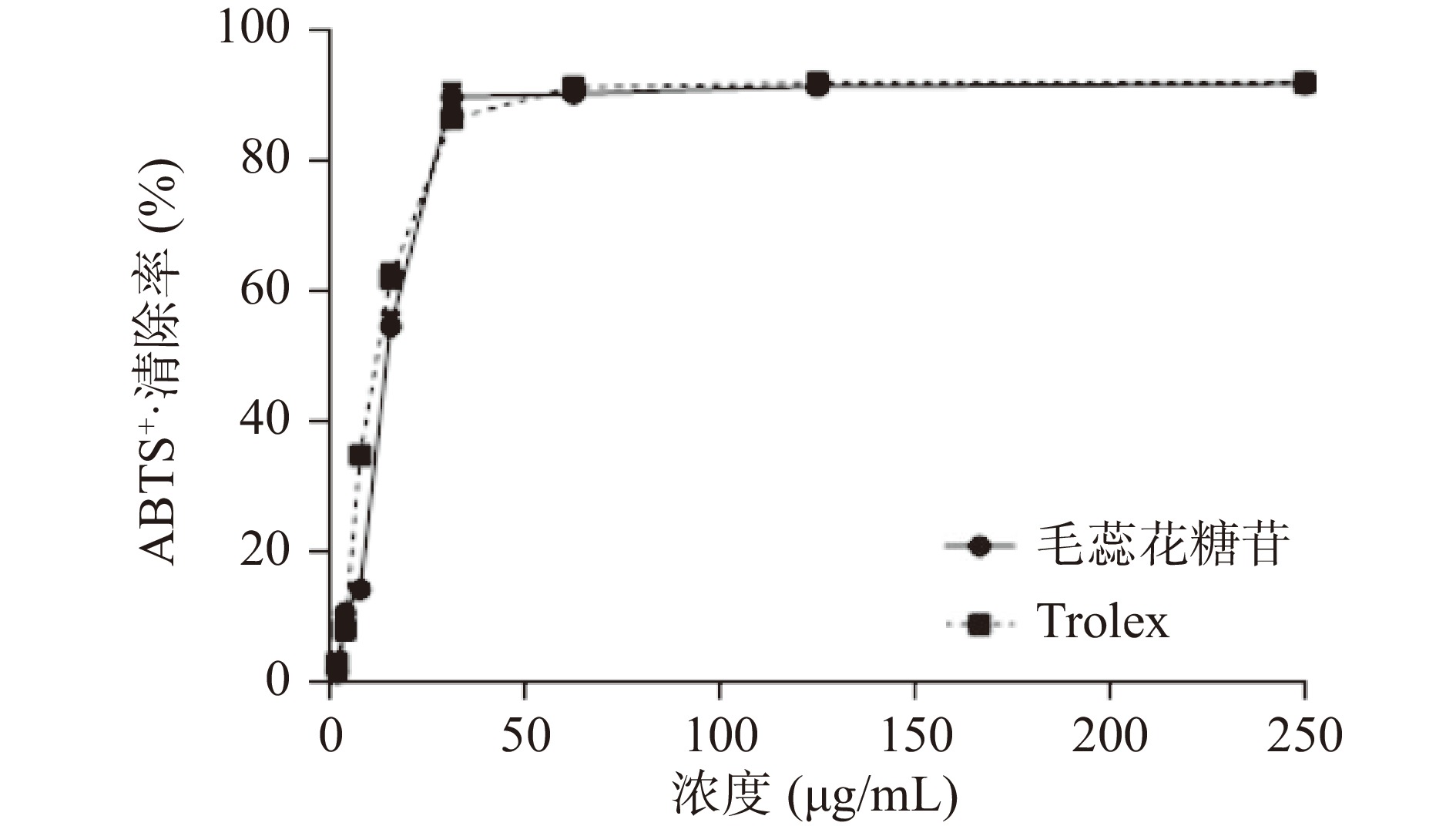
桂花水提物的DPPH·清除能力、ABTS+·清除能力和FRAP结果分别见图3、图4、图5。由图可知,桂花水提物和Trolex清除DPPH·、ABTS+·能力及总抗氧化能力与二者的质量浓度均呈现一定的量效关系。与相同质量浓度的Trolex相比较,桂花水提物清除DPPH·、ABTS+·的能力略弱。桂花水提物和Trolex清除DPPH·的半数有效浓度(EC50)值分别为37.66 μg/mL及17.17 μg/mL。桂花水提物和Trolex清除ABTS+·的EC50值分别为38.32 μg/mL及11.80 μg/mL。结果显示,桂花水提物具有良好的清除DPPH·及ABTS+·的效果。不同浓度样品的总抗氧化能力用标准物质FeSO4 溶液浓度表示,即FRAP值。当桂花浓度达到2 mg/mL时,FRAP值可高达3.17。
因此,桂花水提物具有较强的抗氧化作用,结果与文献[28]报道一致。初步猜测是桂花提取物中含有丰富的总多酚及总黄酮。然而,文献中的桂花基本都是乙醇提取,且没有评价各成分对抗氧化的贡献。因此,后续采用UPLC-QDa-ABTS+·在线筛选桂花水提物中主要的抗氧化活性成分。
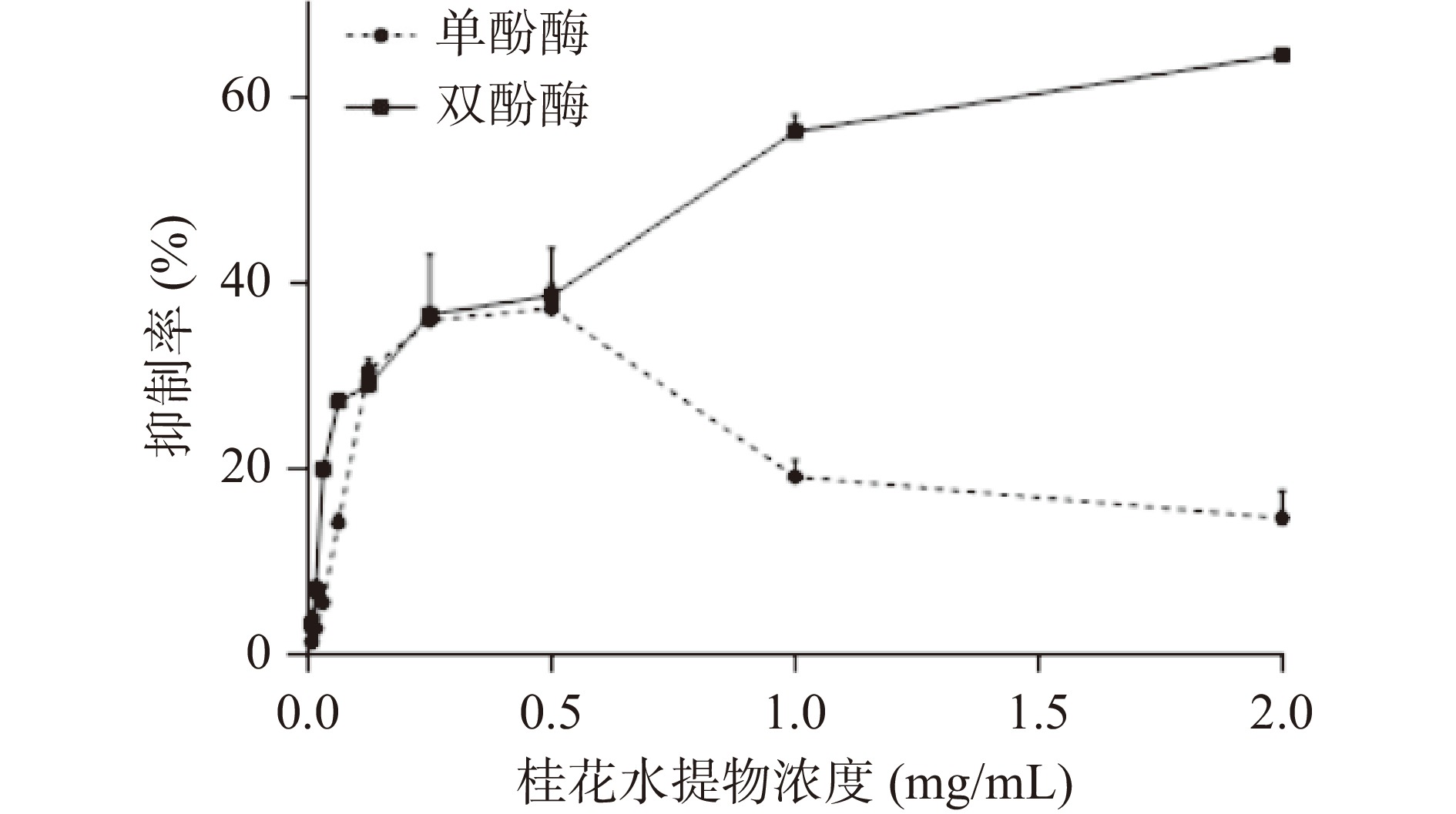
2.1.2 桂花提取物对酪氨酸酶抑制活性
桂花提取物对酪氨酸酶单酚酶、双酚酶的抑制活性测定结果见图6。桂花提取物浓度在8~500 μg/mL范围内,酪氨酸酶单酚酶抑制率随样品浓度的升高而升高,呈现剂量依赖关系。但当桂花浓度大于500 μg/mL时,酪氨酸酶单酚酶抑制率却出现明显下降。而对于酪氨酸酶双酚酶,桂花提取物抑制活性随样品浓度的升高而升高,剂量依赖性明显,具有较好的双酚酶抑制效果,EC50为595.9 μg/mL。
文献[29]中发现桂花丙酮提取物对酪氨酸酶单酚酶的抑制率远远高于双酚酶。实验结果显示桂花水提物对酪氨酸酶双酶有更好地抑制效果,可能与不同溶剂提取的活性成分不同有关。
2.2 桂花化学成分的鉴定
通过UPLC-Q-TOF-MS对桂花提取液进行分析[30],结合“Analyst 1.1.7”及“Peakview 1.2.0.3”软件中色谱峰对应的准分子离子信息、二级碎片信息,并参考相关文献(表1),成功初步鉴定了28个化合物(见图7)。其中,苯乙醇苷类成分5个,分别是红景天苷、橄榄苦苷、毛蕊花糖苷、异毛蕊花糖苷和2-乙酰基毛蕊花糖苷;黄酮类成分8个,分别为芦丁及其同分异构体、异槲皮苷、木犀草苷、山奈酚-3-O-葡萄糖苷、山奈酚-3-O-芸香糖苷、山奈酚-3-O-鼠李糖苷和柚皮素;环烯醚萜类化合物2个,分别是特女贞苷和女贞苷;木脂素类化合物3个,分别是r-连翘种苷、s-连翘种苷和连翘苷;有机酸类成分7个,分别为奎宁酸、新绿原酸、绿原酸、隐绿原酸、咖啡酸、对香豆酸和阿魏酸;糖类成分1个,为阿洛糖醇;其他2种化合物为Caffeoyl rutinose ester及一个未知物。
表 1 桂花提取物主要成分鉴定结果Table 1. Compounds of O. fragrans flowers identified by UPLC–QTOF–MS序号 保留时间(min) [M-H]- m/z 分子式 中文名 英文名 MS/MS 数据 参考文献 1 0.87 181.0718 C6H14O6 阿洛糖醇 Allitol 181.0717;119.0369;101.0255;
89.0261;71.0143[34] 2 0.92 191.0568 C7H12O6 奎宁酸 Quinic acid 191.0561;127.0402;93.0347;85.0295 [35] 3 1.79 312.1092 C14H19NO7 未知 Unknown 161.0467;159.0311;150.0572;101.0249 4 2.62 353.0891 C16H18O9 新绿原酸 Neochlorogenic acid 191.0558;173.0441;135.0450;127.0401 [36] 5 2.74 299.1137 C14H20O7 红景天苷 Salidroside 137.0239;119.0508;95.0316;89.0254 [32] 6 2.87 487.1475 C21H28O13 / Caffeoyl rutinose ester 487.1515;179.0371;161.0264;
135.0467;133.0317[31] 7 4.14 353.0878 C16H18O9 绿原酸 Chlorogenic acid 191.0571;161.0255;135.0463;127.0410 [32] 8 4.41 353.0883 C16H18O9 隐绿原酸 4-Dicaffeoylquinic acid 191.0558;179.0341;161.0243;
135.0441;127.0390[32] 9 5.39 179.0356 C9H8O4 咖啡酸 Caffeic acid 143.8633;135.0459;134.0393;
107.0490;79.0547[36] 10 7.43 639.1924 C29H36O16 r-连翘种苷 r-Suspensaside 639.1947;621.1817;179.0344;
161.0237;151.0395[37] 11 7.63 639.1925 C29H36O16 s-连翘种苷 s-Suspensaside 639.1953;621.1850;179.0354;
161.0257;151.0404[38] 12 8.13 163.0405 C9H8O3 对香豆酸 p-Coumaric acid 162.8371;119.0495;93.0340 [39] 13 9.30 193.0513 C10H10O4 阿魏酸 Ferulic acid 178.0246;149.0614;134.0370;133.0294 [6] 14 10.05 609.148 C27H30O16 芦丁 Rutin 609.1433;609.1841;301.0321;
300.0258;271.0208[40] 15 10.72 463.0885 C21H20O12 异槲皮苷 Isoquercitrin 463.0877;301.0306;300.0270;271.0254;
178.9921;151.0015[31] 16 10.88 623.1963 C29H36O15 毛蕊花糖苷 Verbascoside 623.1975;461.1676;161.0250;133.0298 [7] 17 12.06 623.1985 C29H36O15 异毛蕊花糖苷 Isoacteoside 623.1975;461.167;161.0253;133.0293 [33] 18 12.25 609.1473 C27H30O16 芦丁同分异构体 Isomer of rutin 609.1473;300.0230;301.0347;
255.0298;178.9968[41] 19 12.41 449.1091 C21H20O11 木犀草苷 Luteoloside 287.0577;258.0527;145.0521 [31] 20 12.59 447.0937 C21H20O11 山奈酚-3-O-葡萄糖苷 Kaemferol-3-O-glucopyranoside 447.0915;284.0320;255.0285;227.0339 [35] 21 13.64 665.2086 C31H38O16 2-乙酰基毛蕊花糖苷 2-Acetylacteoside 665.2064;623.1952;461.1631;
161.0240;133.0289[41] 22 13.86 593.1515 C27H30O15 山奈酚-3-O-芸香糖苷 Kaempferol 3-rutinoside 593.1504;285.0389;284.0304;229.0512 [42] 23 14.15 539.1769 C25H32O13 橄榄苦苷 Oleuropein 539.1787;377.1211;307.0847;
149.0247;89.0235[31] 24 14.42 431.0984 C21H20O10 山奈酚-3-O-鼠李糖苷 Kaempferol-3-O-rhamnoside 285.0380;284.0296;255.0286;
229.0492;227.0337[43] 25 15.34 579.2082 C27H34O11 连翘苷 Phillyrin 579.2087;533.2042;371.1501;
356.1283;161.0488[44] 26 15.61 685.2349 C31H42O17 特女贞苷 Specnuezhenide 361.1288;291.0864;223.017;
127.0417;89.0255[31] 27 15.94 523.1828 C25H32O12 女贞苷 Ligustroside 523.1785;361.1268;291.0855;259.0952;
171.0291;111.0083;59.0140[31] 28 18.39 271.0613 C15H12O5 柚皮素 Naringenin 271.0612;177.0189;151.0036;
119.0497;107.0126[45] 化合物6的分子离子峰[M-H]-的m/z值为487.15,是毛蕊花糖苷脱离了-C8H8O2(136 Da),与文献[31]报道的Caffeoyl rutinose ester相一致。化合物7的一级质谱准分子离子峰为m/z 353.09,UPLC-Q-TOF-MS根据数据处理软件计算其分子式可能为C16H18O9,其二级质谱碎片显示为m/z 191,推测为失去一分子咖啡酰基的奎尼酸。与商业化标准品进行比较后,进一步验证了化合物7为绿原酸,与文献[32]报道的结果相一致。化合物16、17的分子离子峰[M-H]-的m/z值为623.20,并在m/z 461.17生成主要离子碎片,推断为失去一分子葡萄糖(162 Da)的苷元。二者均显示相似的二级质谱碎片(m/z 161.02,133.03),推断进一步失去一分子咖啡酰基。与商业化标准品进行比较后,进一步验证了化合物16、17为同分异构体,分别为毛蕊花糖苷和异毛蕊花糖苷,是桂花的主要活性成分,与文献[7,33]的报道结果相一致。化合物27的分子离子峰[M-H]-的m/z值为523.18。其二级碎片m/z 361.13推测是失去一分子葡萄糖得到的,碎片m/z 291.09和259.10是由于该残基进一步失去C4H6O、CH3OH产生的。二级质谱碎片m/z 171.03和111.01也与文献[31]报道一致,初步推断为女贞苷。其他化合物也依据其保留时间、碎片信息、参考文献进行初步推断,结果见表1。
2.3 桂花提取物中抗氧化成分的鉴定
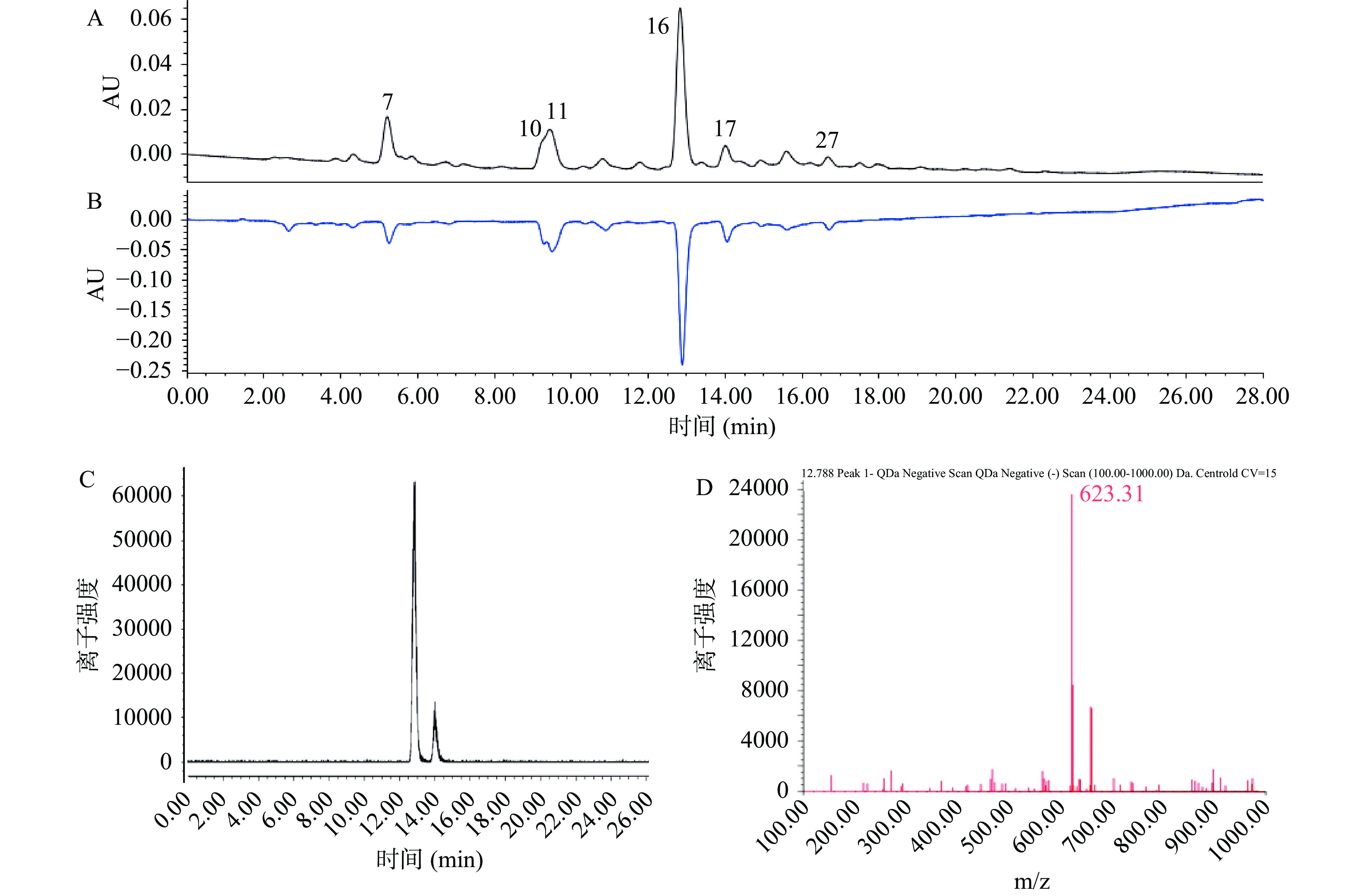
桂花供试品溶液经色谱分离后在330 nm波长下进行检测,得到呈正峰的色谱分析图(图8A)。另外供试品溶液经过色谱分离后进入柱后衍生器和ABTS发生反应后在729 nm下进行检测,得到呈负峰的抗氧化活性分析图(图8B)。由图8A、B显示,共有6个较明显的对应的正负峰,说明这6个化合物均有不同程度的抗氧化活性,其中主要抗氧化成分为化合物16。分别对其中的质谱峰进行分析,得化合物7的分子离子峰[M−H]−的m/z 值为352.94,化合物10、11的分子离子峰[M−H]−的m/z值为639.19、639.21,化合物16、17的分子离子峰[M−H]−的m/z 值为623.31、623.36(如图8C:分子量623.3的提取离子流图;图8D:毛蕊花糖苷的质谱图),化合物27的分子离子峰[M−H]−的m/z 值为523.20。结合2.2的化学成分鉴定结果,根据化合物的紫外吸收、保留时间及分子量信息,初步推断化合物7、10、11、16、17和27分别为绿原酸、r-连翘种苷、s-连翘种苷、毛蕊花糖苷、异毛蕊花糖苷及女贞苷。
根据文献[6]可知,毛蕊花糖苷是桂花的主要成分,含量高达10%。结合2.2的MS图谱及图8A、B,毛蕊花糖苷的正峰及负峰面积均为最大,说明毛蕊花糖苷是桂花水提物中最主要的抗氧化活性成分。
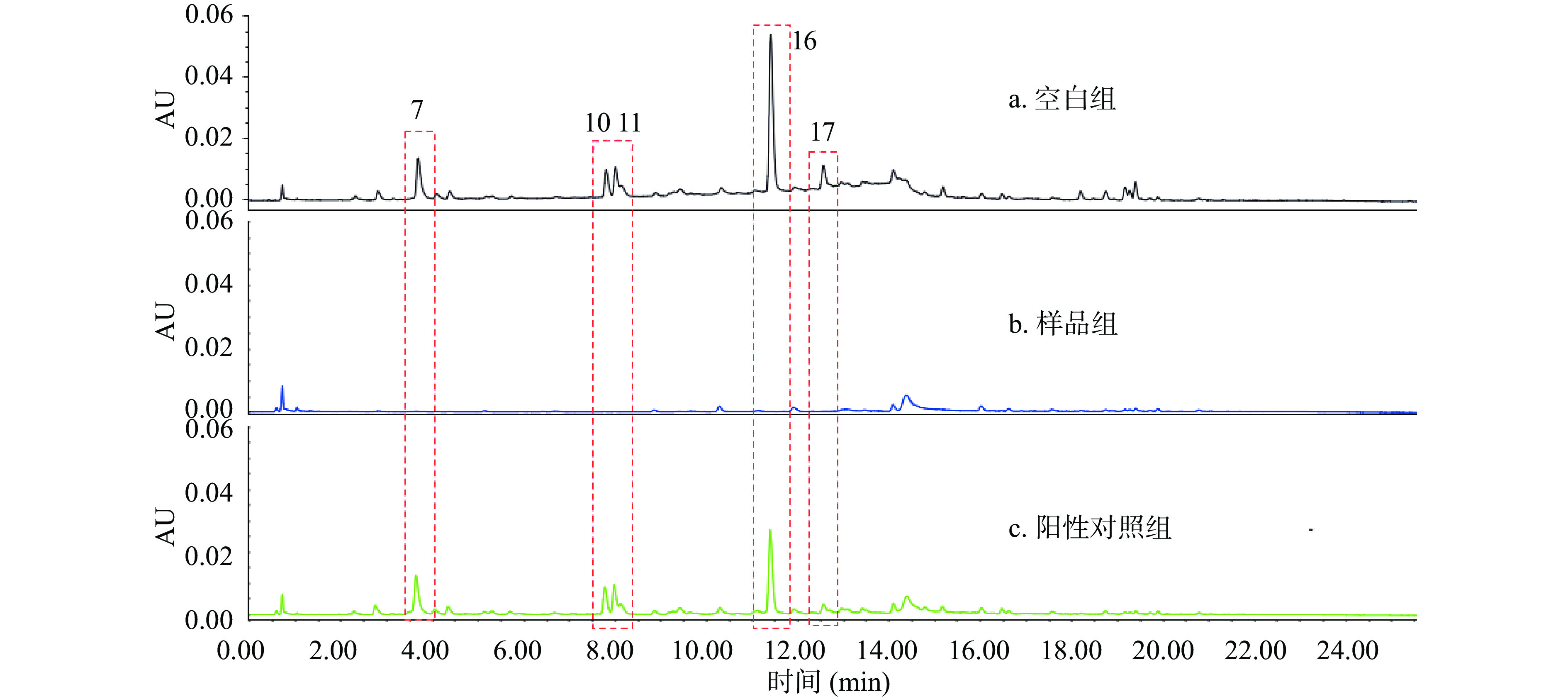
2.4 超滤离心法分析桂花提取物中抑制酪氨酸酶的活性成分
与桂花提取物的色谱图(空白组,图9a)相比,样品组(图9b)的桂花提取物中部分成分色谱峰面积要低于空白组,提示桂花提取物中部分化合物能够与酪氨酸酶结合。为排除非特异性结合而造成的假阳性结果,设计以白藜芦醇为阳性对照的竞争性抑制试验阳性对照组(图9c)。酪氨酸酶与白藜芦醇预孵化后,白藜芦醇会提前占据酪氨酸酶的活性位点。此时桂花提取物中活性成分则无法与酪氨酸酶进一步结合,活性成分的色谱峰面积较样品组则会升高。试验结果显示,桂花中化合物7、10、11、16、17的峰面积较空白组(图9a)有较明显的降低(图9b)。而在添加了竞争性配体白藜芦醇后,这5个化合物的峰面积又得以恢复(图9c),因此,推测5个化合物与酪氨酸酶发生了特异性结合,可能是潜在的酶抑制剂。结合2.2数据,比对相应化合物的分子离子峰数据,推断化合物7、10、11、16、17分别为绿原酸、r-连翘种苷、s-连翘种苷、毛蕊花糖苷和异毛蕊花糖苷。由于毛蕊花糖苷(化合物16)的下降程度最为明显,推测其是主要的酪氨酸酶抑制剂。
2.5 毛蕊花糖苷体外抗氧化能力及对酪氨酸酶抑制活性验证
2.5.1 毛蕊花糖苷抗氧化活性
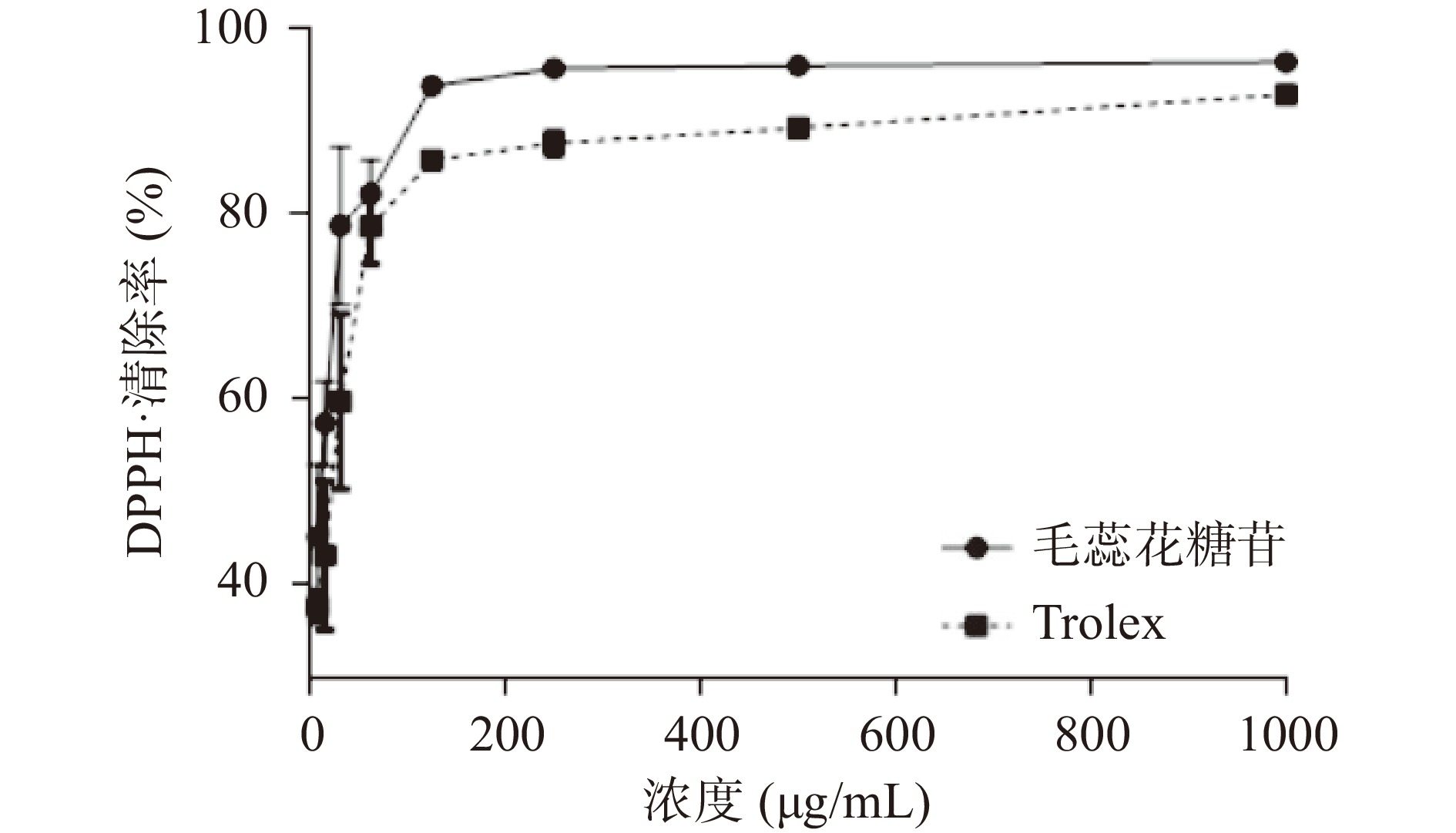
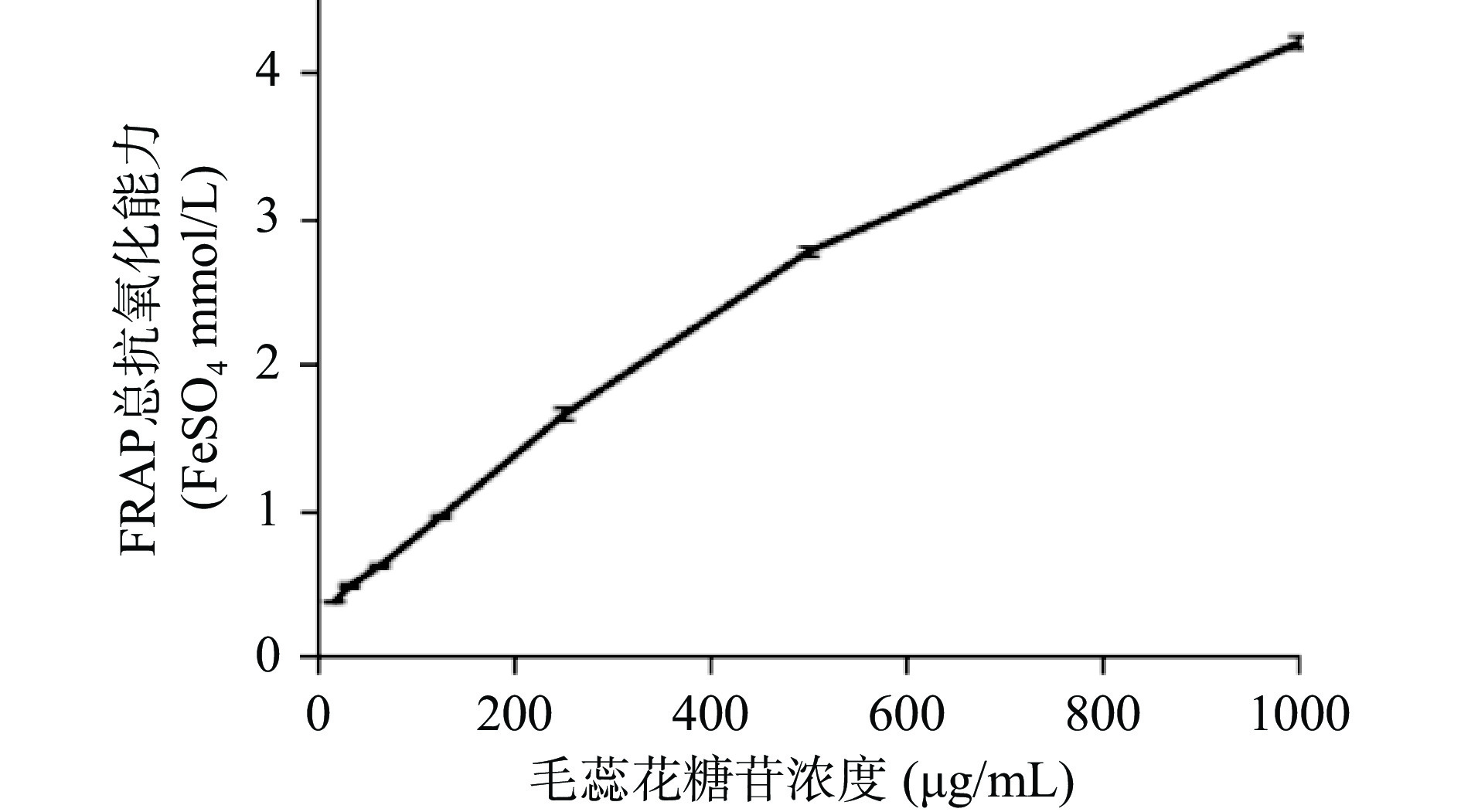
毛蕊花糖苷的DPPH·清除能力、ABTS+·清除能力和FRAP结果分别见图10、图11、图12。由图可知,毛蕊花糖苷和Trolex清除DPPH·、ABTS+·能力及总抗氧化能力与二者的质量浓度均呈现一定的量效关系。同批次实验下,毛蕊花糖苷和Trolex清除DPPH·的EC50值分别为10.27及18.77 μg/mL。毛蕊花糖苷和Trolex清除ABTS+·的EC50值分别为14.96及12.20 μg/mL。不同浓度样品的总抗氧化能力用标准物质FeSO4溶液浓度表示,即FRAP值。当毛蕊花糖苷浓度达到1 mg/mL时,FRAP值可高达4.22。因此,毛蕊花糖苷具有较强的抗氧化能力。
2.5.2 毛蕊花糖苷抑制酪氨酸酶活性
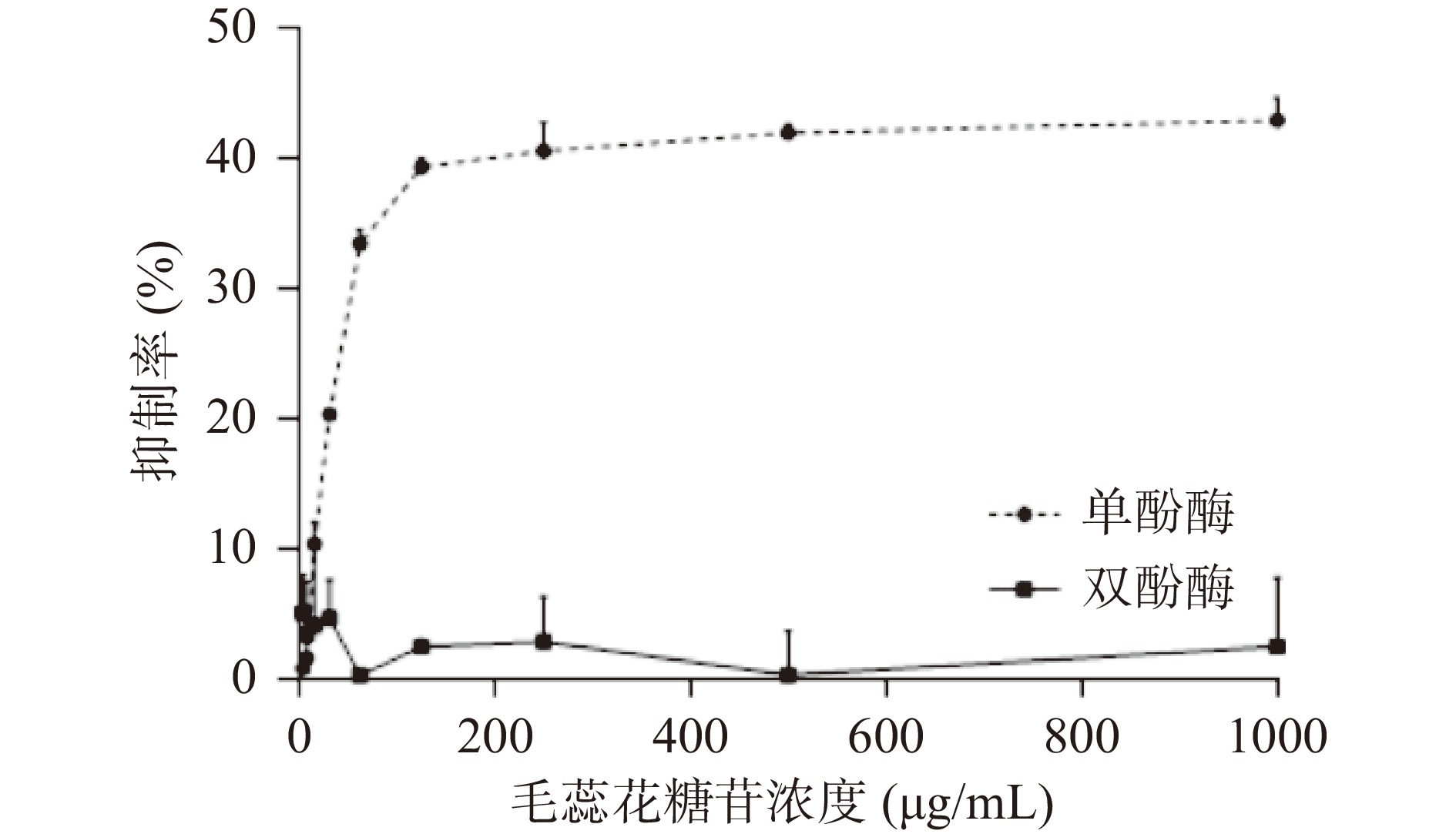
毛蕊花糖苷对酪氨酸酶单酚酶、双酚酶的抑制活性测定结果见图13。毛蕊花糖苷浓度在4~1000 μg/mL范围内,酪氨酸酶单酚酶抑制率随浓度的升高而升高,且呈现剂量依赖性;然而对酪氨酸酶双酚酶几乎无抑制作用。综上,毛蕊花糖苷有较好的酪氨酸酶的单酚酶抑制效果,EC50为477.5 μg/mL。
然而,实验发现桂花具有较好的双酚酶抑制效果,毛蕊花糖苷则只有较好的单酚酶活性,几乎没有双酚酶抑制活性,表明两者对酶的作用机制并不相同,猜测与竞争性底物不同有关[46]。超滤亲和技术主要探索的是酶与小分子化合物的结合效果,并不能深层次解释酶的抑制机理,因此化合物的酶抑制效果及具体作用机理需要后期进一步验证。
2.6 桂花与毛蕊花糖苷对人皮肤成纤维细胞氧化损伤的保护作用
2.6.1 桂花提取液及毛蕊花糖苷的安全浓度范围
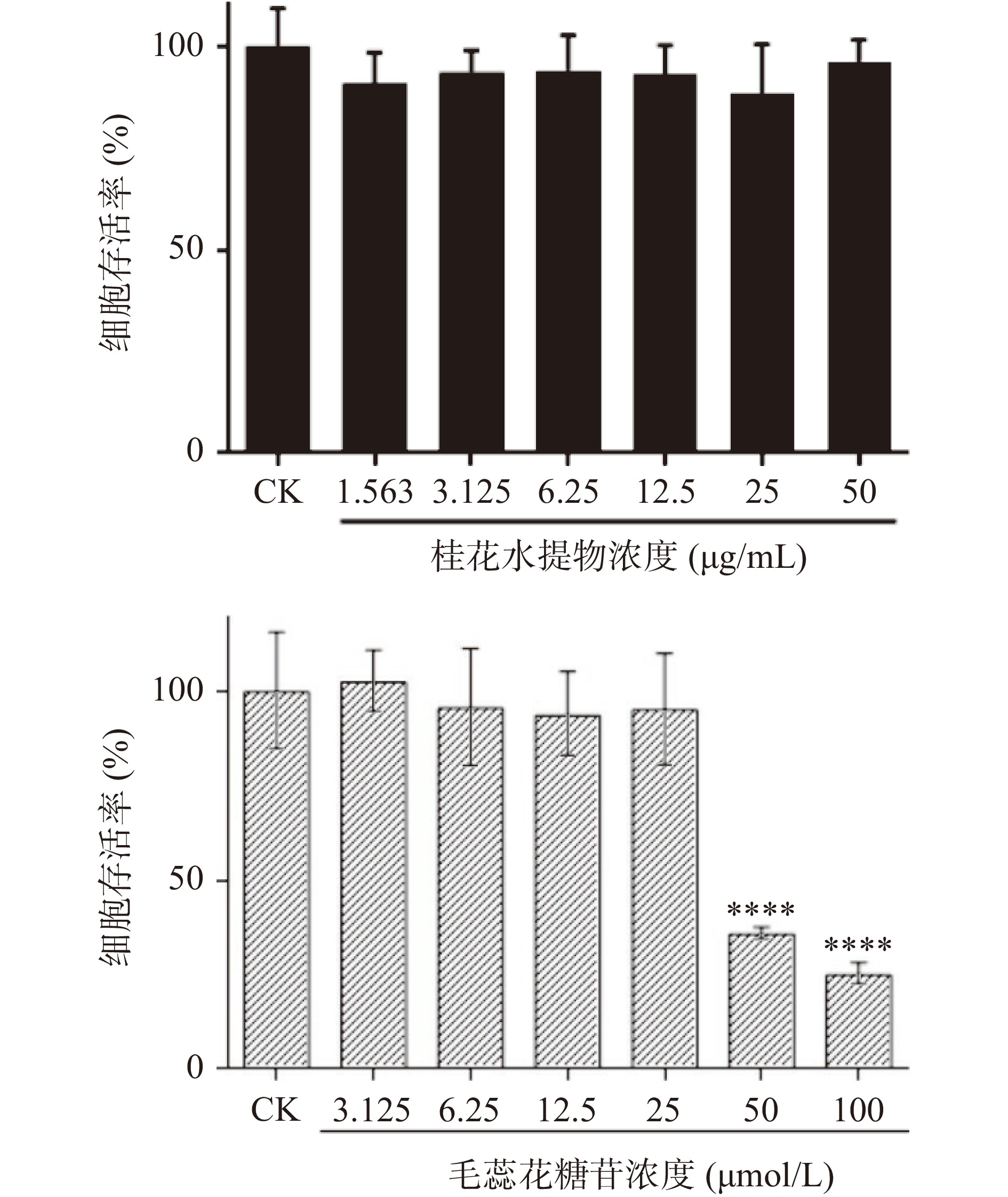
不同浓度桂花提取液(1.563~50 μg/mL)及毛蕊花糖苷(3.125~100 μmol/L)分别加入细胞培养液孵育。48 h后MTT法检测各组HS27成纤维细胞存活率。结果显示毛蕊花糖苷100及50 μmol/L两组细胞存活率明显下降,与未加药组相比差异有统计学意义(P<0.0001),见图14。上述结果表明,桂花提取液≤50 μg/mL均没有明显毒性,毛蕊花糖苷的安全浓度范围为≤25 μmol/L。因此进一步选择安全浓度范围内的桂花提取液及毛蕊花糖苷进行后续实验。
2.6.2 桂花提取液及毛蕊花糖苷对细胞中ROS水平的影响
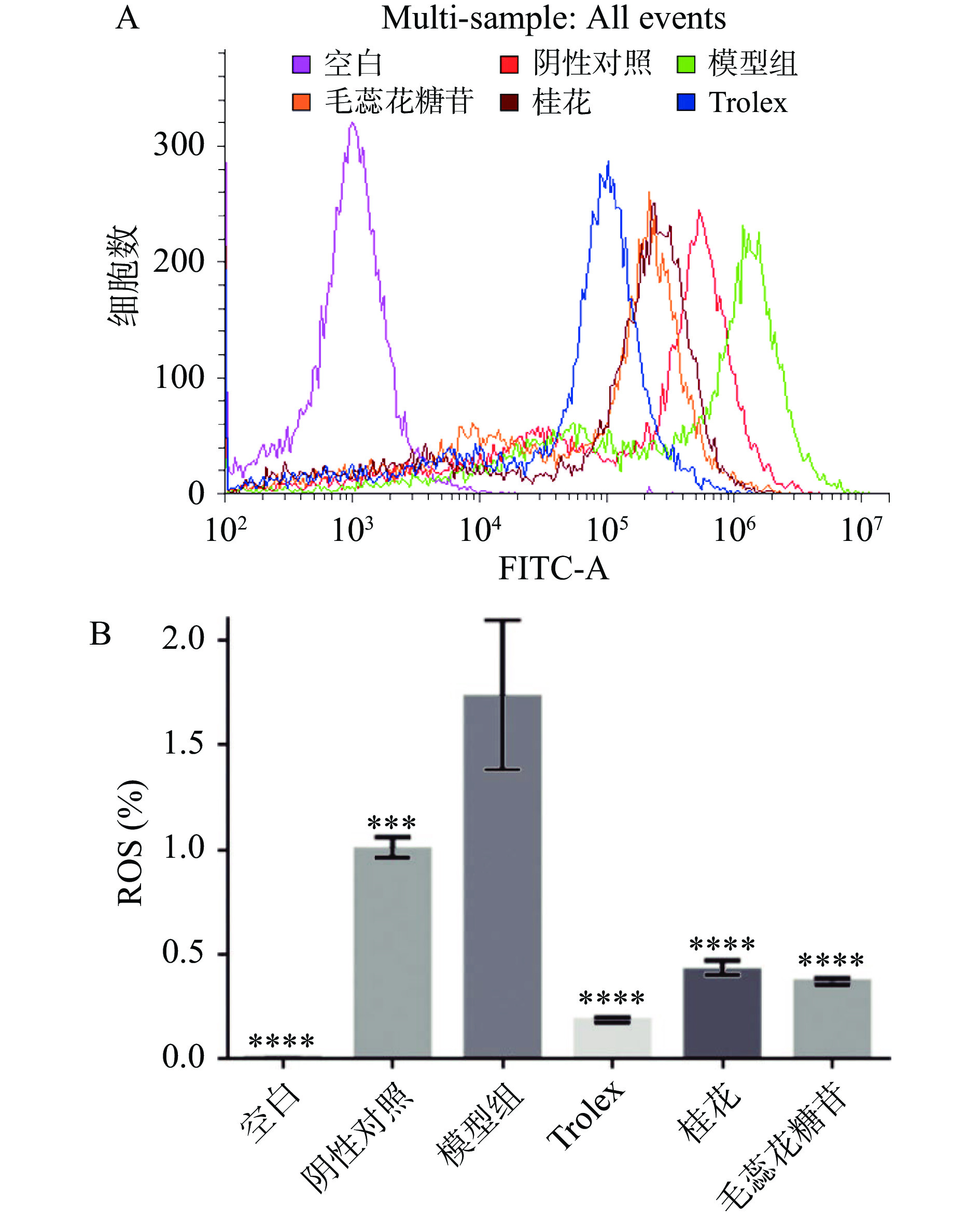
成纤维细胞是皮肤衰老过程中最主要的效应细胞,H2O2是一种常见的活性氧,极易透过细胞膜导致细胞结构的氧化损伤或诱发细胞凋亡[47]。利用离体细胞氧化损伤模型研究ROS的作用机制并筛选抗氧化损伤物质是较为有效的技术方法[48]。ROS是氧化应激反应后生成的一种自由基。细胞内ROS过多或未被及时清除,细胞会对刺激性因子产生急性的应激性反应,使细胞结构等发生不可逆性的改变和功能失常,从而促使机体细胞衰老、脏器功能减退等[49]。为了进一步了解桂花水提物及毛蕊花糖苷延缓人皮肤成纤维细胞因氧化应激所致衰老的可能机制,本文进一步观察了干扰后细胞经H2O2处理后细胞中ROS水平。
如图15A所示,空白组荧光响应值很低,说明细胞本身发出的背景荧光很弱。阴性对照组为在无H2O2存在下细胞自身ROS水平。模型组为在H2O2刺激下细胞内部的ROS水平,模型组相比较阴性对照组荧光强度显著升高,说明造模成功。由2.6.1结果可知,50 μg/mL桂花提取物及25 μmol/L毛蕊花糖苷均没有细胞毒性,因此选用该浓度进行样品功效分析。由图15B可知,50 μg/mL桂花提取物及25 μmol/L毛蕊花糖苷处理后的细胞ROS水平与模型组相比差异极显著(P<0.0001),说明桂花提取物及毛蕊花糖苷对皮肤成纤维细胞氧化损伤具有显著保护作用。
3. 讨论与结论
在体外的抗氧化实验中,桂花水提取物对DPPH·清除能力、ABTS+·清除能力和FRAP 3种抗氧化活性评价指标均表现出优异效果,EC50值与Trolex 阳性对照基本接近;此外,桂花水提物对酪氨酸酶也有显著的抑制作用。说明桂花水提取物具有明显的抗氧化作用及抑制酪氨酸酶活性。经过对桂花水提取物液质联用分析研究,从桂花水提取物中共鉴定了28 个化合物,主要为苯乙醇苷类、黄酮类、环烯醚萜类、木脂素类及有机酸类成分。通过本研究通过在线-UPLC-ABTS+·方法及超滤亲和-液质联用技术分别从桂花水提物中快速简便地筛选出抗氧化剂及酪氨酸酶抑制剂,初步推断毛蕊花糖苷是桂花中的主要活性成分。体外抗氧化实验及酶活性试验也进一步验证了毛蕊花糖苷具有显著的抗氧化活性及酪氨酸酶抑制作用。结合文献[50]报道的抑制黑色素实验,桂花水提物及毛蕊花糖苷具有潜在美白功效。
为了进一步了解桂花水提物及毛蕊花糖苷延缓人皮肤因氧化应激所致衰老的可能机制,本文进一步观察了人皮肤成纤维细胞经H2O2处理后的ROS水平。实验结果显示,桂花水提取物及毛蕊花糖苷均能显著降低H2O2处理后细胞的活性氧水平,对皮肤成纤维细胞氧化损伤具有显著保护作用。该结果为以后桂花质量标准的提升和桂花保健美容功能的综合开发提供参考和数据支持。
由于本文运用的两种快速筛选技术的原理不一样,无法实现同时评估。后期可尝试将超滤亲和处理后的样品也同时引入柱后反应体系,在lineA系统中分析超滤亲和处理后的3个样品。省去不同体系转化的时间,减少进样次数,将两种体系合为一体,从而实现同时在线分析不同体系的活性成分。但是,柱后反应体系的加入,会极大地影响色谱峰的分离度,对于成分复杂的提取物具有较大挑战。
-
表 1 桂花提取物主要成分鉴定结果
Table 1 Compounds of O. fragrans flowers identified by UPLC–QTOF–MS
序号 保留时间(min) [M-H]- m/z 分子式 中文名 英文名 MS/MS 数据 参考文献 1 0.87 181.0718 C6H14O6 阿洛糖醇 Allitol 181.0717;119.0369;101.0255;
89.0261;71.0143[34] 2 0.92 191.0568 C7H12O6 奎宁酸 Quinic acid 191.0561;127.0402;93.0347;85.0295 [35] 3 1.79 312.1092 C14H19NO7 未知 Unknown 161.0467;159.0311;150.0572;101.0249 4 2.62 353.0891 C16H18O9 新绿原酸 Neochlorogenic acid 191.0558;173.0441;135.0450;127.0401 [36] 5 2.74 299.1137 C14H20O7 红景天苷 Salidroside 137.0239;119.0508;95.0316;89.0254 [32] 6 2.87 487.1475 C21H28O13 / Caffeoyl rutinose ester 487.1515;179.0371;161.0264;
135.0467;133.0317[31] 7 4.14 353.0878 C16H18O9 绿原酸 Chlorogenic acid 191.0571;161.0255;135.0463;127.0410 [32] 8 4.41 353.0883 C16H18O9 隐绿原酸 4-Dicaffeoylquinic acid 191.0558;179.0341;161.0243;
135.0441;127.0390[32] 9 5.39 179.0356 C9H8O4 咖啡酸 Caffeic acid 143.8633;135.0459;134.0393;
107.0490;79.0547[36] 10 7.43 639.1924 C29H36O16 r-连翘种苷 r-Suspensaside 639.1947;621.1817;179.0344;
161.0237;151.0395[37] 11 7.63 639.1925 C29H36O16 s-连翘种苷 s-Suspensaside 639.1953;621.1850;179.0354;
161.0257;151.0404[38] 12 8.13 163.0405 C9H8O3 对香豆酸 p-Coumaric acid 162.8371;119.0495;93.0340 [39] 13 9.30 193.0513 C10H10O4 阿魏酸 Ferulic acid 178.0246;149.0614;134.0370;133.0294 [6] 14 10.05 609.148 C27H30O16 芦丁 Rutin 609.1433;609.1841;301.0321;
300.0258;271.0208[40] 15 10.72 463.0885 C21H20O12 异槲皮苷 Isoquercitrin 463.0877;301.0306;300.0270;271.0254;
178.9921;151.0015[31] 16 10.88 623.1963 C29H36O15 毛蕊花糖苷 Verbascoside 623.1975;461.1676;161.0250;133.0298 [7] 17 12.06 623.1985 C29H36O15 异毛蕊花糖苷 Isoacteoside 623.1975;461.167;161.0253;133.0293 [33] 18 12.25 609.1473 C27H30O16 芦丁同分异构体 Isomer of rutin 609.1473;300.0230;301.0347;
255.0298;178.9968[41] 19 12.41 449.1091 C21H20O11 木犀草苷 Luteoloside 287.0577;258.0527;145.0521 [31] 20 12.59 447.0937 C21H20O11 山奈酚-3-O-葡萄糖苷 Kaemferol-3-O-glucopyranoside 447.0915;284.0320;255.0285;227.0339 [35] 21 13.64 665.2086 C31H38O16 2-乙酰基毛蕊花糖苷 2-Acetylacteoside 665.2064;623.1952;461.1631;
161.0240;133.0289[41] 22 13.86 593.1515 C27H30O15 山奈酚-3-O-芸香糖苷 Kaempferol 3-rutinoside 593.1504;285.0389;284.0304;229.0512 [42] 23 14.15 539.1769 C25H32O13 橄榄苦苷 Oleuropein 539.1787;377.1211;307.0847;
149.0247;89.0235[31] 24 14.42 431.0984 C21H20O10 山奈酚-3-O-鼠李糖苷 Kaempferol-3-O-rhamnoside 285.0380;284.0296;255.0286;
229.0492;227.0337[43] 25 15.34 579.2082 C27H34O11 连翘苷 Phillyrin 579.2087;533.2042;371.1501;
356.1283;161.0488[44] 26 15.61 685.2349 C31H42O17 特女贞苷 Specnuezhenide 361.1288;291.0864;223.017;
127.0417;89.0255[31] 27 15.94 523.1828 C25H32O12 女贞苷 Ligustroside 523.1785;361.1268;291.0855;259.0952;
171.0291;111.0083;59.0140[31] 28 18.39 271.0613 C15H12O5 柚皮素 Naringenin 271.0612;177.0189;151.0036;
119.0497;107.0126[45] -
[1] 施婷婷, 杨秀莲, 王良桂. 3个桂花品种花香组分动态特征及花被片结构解剖学观测[J]. 南京林业大学学报:自然科学版,2020,44(4):12−20. [SHI Tingting, YANG Xiulian, WANG Lianggui. Observation on the dynamic characteristics of floral components of three Osmanthus fragrans varieties and the structural anatomy of tepals[J]. Journal of Nanjing Forestry University:Natural Science Edition,2020,44(4):12−20. [2] 薛锦赢, 殷佳雅, 黄秀玉, 等. 发酵型桂花酒的工艺优化[J]. 食品研究与开发,2021,42(10):6. [XUE Jinying, YIN Jiaya, HUANG Xiuyu, et al. Process optimization of fermented osmanthus wine[J]. Food Research and Development,2021,42(10):6. [3] 李振兴, 白杨. 纷纷加码"中国味" 百事可乐和可口可乐的竞争再升级[J]. 中国食品,2020,794(10):76−77. [LI Zhengxing, BAI Yang. The competition between Pepsi and Coca-Cola is escalating[J]. China Food,2020,794(10):76−77. [4] 刘有停, 张卫红, 周桐, 等. 桂花提取液在抗皮肤老化方面的功效研究[J]. 香料香精化妆品,2019,173(2):29−32. [LIU Youting, ZHANG Weihong, ZHOU Tong, et al. Study on the efficacy of Osmanthus fragrans extract in anti-aging skin[J]. Fragrance, Fragrance and Cosmetics,2019,173(2):29−32. [5] 赵东, 袁志彬, 孙琳, 等. 桂花及桂花酒的研究进展[J]. 酿酒科技,2017(1):90−94. [ZHAO Dong, YUAN Zhibin, SUN Lin, et al. Research progress of Osmanthus and Osmanthus wine[J]. Wine Science and Technology,2017(1):90−94. [6] 宋晓芳, 范宝磊, 曾祥玲, 等. HPLC-MS/MS法同时测定不同桂花品种中7个多酚类活性成分的含量[J]. 药物分析杂志,2019,39(10):1811−1820. [SONG Xiaofang, FANG Baolei, ZENG Xiangling, et al. HPLC-MS/MS simultaneous determination of the contents of 7 polyphenolic active components in different Osmanthus species[J]. Journal of Journal of Pharmaceutical Analysis,2019,39(10):1811−1820. [7] 丁立新, 李焕, 范宝俭, 等. HPLC法测定不同产地桂花中红景天苷和毛蕊花糖苷的含量[J]. 药物分析杂志,2013,33(5):894−897. [DING Lixin, LI Huan, FAN Baojian, et al. Determination of salidroside and verbascoside in Osmanthus fragrans from different origins by HPLC[J]. Journal of Pharmaceutical Analysis,2013,33(5):894−897. [8] SHI Yunshi, PENG Mijun, ZHANG Yuping, et al. Combination of preparative HPLC and HSCCC methods to separate phosphodiesterase inhibitors from Eucommia ulmoides bark guided by ultrafiltration-based ligand screening[J]. Analytical & Bioanalytical Chemistry,2013,405(12):4213−4223.
[9] AYA A K, MURAT K, et al. Antioxidant components of Viburnum opulus L. determined by on-line HPLC-UV-ABTS radical scavenging and LC-UV-ESI-MS methods[J]. Food Chemistry,2015,175:106−114. doi: 10.1016/j.foodchem.2014.11.085
[10] YANG Yinjun, SUN Xinguang, LIU Jinjun, et al. Quantitative and qualitative analysis of flavonoids and phenolic acids in snow chrysanthemum (Coreopsis tinctoria Nutt.) by HPLC-DAD and UPLC-ESI-QTOF-MS[J]. Molecules,2016,21(10):1307. doi: 10.3390/molecules21101307
[11] 甘小娜, 彭博, 李廷钊, 等. UPLC-PDA-MS-ABTS阳离子自由基在线分析藤茶的抗氧化活性成分[J]. 食品科学,2020,41(18):254−259. [GAN Xiaona, PENG Bo, LI Tingzhao, et al. Cationic free radical online analysis of the antioxidant active components of vine tea[J]. Food Science,2020,41(18):254−259. [12] RANI M P, PADMAKUMARI K P. HPTLC and reverse phase HPLC methods for the simultaneous quantification and in vitro screening of antioxidant potential of isolated sesquiterpenoids from the rhizomes of Cyperus rotundus[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2012,904:22−28.
[13] CALDERN M A I. Development of an ultrafiltration-liquid chromatography/mass spectrometry (UF-LC/MS) based ligand-binding assay and an LC/MS based functional assay for Mycobacterium tuberculosis shikimate kinase[J]. Analytical Chemistry,2010,82(9):3616−3621. doi: 10.1021/ac902849g
[14] S FANG, L SHEN, Z MA. Screening for ligands of human aromatase from mulberry (Mori alba L.) leaf by using high-performance liquid chromatography/tandem mass spectrometry[J]. Food Chemistry,2011,126(3):1337−1343. doi: 10.1016/j.foodchem.2010.11.096
[15] CHOI Y, JERMIHOV K, NAM S J, et al. Correction to screening natural products for inhibitors of quinone reductase-2 using ultrafiltration LC–MS[J]. Analytical Chemistry,2011,83(11):4325−4325. doi: 10.1021/ac2010197
[16] SONG H P, ZHANG H, FU Y, et al. Screening for selective inhibitors of xanthine oxidase from Flos Chrysanthemum using ultrafiltration LC–MS combined with enzyme channel blocking[J]. Journal of Chromatography B,2014,961:56−61. doi: 10.1016/j.jchromb.2014.05.001
[17] LI Y, DENG B, YANG S, et al. A colorimetric fluorescent probe for the detection of tyrosinase and its application for the food industry[J]. Journal of Photochemistry and Photobiology A Chemistry,2021,419(13):113458.
[18] VALVERDE P, GARCIA J C, JIMENEZ-CERVANTES C, et al. Tyrosinase isoenzymes in mammalian melanocytes. 2. Differential activation by alpha-melanocyte-stimulating hormone[J]. Febs Journal,2010,217(2):541−548.
[19] LIU M C, YANG S J, DA H, et al. A simple and convenient method for the preparation of antioxidant peptides from walnut (Juglans regia L. ) protein hydrolysates[J]. Chemistry Central Journal,2016,10:39−39. doi: 10.1186/s13065-016-0184-x
[20] 王计瑞, 谭均, 李隆云, 等. 国槐不同组织器官中多成分分析及抗氧化活性研究[J]. 中草药,2020,51(17):4513−4520. [WANG Jirui, TAN Jun, LI Longyun, et al. Multi-component analysis and antioxidant activity in different tissues and organs of Chinese Sophora japonicus[J]. Chinese Herbal Medicine,2020,51(17):4513−4520. [21] HIMANI Singh, MADHURI Kaushish Lily, KOUSHALYA Dangwal. Viburnum mullaha D. DON fruit (Indian Cranberry): A potential source of polyphenol with rich antioxidant, anti-elastase, anti-collagenase and anti-tyrosinase activities[J]. International Journal of Food Properties,2016,20(5-8):1729−1739.
[22] 王苗苗, 严欢, 田合, 等. 薰衣草提取物的体外抗氧化活性及酶抑制活性研究[J]. 食品工业科技,2019,40(16):14−26. [WANG Miaomiao, YAN Huan, TIAN He, et al. Study on the antioxidant activity and enzyme inhibition activity of lavender extract in vitro[J]. Food Industry Science and Technology,2019,40(16):14−26. [23] 王丹, 时志春, 李军, 等. HPLC-ABTS+·在线检测快速评价茶叶总抗氧化能力[J]. 食品工业,2020,41(8):280−283. [WANG Dan, SHI Zhichun, LI Jun, et al. HPLC-ABTS+· on-line detection to quickly evaluate the total antioxidant capacity of tea[J]. Food Industry,2020,41(8):280−283. [24] 陈菁, 周建桥, 谭国英, 等. 在线提取HPLC-ABTS联用快速分析枳椇子中抗氧化成分[J]. 药物分析杂志,2021,41(2):203−209. [CHEN Jing, ZHOU Jianqiao, TAN Guoying, et al. On-line extraction of HPLC-ABTS combined with rapid analysis of the antioxidant components in Hovenia dulcis[J]. Chinese Journal of Pharmaceutic,2021,41(2):203−209. [25] LIM, SOON, SUNG. Identification of tyrosinase specific inhibitors from Xanthium strumarium fruit extract using ultrafiltration-high performance liquid chromatography[J]. Journal of Chromatography B,2015,1002:319−328. doi: 10.1016/j.jchromb.2015.08.030
[26] CHANG J L, PARK S K, JIN Y K, et al. Melanogenesis regulatory activity of the ethyl acetate fraction from Arctium lappa L. leaf on α-MSH–induced B16/F10 melanoma cells[J]. Industrial Crops and Products,2019,138:111581. doi: 10.1016/j.indcrop.2019.111581
[27] 王春宇, 姜民, 侯冠宇, 等. 小柴胡汤对过氧化氢诱导的人皮肤成纤维细胞氧化应激损伤的保护作用[J]. 中国实验诊断学,2018,22(6):1074−1077. [WANG Chunyu, JIANG Min, HOU Guanyu, et al. Protective effect of Xiaochaihu decoction on oxidative stress damage of human skin fibroblasts induced by hydrogen peroxide[J]. Chinese Laboratory Diagnosis,2018,22(6):1074−1077. [28] 黄玲艳. 桂花提取物的抗氧化及延缓衰老作用研究[D]. 扬州: 扬州大学, 2017 WANG Lingyan. The antioxidant and anti-aging effects of Osmanthus fragrans extract[D]. Yangzhou: Yangzhou university, 2017.
[29] WU L C, CHANG L H, CHEN S H, et al. Antioxidant activity and melanogenesis inhibitory effect of the acetonic extract of Osmanthus fragrans: A potential natural and functional food flavor additive[J]. LWT-Food Science and Technology,2009,42(9):1513−1519. doi: 10.1016/j.lwt.2009.04.004
[30] FEI Z, PENG J, ZHAO Y. Varietal classification and antioxidant activity prediction of Osmanthus fragrans Lour. flowers using UPLC–PDA/QTOF–MS and multivariable analysis[J]. Food Chemistry,2017,217:490−497. doi: 10.1016/j.foodchem.2016.08.125
[31] LIAO X, HONG Y, CHEN Z. Identification and quantification of the bioactive components in Osmanthus fragrans roots by HPLC-MS/MS[J]. Journal of Pharmaceutical Analysis,2021,11(3):299−307. doi: 10.1016/j.jpha.2020.06.010
[32] 钟询龙, 王若伦, 段炼, 等. 基于UPLC/Q-TOF-MS技术分析女贞子与墨旱莲配伍协同增效的物质基础[J]. 中国医院药学杂志,2017,37(19):1887−1891. [ZHONG Xunlong, WANG Ruolun, DUAN Lian, et al. Based on UPLC/Q-TOF-MS technology to analyze the material basis of the synergy of the compatibility of Ligustrum lucidum and Eclipta prostrata[J]. Chinese Journal of Hospital Pharmacy,2017,37(19):1887−1891. [33] 夏玉英, 陈铃, 刘方乐, 等. LC-MS/MS法测定脑透析液中3种苯乙醇苷类成分的浓度及其体内外探针回收率考察[J]. 天然产物研究与开发,2017,29(11):1841−1845. [XIA Yuying, CHEN Ling, LIU Fangle, et al. Determination of the concentration of three phenethyl alcohol glycosides in cerebral dialysis fluid by LC-MS/MS and investigation of the probe recovery rate in vivo and in vitro[J]. Research and Development of Natural Products,2017,29(11):1841−1845. [34] 尹伟, 宋祖荣, 刘金旗, 等. 桂花的化学成分研究[J]. 中国中药杂志,2015,40(4):679−685. [YI Wei, SONG Zurong, LIU Jinqi, et al. Study on the chemical constituents of Osmanthus fragrans[J]. Chinese Journal of Traditional Chinese Medicine,2015,40(4):679−685. [35] 吴超然, 房仙颖, 萧伟. 桂花非挥发性成分及药理活性研究进展[J]. 天然产物研究与开发,2017,29(8):1439−1448. [WU Chaoran, FANG Xianyin, XIAO Wei. Research progress on non-volatile constituents and pharmacological activities of Osmanthus fragrans[J]. Natural Product Research and Development,2017,29(8):1439−1448. [36] 林秀莲, 宋粉云, 潘玄玄, 等. UPLC-Q-TOF-MS分析补肾强身片中化学成分[J]. 中国实验方剂学杂志,2018,24(19):61−67. [LIN Xiulian, SONG Fenyun, PAN Xuanxuan, et al. Chemical constituents in the kidney tonifying and body strengthening tablets[J]. Chinese Journal of Experimental Formulas,2018,24(19):61−67. [37] CUI Y, WANG Q, SHI X, et al. Simultaneous quantification of 14 bioactive constituents in Forsythia suspensa by liquid chromatography-electrospray ionisation-mass spectrometry[J]. Phytochemical Analysis Pca,2010,21(3):253−260. doi: 10.1002/pca.1194
[38] HAN J, MIN Y, HUI G, et al. Analysis of multiple constituents in a Chinese herbal preparation Shuang-Huang-Lian oral liquid by HPLC-DAD-ESI-MSn[J]. J Pharm Biomed Anal,2007,44(2):430−438. doi: 10.1016/j.jpba.2007.02.023
[39] 常冰. 不同桂花品种GC/MS和HPLC指纹图谱分析[D]. 开封: 河南大学, 2019 CHANG Bing. GC/MS and HPLC fingerprint analysis of different Osmanthus fragrans varieties[D]. Kaifeng: Henan University, 2019.
[40] 宋晓芳. 桂花中多酚类成分分析和过氧化麦角甾醇抗肿瘤活性研究[D]. 咸宁: 湖北科技学院, 2019 SONG Xiaofang. Analysis of polyphenols in Osmanthus fragrans and study on anti-tumor activity of ergosterol peroxide[D]. Xianning: Hubei University of Science and Technology, 2019.
[41] 吴金凤, 尹权微, 潘有智, 等. UPLC-Q-TOF-MS/MS快速分析苁蓉总苷胶囊化学成分[J]. 中国中药杂志,2016,41(17):3244−3251. [WU Jingfeng, YI Quanwei, PAN Youzhi, et al. UPLC-Q-TOF-MS/MS quick analysis of chemical components of cistanche glycoside capsules[J]. Chinese Journal of Traditional Chinese Medicine,2016,41(17):3244−3251. [42] 梁世瓢, 刘飞, 杜飞飞, 等. LC-MS/MS法测定血浆中山奈酚-3-O-芸香糖苷浓度及其在大鼠药动学研究中的应用[J]. 中国临床药理学与治疗学,2006,11(5):491−496. [LIANG Shipiao, LIU Fei, DU Feifei, et al. LC-MS/MS method for determination of kaempferol-3-O-rutinoside in plasma and its application in rat pharmacokinetics[J]. Chinese Clinical Pharmacology and Therapeutics,2006,11(5):491−496. [43] 赵明慧, 姜子涛, 刘韬, 等. 平榛叶中黄酮类化合物成分的研究[J]. 现代食品科技,2014,30(12):235−240. [ZHAO Minghui, JIANG Zitao, LIU Tao, et al. Study on the flavonoids in the leaves of Corylus heterophylla Fisch [J]. Modern Food Technology,2014,30(12):235−240. [44] 元新霞, 桂花花期及采后储藏过程中连翘脂素含量变化规律研究[D]. 武汉: 华中科技大学, 2013 YUAN Xinxia, Study on the change of forsythiaside content in Osmanthus fragrans during flowering and postharvest storage[D]. Wuhan: Huazhong University of Science and Technology, 2013.
[45] 代纯, 靳熙茜, 汪海波, 等. 桂花乙醇萃取物的抗氧化活性及主成分结构的鉴定[J]. 武汉轻工大学学报,2019,38(1):9−16. [DAI Chun, JIN Xiqian, WANG Haibo, et al. Antioxidant activity of ethanol extract of Osmanthus fragrans and identification of main component structure[J]. Journal of Wuhan University of Light Industry,2019,38(1):9−16. [46] 刘东茹, 任亚梅, 伯继芳, 等. 根皮苷及苹果幼果多酚对酪氨酸酶活性的抑制作用[J]. 现代食品科技,2019,35(8):113−119. [LIU Dongru, REN Yamei, BO Jifang, et al. Inhibition of phlorizin and polyphenols from green apple on tyrosinase activity[J]. Modern Food Technology,2019,35(8):113−119. [47] 史莎莎, 阎胜利, 张方华. 维生素E对H2O2诱导的人甲状腺细胞凋亡的保护作用[J]. 免疫学杂志,2011,27(6):45−52. [SHI Shasha, YAN Shengli, ZHANG Fanghua. The protective effect of vitamin E on the apoptosis of human thyroid cells induced by H2O2[J]. Journal of Immunology,2011,27(6):45−52. [48] 金明, 王玉娇, 金梅花, 等. 两种细胞建立肝细胞氧化损伤模型比较[J]. 中国公共卫生,2015,31(3):324−326. [JIN ming, WANG yujiao, JIN meihua, et al. Comparison of two kinds of cells to establish hepatocyte oxidative damage model[J]. Chinese Public Health,2015,31(3):324−326. [49] 刘雷山. 两种皮肤细胞对过氧化氢的不同反应及CD147在氧化应激所致人皮肤成纤维细胞衰老中的机制研究[D]. 长沙: 中南大学, 2012 LIU Leishan. Study on the different reactions of two kinds of skin cells to hydrogen peroxide and the mechanism of CD147 in the senescence of human skin fibroblasts induced by oxidative stress[D]. Changsha: Zhongnan University, 2012.
[50] WANG Z. Osmanthus fragrans flower aqueous extract and its enriched acteoside inhibit melanogenesis and ultraviolet-induced pigmentation[J]. Natural Product Communications,2018,13(5):575−580.
-
期刊类型引用(6)
1. 杨琳,江蓉倩,张杭颖,李树玉,武马璐,张君诚. 五指毛桃水提液制备泡腾片工艺优化. 食品工业科技. 2024(08): 200-207 .  本站查看
本站查看
2. 王江,马彩珍,李甜,霍彦雄,张亮亮,吴子健,徐建国. 野生接骨木果含片的制备及其抗氧化、抗运动疲劳作用研究. 保鲜与加工. 2024(05): 69-76 .  百度学术
百度学术
3. 许甜,吴萌,葛世辉,陈君,李赛,王智森. 沙棘果、叶的研究进展. 今日药学. 2024(06): 466-472 .  百度学术
百度学术
4. 冯思思,张喜瑞,于梦言,徐玉孟,李梓诺,李嘉慧,孙万萌,王璐,梁彬,孙婵婵. 黑蒜泡腾片的制备工艺优化及其对肠道微生态的影响. 食品与发酵工业. 2024(19): 49-55+86 .  百度学术
百度学术
5. 王媛媛,冯勇荣,孙青占,吕兆林. 不同产地沙棘叶茶品质分析及综合评价. 食品与发酵工业. 2024(24): 331-338 .  百度学术
百度学术
6. 王菲,沈卉芳,王瑶,沈鑫婷,郑先哲,姚鑫淼. 葡萄籽原花青素泡腾片的制备工艺优化及品质分析. 食品工业. 2024(12): 48-53 .  百度学术
百度学术
其他类型引用(3)





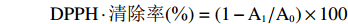
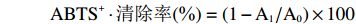
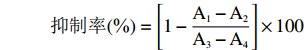

 下载:
下载:

 下载:
下载:



