Determination of Amylose and Amylopectin Contents in Yam and Taros by Dual-Wavelength Spectrophotometry
-
摘要: 目的:建立薯芋类农产品中直链淀粉和支链淀粉的双波长测定法,为品种选育、品质分级、加工应用和标准制定等提供基础数据。方法:研究了直链淀粉和支链淀粉的吸收光谱图,确定二者的最大吸收波长及参比波长。优化了分散剂、乙酸加入量等显色条件及测定条件。结果:直链淀粉标准曲线方程为:y=0.0259x−0.0051,R2=0.9994,线性范围0~33 μg/mL;支链淀粉标准曲线方程为:y=0.0031x+0.0167,R2=0.9965,线性范围0~111 μg/mL。直链淀粉的检出限为0.093 μg/mL,定量限0.28 μg/mL;支链淀粉的检出限为0.079 μg/mL,定量限0.24 μg/mL,直链淀粉回收率为90.0%~100.0%;支链淀粉回收率为88.0%~108.0%。结论:双波长法简单易行,结果准确可靠,适用于薯芋类农产品中直链淀粉和支链淀粉的分析检测。Abstract: Objective: The paper aims to establish a dual-wavelength spectrophotometry method for the determination of the content of amylose and amylopectin in yam and taros, and to provide basic data for variety selection, quality grading, product processing and standard formulation. Method: The spectrum of amylose and amylopectin were studied and the maximum absorption wavelength and reference wavelength were determined. The color conditions such as dispersant and acetic acid and measuring conditions were optimized. The absorbance values of the color complexes were determined. Result: The standard curve equation of amylose was y=0.0259x−0.0051, R2=0.9994, with the linear range of 0~33 μg/mL. The standard curve equation of amylopectin was y=0.0031x+0.0167, R2=0.9965, with the linear range of 0~111 μg/mL. The limits of detection and quantification of amylose were 0.093 μg/mL and 0.28 μg/mL respectively. The limits of detection and quantification of amylopectin were 0.079 μg/mL and 0.24 μg/mL, respectively. The recovery of amylose was 90.0%~100.0%. The recoveries of amylopectin were 88.0%~108.0%. Conclusion: The dual-wavelength spectrophotometry method was simple and feasible, accurate and reliable. It was suitable for the determination of amylose and amylopectin in yam and taros.
-
Keywords:
- dual-wavelength spectrophotometry /
- yam and taros /
- amylose /
- amylopectin
-
薯芋类是一类以植物的根茎作为食用或者加工部分的农产品,包括甘薯、木薯、山药、马铃薯、芋头等[1],其食用部分含有大量的淀粉[2]。淀粉由α-1,4-糖苷键和α-1,6-糖苷键连接的D-吡喃葡萄糖单元构成[3],包括直链淀粉和支链淀粉两种组成部分[4]。传统的直链淀粉检测方法是利用淀粉与碘能形成碘-淀粉显色复合物,利用其吸光值与直链淀粉含量成正比的原理,通过单波长法[5-7]测定显色复合物吸光值得到直链淀粉的含量。现行标准《GB 7648-1987 水稻、玉米、谷子籽粒直链淀粉测定法》[8]、《GB/T 15683-2008大米直链淀粉含量的测定》[9]、《NY/T 2639-2014稻米直链淀粉的测定 分光光度法》[10]中,均利用单波长法测定直链淀粉的含量。由于支链淀粉也能与碘结合形成显色复合物,单波长法测定直链淀粉含量会受到支链淀粉的影响而引起测定误差[11]。双波长法可以消除这种误差,提高了测定的准确度和灵敏度[12]。
直链淀粉和支链淀粉的比例和结构决定了淀粉的粘性[13]、弹性、膨胀能力、消化率[14]、糊化[15]和老化[16]等功能特性,是农产品的重要营养指标和品质指标[17],影响着产品的食味品质[18-19]、加工应用[20-22]和农业选种等。不同品种农产品中的直链淀粉及支链淀粉含量存在较大差异[23],可以作为品质和品种鉴定、选育良种的依据[24]。长期以来,由于没有制定薯芋类直链淀粉和支链淀粉含量的检测标准,限制了相关检测机构和企业的发展,不利于粮食质量安全检验监测体系的建设和完善。因此建立薯芋类农产品中直链淀粉和支链淀粉含量的测定方法很有意义。目前双波长法已经在谷类[25-26]、豆类[12]中得到应用,而系统地测定薯芋类农产品中两种淀粉含量的方法还鲜见报道。
本文对薯芋类中直链淀粉和支链淀粉含量的测定方法进行研究,通过直链淀粉和支链淀粉的吸收光谱图确定最大吸收波长及参比波长,并优化了显色条件和测定条件。以期建立一种双波长快速测定薯芋类农产品中直链淀粉和支链淀粉的方法,为薯芋类农产品品种选育、品质分级、产品加工和标准制定等提供一定的基础数据。
1. 材料与方法
1.1 材料与仪器
甘薯、木薯、山药、马铃薯、芋头 购于菜市场和超市;标准直链淀粉 美国Sigma-Aldrich公司;标准支链淀粉 上海源叶生物科技有限公司。无水乙醇 广东光华科技股份有限公司;盐酸 国药集团化学试剂有限公司;氢氧化钾 天津市光复科技发展有限公司;氢氧化钠、石油醚、碘 广东光华科技股份有限公司;碘化钾 上海申博化工有限公司;所用试剂 均为分析纯;超纯水 自制。
GR-202分析天平 日本A&D有限公司;HH-8 数显恒温水浴锅 金坛市精达仪器制造有限公司;UV-2601 双光束紫外/可见分光光度计 北京北分瑞利分析仪器(集团)有限责任公司;CAHT-50L超纯水器 北京中科智恒科技有限公司;S400-K 多参数测试仪 梅特勒-托利多仪器(上海)有限公司;DHG-9246A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;PM400落地式行星式球磨仪 德国莱驰(Retsch)。
1.2 实验方法
1.2.1 样品溶液制备及标准曲线绘制
1.2.1.1 标准溶液配制
分别称取100 mg标准直链淀粉和标准支链淀粉(含量100%,未达到100%需折算)于50 mL烧杯中,加入1 mL无水乙醇湿润,再加入9 mL 1mol/L KOH溶液轻摇使淀粉分散,沸水浴加热10 min后迅速冷却,用水定容至100 mL,分别配制成1 mg/mL的直链标准溶液和1 mg/mL的支链淀粉标准溶液。吸取直链淀粉标准溶液6 mL,支链淀粉标准溶液24 mL,混合成1:4的混合标准溶液。
1.2.1.2 试样制备
甘薯、木薯、山药、马铃薯、芋头分别洗净、搽干、去皮、切薄片(1 mm),90 ºC杀青30 min[27],60 ºC烘干,用球磨仪220转粉碎至全部过100目筛制成样品,烘干至恒重,储存于干燥器中。
1.2.1.3 样品溶液制备
称取100 mg样品于50 mL烧杯中,加入1 mL无水乙醇湿润样品,再加入9 mL 1 mol/L的KOH溶液,烧杯口封膜,沸水浴加热10 min后迅速冷却至室温,加水定容至100 mL,制成分散液。脱脂[10]:量取30 mL分散液于50 mL具塞刻度试管中,加入10 mL石油醚,间歇摇动10 min,静置15 min,分层后用滴管吸走上部石油醚层,重复操作3次得到样品脱脂溶液。同法平行操作3份。不加样品其他操作相同制备样品空白溶液。
1.2.1.4 标准曲线绘制
为了减少误差,使用混合标准溶液用于制作标准曲线[28]。
分别吸取混合标准溶液0、0.1、0.2、0.3、0.4、0.5、1.0、2.0、4.0、8.0 mL,置于50 mL容量瓶中,分别加入0.09 moL/L氢氧化钾溶液补足至8.0 mL,再加入1 mol/L乙酸溶液2 mL,碘试剂1 mL,用水定容至50 mL,静置30 min。
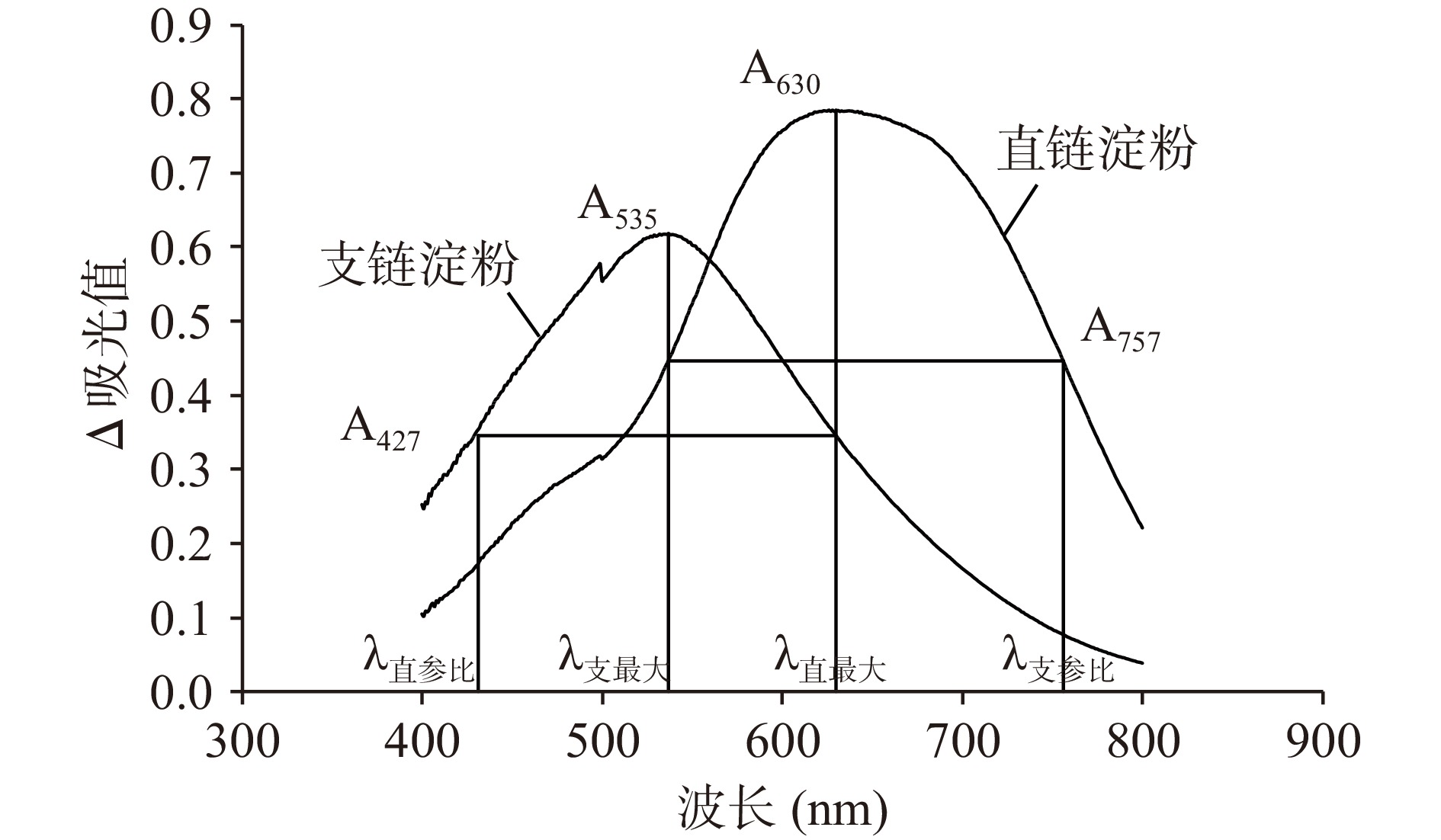
测定:用0 μg/mL标准溶液调零,在波长427 nm(λ直参比)、535 nm(λ支最大)、630 nm(λ直最大)、757 nm(λ支参比)处测定混合标准溶液的吸光值,分别记为A427、A535、A630、A757,即得ΔA直=A630−A427、ΔA支=A535−A757。
绘制:分别以ΔA直和ΔA支为纵坐标,直链淀粉和支链淀粉标准溶液浓度(μg/mL)为横坐标,分别绘制双波长直链淀粉、支链淀粉标准曲线,并计算出回归方程。
1.2.2 方法学验证
1.2.2.1 检出限、定量限
测定10份样品空白显色后在4个特征波长下的吸光值,通过公式计算得出检出限和定量限。
计算公式:
检出限=3.3σS 定量限=10σS 式中:σ表示10份样品空白显色液吸光值的标准偏差;S表示直链、支链淀粉标准曲线的斜率。
1.2.2.2 回收率试验
在甘薯、木薯、山药、马铃薯、芋头样品中分别添加不同量的标准直链淀粉和标准支链淀粉,按样品测定方法进行分析,通过公式计算得出回收率。
计算公式:
回收率(%)=添加后直链淀粉或支链淀粉含量−添加前直链淀粉或支链淀粉含量添加标准直链淀粉或支链淀粉质量×100 1.2.3 样品测定
分别吸取样品空白溶液、样品溶液2 mL于50 mL容量瓶中,加入6 mL 0.09 moL/L KOH溶液,2 mL 1 mol/L乙酸溶液,1 mL碘试剂,用水定容,室温下放置30 min。分光光度计用样品空白溶液调零,此后步骤同1.2.1.4中的测定。将ΔA直和ΔA支分别代入直链淀粉、支链淀粉标准曲线回归方程中,得出样品溶液直链淀粉、支链淀粉浓度。
计算公式:
A(%)=C×V1×V2V3×m×1000000×100 式中:A表示直链淀粉或支链淀粉含量,%;C表示根据吸光值计算出直链淀粉或支链淀粉浓度,μg/mL;V1表示样品分散时定容体积,mL;V2表示样品显色测定时定容体积,mL;V3表示显色时吸取样品脱脂溶液的体积,mL;m表示样品质量,g;1000000表示换算系数。
1.3 数据处理
使用SPSS 22.0及Excel 2007软件进行数据处理。
2. 结果与分析
2.1 分散剂的优化
样品加入分散剂后在沸水浴加热溶解,淀粉颗粒吸水溶胀,随着氢键被打断,直链淀粉和支链淀粉分散开来[29]。对常用的分散剂NaOH溶液和KOH溶液进行了筛选试验。分别称取0.1 g直链淀粉标准品、0.1 g直链淀粉标准品、0.1 g支链淀粉标准品、0.1 g支链淀粉标准品于4个50 mL烧杯中,各加入1 mL无水乙醇湿润。再分别加入KOH溶液(1 mol/L)、NaOH溶液(1 mol/L)、KOH溶液(1 mol/L)、NaOH溶液(1 mol/L)各9 mL于烧杯中作为淀粉分散剂,沸水浴加热10 min后迅速冷却,定容至100 mL。观察淀粉分散性。由图1可知,直链淀粉在KOH溶液中分散均匀,溶液澄清;在NaOH溶液中很难分散,浑浊成块。这可能是因为淀粉颗粒的溶胀不充分引起的。不澄清的分散液与碘试剂显色后会形成悬浮物,对检测结果的准确度和稳定性造成影响。KOH溶液对淀粉颗粒的分散效果更好,因此,确定KOH溶液为分散剂。
2.2 乙酸加入量的优化
淀粉与碘试剂形成显色复合物的最佳pH条件在3.00~5.00左右[30]。因为分散剂是碱性,一般的方法中,标准曲线和样品溶液显色前通常需要pH计调节至合适的范围[28]。本实验省略了pH计调节步骤,优化了方法。通过确定乙酸的加入量,使显色液的pH落在合适的范围,大大提高了效率和可操作性,更适合大批量样品的检测。观察不同加入量(1、2、3 mL)的乙酸(1 mol/L)对显色液(定容体积50 mL)pH的影响,由表1可知,淀粉标准溶液体积在2~10 mL之间,乙酸(1 mol/L)加入量2 mL时,显色液pH在3.56~4.38之间。因此选择乙酸(1 mol/L)的加入量为2 mL。
表 1 加入不同体积乙酸显色液pH变化Table 1. pH value of color complexes with different adding volumes of acetic acid吸取标准溶液体积
(mL)加入1 mol/L乙酸体积
(mL)显色液 pH 2 1 3.90 2 2 3.56 2 3 3.41 4 1 4.27 4 2 4.01 4 3 3.72 6 1 4.52 6 2 4.09 6 3 3.78 8 1 4.69 8 2 4.21 8 3 3.98 10 1 5.20 10 2 4.38 10 3 4.26 2.3 最大吸收波长及参比波长的确定
配制30 μg/mL直链淀粉标准溶液,160 μg/mL支链淀粉标准溶液,用紫外/可见分光光度计进行扫描,得到直链淀粉与支链淀粉光谱扫描曲线(图2),确定二者最大吸收波长,并通过等吸收点作图法[31]确定参比波长。由图2可知,直链淀粉测定波长为:最大吸收波长630 nm(λ直最大)、参比波长427 nm(λ直参比);支链淀粉测定波长为:最大吸收波长535 nm(λ支最大)、参比波长757 nm(λ支参比)。结果中直链淀粉最大吸收波长与夏慧玲[32]提纯后红薯直链淀粉碘复合物的最大吸收波长一致,并符合石海信等[33]研究自制木薯直链、支链淀粉最大吸收波长范围,也与崔晋等[34]报道的结果相似。
2.4 双波长标准曲线的绘制
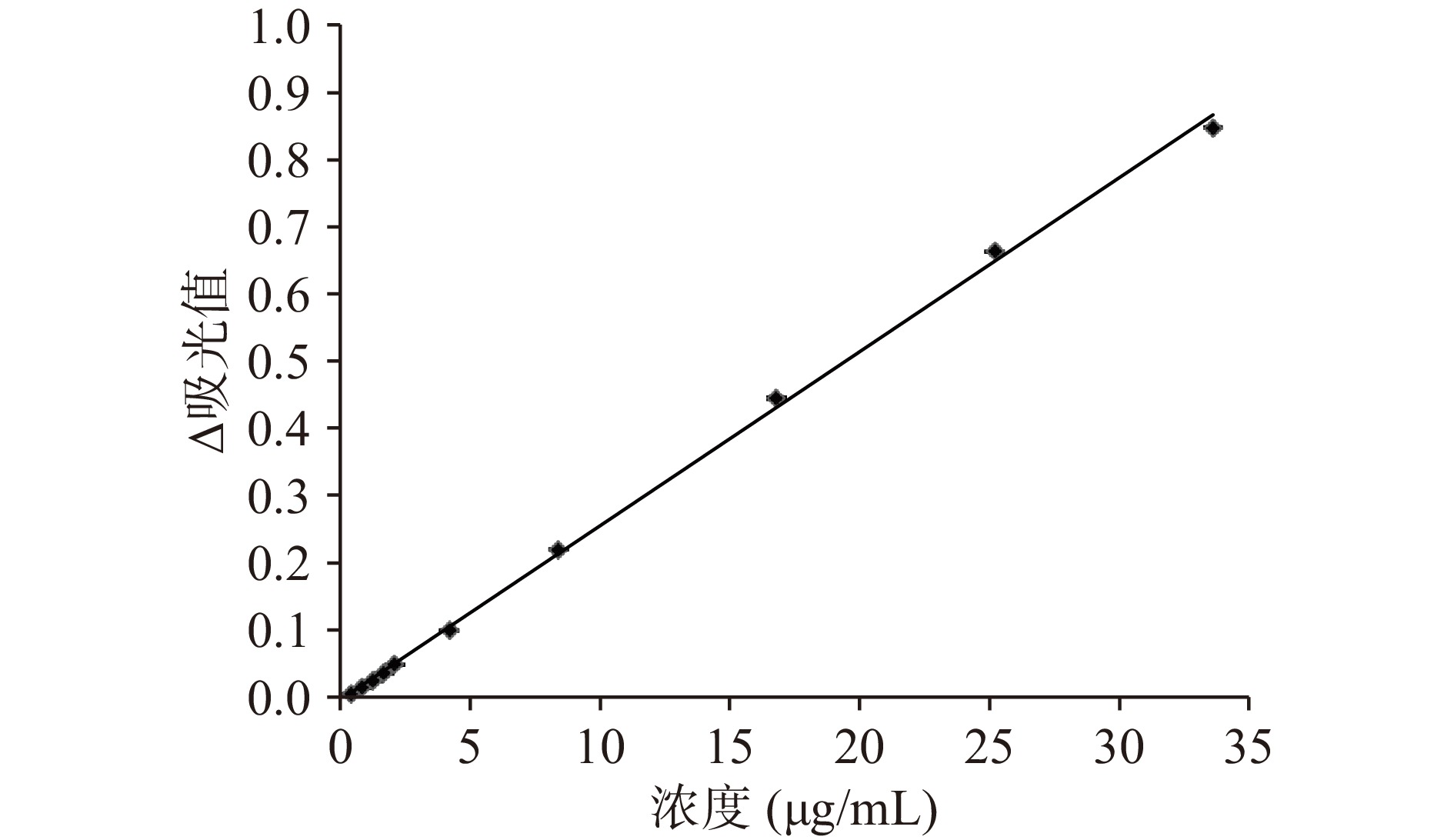
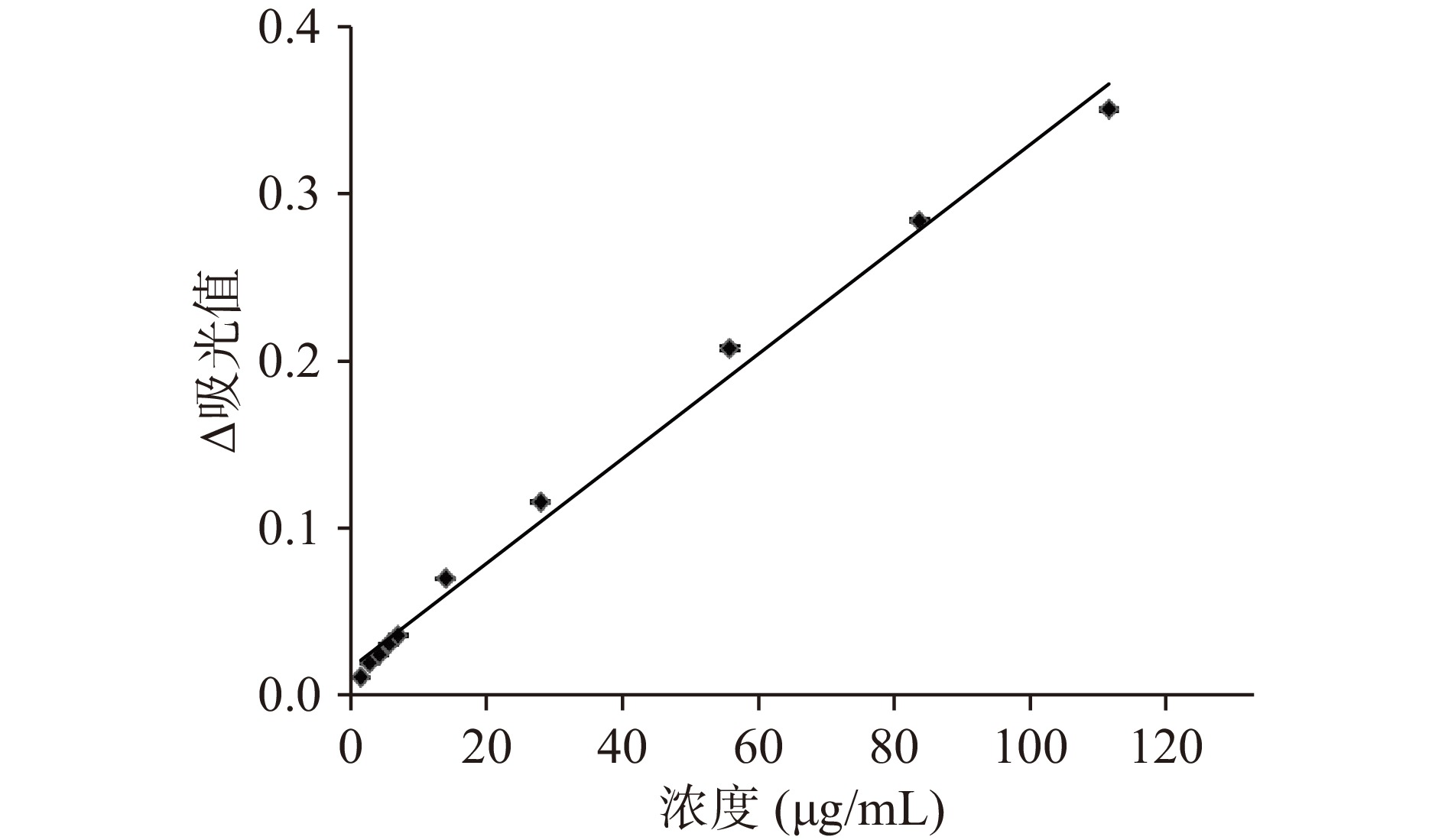
双波长直链淀粉和支链淀粉标准曲线见图3和图4。直链淀粉标准曲线方程为:y=0.0259x−0.0051,R2=0.9994,线性范围0~33 μg/mL;支链淀粉标准曲线方程为:y=0.0031x+0.0167,R2=0.9965,线性范围0~111 μg/mL。
2.5 稳定性试验
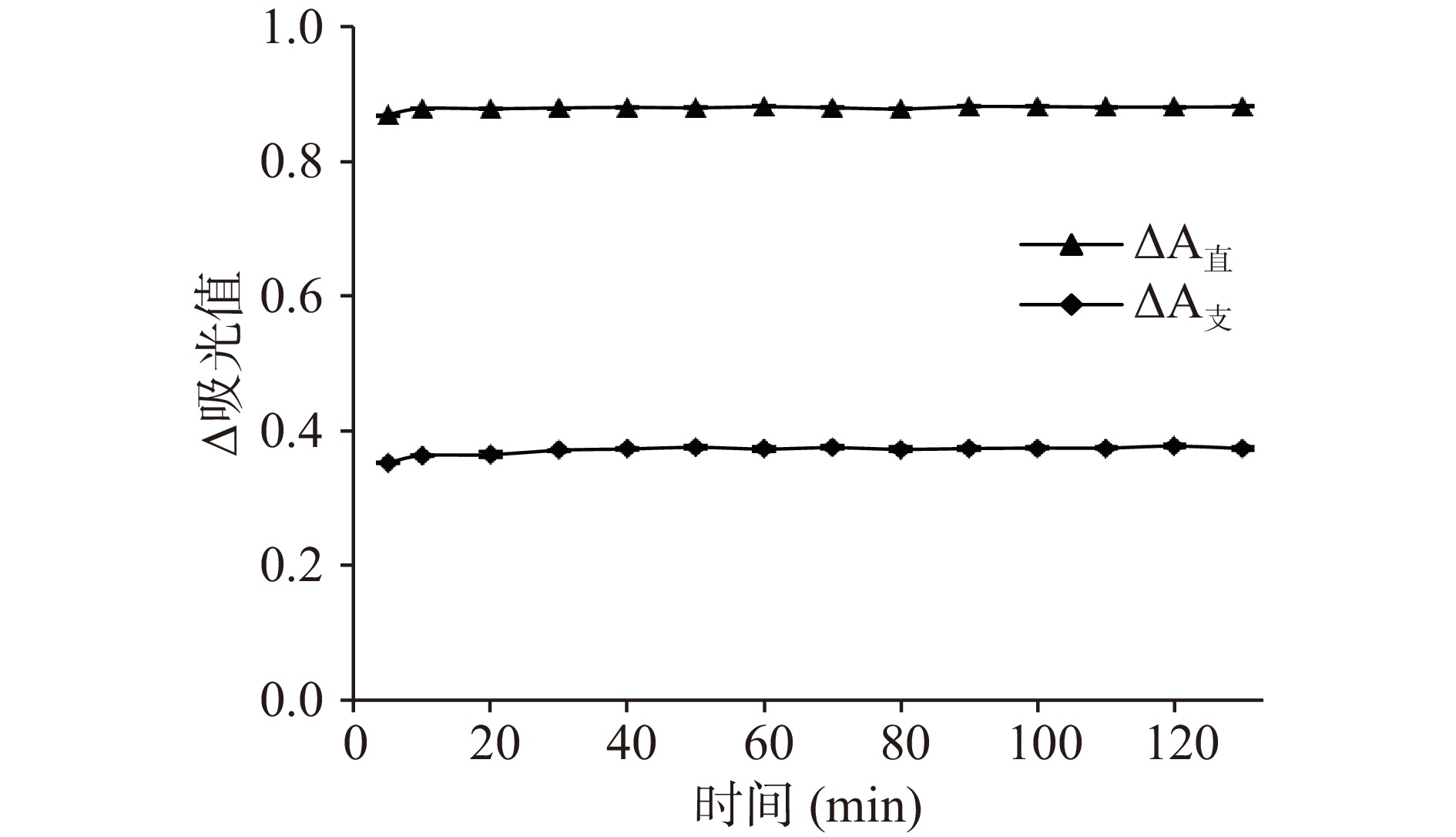
配制40 μg/mL直链淀粉显色液、120 μg/mL支链淀粉显色液及试剂空白溶液。以试剂空白溶液调零,每隔10 min测定一次直链淀粉显色液(427 nm,630 nm)和支链淀粉显色液(530 nm,757 nm)的吸光值,分别计算ΔA直和ΔA支。由图5可知,30~130 min内ΔA直和ΔA支基本稳定,选择静置时间为30 min。这个时间与加列西·马那甫[12]报道的淀粉显色液稳定时间一致。
2.6 检出限和定量限
测定10份样品空白显色后在4个特征波长下的吸光值,求出ΔA直和ΔA支的标准偏差分别为0.0007和0.0001,根据公式得到直链淀粉的检出限为0.093 μg/mL,定量限0.28 μg/mL;支链淀粉的检出限为0.079 μg/mL,定量限0.24 μg/mL,说明本方法的可检测范围较大。
2.7 精密度和重复性
选取3份不同的薯芋类样品进行测定,每个样品称取3个平行样,选择两家检验机构按本方法进行比对试验,测定结果见表2,实验室A样品相对标准偏差在0.00~1.84%之间;实验室B样品相对标准偏差在0.23%~2.16%之间,方法的精密度较高,重复性较好。两个实验室间样品相对误差在0.25%~4.08%,低于5%,说明本方法具有重复性,适合推广使用。
表 2 两个实验室样品测定结果Table 2. Sample determintion results of two laboratory编号 实验室A直链
淀粉含量(%)实验室A支链
淀粉含量(%)实验室A
总淀粉含量(%)实验室B
直链淀粉含量(%)实验室B
支链淀粉含量(%)实验室B
总淀粉含量(%)实验室间
直链淀粉对比
相对误差(%)实验室间
支链淀粉对比
相对误差(%)实验室间
总淀粉对比
相对误差(%)样品1 4.38 44.56 48.94 4.22 43.58 53.23 2.08 0.48 0.25 样品1 4.38 43.17 47.55 4.42 43.05 47.55 样品1 4.38 43.17 47.55 4.24 44.89 47.55 平均值 4.38 43.63 48.01 4.29 43.84 48.13 RSD 0.00 1.84 1.67 0.23 2.16 1.83 样品2 15.44 60.52 75.96 15.46 60.41 75.87 4.08 0.27 0.61 样品2 15.94 59.83 75.77 14.86 60.82 75.68 样品2 15.94 59.83 75.77 15.10 59.42 74.55 平均值 15.77 60.06 75.83 15.14 60.22 75.36 RSD 1.83 0.66 0.14 1.99 1.20 0.97 样品3 20.13 72.32 92.45 19.38 75.79 95.17 3.08 4.00 2.51 样品3 20.03 72.32 92.35 19.72 76.72 96.44 样品3 20.23 73.01 93.24 19.47 74.03 93.5 平均值 20.13 72.55 92.68 19.52 75.51 95.04 RSD 0.50 0.55 0.53 0.90 1.81 1.55 2.8 样品回收率
由表3和表4可知,直链淀粉回收率为90.0%~100.0%,支链淀粉回收率为88.0%~108.0%,说明方法具有较高的准确度。
表 3 直链淀粉添加回收率Table 3. Recoveries of amylose样品 添加前
直链淀粉含量(mg)添加后
直链淀粉含量(mg)添加标准
直链淀粉质量(mg)直链淀粉
回收率(%)甘薯 0.11 0.35 0.25 96.0 甘薯 0.12 0.57 0.50 90.0 甘薯 0.11 0.79 0.75 90.7 木薯 0.39 0.63 0.25 96.0 木薯 0.38 0.83 0.50 90.0 木薯 0.38 1.08 0.75 93.3 山药 0.50 0.73 0.25 92.0 山药 0.51 0.96 0.50 90.0 山药 0.50 1.19 0.75 92.0 马铃薯 0.57 0.81 0.25 96.0 马铃薯 0.59 1.04 0.50 90.0 马铃薯 0.58 1.27 0.75 92.0 芋头 0.17 0.42 0.25 100.0 芋头 0.17 0.64 0.50 94.0 芋头 0.17 0.86 0.75 92.0 表 4 支链淀粉添加回收率Table 4. Recoveries of amylopectin样品 添加前
支链淀粉含量(mg)添加后
支链淀粉含量(mg)添加标准
支链淀粉质量(mg)支链淀粉
回收率(%)甘薯 1.15 1.67 0.50 104.0 甘薯 1.14 2.16 1.00 102.0 甘薯 1.19 3.26 2.00 103.5 木薯 1.54 2.00 0.50 92.0 木薯 1.54 2.47 1.00 93.0 木薯 1.51 3.67 2.00 108.0 山药 2.20 2.66 0.50 92.0 山药 2.19 3.07 1.00 88.0 山药 2.19 4.18 2.00 99.5 马铃薯 2.24 2.71 0.50 94.0 马铃薯 2.28 3.31 1.00 103.0 马铃薯 2.21 4.05 2.00 92.0 芋头 2.13 2.62 0.50 98.0 芋头 2.16 3.23 1.00 107.0 芋头 2.16 4.29 2.00 106.5 2.9 样品测定结果
测定甘薯、木薯、山药、马铃薯、芋头样品中两种淀粉的含量,结果如表5所示。木薯直链淀粉含量15.14%±0.30%,与郭运玲等[35]研究的不同株系木薯直链淀粉含量变化范围14.88%~21.91%的结果相符。山药直链淀粉含量16.68%±0.16%,支链淀粉含量74.22%±0.38%,总淀粉含量90.91%±0.30%,这结果与崔晋等[34]报道的山药直链淀粉含量在15.2%~27.3%之间,支链淀粉含量在43.8%~77.72%之间,总淀粉含量在67.7%~93.09%之间的结果相符。马铃薯直链淀粉含量19.52%±0.18%,与宋玉浩等[30]研究的不同品种马铃薯直链淀粉含量范围17.4%~33.3%的结果相符。样品结果相对标准偏差在0.23%~2.39%之间,均小于3%。本方法适合薯芋类样品的测定。
表 5 不同薯芋类农产品中直链淀粉、支链淀粉、总淀粉含量的差异Table 5. Amylose, amylopectin and total starch contents in different yam and taros样品 直链淀粉
(%)支链淀粉
(%)总淀粉
(%)支链淀粉/直链淀粉 甘薯 4.29±0.11e 43.84±0.95e 48.13±0.88e 10.22±0.43b 木薯 15.14±0.30c 60.22±0.72d 75.36±0.73d 3.98±0.10d 山药 16.68±0.16b 74.22±0.38c 90.91±0.30b 4.45±0.06c 马铃薯 19.52±0.18a 75.51±1.37b 95.04±1.47a 3.87±0.06e 芋头 6.68±0.16d 82.47±0.56a 89.15±0.71c 12.35±0.22a 注:同列数据不同字母表示具有显著性差异(P<0.05)。 3. 结论
对标准直链淀粉和标准支链淀粉进行特征光谱扫描,通过作图法确定直链淀粉最大吸收波长为630 nm;支链淀粉最大吸收波长为535 nm。直链淀粉浓度在0~33 μg/mL范围内有良好的线性关系,R2=0.9994。支链淀粉浓度在0~111 μg/mL范围内有良好的线性关系,R2=0.9965,符合朗伯比尔定律。研究发现KOH溶液比NaOH溶液对淀粉颗粒的分散效果更好,提高了显色液的稳定性。使用KOH溶液为分散剂后,显色液30~130 min内吸光值稳定。优化乙酸的加入量,使显色液的pH落在合适的范围,可以省略pH计调节环节,提高了效率和可操作性,更适合大批量样品的检测。
采用双波长法测定甘薯、木薯、山药、马铃薯、芋头等薯芋类农产品中直链淀粉和支链淀粉的含量,直链淀粉回收率为90.0%~100.0%,支链淀粉回收率为88.0%~108.0%。直链淀粉的检出限为0.093 μg/mL,定量限0.28 μg/mL;支链淀粉的检出限为0.079 μg/mL,定量限0.24 μg/mL,方法的可检测范围较大。样品结果相对标准偏差在0.23%~2.39%之间,均小于3%,方法重复性好。该方法适用于快速测定不同薯芋类农产品中直链淀粉和支链淀粉的含量,结果准确可靠,适合大批量样品的分析,可以为薯芋类农产品的品种选育、加工应用等提供技术支持。
-
表 1 加入不同体积乙酸显色液pH变化
Table 1 pH value of color complexes with different adding volumes of acetic acid
吸取标准溶液体积
(mL)加入1 mol/L乙酸体积
(mL)显色液 pH 2 1 3.90 2 2 3.56 2 3 3.41 4 1 4.27 4 2 4.01 4 3 3.72 6 1 4.52 6 2 4.09 6 3 3.78 8 1 4.69 8 2 4.21 8 3 3.98 10 1 5.20 10 2 4.38 10 3 4.26 表 2 两个实验室样品测定结果
Table 2 Sample determintion results of two laboratory
编号 实验室A直链
淀粉含量(%)实验室A支链
淀粉含量(%)实验室A
总淀粉含量(%)实验室B
直链淀粉含量(%)实验室B
支链淀粉含量(%)实验室B
总淀粉含量(%)实验室间
直链淀粉对比
相对误差(%)实验室间
支链淀粉对比
相对误差(%)实验室间
总淀粉对比
相对误差(%)样品1 4.38 44.56 48.94 4.22 43.58 53.23 2.08 0.48 0.25 样品1 4.38 43.17 47.55 4.42 43.05 47.55 样品1 4.38 43.17 47.55 4.24 44.89 47.55 平均值 4.38 43.63 48.01 4.29 43.84 48.13 RSD 0.00 1.84 1.67 0.23 2.16 1.83 样品2 15.44 60.52 75.96 15.46 60.41 75.87 4.08 0.27 0.61 样品2 15.94 59.83 75.77 14.86 60.82 75.68 样品2 15.94 59.83 75.77 15.10 59.42 74.55 平均值 15.77 60.06 75.83 15.14 60.22 75.36 RSD 1.83 0.66 0.14 1.99 1.20 0.97 样品3 20.13 72.32 92.45 19.38 75.79 95.17 3.08 4.00 2.51 样品3 20.03 72.32 92.35 19.72 76.72 96.44 样品3 20.23 73.01 93.24 19.47 74.03 93.5 平均值 20.13 72.55 92.68 19.52 75.51 95.04 RSD 0.50 0.55 0.53 0.90 1.81 1.55 表 3 直链淀粉添加回收率
Table 3 Recoveries of amylose
样品 添加前
直链淀粉含量(mg)添加后
直链淀粉含量(mg)添加标准
直链淀粉质量(mg)直链淀粉
回收率(%)甘薯 0.11 0.35 0.25 96.0 甘薯 0.12 0.57 0.50 90.0 甘薯 0.11 0.79 0.75 90.7 木薯 0.39 0.63 0.25 96.0 木薯 0.38 0.83 0.50 90.0 木薯 0.38 1.08 0.75 93.3 山药 0.50 0.73 0.25 92.0 山药 0.51 0.96 0.50 90.0 山药 0.50 1.19 0.75 92.0 马铃薯 0.57 0.81 0.25 96.0 马铃薯 0.59 1.04 0.50 90.0 马铃薯 0.58 1.27 0.75 92.0 芋头 0.17 0.42 0.25 100.0 芋头 0.17 0.64 0.50 94.0 芋头 0.17 0.86 0.75 92.0 表 4 支链淀粉添加回收率
Table 4 Recoveries of amylopectin
样品 添加前
支链淀粉含量(mg)添加后
支链淀粉含量(mg)添加标准
支链淀粉质量(mg)支链淀粉
回收率(%)甘薯 1.15 1.67 0.50 104.0 甘薯 1.14 2.16 1.00 102.0 甘薯 1.19 3.26 2.00 103.5 木薯 1.54 2.00 0.50 92.0 木薯 1.54 2.47 1.00 93.0 木薯 1.51 3.67 2.00 108.0 山药 2.20 2.66 0.50 92.0 山药 2.19 3.07 1.00 88.0 山药 2.19 4.18 2.00 99.5 马铃薯 2.24 2.71 0.50 94.0 马铃薯 2.28 3.31 1.00 103.0 马铃薯 2.21 4.05 2.00 92.0 芋头 2.13 2.62 0.50 98.0 芋头 2.16 3.23 1.00 107.0 芋头 2.16 4.29 2.00 106.5 表 5 不同薯芋类农产品中直链淀粉、支链淀粉、总淀粉含量的差异
Table 5 Amylose, amylopectin and total starch contents in different yam and taros
样品 直链淀粉
(%)支链淀粉
(%)总淀粉
(%)支链淀粉/直链淀粉 甘薯 4.29±0.11e 43.84±0.95e 48.13±0.88e 10.22±0.43b 木薯 15.14±0.30c 60.22±0.72d 75.36±0.73d 3.98±0.10d 山药 16.68±0.16b 74.22±0.38c 90.91±0.30b 4.45±0.06c 马铃薯 19.52±0.18a 75.51±1.37b 95.04±1.47a 3.87±0.06e 芋头 6.68±0.16d 82.47±0.56a 89.15±0.71c 12.35±0.22a 注:同列数据不同字母表示具有显著性差异(P<0.05)。 -
[1] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 34258-2017 农产品购销基本信息描述 薯芋类[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 34258-2017 Basic information description of agricultural products for purchase and sale-yam and taros[S]. Beijing: Standards Press of China, 2017.
[2] 任静. 薯芋及淀粉的傅里叶变换红外光谱研究[D]. 昆明: 云南师范大学, 2015. REN Jing. Study on fourier transform infrared spectroscopy of root-tuber crops and starches[D]. Kunming: Yunnan Normal University, 2015.
[3] 韩文芳, 林亲录, 赵思明, 等. 直链淀粉和支链淀粉分子结构研究进展[J]. 食品科学,2020,41(13):267−275. [HAN Wenfang, LIN Qinlu, ZHAO Siming, et al. Recent advances in molecular structures of amylose and amylopectin[J]. Food Science,2020,41(13):267−275. doi: 10.7506/spkx1002-6630-20190626-330 [4] LINDEBOOM N, CHANG P R, TYLER R T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: A review[J]. Starch/Stärke,2004,56:89−99.
[5] 付颖, 沈轶男, 刘艳春, 等. 不同春谷品种支链淀粉含量与营养品质指标及农艺性状的相关性分析[J]. 作物杂志,2019(2):90−93. [FU Ying, SHEN Yinan, LIU Yanchun, et al. Correlation analysis of amylopectin content, nutritional quality agronomic traits in spring millet varieties[J]. Crops,2019(2):90−93. [6] 吴远琴, 黄娟, 郑兴汶, 等. 23份莲资源直链淀粉和支链淀粉含量测定[J]. 长江蔬菜,2014(6):41−43. [WU Yuanqin, HUANG Juan, ZHENG Xingwen, et al. Determination of amylose and amylopectin contents 23 lotus (Nelumbo nucifera) accessions[J]. Journal of Changjiang Vegetables,2014(6):41−43. doi: 10.3865/j.issn.1001-3547.2014.06.014 [7] 赵文亚. 荸荠淀粉理化性质研究[J]. 农业机械,2011(26):85−87. [ZHAO Wenya. Study on physicochemical properties of water chestnut starch[J]. Farm Machinery,2011(26):85−87. [8] 中华人民共和国农牧渔业部. GB 7648-1987 水稻、玉米、谷子籽粒直链淀粉测定法[S]. 北京: 中国标准出版社, 1987. Ministry of Agriculture, Animal Husbandry and Fisheries of the Peoples Republic of China. GB 7648-1987 Determination of amylase in grains of rice, maize and millet[S]. Beijing: Standards Press of China, 1987.
[9] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 15683-2008 大米 直链淀粉含量的测定[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 15683-2008 Determination of amylose content in rice[S]. Beijing: Standards Press of China, 2009.
[10] 中华人民共和国农业部. NY/T 2639-2014 稻米直链淀粉的测定 分光光度法[S]. 北京: 中国标准出版社, 2014. The Ministry of Agriculture of the People's Republic of China. NY/T 2639-2014 Determination of amylose content in rice-spectrophotometry method[S]. Beijing: Standards Press of China, 2014.
[11] 李莉. 玉米淀粉中直链淀粉含量的分析测定方法研究[D]. 郑州: 河南工业大学, 2018. LI Li. Study on analysis of the amylose content in corn starch[D]. Zhengzhou: Henan University of Tech-nology, 2018.
[12] 加列西·马那甫, 景伟文, 削合来提·再丁. 双波长法测定谷类和豆类作物籽粒中直链和支链淀粉的含量[J]. 新疆农业科学,2010,47(3):564−568. [JIALIEXI M, JING W W, XUELAITI Z. Determination of amylose and amylopectin in grain and bean by dual-wavelength spectrophotometry[J]. Xinjiang Agricultural Sciences,2010,47(3):564−568. doi: 10.6048/j.issn.1001-4330.2010.03.027 [13] ZHU F, CUI R. Comparison of physicochemical properties of oca (Oxalis tuberosa), potato, and maize starches[J]. International Journal of Biological Macromolecules,2020,148:601−607. doi: 10.1016/j.ijbiomac.2020.01.028
[14] WANG S. Starch structure, functionality and application in Foods[M]. Singapore: Springer Nature Singapore Pte Ltd., 2020.
[15] LI C, HU Y, HUANG T, et al. A combined action of amylose and amylopectin fine molecular structures in determining the starch pasting and retrogradation property[J]. International Journal of Biological Macromolecules,2020,164:2717−2725. doi: 10.1016/j.ijbiomac.2020.08.123
[16] 康昱倢, 贾祥泽, 郑少婷, 等. 淀粉颗粒微观结构及结晶调控技术的研究进展[J]. 食品工业科技,2017,38(19):316−322. [KANG Yujie, JIA Xiangze, ZHENG Shaoting, et al. Research pro-gressin starch micro architecture and crystal transformation[J]. Science and Technology of Food Industry,2017,38(19):316−322. [17] LEMOS P, BARBOSA L S, RAMOS I G, et al. Characterization of amylose and amylopectin fractions separated from potato, banana, corn, and cassava starches[J]. International Journal of Biological Macromolecules,2019,132:32−42. doi: 10.1016/j.ijbiomac.2019.03.086
[18] 邹茜, 邵源梅, 黄平, 等. 不同生态型低AC稻米蒸煮和食味品质特性研究[J]. 西南农业学报,2019,32(11):2514−2520. [ZOU Qian, SHAO Yuanmei, HUANG Ping, et al. Eating and cooking qualities in low amylose content rice with different ecotypes[J]. Southwest China Journal of Agricultural Sciences,2019,32(11):2514−2520. [19] LI H, PRAKASH S, NICHOLSON T M, et al. The importance of amylose and amylopectin fine structure for textural properties of cooked rice grains[J]. Food Chemistry,2016,196:702−711. doi: 10.1016/j.foodchem.2015.09.112
[20] 马雨洁, 刘航, 许芳溢, 等. 淀粉组成对荞麦面条食用和烹调品质的影响[J]. 食品工业科技,2012,33(19):49−52. [MA Yujie, LIU Hang, XU Fangyi, et al. Effect of starch composition on the cooking and sensory quality of buckwheat noodles[J]. Science and Technology of Food Industry,2012,33(19):49−52. [21] ZHANG Z, FAN X, YANG X, et al. Effects of amylose and amylopectin fine structure on sugar-snap cookie dough rheology and cookie quality[J]. Carbohydrate Polymers,2020,241(1):116371.
[22] LI Q, SHI S, DONG Y, et al. Characterization of amylose and amylopectin with various moisture contents after frying process: Effect of starch-lipid complex formation[J]. International Journal of Food Science & Technology,2021,56(2):639−647.
[23] TORTOE C, AKONOR P T, KOCH K, et al. Amylose and amylopectin molecular fractions and chain length distribution of amylopectin in 12 varieties of Ghanaian sweet potato (Ipomoea batatas) flours[J]. International Journal of Food Properties,2017,20(12):3225−3233. doi: 10.1080/10942912.2017.1283326
[24] 李静静, 李小安. 不同品种山药直链淀粉、支链淀粉含量测定及分析[J]. 农业工程,2017,7(6):98−99,103. [LI Jingjing, LI Xiaoan. Determination and analysis of amylose and amylopectin content in different varieties of yam[J]. Agricultural Engineering,2017,7(6):98−99,103. doi: 10.3969/j.issn.2095-1795.2017.06.028 [25] 金玉红, 张开利, 张兴春, 等. 双波长法测定小麦及小麦芽中直链、支链淀粉含量[J]. 中国粮油学报, 2009, 24(1): 137-140. JIN Yuhong, ZHANG Kaili, ZHANG Xingchun, et al. Determination of amylose and amylopectin in wheat and wheat malt by dual-wavelength spectrophotometry[J]. Journal of the Chinese Cereals and Oils Association, 2009, 24(1): 137-140. [26] 林美娟, 宋江峰, 李大婧, 等. 用双波长分光光度法测定鲜食玉米中直链淀粉和支链淀粉含量[J]. 江西农业学报,2010,22(12):117−119,123. [LIN Meijuan, SONG Jiangfeng, LI Dajing, et al. Determination of amylose and amylopectin content in freshcorn by dual-wavelength spectrophotometr[J]. Acta Agriculturae Jiangxi,2010,22(12):117−119,123. doi: 10.3969/j.issn.1001-8581.2010.12.036 [27] 鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社, 2008. BAO Shidan. Soil agrochemical analysis (3rd edition)[M]. Beijing: China Agriculture Press, 2008.
[28] 焦梦悦, 高涵, 王伟娜, 等. 四种测定直链淀粉和支链淀粉方法的比较[J]. 食品工业科技,2019,40(12):259−264. [JIAO Mengyue, GAO Han, WANG Weinan, et al. Comparison of four methods for determination of amylose and amylopectin[J]. Science and Technology of Food Industry,2019,40(12):259−264. [29] 曾凡逵, 赵鑫, 周添红, 等. 双波长比色法测定马铃薯直链/支链淀粉含量[J]. 现代食品科技,2012,28(1):119−122. [ZENG Fankui, ZHAO Xin, ZHOU Tianhong, et al. Dual-wavelength colorimetric method for measuring amylose and amylopectin contents of potato starch[J]. Modern Food Science and Technology,2012,28(1):119−122. [30] 宋玉浩, 史伟玲, 张娇, 等. 马铃薯块茎淀粉组分高效检测体系的建立及应用[J]. 园艺学报,2021,48(3):600−608. [SONG Yujie, SHI Weiling, ZHANG Jiao, et al. Development and application of an efficient method for the amylose/amylopectin ratio determination in potato tubers[J]. Acta Horticulturae Sinica,2021,48(3):600−608. [31] 刘雪梅, 宋烨, 闫新焕, 等. 鲜食山药直链淀粉、支链淀粉含量测定及品种差异比较[J]. 食品科技,2017,42(7):290−293. [LIU Xuemei, SONG Ye, YAN Xinhuan, et al. Determination of amylose and amylopectin content in fresh yam and comparison of varieties[J]. Food Science and Technology,2017,42(7):290−293. [32] 夏慧玲, 王水兴, 潘阳. 红薯直链淀粉的分离纯化和检测[J]. 食品研究与开发,2006,27(11):47−49. [XIA Huiling, WANG Shuixing, PAN Yang. The separation and purification of amylose from sweet potato starch[J]. Food Research and Development,2006,27(11):47−49. doi: 10.3969/j.issn.1005-6521.2006.11.015 [33] 石海信, 郝媛媛, 方怀义, 等. 双波长法测定木薯淀粉中直链和支链淀粉的含量[J]. 食品科学,2011,32(21):123−127. [SHI Haixin, HAO Yuanyuan, FANG Huaiyi, et al. Separation and purification of amylose and amylopectin from cassava starch and content determination by dual-wavelength spectrophotometry[J]. Food Science,2011,32(21):123−127. [34] 崔晋, 李建军, 马艳弘, 等. 双波长法测定山药中直链和支链淀粉含量[J]. 食品研究与开发,2017,38(13):150−154. [CUI Jin, LI Jianjun, MA Yanhong, et al. Dual-wavelength spectrophotometry method for measuring amylase and amylopectin contents of yam[J]. Food Research and Development,2017,38(13):150−154. doi: 10.3969/j.issn.1005-6521.2017.13.031 [35] 郭运玲, 孔华, 左娇, 等. 双波长法测定木薯的直链和支链淀粉含量[J]. 热带作物学报,2016,37(6):1213−1217. [GUO Yunling, KONG Hua, ZUO Jiao, et al. Determination of amylose and amylopeetin content in cassava by dual-wavelength method[J]. Chinese Journal of Tropical Crops,2016,37(6):1213−1217. doi: 10.3969/j.issn.1000-2561.2016.06.027 -
期刊类型引用(6)
1. 杨琳,江蓉倩,张杭颖,李树玉,武马璐,张君诚. 五指毛桃水提液制备泡腾片工艺优化. 食品工业科技. 2024(08): 200-207 .  本站查看
本站查看
2. 王江,马彩珍,李甜,霍彦雄,张亮亮,吴子健,徐建国. 野生接骨木果含片的制备及其抗氧化、抗运动疲劳作用研究. 保鲜与加工. 2024(05): 69-76 .  百度学术
百度学术
3. 许甜,吴萌,葛世辉,陈君,李赛,王智森. 沙棘果、叶的研究进展. 今日药学. 2024(06): 466-472 .  百度学术
百度学术
4. 冯思思,张喜瑞,于梦言,徐玉孟,李梓诺,李嘉慧,孙万萌,王璐,梁彬,孙婵婵. 黑蒜泡腾片的制备工艺优化及其对肠道微生态的影响. 食品与发酵工业. 2024(19): 49-55+86 .  百度学术
百度学术
5. 王媛媛,冯勇荣,孙青占,吕兆林. 不同产地沙棘叶茶品质分析及综合评价. 食品与发酵工业. 2024(24): 331-338 .  百度学术
百度学术
6. 王菲,沈卉芳,王瑶,沈鑫婷,郑先哲,姚鑫淼. 葡萄籽原花青素泡腾片的制备工艺优化及品质分析. 食品工业. 2024(12): 48-53 .  百度学术
百度学术
其他类型引用(3)





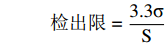


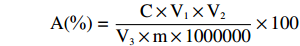

 下载:
下载:
 下载:
下载:



