Study on the Internal and External Antioxidant and Cardio Protective Activities of Fermented Wheat Bran Aqueous Extracts
-
摘要: 为评价发酵麸皮水提物(fermented wheat bran water extract, FWBE)的生物活性,通过测定FWBE的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基和羟基自由基(·OH)清除率、还原力,评估其体外抗氧化活性。通过以2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-azobis-2-methyl-propanimidamide, dihydrochloride, AAPH)诱导建立的斑马鱼体内氧化应激模型,测定其活性氧(reactive oxygen species, ROS)产生率、细胞死亡率及脂质过氧化程度,评价FWBE对斑马鱼体内抗氧化的作用。另以特非那定诱导建立斑马鱼心脏损伤模型,测定不同浓度的FWBE预暴露对特非那定诱导的斑马鱼静脉窦-动脉球间距(SV-BA间距)和心率的影响。体外抗氧化结果表明:FWBE溶液在浓度为4 mg/mL时对DPPH自由基和·OH清除作用可达79.40%及53.99%,还原力为1.11。体内抗氧化结果表明在最优浓度下可以缓解由AAPH诱导的ROS生成率、细胞死亡率和脂质过氧化程度(P<0.05)。FWBE预暴露后可显著缓解特非那定诱导引起的斑马鱼心率降低、SV-BA间距上升(P<0.05),且随着FWBE浓度的升高其缓解作用逐渐增强。综上,FWBE具有较强的体内外抗氧化活性,且具有缓解心脏损伤的作用。Abstract: To evaluate the biological activity of fermented bran, this experiment was conducted to assess the in vitro antioxidant activity of fermented bran aqueous extract by measuring the DPPH radical and hydroxyl radical scavenging activity and reducing power using FWBE raw material. The in vivo antioxidant effect of FWBE on zebrafish was evaluated by establishing an in vivo oxidative stress model induced by AAPH and measuring its ROS production rate, cell mortality and lipid peroxidation. In addition, a zebrafish cardiac injury model was established with terfenadine induction, and the effects of different concentrations of FWBE pre-exposure on the venous sinus-arterial bulb spacing (SV-BA spacing) and heart rate of terfenadine-induced zebrafish were determined to evaluate the protective effects of FWBE on zebrafish heart. In vitro antioxidant results showed that FWBE scavenged up to 79.40% (4 mg/mL) of DPPH radicals; 53.99% (4 mg/mL) of hydroxyl radicals; and 1.11 (4 mg/mL) of reducing power. In vivo antioxidant results showed that the rate of AAPH-induced ROS generation, cell mortality and lipid peroxidation were alleviated at optimal concentrations (P<0.05). FWBE pre-exposure significantly alleviated the terfenadine-induced reduction in heart rate and increase in SV-BA spacing in zebrafish (P<0.05), and its alleviating effect increased gradually with increasing FWBE concentration. In conclusion, FWBE has strong antioxidant activity in vitro and in vivo, and has the effect of alleviating cardiac injury.
-
许多疾病的发生和发展都与体内产生的氧化应激有关[1-3],氧化/抗氧化机制的失衡会导致氧化应激和血管损伤,并最终引发心血管疾病及其并发症[4-6]。心肌梗死是一种冠状动脉疾病,会造成心肌缺氧缺血,导致ROS的产生,而ROS会进一步刺激炎症反应,炎症因子则又促进ROS的形成,造成心肌细胞氧化应激和炎症反应级联放大[7]。ROS通过诱导心肌细胞肥大信号的凋亡和坏死,对心肌钙代谢产生负作用,引起心率失常并促进心肌重塑,并通过肾素-血管紧张素-醛固酮系统和交感神经系统的神经体液激活,加上负荷前后的增加,带给心肌额外的氧化应激[8]。因此,寻找一个既能缓解氧化应激也能保护心脏的有效且安全的物质是必要的。
全麦食品的摄入能有效清除自由基、降低癌症的发病率和预防心血管疾病的发生[9-11]。但是,传统面粉加工产生的小麦麸皮和小麦胚芽被用作低价动物饲料原料,使其附加值和综合利用率下降。研究表明,麦麸中含有许多功能性成分,如咖啡酸、香草酸及阿魏酸等在内的酚酸类化合物、维生素E、多糖类物质和黄酮类化合物等[12],使其具有抗氧化和保护心脏的作用[13-14]。罗昆等[15]的研究证明麸皮在发酵过程中水溶性阿拉伯木聚糖的含量增加了17.88 mg/g;游离酚与阿魏酸的含量分别上升了73%和234%。本课题组的研究同样发现经枯草芽孢杆菌和酿酒酵母混合发酵后提高了游离型和结合型阿魏酸的含量,分别达到20.22、1160.6 mg/kg[16]。王园等[17]发现灌胃40 mg/kg mb发酵麸皮多糖能显著提高断奶大鼠空肠组织中总抗氧化能力、过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物活力及谷胱甘肽含量,显著降低8-羟基脱氧鸟苷含量。
斑马鱼是一种热带淡水鱼,由于其体积小、产卵量大、透明度高、成本低以及与哺乳动物生理上的相似性而被用作脊椎动物的模型生物[18-19]。近年来,斑马鱼被作为一种替代其他实验动物的体内模型来研究氧化应激和心脏问题[20-21]等人类疾病的发展。因此,本实验以发酵麸皮水提物为研究对象,评价其体外抗氧化能力、缓解斑马鱼氧化应激和心脏损伤保护作用,以期为麸皮高附加值利用提供数据参考。
1. 材料与方法
1.1 材料与仪器
实验所用麸皮 购于市场;酿酒酵母CGMCC 2.119及枯草芽孢杆菌CGMCC 1.0892 保存于动物科学学院水产实验室;实验用斑马鱼成鱼 购于国家斑马鱼资源中心(中国,武汉);特非那定、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-azobis-2-methyl-propanimidamide, dihydrochloride, AAPH)、2',7'-二氯荧光黄双乙酸(2',7'-dichlorodi-hydrofluorescein diacetate, DCFH-DA)、吖啶橙(acridine orange, AO)、1,3-双(二苯膦)丙烷(1,3-bis(diphenyphosphino) propane, DPPP) 美国Sigma公司;DPPH、间氨基苯甲酸乙酯甲磺酸盐(3-aminobenzoic acid ethyl ester methanesulfonate, MS-222)、叔丁基-4-羟基茴香醚(butyl hydroxyanisole, BHA)、水杨酸、磷酸盐缓冲液、六氰合铁酸钾、FeSO4、过氧化氢、三氯乙酸、FeCl3、NaOH、NaNO2、Al(NO3)3 国药集团化学试剂有限公司。
HH-2数显恒温水浴锅 常州国华电器有限公司;EPOCH2T酶标仪 美国伯滕仪器有限公司;TC-S-SR倒置显微镜、正置荧光显微镜 日本尼康。
1.2 实验方法
1.2.1 发酵麸皮水提物的制备
实验所用的麸皮由枯草芽孢杆菌和酿酒酵母菌按6.73:3.26混合,37 ℃发酵72 h,于45 ℃烘箱中烘干后粉碎过60目筛,称取以料水比1:10(g/mL)加入蒸馏水中,80 ℃热水浸提30 min,冷却至室温5000 r/min离心10 min,取上清液,烘干备用。
1.2.2 FWBE的体外抗氧化能力
1.2.2.1 DPPH自由基清除率
参照文献对FWBE的DPPH自由基清除活性进行测定[22]。以叔丁基-4-羟基茴香醚(BHA)为阳性对照,将FWBE和BHA分别溶于蒸馏水中,并稀释至不同浓度(0.5、1.0、2.0、4.0 mg/mL),然后将2 mL的DPPH(0.5 mmol/L,溶解在95%乙醇中)溶液与2.0 mL不同浓度的样品溶液混合,充分混匀,同时空白组用2 mL的蒸馏水代替水提麸皮多糖溶液。本底用95%乙醇代替DPPH溶液。在室温下黑暗环境中反应30 min,在517 nm处测定吸光度。DPPH自由基清除活性按以下公式进行计算:
DPPH自由基清除率(%)=1−A0−A1A2×100 式中:A0为样品吸光度;A1为95%乙醇代替DPPH溶液吸光度;A2为蒸馏水代替样品的吸光度。
1.2.2.2 羟基自由基清除率
参照已有文献对FWBE的羟基自由基清除活性进行测定[23]。以BHA为阳性对照,将FWBE和BHA分别溶于蒸馏水中,并稀释至不同浓度(0.5、1.0、2.0、4.0 mg/mL),然后将0.5 mL FeSO4溶液(9.0 mmol/L)溶液、0.5 mL H2O2溶液(8.8 mmol/L)与0.5 mL不同浓度的样品溶液混合,充分摇匀,同时空白组用2 mL的蒸馏水代替水提麸皮多糖溶液,室温反应10 min,加入0.5 mL水杨酸乙醇溶液(9.0 mmol/L),室温反应30 min,在510 nm处测定吸光度,本底用蒸馏水代替FeSO4溶液。
羟基自由基清除率(%)=1−A0−A1A2×100 式中:A0为样品吸光度;A1为蒸馏水代替FeSO4溶液吸光度;A2为蒸馏水代替样品的吸光度。
1.2.2.3 还原力的测定
参照已有文献对FWBE的还原力进行测定[24]。以BHA为阳性对照,将FWBE和BHA分别溶于蒸馏水中,并稀释至不同浓度(0.5、1.0、2.0、4.0 mg/mL),然后将0.75 mL的磷酸缓冲溶液(0.2 mmol/L,pH6.6)、0.75 mL的1%六氰合铁酸钾溶液与0.75 mL不同浓度样品溶液混合,充分摇匀,50 ℃水浴反应20 min,待冷却后加入0.75 mL10%的三氯乙酸,3000 r/min离心10 min,取1.5 mL上清液依次加入1.5 mL蒸馏水和400 μL的0.1% FeCl3溶液,室温静置反应10 min。以蒸馏水做为参比,在700 nm波长处测定吸光度。
1.2.3 FWBE的体内抗氧化能力
1.2.3.1 斑马鱼喂养及胚胎收集
斑马鱼亲鱼饲养于玻璃水族缸中,饲养温度(28.5±1)℃,光周期为照明14 h/黑暗10 h。每天喂食四次饲料,并辅以丰年虫。实验前一天,将雌鱼与雄鱼按照1:2的比例进行杂交繁殖。胚胎由隔日清晨开灯诱导自然产卵获得并于产卵后30 min左右收集受精卵。下午2点左右收集300~400枚胚胎于干净培养皿中并移除排泄物、杂质及未受精胚胎。
1.2.3.2 斑马鱼胚胎存活率的测定
选取受精后8 h(hours post fertilization,hpf)的正常发育胚胎随机放置在24孔板中,每孔10枚,加入2 mL浓度梯度为0、50、100、150、200、300、400、500 μg/mL的水提麸皮多糖溶液,恒温培养,于给药后24、48、72、96 h后观察记录胚胎的孵化率和死亡率。实验重复3次。斑马鱼胚胎在出现白色的卵凝结时定为胚胎死亡,在hpf时斑马鱼出膜则定为胚胎孵化。死亡率计算公式为:死亡率(%)=死亡胚胎数/胚胎总数×100%;孵化率计算公式为:孵化率(%)=孵化胚胎总数/(胚胎总数-死亡胚胎数)×100%。
1.2.3.3 胚胎处理
约受精后的7~9 hpf后,将胚胎转移到含有2 mL充氧水的24孔板中,随机分为对照组(不添加任何处理)、AAPH诱导组、100、200、300 μg/mL的FWBE溶液组,每组4个重复。1 h后除对照组外均加入15 mmol AAPH溶液共同孵育16 h后在新的24孔板中清洗胚胎。等胚胎发育至72 hpf时进一步测定ROS的产生率、细胞死亡率和脂质过氧化程度。
1.2.3.4 氧化应激诱导的细胞内ROS生成率、细胞死亡率和脂质过氧化程度测定
用非标记性的氧化敏感的荧光探针DCF-DA、AO和DPPP分别检测斑马鱼胚胎中细胞内ROS的产生率、细胞死亡率和脂质过氧化程度[25]。在72 hpf时,将斑马鱼幼虫转移到24孔板中,分别用DCF-DA溶液(20 μg/mL)、AO溶液(7 μg/mL)和DPPP溶液(25 μg/mL)处理所有试验组,随后将24孔板在(28.5±1)℃黑暗环境中分别孵育1、0.5和1 h,孵育结束后,用充氧水冲洗斑马鱼幼虫,并在荧光拍照前用MS-222麻醉。斑马鱼幼虫在荧光显微镜下拍摄,用Image J对斑马鱼幼虫的荧光强度进行分析。
1.2.4 FWBE对斑马鱼的心脏保护作用
1.2.4.1 斑马鱼心率的测定
斑马鱼的胚胎心脏在24 hpf左右开始跳动,72 hpf时心脏的形态发育基本完成,且心跳逐渐变得强烈而稳定[26],所以选择24 hpf斑马鱼胚胎研究FWBE对斑马鱼心率的影响。将胚胎移至24孔板中,实验分为5组:正常对照组、2.5 μg/mL特非那定组以及实验组(2.5 μg/mL特非那定+FWBE溶液),试验组FWBE浓度分别是50、100、150、200 μg/mL,每组4个重复,每个重复10枚胚胎。所有孔中加入2 mL新的培养液,置于(28.5±1)℃中培养,待处理48 h后,将各组鱼吸到载玻片上,于倒置显微镜下观测心率,记录15 s内斑马鱼的心跳数。
1.2.4.2 斑马鱼静脉窦-动脉球(SV-BA)间距的测量
同样在48 h后在24孔板中加入少量的MS-222对斑马鱼进行麻醉,随后将斑马鱼置于载玻片上,使之侧卧,双眼重合,用倒置显微镜对斑马鱼心脏部位进行拍照,通过Imagepro-plus软件测定SV-BA之间的间距。同时计算斑马鱼心脏损伤修复率[心脏损伤修复率(%)=(实验组斑马鱼心脏SV-BA间距−特非那定组斑马鱼心脏SV-BA间距)/(空白对照组斑马鱼SV-BA间距−特非那定组斑马鱼SV-BA间距)×100]。
1.3 数据处理
所有实验均一式三份。数据以平均值±标准误差(SE)表示。用SAS的单因素方差分析程序对数据进行方差分析。对于有显著差异的处理,采用Tukey检验比较其平均值。显著性水平设定为P<0.05,并通过Originpro 2017 C软件进行作图。
2. 结果与分析
2.1 体外抗氧化活性结果分析
2.1.1 DPPH自由基清除能力
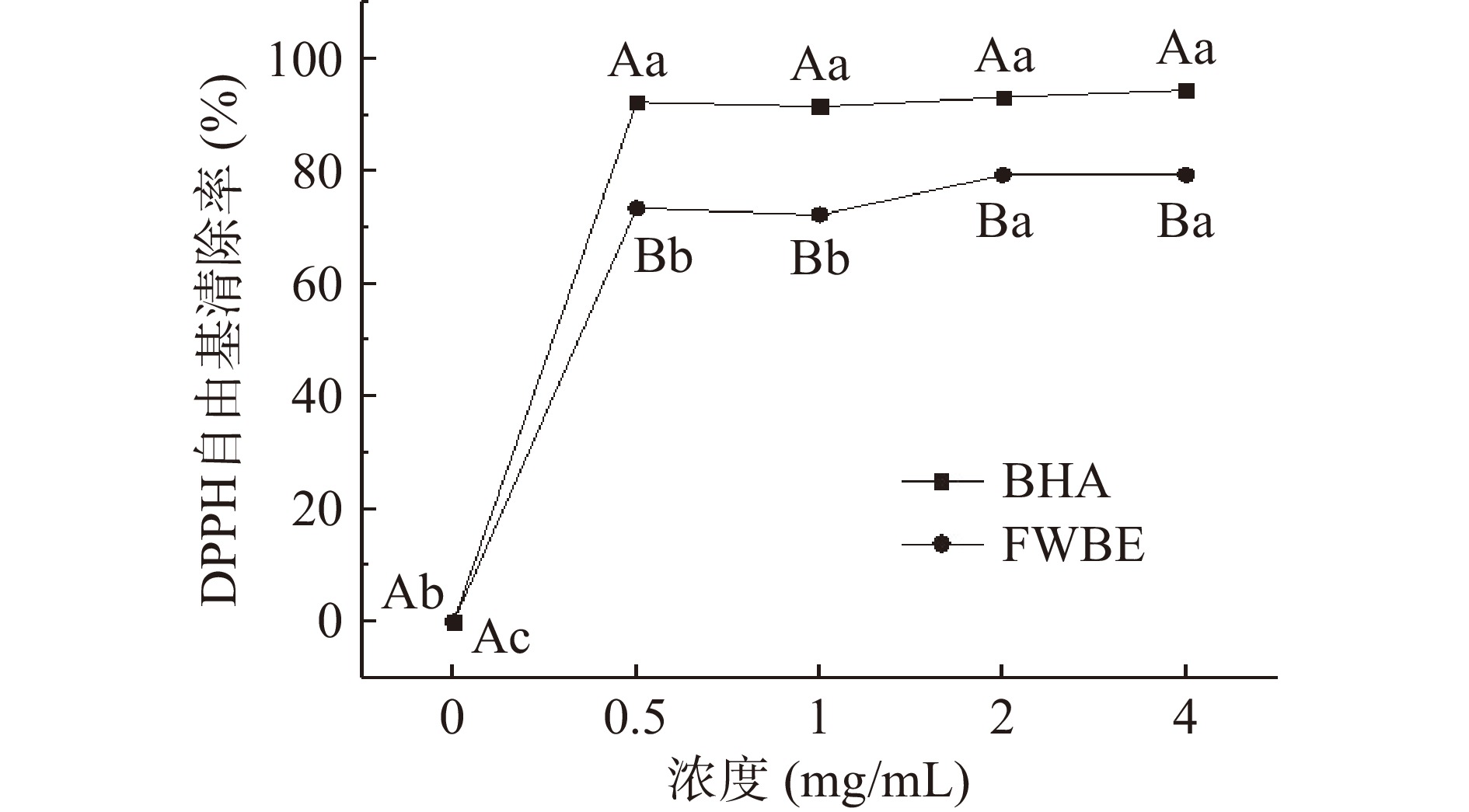
DPPH分子包含一个稳定的自由基,已被广泛用于评估抗氧化剂的自由基清除能力,并且由清除DPPH的能力可以反映出其他物质抗氧化活性大小[27-28]。FWBE对DPPH自由基的清除率如图1所示,随着FWBE溶液浓度的增加DPPH自由基的清除能力先逐渐上升后又趋于平缓,虽然与BHA标准品相比,FWBE的DPPH自由基清除率较低,但当FWBE的浓度为4 mg/mL时对DPPH的清除率可达79.40%,说明FWBE具有良好的抗氧化效果。可能是由于DPPH与FWBE的酚羟基中氢原子容易发生反应[29]。
2.1.2 羟基自由基清除能力
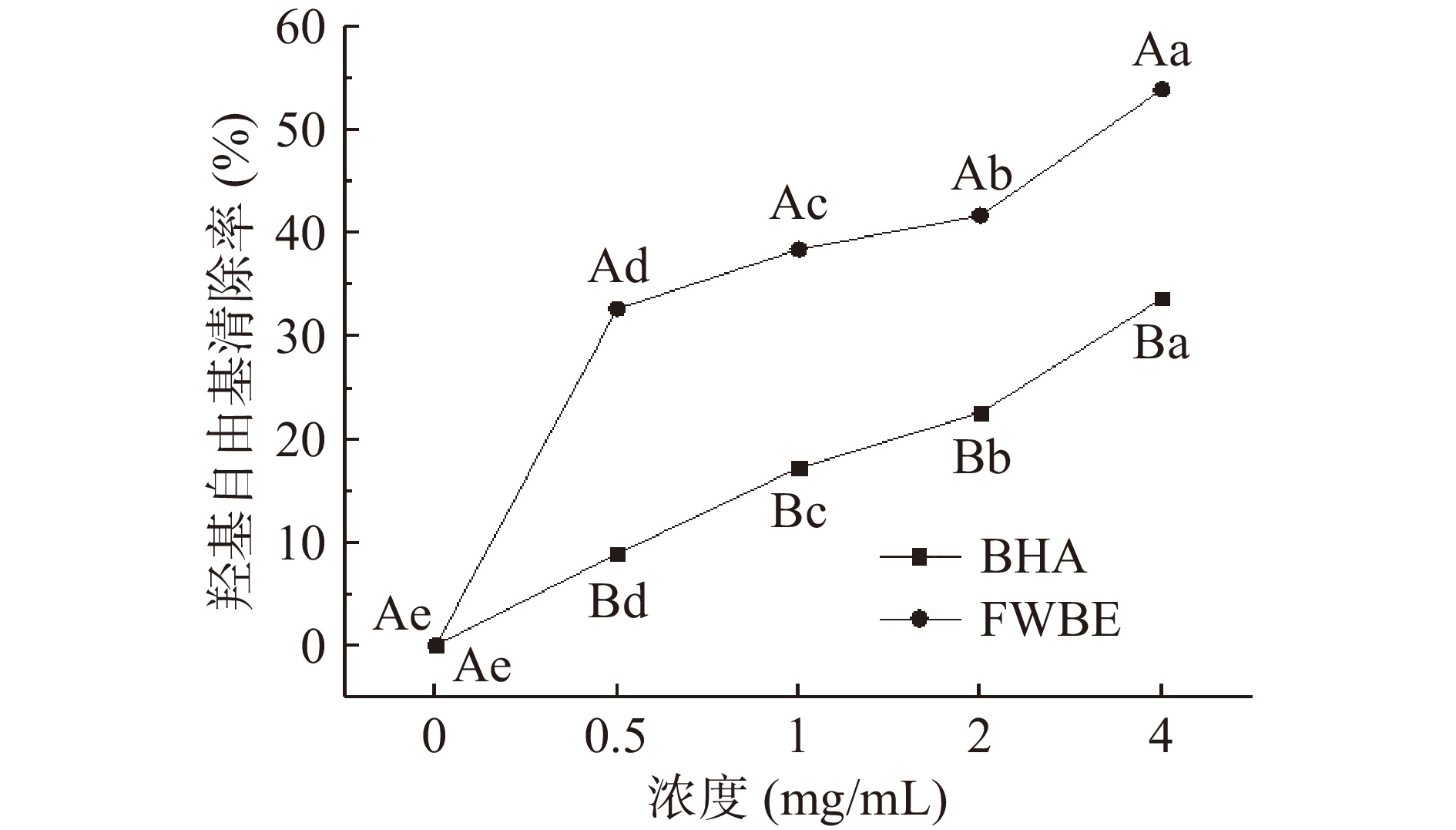
羟基自由基是一种化学性质最活跃的自由基,危害性极大,在生物体内攻击细胞膜,造成细胞膜损伤;破坏DNA的碱基和糖基序列,导致双螺旋结构解体,甚至造成细胞死亡和突变[30-32]。因此,羟基自由基的清除活性常用于评价物质清除自由基的能力。FWBE对羟基自由基的清除能力如图2所示,羟基自由基的清除能力与FWBE的浓度呈剂量依赖性增加,且FWBE的羟基自由基清除能力显著高于BHA(P<0.05)。FWBE对羟基自由基的IC50为3.315 mg/mL,且当FWBE浓度为4 mg/mL,其羟基自由的清除能力可达到53.99%,而BHA则为32.98%,这说明FWBE具有较好的羟基自由基清除能力。
2.1.3 还原力
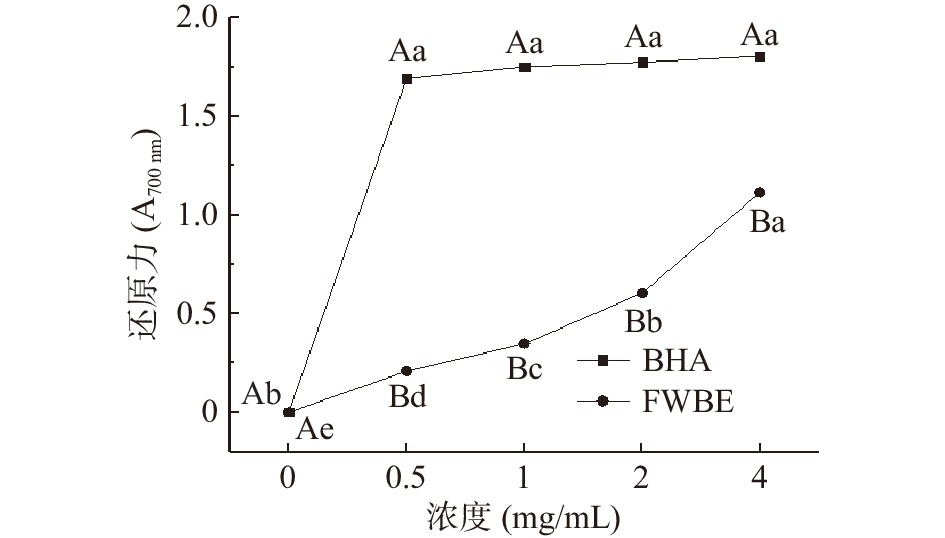
还原力代表了物质提供电子的能力,还原性强,说明物质抗氧化能力强,所以其是评价抗氧化能力的重要指标之一[27,33]。FWBE还原力大小如图3所示,还原力的大小与FWBE溶液浓度呈正相关;在实验研究的浓度范围内,同一浓度下FWBE的还原力显著低于标准品BHA(P<0.05),但随着FWBE浓度的增加,还原力增加。FWBE还原力的IC50(清除率/吸光度=50%/0.5时的样品浓度)为1.611 mg/mL,同时当浓度为4 mg/mL时FWBE的还原力可以达到1.11。可能是由于经过发酵后的麸皮可以将束缚型酚类物质释放,降低了氧化还原电位[34]。
2.2 体内抗氧化活性结果分析
2.2.1 FWBE对斑马鱼胚胎死亡率和孵化率的影响
为了评价FWBE对斑马鱼胚胎发育的毒性,分析了不同浓度的FWBE作用96 hpf后斑马鱼胚胎的死亡率和孵化率。如图 4所示,在400和500 μg/mL 的FWBE条件下,96 hpf时斑马鱼胚胎死亡率为50%。并且在最高试验浓度500 μg/mL时,胚胎始终没有孵化。在50、100、150 μg/mL的FWBE条件下,对96 hpf斑马鱼胚胎无致死和抑制孵化的作用。FWBE的96 hpf-LC50(半致死浓度)是400 μg/mL。由于400和500 μg/mL FWBE溶液会造成斑马鱼半数致死且会抑制孵化,因此没有对其进行进一步分析。但在发酵麸皮多糖对大鼠进行处理时添加量最高可达400 mg/kg[35],因此,推测斑马鱼较小导致耐受量降低。
2.2.2 FWBE对AAPH诱导的斑马鱼ROS产生率的影响
细胞中过量的ROS积累会损害细胞器和生物分子,如脂质、蛋白质和核酸[36]。不同浓度的FWBE对斑马鱼体内产生ROS的影响如图5所示,经过AAPH诱导后斑马鱼体内ROS的产生量上升至106.30%(P<0.05),但经过FWBE预保护后ROS的产生率显著降低(P<0.05)。在FWBE浓度为100、200、300 μg/mL时,ROS的产生率分别降低至98.91%、102.29%、102.52%,与对照组差异不显著(P>0.05),说明起到了缓解由AAPH诱导所引起的ROS产生率上升的作用。
2.2.3 FWBE对AAPH诱导的斑马鱼细胞死亡率的影响
FWBE对AAPH诱导的斑马鱼体内细胞死亡率的影响如图6所示,凋亡细胞与荧光染料结合后发出较强的荧光,荧光图像反映出经AAPH诱导之后,斑马鱼体内细胞死亡率上升至129.03%(P<0.05),而添加不同浓度的FWBE预保护后显著降低了由AAPH诱导产生的细胞死亡(P<0.05),但是各浓度组间的缓解作用无显著差异(P>0.05),其中,浓度为200 μg/mL时与对照组无显著差异(P>0.05)。
2.2.4 FWBE对AAPH诱导的斑马鱼脂质过氧化程度的影响
DPPP可以穿透细胞膜,通过脂质过氧化产生的氢过氧化物诱导氧化并产生具有荧光的DPPP氧化物[37]。不同浓度的FWBE对斑马鱼体内脂质过氧化程度的影响如图7所示,经过AAPH诱导后斑马鱼体内脂质过氧化程度上升至117.20%(P<0.05),但经过FWBE预保护后斑马鱼体内的脂质过氧化程度显著降低(P<0.05)。除浓度为100 μg/mL与对照组间无显著差异外(P>0.05),其余两个浓度与对照组之间存在显著差异(P<0.05),但二者之间的缓解作用无显著差异(P>0.05)。
2.3 FWBE对斑马鱼的心脏保护作用
斑马鱼的心脏是第一个发育和发挥功能的器官,在36 hpf心脏传导系统开始,到72 hpf心脏功能逐步成熟[38]。心率作为体现心功能的重要指标反应出了心脏的泵血功能,而静脉窦-动脉球间距(SV-BA)间距则可以显示出心脏受损程度[39-40]。图8和图9表明,在特非那定诱导后斑马鱼的心脏出现明显损伤,在卵黄囊处出现了一个肿包(图8B),且当在显微镜下观察时斑马鱼的心率减慢。与空白对照组相比,经过特非那定诱导后斑马鱼的心率显著降低(P<0.05),SV-BA间距显著加大(P<0.05),表明建模成功,特非那定成功诱导了斑马鱼心脏损伤。与特非那定组相比,添加50、100、150、200 μg/mL会显著提高斑马鱼的心率(P<0.05),并且各浓度组间差异不显著(P>0.05),但是当浓度为200 μg/mL心率有所下降,所以在测定斑马鱼SV-BA间距时只选取浓度为50、100、150 μg/mL的FWBE。与特非那定组相比,添加50、100、150 μg/mL FWBE的斑马鱼SV-BA间距显著减小(P<0.05),且FWBE浓度为150 μg/mL时对斑马鱼的心脏保护作用最好,其心脏损伤修复率可达48.15%,表明FWBE对由特非那定造成的斑马鱼心脏损伤具有一定的缓解作用,可以起到保护心脏的功能。
3. 结论
本研究对FWBE的体外抗氧化效果进行评价,结果发现当FWBE浓度为0~4 mg/mL对羟基自由基、DPPH自由基的清除率及还原力的值在逐渐上升,说明FWBE具有一定的抗氧化能力。随后,利用斑马鱼模型对FWBE的体内抗氧化进行评价,发现AAPH诱导使斑马鱼体内的ROS水平、细胞死亡率和脂质过氧化程度显著增加(P<0.05),分别上升至106.30%、129.03%、117.20%。但加入不同浓度的FWBE处理后三个指标显著降低(P<0.05)。当添加50、100、150 μg/mL的FWBE对特非那定诱导的斑马鱼心脏损伤有不同程度的改善,其心率显著升高及SV-BA间距显著缩短(P<0.05)。实验结果为麦麸作为天然抗氧化剂和心脏保护剂提供了可靠的理论依据,证明麦麸具有很大的市场价值和应用前景。
-
-
[1] 侯广月, 郑重, 宋凤瑞, 等. 基于紫外及荧光光谱方法的中药抗氧化应激作用研究[J]. 光谱学与光谱分析,2015,35(3):680−683. [HOU G Y, ZHENG Z, SONG F R, et al. Investigation on ihibitory capacities of serventeen herbal extracts on oxidative stress using ultraviolet and fluorescence spectroscopy[J]. Spectroscopy and Spectral Analysis,2015,35(3):680−683. [2] 李兴太, 纪莹. 线粒体氧化应激与天然抗氧化剂研究进展[J]. 食品科学,2015,36(7):268−277. [LI X T, JI Y. Recent advances in mitochondrial oxidative stress and natural antioxidants[J]. Food Science,2015,36(7):268−277. [3] 牙甫礼, XIN Yu, 张春梅, 等. 姜黄素对过氧化氢诱导血小板凋亡作用的影响及分子机制研究[J/OL]. 食品科学: 1−11 [2021-07-03]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201120.1319.004.html. YA F L, XIN Y, ZHANG C M, et al. Effects and mechanisms of curcumin on hydrogen peroxide-induced platelet apoptosis[J/OL]. Food Science, 1−11 [2021-07-03]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201120.1319.004.html.
[4] ANA N, NATAŠA B S, MIRON S, et al. Superoxide dismutase isoenzymes gene expression in peripheral blood mononuclear cells in patients with coronary artery disease[J]. Journal of Medical Biochemistry,2019,38(3):284−291. doi: 10.2478/jomb-2018-0041
[5] LIN C P, LIN F Y, HUANG P H, et al. Endothelial progenitor cell dysfunction in cardiovascular diseases: Role of reactive oxygen species and inflammation[J]. Bio Med Research International, 2013: 845037.
[6] AJO E, JOH N, KATTOO R, et al. Oxidative stress in atherosclerosis[J]. Current Atherosclerosis Reports,2017,19(11):42. doi: 10.1007/s11883-017-0678-6
[7] THOMAS M, GIOVANNI G C, CHRISTOPH M, et al. Impact of oxidative stress on the heart and vasculature[J]. Journal of the American College of Cardiology,2017,70(2):212−229. doi: 10.1016/j.jacc.2017.05.035
[8] KURA B, SZEIFFOVA B B, KALOCAYOVA B, et al. Oxidative stress-responsive MicroRNAs in heart injury[J]. Int J Mol Sci,2020,21(1):358. doi: 10.3390/ijms21010358
[9] 陈飞雪, 包志华. 小麦胚芽营养价值及发酵食品的研究进展[J]. 农产品加工,2016(6):66−67. [CHEN F X, BAO Z H. Research progress of nutritional value of wheat germ and fermented food[J]. Agricultural Products Processing,2016(6):66−67. [10] PARK Y, BRINTON L A, SUBAR A F, et al. Dietary fiber intake and risk of breast cancer in postmenopausal women: The national institutes of health-AARP diet and health study[J]. The American Jurnal of Clinical Nutrition,2009,90(3):664−71. doi: 10.3945/ajcn.2009.27758
[11] 谭斌, 谭洪卓, 刘明, 等. 粮食(全谷物)的营养与健康[J]. 中国粮油学报,2010,25(4):100−107. [TAN B, TAN H Z, LIU M, et al. The Grain, the whole grain: Nutrition and health benefits[J]. Journal of the Chinese Cereals and Oils Association,2010,25(4):100−107. [12] 周洁, 王立, 周惠明. 麦类抗氧化物之探讨[J]. 粮食与油脂,2002(11):29−30. [ZHOU J, WANG L, ZHOU H M. Exploration of wheat antioxidants[J]. Cereals Oils,2002(11):29−30. [13] 陈琬盈, 李江, 郑育桃, 等. 三种膳食纤维的抗氧化活性及主要吸附能力的比较研究[J]. 中国酿造,2015,34(1):99−104. [CHEN W Y, LI J, ZHENG Y T, et al. Comparative study on antioxidant activity of kinds of dietary fibers and the main adsorption capactities[J]. China Brewing,2015,34(1):99−104. [14] 贾天广, 刘邦迪, 郭亚辉. 麦麸的功能成分及其应用研究进展[J]. 食品研究与开发,2014,35(7):122−126. [JIA T G, LIU B D, GUO Y H, et al. Research progress of the wheat bran functional composition and its application[J]. Food Research and Development,2014,35(7):122−126. [15] 罗昆, 杨文丹, 马子琳, 等. 发酵麦麸及其面包面团中阿拉伯木聚糖溶解性与酚酸释放研究[J]. 食品科学,2019,40(4):42−48. [LUO K, YANG W D, MA Z L, et al. Araboxylan solubilization and phenolic acid release from fermented wheat bran and bread dough incorporated with it[J]. Food Science,2019,40(4):42−48. [16] 任雪荣, 齐景伟, 刘娜, 等. 微生物发酵对麦麸水溶性多酚含量、组成及抗氧化活性的影响研究[J]. 食品工业科技,2020,41(3):104−109. [REN X R, QI J W, LIU N, et al. Effect of microbial fermentation on content, composition and antioxidant activity of water-soluble polyphenols in eheat bran[J]. Science and Technology of Food Industry,2020,41(3):104−109. [17] 王园, 杨可心, 段元霄, 等. 发酵麸皮多糖对大鼠空肠组织抗氧化能力、形态结构和紧密连接蛋白表达的影响[J]. 食品科学,2019,40(13):166−170. [WANG Y, YANG K X, DUAN Y X, et al. Effect of fermented wheat bran polysaccharides on antioxidant capacity morphological structure and tight junction protein expression in rat jejunum[J]. Food Science,2019,40(13):166−170. [18] JUDITH S EISEN. Zebrafish make a big splash[J]. Cell,1996,87(6):969−977. doi: 10.1016/S0092-8674(00)81792-4
[19] FISHMAN M C. Zebrafish genetics: The enigma of arrival[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(19):10554−10556. doi: 10.1073/pnas.96.19.10554
[20] YANG H M, HAM Y M, YOON W J, et al. Quercitrin protects against ultraviolet B-induced cell death in vitro and in an in vivo zebrafish model[J]. Journal of Photochemistry and Photobiology B: Biology,2012,114:126−131.
[21] 李智平, 韩利文, 何秋霞, 等. 原花青素对特非那定诱导的斑马鱼心脏损伤的保护作用[J]. 中药药理与临床,2017,33(3):54−57. [LI Z P, HAN L W, HE Q X, et al. Protective effect of procyanidins to terfenadine-induced cardiac injury on zebrafish embryos[J]. Pharmacology and Clinics of Chinese Materia Medica,2017,33(3):54−57. [22] XIE J H, WANG Z J, SHEN M Y, et al. Sulfated modification, characterization and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Food Hydrocolloids,2016,53:7−15. doi: 10.1016/j.foodhyd.2015.02.018
[23] WU D T, LIU W, QIAO H, et al. Physicochemical characteristics and antioxidant activities of non-starch polysaccharides from different kiwifruits[J]. International Journal of Biological Macromolecules,2019,136:891−900. doi: 10.1016/j.ijbiomac.2019.06.142
[24] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. 1989, 28(4): 1057−1060.
[25] JU YOUNG KO, EUN A KIM, JI HYEOK LEE, et al. Protective effect of aquacultured flounder fish-derived peptide against oxidative stress in zebrafish[J]. Fish and Shellfish Immunology,2014,36(1):320−323. doi: 10.1016/j.fsi.2013.11.018
[26] CHARLES B, KIMME L, WILLIAM W, et al. Stages of embryonic development of the zebrafish[J]. 1995, 203(3): 253−310.
[27] RAGURAMAN V, ABRAHAM L S, JYOTSN A, et al. Sulfated polysaccharide from Sargassum tenerrimum attenuates oxidative stress induced reactive oxygen species production in in vitro and in zebrafish model[J]. Carbohydrate Polymers,2019,203(203):441−449.
[28] SOARES J R, DINS T C P, ANTONO P C, et al. Antioxidant activities of some extracts of Thymus zygis[J]. Free Radical Research,1997,26(5):469−478. doi: 10.3109/10715769709084484
[29] 齐希光, 张晖, 王立, 等. 麦麸阿魏酰低聚糖抗氧化性的研究[J]. 食品工业科技,2011,32(8):71−73,76. [QI X G, ZHANG H, WANG L, et al. Study on antioxidative activity of feruloyl oligosaccharides[J]. Science and Technology of Food Industry,2011,32(8):71−73,76. [30] PATRICIA V, EDUARDA F, FE1IX C, et al. Anti-oxidative proper-ties of Cardoon (Cynara cardunculus L.) infusion against super oxide radical, hydroxyl radical, and hypoch1orous acid[J]. Journal of Agricultural and Food Chem,2002,50:4989−4991. doi: 10.1021/jf020225o
[31] PAREJOA I, VILADOMATA F, BASTIDA J, et al. Investigation of Bo-livian plant extracts for their radical scavenging activity and antioxidant activity[J]. Life Science,2003,73:1667−1681. doi: 10.1016/S0024-3205(03)00488-0
[32] SINGH N, RAJINI P S. Free radical scavenging activity of an aqueous extract of potato peel[J]. Food Chemistry,2004,85:611−613. doi: 10.1016/j.foodchem.2003.07.003
[33] 李艳. 发酵工程原理与技术[M]. 北京: 高等教育出版社, 2007. LI Y. Fermentation engineering principles and technology[M]. Beijing: Higher Education Press, 2007.
[34] 杜小燕, 吴晖, 唐语谦, 等. 麦麸发酵前后不同存在形态酚类物质中酚酸含量的变化及其抗氧化活性分析[J]. 中国粮油学报,2016,31(6):17−23. [DU X Y, WU H, TANG Y Q, et al. Analysis of phenolic compounds contents and antioxidant activities in unfermented and fermented wheat bran[J]. Journal of the Chinese Cereals and Oils Association,2016,31(6):17−23. [35] 安晓萍, 王园, 史俊祥, 等. 一种发酵麸皮多糖的提取及其对大鼠的抗氧化作用[J]. 食品工业科技,2018,39(16):281−285. [AN X P, WANG Y, SHI J X, et al. Extraction of fermented wheat bran polysaccharides and its antioxidative effects on rats[J]. Science and Technology of Food Industry,2018,39(16):281−285. [36] LEI W, WON W L, HYE-WON Y, et al. Protective effect of water extract of citrus pomace against AAPH-induced oxidative stress in vitro in vero cells and in vivo in zebrafish[J]. Preventive Nutrition and Food Science,2018,23(4):301−308. doi: 10.3746/pnf.2018.23.4.301
[37] KAZUAKI A, TATEO S, HIROSHI O, et al. Study on aromatic phosphines for novel fluorometry of hydroperoxides(II)-The determination of lipid hydroperoxides with diphenyl-1-pyrenylphosphine[J]. Analytical Letters,1987,20(5):797−807. doi: 10.1080/00032718708062929
[38] YALCIN H C, AMINDARI A, BUTCHER J T, et al. Heart function and hemodynamic analysis for zebrafish embryos[J]. Developmental Dynamics: An Official Publication of the American Association of Anatomists,2017,246(11):868−880. doi: 10.1002/dvdy.24497
[39] 杨龙飞, 赵渤年, 丁晓彦, 等. 丹参水溶性成分促斑马鱼血管生成及心脏保护活性的谱-效关系研究[J]. 中草药,2019,50(12):2899−2907. [YANG L F, ZHAO B N, DIN X Y, et al. Spectrum-effect relationship of angiogenesis activity and cardioprotection of water-soluble components Salvia militorrhiza in zebrafish[J]. Chinese Herbal Medicines,2019,50(12):2899−2907. [40] 蒋易, 燕艳丽, 白建文. 抗细胞趋化因子CCL21单克隆抗体处理对小鼠急性心肌梗死后左心室重构及心功能的影响[J]. 中国应用生理学杂志,2018,34(3):197−200. [JIANG Y, YAN Y L, BAI J W. Effect of treating with anti-CCL21 monoclonal antibody on left ventricular remodeling and cardiac function post-acute myocardial infarction in mice[J]. Chinese Journal of Applied Physiology,2018,34(3):197−200. -
期刊类型引用(3)
1. 董欢欢,杨梅,周莹,张媛,管咏梅,段炫彤,陈丽华,朱卫丰. 葛粉对小鼠糖脂代谢紊乱的改善作用研究. 时珍国医国药. 2024(03): 513-518 .  百度学术
百度学术
2. 郝世奇,李雅菲,吕浩迪,李琳,Tuyatsetseg Jambal,吉日木图,明亮. 基于脂质组学研究骆驼乳对小鼠非酒精性脂肪肝的缓解作用. 中国食品学报. 2024(06): 128-141 .  百度学术
百度学术
3. 姚怀兵,李娜,梁小瑞,郝泽林,闫慧,赵仲凯,刘颖,马强,王玉琢,陈钢粮,杨洁. 新疆双峰驼产奶性状与体尺、体重及血液理化指标的测定及相关性分析. 中国畜牧兽医. 2023(08): 3210-3220 .  百度学术
百度学术
其他类型引用(2)







 下载:
下载:






 下载:
下载:



