Effect of Exogenous Melatonin Treatment on Browning and Quality of Sweet Cherry
-
摘要: 为探讨外源褪黑素处理对采后甜樱桃褐变和品质的影响,本研究以‘萨米脱’甜樱桃为材料,分别以蒸馏水、100 μmol·L−1外源褪黑素浸泡处理甜樱桃果实5 min,于0±1 ℃下贮藏,定期取样进行褐变和品质相关生理指标的测定。结果表明:外源褪黑素处理能够显著(P<0.05)抑制褐变指数上升,降低了33.3%腐烂率,并显著(P<0.05)延缓了硬度、可滴定酸、可溶性固形物和抗坏血酸含量的下降。褪黑素处理还显著(P<0.05)提高了超氧化物歧化酶和过氧化氢酶活性,显著(P<0.05)抑制了脂氧合酶活性、O2−·产生速率、H2O2水平、丙二醛含量和相对膜透性的上升。同时,褪黑素处理显著(P<0.05)延缓了过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶活性的上升,并显著(P<0.05)提高了多酚含量。这些结果表明,外源褪黑素处理抑制甜樱桃果实褐变可能与提高抗氧化酶活性,降低膜脂过氧化程度,保持细胞膜结构完整性和抑制褐变相关酶活性密切相关。Abstract: To investigate the effects of melatonin on the browning and quality of postharvest sweet cherry fruits, ‘Samituo’sweet cherry was used as the material in this study. Sweet cherry was treated with distilled water and 100 μmol·L−1 exogenous melatonin, and the relevant physiological indexes related with browning and quality were determinated at regular time during storage at 0±1 ℃. The results showed that melatonin treatment significantly (P<0.05) inhibited the increase of browning index, reduced the decay rate by 33.3%, significantly (P<0.05) delayed the decrease of firmness, total soluble solids, titratable acidity, and ascorbic acid content. The melatonin significantly (P<0.05) increased the activities of superoxide dismutase and catalase, significantly (P<0.05) inhibited the increase of lipoxygenase activity, O2−· generation rate, H2O2, malondialdehyde content , and relative membrane permeability. Meanwhile, melatonin treatment significantly (P<0.05) delayed the increase of peroxidase, polyphenol oxidase, and phenylalanine ammonia lyase, and significantly (P<0.05) increased polyphenol content. These results indicated that the inhibiting fruit browning via exogenous melatonin treatment in sweet cherries might be closely associated with the improvement of antioxidant enzyme activities, the reduction of membrane lipid peroxidation degree, the maintenance of structural integrity of cell membrane and the inhibition of browning related enzyme activities.
-
Keywords:
- sweet cherry /
- exogenous /
- melatonin /
- browning /
- quality
-
甜樱桃果实色泽鲜艳、香味浓郁、营养丰富并具有较高的医疗保健价值,因此深受国内外消费者的喜爱[1]。然而,甜樱桃果实汁多、皮薄,不耐贮运,采收时节又多在高温季节,采后极易褐变、腐烂,常温下3~5 d便失去商品价值。因此,减轻甜樱桃果肉褐变,延缓衰老,提高果实品质是解决其贮运的关键问题。目前,有关甜樱桃果实采后保鲜技术多数集中在对浸钙[2]、香豆酸[3]、2,4-表油菜素内酯[4]等的研究上。这些技术因投资成本较高,技术管理复杂,毒性残留高等问题很难进行大范围的推广与应用。因此,寻求经济、易操作、无毒副作用的甜樱桃保鲜技术具有十分重要的意义。
褪黑素(N-acetyl-5-methoxytryptamine,MT)是广泛存在于动植物体内的一类重要的色氨酸吲哚类化合物[5]。MT具有促进植物生长发育、调控果实成熟和采后衰老及改善果实质量等一系列生理功能[6]。它是一种良好的抗氧化剂,可以直接清除植物体内的自由基,提高抗氧化酶和抗氧化剂的含量,并增加与抗氧化酶有关基因的表达,以保护植物不受过氧化损伤,最终维持细胞膜结构的完整性[7]。果蔬中的MT很容易被人体利用,从营养角度来看,MT是一种维生素,与维生素A相似,对人体的健康有益[8]。据报道,外源褪黑素保持了桃果实细胞膜区域化结构的完整性,使得多酚物质与褐变酶无法接触,同时抑制了多酚氧化酶(PPO)和过氧化物酶(POD)活性,导致多酚物质氧化消耗减少并得到积累,最终抑制了果实褐变[9]。外源褪黑素可通过调节活性氧代谢、膜脂和能量代谢来延缓荔枝果实的褐变和衰老[10-11]。这些发现为MT参与果蔬采后衰老褐变提供了有效证据。但目前尚未见到MT在甜樱桃采后褐变方面的应用,本试验通过研究外源褪黑素对冷藏过程中甜樱桃果实褐变指数和相关生理生化指标的影响,评价其减轻果实褐变的效果,以期为甜樱桃贮运技术的改进提供参考。
1. 材料与方法
1.1 材料与仪器
‘萨米脱’甜樱桃果实 采自管理水平良好的甜樱桃示范基地,果实八九成成熟度时采收,采收结束后1 h内,迅速将果实运回实验室;褪黑素、磷酸氢二钠、氯化镁、磷酸二氢钠、硫代巴比妥酸、三氯乙酸、乙二胺四乙酸二钠、氢氧化钠、三氯乙酸、过氧化氢、氮蓝四唑、钼酸铵、核黄素、L-苯丙氨酸、聚乙烯吡咯烷酮、愈创木酚等 上海源叶科技有限公司。
TAI604型电子天平 上海舜宇恒平科学仪器有限公司;DDS-307A电导率仪 上海佑科仪器仪表有限公司;Sigma3k15高速冷冻离心机 德国Sigma公司;UV-5500PC型紫外-可见分光光度计 上海元新仪器有限公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;TA-XT Express-v3.1型质构仪 英国Stable Micro System公司;SDR-500型数显糖度计 上海束句科仪有限公司。
1.2 实验方法
1.2.1 样品处理
选取无机械损伤、无病、大小均一、带果梗的正常果为实验材料,随机分成2组,每组60 kg,每组分成3个重复,每重复20 kg果实。将甜樱桃果实分别浸入0 mmol·L−1(蒸馏水)、100 μmol·L−1MT溶液中浸泡5 min(前期预实验基础上筛选出来),晾干果实表面水分,平铺于塑料筐(44 cm×33 cm×11 cm)中,筐外套0.03 mm PE保鲜袋,挽口不封袋,贮藏于0±1 ℃、相对湿度90%~95%的环境条件下。
贮藏过程中,定期取样,每次取75个果,其中45个用于测定硬度、可滴定酸、可溶性固形物、细胞膜透性,同时果实切成2 mm3方块,并以液氮速冻保存于−80 ℃的超低温冰箱中,用于丙二醛(MDA)、抗坏血酸、O2−·、H2O2和酶活性的测定。另外30个果实,用于褐变指数的统计。在贮藏结束时,100个果实用于腐烂率的统计。
1.2.2 褐变指数和腐烂率测定
褐变指数参照杨青珍等[12]的方法进行。取30个果实,沿赤道部横切。褐变指数分级:0级果肉无褐变;1级果肉褐变面积≤1/4;2级果肉褐变面积1/4~1/2;3级果肉褐变面积1/2~3/4;4级果肉褐变面积≥3/4。
果肉褐变指数=∑(褐变级数×该级果数)/(4×N)
腐烂率(%)=腐烂果实数/总果实数×100
1.2.3 硬度和可溶性固形物含量测定
硬度和可溶性固形物含量的测定参照FUENTEALBA等[1]的方法,略有修改。硬度测定:取15个果实,去果实赤道部相对两面的皮,用英国TA-XT Express-v3.1型质构仪测果实硬度,探头直径为2 mm,以5 mm·s−1的速率进行下压,下压深度为2 mm,以最大峰值为硬度指标,单位为N。
可溶性固形物含量的测定:取15个果实,用数显糖度计测定,单位为%。
1.2.4 可滴定酸和抗坏血酸含量测定
可滴定酸参照YANG等[13]的方法,略有修改。取15个果实,称取2.0 g混匀果肉,置于研钵中磨碎,滴加20 mL蒸馏水将匀浆液洗倒入50 mL离心管中摇匀,在4000 r·min−1离心10 min。将20 mL上清液倒入锥形瓶中,用0.1 mol·L−1 NaOH进行滴定,终点设置为pH8.1,可滴定酸按苹果酸计,单位%(质量分数)。
抗坏血酸参照高俊凤[14]的方法,略有修改。取15个果实,称取2.0 g混匀果肉,加7.5 mL草酸-EDTA,研磨成浆,并仔细转入10 mL离心管内、经10000 r·min−1离心10 min后,取1 mL上清液,在760 nm下测定吸光度,以mg·g−1鲜重(FW)表示。
1.2.5 O2−·产生速率和H2O2含量测定
O2−·产生速率和H2O2含量参考高俊凤[14]方法测定,略有修改。
O2−·产生速率测定:取15个果实,称取3.0 g果肉,加入6.0 mL50 mmol·L−1 pH7.8磷酸钠缓冲液(含1 mmol·L−1 EDTA,1% TritonX-100和5% PVP),在冰浴条件下研磨匀浆,4 ℃ 10000 r·min−1离心15 min。取1.0 mL上清液,加入1.0 mL 50 mmol·L−1pH7.8磷酸缓冲液和1.0 mL l mmol·L−1的盐酸羟胺溶液,摇匀后于25 ℃保温20 min。然后加入1.0 mL 7 mmol·L−1 α-萘胺溶液和1.0 mL l7 mmol·L−1对氨基苯磺酸溶液,混匀于30 ℃水浴显色反应30 min,在530 nm处测定吸光度值,以µmol·min−1·g−1 FW表示O2−·产生速率。
H2O2含量测定:取15个果实,称取2.0 g果肉,加入5 mL pH6.5磷酸缓冲液,在冰浴下研磨成匀浆,4 ℃ 10000 r·min−1离心15 min。取1 mL 提取液,加入0.1 mL 10%四氯化钛-盐酸溶液和0.2 mL浓氨水,反应5 min后离心,沉淀用预冷丙酮洗涤2~3次,加入2.0 mL的2 mol·L−1硫酸溶解,进行比色测定,以μmol·g−1 FW表示H2O2含量。
1.2.6 丙二醛含量和细胞膜相对透性测定
细胞膜相对透性参考YANG等[15]的方法测定。取15个果实,在果实赤道部去果皮,用1 cm直径不锈钢打孔器打孔,将果肉切成1 mm圆片,随机取20个圆片置小烧杯中,加20 mL蒸馏水搅拌均匀,平衡30 min,期间不断搅拌,然后测定电导率C1,沸水浴中煮15 min,冷却后添加蒸馏水至20 mL,测定电导率C2。细胞膜相对透性(%)=(C1/C2)×100
丙二醛(MDA)含量测定参考DHINDSA等[16]的方法测定。取15个果实,称取2.0 g果肉,加入5.0 mL100 g·L−1三氯乙酸溶液,研磨成匀浆,4 ℃ 10000 r·min−1离心20 min。取2.0 mL上清液,加入3.0 mL硫代巴比妥酸,混合后在沸水浴中煮沸20 min,迅速冷却,10000 r·min−1离心20 min,分别测定上清液在450、532和600 nm吸光度值。MDA含量(µmol·g−1 FW)=[6.45×(OD532-OD600)−0.56×OD450]×Vt/(Vs×m),Vt代表样品提取液总体积,Vs代表测定时所取样品提取液体积,m代表样品质量。
1.2.7 脂氧合酶(LOX)酶活性测定
LOX酶活性参照DING等[17]的方法测定,略有修改。取15个果实,取2 g果肉,加入2 mL提取缓冲液(含有1% TritonX-100和4% PVP),冰浴条件下迅速研磨成匀浆,4 ℃ 10000 r·min−1条件下离心20 min,取上清液用于LOX活性测定。采用3 mL 50 mmo1·L−1 pH6.8磷酸钠缓冲液反应体系中包含0.1 mL 0.5%亚油酸溶液,30 ℃水浴反应10 min,再加入0.2 mL酶液,混匀,在234 nm波长测定3 min内吸光度值变化,每克果肉每分钟0.01为一个酶活性单位,以U·min−1·g−1 FW表示酶活性。
1.2.8 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性测定
SOD和CAT活性参照YANG等[15]方法,略有修改。取15个果实,称取3 g左右的甜樱桃果肉,加入6 mL pH7.8 100 mmol·L−1磷酸缓冲液(内含1.0 mmol·L−1 EDTA,50 g·L−1 PVP,10 mL·L−1 TritonX-100),冰浴条件下迅速研磨成匀浆,再在4 ℃ 10000 r·min−1离心15 min,取上清液分别测定SOD和CAT活性。
SOD采用3 mL 50 mmol·L−1 pH7.8磷酸缓冲液反应体系(130 mmol·L−1MET溶液、750 μmol·L−1NBT溶液、100 μmol·L−1EDTA-Na2、2 mmol·L−1核黄素和0.5 mL酶液),反应混合液在4000 lx日光灯下反应5 min后,在560 nm波长测吸光度,以抑制NBT光化还原50%为一个酶活性单位,U·h−1·g−1 FW表示酶活性。
CAT采用3 mL 50 mmo1·L−1 pH7.0磷酸缓冲液反应体系中包含10 mmol·L−1 H2O2和0.5 mL酶液,在240 nm波长测定3 min内吸光度值变化,每克果肉每分钟0.1吸光度值变化为一个酶活性单位,U·min−1·g−1 FW表示酶活性。
1.2.9 多酚含量测定
多酚含量参照KAUR等[18]方法,略有修改。取15个果实,称取1 g左右果实,加入1 mL预冷的60%乙醇,研磨成匀浆后,4 ℃ 10000 r·min−1离心30 min。取0.25 mL上清液分别加入试管中,再加入0.25 mL的福林酚试剂,混合静置3 min后,再加入0.5 mL的12%碳酸钠溶液,摇匀,定容到5 mL,20 ℃下避光2 h,在765 nm下测定吸光度,以mg·g−1 FW表示。
1.2.10 褐变相关酶活性测定
PPO酶活性测定参考ZHANG等[19]方法,略有修改。取15个果实,称量3 g果肉,加入5 mL 50 mmol·L−1、pH5.5乙酸-乙酸钠缓冲液提取缓冲液,冰浴条件下迅速研磨成匀浆,4 ℃ 10000 r·min−1条件下离心15 min,3 mL 50 mmol·L−1 pH5.5乙酸-乙酸钠缓冲液包含1.0 mL 50 mmol·L−1邻苯二酚溶液和0.5 mL酶液,在398 nm波长测定3 min内吸光度值变化,每克果肉每分钟吸光度值变化0.001为1个酶活性单位,U·min−1·g−1 FW表示酶活性。
POD酶活性测定参考YANG等[13]方法,略有修改。取15个果实,称取3 g左右的甜樱桃果肉,加入6 mL pH6.8 100 mmol·L−1磷酸缓冲液(内含1.0 mmol·L−1 EDTA,50 g·L−1 PVP,10 mL·L−1 TritonX-100),在冰浴条件下迅速研磨成匀浆,之后4 ℃ 10000 r·min−1离心15 min,取上清液为待测酶液。3 mL 50 mmo1·L−1 pH7.0磷酸缓冲液反应体系(包含10 mmol·L−1 H2O2、10 mmol·L−1愈创木酚和0.3 mL酶液),在470 nm波长测定3 min内吸光度值变化,每克果肉每分钟吸光度值变化0.001为1个酶活性单位,U·min−1·g−1 FW表示酶活性。
苯丙氨酸氨裂合酶(PAL)酶活性的测定参考ASSIS等[20]方法测定,略有修改。取15个果实,称取2.0 g果肉,加入5.0 mL 50 mmol·L−1 pH8.8硼酸缓冲液(内含5.0 mmol·L−1巯基乙醇,1.0 mmol·L−1EDTA-Na2,5%甘油,5% PVP),在冰浴条件下研磨匀浆,于4 ℃10000 r·min−1,离心15min,取上清液为待测酶液。3 mL pH8.8 0.1 mol·L−1硼酸盐缓冲液反应体系包含0.5 mL 20 mmol·L−1 L-苯丙氨酸,在37 ℃下预热10 min,加入0.3 mL酶液,混匀并将反应管在37 ℃下保温60 min,之后迅速加入0.1 mL 6 mmol·L−1浓盐酸终止反应,并在290 nm处测定吸光度值。每克果肉每分钟吸光度值变化0.001为1个酶活性单位,以U·min−1·g−1 FW表示酶活性。
1.3 数据处理
采用SAS8.0统计软件进行数据分析,用平均值±标准误(SE)表示结果,采用最小显著极差法检验差异显著性,差异显著水平为0.05。同时,利用Excel和Origin2017软件做图。
2. 结果与分析
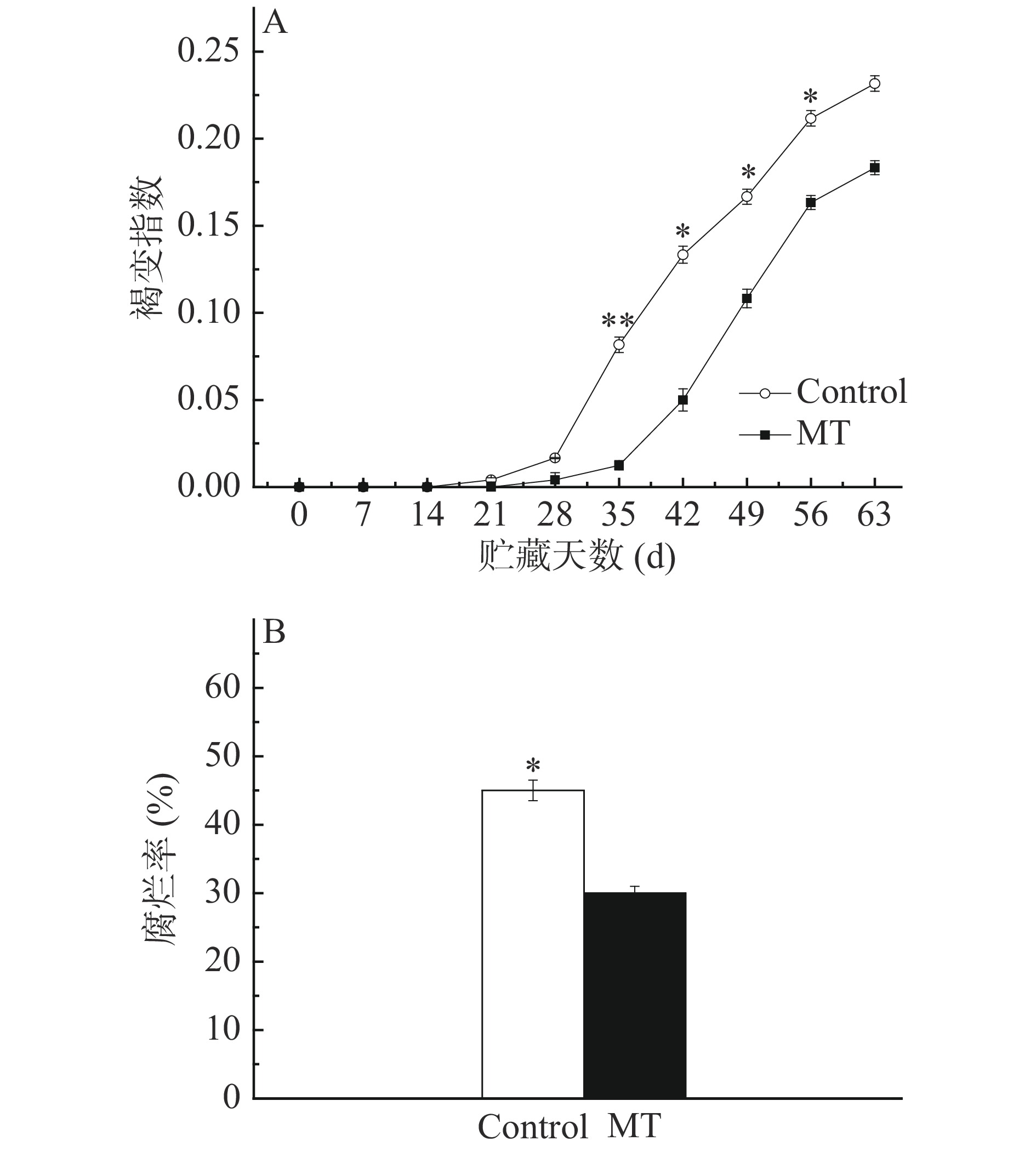
2.1 外源MT处理对甜樱桃果实褐变指数和腐烂率的影响
褐变不仅影响果蔬的商品价值,也降低了果蔬的内在品质。由图1A可知,甜樱桃果实在低温贮藏过程中褐变指数整体呈上升趋势,在贮藏前14 d果实都没有发现褐变症状,对照果实21 d先表现出褐变症状,且褐变指数上升较快。MT处理果实在冷藏的28 d后表现出褐变症状,35 d至贮藏结束其褐变指数显著低于对照(P<0.05),贮藏结束时其褐变指数比对照降低20.9%。
由图1B可知,贮藏结束时MT处理果实的腐烂率比对照显著降低33.3%(P<0.05)。说明MT可抑制果实腐烂,这与褪黑素在猕猴桃中的研究结果相一致[21]。MT抑制果实腐烂作用可能与其抑菌作用有关,其作用机理有待于进一步研究。
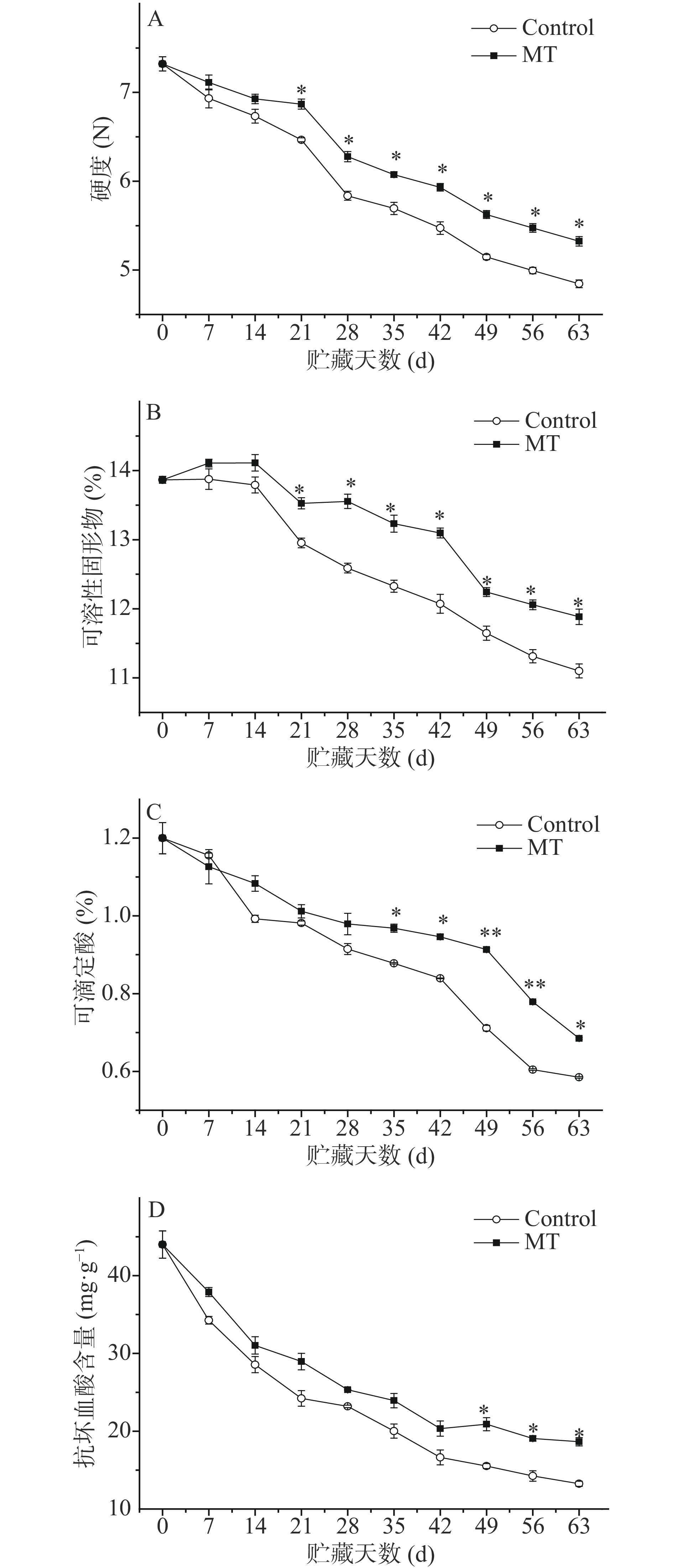
2.2 外源MT处理对甜樱桃果实品质的影响
果实硬度、可溶性固形物、可滴定酸、抗坏血酸含量是甜樱桃果实品质的重要指标,其值大小能够反映果实品质的好坏。由图2A可知,甜樱桃果实硬度整体呈下降趋势,MT处理可抑制硬度下降,21 d至贮藏结束与对照差异达显著水平(P<0.05),贮藏结束时其硬度比对照提高9.9%。
由图2B可知,可溶性固形物含量呈现先上升后下降趋势。对照果实可溶性固形物含量下降最快,MT处理抑制其下降,21 d至贮藏结束与对照差异达显著水平(P<0.05),贮藏结束时其含量比对照提高7.1%。
可滴定酸是影响果蔬品质的重要因素之一。由图2C可知,可滴定酸含量在低温贮藏过程中整体呈下降趋势。MT处理可抑制可滴定酸含量下降,35 d至贮藏结束与对照差异达显著水平(P<0.05),贮藏结束时其含量比对照提高17.1%。
由图2D可知,抗坏血酸含量呈降低趋势,对照果实的抗坏血酸含量下降较快,MT处理可抑制其下降,49 d至贮藏结束与对照差异达显著水平(P<0.05),贮藏结束时其含量比对照提高40.8%。
MT处理抑制硬度、可滴定酸、可溶性固形物和抗坏血酸含量下降,保持了良好的品质,可能与MT延缓果实衰老,抑制营养成分分解有关,这与褪黑素在水蜜桃[9]、鲜切梨[22]等果实的研究结果一致。
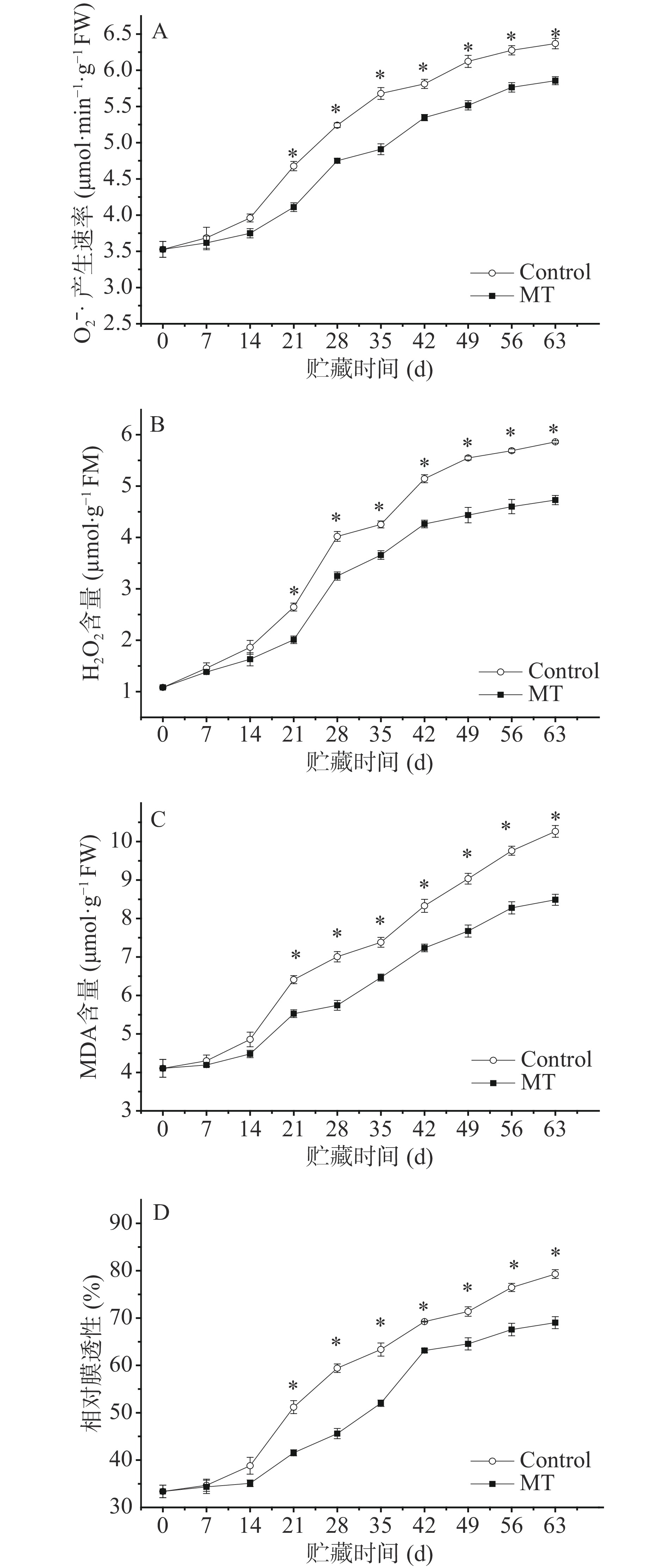
2.3 外源MT处理对甜樱桃果实O2−·、H2O2、MDA含量和相对膜透性的影响
由图3A可知,O2−·产生速率总体呈上升趋势。MT处理抑制其上升趋势,其O2−·始终低于对照(P<0.05),21 d至贮藏结束与对照差异均达显著水平(P<0.05)。
由图3B可知,H2O2含量总体呈上升期趋势。MT处理抑制其上升趋势,其H2O2含量始终低于对照(P<0.05),21 d至贮藏结束与对照差异均达显著水平(P<0.05)。
MDA是膜脂过氧化作用的主要产物之一。由图3C可知,丙二醛含量总体呈上升趋势。MT处理抑制其上升趋势,其含量始终显著低于对照(P<0.05),21 d至贮藏结束与对照差异均达显著水平(P<0.05)。
相对膜透性的高低反映了细胞膜的完整程度和稳定性。由图3D可知,相对膜透性整体呈上升趋势。MT处理果实相对膜透性始终低于对照(P<0.05),21 d至贮藏结束与对照差异均达显著水平(P<0.05)。
O2−·和H2O2等活性氧是果蔬细胞正常代谢副产物,在衰老和低温逆境等条件下,活性氧代谢会失衡,过量的活性氧会攻击细胞膜,导致细胞膜脂化,促使细胞膜脂过氧化产物MDA积累和细胞膜相对透性提高,从而破坏膜结构,打破了细胞区域化结构,促使底物和酶大量接触,引起果实褐变[22]。因而O2−·、H2O2、MDA和细胞膜相对透性变化可以作为甜樱桃果实衰老褐变重要指标。结合O2−·、H2O2、MDA和细胞膜相对透性变化,可以看出MT处理降低活性氧,减少细胞膜脂过氧化产物MDA积累和细胞膜相对透性的提高,保持细胞膜完整性,从而促使底物和酶分布于细胞不同区域,抑制褐变发生。这与外源MT抑制荔枝[23]、双孢菇[24-25]等果蔬褐变结果一致。
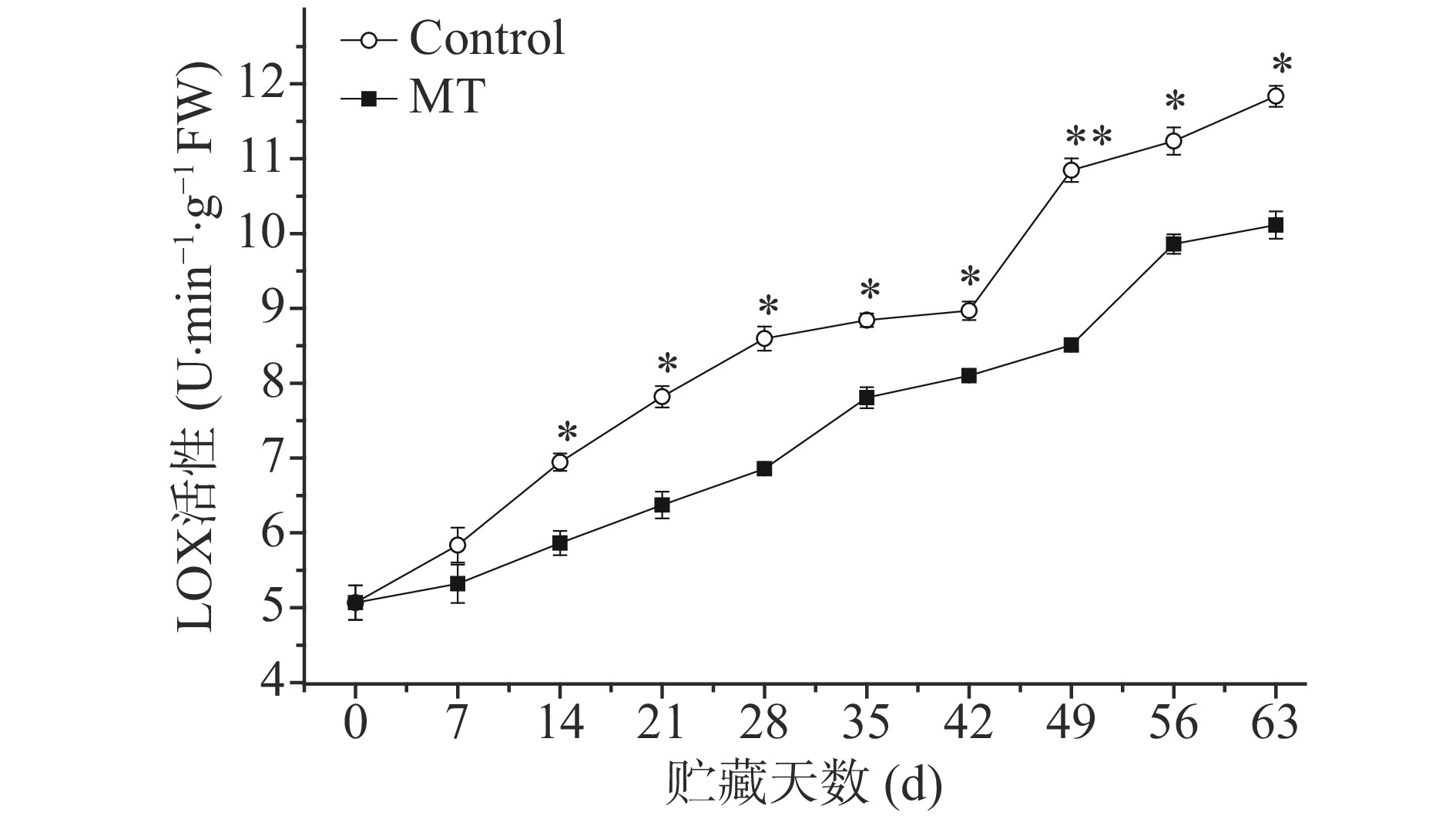
2.4 外源MT处理对甜樱桃果实LOX活性的影响
由图4可知,冷藏过程中LOX酶活性呈上升趋势。MT处理抑制其上升趋势,14 d至贮藏结束与对照差异达显著水平(P<0.05)。
LOX以多不饱和脂肪酸为底物,催化膜脂过氧化,从而降低脂质不饱和度,改变细胞膜流动性,打破细胞膜区室化,为酚类底物和褐变相关酶接触提供了条件,促使褐变发生。因而LOX酶可作为甜樱桃果实衰老褐变的一个重要指标。结合LOX酶活性变化,可以看出MT处理降低了LOX酶活性,抑制了膜脂过氧化进程,保护了细胞膜结构和功能的完整性,从而促使底物和酶分布于细胞不同区域,抑制褐变发生。本研究结果与JANNATIZADEH[26]使用100 μmol·L−1外源褪黑素处理石榴的实验结果基本一致,说明外源褪黑素可以显著降低采后甜樱桃的LOX酶活性(P<0.05),从而抑制甜樱桃果实衰老褐变。
2.5 外源MT对甜樱桃果实SOD和CAT活性的影响
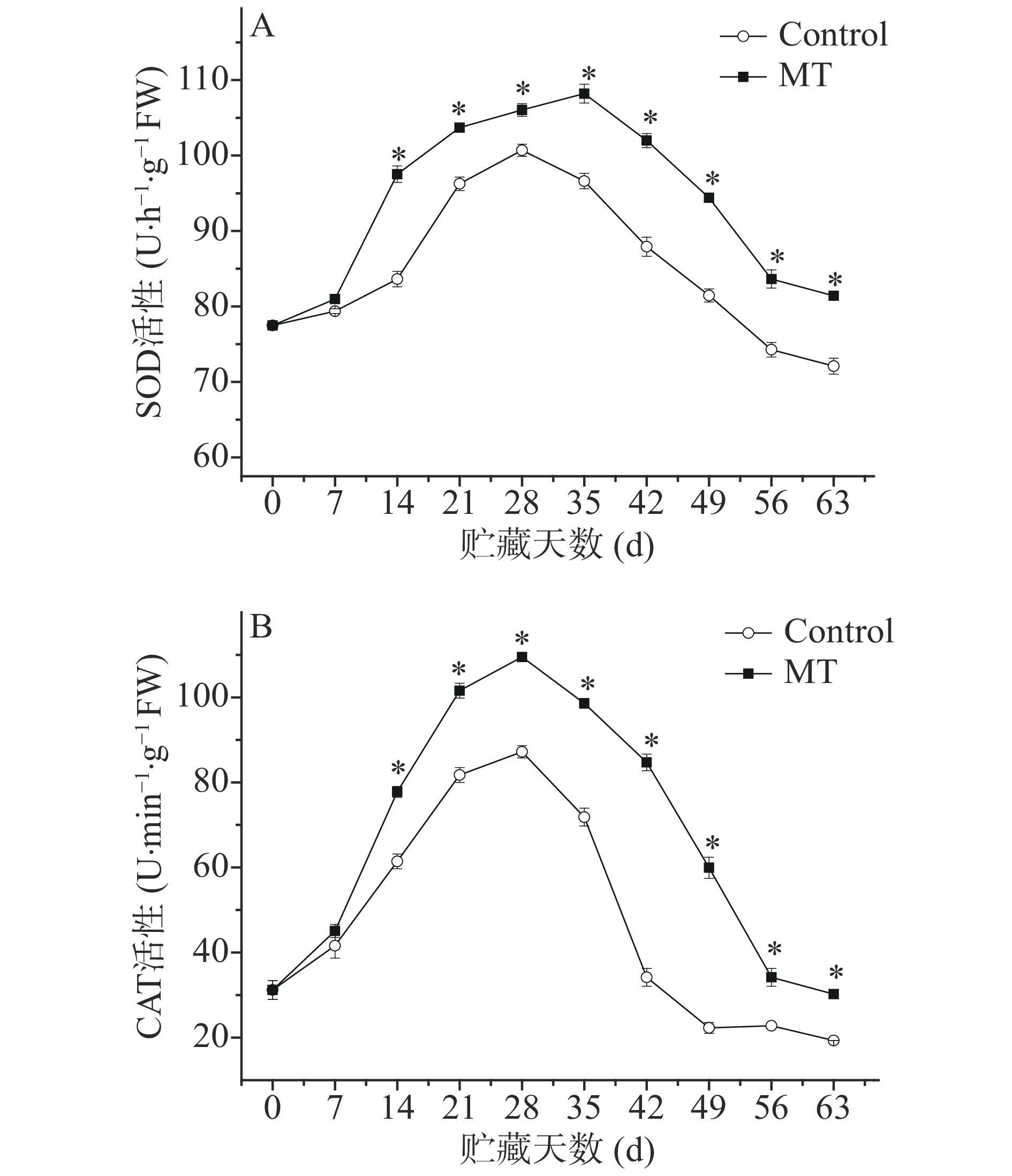
SOD活性可以清除细胞中多余的超氧阴离子自由基,防止对细胞膜造成伤害。由图5A可知,SOD活性呈现先上升后下降。MT处理促进SOD活性上升抑制其下降,贮藏过程中其活性始终高于对照,14 d至贮藏结束与对照差异达显著水平(P<0.05)。
由图5B所示,CAT活性呈先上升后下降的变化趋势。MT处理促进CAT活性上升抑制其下降,贮藏过程中其活性始终高于对照,14 d至贮藏结束与对照差异达显著水平(P<0.05)。
SOD酶可歧化O2−·成H2O2,CAT酶进而将H2O2清除出去,从而减少对细胞膜脂过氧化作用,保护细胞膜结构与功能完整性[27]。因此SOD和CAT酶活性是反映果蔬衰老和死亡的一个重要指标。本研究结果与乔沛等[10]使用50 μmol·L−1外源褪黑素处理荔枝的实验结果基本一致,说明外源褪黑素可以显著提高采后甜樱桃的SOD和CAT酶活性。
2.6 外源MT处理对甜樱桃果实多酚含量的影响
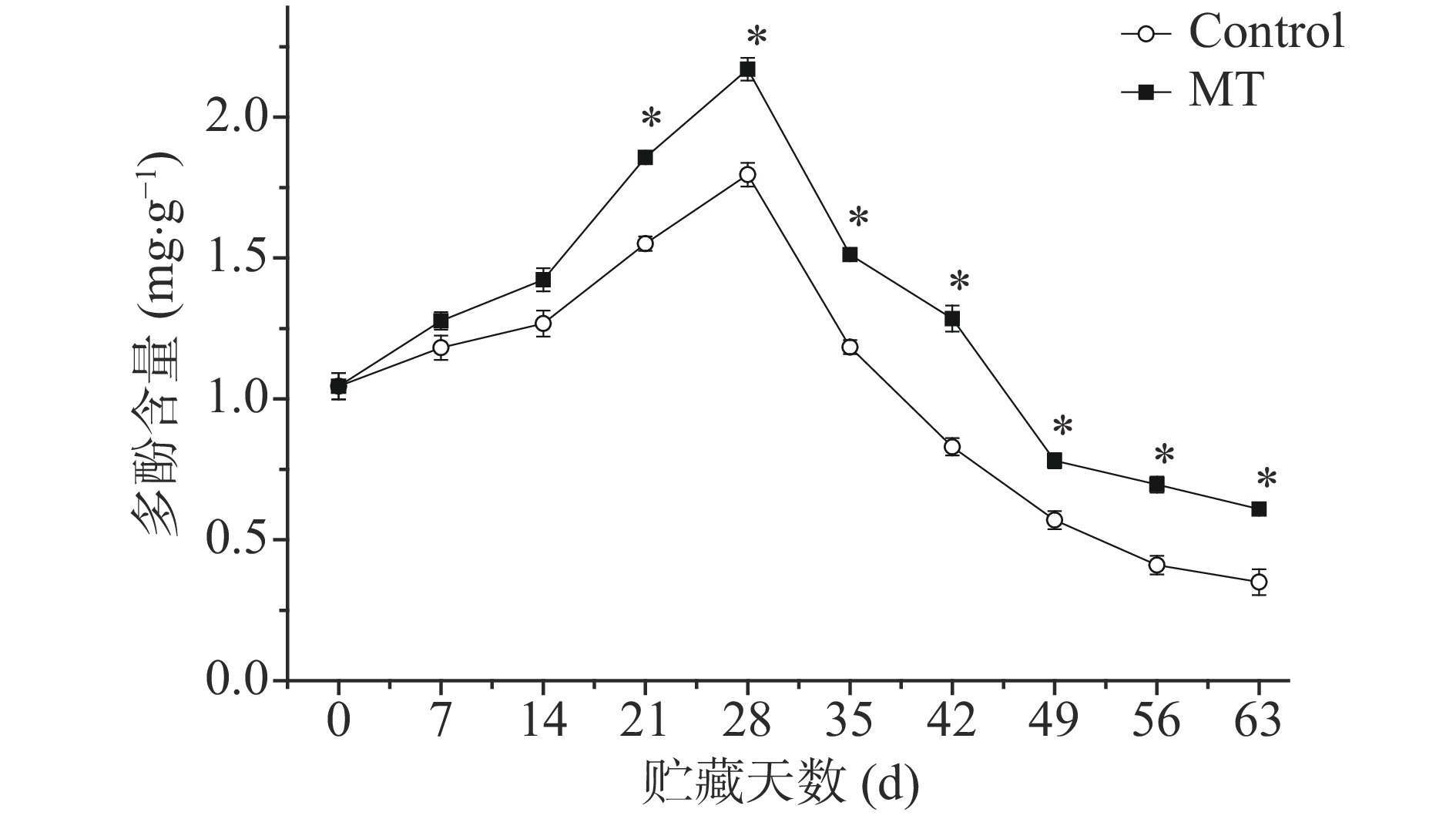
由图6可知,甜樱桃在冷藏过程中多酚含量呈先上升后下降的趋势。MT处理可促进其上升抑制其下降,其含量始终高于对照,21 d至贮藏结束与对照差异达显著水平(P<0.05)。
多酚是果蔬中重要的抗氧化物质,可提高果蔬的抗逆性和抗病性,同时可被氧化成有色素物质而导致褐变发生[28]。褐变底物多酚含量的多少可反映果蔬褐变发生的程度。褐变底物多酚含量越高,说明褐变发生的程度越轻。结合多酚含量变化可以看出,MT处理促进多酚含量上升并抑制其下降,使其含量保持在较高水平,说明MT处理的甜樱桃果实褐变发生程度较轻。这与外源MT抑制南果梨[29]褐变结果一致。
2.7 外源MT处理对甜樱桃果实褐变相关酶活性的影响
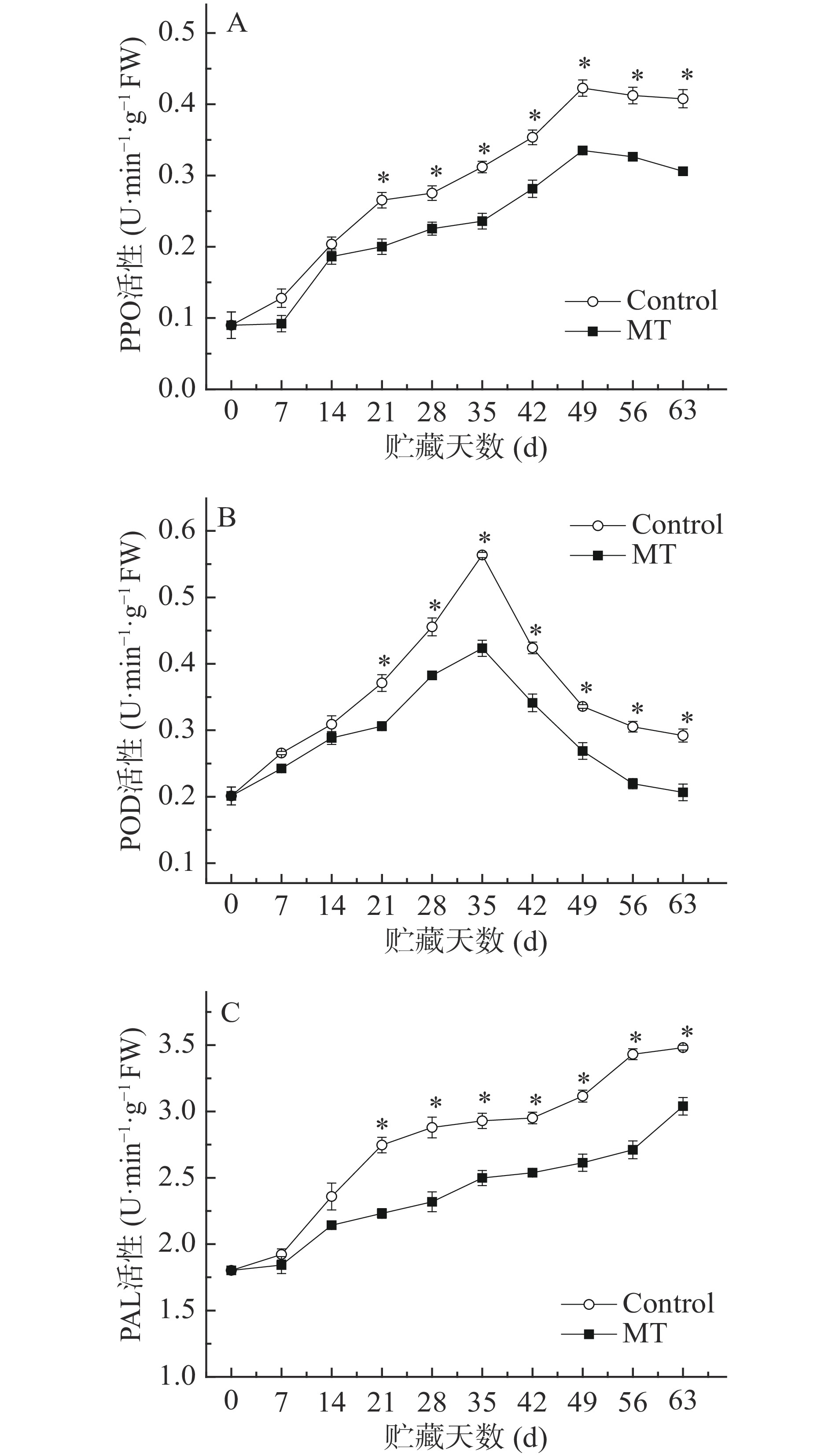
PPO能将多酚类物质氧化成醌而引起果蔬褐变。由图7A可知,甜樱桃在冷藏过程中PPO酶活性呈先上升后下降的趋势。MT处理抑制PPO酶活性上升促进其下降,其活性始终低于对照,21 d至贮藏结束与对照差异达显著水平(P<0.05)。
POD能催化过氧化物对酚类物质的氧化。由图7B可知,甜樱桃果实在冷藏过程中POD酶活性在0~35 d间呈上升趋势,在35 d之后呈现迅速下降。MT酶活性都低于对照,21 d至贮藏结束与对照差异达显著水平(P<0.05)。
PAL能将该代谢途径的中间产物及进一步转化的酚类类黄酮物质氧化成褐色物质。由图7C可知,在冷藏过程中PAL酶活性的呈上升趋势,MT处理抑制PAL酶活性上升,21 d至贮藏结束与对照差异达显著水平(P<0.05)。
酚类物质酶促氧化是果实发生褐变的关键。PPO、PAL和POD是引起果实酶促褐变的关键酶[30-31]。这些酶能将果实中的酚类物质氧化为颜色更深的醌类物质,从而导致果实组织发生褐变。因而PPO、PAL和POD酶可以作为甜樱桃果实衰老褐变的重要指标。结合PPO、PAL和POD酶活性变化,可以看出MT处理降低了PPO、PAL和POD酶活性,抑制褐变发生。相似的有关外源MT抑制PAL、PPO和POD酶活性而抑制褐变已在水蜜桃[9]和香蕉[32]等果蔬中证实。但对于褪黑素处理是如何抑制褐变相关酶活性及保持较高多酚含量,其调控褐变的分子机理尚不十分清楚,有待于进一步研究。
3. 结论
褪黑素是一种重要的吲哚胺激素,具有延缓衰老,提高抗逆性等作用,近年来己广泛应用于猕猴桃、荔枝、香蕉、梨、黄瓜、番茄等果蔬保鲜中。本试验结果显示外源褪黑素处理能够显著(P<0.05)抑制褐变指数上升,降低了33.3%腐烂率,并显著(P<0.05)延缓了硬度、可滴定酸、可溶性固形物和抗坏血酸含量的下降。说明褪黑素在抑制甜樱桃果实褐变,保持果实营养品质方面发挥着重要作用。MT处理还可提高SOD和CAT酶活性,抑制LOX酶活性上升,并降低O2−·和H2O2积累,显著减少膜脂过氧化产物MDA和相对膜透性的增加(P<0.05)。同时,MT处理抑制POD、PPO、PAL酶活性,并保持较高多酚含量,最终抑制甜樱桃果实褐变。MT处理抑制甜樱桃果实褐变可能与提高抗氧化酶活性,降低膜脂过氧化程度,保持细胞膜结构完整性和抑制褐变相关酶活性密切相关。本研究结果将为褪黑素抑制非跃变型果蔬衰老褐变提供重要理论参考,又因褪黑素价格便宜、操作简单,无毒副作用,因而具有广阔的应用前景。
-
-
[1] FUENTEALBA C, EJSMENTEWICZ T, CAMPOS-VARGAS R, et al. Cell wall and metabolite composition of sweet cherry fruits from two cultivars with contrasting susceptibility to surface pitting during storage[J]. Food Chemistry,2021,342:128307. doi: 10.1016/j.foodchem.2020.128307
[2] ÖZTÜRK B, AĞLAR E, KARAKAYA O, et al. Effects of preharvest GA3, CaCl2 and modified atmosphere packaging treatments on specific phenolic compounds of sweet cherry[J]. Turkish Journal of Food and Agriculture Sciences,2019,1(2):44−56.
[3] LIU X, JI D, CUI X, et al. p-Coumaric acid induces antioxidant capacity and defense responses of sweet cherry fruit to fungal pathogens[J]. Postharvest Biology and Technology,2020,169:111297. doi: 10.1016/j.postharvbio.2020.111297
[4] 周慧, 王云香, 王愈, 等. EBR处理对甜樱桃果实褐变及相关酶基因表达的影响[J]. 华北农学报, 2020, 35 (增刊): 24−30. ZHOU H, WANG Y X, WANG Y, et al. Effect of EBR treatment on fruit browning and related enzyme gene expression in sweet cherry[J]. Acta Agriculturae Boreali-Sinica, 2020, 35 (supplementary issue): 24−30.
[5] AGHDAM M S, LUO Z, LI L, et al. Melatonin treatment maintains nutraceutical properties of pomegranate fruits during cold storage[J]. Food Chemistry,2020,303:125385. doi: 10.1016/j.foodchem.2019.125385
[6] TIWARI R K, LAL M K, NAGA K C, et al. Emerging roles of melatonin in mitigating abiotic and biotic stresses of horticultural crops[J]. Scientia Horticulturae,2020,272:109592. doi: 10.1016/j.scienta.2020.109592
[7] BOSE S K, HOWLADER P. Melatonin plays multifunctional role in horticultural crops against environmental stresses: A review[J]. Environmental and Experimental Botany,2020,176:104063. doi: 10.1016/j.envexpbot.2020.104063
[8] TAN D X. Melatonin and plants[J]. Journal of Experimental Botany,2015,66(3):625−625. doi: 10.1093/jxb/eru523
[9] 千春录, 朱芹, 高珊, 等. 外源褪黑素处理对采后水蜜桃冷藏品质及冷害发生的影响[J]. 江苏农业学报,2020,36(3):702−708. [QIAN C L, ZHU Q, GAO S, et al. Effects of exogenous melatonin treatment on cold storage quality and chilling injury of postharvest peach fruit[J]. Jiangsu Journal of Agricultural Science,2020,36(3):702−708. doi: 10.3969/j.issn.1000-4440.2020.03.024 [10] 乔沛, 殷菲胧, 王雨菲. 等. 外源褪黑素处理对采后荔枝褐变及活性氧代谢的影响[J]. 食品工业科技,2021,42(6):281−287. [QIAO P, YIN F L, WANG Y F, et al. Effects of exogenous melatonin on browning and active oxygen metabolism of postharvest litchi[J]. Science and Technology of Food Industry,2021,42(6):281−287. [11] WANG T, HU M, YUAN D, et al. Melatonin alleviates pericarp browning in litchi fruit by regulating membrane lipid and energy metabolisms[J]. Postharvest Biology and Technology,2020,160:111066. doi: 10.1016/j.postharvbio.2019.111066
[12] 杨青珍, 王锋. PVP对大久保桃品质及贮藏效果的影响[J]. 食品科学,2016(14):264−269. [YANG Q Z, WANG F. Effect of polyvinyl pyrrolidone on the quality and browning of ‘okubo’ peach fruits during storage[J]. Food Science,2016(14):264−269. doi: 10.7506/spkx1002-6630-201614048 [13] YANG Q, WANG F, RAO J. Effect of putrescine treatment on chilling injury, fatty acid composition and antioxidant system in kiwifruit[J]. PLoS One,2016,11(9):e0162159. doi: 10.1371/journal.pone.0162159
[14] 高俊凤. 植物生理学实验指导[M] 北京: 高等教育出版社, 2006. GAO J F. Plant physiology experiment guidance[M]. Beijing: Higher Education Press, 2006.
[15] YANG Q, ZHANG Z, RAO J, et al. Low‐temperature conditioning induces chilling tolerance in ‘Hayward’ kiwifruit by enhancing antioxidant enzyme activity and regulating enogenous hormones levels[J]. Journal of the Science of Food and Agriculture,2013,93(15):3691−3699. doi: 10.1002/jsfa.6195
[16] DHINDSA R S, PLUMB-DHINDSA P, THORPE T A. Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase[J]. Journal of Experimental Botany,1981,32(1):93−101. doi: 10.1093/jxb/32.1.93
[17] DING Y, ZHU Z, ZHAO J, et al. Effects of postharvest brassinolide treatment on the metabolism of white button mushroom (Agaricus bisporus) in relation to development of browning during storage[J]. Food and Bioprocess Technology,2016,9(8):1327−1334. doi: 10.1007/s11947-016-1722-1
[18] KAUR C, KAPOOR H C. Anti-oxidant activity and total phenolic content of some Asian vegetables[J]. International Journal of Food Science & Technology,2002,37(2):153−161.
[19] ZHANG Z, ZHANG Y, HUBER D J, et al. Changes in prooxidant and antioxidant enzymes and reduction of chilling injury symptoms during low-temperature storage of ‘Fuyu’ persimmon treated with 1-methylcyclopropene[J]. HortScience,2010,45(11):1713−1718. doi: 10.21273/HORTSCI.45.11.1713
[20] ASSIS J S, MALDONADO R, MUÑOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology,2001,23(1):33−39. doi: 10.1016/S0925-5214(01)00100-4
[21] 胡苗, 李佳颖, 饶景萍. 褪黑素处理对采后猕猴桃果实后熟衰老的影响[J]. 食品科学,2018,39(19):226−232. [HU M, LI J Y, RAO J P. Effect of melatonin on ripening and senescence of postharvest kiwifruits[J]. Food Science,2018,39(19):226−232. doi: 10.7506/spkx1002-6630-201819035 [22] ZHENG H, LIU W, LIU S, et al. Effects of melatonin treatment on the enzymatic browning and nutritional quality of fresh-cut pear fruit[J]. Food Chemistry,2019,299:125116. doi: 10.1016/j.foodchem.2019.125116
[23] ZHANG Y, HUBER D J, HU M, et al. Delay of postharvest browning in litchi fruit by melatonin via the enhancing of antioxidative processes and oxidation repair[J]. Journal of Agricultural and Food Chemistry,2018,66(28):7475−7484. doi: 10.1021/acs.jafc.8b01922
[24] SHEKARI A, HASSANI R N, AGHDAM M S, et al. The effects of melatonin treatment on cap browning and biochemical attributes of Agaricus bisporus during low temperature storage[J]. Food Chemistry,2021,348:129074. doi: 10.1016/j.foodchem.2021.129074
[25] LI L, KITAZAWA H, ZHANG X, et al. Melatonin retards senescence via regulation of the electron leakage of postharvest white mushroom (Agaricus bisporus)[J]. Food Chemistry,2021,340:127833. doi: 10.1016/j.foodchem.2020.127833
[26] JANNATIZADEH A. Exogenous melatonin applying confers chilling tolerance in pomegranate fruit during cold storage[J]. Scientia Horticulturae,2019,246:544−549. doi: 10.1016/j.scienta.2018.11.027
[27] WANG F, ZHANG X, YANG Q, et al. Exogenous melatonin delays postharvest fruit senescence and maintains the quality of sweet cherries[J]. Food Chemistry,2019,301:125311. doi: 10.1016/j.foodchem.2019.125311
[28] YANG Q, ZHANG X, WANG F, et al. Effect of pressurized argon combined with controlled atmosphere on the postharvest quality and browning of sweet cherries[J]. Postharvest Biology and Technology,2019,147:59−67. doi: 10.1016/j.postharvbio.2018.09.007
[29] VERDE A, MÍGUEZ J M, GALLARDO M. Melatonin and related bioactive compounds in commercialized date palm fruits (Phoenix dactylifera L.): Correlation with some antioxidant parameters[J]. European Food Research and Technology,2019,245(1):51−59. doi: 10.1007/s00217-018-3139-8
[30] SUPAPVANICH S, PROMYOU S. Efficiency of salicylic acid application on postharvest perishable crops[M]. New York: Springer Publication, 2013.
[31] 宋晓雪, 胡文忠, 毕阳, 等. 鲜切果蔬酶促褐变关键酶的研究进展[J]. 食品工业科技,2013,34(15):390−392. [SONG X X, HU W Z, BI Y, et al. Research progress in key enzymes for enzymatic browning of fresh-cut fruits and vegetables[J]. Science and Technology of Food Industry,2013,34(15):390−392. [32] WANG Z, PU H, SHAN S, et al. Melatonin enhanced chilling tolerance and alleviated peel browning of banana fruit under low temperature storage[J]. Postharvest Biology and Technology,2021,179:111571. doi: 10.1016/j.postharvbio.2021.111571
-
期刊类型引用(3)
1. 王玉净,都治香,张霞,王旭,王娜. 沙棘黄酮通过调控TLR4/NF-κB信号通路改善大鼠多囊卵巢综合征的作用. 食品工业科技. 2024(16): 340-347 .  本站查看
本站查看
2. 王杰,常晨城,杨彦达,郭丽丽,张景萍,付绍印,石彩霞,张文广. 黄酮在反刍动物生产中的应用研究进展. 饲料研究. 2023(12): 144-147 .  百度学术
百度学术
3. 陈美庆,朱卫丰,管咏梅,冯育林,张艳丽,景秀村,彭万钱,欧阳辉,李琼. 基于UPLC-Q-TOF-MS/MS技术分析葛根配方颗粒的化学成分. 中国实验方剂学杂志. 2023(19): 176-186 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:
 下载:
下载:



