Spatial Distribution and Relationship of Volatile Compounds and Microbial Community in Pit Mud
-
摘要: 为了研究窖泥中的微生物和挥发性物质的空间分布规律,本文采用固相微萃取法偶联气相色谱-质谱联用法对窖泥中的主要挥发性物质成分进行定性定量分析,并利用Illumina MiSeq测序分析窖泥中的微生物群落组成。结果表明,窖泥中的挥发性物质成分主要以酯类和酸类物质为主,占比达到73.01%~98.36%,随着窖池深度的增加而不断增加。窖泥样品中的原核微生物共检出10门,15纲,21目,42科,64属,门水平上优势菌群占细菌总数的98.86%~99.93%,厚壁菌门为绝对优势菌群。Shannon指数从2.130增加到4.970,Simpson指数从0.557增加到0.932,ACE指数和Chao1指数在池底部最高,分别为114.523和114.50。α-多样性表明,池壁下部和池底部窖泥中的微生物菌群丰度和多样性高于池壁上部和中部,这与挥发性物质的种类和含量分布规律相吻合。梭菌属和甲烷菌属等优势菌属是进行微生物代谢和种间物质交换、产生重要香气物质及其前体的主要微生物,并随着空间深度的增加,不断反应和富集,形成与窖泥的空间位置密切相关的规律。空间差异性是导致窖泥不同空间位置原核微生物菌群和挥发性物质成分存在差异性的重要原因。Abstract: In order to study the spatial distribution of microorganisms and volatile compounds in pit mud, solid phase microextraction (SPME) coupled with gas chromatography-mass spectrometry (GC-MS) was used to qualitatively and quantitatively analyze the main volatile compounds in pit mud, and Illumina MiSeq sequencing was used to analyze the composition of microbial community in pit mud. The results of the study showed that the volatile components in the pit mud were mainly esters and acids, accounting for 73.01% to 98.36%, and they continued to increase with the increase of the depth of the pit. A total of 10 phyla, 15 classes, 21 orders, 42 families, and 64 genera of prokaryotic microorganisms were detected in the pit mud samples. The dominant flora accounted for 98.86%~99.93% of the total number of bacteria at the phylum level, and Firmicutes was the absolute dominant flora. The Shannon index increased from 2.130 to 4.970, the Simpson index increased from 0.557 to 0.932, and the ACE index and Chao1 index were the highest at the bottom of the pool, at 114.523 and 114.50, respectively. Results of α-diversity indicated that the abundance and diversity of microbial flora in the lower part of the pool wall and pit mud at the bottom of the pool were higher than that in the upper and middle parts of the pool wall, which was consistent with the type and content distribution of volatile substances. Dominant bacteria such as Clostridium and Methanobacter were the main microorganisms which could carry out microbial metabolism and inter-species material exchange, and produce important aroma substances and their precursors. As the depth of space increased, they continued to react and accumulate, closely related to spatial location of the mud. Spatial difference was an important reason for the differences in the composition of prokaryotic microbes and volatile substances in different spatial locations of pit mud.
-
窖池是浓香型白酒的发酵装置,其中窖泥的质量决定了浓香型白酒的品质[1-2]。在浓香型白酒发酵的过程中,窖泥中栖息的微生物在糟醅与窖泥接触的界面长期接触与反应,进行物质交换,进而产生各种香气成分[3-4]。研究窖泥不同空间位置微生物分布与香气成分的构成对深入理解窖泥在浓香型白酒生产中的作用具有重要意义。
窖泥中的挥发性物质的含量是表征窖泥优劣的一项重要指标,是与糟醅相互交换的物质基础。顶空固相微萃取(head-space solid-phase microextraction, HS-SPME)偶联气质联用法(gas-chromatography mass spctromrtry, GC-MS)具有操作简便、结果易于处理等优点,近年来在窖泥和酒糟中挥发性物质的研究上应用广泛[5-6]。对糟醅中香气成分的空间分布研究发现,同层糟醅中距离窖泥越近的部分酯类和酸类含量越高,且呈逐步递减趋势,而醇类和醛酮类香气成分的含量并未因空间位置的不同而呈现出显著的差异[5],表明糟醅酯类和酸类的形成和窖泥相关,而醇类和醛酮类的形成和窖泥关系不大。另一项研究表明窖泥中有机酸含量随窖池深度的加深而增加[6],结果和糟醅中的有机酸含量变化一致。对五粮液窖池中的窖泥和对应位置的出窖糟醅的香气成分进行定性定量分析,发现窖泥和对应的窖边糟中的优势香气成分高度相似,进一步研究发现窖边糟中香气成分含量显著高于中心糟,表明窖泥和窖边糟在白酒发酵过程中一直在相互作用,发生物质交换。
窖泥微生物中的优势菌群是维持窖泥微生物网络结构稳定、维持微生态平衡、进行微生物代谢和种间物质交换、产生重要香气物质及其前体的主要微生物,并随着空间深度的增加,不断反应和富集,形成与窖泥的空间位置密切相关的规律,进而影响着酒体中的呈香物质组成。窖泥中微生物群落的组成受空间分布的影响,与窖泥所在的空间位置密切相关。利用16S rRNA基因克隆文库技术分析了窖池上、中、底三个不同部位的窖泥中原核微生物,发现上层窖泥中微生物群落组成较为单一,中层和底层较为丰富[7];高通量测序技术解析窖泥中微生物群落的多样性,同样得出在上部和下部的窖泥之间微生物群落组成存在差异的结论[8]。这些研究均表明,窖池中不同部位的窖泥中微生物组成的差异和窖泥中挥发性成分含量,尤其是与酸类和酯类的含量特别相关。
本研究以浓香型白酒窖池中不同空间位置的窖泥为研究对象,采取固相微萃取偶联气质联用法,分析不同空间位置的窖泥中挥发性物质的种类及分布规律,利用高通量测序技术分析不同空间位置窖泥中的微生物种类和分布规律,探索微生物分布规律和挥发性风味物质的分布规律之间的关系,以期为研究不同空间位置的窖泥对酒质的影响提供数据支持,为浓香型白酒的实际生产提供指导。
1. 材料与方法
1.1 材料与仪器
窖泥 取自安徽文王酒业老车间窖池3-122,分别取窖池的上部、中部、下部、池底的窖泥,每个部位按照前后左右取四个长约5 cm,直径1.5 cm的圆柱形样品,将四个样品在低温下均匀混合作为一个试样。
手动SPME进样器、50/30 μm DVB/CAR/PDMS Stableflex固相微萃取头 默克Supelco公司;Agilent 7890-5975C气质联用仪 美国安捷伦科技公司。
1.2 实验方法
1.2.1 固相微萃取操作条件
先将萃取头置于气相质谱的进样口处250 ℃老化30 min[9],取窖泥样品5 g置于20 mL顶空采样瓶中,45 ℃恒温水浴中加热平衡30 min,然后顶空吸附萃取60 min,吸附结束后,将萃取头插入GC-MS进样口250 ℃解吸3 min。每个样品重复取样三次分析。
1.2.2 气质联用分析条件
色谱柱:CP-Wax 57 CB(60 m×0.25 mm×0.4 μm);载气:He;恒压:33 cm/s;进样口温度:250 ℃;升温程序:初始温度50 ℃,保持1 min,然后以3 ℃/min 升温速率升至180 ℃,保持1 min;再以8 ℃/min上升至225 ℃,保持3 min。
质谱电离方式:EI;电离能量:70 eV;传输线温度:280 ℃;离子源温度:220 ℃;扫描方式:全扫描(full);质量扫描范围:m/z 33~450 amu;发射电流:100 μA。
1.2.3 窖泥高通量测序分析
将混合好的窖泥样品取样5 g,样品送苏州GENEWIZ生物科技有限公司做高通量测序,分析样品中含有的细菌的种类和数量,所得数据通过软件进行分析。
使用金唯智生物科技公司提供的Magen Hipure Soil DNA Kit试剂盒从窖泥样本中提取DNA,使用Qubit dsDNA HS Assay Kit试剂盒检测DNA浓度。PCR扩增及文库构建,以20~30 ng DNA为模板,使用金唯智生物科技公司设计的一系列PCR引物扩增原核生物16S rDNA上包括V3及V4的2个高度可变区。采用包含"CCTACGGRRBGCASCAGKVRVGAAT”序列的上游引物和包含"GGACTACNVGGGTWTCTAATCC"序列的下游引物扩增V3和V4区。另外,通过PCR向16S rDNA的PCR产物末端加上带有Index的接头,以便进行NGS测序。
PCR反应参数:预变性参数94 ℃ 3 min;变性参数94 ℃ 5 s,退火参数57 ℃ 90 s,延伸72 ℃ 10 s,共进行24个循环;终延伸参数72 ℃ 5 min。PCR扩增结果鉴定:PCR产物用1.5%琼脂糖凝胶电泳检测(表1)。
表 1 PCR扩增条件Table 1. PCR amplification conditionsPCR扩增体系 反应体系(25 μL) TransStart Buffer 2.5 μL dNTPs 2 μL Primers 1 μL×2 TransStart Taq DNA 0.5 μL 模板DNA 20 ng ddH2O 补至总体系25 μL 上机测序,通过Qubit3.0 Fluorometer(Invitrogen, Carlsbad, CA)检测文库浓度。将文库定量到10 nmol/L,按Illumina MiSeq(Illumina, San Diego, CA, USA)仪器说明进行PE250/FE300双端测序,由MiSeq自带的MiAeq Control Software(MCS)读取序列信息。
1.3 数据处理
本文所用数据平行及重复次数均为3次,绘图软件使用R语言和GraphPad Prism 8。
挥发性物质的定性与定量分析利用随机携带工作站,在NIST08和AMDIS标准谱库检索分析各组分质谱数据,确定分离得到的每个峰对应的风味物质,利用面积归一化法计算各组分的相对含量,利用面积加和比较法计算不同空间位置窖泥中的总酸、总酯、总醇、总醛酮及总挥发性物质的相对含量。
使用Bcl2fastq(v2.17.1.14)软件对测序结果原始图像数据进行基本调用,使用CutAdapt(v1.9.1)、Vsearch(1.9.6)和Qiime(1.9.1)软件对测序数据进行质量优化,去除其中的嵌合体序列,得到有效数据。对序列进行归类操作,使用Vsearch(1.9.6)按照97%相似性对unique序列进行OUT聚类,在聚类过程中进一步去除嵌合体序列,将优化后的序列与OUT代表序列进行比对,与OUT代表序列相似性在97%以上的序列为同一OUT[10],统计生成OUT丰富表。根据OUT聚类分析结果,统计不同样本共有和特有的OUT,使用R语言绘制韦恩图。使用RDP classifier贝叶斯算法对97%相似水平的OUT代表序列进行分类学分析[11],得到每个样本在各个水平的群落组成。使用Qiime(1.9.1)软件对有效序列进行随机抽样进行OUT分析,分别计算各α-多样性指数,估计环境群落的物种丰度和多样性。
2. 结果与讨论
2.1 窖池中不同空间位置窖泥中挥发性物质的分析
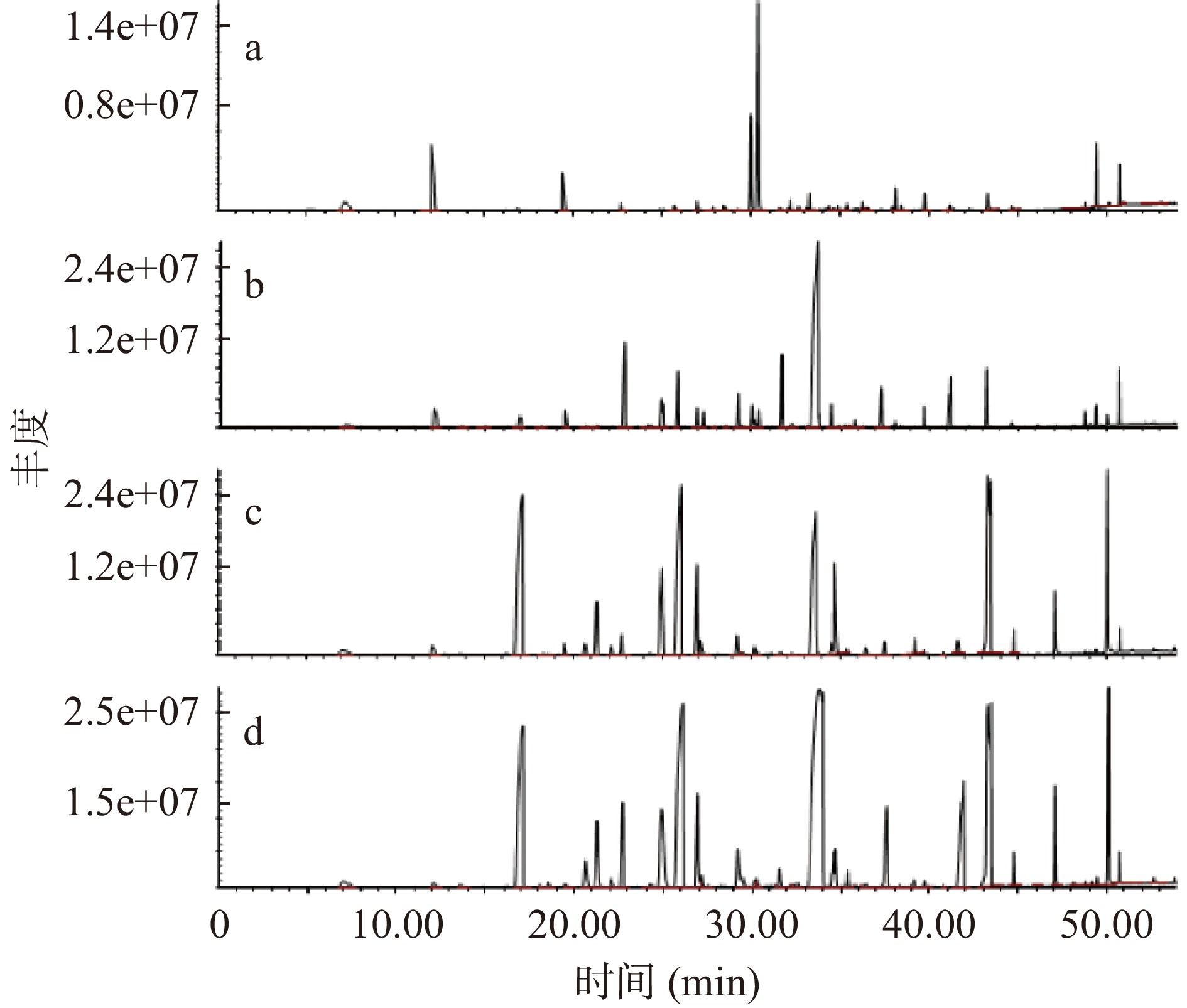
对不同空间位置处的窖泥样品进行分析,总离子流图如图1所示,通过检索谱库NIST08和AMDIS,分析确定窖泥中挥发性物质成分。不同空间位置窖泥中各类挥发性物质成分及相对含量见表2。
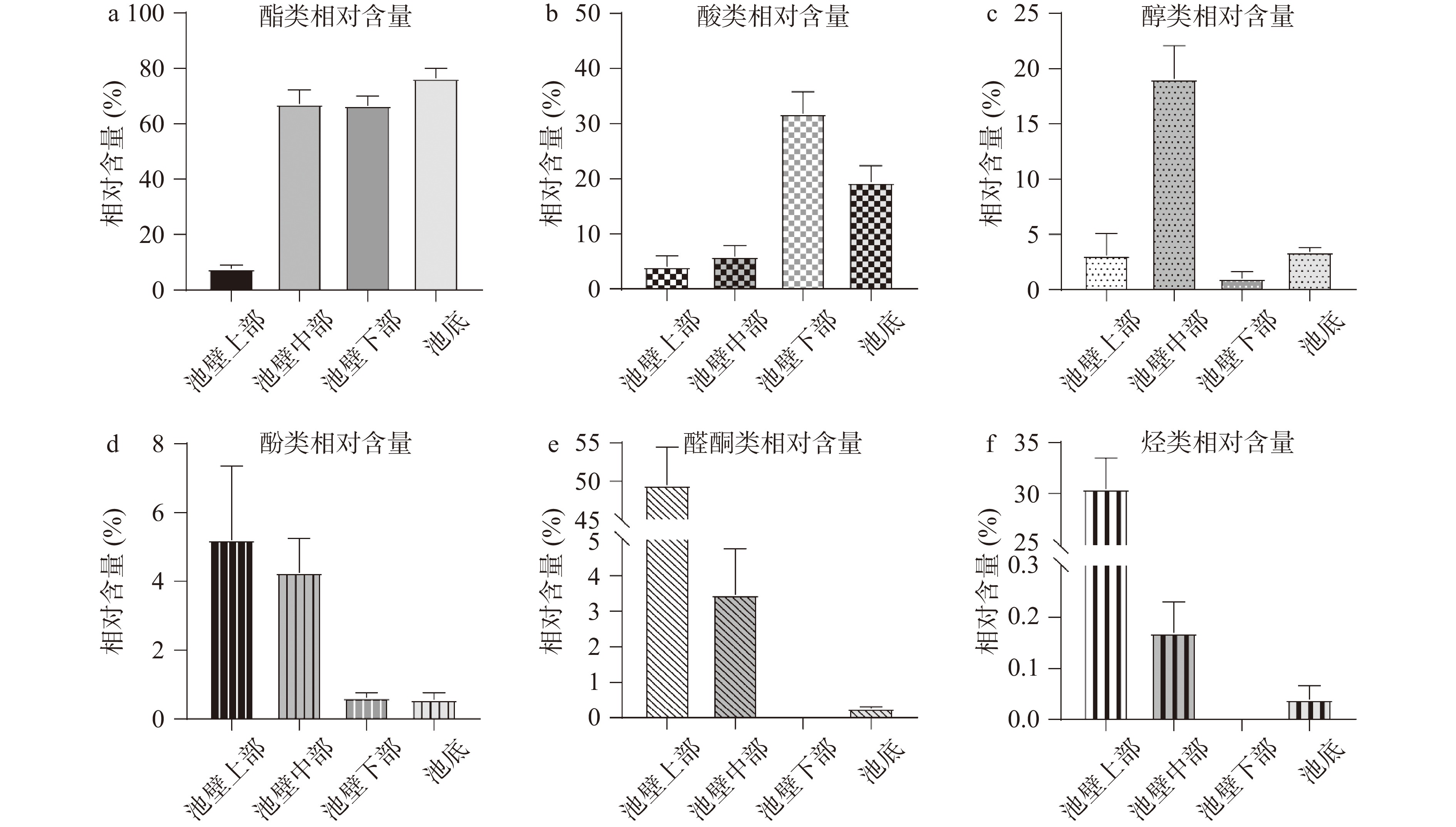
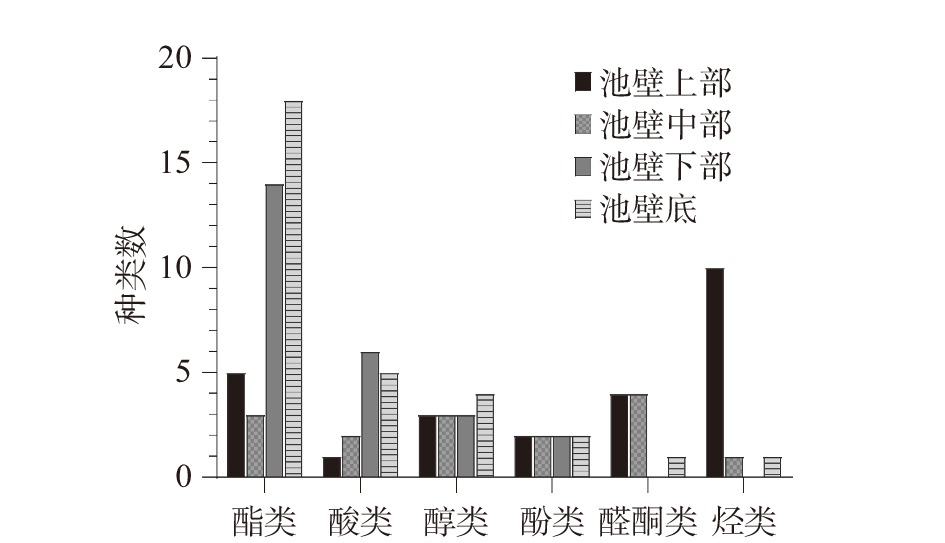
表 2 挥发性物质成分表及相对含量(%)Table 2. Volatile substance composition table and relative content (%)种类 名称 池壁上部 池壁中部 池壁下部 池底 醇类 1-戊醇 0.08 1-己醇 1.39 11.43 0.83 2.72 1-庚醇 1.30 1-辛醇 0.82 6.35 0.12 0.57 苯乙醇 0.06 0.05 1-十三炔-4-醇 0.89 酯类 乙酸己酯 0.17 己酸乙酯 19.94 13.02 己酸丙酯 0.76 1.14 己酸丁酯 6.45 4.88 己酸戊酯 1.01 2.09 己酸己酯 2.70 60.98 14.58 28.62 己酸庚酯 2.78 己酸辛酯 1.32 己酸异戊酯 3.60 2.63 庚酸乙酯 2.64 4.14 辛酸乙酯 1.70 5.43 15.52 14.98 辛酸丙酯 0.14 辛酸辛酯 0.11 壬酸乙酯 0.54 癸酸乙酯 0.60 十四烷酸乙酯 0.06 1-甲基己酸己酯 0.27 2-己酸苯乙酯 0.12 2-甲基己酸丙酯 0.46 0.35 3-甲基辛酸丁酯 0.18 0.35 苯丙酸乙酯 1.36 0.72 0.66 0.60 苯乙酸乙酯 0.08 0.04 酸类 乙酸 0.87 丁酸 4.62 1.70 戊酸 0.67 0.30 己酸 4.08 4.81 17.79 12.26 庚酸 1.95 辛酸 1.07 5.90 4.94 己酸酸酐 0.17 烃类 2,6,6-三甲基-,[1S-(1α,2β,5α)]-双环[3.1.1]庚烷 1.24 5-(1,5-二甲基-4-己烯基)-2-甲基-,[S-(R*,S*)]- 1,3-环己二烯 15.54 2,6-二甲基-6-(4-甲基-3-戊烯基)-双环[3.1.1]庚-2-烯 2.37 2,6,10-三甲基-,(Z)-1,5,9-十一碳三烯 0.82 3-(1,5-二甲基-4-己烯基)-6-亚甲基-,[S-(R*,S*)]-环己烯 0.43 己烯三烯 2.37 0.17 1,1-二甲基癸基苯 1.30 β-异丁烯二烯 0.66 2,6,6,9-四甲基-,(1R,2S,7R,8R)-三环[5.4.0.0(2,8)]十一烷基-9-烯 3.13 1-(1,5-二甲基-4-己烯基)-4-甲基苯 2.61 0.04 醛酮类 苯甲醛 40.03 1.69 0.26 2-十一烷酮 0.57 2-壬酮 0.32 丁香醛B 6.55 1.18 β-姜黄素 2.33 0.27 酚类 苯酚 0.75 0.94 0.09 0.08 4-甲基苯酚 4.46 3.32 0.54 0.49 由图2和表3得到的分析结果可知,窖泥中含有丰富的挥发性风味物质,但是不同空间位置的窖泥中这些挥发性物质的分布差异明显。初步鉴定出池壁上部窖泥样品中主要挥发性物质组分有25种,其中醛酮类4种(49.48%)、烃类10种(30.47%)、酚类2种(5.21%)、酯类5种(7.68%)、酸类1种(4.08%)、醇类3种(3.10%),其中最主要的挥发性物质是苯甲醛(40.03%)和5-(1,5-二甲基-4-己烯基)-2-甲基-,[S-(R*,S*)]-1,3-环己二烯(15.54%)。池壁中部窖泥样品中的主要挥发性物质组分有15种,其中酯类3种(67.13%)、醇类3种(19.08%)、酸类2种(5.88%)、酚类2种(4.26%)、醛酮类4种(3.46%)、烃类1种(0.17%),其中最主要的挥发性风味物质是己酸己酯(60.98%),其次是1-己醇(11.43%)。池壁下部窖泥样品中的主要挥发性物质组分有25种其中酯类14种(66.56%)、酸类6种(31.80%)、醇类3种(1.02%)、酚类2种(0.63%),其中最主要的挥发性物质是己酸乙酯(19.94%)、己酸(17.79%)、辛酸乙酯(15.52%)、己酸己酯(14.58%);池底窖泥样品中的主要挥发性物质组分有31种,其中酯类18种(76.35%),酸类5种(19.37%)、醇类4种(3.42%)、酚类2种(0.57%)、醛酮类1种(0.26%)、烃类1种(0.04%),其中最主要的挥发性物质是己酸己酯(28.62%)、辛酸乙酯(14.98%)、己酸乙酯(13.02%)、己酸(12.26%)。
2.1.1 酯类物质
由图2-a可知,窖泥池壁上部含有的酯类相对含量较少,中下底部远远高于池壁上部,且图3中池壁下部和底部酯类的种类数也较多,池底最多为18种。池壁中部虽然含有较多的酯类物质,但种类数只有3种。窖泥中所含酯类的峰面积总量随窖池深度的增加呈现大幅递增趋势,从池壁上部峰面积1.66×108增加到池底部276.63×108。表2中,己酸己酯、辛酸乙酯、苯丙酸乙酯为四组窖泥样品中共有成分,其中,己酸己酯由池壁中部位置处开始大量生成,成为池壁中部的主要酯类,占比60.98%,随着窖池深度的增加,酯类物质种类逐渐丰富,己酸己酯在酯类中的占比降低,池壁下部14.58%、池底部28.62%,但生成己酸己酯的量在增加。原因可能是在池壁上部,未能构成良好的厌氧环境,厌氧菌丰度不够未能成为优势菌属,不能将营养物质完全分解转化,产生的酸类和醇类等酯类的前体物质较少,故生成的酯类物质较少。
2.1.2 酸类物质
由图2-b和图3可知,窖泥池壁下部所含酸类物质的种类最多为6种,相对含量与其他位置相比最高,池底部次之,池壁上部和池壁中部所含酸类物质种类数和相对含量都较少。窖泥中所含酸类物质的峰面积总量随窖池深度的增加而增加,下底部增长较大,由池壁上部0.88×108增加到中部4.48×108再到池壁下部65.67×108和池底70.14×108。表2显示己酸均在四组窖泥样品中检测到,这与己酸己酯的分布一致,且己酸的含量呈现大幅增加趋势,这可能与产生己酸的菌群为厌氧菌群有关。
2.1.3 醇类物质
在图3中,窖泥各空间位置所含醇类物质种类数无明显差异,其中,池壁上、中、下部均含有3种,池底含有4种醇类物质。图2-c中池壁中部所含醇类物质的相对含量远远高于其它位置处,为19.08%。由表2可知,1-辛醇和1-己醇在四组窖泥样品中均可被检测到, 池底的醇类物质含量较池壁下部多,池壁中部最多。可能是因为在池壁中部,因营养丰富、环境适宜,大量微生物生长繁殖,丰度提高,对营养物质的分解较为充分,醛酮类和烃类物质大幅减少,醇类大量生成。
2.1.4 酚类物质
在图2-d中,窖池不同深度窖泥所含酚类物质均为2种,为苯酚和4-甲基苯酚。池壁上、中部酚类物质的相对含量大于池壁下部和池底。池壁上部的4-甲基苯酚含量高于其余部位,4-甲基苯酚可能与厌氧程度相关[12]。
2.1.5 醛酮类物质
图2-e和图3中,池壁上部所含醛酮类物质相对含量远远高于其它位置处窖泥,达到了49.48%,池壁中部含有四种醛酮类物质,相对含量为3.46%;池壁底部仅有一种,相对含量为0.26%;池壁下部则无醛酮类物质。浓香型白酒生产原料主要为粮食,其细胞壁中含有木质素。窖泥中的微生物将木质素降解,氧化生成苯酚类物质和芳香醛类物质[13]。故而丁香醛等物质多在池壁上部和中部被检测到。
2.1.6 烃类物质
由图2-f和图3可知,烃类物质较多的存在于窖泥池壁上部,10种相对含量为30.47%;池壁的中部和底部都只含有一种,相对含量各自为0.17%和0.04%;池壁下部未检测出烃类物质。酿酒生产过程中,酿酒的原料主要与池壁上部接触,木质素含碳量较高,被降解形成烃类物质,未能构成良好的厌氧环境,厌氧菌丰度不够未能成为优势菌属,未能将烃类进行进一步的转化,导致烃类物质较多地在上部被检测到。
窖池不同空间位置处窖泥含有的挥发性物质主要有酯类化合物、醇类化合物、酸类化合物、酚类化合物、醛酮类化合物、烯烃类化合物,这些物质与白酒中呈香化合物基本一致[14]。其中,酯类、酸类和醇类的种类数较多,且含量呈现出随着窖池深度的增加逐步增加的趋势。这可能是因为窖池中糟醅的水分由上自下逐渐浸落,部分微生物逐渐在窖池的下底部富集,因此窖池下底部的原核微生物群落与中上层存在明显差异的同时也具有一定的相似性[15],也进一步证明了白酒中风味物质的产生位置主要在窖池的中部以下。不同空间位置的窖泥中优势菌群构成存在差异,影响着代谢反应循环,进而影响着酒体中的呈香物质组成,例如己酸菌发酵产生己酸、丁酸和少量的乙酸[16];有机酸代谢过程中会产生氢,存在着微生物代谢控制的底物抑制现象,窖泥中的甲烷菌和硝酸盐还原菌均具有解除产酸菌的氢抑制现象[17],促使有机酸的产生。
综上所述,窖泥中含有的烯烃类物质和醛酮类物质较多分布在池壁的上部,在池壁中下部和池底窖泥中存在较多的挥发性物质主要是酯类、醇类和酸类。不同位置主要挥发性成分存在差异是由于窖池中不同部位的厌氧程度决定的[18]。窖池的中部及以下厌氧性明显强于窖池上部,利于窖泥中厌氧菌的生长和代谢,对有机质的分解代谢较彻底[19],利用营养物质代谢生酸并酯化,因此烯烃类物质较少,而醇、酸类物质较多,进一步反应生成酯类物质也较多[20]。在池壁下部和池底,由于厌氧环境良好,厌氧菌属和耐高酸等恶劣环境的菌属如梭菌属等成为优势菌属,能将纤维素、半纤维素等降解为含碳物质[21],还能为酒香中重要的风味物质己酸乙酯的合成提供前体物质,对窖池中微生物群落的结构组成拥有调控能力,故而在这一空间位置能充分生成酯类和酸类等呈香性物质。说明长期低氧环境更有利于窖泥中的微生态系统的完善[22]和有机质的分解。
2.2 窖池中不同空间位置窖泥中的微生物群落分布分析
2.2.1 窖泥中微生物群落的α-多样性
群落生态学中,α-多样性通过一系列统计学指数的分析来估计环境群落的物种丰度和多样性[23]。计算菌群丰度的指数有ACE和Chao指数,ACE是用来估计群落中含有OUT数目的指数,Chao是用Chao1算法估计样本中所含OUT数目的指数[24],ACE和Chao指数越大,说明群落中含有的OUT数目越多,群落的丰富度越大。计算菌群多样性的指数有Shannon和Simpson指数,Shannon用来估算样本中微生物多样性[25],值越大说明群落多样性越高,Simpson在生态学中反映优势种在群落中的地位和作用。通过对原始序列进行质量控制和优化,共得到了65688条有效序列,平均长度为449.72 bp。每个窖泥样品中的序列数量从126576~163696个不等。且池壁中部窖泥中的序列数量最多,池底窖泥中的序列数量最少。
Observed OUT表示含有的物种数目,由表3可知,池底部和池壁中部的窖泥物种丰富度较高,池壁下部稍少于池壁中部,池壁上部的窖泥中物种丰富度最低。Shannon指数从2.130增加到4.970,Simpson指数从0.557增加到0.932,均随着窖泥深度的增加而增加,表明不同空间位置窖泥的物种多样性随窖泥深度的增加呈现增加的趋势,池壁中下部和底部的Simpson指数增长较为平缓,表明中下底部窖泥物种多样性增加的同时趋于稳定,且池壁中下部和池底的窖泥中微生物多样性显著高于池壁上部。ACE指数由70.026增加到112.271,随后有小幅度降低,又由99.510增加到114.523。Chao1指数由67.51增加到112.00,小幅降低至98.50,再增加到114.50。ACE指数和Chao1指数表明窖泥微生物物种丰富度呈现先上升后下降再上升的趋势,池底的物种丰富度最高。Chao1、Shannon、Simpson、ACE指数均表明,在整个窖池中,池底的窖泥中微生物物种多样性和物种丰富度最高。
表 3 不同空间位置窖泥中微生物群落的α-多样性Table 3. α-Diversity of microbial communities in pit mud in different spatial locations多样性指数 池壁上部 池壁中部 池壁下部 池底 有效序列 71344 72879 62358 56172 Observed OTU 63.50±2.50 110.30±1.70 95.30±1.40 111.40±1.80 Chao1 67.51 112.00 98.50 114.50 Shannon 2.130 4.572 4.642 4.970 Simpson 0.557 0.911 0.929 0.932 ACE 70.026 112.271 99.510 114.523 2.2.2 不同空间位置窖泥中微生物群落门、纲水平的变化
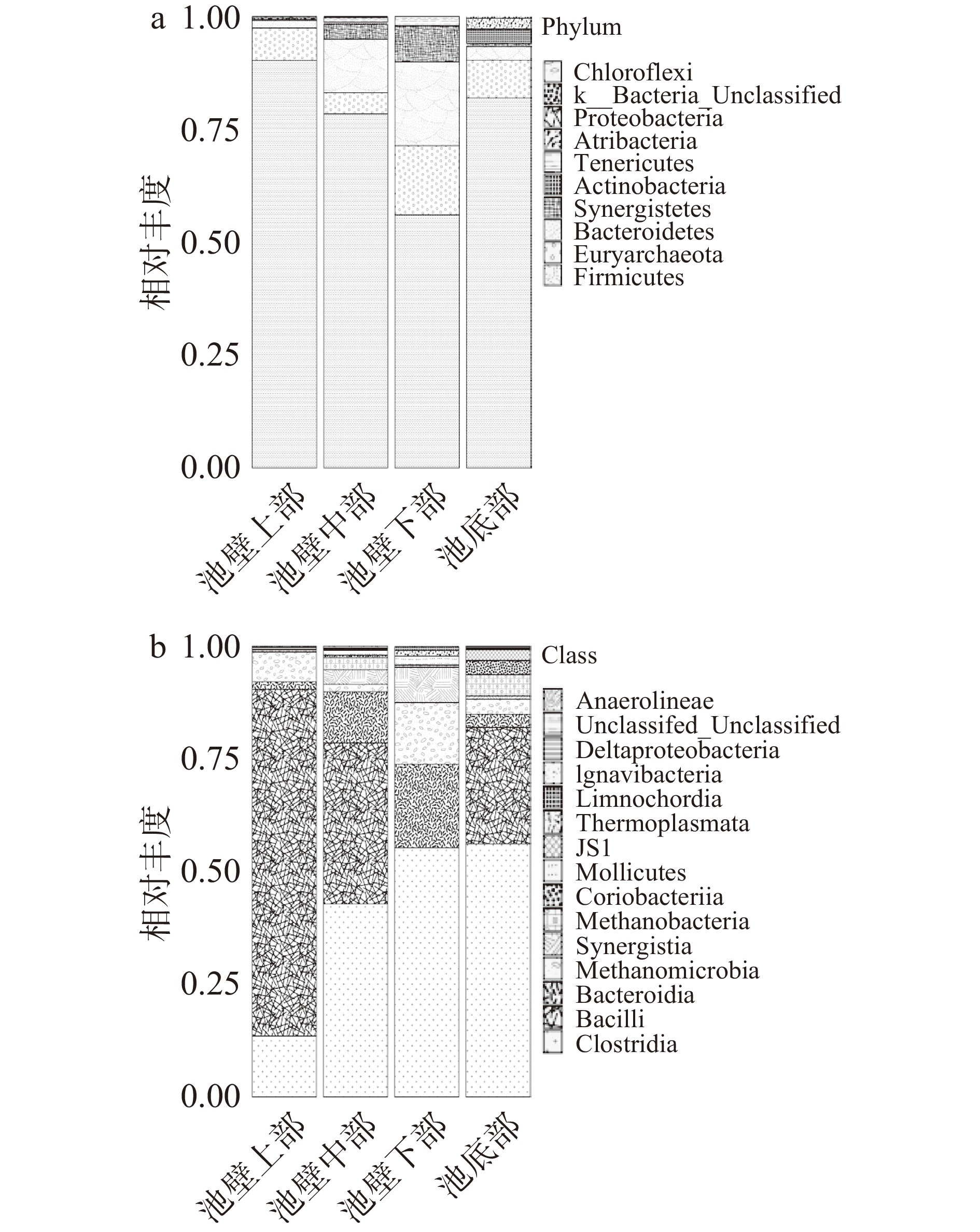
根据图4 OTU注释,共鉴定出10个门,其中细菌门9个,古细菌门1个。共发现8个优势菌群(平均丰度>0.1%),占每个样品细菌总数的98.86%~99.93%,其中厚壁菌门(Firmicutes)为绝对优势菌群。窖池上部优势菌群由高到低的顺序为:厚壁菌门(Firmicutes)>广古菌门(Euryarchaeota)> 拟杆菌门(Bacteroidetes)>变形菌门(Proteobacteria);池壁中部和下部优势菌群由高到低的顺序较为相似:厚壁菌门(Firmicutes)>拟杆菌门(Bacteroidetes)>广古菌门(Euryarchaeota)>互养菌门(Synergistetes)>软壁菌门(Tenericutes)>放线菌门(Actinobacteria);窖池底部由高到低分别为:厚壁菌门(Firmicutes)>广古菌门(Euryarchaeota)>放线菌门(Actinobacteria)>拟杆菌门(Bacteroidetes)>暗黑菌门[26](Atribacteria)>互养菌门(Synergistetes)>软壁菌门(Tenericutes)。随着窖池深度的增加,窖泥中的优势菌群逐渐由4个类群向多个菌群转变,最后又回到单一的绝对优势菌群,厚壁菌门数量先减少后增加,其他优势菌群均有不同程度的先增加后减少最后在池壁底处最少。
在纲水平上,从所有窖泥样品中检测到15类原核微生物。共发现6个优势菌群(平均丰度>1%),从高到低的顺序为:梭菌纲(Clostridia)>杆菌纲(Bacilli)>拟杆菌纲(Bacteroidia)>甲烷微菌纲(Methanomicrobia)>互养菌纲(Synergistia)>甲烷杆菌纲(Methanobacteria)。池壁中部和池底窖泥中都有丰富的细菌分布,池壁下部和池壁上部次之。梭菌纲的含量随着窖池深度的增加而逐渐增加,在池壁下部和池底窖泥中达到最高;杆菌纲的含量则随着窖池深度的增加而逐渐减少,在池壁下部和池底的窖泥中接近于0;拟杆菌纲和互养菌纲的含量随着窖池深度的增加逐渐增加,并在池底部时降到最低;随着窖池深度的增加,甲烷微菌纲和甲烷杆菌纲的数量呈现先降低再增加再降低的规律。窖泥微生物的群落组成因处于窖池的不同空间位置而具有明显的空间差异性。
2.2.3 不同空间位置窖泥中微生物群落优势菌属水平的变化
在属水平上,从4个不同空间位置的窖泥样品中检测到64个可识别属和未分类属。对每份窖泥样品中1%以上核心属进行统计分析,共有21个核心属,含量分别为98.43%(池壁上部)、85.01%(池壁中部)、85.65%(池壁下部)、77.73%(池底),表明池壁底是窖泥中微生物最复杂的位置。
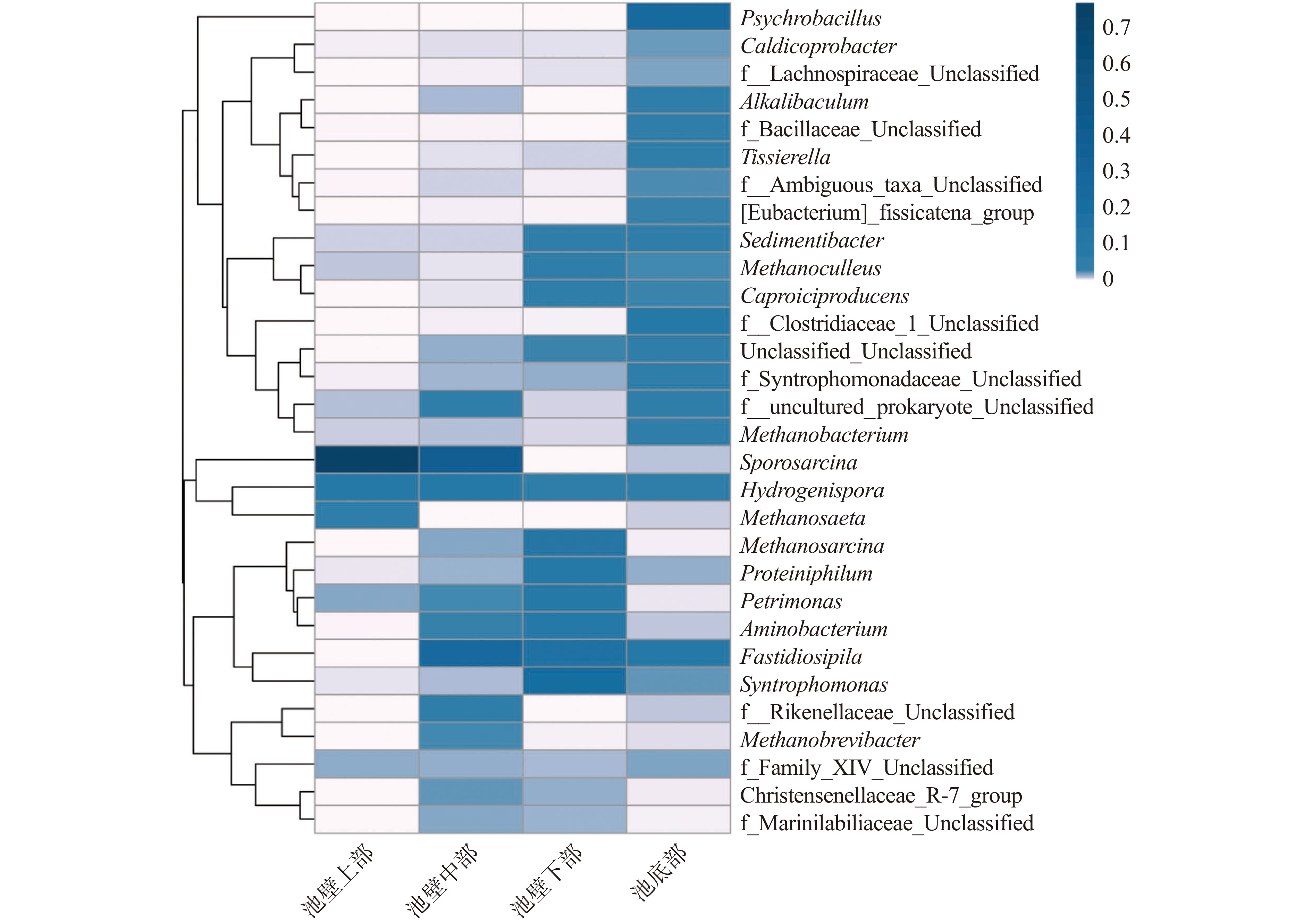
本研究选取每个样品的前30个属进行热谱分析,从较小的分类水平上揭示窖泥中微生物群落组成的差异。结果如图5所示,通过热图的颜色差异可直观显示物种的相似性和差异性。前30个属占比分别占每个样品的88.79%~99.2%。根据图6可知,池壁上和池壁中、池壁下和池壁底明显地被分为两个聚类,下底部窖泥中微生物结构与中上部存在部分相似性又存在较大的差异性。在窖池上部,芽孢八叠球菌属(Sporosarcina)的含量最高,随着窖池空间位置的增加逐渐降低,在窖池的下底部含量几近为零,符合多分布于泥土表面的习性。Sedimentibacter、Unclassified_Unclassified、f_Syntrophomonadaceae_Unclassified、甲烷囊菌属(Methanoculleus)、Caproiciproducens等属的变化规律大体相同,都随着窖池空间位置的增加逐渐增加;部分菌如互营单胞菌属(Syntrophomonas)、Petrimonas、甲烷八叠球菌属(Methanosarcina)、Proteiniphilum等则呈现从池壁上至池壁下先增加后在池壁底部降低的规律。说明窖池中微生物种类的空间分布与窖池的空间位置有关。
梭菌属(Clostridium)、互营单胞菌属(Syntrophomonas)、Sedimentibacter、泰氏菌属(Tissierella)、Garciella等梭菌科属是生成丁酸、己酸等酯类前体物质的重要菌群,其他优势菌属Petrimonas、Proteiniphilum等微生物的代谢产生物也构成白酒中的重要风味物质或风味物质前体。本研究中检出的优势古菌属中,甲烷菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)和甲烷囊菌属(Methanoculleus)属氢营养型甲烷菌[27],而氢营养型产甲烷古菌可以H2为代谢底物促进己酸的合成[15],甲烷八叠球菌属(Methanosarcina)可同时利用乙酸和H2,这些甲烷菌可以通过种间作用来实现己酸乙酯产量的提升。这些优势菌群都是维持窖泥微生物网络结构稳定、维持微生态平衡、进行微生物代谢和种间物质交换、产生重要香气物质及其前体的主要微生物,并随着空间深度的增加,不断反应和富集,形成与窖泥的空间位置密切相关的规律。
韦恩图中不同颜色的圈表示不同的样本分组,图中数字代表每个样本分组特有或共有的OUT数目,最中间数字表明所有样本分组共有的OTU数目。根据OUT聚类分析结果,由图6可知,共有属部分数量为51种,占43.59%,池壁上含有特种属,数量和占比分别为2和1.71%,池壁中下部和池底窖泥中微生物群落较池壁上部具有更大的相似性。
2.2.4 多样本比较分析
β-多样性值为两个样本间的相异系数,反映不同样本间的多样性的差异。
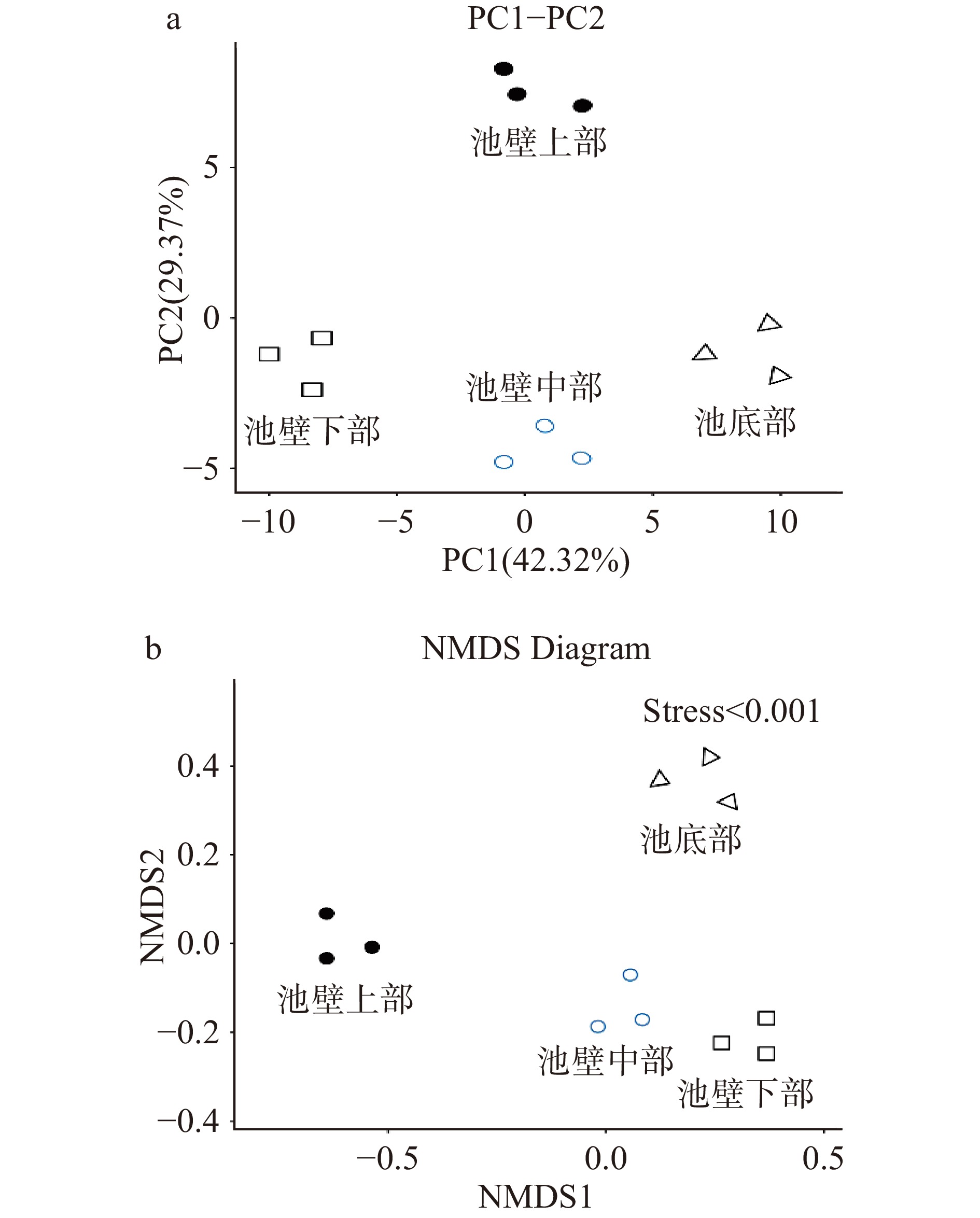
样本点之间距离表明了样本中功能分类分布的相似性,距离越近,相似度越高。图7-a中,在主成分1(PC1)的条件下,样本中池壁上部和池壁中部极为接近,相似度较高,与池壁下部和池底部存在差异。在主成分2(PC2)的条件下,样本中的池壁下部和池底距离极为接近,与池壁中部较为相近,相似度较高,与池壁上部距离较远,存在较大差异性。非度量多维尺度法是根据样本中包含的物种信息,以点的形式反应在多维空间上,通过点与点之间的距离来反映不同样本间的差异程度。图7-b中,每一个点代表一个样本,表明窖泥池壁上部的菌群组成与窖泥池壁中下底部的菌群组成存在明显差异,而窖泥池壁中部和池壁下部菌群结构组成类似。β-多样性分析表明,窖泥中的群落结构随着窖泥空间位置的加深与环境因子相互作用而逐渐趋于稳定,空间位置在一定程度上影响了窖泥中原核微生物群落的α-和β-多样性,这主要是由于不同位置窖泥的理化性质不同所致,这是影响微生物群落多样性变化的根本因素[28]。
2.3 窖池中不同空间分布窖泥中挥发性物质分布和微生物群落分布之间的关系
本研究发现窖池下部和池底窖泥中的原核菌群的丰度和多样性[29]要高于窖池上部和中部的窖泥,这与挥发性物质的种类分布规律相吻合,与窖池下部和底部长期良好的厌氧环境有关,与高酸环境也有一定关联。生孢产氢菌(Hydrogenispora)在窖池的各个空间位置均有分布,主要产物是乙酸、乙醇和氢等[30]。在池壁上部,芽孢八叠球菌属(Sporosarcina)为上层的优势菌属,能发酵产生二氧化碳和乙酸等,但因厌氧环境较差,厌氧菌丰度不够,不能将营养物质完全分解,导致烯烃类和醛类物质较多;池壁中层窖泥拥有丰富的营养物质,环境因子较为适宜,原核微生物群落的多样性也反映着丰富的风味物质组成,优势菌群如柯生菌属(Fastidiosipila)等梭菌属菌群丰度增加,白酒呈香性物质中重要的己酸乙酯及其前体物质等含量也开始增加;池壁下部和底部窖泥因长期处于良好的厌氧环境中,适宜在极端生长环境中的原核微生物充分代谢反应,甲烷细菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)和甲烷囊菌属(Methanoculleus)属等甲烷菌,在促进己酸的合成的同时,还可以通过种间作用与己酸菌共生共养[31],实现己酸和己酸乙酯产量的提升,在此空间位置丰度较高的微生物物种,对窖池中的微生物群落结构组成拥有调控能力,故而在这一空间位置能充分生成酯类和酸类等呈香性物质。随着窖泥空间位置的加深,越靠近下层厌氧环境越好,厌氧菌在下底部大量沉积繁殖,在发酵过程中产生的醇、醛、酸、酮、酯等代谢产物不仅为酒体的呈香物质,部分还能作为生长因子或代谢前体物质促进微生物的生长繁殖,为多样的风味物质组成提供了物质基础。
3. 结论
随窖池深度的增加,挥发性物质总量也在逐渐增加,峰面积总量由池壁上部21.65×108增加到池底部362.31×108。其中酯类和酸类种类较多,占比达到73.01%~98.36%。窖泥样品中池壁下部和池底部窖泥中的微生物菌群丰度和多样性高于池壁上部和中部,这与挥发性物质的种类和含量分布规律相吻合。微生物门水平上优势菌群占细菌总数的98.86%~99.93%,厚壁菌门为绝对优势菌群。梭菌属和甲烷菌属等优势菌属是进行微生物代谢和种间物质交换、产生重要香气物质及其前体的主要微生物,并随着空间深度的增加,不断反应和富集,形成与窖泥的空间位置密切相关的规律。空间差异性是导致窖泥不同空间位置原核微生物菌群和挥发性物质成分存在差异性的重要原因。
窖泥生态系统中蕴藏着一个与窖泥密切相关的复杂原核生物群落[32-33],微生物群落与风味物质之间并非简单的一一对应的关系。本项研究联系了窖泥空间特征对原核生物群落的影响及挥发性物质的空间分布规律,研究结果对于不同空间位置窖泥中微生物群落的分布规律及其间的原核生物群之间的相互作用起到一定的参考,对酒质的影响提供数据支持。
-
表 1 PCR扩增条件
Table 1 PCR amplification conditions
PCR扩增体系 反应体系(25 μL) TransStart Buffer 2.5 μL dNTPs 2 μL Primers 1 μL×2 TransStart Taq DNA 0.5 μL 模板DNA 20 ng ddH2O 补至总体系25 μL 表 2 挥发性物质成分表及相对含量(%)
Table 2 Volatile substance composition table and relative content (%)
种类 名称 池壁上部 池壁中部 池壁下部 池底 醇类 1-戊醇 0.08 1-己醇 1.39 11.43 0.83 2.72 1-庚醇 1.30 1-辛醇 0.82 6.35 0.12 0.57 苯乙醇 0.06 0.05 1-十三炔-4-醇 0.89 酯类 乙酸己酯 0.17 己酸乙酯 19.94 13.02 己酸丙酯 0.76 1.14 己酸丁酯 6.45 4.88 己酸戊酯 1.01 2.09 己酸己酯 2.70 60.98 14.58 28.62 己酸庚酯 2.78 己酸辛酯 1.32 己酸异戊酯 3.60 2.63 庚酸乙酯 2.64 4.14 辛酸乙酯 1.70 5.43 15.52 14.98 辛酸丙酯 0.14 辛酸辛酯 0.11 壬酸乙酯 0.54 癸酸乙酯 0.60 十四烷酸乙酯 0.06 1-甲基己酸己酯 0.27 2-己酸苯乙酯 0.12 2-甲基己酸丙酯 0.46 0.35 3-甲基辛酸丁酯 0.18 0.35 苯丙酸乙酯 1.36 0.72 0.66 0.60 苯乙酸乙酯 0.08 0.04 酸类 乙酸 0.87 丁酸 4.62 1.70 戊酸 0.67 0.30 己酸 4.08 4.81 17.79 12.26 庚酸 1.95 辛酸 1.07 5.90 4.94 己酸酸酐 0.17 烃类 2,6,6-三甲基-,[1S-(1α,2β,5α)]-双环[3.1.1]庚烷 1.24 5-(1,5-二甲基-4-己烯基)-2-甲基-,[S-(R*,S*)]- 1,3-环己二烯 15.54 2,6-二甲基-6-(4-甲基-3-戊烯基)-双环[3.1.1]庚-2-烯 2.37 2,6,10-三甲基-,(Z)-1,5,9-十一碳三烯 0.82 3-(1,5-二甲基-4-己烯基)-6-亚甲基-,[S-(R*,S*)]-环己烯 0.43 己烯三烯 2.37 0.17 1,1-二甲基癸基苯 1.30 β-异丁烯二烯 0.66 2,6,6,9-四甲基-,(1R,2S,7R,8R)-三环[5.4.0.0(2,8)]十一烷基-9-烯 3.13 1-(1,5-二甲基-4-己烯基)-4-甲基苯 2.61 0.04 醛酮类 苯甲醛 40.03 1.69 0.26 2-十一烷酮 0.57 2-壬酮 0.32 丁香醛B 6.55 1.18 β-姜黄素 2.33 0.27 酚类 苯酚 0.75 0.94 0.09 0.08 4-甲基苯酚 4.46 3.32 0.54 0.49 表 3 不同空间位置窖泥中微生物群落的α-多样性
Table 3 α-Diversity of microbial communities in pit mud in different spatial locations
多样性指数 池壁上部 池壁中部 池壁下部 池底 有效序列 71344 72879 62358 56172 Observed OTU 63.50±2.50 110.30±1.70 95.30±1.40 111.40±1.80 Chao1 67.51 112.00 98.50 114.50 Shannon 2.130 4.572 4.642 4.970 Simpson 0.557 0.911 0.929 0.932 ACE 70.026 112.271 99.510 114.523 -
[1] 施思, 乔宗伟, 罗青春, 等. 窖池微生态调控对窖泥驯化及酒质影响的研究[J]. 中国酿造,2021,40(5):163−167. [SHI Si, QIAO Zongwei, LUO Qingchun, et al. Study on the influence of pit mud domestication and wine quality by microecological regulation of pits[J]. China Brewing,2021,40(5):163−167. doi: 10.11882/j.issn.0254-5071.2021.05.030 [2] LIU Maoke, TANG Yuming, ZHAO Ke, et al. Determination of the fungal community of pit mud in fermentation cellars for Chinese strong-flavor liquor, using DGGE and Illumina MiSeq sequencing[J]. Food Research International,2017,91:80−87. doi: 10.1016/j.foodres.2016.11.037
[3] ZHANG Yanyan, ZHU Xiaoyu, LI Xiangzhen, et al. The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J]. BMC Microbiology,2017,17(1):196−206. doi: 10.1186/s12866-017-1106-3
[4] 赵东, 郑佳, 彭志云, 等. 五粮浓香型发酵糟醅与窖泥的相关性研究[J]. 食品与发酵工业,2019,45(6):1−7. [ZHAO Dong, ZHENG Jia, PENG Zhiyun, et al. Research on the correlation between five grains of aromatic fermented grains and pit mud[J]. Food and Fermentation Industry,2019,45(6):1−7. [5] 唐圣云, 王戎, 陈小文, 等. 五粮液的老窖泥研究综述[J]. 食品与发酵科技,2012,48(6):7−11. [TANG Shengyun, WANG Rong, CHEN Xiaowen, et al. Research review of the old pit mud of Wuliangye[J]. Food and Fermentation Science and Technology,2012,48(6):7−11. [6] 雷学俊, 杨康卓, 张建敏, 等. 多粮浓香型白酒糟醅中香气成分的空间分布规律[J]. 食品与发酵工业,2020,46(21):48−54. [LEI Xuejun, YANG Kangzhuo, ZHANG Jianmin, et al. Spatial distribution of aroma components in multi-grain strong-flavor liquor grains[J]. Food and Fermentation Industry,2020,46(21):48−54. [7] 刘森, 李林光, 李可, 等. 中国浓香型白酒窖池窖泥中原核微生物群落的空间异质性[J]. 食品科学,2013,34(21):221−226. [LIU Sen, LI Linguang, LI Ke, et al. Spatial heterogeneity of prokaryotic microbial community in pit mud of Chinese Luzhou-flavor liquor cellar[J]. Food Science,2013,34(21):221−226. [8] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D]. 无锡: 江南大学, 2015. HU Xiaolong. Study on the relationship between the diversity of clostridium community in pit mud and the quality of pit mud in Luzhou-flavor liquor[D]. Wuxi: Jiangnan University, 2015.
[9] 王栋, 钱存卫, 陈选荣, 等. 海天酱油中的挥发性风味物质研究[J]. 广东化工,2019,46(4):29−30. [WANG Dong, QIAN Cunwei, CHEN Xuanrong, et al. Research on volatile flavor compounds in Haitian soy sauce[J]. Guangdong Chemical Industry,2019,46(4):29−30. doi: 10.3969/j.issn.1007-1865.2019.04.013 [10] 王艳丽, 张会敏, 孟雅静, 等. 基于16S rDNA V4与V3-V4可变区高通量测序对浓香型白酒窖泥菌群组成的比较分析[J]. 现代食品科技,2020,36(6):147−154. [WANG Yanli, ZHANG Huimin, MENG Yajing, et al. Comparative analysis of the composition of Luzhou-flavor liquor pit mud microflora based on 16S rDNA V4 and V3-V4 variable region high-throughput sequencing[J]. Modern Food Science and Technology,2020,36(6):147−154. [11] 胡晓龙, 王康丽, 余苗, 等. 浓香型窖泥原核微生物群落多样性及其在窖池中的空间异质性[J]. 食品与发酵工业,2020,46(11):77−84. [HU Xiaolong, WANG Kangli, YU Miao, et al. Diversity of the prokaryotic microbial community of Luzhou-flavor pit mud and its spatial heterogeneity in the pit[J]. Food and Fermentation Industry,2020,46(11):77−84. [12] 刘博, 杜海, 王雪山, 等. 基于高通量测序技术解析浓香型白酒中窖泥臭味物质4-甲基苯酚的来源[J]. 微生物学通报,2017,44(1):108−117. [LIU Bo, DU Hai, WANG Xueshan, et al. Analysis of the source of 4-methylphenol, an odorous substance from pit mud in Luzhou-flavor liquor based on high-throughput sequencing technology[J]. Microbiology Bulletin,2017,44(1):108−117. [13] 李莉. 木质素催化转化制备丁香醛的过程研究[D]. 北京: 北京化工大学, 2016. LI Li. Study on the process of preparing syringaldehyde by catalytic conversion of lignin[D]. Beijing: Beijing University of Chemical Technology, 2016.
[14] LIU Huilin, SUN Baoguo. Effect of fermentation processing on the flavor of Baijiu[J]. Journal of Agricultural and Food Chemistry,2018,66(22):5425−5432. doi: 10.1021/acs.jafc.8b00692
[15] 赵东, 郑佳, 彭志云, 等. 高通量测序技术解析五粮液窖泥原核微生物群落结构[J]. 食品与发酵工业,2017,43(9):1−8. [ZHAO Dong, ZHENG Jia, PENG Zhiyun, et al. Analysis of the prokaryotic microbial community structure of Wuliangye pit mud by high-throughput sequencing technology[J]. Food and Fermentation Industry,2017,43(9):1−8. [16] TAO Yong, LI Jiabao, RUI Junpeng, et al. Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J]. Applied and Environmental Microbiology,2014,80(7):2254−2260. doi: 10.1128/AEM.04070-13
[17] SEEDORF H, FLORIAN W F, VEITH B, et al. The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(6):2128−2133. doi: 10.1073/pnas.0711093105
[18] 熊燕飞, 马卓, 彭远松, 等. 中国白酒风味成分的色谱分析方法研究进展[J]. 中国酿造,2019,38(11):1−5. [XIONG Yanfei, MA Zhuo, PENG Yuansong, et al. Research progress on chromatographic analysis methods of Chinese liquor flavor components[J]. China Brewing,2019,38(11):1−5. doi: 10.11882/j.issn.0254-5071.2019.11.001 [19] 余有贵, 李侦, 熊翔, 等. 窖泥微生态的主要特征研究[J]. 食品科学,2009,30(21):258−261. [YU Yougui, LI Zhen, XIONG Xiang, et al. Research on the main characteristics of pit mud microecology[J]. Food Science,2009,30(21):258−261. doi: 10.3321/j.issn:1002-6630.2009.21.060 [20] 韩颖. 古井窖泥菌群中厌氧菌的纯化培养与分子鉴定[D]. 哈尔滨: 哈尔滨工业大学, 2017. HAN Ying. Purification culture and molecular identification of anaerobic bacteria in the pit mud flora of ancient wells[D]. Harbin: Harbin Institute of Technology, 2017.
[21] 勾文君, 田源, 孔小勇, 等. 洋河酒窖泥细菌群落结构与菌株产酸能力分析[J]. 微生物学通报,2020,47(6):1651−1661. [GOU Wenjun, TIAN Yuan, KONG Xiaoyong, et al. Analysis of bacterial community structure and acid production capacity of strains in Yanghe wine cellar mud[J]. Microbiology Bulletin,2020,47(6):1651−1661. [22] 郭壮, 赵慧君, 雷敏, 等. 白酒窖泥微生物多样性研究方法及进展[J]. 食品研究与开发,2018,39(22):200−207. [GUO Zhuang, ZHAO Huijun, LEI Min, et al. Research methods and progress of microbial diversity in liquor pit mud[J]. Food Research and Development,2018,39(22):200−207. doi: 10.3969/j.issn.1005-6521.2018.22.034 [23] 刘长根. 我国传统发酵蔬菜微生物多样性比较[D]. 南昌: 南昌大学, 2019. LIU Changgen. Comparison of microbial diversity of traditional fermented vegetables in my country[D]. Nanchang: Nanchang University, 2019.
[24] LI Bing, ZHANG Xuxiang, GUO Feng et al. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research,2013,47(13):4207−4216. doi: 10.1016/j.watres.2013.04.021
[25] 孔德杰. 秸秆还田和施肥对麦豆轮作土壤碳氮及微生物群落的影响[D]. 杨凌: 西北农林科技大学, 2020. KONG Dejie. Effects of straw returning and fertilization on soil carbon and nitrogen and microbial communities in wheat-bean rotation[D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2020.
[26] 刘忠林, 刘一凡, 林丹丹, 等. 暗黑菌(Atribacteria)的环境分布和功能特征[J/OL]. 微生物学报: 1−15 [2021-06-07]. https://doi.org/10.13343/j.cnki.wsxb.20210184. LIU Zhonglin, LIU Yifan, LIN Dandan, et al. Environmental distribution and functional characteristics of Atribacteria[J/OL]. Chinese Journal of Microbiology: 1−15 [2021-06-07]. https://doi.org/10.13343/j.cnki.wsxb.20210184.
[27] 张应刚. 产甲烷菌对窖泥中香味成分的影响[D]. 北京: 中国农业科学院, 2019. ZHANG Yinggang. The effect of methanogens on aroma components in pit mud[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
[28] 张会敏, 王艳丽, 孟雅静, 等. 浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J]. 食品科学,2020,41(6):207−214. [ZHANG Huimin, WANG Yanli, MENG Yajing, et al. Analysis of physical and chemical factors and prokaryotic microbial community structure differences between new and old pit mud in Luzhou-flavor liquor fermentation[J]. Food Science,2020,41(6):207−214. doi: 10.7506/spkx1002-6630-20190226-190 [29] 张明珠, 吴学凤, 穆冬冬, 等. 基于高通量测序的窖泥原核微生物群落结构及其理化因子相关性分析[J/OL]. 食品科学: 1−12 [2021-04-12]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201213.1312.002.html. ZHANG Mingzhu, WU Xuefeng, MU Dongdong, et al. Pit mud prokaryotic microbial community structure and correlation analysis of its physical and chemical factors based on high-throughput sequencing[J/OL]. Food Science: 1−12 [2021-04-12]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201213.1312.002.html.
[30] LIU Yi, QIAO Jiangtao, YUAN Xianzheng, et al. Hydrogenispora ethanolica gen. nov., sp. nov., an anaerobic carbohydrate-fermenting bacterium from anaerobic sludge[J]. International Journal of Systematic and Evolutionary Microbiology,2014,64(5):1756−1762.
[31] FAN Wenlai,QIAN M C. Headspace solid phase microextraction and gas chromatography-olfactometry dilution analysis of young and aged Chinese “Yanghe Daqu” liquors[J]. Journal of Agricultural and Food Chemistry,2005,53(20):7931−7938. doi: 10.1021/jf051011k
[32] ZHENG Jia, LIANG Ru, ZHANG Liqiang, et al. Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J]. Food Research International,2013,54(1):660−666. doi: 10.1016/j.foodres.2013.07.058
[33] WANG Xujia, ZHU Hongmei, REN Zhiqiang, et al. Characterization of microbial diversity and community structure in fermentation pit mud of different ages for production of strong-aroma Baijiu[J]. Polish Journal of Microbiology,2020,69:1−14.
-
期刊类型引用(3)
1. 闫昊前,张扬,邢芳毓,高建萍,张天阳,李晓静,宋默微,孙冰冰,马莉,张贵锋. 葵花盘中黄嘌呤氧化酶抑制活性成分识别与活性分析. 生物学杂志. 2025(02): 66-74 .  百度学术
百度学术
2. 孙秋南,刘扬,白大娟,任红. 鹧鸪茶资源开发及综合利用研究进展. 中国热带农业. 2024(01): 17-22 .  百度学术
百度学术
3. 王昱文,段涵怡,董悦君,范怡然,杨颖,赵佳迪,杨雪. 黄芩黄酮的微波-超声法提取及降胆固醇活性评价. 饲料工业. 2023(11): 98-104 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:

 下载:
下载:



