Research Progress on Immobilization of Biological Enzymes on Metal-organic Framework Carriers
-
摘要: 金属有机骨架(Metal-Organic Frameworks, MOFs)是金属中心与有机配体通过配位作用自组装形成的多孔晶态材料。MOFs具有稳定性强、大比表面积、高孔隙率、可重复使用等特点,作为一种新型固定化载体材料,具有广泛的应用前景。本文主要从MOFs载体固定化生物酶的合成方法、MOFs-生物酶复合材料的特性和应用等方面进行总结分析,并对MOFs载体固定化生物酶的将来研究方向进行了展望,为后续开发研究和在生物与医药行业应用提供了理论依据。
-
关键词:
- 金属有机骨架 /
- 固定化酶 /
- 共固定化 /
- 金属有机骨架-生物酶复合材料
Abstract: Metal-Organic Frameworks (MOFs) are porous crystalline materials formed by self-assembly of metal centers and organic ligands through coordination. MOFs have the characteristics of strong stability, large specific surface area, high porosity, and reusability. As a new type of immobilized carrier material, it has a wide range of application prospects. In this article, the synthesis method of biological enzyme immobilized on MOFs carrier is mainly summarized and analyzed, the characteristics and application of MOFs-biological enzyme composite material, and the future research direction of the synthetic method of enzyme immobilized on MOFs carrier are prospected. A theoretical basis would be provided for the development research and applications in the biological and pharmaceutical industries. -
金属有机骨架(Metal-Organic Frameworks,MOFs)是由金属中心与有机配体通过配位作用自组装形成的一类具有周期性多维网络结构的多孔晶态材料[1]。作为一种新型生物固定化载体材料,MOFs引起众多研究者的极大兴趣[2-3]。近年来,MOFs材料在吸附、催化、生物传感、气体储存等多个技术领域均有广泛的应用前景[4-8]。生物酶作为一种高效、绿色的生物催化剂,它的存在大大提高了反应速率,而且在反应过程中自身还不会产生损耗[9-10]。但在工业生产过程中经常面临生物酶的化学稳定性差、储存条件要求苛刻、回收困难和不可重复使用等问题[11-12]。Wang等[13]将生物酶固定在MOFs材料的表面或空腔中形成固定化酶则可以有效地解决这些问题,生物酶通过MOFs固定化后具有高稳定性、较强的选择性、易于分离等性质;同时,固定化后的生物酶还可以循环使用,降低了生产成本。该方法在化学、生物、农业和医药等领域均得到广泛应用[14-16]。
本文拟阐述MOFs载体固定生物酶合成方法的研究现状,通过分析MOFs-生物酶复合材料的特性及应用,加深研究者对MOFs载体固定化生物酶的了解,为后续开发研究和在生物与医药行业的应用提供可靠的理论参考。
1. MOFs载体固定化生物酶的合成方法
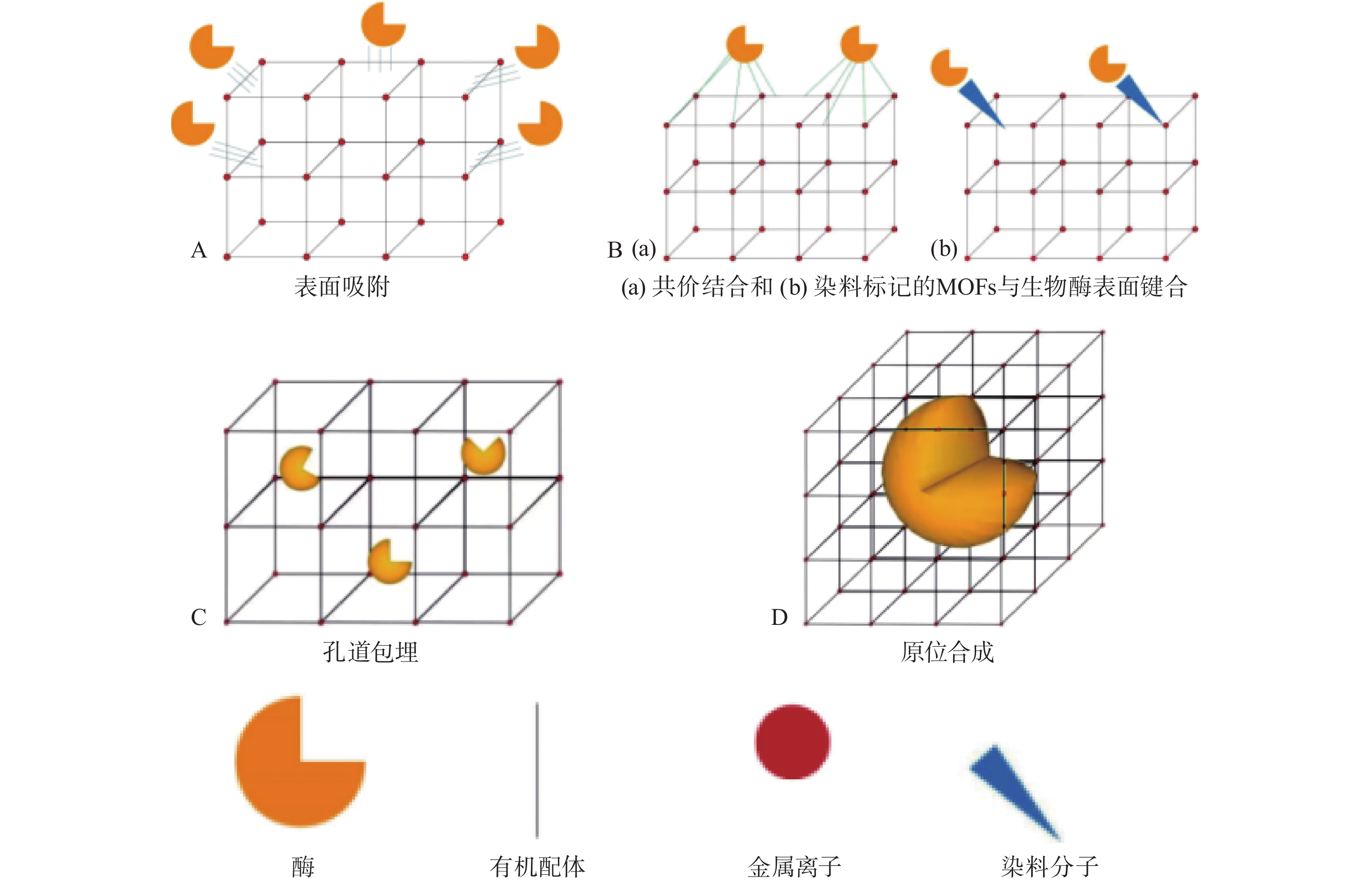
生物酶固定化可以通过同时形成和固定在MOFs载体中实现,也可以通过物理相互作用或化学键合将酶固定到预合成的MOFs载体上。这些固定化方法可分为四类(图1):表面吸附、共价结合、孔道包埋和原位合成。
1.1 表面吸附
表面吸附是生物酶固定化方法中最重要和应用最广泛的方法之一[17],发生在MOFs的配体与蛋白质的游离氨基、羧基之间,或是带正电荷的MOFs金属基团与带负电荷的蛋白质之间(图1A)。MOFs通过物理相互作用如π-π堆积作用、疏水作用、静电作用力、范德华力、电荷相互作用和分子相互作用等将生物酶紧紧吸附在表面达到共固定化的效果[11]。
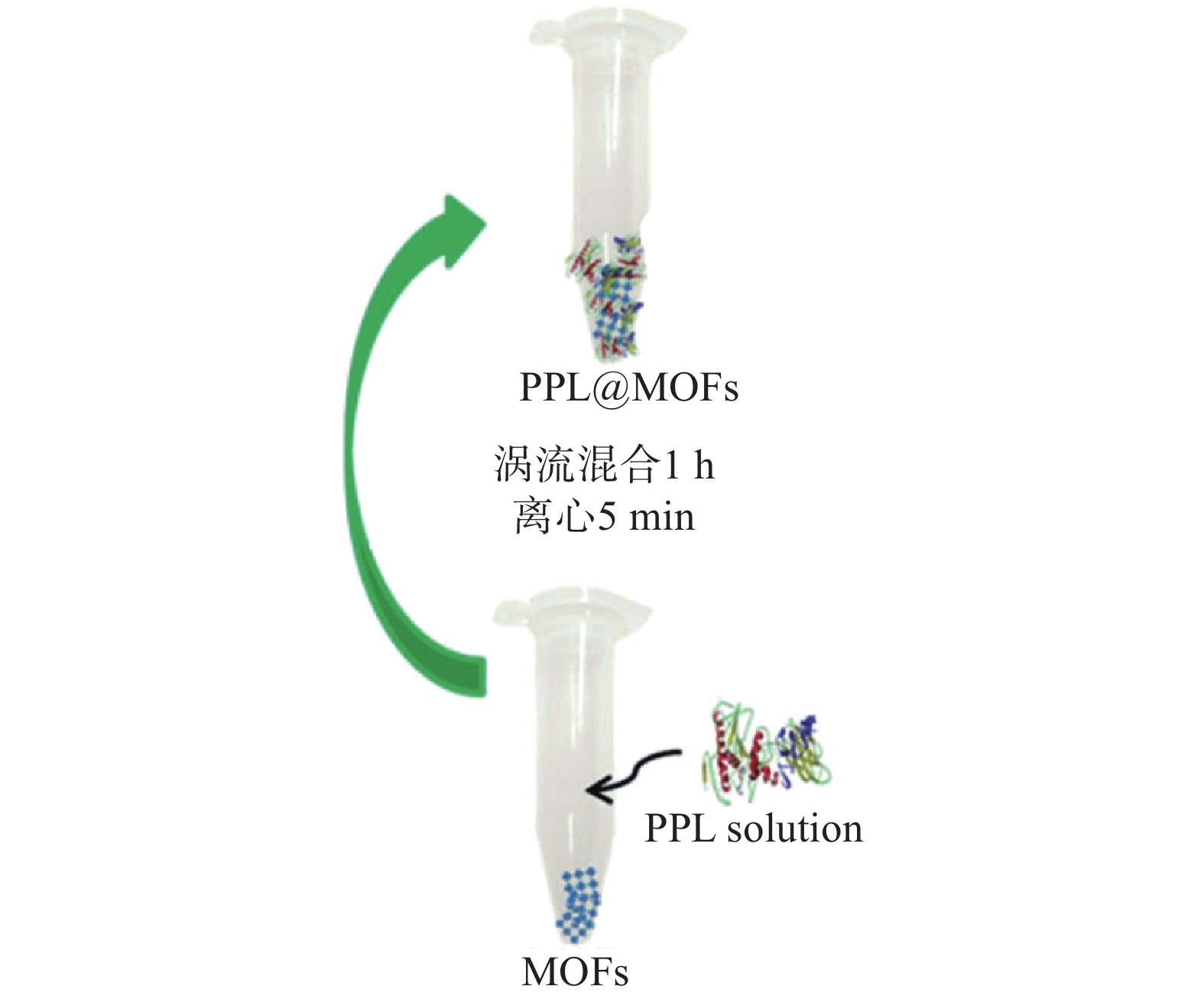
2006年Psklak等[18]首次尝试将MOFs材料应用于固定化酶技术;而后,Liu等[19]提出的“固定化平台”理论引起了研究人员对MOFs材料表面接合酶方面的深入研究,并进一步细化到固定化一种工业上常见的胰蛋白酶(Trypsin)。Li等[20]利用MOFs材料的孔隙对小分子的独特容纳能力和对生物大分子的高效传递效率,将胰蛋白酶吸附于含有金属有机骨架CYCU-4[Al(OH)(SDC)]和MIL-101的表面,固定化后的胰蛋白酶活性和稳定性显著提高。Cui等[21]将假丝酵母脂肪酶(CRL)固定化在MOFs材料NH2-MIL-88B外表面并与磁性Fe3O4结合,通过用碳二亚胺(EDC)活化脂肪酶的羧基,在NH2-MIL-88B表面与配体上暴露的氨基结合,磁性Fe3O4在该过程中起到促进CRL-NH2-MIL-88B分离的作用。研究表明,CRL-NH2-MIL-88B催化载体的效率比游离CRL高69%。Liu等[22]采用直接物理吸附法将猪胰脂酶(PPL)固定在微孔MOFs上,这些MOFs包括UiO-66(Zr)、UiO-66NH2(Zr)、MIL-53(Al)等;他们首先将新合成的MOFs浸泡在甲醇和二甲基亚砜的PPL溶液中,然后涡流混合1 h,最后离心5 min得到PPL@MOF粉末;通过傅立叶变换红外光谱仪(FTIR)、X射线衍射仪技术(XRD)和扫描电子显微镜(SEM)等结构表征证实了PPL成功地吸附在MOFs上,并且具有良好的稳定性和结晶度(图2)。表面固定化作为酶固定化中最简单的方法,在开发生物电极和生物传感器的研发等领域普遍适用[23],但不足的是生物酶与MOFs载体的结合力较小,如果外界环境发生变化,容易导致生物酶从MOFs载体上分离脱落。
1.2 共价结合
虽然生物酶可以通过表面固定化法有效地附着在MOFs表面,但是仅仅通过MOFs和生物酶分子之间的弱相互作用形成的固定化酶稳定性较差,MOFs表面的共价结合酶可提高稳定性以及可回收性[24]。目前共价结合法可以分为两种:一种是不同MOFs表面有多种官能团(如:氨基、羟基、羧基等),它们通过共价键将生物酶连接在MOFs表面(图1B);另一种是,首先MOFs载体内的有机连接体通过π-π堆积作用与一些小分子(如染料分子)结合,生物酶再通过氢键与作为锚定分子的染料结合[25]。由于染料分子可以渗透到MOFs的微孔中,生物酶分子悬浮在MOFs的表面即构成了生物酶和MOFs的共价结合。
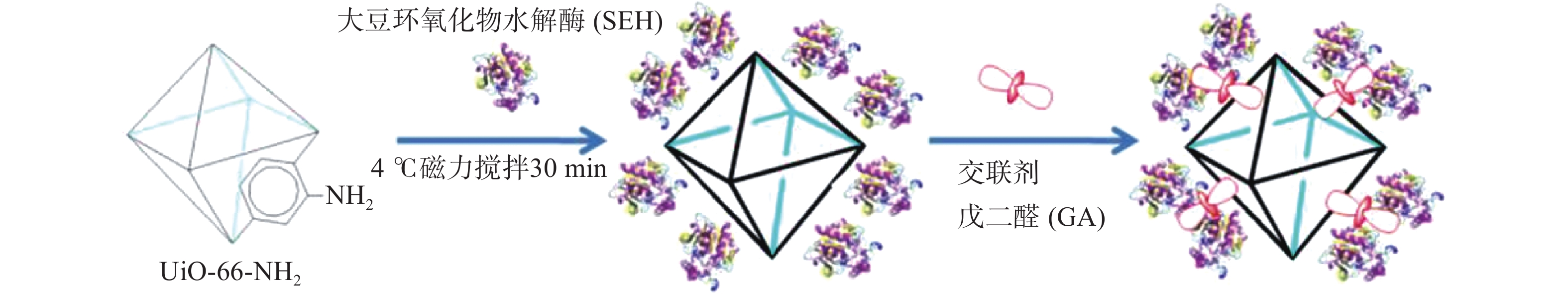
Cao等[26]通过共价键结合的方式将制备的功能化金属有机骨架UiO-66-NH2与大豆环氧化物水解酶(SEH)混合后,添加到100%饱和硫酸铵溶液内,4 ℃磁力搅拌30 min使大豆环氧化物水解酶沉淀,然后注入适量的25%戊二醛(GA)并搅拌可将大豆环氧化物水解酶(SEH)交联到功能化UiO-66-NH2上(图3);经对比,固定化SEH比天然SEH具有更高的稳定性,在储存稳定性研究中,SEH/UiO-66-NH2在4周后显示出其原始活性的97.5%;然而,研究发现由于反应需要添加大量的交联剂和活化剂,同时剧烈的固定化条件(如:高速搅拌)均对大豆环氧化物水解酶的活性造成影响。Liu等[19]首次通过生物酶-染料标记机理的研究,将胰蛋白酶(Trypsin)与含有CYCU-4[Al(OH)(SDC)]和MIL-101的MOFs结合并与染料异硫氰酸荧光素(FITC)混合,获得胰蛋白酶@MOFs共价结合体,证实酶分子与染料结合后,能够进入MOFs的微孔中实现生物酶的固定化。Mohamad等[27]利用4-氯-7-硝基苯并呋喃(NBD)染料的分子尺寸与金属有机骨架(UiO-66)的微孔尺寸相匹配的特点,将NBD用于UiO-66载体固定化胰蛋白酶(Trypsin);NBD染料附着在胰蛋白酶表面使酶稳定性显著提高,同时,NBD还可使UiO-66表面结合位点增多,因此UiO-66 负载酶能力增加,UiO-66负载Trypsin-NBD的量达到80 μg/mg;此外,NBD染料与胰蛋白酶共价结合使染料具有特定的荧光发射,通过检测产物的荧光强度可直接评价回收固定化酶的性能,但Trypsin的活性位点因变形导致活力下降。综上所述,共价结合方法提高了生物酶的稳定性,减少生物酶在反应过程中的泄漏,达到固定化酶的效果;但是,存在使用前需要繁琐的活化程序、MOFs与生物酶分子共价结合需要剧烈的固定化条件等问题,将会制约共价结合方法在工业催化领域的应用。
1.3 孔道包埋
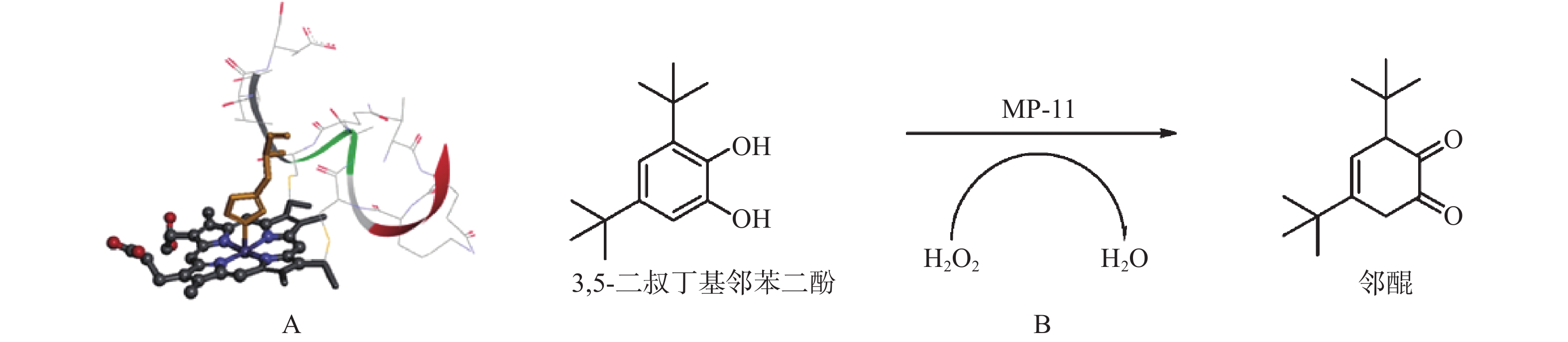
由于MOFs的孔隙尺寸可以被合理地调节,调节后的MOFs的孔径一般比生物酶的直径大,生物酶就很容易地扩散到MOFs的孔中实现生物酶的共固定化(图1C)。根据MOFs的金属结构该固定化方法可以分为两种:生物酶被包埋在未修饰的MOFs中,或包埋在使用致孔剂辅助修饰的MOFs孔中。Tsuruoka等[28]将微过氧化物酶-11(MP-11)固定化在具有较大的孔径(3.9 nm×4.7 nm)的MOFs材料介孔中构建MP-11@MOFs,用于催化H2O2氧化3,5-二叔丁基邻苯二酚生成邻醌(图4);结果表明,与游离MP-11和MOFs相比,MP-11@MOFs复合材料具有较高的反应速率和转化率,通过傅立叶变换红外光谱仪(FTIR)、X射线衍射仪技术(XRD)和扫描电子显微镜(SEM)等结构表征证实MP-11在MOFs孔道存在扩散运动。然而,MOFs载体的孔道只能包埋一些分子量较小、形状规则的生物酶,并且MOFs的微孔尺寸与生物酶分子的直径匹配度低,使得孔道包埋的方法应用范围缩小。因此,MOFs材料作为固定化酶的载体应用到工业生产领域仍然受限制。
1.4 原位合成
目前大多数MOFs的孔径小于生物酶的孔径,生物酶不能通过扩散的方法进入到MOFs孔隙内。为实现在MOFs框架内包封大型生物酶的需求,研究人员针对MOFs内生物酶的原位合成方法进行深入研究[29]。原位合成方法的特点是生物酶的成核和MOFs的形成发生在同一时间(图1D),并且生物酶不在MOFs的微孔或通道中而是被MOFs的骨架包围。
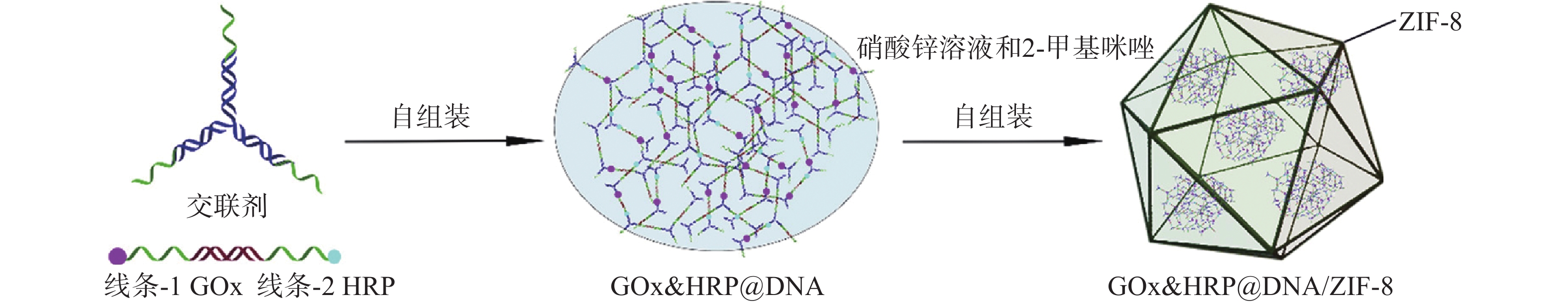
范铮等[30]开发了一种超大介孔稳定的MOFs阵列,用于包封微过氧化物酶(MP-11)、辣根过氧化物酶(HRP)和细胞色素C(Cytc),包封后的生物酶具有可回收性和高催化效率。为提高酶活性和整体催化效率。Chen等[31]引入DNA作为交联剂将葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)制成双酶体系GOx&HRP@DNA,将其与硝酸锌溶液和2-甲基咪唑混合,25 ℃搅拌30 min成功将GOx和HRP封装在沸石咪唑酯骨架(ZIF-8)中构成GOx&HRP@DNA/ZIF-8(图5),该方法能有效抑制生物酶从MOFs骨架中浸出,浸出量比传统方法低10倍以上。综上所述,以MOFs为骨架的生物酶的原位包封,可以使更大的蛋白分子达到固定化效果。然而,MOFs的微孔结构却限制了底物分子与MOFs骨架内的酶接触,为了避免酶失活变性,诱导MOFs生长过程必须保证在温和条件下进行[32]。
2. MOFs-生物酶复合材料的特性
2.1 提高催化活性
与游离酶相比,MOF-生物酶复合物材料表现出更强的催化活性。当生物酶暴露在极端环境或有机溶剂中,生物酶本身的结构会发生变化,同时生物酶活性位点变形导致活力下降[33]。MOFs可以为生物酶分子构建稳定的微环境维持酶的生物活性,有效防止生物酶分子的聚集。固定在MOFs材料上的生物酶会更加稳定,生物酶活性的损失降低,也提高生物酶对恶劣环境的耐受性[34]。2006年,Feng等[35]首次对微过氧化物酶-11(MP-11)在Cu-MOFs中的扩散进行研究,一方面,由于Cu-MOFs的比表面积为1260 m2/g,平均孔径为1.78 nm,适合MP-11的扩散;另一方面,MP-11可以通过扩散包埋到Cu-MOFs介孔中;结果表明,固定化后的MP-11具有较高的酶催化性能。
2.2 提高稳定性
当生物酶暴露在极端的pH、温度或有机溶剂中时,就会发生酶变性。MOFs通过在生物酶和载体之间形成新的化学键,为生物酶提供保护环境,使固定化酶在较高温度下仍然保持稳定[36]。Lin等[37]使用N,N'-二环己基碳二亚胺(DCC)将MOFs材料MIL-101(Cr),MIL-88B(Cr)和MIL-88B-NH2(Cr)激活,激活后表面成的肽键可与胰蛋白酶(Trypsin)紧密结合,通过共价键合制备出胰蛋白酶(Trypsin)-MOFs复合材料;结果表明,Trypsin-MOFs复合材料在极端条件下表现出前所未有的高稳定性,如将胰蛋白酶溶液置于沸水(100 °C)煮沸1 h后,酶的活性和底物选择性未受到影响,酶活性远高于游离胰蛋白酶,这个结果对于酶固定在其他材料上所展现的高稳定性是前所未有的。
2.3 提高可重复使用性
尽管生物酶在催化过程具有高效性和选择性,但恶劣的生产条件下酶可能会发生变性,从而降低了其催化性能和长期可回收性。由于MOFs结构刚性和优异的稳定性能阻止生物酶从金属有机骨架中浸出,故可提高酶的可回收性,减少产品中的酶污染,并且使反应的催化效率得到改善[2]。与游离酶相比,固定化酶最大的优势之一是其可循环利用,这大大降低了生产成本[38]。以金属有机骨架为载体固定化生物酶的合成方法极大地促进了复合材料的生产和发展,MOFs-生物酶复合材料将在工业催化和生物催化中得到广泛的应用。
2.4 其他
酶的固定化可以通过将酶限制在具有保留的酶活性的特定空间中来以低成本的方式提高酶的稳定性、可回收性和回收率。传统固定化酶常见的载体为颗粒[39]、水凝胶[40]、氧化石墨烯[41]、碳纳米管[42]、中孔二氧化硅[43]和聚合物[44]等。将生物酶固定在这些材料上不可避免地出现了低负载率、变性等问题。由于MOFs具有大表面积和孔隙尺寸可调节等特性[45],使MOFs材料可以装载大量的生物酶,负载能力强;并且通过调节不同孔隙的MOFs对反应底物和产物进行尺寸及形状的筛选,使催化反应效率得到显著提高[46]。因此,MOFs-生物酶复合材料可以保持生物酶的完整性和活性,具有较大的研究价值。但是,由于MOFs环境信号的干扰,测定MOFs-生物酶复合材料中生物酶的取向一直是一大难题;同时,生物酶直接进入MOFs的孔隙中易引起生物酶的结构发生变化,致使酶活性降低[47]。因此,以MOFs为载体固定化生物的合成方法有待研究人员进一步优化。
3. MOFs载体固定化生物酶的应用
3.1 构建微反应器
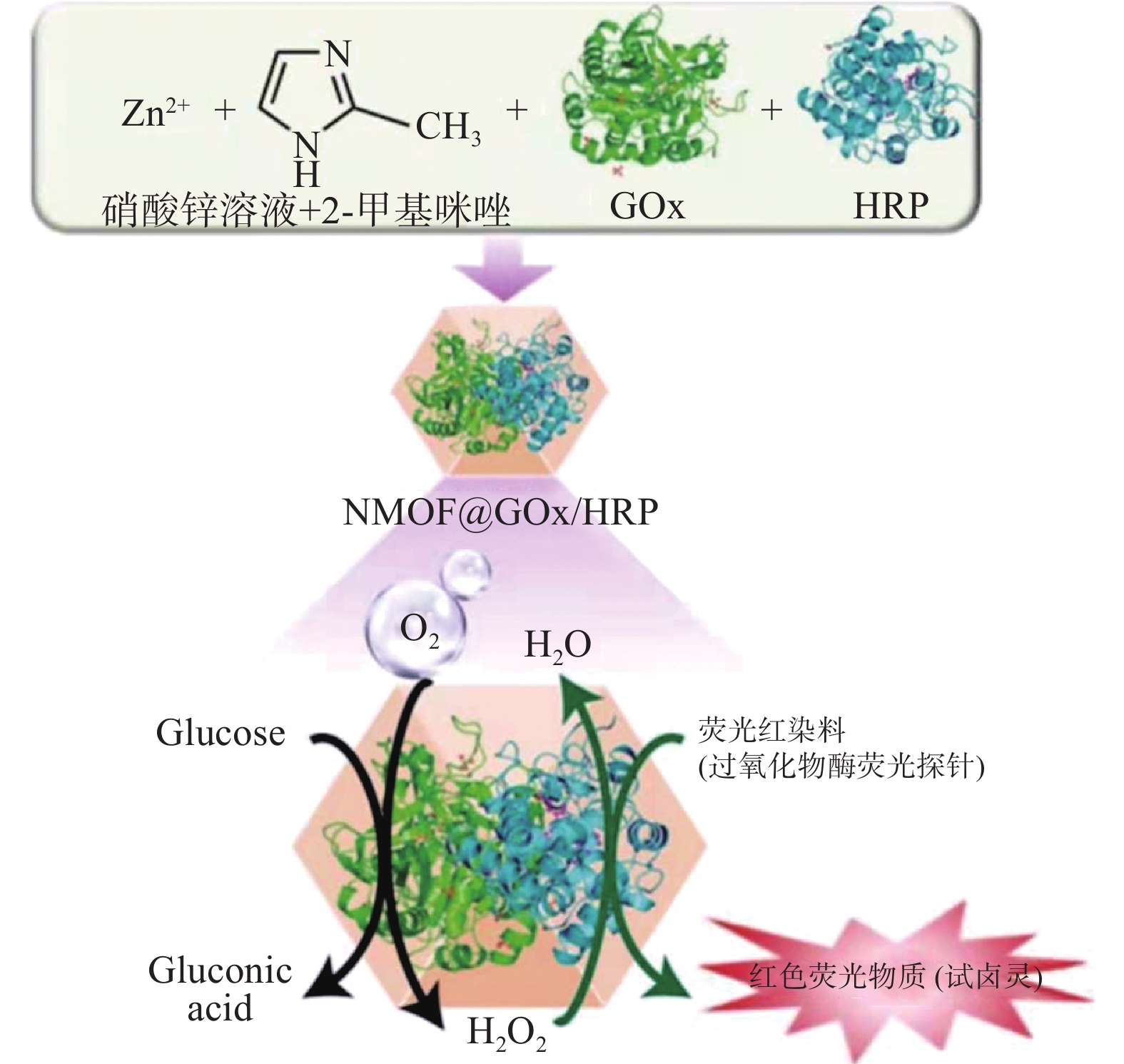
目前,许多研究人员使用MOFs材料固定生物酶以维持生物酶的稳定性,通过构建多酶催化的高性能仿生反应器完成高效催化反应。Wang等[48]通过原位合成法将葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)嵌入沸石咪唑酯骨架(ZIF-8)构成的纳米金属有机框架材料(NMOF)中构成NMOF微反应器(NMOF@GOx/HRP)(图6);GOx催化葡萄糖(Glucose)与氧气反应生成葡萄糖酸(Gluconic acid)和过氧化氢(H2O2),同时HRP催化产物H2O2生成H2O和O2,并催化H2O2与荧光红染料(Amplex Red)产生强烈的红色荧光物质试卤灵(Resorufin),通过FTIR、XRD和SEM等结构表征证实GOx和HRP成功地固定在(ZIF-8)NMOF内,并且封装在NMOF中的GOx或HRP比封装前保留了>90%的酶活性。Zou等[49]成功构建一个双酶微反应器,通过仿生矿化将胰凝乳蛋白酶(Chymotrypsin)封装在金属有机骨架(ZIF-90)框架中,然后将胰蛋白酶(Trypsin)共价吸附在ZIF-90的外表面。与溶液消化相比,微反应器具有更高的稳定性(如:热稳定性、pH稳定性等)。因此,通过改变生物酶的类型可设计出用于多酶催化的高性能仿生反应器,能够进一步开发生物大分子在催化反应中的巨大潜力。
3.2 生物传感与检测
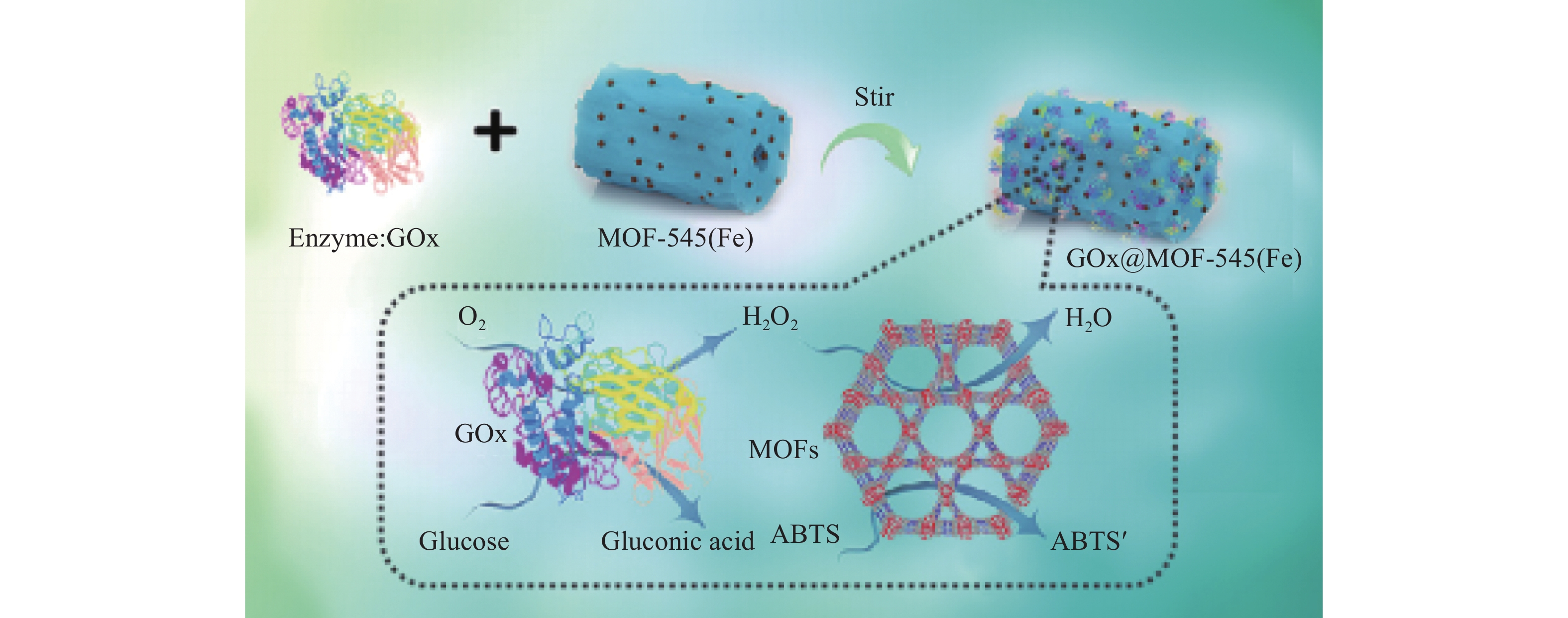
近年来,基于固定化酶生物传感的制备与检测,在临床诊断、食品监测和质量检查等领域引起广泛关注。葡萄糖是维持生物体生命、促进生物体生长必须的一种营养成分,准确测定葡萄糖含量对于糖尿病等疾病的治疗和工业生产的调控具有重要意义[50]。Qiu等[51]利用共价键将葡萄糖氧化酶(GOx)和过氧化物酶(POD)固定化在MOFs材料MIL-101(Al)-NH2表面制备出一种葡萄糖比色生物传感器,可催化葡萄糖生成葡萄糖酸(gluconic acid)和H2O2,同时催化产物H2O2与3,3’,5,5’-四甲基联苯胺(TMB)发生显色反应,通过颜色变化测定溶液中葡萄糖的浓度,该葡萄糖比色生物传感器线性范围在10~1000 μmol/L;将比葡萄糖浓度高3倍的果糖、乳糖和麦芽糖作为对照组,对研发的传感器进行特异性测试,未得到明显的检测信号,说明该生物传感器对于葡萄糖具备较高的选择性。Amarajothi等[52]将GOx固定在MOFs材料[MOF-545(Fe)]上构建GOx@MOF-545(Fe)(图7),有氧条件下催化葡萄糖与(2-乙基苯并噻唑啉)-6-磺酸钠(ABTS)反应生成ABTS+,检测限低(0.28 μmol/L),特异性强,也可用于葡萄糖的快速检测;此外,GOx@MOF-545(Fe)在贮藏7 d后仍保持其原有活性的92%,而在类似条件下游离酶的活性仅保持40%,说明该固定化酶提高其原有游离酶的稳定性。
3.3 药物输送与靶向治疗
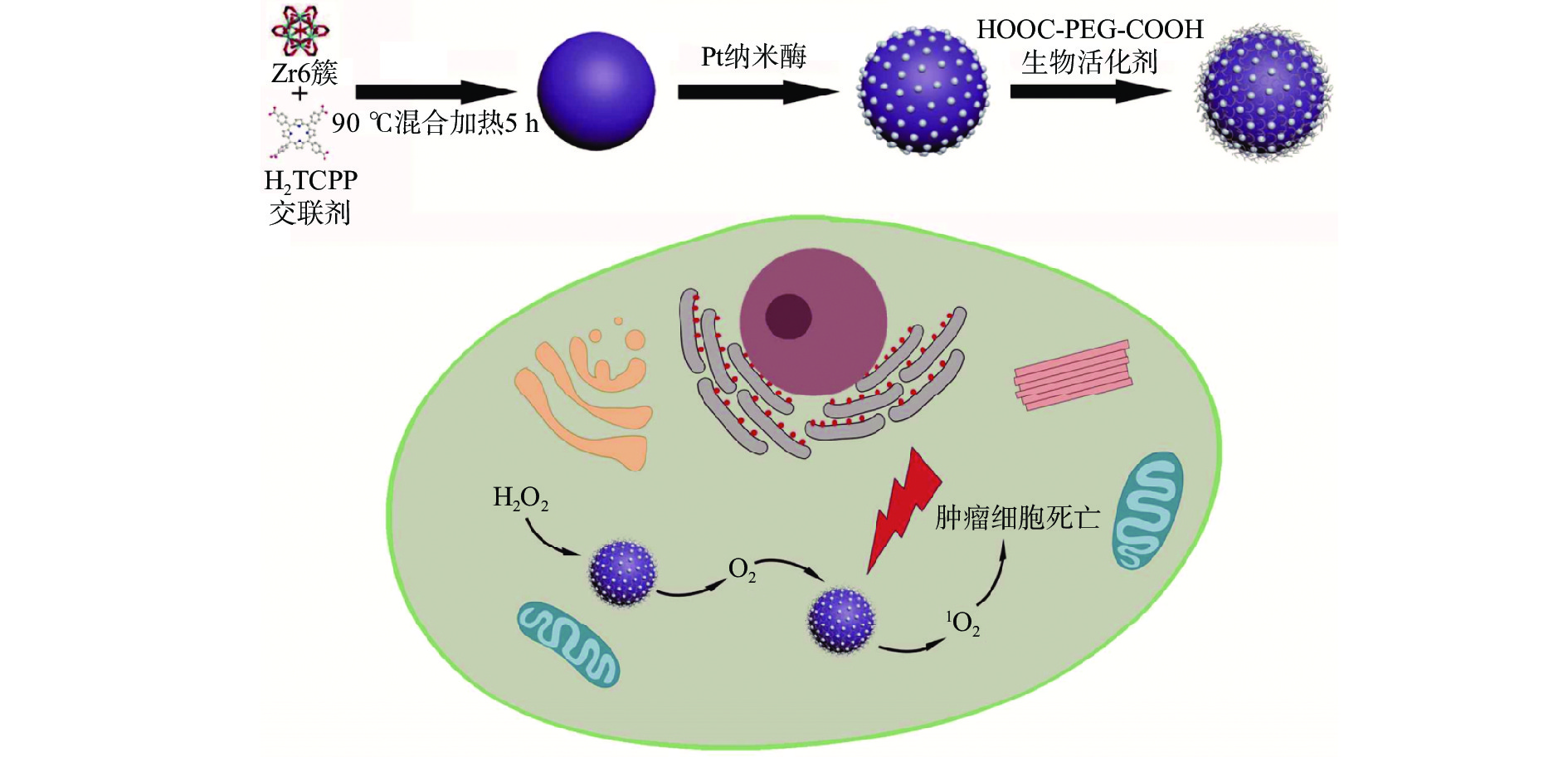
MOFs大表面积和高孔隙率的特点使其具有高负载能力。目前,被广泛用于各种生物医学应用,如药物输送[53]、临床肿瘤监测及治疗[54]等。肿瘤细胞的快速增殖过程需要消耗大量的葡萄糖,葡萄糖氧化酶(GOx)可以催化葡萄糖产生葡萄糖醛酸(gluconic acid)和过氧化氢(H2O2),研究人员基于该原理研发出一种饥饿性协同癌症治疗方法,引入GOx用于抑制癌细胞快速增长。Zhang等[55]通过将GOx和前药替拉扎明(Tirapazamine,TPZ)封装在红细胞膜包裹的MOFs纳米粒子中,研制了一种仿生纳米反应器;该仿生纳米反应器可以将GOx输送到肿瘤细胞,并耗尽肿瘤细胞内的葡萄糖,有效阻断肿瘤营养供应。Zhang等[56]将具有类过氧化氢酶活性的铂(Pt)纳米酶固定在MOFs材料Zr基卟啉(PCN-224)内,成功制备了一种新型的纳米复合材料PCN-224@Pt(图8),此时PCN-224@Pt具有高稳定性和良好的过氧化氢酶活性,能分解肿瘤内H2O2并在肿瘤内原位生成O2,利用其产生的细胞毒性1O2对癌细胞造成严重损伤。酶激活前药疗法(Enzyme Activation Prodrug Therapy,EAPT)是一种广泛使用且有效的癌症治疗方法,通过将前药转化为药物,其关键步骤是前药激活,比常规化疗法具有更好的选择性,并且对人体伤害性降低[57]。由于PCN-333纳米颗粒具有较高的酶包埋能力,易被荧光团修饰,化学性质稳定性等特点。Lian[58]将其作为生物酶载体,用于实现肿瘤特异性前药激活。选择酪氨酸酶(TYR)作为激活酶,并将其装载在PCN-333纳米颗粒(NPCN-333)中,形成一种纳米酶复合反应器TYR@NPCN-333。细胞毒性来自对乙酰氨基酚(APAP)的酶促转化产物4-乙酰氨基-邻-苯醌(AOBQ),TYR@NPCN-333通过产生活性氧(ROS)和消耗谷胱甘肽(GSH),可持续激活癌细胞中的前药APAP。结果表明,无毒前药APAP可以被TYR@NPCN-333有效激活,产生细胞毒性化合物,抑制癌细胞增殖,诱导癌细胞凋亡。用TYR@NPCN-333和APAP治疗后,肿瘤体积消退了2.5倍,故在药物输送与肿瘤靶向治疗方面,更加高效,对人体的伤害性更低。
4. 结论与展望
作为稳定性强、高效的固定化酶的载体,金属有机骨架MOFs使生物酶的稳定性、催化活性、可回收性等得到显著提升,构建的MOFs固定化酶复合材料在不同领域应用均体现出它独特的优势。但同时MOFs载体固定化生物酶也存在一些待解决的问题:其一,绝大多数MOFs材料在极端的条件下(如溶剂、pH等)性质不稳定,严重阻碍它们在实际条件下作为酶固定化载体的应用。其二,由于MOFs的微孔尺寸与生物酶分子的直径不匹配,使MOFs材料作为固定化酶的载体应用到生产领域仍然受限制。其三,由于生物酶不能通过扩散的方法进入到MOFs孔隙内,其直接进入MOFs的孔隙中易引起酶的结构变化,使酶活性降低。今后,希望致力于提高MOFs的结构稳定性和适用性方面的研究,开发、设计新型MOFs材料以固定不同种类的生物酶,并向一次催化多种反应的MOFs固定化酶方向发展。
-
-
[1] FAN K, JIN Z L, YUAN H, et al. Construction of CuO-modified zeolitic imidazolate framework-9 for photocatalytic hydrogen evolution[J]. Chinese J Catal,2017,38(12):2056−2066. doi: 10.1016/S1872-2067(17)62969-3
[2] HU Y, DAI L, LIU D, et al. Progress & prospect of metal-organic frameworks (MOFs) for enzyme immobilization (enzyme/MOFs)[J]. Renewable and Sustainable Energy Reviews,2018,91:793−801. doi: 10.1016/j.rser.2018.04.103
[3] 张贺, 李国良, 张可刚, 等. 金属有机骨架材料在吸附分离研究中的应用进展[J]. 化学学报,2017,75(9):841−859. [ZHANG H, LI G L, ZHANG K G, et al. Progress in the application of metal-organic framework materials in the study of adsorption and separation[J]. Acta Chimica Sinica,2017,75(9):841−859. doi: 10.6023/A17040168 [4] ZHAO J P, XU J, HAN S D, et al. A niccolite structural multiferroic metal-organic framework possessing four different types of bistability in response to dielectric and magnetic modulation[J]. Adv Mater,2017,29(23):1606966. doi: 10.1002/adma.201606966
[5] MOHAMMED K, BAO L D. Metal-organic frameworks (MOFs) in water filtration membranes for desalination and other applications[J]. Appl Mater Today,2018,11:219−230. doi: 10.1016/j.apmt.2018.02.008
[6] ALI S, ZAFAR W, SHAFIQ S, et al. Enzymes immobilization: An overview of techniques[J]. Support Materials and Its Applications, 2017, 3(1): 1−9.
[7] AGARWAL P K. A biophysical perspective on enzyme catalysis[J]. Biochemistry,2018,58(6):438−449.
[8] PENTYALA V, DAVYDOVSKAYA P, ADE M, et al. Carbon dioxide gas detection by open metal site metal organic frameworks and surface functionalized metal organic frameworks[J]. Sensors and Actuators B: Chemical,2016,225:363−368. doi: 10.1016/j.snb.2015.11.071
[9] MOREIRA W C, ELIAS A, OSÓRIO W R, et al. Alternative method to improve the ethyl valerate yield using an immobilised Burkholderia cepacia lipase[J]. J Microencapsul,2019,36(5):1−28.
[10] CASTILLO E, CASAS G L, SANDOVAL G. Medium-engineering: A useful tool for modulating lipase activity and selectivity[J]. Biocatalysis,2016,1(1):653−667.
[11] PATIDAR M K, NIGHOJKAR S, KUMAR A, et al. Pectinolytic enzymes-solid state fermentation, assay methods and applications in fruit juice industries: A review[J]. Biotech,2018,8(4):199.
[12] SHAFI A, AHMED F, HUSAIN Q. β-galactosidase mediated synthesized nanosupport for the immobilization of same enzyme: Its stability and application in the hydrolysis of lactose[J]. International Journal of Biological Macromolecules,2021,184:57−67. doi: 10.1016/j.ijbiomac.2021.06.034
[13] WANG C, KIM J, MALGRAS V, et al. Metal-organic frameworks and their derived materials: Emerging catalysts for a sulfate radicals-based advanced oxidation process in water purification[J]. Small,2019,15(16):1900744. doi: 10.1002/smll.201900744
[14] YOUNG C, KIM J, KANETI Y V, et al. One-step synthetic strategy of hybrid materials from bimetallic metal-organic frameworks(MOFs) for supercapacitor applications[J]. ACS Appl Energy Mater,2018,1(5):2007−2015. doi: 10.1021/acsaem.8b00103
[15] SAMUEL O O, CHRISTOPHER J C, DONALD G T, et al. ChemInform abstract: Quantum-chemical characterization of the properties and reactivities of metal-organic frameworks[J]. Chem Rev,2015,115(12):6051−6111. doi: 10.1021/cr500551h
[16] LIU Y, CHENG H, CHENG M, et al. The application of zeolitic imidazolate frameworks (ZIFs) and their derivatives based materials for photocatalytic hydrogen evolution and pollutants treatment[J]. Chem Eng J,2020:127914.
[17] WANG Q, LIAN X, YU F, et al. Applications of immobilized bio-catalyst in metal-organic frameworks[J]. Catalysts,2018,8(4):166. doi: 10.3390/catal8040166
[18] PISKLAK T J, MACÍAS M, COUTINHO D H, et al. Hybrid materials for immobilization of MP-11 catalyst[J]. Topics in Catalysis,2006,38(4):269−278. doi: 10.1007/s11244-006-0025-6
[19] LIU W L, LO S H, SINGCO B, et al. Novel trypsin-FITC@MOF bioreactor efficiently catalyzes protein digestion[J]. J Mater Chem,2013,1:928−932. doi: 10.1039/c3tb00257h
[20] LI S Q, LIU X D, CHAI H X, et al. Recent advances in the construction and analytical applications of metal-organic frameworks-based nanozymes[J]. TRAC-Trend Anal Chem,2018,105:391−403. doi: 10.1016/j.trac.2018.06.001
[21] CUI J D, REN S Z, SUN B T, et al. Optimization protocols and improved strategies for metal-organic frameworks for immobilizing enzymes: Current development and future challenges[J]. Coord Chem Rev,2018,370:22−41. doi: 10.1016/j.ccr.2018.05.004
[22] LIU W L, YANG N S, CHEN Y T, et al. Lipase-supported metal-organic framework bioreactor catalyzes warfarin synthesis[J]. Chemistry–A European Journal,2015,21(1):115−119. doi: 10.1002/chem.201405252
[23] LIAN X, FANG Y, JOSEPH E, et al. Enzyme-MOF (metal-organic framework) composites[J]. Chemical Society Reviews,2017,46(11):3386−3401. doi: 10.1039/C7CS00058H
[24] LIN C H, LIRIO S, SHIH Y H, et al. Fast multipoint immobilization of lipase through chiral L-proline on MOF as chiral bioreactor[J]. DalTon T, 2021.
[25] SAMAHE S, MAJID M, VAHIDEH Z, et al. SBA-15/hydrotalcite nanocomposite as an efficient support for the immobilization of heteropolyacid: A triply-hybrid catalyst for the synthesis of 2-amino-4H-pyrans in water[J]. Applied Surface Science,2017,426:881−889. doi: 10.1016/j.apsusc.2017.06.182
[26] CAO S L, YUE D M, LI X H, et al. Novel nano-/microbiocatalyst: Soybean epoxide hydrolase immobilized on UiO-66-NH2 MOF for efficient biosynthesis of enantiopure (R)-1, 2-octanediol in deep eutectic solvents[J]. ACS Sustain Chem Eng,2016,4:3586−3595. doi: 10.1021/acssuschemeng.6b00777
[27] MOHAMAD N R, MARZUKI N, BUANG N A, et al. An overview of technologies for immobilization of enzymes and surface analysis techniques for immobilized enzymes[J]. Biotechnol Biotec Eq,2015,29(2):205−220. doi: 10.1080/13102818.2015.1008192
[28] TSURUOKA T, HATA M, HIRAO S, et al. Formation of metal-organic frameworks on a metal ion-doped polymer substrate: In-depth time-course analysis using scanning electron microscopy[J]. Langmuir,2019,35(32):10390−10396. doi: 10.1021/acs.langmuir.9b01676
[29] SONG J, HE W, SHEN H, et al. Construction of multiple enzyme metal–organic frameworks biocatalyst via DNA scaffold: A promising strategy for enzyme encapsulation[J]. Chemical Engineering Journal,2019,363:174−182. doi: 10.1016/j.cej.2019.01.138
[30] 范铮, 唐咸昌, 张旭, 等. 金属有机骨架材料载体用于酶固定化的研究进展[J]. 化工进展,2019,38(10):4606−4613. [FAN Z, TANG X C, ZHANG X, et al. Research progress in immobilization of enzymes on metal organic frameworks[J]. Progress in Chemical Industry,2019,38(10):4606−4613. [31] CHEN W H, MARGARITA V G, AMANI Z, et al. Biocatalytic cascades driven by enzymes encapsulated in metal-organic framework nanoparticles[J]. Nat Catal,2018,1:689−695. doi: 10.1038/s41929-018-0117-2
[32] TAN A, LIM C, ZOU S, et al. Electrochemical nucleic acid biosensors: From fabrication to application[J]. Analytical Methods,2016,8(26):5169−5189. doi: 10.1039/C6AY01221C
[33] 何连顺. 生物酶催化在工业合成中的应用[J]. 中国高新科技,2020(13):137−138. [HE L S. Application of biological enzyme catalysis in industrial synthesis[J]. Chinese Journal of High and New Technology,2020(13):137−138. doi: 10.3969/j.issn.2096-4137.2020.13.062 [34] SHER H, ALI H, RASHID M H, et al. Enzyme immobilization on metal-organic framework(MOF): Effects on thermostability and function[J]. Protein and Peptide Letters,2019,26(9):636−647. doi: 10.2174/0929866526666190430120046
[35] FENG D W, LIU T F, SU J, et al. Stable metal-organic frameworks containing single-molecule traps for enzyme encapsulation[J]. Nat Commun,2015,6(1):5979. doi: 10.1038/ncomms6979
[36] GASCÓN V, JIMÉNEZ M B, BLANCO R M, et al. Semi-crystalline Fe-BTC MOF material as an efficient support for enzyme immobilization[J]. Catalysis Today,2018,304:119−126. doi: 10.1016/j.cattod.2017.10.022
[37] LIN C P, XU K, ZHENG R C, et al. Immobilization of amidase into a magnetic hierarchically porous metal-organic framework for efficient biocatalysis[J]. Chem Comm, 2019, 55(40).
[38] WANG L, GUAN S, BAI J, et al. Enzyme immobilized in BioMOFs: Facile synthesis and improved catalytic performance[J]. International Journal of Biological Macromolecules,2020,144:19−28. doi: 10.1016/j.ijbiomac.2019.12.054
[39] 孙宁. 磁性颗粒聚集体表面复合修饰及固定化酶研究[D]. 广州: 华南理工大学, 2017. SUN N. Research on surface composite modification of magnetic particle aggregate and immobilized enzyme[D]. Guangzhou: South China University of Technology, 2017.
[40] 陈辉, 黄惠华. 菠萝皮渣羧甲基纤维素/海藻酸钠复合水凝胶珠固定化菠萝蛋白酶的制备及稳定性研究[J]. 食品工业科技,2020,41(6):131−134,141. [CHEN H, HUANG H B. Preparation and stability of immobilized bromelain in pineapple peel residue carboxymethylcellulose/sodium alginate composite hydrogel beads[J]. Science and Technology of Food Industry,2020,41(6):131−134,141. [41] HERMANOVÁ S, ZAREVÚCKÁ M, BOUŠA D, et al. Graphene oxide immobilized enzymes show high thermal and solvent stability[J]. Nanoscale,2015,7(13):58522−58528.
[42] 李丽娟, 夏文静, 马贵平. 碳纳米管固定化纤维素酶的最佳工艺研究[J]. 生物技术进展,2020,10(4):426−431. [LI L J, XIA W J, MA G P. Study on the best technology of immobilizing cellulase on carbon nanotubes[J]. Progress in Biotechnology,2020,10(4):426−431. [43] PAULAMI M, ANEES Y K, RAJDIP B. Diffusion, adsorption and reaction of glucose in glucose oxidase enzyme immobilized mesoporous silica (SBA-15) particles: Experiments and modeling[J]. Biochemical Engineering Journal,2016,105:489−496. doi: 10.1016/j.bej.2015.10.011
[44] 王宁. 聚合物改性的纳米载体固定化脂肪酶的研究[D]. 芜湖: 安徽工程大学, 2018. WANG N. Study on immobilization of lipase on polymer-modified nanocarriers[D]. Wuhu: Anhui University of Technology, 2018.
[45] STRAUS D B, CAVA R J. Self-assembly of a chiral cubic three-connected net from the high symmetry molecules C60 and SnI4[J]. J Am Chem Soc,2020,142(30):13155−13161. doi: 10.1021/jacs.0c05563
[46] 林真真. 基于MOFs的贵金属Ru/磺酸双功能催化剂的合成及其在生物质转化中的应用[D]. 金华: 浙江师范大学, 2018. LIN Z Z. Synthesis of noble metal Ru/sulfonic acid bifunctional catalyst based on MOFs and its application in biomass conversion[D]. Jinhua: Zhejiang Normal University, 2018.
[47] PAN Y, LI H, FARMAKES J, et al. How do enzymes orient when trapped on metal–organic framework (MOF) surfaces?[J]. Journal of the American Chemical Society,2018,140(47):16032−16036. doi: 10.1021/jacs.8b09257
[48] WANG Q Q, ZHANG X P, HUANG L, et al. GOx@ZIF-8(NiPd) nanoflower: An artificial enzyme system for tandem catalysis[J]. Angew Chem Int Ed Engl,2017,129(50):16298−16301. doi: 10.1002/ange.201710418
[49] ZOU Y L, LIU X Y, ZHANG H X. A dual enzyme-containing microreactor for consecutive digestion based on hydrophilic ZIF-90 with size-selective sheltering[J]. Colloids Surf B,2021,197:111422. doi: 10.1016/j.colsurfb.2020.111422
[50] 冯东, 李秋顺, 刘凤, 等. 葡萄糖的测定方法与应用研究进展[J]. 传感器与微系统,2015,34(12):5−8. [FENG D D, LI Q S, LIU L, et al. Glucose determination method and application research progress[J]. Sensors and Microsystems,2015,34(12):5−8. [51] QIU Q M, CHEN H Y, WANG Y X, et al. Recent advances in the rational synthesis and sensing applications of metal-organic framework biocomposites[J]. Coordination Chemistry Reviews,2019,387:60−78. doi: 10.1016/j.ccr.2019.02.009
[52] AMARAJOTHI D, ABDULLAH M A, HERMENEGILDO G. Integration of metal organic frameworks with enzymes as multifunctional solidsfor cascade catalysis[J]. Dalton Trans, 2020, 49(32): 11059−11072.
[53] WU M X, YANG Y W. Metal-organic framework (MOF)-based drug/cargo delivery and cancer therapy[J]. Advanced Materials,2017,29(23):1606134. doi: 10.1002/adma.201606134
[54] 张凯. 功能化金属有机框架纳米材料在肿瘤诊疗中的应用[D]. 北京: 北京科技大学, 2020. ZHANG K. Application of functionalized metal-organic framework nanomaterials in tumor diagnosis and treatment[D]. Beijing: University of Science and Technology Beijing, 2020.
[55] ZHANG K, MENG X, CAO Y, et al. Metal-organic framework nanoshuttle for synergistic photodynamic and low-temperature photothermal therapy[J]. Advanced Functional Materials,2018,28(42):1804634. doi: 10.1002/adfm.201804634
[56] ZHANG X L, LI G L, WU D, et al. Recent progress in the design fabrication of metal-organic frameworks-based nanozymes and their applications to sensing and cancer therapy[J]. Biosensors and Bioelectronics,2019,137:178−198. doi: 10.1016/j.bios.2019.04.061
[57] DU B J, LI D, WANG J, et al. Designing metal-contained enzyme mimics for prodrug activation[J]. Advanced Drug Delivery Reviews,2017,118:78−93. doi: 10.1016/j.addr.2017.04.002
[58] LIAN X. Design and synthesis of enzyme-MOF (Metal-organic framework) composites for long-persistent biomedical applications[D]. Texas: Texas A & M University, 2018.
-
期刊类型引用(3)
1. 李巧莲,罗景阳,周长民,王岩松,袁帅,李娇,刘鑫,张承昕. 超高效液相色谱-四级杆/静电场轨道阱高分辨质谱法测定6种水果和蔬菜中41种农药残留. 中国食品添加剂. 2025(02): 143-153 .  百度学术
百度学术
2. 李巧莲,王岩松,罗景阳,宣彤. 液相色谱串联三重四极杆复合线性离子阱质谱法测定水果和蔬菜中43种杀菌剂残留量. 食品与机械. 2024(07): 53-62 .  百度学术
百度学术
3. 扈斌,蒋康丽,连思雨,崔宗岩,范春林,王明林,陈辉,连玉晶,吕美玲,王雯雯. 自动QuEChERS结合液相色谱-串联质谱法测定香叶中的212种农药残留. 食品安全质量检测学报. 2022(04): 1114-1122 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



