Optimization of Preparation Process of Polypeptide Metal Chelates from the Scales of American red fish (Sciaenops ocellatus)
-
摘要: 本文研究并优化了以美国红鱼(Sciaenops ocellatus)鱼鳞为原料制备多肽及合成多肽金属螯合物的工艺条件。以美国红鱼鱼鳞为原料制备多肽,采用凝胶色谱分析多肽的分子量;利用水体系法合成多肽金属螯合物并采用EDTA络合滴定法测定金属螯合率;设计并利用L9(34)正交试验优化了多肽金属螯合物工艺条件;利用红外光谱检测多肽和多肽金属螯合物,验证多肽与金属的结合。凝胶色谱分析获得多肽分子量在1~6 kDa左右,正交试验获得了多肽金属螯合物的制备工艺条件,即多肽锌螯合物的工艺条件为质量比2:1、pH5.5、温度55 ℃、时间60 min;多肽铜螯合物的工艺条件为质量比2:1、pH6.0、温度35 ℃、时间55 min,在该最佳螯合条件下制备的多肽锌、铜螯合物的螯合率分别为78.21%、91.24%。红外吸收光谱结果显示Zn2+、Cu2+与-NH2结合成功,表明多肽锌、铜螯合物是新的物质。研究结果表明,该工艺条件下的螯合率明显提高,且富含金属离子、成本低廉、市场前景可观,有利于海洋水产加工副产物高值化应用,促进渔业加工产业的技术升级。Abstract: In this paper, the preparation of polypeptides and the synthesis of polypeptide metal chelates from American red fish(Sciaenops ocellatus )scales were studied and optimized. Polypeptides were prepared from the scales of American red fish. The molecular weight of the peptides was analyzed by gel chromatography. Polypeptide metal chelates were synthesized by water system method and the metal chelating rate was determined by EDTA complexometric titration method. L9(34) orthogonal test was used to optimize the processing conditions of polypeptide metal chelates. The binding of polypeptide to metal was verified by detecting polypeptide and metal chelate by infrared spectroscopy. The molecular weight of polypeptide was about 1~6 kDa by gel chromatography analysis. The preparation conditions of polypeptide zinc chelate were obtained by orthogonal experiment, that is, the mass ratio of zinc chelate was 2:1, pH5.5, temperature 55℃, time 60 min. The optimal chelating conditions were mass ratio 2:1, pH6.0, temperature 35℃ and time 55 min. Under the optimized condition, the chelate ratio of zinc and copper were 78.21% and 91.24% respectively. The infrared absorption spectra showed that Zn2+, Cu2+ and -NH2 were successfully combined. The results showed that the chelation rate was significantly improved under the condition of this process, and it was rich in metal ions, low cost and promising market prospect, which would be conducive to the high-value application of marine fishery processing by-products and promote the technological upgrading of fishery processing industry.
-
金属元素锌、铜虽然在人和动物体内含量微乎其微,但对其健康至关重要,是维持机体生命活动和生长发育的重要营养物质。锌、铜参与体内大多数酶类、血红蛋白和某些氧化酶的组成,对机体、神经系统及结缔组织各器官的发育有重要作用[1-3]。微量元素以无机盐形式存在于体内,其利用率易受pH、脂类、蛋白质、纤维素、氧化物、维生素、植酸盐及霉菌毒素的影响[4],在动物体内的吸收差,总的生物利用率低于20%,有的甚至更低。而多肽金属螯合物是将金属元素与机体必需营养源多肽结合而制成的新一代营养添加剂[5],其多肽具有保护胃粘膜、抗溃疡、促进骨形成、皮肤胶原代谢等生理功能[6],结合金属元素后在混料中结构稳定,吸收效率高、对维生素E、C的破坏作用明显小于无机盐[7],在体内溶解性好且易于吸收,对机体无刺激作用,可起到既补充微量元素又补充体内多肽的双重效果,进一步拓展了多肽研究领域,同时也可以降低补充剂服用的成本[8]。
目前多肽螯合盐多以植物蛋白或陆源动物蛋白为原料,成本较高且安全性也受到较大质疑,而以水产下脚料为原料的报道不多。美国红鱼(Sciaenops ocellatus)为美国西洋沿岸及墨西哥湾的重要鱼种[9],其鱼鳞蛋白含量高达41.9%,而脂肪含量仅低为0.08%。目前在我国沿海各省市均有大规模养殖,2020年我国美国红鱼养殖量达7.02万吨,在海水养殖鱼类产量中排第五位[10],与其他鱼类相比产量较大。美国红鱼加工过程中产生的鱼鳞等废弃下脚料占鱼体总重约30%,如果不进行合理利用,势必造成海洋资源浪费及环境污染等不良后果。本文以美国红鱼鱼鳞为原料,采用生物酶水解获得鱼鳞多肽制品,利用水体系法合成多肽锌、铜螯合物并进行单因素和正交法联用优化了其制备工艺条件。所得多肽金属螯合物能同时补充机体所需的蛋白质和金属元素,有效促进动物生产性能,解决现有饲料添加剂的不足,另一方面也有利于低值水产副产物高值化利用,促进渔业加工等农业、食品企业的技术升级。
1. 材料与方法
1.1 材料与仪器
美国红鱼(Sciaenops ocellatus)鱼鳞 购自福建东山;无水硫酸铜、硫酸锌、无水乙醇(AR)、二甲酚橙 西陇科学股份有限公司;氢氧化钠、盐酸 国药集团化学试剂有限公司;0.05 mol/L EDTA标准液 上海德榜化工有限公司;溴化钾PAN 南京安培化工科技有限公司;所有分离用有机溶剂 均为国产分析纯;胰蛋白酶(酶活250万 U/g,最适酶解pH7.5)、木瓜蛋白酶(酶活10万 U/g,最适酶解pH6.5) 南宁庞博生物工程有限公司;凝胶色谱用蛋白标准品 Sigma公司。
DK-8D数显恒温水浴锅 金坛市亿能实验仪器厂;TG18-WS台式高速离心机 长沙维尔康湘鹰离心机有限公司;AKTA-Purifier凝胶色谱柱 美国GE公司;Sephadex 200 10/300 GL(柱体积23.56 mL)、Sephadex peptide 10/300GL(柱体积23.56 mL)、DZF-6032真空干燥箱 上海精宏实验设备有限公司;玛瑙研钵 阜新蒙古族自治县伟成玛瑙制品厂;德国VERTEX70傅里叶红外光谱仪器 德国Bruker有限公司;BY-40红外光谱仪压片机 杭州格图科技有限公司;UV-2550紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 美国红鱼鱼鳞多肽的制备
鱼鳞直接清水清洗并浸泡1 d后晒干得干净白色鱼鳞。参考本实验室前期已优化工艺对鱼鳞进行前处理,采用吴琴琴等[11]脱脂方法,以食品级NaHCO3为脱脂皂化试剂,选择温度18 ℃,碱浓度0.5 mol/L,浸泡8 h进行脱脂处理;采用唐旭等[12]脱钙方法,取脱脂后洗涤干燥鱼鳞按料液比1:10 g/mL,温度18 ℃,盐酸浓度0.8 mol/L,浸泡24 h进行脱钙处理。将脱脂脱钙处理后的鱼鳞清水洗涤后,晾干后室温真空干燥24 h后保存备用。处理后鱼鳞通过前期预实验选择最适酶解条件,先进行胰酶处理,条件为加酶量0.05 g/g鱼鳞,温度50 ℃,底物浓度10%,酶解pH6.5,时间2.5 h;后用木瓜蛋白酶进行二次水解[13],条件为加酶量0.04 g/g鱼鳞,温度65 ℃,底物浓度10%,酶解pH6.0,时间1.5 h;两次酶解后置于90 ℃条件下水浴30 min灭酶活;对所获得的样品溶液冷却至室温后进行膜过滤纯化、喷雾干燥(进风温度140 ℃,出风温度90 ℃),最终获得鱼鳞多肽粉末样品,干燥保存备用。
1.2.2 多肽的分子量检测
将1.2.1制备所的的多肽粉末0.5 g溶于100 mL去离子水,稀释5倍,经0.45 μm微孔滤膜过滤后,自动进样至Sephadex 200和Sephadex peptide凝胶柱,分析鱼鳞蛋白水解后的分子量分布,上样体积为50 μL,0.05 mol/L的PBS缓冲液(pH7.45)作洗脱液,0.5 mL/min流速,0.7 MPa,柱温室温,检测波长为215~220 nm,与标准蛋白对照品比对,检测分析水解所得的蛋白肽的分子量分布,数据处理使用系统自带软件UNICORN 5.2。
1.2.3 多肽-金属螯合物制备及纯化
采用水体系合成法[14],将1.2.1制得的鱼鳞多肽粉末与去离子水配成3%多肽水溶液,在多肽水溶液中分别加一定比例无机盐(硫酸锌、五水合硫酸铜)后调节溶液pH,置于恒温水浴中分别进行螯合反应得多肽-金属螯合物溶液。室温冷却后以5000 r/min离心5 min取上清液;按上清液与乙醇体积比(多肽-锌螯合物1:8,多肽-铜螯合物1:10)加入无水乙醇进行醇沉,边加边搅拌,析出沉淀后5000 r/min离心10 min,弃上清取沉淀;用无水乙醇洗涤沉淀3次后将所得固体沉淀50 ℃真空干燥,即得多肽-金属螯合物样品。
1.2.4 多肽-金属螯合物螯合率的测定
采用EDTA络合滴定法[15]滴定多肽金属螯合物中锌、铜的含量并计算其螯合率,每组试验重复三次。
称量0.2 g多肽螯合物于250 mL锥形瓶中,加入50 mL去离子水,滴加3滴二甲酚橙或PAN作指示剂,用0.02 mol/L EDTA标准溶液滴定,记下所消耗溶液的体积V0。另称相同质量的多肽螯合物样品,加50 mL乙醇,水浴温热并充分搅拌后4000 r/min离心10 min,沉淀用蒸馏水洗,定容到100 mL,摇匀。取25 mL到250 mL锥形瓶中,加3滴PAN指示剂或二甲酚橙指示剂,用0.02 mol/L EDTA溶液滴定,记下所消耗溶液的体积V1。螯合率计算公式如下:
螯合率(%)=(螯合态微量元素的含量/微量元素的总量)×100=(CV1/CV0)×100=(V1/V0)×100
式中:C为EDTA溶液的浓度,mol/L;V1为滴定螯合态微量元素所消耗的EDTA溶液体积,mL;V0为滴定微量元素的总量所消耗的EDTA溶液体积,mL。
1.2.5 鱼鳞多肽金属螯合物的工艺优化
1.2.5.1 鱼鳞多肽金属螯合物的单因素实验
以多肽金属螯合率为指标进行单因素实验。多肽金属螯合物制备中质量比的影响:pH为6.0,螯合时间为50 min,螯合温度为50 ℃,多肽与金属盐的质量比分别为1:2、1:1、2:1、3:1、4:1、5:1。pH的影响:多肽与金属盐质量比为2:1,螯合时间为50 min,螯合温度为50 ℃,pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。螯合温度的影响:多肽与金属盐质量比为2:1,螯合时间为50 min,pH为7.0,螯合温度分别为20、30、40、50、60、70、80 ℃。螯合时间的影响:多肽与金属盐质量比为2:1,pH为7.0,螯合温度为50 ℃,螯合时间分别为20、30、40、50、60、70、80、90 min。
1.2.5.2 鱼鳞多肽锌、铜螯合物制备的正交试验
根据单因素实验结果和正交试验设计原理,以螯合率作为试验评价指标,以反应物的质量比、pH、螯合温度、螯合时间为考察因素,每个因素分别按3水平,设计L9(34)正交表进行试验,试验因素水平见表1和表2。
表 1 多肽-锌螯合物的正交试验因素水平表Table 1. Factor levels for orthogonal test of polypeptide-zinc chelates水平 因素 质量比A pH B 反应温度C(℃) 反应时间D(min) −1 1:1 4.5 45 55 0 2:1 5.0 50 60 1 3:1 5.5 55 65 表 2 多肽-铜螯合物的正交试验因素水平表Table 2. Factor levels for orthogonal test of polypeptide-copper chelates水平 因素 质量比A pH B 反应温度C(℃) 反应时间D(min) −1 1:1 5.5 35 55 0 2:1 6.0 40 60 1 3:1 6.5 45 65 1.2.5.3 多肽-金属螯合物的红外光谱检测
采用KBr压片法,称取鱼鳞多肽和多肽金属螯合物样品各2 mg分别与200 mg KBr粉末于玛瑙研钵中充分研磨1~2 min。将研磨后的粉末转入模具中,分布均匀后抽空压成透明薄片,装入红外光谱压片夹,以纯KBr压片作为空白参照。红外光谱仪在光谱分辨率为2 cm−1,波数范围为400~4000 cm−1条件下对样品进行扫描,获得多肽-金属螯合物的红外吸收光谱图。
1.3 数据处理
采用Excel 2013软件分析数据,每个试验重复3次,采用统计学软件SPASS 19.0软件进行方差及差异显著性分析,当P<0.05时,差异被认为是有意义的,结果表示为平均值±标准差,采用Origin 8.0软件制图。
2. 结果与分析
2.1 美国红鱼鱼鳞多肽分子量分布
美国红鱼鱼鳞多肽分子量分布结果如图1所示。从图中可以看出鱼鳞蛋白经过复合蛋白酶水解后,大分子量区域呈平直的基线水平,说明原料几乎全部被分解成10 kDa以下的片段;鱼鳞蛋白水解后肽段分子量主要集中在第2和第3个峰之间,即1~6 kDa范围内,小分子量的小肽或游离氨基酸的含量很少,肽段的大小比较合适。如果水解度过高,芳香族等疏水基团将暴露出来,造成苦味肽大量产生[16]。总体来看,复合蛋白酶能够将鱼鳞蛋白很好地水解,所得的蛋白肽适合饲料加工业、食品行业的需求。
![]() 图 1 鱼鳞多肽Sephadex 200、Sephadex peptide分离结果注:A中1:甲状腺球蛋白Thyroglobulin(669000);2:铁蛋白Ferritin(440000);3:牛血清白蛋白BSA(67000);4:β-乳球蛋白β-Lactoglobulin(35000);5:细胞色素Cytochrome(13600);6:Aprotinin(6512)。B中1:细胞色素c Cytochrome C(12500);2:抑酞酶Aprotinin(6512);3:维生素B12 Vitamin B12(1355);4:甘氨酸Gly-Gly-Gly(189);5:甘氨酸Glycine(75)。Figure 1. Separation results of fish scale polypeptides on sephadex 200 and sephadex peptide column
图 1 鱼鳞多肽Sephadex 200、Sephadex peptide分离结果注:A中1:甲状腺球蛋白Thyroglobulin(669000);2:铁蛋白Ferritin(440000);3:牛血清白蛋白BSA(67000);4:β-乳球蛋白β-Lactoglobulin(35000);5:细胞色素Cytochrome(13600);6:Aprotinin(6512)。B中1:细胞色素c Cytochrome C(12500);2:抑酞酶Aprotinin(6512);3:维生素B12 Vitamin B12(1355);4:甘氨酸Gly-Gly-Gly(189);5:甘氨酸Glycine(75)。Figure 1. Separation results of fish scale polypeptides on sephadex 200 and sephadex peptide column2.2 单因素实验结果
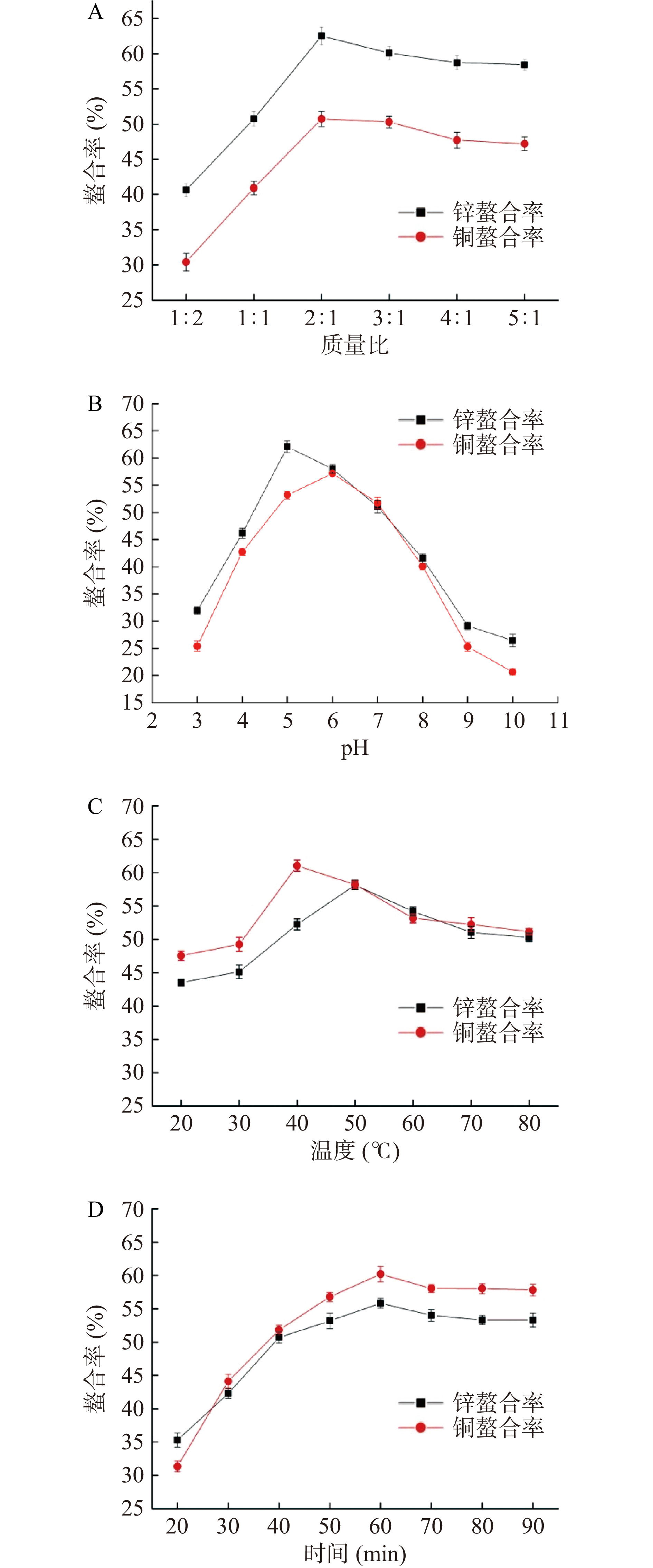
2.2.1 多肽与金属盐质量比对螯合率的影响
多肽锌、铜离子的质量比对螯合率影响的结果见图2A。当多肽与金属离子质量比为1:1时,螯合率均较低,锌螯合率为50.74%,铜螯合率为40.92%;当质量比为2:1时,螯合率达到峰值,锌螯合率为62.51%,铜螯合率为50.72%;当质量比为3:1和4:1,螯合率趋于平稳。多肽量增大有利于螯合反应的进行,但加入的多肽量过多会造成多肽的剩余,使多肽的利用率降低。从多肽的结构考虑,两个酰胺键与一个锌或铜离子形成配位是较为理想的结构[17]。顾冰飞等[18]研究结果显示,当质量比为2:1时,氨基酸与金属的螯合反应进行的比较充分,与本研究结果基本一致。因此选择多肽锌螯合物及多肽-铜螯合物的质量比1:1、2:1、3:1进行正交试验。
2.2.2 反应pH对螯合率的影响
反应pH对多肽金属螯合物螯合率影响的结果见图2B。pH对多肽金属螯合物螯合率的影响较大,呈现先上升后下降的趋势。pH为3.0时,锌、铜螯合率均呈现较低,锌螯合率为31.94%,铜螯合率为25.42%;pH在4.0~5.0间,螯合率逐渐升高,多肽锌螯合率在pH为5.0左右,螯合率达到峰值为62.08%;多肽铜螯合率仍继续上升,在pH为6.0左右,多肽铜螯合率达到峰值为57.15%,此时锌螯合率略有下降;随着pH的逐渐升高,pH在7.0~10.0间,螯合率呈现快速下降的趋势。在pH较低的酸性条件下,氢离子将与金属离子争夺供电子基团,不利于鱼鳞多肽金属螯合物的形成;在pH较高的碱性条件下,氢氧根离子与供电子基团争夺金属离子而形成氢氧化物沉淀。从多肽的生物学特性考虑,pH大概为5.0、6.0时,酸碱环境适宜,多肽与金属离子的螯合率达到一个峰值;调整pH,滴加NaOH时会造成Zn(OH)2、Cu(OH)2出现,金属离子多以沉淀的形式析出[19],造成螯合率的下降。此结果与许庆陵[3]、周龙等[1]的研究基本一致。因此,多肽-锌螯合率的pH正交试验选择4.5、5.0和5.5;铜螯合率的pH正交试验选择5.5、6.0和6.5。
2.2.3 反应温度对螯合率的影响
反应温度对多肽金属螯合物螯合率影响的结果见图2C。在不同温度下其螯合率值相差不大,表明温度对多肽金属螯合物螯合率的影响较小,螯合率随着温度的升高而逐渐升高,当温度达到一定时,螯合率略有下降且后续维持稳定。温度过高会破坏多肽的结构,影响螯合反应的进行,多肽金属螯合物在高温环境下不稳定易容易分解[20]。多肽锌螯合率在反应温度为50 ℃左右螯合率达到最大值,多肽铜螯合率在反应温度为40 ℃左右螯合率达到最大值。该结果与乔月建[21]、Petrovic等[22]的研究基本一致。因此多肽锌螯合物的反应温度正交试验选择为45、50和55 ℃,多肽铜螯合物的反应温度正交试验选择为35、40和45 ℃。
2.2.4 反应时间对螯合率的影响
反应时间对多肽金属螯合物螯合率影响的结果见图2D。螯合反应60 min后,时间的延长对多肽金属螯合物的螯合率变化不大。在20~60 min随着反应时间的增加,螯合率呈现平缓增加的趋势;在60 min后,反应时间延长,螯合率变化不大。分析说明反应时间在一定程度上对螯合率的影响不大,前期时间增加,反应体系内金属与多肽螯合越充分,时间越长,反应体系内部分金属离子游离出来,致使螯合率稍有下降,后续螯合率都维持在稳定值基本不变。综合各项因素考虑,多肽锌螯合物及多肽铜螯合物的反应时间正交试验选择55、60和65 min。
2.3 正交试验结果分析
在单因素实验的基础上设计L9(34)正交试验,试验结果如表3~表4所示,方差分析结果见表5~表6。
表 3 多肽锌螯合物正交试验结果Table 3. Orthogonal test results of polypeptide zinc chelate实验号 A B C D 锌螯合率(%) 1 −1 −1 −1 −1 60.15±0.31 2 −1 0 0 0 65.22±0.72 3 −1 1 1 1 70.42±0.39 4 0 −1 0 1 65.26±0.53 5 0 0 1 −1 68.42±0.62 6 0 1 −1 0 74.51±0.29 7 1 −1 1 0 66.74±0.81 8 1 0 −1 1 68.14±0.26 9 1 1 0 −1 69.37±0.48 k1 65.26 64.05 67.60 65.89 k2 69.31 67.18 66.62 68.82 k3 68.08 71.43 68.44 67.94 R 4.05 7.38 1.82 2.93 表 4 多肽铜螯合物正交试验结果Table 4. Orthogonal test results of polypeptide copper chelate实验号 A B C D 铜螯合率(%) 1 −1 −1 −1 −1 83.05±0.72 2 −1 0 0 0 81.32±0.68 3 −1 1 1 1 70.79±0.52 4 0 −1 0 1 83.75±0.91 5 0 0 1 0 90.33±0.63 6 0 1 −1 −1 78.89±0.58 7 1 −1 1 0 82.39±0.39 8 1 0 0 1 87.42±0.36 9 1 1 −1 −1 75.05±0.27 k1 79.38 83.06 83.12 82.81 k2 84.32 86.35 80.04 80.87 k3 81.62 74.91 81.17 80.65 R 5.94 11.44 3.08 2.16 表 5 多肽锌螯合物方差分析表Table 5. Anova table of polypeptide zinc chelates来源 Ⅲ类平方和 自由度 均方 F 显著性 校正模型 353.477 8 44.185 105.817 质量比 70.589 2 35.294 84.525 0.005 pH 231.825 2 115.913 277.595 0.001 温度 19.895 2 9.948 23.823 0.026 时间 31.169 2 15.584 37.323 0.010 误差 7.516 18 0.418 表 6 多肽铜螯合物方差分析表Table 6. Anova table of polypeptide copper chelates来源 Ⅲ类平方和 自由度 均方 F 显著性 校正模型 855.541 8 106.943 70.065 质量比 175.242 2 81.621 57.406 0.027 pH 626.338 2 313.169 205.178 0.010 温度 31.318 2 15.659 10.259 0.022 时间 22.644 2 11.322 7.418 0.048 误差 27.474 18 1.526 多肽锌螯合正交试验中,各个因素对螯合率的影响B>A>D>C,即pH>质量比>时间>温度。优化组合A2B3C3D2条件下,多肽锌螯合物的螯合率最高,在此优化条件下重复3次,得到螯合率为78.21%,为最佳优化条件,即多肽锌螯合物的最佳螯合条件为:质量比2:1、pH5.5、反应温度55 ℃、反应时间60 min。
多肽-铜螯合正交试验中,各个因素对螯合率的影响B>A>C>D,即pH>温度>质量比>时间。优化组合A2B2C1D1条件下,多肽铜螯合物的螯合率最高。在此优化条件下重复3次,得到螯合率为91.24%,为最佳优化条件,即多肽铜螯合物的最佳螯合条件为:质量比2:1、pH6.0、反应温度35 ℃、反应时间55 min。
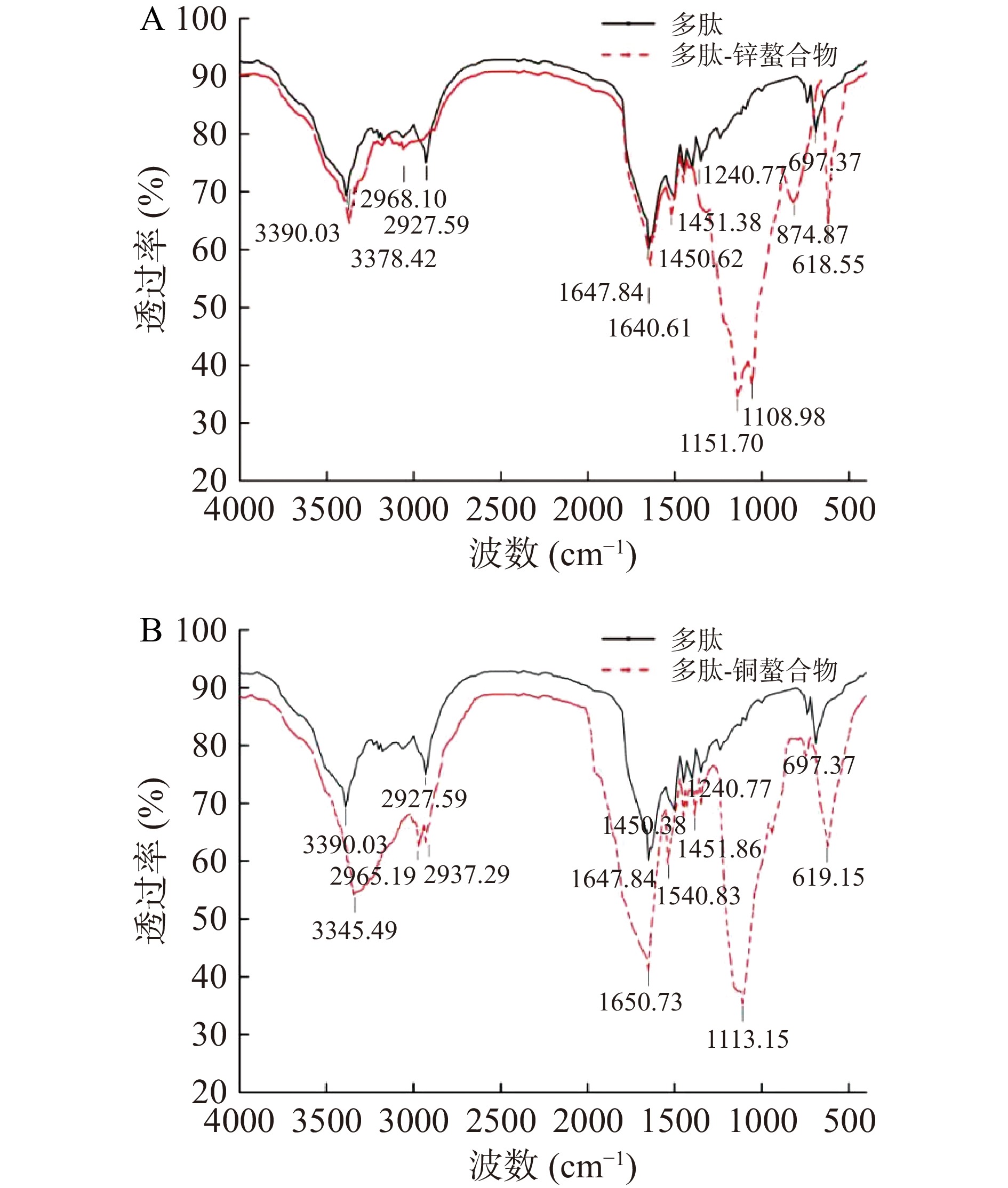
2.4 多肽金属螯合物的红外谱图
多肽锌、铜螯合物和多肽的傅里叶变换红外光谱结果见图3。从图3中可知,三者的FTIR谱图在强度和吸收频率方面均存在较大差异。多肽的酰胺A带在3404.78 cm−1处,是由N-H的伸缩振动引起;酰胺Ⅰ带在1654.19 cm−1处,由C=O的伸缩振动引起;在1339.85 cm−1处的峰由COO-的伸缩振动引起;669.38 cm−1的峰由C=O面向外弯曲引起[23]。
由图3A可知,多肽与锌离子螯合成多肽锌之后,在3390.03 cm−1处的吸收峰红移至3378.42 cm−1,红移了11.61 cm−1;在3081.84 cm−1左右的吸收峰消失了,且吸收峰变强而宽;这些谱带对应着多肽的N-H的对称伸缩振动和反对称伸缩振动,它们的变化说明多肽分子的氨基和羧基都参与了Zn2+的配位,而且多肽中与Zn2+结合的说明N-H之间还可能存在着氢键。多肽在2933.91 cm−1处的吸收峰在多肽-Zn中几乎消失,这说明Zn2+与多肽的作用导致了多肽结构的部分变化,影响了-CH2-和CH-基团的伸缩振动。多肽中1654.19 cm−1处的吸收峰在多肽锌螯合物中分别移至1640.61 cm−1,红移了13.58 cm−1,这是-COOH或C=O伸缩振动,说明多肽中羧基的氧参与了Zn2+的配位作用。在1108.98 cm−1处产生了C-N键强吸收峰,这是由于氮原子的共用电子对对Zn2+的贡献,导致了C-N键偶极性的增加[24]。多肽锌螯合物在1151.70 cm−1(PtNH2)强吸收峰,在618.55 cm−1处(PrNH2)的特征峰非常明显,证明Zn2+与-NH2有较强的结合。
由图3B可知,多肽与铜离子螯合成多肽-铜之后,在3390.03 cm−1处的吸收峰红移至3345.49 cm−1,红移了 44.54 cm−1,谱带的变化对应着多肽的N-H的对称伸缩振动和反对称伸缩振动,说明多肽分子的氨基和羧基都参与了Cu2+的配位,且多肽中与Cu2+结合的N-H之间还可能存在着氢键。多肽中1654.19 cm−1处的吸收峰在多肽-铜螯合物中移至1650.73 cm−1,红移了3.46 cm−1,酰胺Ⅰ带向低波段移动,其吸收强度增强,这是由COO-或C=O伸缩振动引起,说明多肽中羧基的氧参与了Cu2+的配位作用。在1113.15 cm−1处产生了C-N键强吸收峰,这是由于氮原子的共用电子对对Cu2+的贡献,导致了C-N键偶极性的增加[25]。多肽-铜螯合物在619.15 cm−1处(PrNH2)的特征峰非常明显,说明Cu2+与-NH2有较强的结合,多肽中的N-H和C=O与Cu2+发生配位作用。结果与彭巧云等[26]、程波等[27]的研究基本一致,进一步证明了多肽金属螯合物的合成。
3. 结论
本文利用复合蛋白酶水解美国红鱼鱼鳞制备多肽,凝胶色谱法分析多肽的分子量在1~6 kDa之间。采用水体系法合成多肽金属螯合物,并设计正交试验优化螯合制备工艺条件。优化后的多肽锌最佳螯合工艺条件为质量比2:1,pH5.5,温度55 ℃,时间60 min;多肽铜螯合物的最佳螯合工艺条件为质量比2:1,pH6.0,温度35 ℃,时间55 min,在该最佳螯合条件下得到的多肽锌、铜螯合物的螯合率分别为78.21%、91.24%,较优化前有较大提高并测定原多肽和多肽金属螯合物的红外吸收光谱,验证分析Zn2+、Cu2+与-NH2结合,表明多肽与锌、铜螯合成功。所制备的多肽金属螯合物拓展了海洋水产加工副产物高值化应用市场,能有效促进渔业加工产业的技术升级。进一步研究可从评价多肽金属螯合物相关生物活性方面开展,以及将多肽金属螯合物应用于动物试验中评价其具体饲用效果。
-
图 1 鱼鳞多肽Sephadex 200、Sephadex peptide分离结果
注:A中1:甲状腺球蛋白Thyroglobulin(669000);2:铁蛋白Ferritin(440000);3:牛血清白蛋白BSA(67000);4:β-乳球蛋白β-Lactoglobulin(35000);5:细胞色素Cytochrome(13600);6:Aprotinin(6512)。B中1:细胞色素c Cytochrome C(12500);2:抑酞酶Aprotinin(6512);3:维生素B12 Vitamin B12(1355);4:甘氨酸Gly-Gly-Gly(189);5:甘氨酸Glycine(75)。
Figure 1. Separation results of fish scale polypeptides on sephadex 200 and sephadex peptide column
表 1 多肽-锌螯合物的正交试验因素水平表
Table 1 Factor levels for orthogonal test of polypeptide-zinc chelates
水平 因素 质量比A pH B 反应温度C(℃) 反应时间D(min) −1 1:1 4.5 45 55 0 2:1 5.0 50 60 1 3:1 5.5 55 65 表 2 多肽-铜螯合物的正交试验因素水平表
Table 2 Factor levels for orthogonal test of polypeptide-copper chelates
水平 因素 质量比A pH B 反应温度C(℃) 反应时间D(min) −1 1:1 5.5 35 55 0 2:1 6.0 40 60 1 3:1 6.5 45 65 表 3 多肽锌螯合物正交试验结果
Table 3 Orthogonal test results of polypeptide zinc chelate
实验号 A B C D 锌螯合率(%) 1 −1 −1 −1 −1 60.15±0.31 2 −1 0 0 0 65.22±0.72 3 −1 1 1 1 70.42±0.39 4 0 −1 0 1 65.26±0.53 5 0 0 1 −1 68.42±0.62 6 0 1 −1 0 74.51±0.29 7 1 −1 1 0 66.74±0.81 8 1 0 −1 1 68.14±0.26 9 1 1 0 −1 69.37±0.48 k1 65.26 64.05 67.60 65.89 k2 69.31 67.18 66.62 68.82 k3 68.08 71.43 68.44 67.94 R 4.05 7.38 1.82 2.93 表 4 多肽铜螯合物正交试验结果
Table 4 Orthogonal test results of polypeptide copper chelate
实验号 A B C D 铜螯合率(%) 1 −1 −1 −1 −1 83.05±0.72 2 −1 0 0 0 81.32±0.68 3 −1 1 1 1 70.79±0.52 4 0 −1 0 1 83.75±0.91 5 0 0 1 0 90.33±0.63 6 0 1 −1 −1 78.89±0.58 7 1 −1 1 0 82.39±0.39 8 1 0 0 1 87.42±0.36 9 1 1 −1 −1 75.05±0.27 k1 79.38 83.06 83.12 82.81 k2 84.32 86.35 80.04 80.87 k3 81.62 74.91 81.17 80.65 R 5.94 11.44 3.08 2.16 表 5 多肽锌螯合物方差分析表
Table 5 Anova table of polypeptide zinc chelates
来源 Ⅲ类平方和 自由度 均方 F 显著性 校正模型 353.477 8 44.185 105.817 质量比 70.589 2 35.294 84.525 0.005 pH 231.825 2 115.913 277.595 0.001 温度 19.895 2 9.948 23.823 0.026 时间 31.169 2 15.584 37.323 0.010 误差 7.516 18 0.418 表 6 多肽铜螯合物方差分析表
Table 6 Anova table of polypeptide copper chelates
来源 Ⅲ类平方和 自由度 均方 F 显著性 校正模型 855.541 8 106.943 70.065 质量比 175.242 2 81.621 57.406 0.027 pH 626.338 2 313.169 205.178 0.010 温度 31.318 2 15.659 10.259 0.022 时间 22.644 2 11.322 7.418 0.048 误差 27.474 18 1.526 -
[1] 周龙. 珍珠蚌肉酶解液多肽锌螯合研究[D]. 杭州: 浙江农林大学, 2014. ZHOU L. Study on pearl mussel meat enzymolysis hydrolysate polypeptide chelated with zinc[D]. Hangzhou: Zhejiang A&F University, 2014.
[2] UDECHUKWU M C, COLLINSO S A, UDENIGWE C C. Prospects of enhancing dietary zinc bioavailability with food-derived zinc-chelating peptides[J]. Food & Function,2016,7(10):4137.
[3] 许庆陵, 王玉飞, 刘浩怀, 等. 罗非鱼多肽-Ca、Cu螯合工艺及其产物的结构特征[J]. 食品科技,2015(11):108−112. [XU Q L, WANG Y F, LIU H H, et al. Chelation technics of structure characteristics of Tilapia peptide-Ca, and peptide-Cu[J]. Food Science and Technology,2015(11):108−112. [4] 姚宝强, 刘丽. 氨基酸微量元素螯合物的研究与应用[J]. 兽药与饲料添加剂,2008,13(3):19−22. [YAO B Q, LIU L. Research and application of amino acid trace element chelate[J]. Veterinary Pharmaceuticals & Feed Additives,2008,13(3):19−22. [5] 黄丹萍, 胡巧玲, 李奎, 等. 有机微量元素氨基酸络(螯)合物评定研究进展[J]. 饲料研究,2015(14):27−31. [HUANG D P, HU Q L, LI K, et al. Research progress on the evaluation of organic trace element amino acid complex (chelate)[J]. Feed Research,2015(14):27−31. [6] TZIVELAKA L A, IOANNOU E, TSIOURVAS D, et al. Collagen from the marine sponges Axinella cannabina and Suberites carnosus: Isolation and morphological, biochemical, and biophysical characterization[J]. Marine Drugs,2017,15(6):152−156. doi: 10.3390/md15060152
[7] 虞俊翔, 孙南耀, 王光然, 等. 微量元素氨基酸螯合物的生物学效价研究进展[J]. 食品科学,2015,36(23):367−371. [YU J X, SUN N Y, WANG G R, et al. Advances in bioavailability of amino acid-microelement chelates[J]. Food Science,2015,36(23):367−371. doi: 10.7506/spkx1002-6630-201523065 [8] 任帅, 徐小健, 赵思梦, 等. 氨基酸螯合物加工制备方法研究进展[J]. 科技创新导报,2017(35):71−73. [REN S, XU X J, ZHAO S M, et al. Review on the processing and preparation methods of amino acid chelate[J]. Science and Technology Innovation Herald,2017(35):71−73. [9] JR W R, TOMASSO J R, III D M G. Production performance and non-specific immunity of cage-raised red drum, Sciaenops ocellatus, fed soybean-based diets[J]. Aquaculture,2015,443:84−89. doi: 10.1016/j.aquaculture.2015.03.012
[10] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2019中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020: 33−35. Fisheries and Fisheries Administration, Ministry of Agriculture and Rural Affairs, National Aquatic Technology Extension Station, Chinese Fisheries Society. 2019 China fishery statistical yearbook[M]. Beijing: China Agricultural Press, 2020: 33−35.
[11] 吴琴琴, 杨丽虹, 唐旭, 等. 鱼鳞胶原蛋白提取过程中脱脂工艺的优化[J]. 食品工业科技,2011(12):273−275. [WU Q Q, YANG L H, TANG X, et al. Optimization of degrease process during extracting collagen from sea-fish scales[J]. Science and Technology of Food Industry,2011(12):273−275. [12] 唐旭, 何建林, 徐长安, 等. 鱼鳞胶原蛋白提取过程中的脱钙工艺条件优化[J]. 食品工业科技,2011,32(6):326−328. [TANG X, HE J L, XU C A, et al. Optimization of decalcification process during extracting collagen from scale of sea fish[J]. Science and Technology of Food Industry,2011,32(6):326−328. [13] 杨丽虹, 吴琴琴, 唐旭, 等. 木瓜蛋白酶水解海洋鱼鳞蛋白的工艺研究[J]. 现代食品科技,2011,27(12):1484−1486. [YANG L H, WU Q Q, TANG X, et al. Hydrolysis process of sea-fish scale protein catalyzed by papain[J]. Modern Food Science and Technology,2011,27(12):1484−1486. [14] 吴胜华, 李吕木. 微量元素氨基酸螯合物合成及螯合率测定的研究[J]. 饲料工业,2008,29(16):11−12. [WU S H, LI L M. Research on compound of amino acid microelement chelate and determination of chelate ratio[J]. Feed Industry,2008,29(16):11−12. doi: 10.3969/j.issn.1001-991X.2008.16.003 [15] 王建坤, 范新宇, 张昊, 等. 基于EDTA络合滴定法测定重金属离子浓度[J]. 天津工业大学学报,2018,37(1):38−42. [WANG J K, FANG X Y, ZHANG H, et al. Determination of heavy metal ion concentration based on EDTA complexometric titration[J]. Journal of Tiangong University,2018,37(1):38−42. [16] 郭兴峰, 魏芳, 周祥山, 等. 苦味肽的形成机理及脱苦技术研究进展[J]. 食品研究与开发,2017,38(21):207−211. [GUO X F, WEI F, ZHOU X S, et al. Review on the formation mechanism and debittering technology of bitter peptides[J]. Food Research and Development,2017,38(21):207−211. doi: 10.3969/j.issn.1005-6521.2017.21.041 [17] KIMIRA Y, ODAIRA H, NOMURA K, et al. Collagen-derived dipeptide prolyl-hydroxyproline promotes osteogenic differentiation through Foxg1[J]. Cellular Molecular Biology Letters,2017,22(1):27. doi: 10.1186/s11658-017-0060-2
[18] 顾冰飞, 赵圆圆, 陈义勇. 杏鲍菇多糖锌螯合物的制备工艺及其抗氧化活性[J]. 食品研究与开发,2019,40(4):105−111. [GU B F, ZHAO Y Y, CHEN Y Y. Preparationn technology of Pleurotus eryngii polysaccharides zinc(Ⅱ) chelate and its antidant acitvities[J]. Food Research and Development,2019,40(4):105−111. [19] JIMENEZ V E, EMILIO P, CRUCES M P, et al. Study on the relationship of genotoxic and oxidative potential of a new mixed chelate copper antitumoral drug, Casiopeina II-gly (Cas II-gly) in Drosophila melanogaster[J]. Environmental Toxicology & Pharmacology,2016,48:286−293.
[20] 阳丽红. 利用金枪鱼加工副产物制备骨粉, 胶原多肽及肽钙螯合物研究[D]. 杭州: 浙江工商大学, 2020. YANG L H. Study on the preparation of bone meal, collagen peptides and peptide calcium chelate by using the by-products of tuna processing[D]. Hangzhou: Zhejiang Gongshang University, 2020.
[21] 乔月建. 小肽螯合锌的制备及对公猪生产性能、血液生理化指标的影响[D]. 邯郸: 河北工程大学, 2016. QIAO Y J. Preparation and effects on the production performance of boars, blood physiological and biochemical indexes of zinc chelated small peptides[D]. Handan: Hebei University of Engineering, 2016.
[22] PETRAVIC V P, ZIVANOVIC M N, SIMIJONOVIC D, et al. Study of the structure, prooxidative, and cytotoxic activity of some chelate copper(II) complexes[J]. Chemical Papers,2017,71(11):1−9.
[23] CRESWELL C J, RUNQUIST O, CAMPBELL M M. Spectral analysis of organic compounds[M]. Burgess Publishing Company, 1972.
[24] SUBA S, VIJAYAKUMAR S, VIDHYA E, et al. Microbial mediated synthesis of ZnO nanoparticles derived from Lactobacillus spp: Characterizations, antimicrobial and biocompatibility efficiencies[J]. Sensors International,2021(10):100104.
[25] GONG X B. Kinetic and equilibrium studies on the adsorption of Pb(II), Cd(II) and Cu(II) by rape straw[J]. Adsorption Science & Technology,2013,31(6):559−571.
[26] 彭巧云, 沈菊泉, 魏东芝, 等. 正交试验优化胶原多肽螯合钙的制备工艺[J]. 食品科学,2013,34(8):94−99. [PENG Q Y, SHEN J Q, WEI D Z, et al. Optimization of preparation of collagen polypeptide chelated calcium by orthogonal array design[J]. Food Science,2013,34(8):94−99. doi: 10.7506/spkx1002-6630-201308019 [27] 程波, 赵君华, 朱志明, 等. 微波法制备鲟鱼皮复合氨基酸螯合铜的工艺[J]. 食品研究与开发,2009,30(9):128−134. [CHEN B, ZHAO J H, ZHU Z M, et al. The synthetic technology of Cu (Ⅱ) chelated with compound amino acids hydrolyzed from farmed sturgeon's under microwave irradiation[J]. Food Research and Development,2009,30(9):128−134. doi: 10.3969/j.issn.1005-6521.2009.09.039 -
期刊类型引用(2)
1. 杜康,花扬扬,魏帅飞,王婷婷,曲冠男,赵猛,蔡红星. 基于内标法的低质量浓度葡萄糖溶液拉曼测定研究. 光学学报(网络版). 2024(05): 4-10 .  百度学术
百度学术
2. 韩春然,岳振歌,遇世友,王鑫,张丝瑶. 检测葡萄糖的Ni基电化学传感器研究进展. 食品工业科技. 2023(14): 482-489 .  本站查看
本站查看
其他类型引用(2)





 下载:
下载:
 下载:
下载:



