Progress on the Application of Aptamers in the Detection of Staphylococcus aureus
-
摘要: 金黄色葡萄球菌(Staphylococcus aureus)是一种重要的食源性致病菌,快速检测方法的开发对于防控该菌引发的食源性疾病具有重要意义。生物识别物是快速检测的核心,核酸适配体作为新兴的生物识别物,与靶标分子有高度的亲和力及特异性,且易于人工合成和修饰,在食源性致病菌的检测方面具有较大的潜力和优势。本文综述了核酸适配体的筛选技术及其在金黄色葡萄球菌分离富集和快速检测中的应用进展,以期为食源性致病菌新型检测方法的开发和实际应用拓宽思路。Abstract: Staphylococcus aureus is one of the most important foodborne pathogens. Rapid detection is of vital importance for the prevention and control of outbreaks caused by this bacterial pathogen. Biological recognition elements are the core of rapid detection. As the emerging biological recognition element, nucleic acid aptamers are easy to be prepared and modified, and have high affinity and specificity that can be combined with targets well, which have great potential and advantages when applied in the detection of foodborne pathogens. For the sake of broadening research ideas on development and application of detection methods for Staphylococcus aureus, aptamer screening technologies and detection methods based on aptamers are reviewed in this article.
-
Keywords:
- aptamers /
- Staphylococcus aureus /
- screening /
- detection /
- biosensor
-
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的食源性致病菌,由于其具有快速适应宿主和环境选择性压力的能力[1],以及较强的耐盐性[2],在食品供应链中污染而导致食物中毒的风险不断增加。其主要致病因子肠毒素具有较好的热稳定性,难以通过热处理等方式破坏其活性[3],对食品安全和公共健康构成了极大威胁。因此,加强金黄色葡萄球菌的检测与监控,对于防控食物中毒事件具有重要意义。
基于培养的传统检测方法通常需要4~7 d才能做出最终鉴定,不能满足快速检测金黄色葡萄球菌的需求[4]。作为一种基于核酸的经典分子生物学检测方法,聚合酶链式反应(polymerase chain reaction,PCR)易受到其他杂质(如蛋白质、多糖、多酚,以及其他杂菌等)的干扰,进而影响测定结果的准确性[5-6]。免疫学检测往往操作简单,反应快速,但抗体质量是制约金黄色葡萄球菌免疫检测的一个重要瓶颈问题,获得一株性能优异的单克隆抗体往往需要付出高昂的代价[7]。因此,除了基于免疫动物体制备抗体之外,迫切需要抗体的替代物,适配体的出现正好满足了这一需求。
核酸适配体是在体外通过指数富集配体的系统进化技术(Systematic Evolution of Ligands by ExponentialEnrichment,SELEX)筛选出的能特异性识别目标物的核酸序列[8],能够与靶标(如小分子、肽、蛋白质、病毒、细胞等)特异性结合。适配体与靶标的结合是通过单链寡核苷酸脱氧核糖核酸(deoxyribonucleic acid,DNA)或核糖核酸(ribonucleic acid,RNA)折叠成特定的三维结构(茎-环、发夹和G-四链体等空间构象)实现的。不论是制备的技术要求,还是制备的便捷程度以及时效性等方面都远远超过抗体,不仅如此,筛选出的适配体可以进行人工合成,极易实现标准化。近年来,由于适配体具有精准的特异性及高度的亲和力,受到了国内外多个领域的广泛关注,如疾病诊断与治疗、药物递送、食品安全检测和环境监测等[9-11]。在食品安全方面,适配体广泛应用于食源性致病菌的检测。将核酸适配体应用于金黄色葡萄球菌的检测,有望实现该致病菌精准、快速且低成本的检测。本文主要针对核酸适配体的筛选及其在金黄色葡萄球菌分离富集和快速检测中的应用进行简要概述。
1. 适配体筛选技术
1.1 适配体的筛选流程
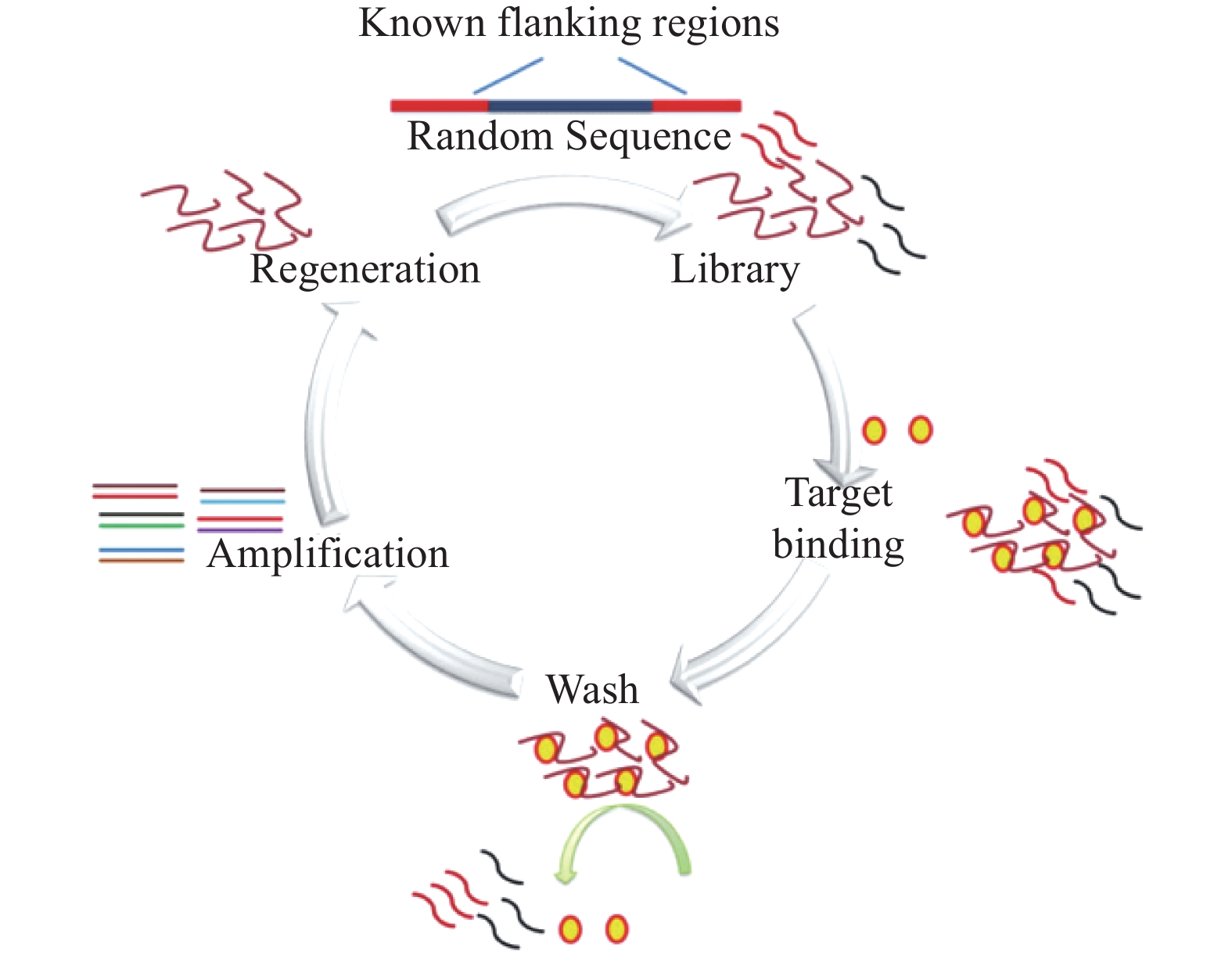
适配体是从DNA或RNA随机文库中通过体外筛选获得。核酸适配体的筛选过程主要包括建立文库、孵育、分离、扩增、单链制备与纯化等步骤,反复进行筛选,经数轮后可得到高亲和力与高特异性的适配体,具体过程如图1所示[12]。具体步骤如下:构建化学合成的寡核苷酸文库,每个寡核苷酸分子通常包含约80个核苷酸,包括随机序列和恒定的引物互补结合序列[13];将构建的文库与靶标物一同孵育,部分序列与靶标物结合(与其他靶标不同,直接用完整的细菌作为识别物可以保持其自身的天然构象,这对于SELEX成功筛选至关重要[14]);将未能结合或者弱结合的寡核苷酸洗脱分离,这个步骤决定了SELEX的筛选效率;利用PCR或实时PCR(real time-PCR)对结合的序列进行扩增;反应得到的扩增序列用于制备下一轮的次级库。
致病菌适配体的筛选也非常复杂,需要反复进行PCR-电泳切胶回收-单链DNA纯化等步骤,以此为循环进行多轮筛选。一般来说,适配体筛选需要6~20轮SELEX循环,每一轮的筛选大约耗费2~3 d时间,总筛选时间往往需要2~3个月[15]。
1.2 适配体的筛选方法
为了使筛选时间缩短且筛选的适配体能够更好地符合预期,SELEX筛选方法一直在不断探索与改进。研究者开发了全细菌SELEX(Whole bacteria SELEX),或称为细胞SELEX(Cell SELEX),以及磁珠SELEX(Magnetic bead SELEX,Mag-SELEX)、毛细管电泳SELEX(Capillary electrophoresis SELEX,CE SELEX)、消减SELEX(Subtractive SELEX)、加尾SELEX(Tailored-SELEX)、无引物SELEX(Primer-free SELEX)、切换SELEX(Toggling SELEX)等技术[16-18]。尽管改进的SELEX技术有很多,但每种方法的原理基本相同,即将目标分子与核酸序列库一同孵育,去除结合力弱的序列与未结合的序列,对特异性结合力较强的序列进行扩增,并通过多次循环富集高亲和力序列。对于细菌的适配体筛选,大多采用全细菌SELEX(或称为细胞SELEX),即将整个细菌的菌体作为筛选目标进行筛选,无需提前知晓生物标志物的构象,也无需纯化目标蛋白质或多糖等目标物,且利用菌体直接筛选,可以保留目的靶标原本的折叠构象,更有利于筛选出在实际菌体检测中能够得以较好应用的适配体[19]。此外,由于细菌菌体较大,目标菌体和适配体文库孵育结合之后,只需要采用离心的方法就可以将游离的未结合序列去除。相对于小分子、蛋白质、病毒等目标物的适配体筛选,细菌适配体的筛选采用全细菌SELEX更为简单易行。
1.3 金黄色葡萄球菌的核酸适配体
表1是近几年报道的部分金黄色葡萄球菌的适配体序列。对金黄色葡萄球菌而言,全细菌SELEX同样是其适配体筛选的首选方法。也有个别研究用金黄色葡萄球菌蛋白A(Staphylococal protein A)作为生物靶标[20],这是由于蛋白A是可以从金黄色葡萄球菌细胞壁分离出的特有蛋白质。此外,也有研究者用金黄色葡萄球菌磷壁酸作为靶标进行筛选[21]。如前所述,用菌体筛选更加简单易行,既无需固定菌体,也无需固定文库,只需要离心就可以将结合与未结合的序列分离,且菌体表面的生物分子均保持天然构象,筛选到的适配体更有利于实际应用,但是,由于筛选是针对菌体进行的,而菌体表面具有无数的生物分子,无法知晓筛选到的适配体具体是针对哪个(或哪类)生物分子为靶标,具有不确定性。在之后的验证中,应该用尽可能多的菌株验证其特异性与准确性,以免在实际应用中出现假阴性或者假阳性的情况。而用金黄色葡萄球菌蛋白A或者金黄色葡萄球菌磷壁酸作为靶标进行适配体筛选,是针对金黄色葡萄球菌菌体表面特异性分子进行筛选,可以保证筛选出的序列具有较高的特异性和准确性,但是人工表达或人工纯化出的生物分子可能与菌体表面的生物分子存在一定的结构差异与空间位阻。因此,最终筛选的适配体不仅需要检测与靶标分子的亲和力,更需要检测与金黄色葡萄球菌菌体之间的亲和力。总的来说,两种策略各有优劣,而成本低廉,简单易行是大多数研究者选用前者的原因。然而,目前而言,不论应用哪种策略,大多数研究都是运用一株目标菌作为筛选菌或亲和力验证的菌株,另选几株其他属的细菌进行特异性验证,缺乏大批量菌株的验证结果,如果想以所筛选到的适配体作为核心的生物识别物构建能够实际应用的检测方法,需要对适配体进行大量的菌株验证。
表 1 金黄色葡萄球菌的核酸适配体序列Table 1. Aptamers for the detection of Staphylococcus aureus适配体名称 筛选方法 靶标 序列(5’→3’) 亲和力Kd(nmol/L) 参考文献 A14 全细菌 SELEX 菌体 CACACCGCAGCAGTGGGAACGTTTCAGCCATGCAAGCATCACGCCCGT 3.49±1.43 [22] RAB10 全细菌SELEX 菌体 TAGCTCACTCATTAGGCACTCGAGAGGGATCTCGGGG
CGTGCGATGATTTTGCCTTCATGCATAGTTAAGCCAGCC46±24 [23] STAPT 全细菌SELEX 菌体 GCCTGTTGTGAGCCTCCTAACTATATCAGCCCACGTAGTTAGGAGGCTCACAACAGGCACATGCTTATTCTTGTCTCCC — [24] PA#2/8 荧光磁性SELEX 蛋白A AGCAACATGAGGGGGATAGAGGGGGTGGGTTCTCTCGGCT 20±1 [20] #02 SELEX 磷壁酸 GGGAGUUUUGAUACGGCUUCAUGCAGUAAUGUUUUUAU — [21] 2. 适配体在金黄色葡萄球菌检测中的应用
2.1 适配体在金黄色葡萄球菌分离富集中的应用
利用适配体对金黄色葡萄球菌进行分离和富集是一种新型方法,携带金黄色葡萄球菌的样品在检测之前需要进行分离和富集等前处理过程。适配体作为生物识别物,可以与纳米磁珠结合从而用于目标菌体的分离与富集。Zhang等[25]通过适配体功能化的磁珠实现了金黄色葡萄球菌的磁性分离,并通过培养基中电导率的变化测定了活菌数。Xu等[26]将经过修饰的适配体探针固定在磁性水凝胶条形码上特异性吸附金黄色葡萄球菌,此磁性水凝胶条形码可以减少其他靶标物的非特异性吸附,捕获效率高,捕获速度快且具有多重捕获能力。相比而言,大量磁性分离的研究都是用免疫磁珠进行的,主要原因是免疫磁珠的生物识别物为抗体,可以适应较为复杂多样的环境,故可应用于多种食品样品(或食品样品处理物)。而以适配体为生物识别物的磁性捕获往往是在水等简单样品中进行,从复杂的食品样品或食品样品处理物中磁性分离目标致病菌可能需要更多的研究。一般适配体往往是在特定的溶液条件中筛选得到,比如特定的pH、特定的Mg2+浓度等,当这些条件改变,往往无法得到较好的亲和性。
2.2 适配体在金黄色葡萄球菌比色法检测中的应用
比色法是通过溶液对光选择性吸收后产生的可视化颜色测定组分含量的检测方法。颜色的变化通常由结构的改变、酶催化底物、纳米材料的催化氧化、纳米粒子的聚集或分散等引起[27-30]。Yu等[31]建立了一种基于适配体和光催化比色的金黄色葡萄球菌检测方法。dsDNA-SYBR Green I(dsDNA-SG I)络合物在光辐照下催化3,3',5,5'-四甲基联苯胺(TMB)的氧化,从而产生对金黄色葡萄球菌的光催化比色反应。Raji等[32]开发了一种基于适配体传感器比色检测耐甲氧西林金黄色葡萄球菌(MRSA)的棉拭子,通过棉拭子显色就可以判断金黄色葡萄球菌的存在与否,全程只需5 min。此外,还可以通过颜色比对实现对金黄色葡萄球菌的定量检测,检出限和定量限的理论值为2 CFU/mL和5 CFU/mL。Fan等[33]建立了基于适配体与纳米材料催化比色的检测方法。首先,针对耐甲氧西林金黄色葡萄球菌(MRSA)的重要标记蛋白PBP2a进行适配体筛选;再基于该适配体和GO/Au可开关的过氧化物酶活性设计比色法生物传感器,对于PBP2a的检出限低至20 nmol/L。除了基于酶反应的比色检测之外,金纳米粒子(AuNPs)是一类经典的常用于比色检测的纳米材料。其优势在于具有较高的消光系数,分散状态呈现紫色,聚集状态呈现蓝色,而且具有易于合成、光学性能良好以及生物相容性较高等特性[34-35]。Yao等[36]将IgY-Fe3O4/Au作为捕获探针,Apt-AuNPs作为信号放大元件,基于金纳米粒子的类过氧化物酶催化活性的增强和TMB/H2O2报告系统的蚀刻检测上清液中未结合的AuNPs,肉眼即可观察到颜色的变化,该方法的检出限为10 CFU/mL。与荧光检测方法、电化学检测方法等其他方法相比,比色法观察更为直观、操作方便简单、成本低廉。而且,比色法检测快速、对人员操作要求较低、无需昂贵的分析仪器,因此,其应用于现场检测更具潜力。
2.3 适配体在金黄色葡萄球菌荧光检测技术中的应用
适配体在荧光检测中的应用是基于适配体与靶标结合时荧光信号的产生或淬灭完成检测的。荧光传感器因具有高通量、高灵敏度和响应快速等优势受到广泛关注。通常利用各类荧光染料设计检测方法,通过荧光指示剂的释放与荧光的激发与否判断食源性致病菌是否存在。
适配体应用于荧光检测存在多种策略。其一,适配体作为荧光染料的封堵剂,适配体将荧光染料封堵在材料内,当目标物存在时,适配体被结合,从而造成荧光染料释放。Pla等[37]将荧光指示剂罗丹明B装载入纳米多孔阳极氧化铝(NAA)支架,用选择性识别金黄色葡萄球菌的DNA适配体进行封盖,当金黄色葡萄球菌存在时将与适配体结合,导致罗丹明B释放,因此可以通过检测罗丹明B对金黄色葡萄球菌进行定量。该方法在缓冲液中的检出限是2 CFU/mL。其二,适配体作为荧光染料发光的触发物,如由于适配体与目标物结合,导致后续反应发生,进而导致荧光产生。Cai等[38]利用链置换扩增(strand displacement amplification,SDA)和自组装DNA六边形结构的优势进行荧光检测,当金黄色葡萄球菌存在时,部分金黄色葡萄球菌适配体的互补链(cDNA)从磁珠上释放,添加引物后开始链置换扩增反应,导致大量ssDNA产生,进而诱导发夹探针打开,后续自组装形成六边形结构,荧光染料SYBR Green嵌入激发荧光探针,从而检测荧光信号,该方法的检出限为1.7 CFU/mL。其三,荧光共振能量转移(fluorescence resonance energy transfer,FRET),当荧光染料(受体)与淬灭剂(供体)相互靠近,达到一定距离之后就会发生荧光共振能量转移[39],适配体在其中充当了让两者“靠近”或者“远离”的介质。FRET一般存在两种模式,即通过某种策略让本来由于发生FRET而不发光的荧光染料重新发光(Turn on)或者让本来发光的荧光染料与淬灭物质两者靠近因发生FRET而不发光(Turn off)。Tao等[40]利用适配体修饰的量子点作为能量供体,抗生素替考拉宁金纳米颗粒(Teico-AuNPs)作为能量受体,基于FRET开发了一种检测食品中金黄色葡萄球菌的Turn off模式传感器。当有金黄色葡萄球菌存在时,量子点与金纳米粒子都与菌体结合,导致供体与受体相互靠近,从而荧光减弱甚至消失。此传感器在缓冲液中检出限为2 CFU/mL。Pebdeni等[41]开发了基于Turn on模式的FRET检测金黄色葡萄球菌,运用天然来源的橄榄叶合成适配体-绿色碳量子点(CQD),以金纳米颗粒(GNP)作为荧光淬灭剂。当存在金黄色葡萄球菌时,适配体-碳量子点复合物与菌体结合,使得原来与复合物结合的金纳米粒子被释放,碳量子点重新发光。该传感器的检出限为10 CFU/mL。类似的策略也会被应用于检测金黄色葡萄球菌肠毒素A。Zhang等[42]构建了以适配体为模板的银纳米簇(DNA-AgNCs)荧光探针,其荧光信号会被聚吡咯纳米粒子(PPyNPs)淬灭。当金黄色葡萄球菌肠毒素A存在时,DNA-AgNCs会从PPyNPs上解离导致荧光信号恢复(Turn on)。随着肠毒素浓度的增加,相对荧光强度也会成比例地增加,从而实现肠毒素的检测,检出限为0.34 ng/mL。其四,与抗体类似,适配体标记荧光染料,形成类似“三联体”结构进行荧光检测。总的来说,荧光检测在适配体检测中的应用最为广泛。其主要原因为荧光检测的仪器主要是荧光分光光度计或带有荧光检测功能的酶标仪,甚至可以在紫外照射下直接观测。和其他检测仪器相比,仪器价格更为低廉,且检测仪器无需额外的耗材,测试样品无需额外处理,检测结果简单直接等。
2.4 适配体在金黄色葡萄球菌电化学生物传感器中的应用
电化学生物传感器是基于生物识别物将检测物质的化学量转化为电学信号的分析设备。适配体和靶分子结合后结构发生改变,影响电极间电子的转移,从而实现电化学检测。Han等[43]构建了以血红素为增强剂的S2O82−/O2电化学发光系统,无金黄色葡萄球菌存在时,电化学发光信号开启,金纳米粒子(AuNPs)和血红素双重作用增强,反之,金黄色葡萄球菌将被适配体捕获,与淬灭探针MoS2-PtNPs-Vancomycin结合,导致信号高度淬灭,通过电化学发光(Electrochemiluminescence,ECL)强度与金黄色葡萄球菌的线性关系进行定量,检出限为28 CFU/mL。Cai等[44]基于三螺旋分子开关设计了金黄色葡萄球菌电化学生物传感器。当金黄色葡萄球菌存在时,适配体与靶标结合从而释放cDNA,通过链置换扩增(SDA)得到大量的ssDNA探针,ssDNA探针与分子开关之间的相互作用导致电极上三螺旋结构的解离,进而触发了大量电活性G-四链体/血红素复合物的形成,并开启了电化学信号,该方法的检出限为8 CFU/mL。电化学生物传感器可以适用于浑浊样品,对于实际样品或样品处理物要求相对不用特别苛刻,然而,其特异性和灵敏度不如光学适配体传感器精确[45],此外,电化学传感器因为电极打磨与修饰等步骤,对操作者要求较高。
2.5 适配体在金黄色葡萄球菌表面增强拉曼散射技术中的应用
表面增强拉曼散射(surface-enhanced raman scattering,SERS)是一项高灵敏度的光学检测方法,通过吸附在粗糙金属表面或纳米结构上的分子增强光的拉曼散射来实现检测。Zhu等[46]开发了一种基于“捕获底物-靶标-信号分子探针”夹心结构结合表面增强拉曼散射技术检测金黄色葡萄球菌的方法,以金纳米粒子-聚二甲基硅氧烷(AuNPs-PDMS)膜为捕获基底,以适配体作为信号探针,通过测量拉曼强度的变化检测金黄色葡萄球菌,检出限为13 CFU/mL。Pang等[47]利用适配体标记的Fe3O4@Au磁性纳米粒子和万古霉素标记的金纳米粒子SERS标签双重识别,从而增强拉曼信号,检出限为3 CFU/mL。Lei等[48]以金纳米粒子修饰的聚苯乙烯微球(Au/PS)作为等离子体耦合微腔,构建了基于荧光和SERS的同时检测金黄色葡萄球菌和大肠杆菌的双模型方法,金黄色葡萄球菌的检出限为3 CFU/mL。表面增强拉曼克服了拉曼光谱灵敏度低的缺点,将灵敏度极大地提高,可以达到103~106倍。其对金、银、铜等材料极强的SERS效应和近几十年来纳米材料的高速发展相互结合,使表面增强拉曼在包括致病菌在内的检测分析领域得到了较高的关注,但是目前仪器价格较高,也是制约其推广应用的主要因素。
2.6 适配体在金黄色葡萄球菌局部表面等离子体共振技术中的应用
表面等离子体共振(Surface plamon resonace,SPR)的基本原理是利用适配体与靶分子结合使溶液界面的折射率上升,从而导致共振角度发生变化来完成检测。SPR具有灵敏度高,检测速度快,样品消耗量少等特点。然而,SPR仪器价格较为昂贵,近年来,也有一些价格更为低廉的局域表面等离子体共振(localized surface plasmon resonance,LSPR)仪器的应用。如瑞典Insplorion局域表面等离子体共振仪,可以通过纳米金颗粒表面分子层厚度发生变化产生光吸收峰的位移检测。Khateb等[49]通过胶体光刻(Holemask colloidal lithography,HMCL)方法构建金纳米盘芯片并将适配体偶联,利用LSPR传感设备检测牛奶中金黄色葡萄球菌,检出限为103 CFU/mL。总的来说,SPR是分析检测领域较为认可的一种技术,早在应用于检测之前,其因为可以识别获取生物分子相互作用的亲和力和动力学信息,已经被广泛应用于生物化学等领域,也是适配体筛选中亲和力测定的重要方法之一。然而,SPR仪器本身昂贵的价格是其在检测中应用的主要制约因素。
2.7 适配体在金黄色葡萄球菌其他检测技术中的应用
除了常规的生物传感器,适配体也适用于其他新的检测技术。Lu等[50]以适配体-金纳米粒子(AuNPs)为探针,以适配体标记的膜作为捕获物,开发了快速检测试纸,用于同时检测鼠伤寒沙门氏菌、大肠杆菌O157:H7和金黄色葡萄球菌,检出限分别为103、104和104 CFU/mL。Lu等[51]基于适配体-细胞复合物的结合保护效应构建了酶切传感器,检出限为64 CFU/mL。Yang等[52]开发了磁性适配体的检测传感器,金黄色葡萄球菌的适配体与捕获探针P通过杂交固定在纳米磁珠上,当存在金黄色葡萄球菌时,适配体与磁珠分开,捕获探针可以和另一个生物素标记探针杂交诱发DNA杂交链式反应,通过血糖仪测定链霉亲和素标记的转化酶浓度进行金黄色葡萄球菌的定量,检出限为2 CFU/mL。总的来说,其他生物识别物(如抗体、受体等)可以进行的生物传感,理论上适配体都能胜任,甚至因为作为核酸序列的特性,具有更为广阔的应用前景。
3. 结语与展望
作为一种新兴的分子检测探针,适配体可以作为抗体、受体等生物识别物的替代物而广泛应用于食源性致病菌的检测。由于其具有良好的特异性、高度的亲和力、较强的化学稳定性以及低廉的成本等优点,被广泛应用于各类检测技术。其中,以比色法检测技术、荧光检测技术和电化学传感器中使用最为广泛。除传统的检测技术和生物传感器外,适配体还可应用于更多的检测技术,如SERS、(L)SPR技术等。这些技术都有各自的优势,对于比色法检测,肉眼即可判断阳性结果;对于荧光法检测,背景干扰少,灵敏度高;对于电化学传感器,其优势是可以用于浑浊样品的检测等。一些基于适配体的检测方法也已开发为便携式的检测设备,检测时间可以缩短至30 min,为金黄色葡萄球菌的检测提供快速有效的工具。
此外,适配体不仅仅只是抗体这类生物识别物的替代物,由于其本质为一段单链核酸序列,因此,拥有其他生物识别物所不具有的更为优异的特性。例如:a.可以与互补链杂交结合,可以利用互补链与靶标物之间的竞争关系设计检测策略;b.可以被核酸酶水解,尤其是核酸外切酶,可以通过适配体与靶标结合与否决定序列是否被外切酶酶解,以此设计多种检测方法;c.可以被核酸聚合酶扩增,除了自身作为核酸序列被扩增之外,也可以通过杂交和其他序列结合,使得其他序列被扩增等策略进行靶标检测。总之,适配体作为生物识别物,不仅仅可以实现识别,而且因为自身具有核酸的特性,还可以利用这些特性作为检测信号的一部分,使基于适配体的检测方法更加灵活多样。
当然,与此同时,也要清楚地认识到核酸适配体技术仍存在一定的缺陷,适配体作为核酸序列,其高级结构易受环境影响。适配体可能会因温度、pH、离子强度等环境因素而发生构象或者性质的改变,导致在检测过程中不能精确地捕获靶标分子,从而导致检测效率不高。核酸适配体在实际样品检测中仍存在一定的问题,实际样品的成分非常复杂,可能导致一些在溶液中效果非常好的适配体在实际样品中由于上述干扰作用出现假阴性或者不能得到理想的检测效果。
此外,针对目前基于适配体检测致病菌研究现状而言,依然存在如下缺陷:其一,适配体筛选与验证所用的菌株均太少。致病菌菌株种类非常多,以沙门氏菌为例,现已发现存在2500余种血清型,以某一株致病菌筛选出的适配体是否对所有血清型均有效且高效,需要大量的菌株验证,而大多数研究均采用一株标准菌株进行筛选验证;其二,研究主要集中在检测方法的构建,大多数研究均只针对缓冲溶液或者简单的饮用水等介质,而食品样品往往种类繁多,成分构成复杂,真实样品的检测研究才能让检测方法得以真正的应用;其三,适配体的筛选通常是在特定的环境中(结合液)进行的,而检测方法所用的往往又是其他的缓冲溶液,此外,针对具体食品样品,又是另一种介质。适配体是否能够真正在不同的环境中发挥高亲和力作用,需要具体的验证。
根据以上的总结和分析,今后适配体在金黄色葡萄球菌检测方面的研究方向应集中在:金黄色葡萄球菌适配体筛选方法的优化,如改进现有的筛选技术以获得更加高效和高性能的适配体,甚至是能够在多种环境中都具有高亲和力的适配体;如何在复杂的食品基质中去除背景干扰(如蛋白质、糖类、脂类等),实现高灵敏度和高准确度的检测;探究合适的前处理方式(或增菌方式),配合后续的适配体精准检测;样品中金黄色葡萄球菌的浓度通常较低,如何放大信号提高灵敏度。这些研究方向的突破也有望为致病菌检测方法的开发提供思路,从而服务于国家的食品安全保障工作。
-
表 1 金黄色葡萄球菌的核酸适配体序列
Table 1 Aptamers for the detection of Staphylococcus aureus
适配体名称 筛选方法 靶标 序列(5’→3’) 亲和力Kd(nmol/L) 参考文献 A14 全细菌 SELEX 菌体 CACACCGCAGCAGTGGGAACGTTTCAGCCATGCAAGCATCACGCCCGT 3.49±1.43 [22] RAB10 全细菌SELEX 菌体 TAGCTCACTCATTAGGCACTCGAGAGGGATCTCGGGG
CGTGCGATGATTTTGCCTTCATGCATAGTTAAGCCAGCC46±24 [23] STAPT 全细菌SELEX 菌体 GCCTGTTGTGAGCCTCCTAACTATATCAGCCCACGTAGTTAGGAGGCTCACAACAGGCACATGCTTATTCTTGTCTCCC — [24] PA#2/8 荧光磁性SELEX 蛋白A AGCAACATGAGGGGGATAGAGGGGGTGGGTTCTCTCGGCT 20±1 [20] #02 SELEX 磷壁酸 GGGAGUUUUGAUACGGCUUCAUGCAGUAAUGUUUUUAU — [21] -
[1] Vaiyapuri M, Joseph T C, Rao B M, et al. Methicillin-resistant Staphylococcus aureus in seafood: Prevalence, laboratory detection, clonal nature, and control in seafood chain[J]. Journal of Food Science,2019,84:3341−3351. doi: 10.1111/1750-3841.14915
[2] 司晓雪. 金黄色葡萄球菌可视化检测方法的建立与评价[D]. 长春: 吉林大学, 2020. Si Xiaoxue. Establishment and evaluation of visual detection method for Staphylococcus aureus[D]. Changchun: Jilin University, 2020.
[3] Le Loir Y, Baron F, Gautier M. Staphylococcus aureus and food poisoning[J]. Genetics and Molecular Research,2003,2(1):63−76.
[4] Brandão D, Liébana S, Pividori M I. Multiplexed detection of foodborne pathogens based on magnetic particles[J]. New Biotechnology,2015,32(5):511−520. doi: 10.1016/j.nbt.2015.03.011
[5] Lantz P G, Knutsson R, Blixt Y, et al. Detection of pathogenic Yersinia enterocolitica in enrichment media and pork by a multiplex PCR: A study of sample preparation and PCR-inhibitory components[J]. International Journal of Food Microbiology,1998,45(2):93−105. doi: 10.1016/S0168-1605(98)00152-4
[6] Kim J S, Taitt C R, Ligler F S, et al. Multiplexed magnetic microsphere immunoassays for detection of pathogens in foods[J]. Sensing and Instrumentation for Food Quality and Safety,2010,4(2):73−81.
[7] Shan Yaqi, Xu Chunxiang, Wang Mingliang, et al. Bilinear Staphylococcus aureus detection based on suspension immunoassay[J]. Talanta,2019,192:154−159. doi: 10.1016/j.talanta.2018.09.027
[8] Li Huiyan, Jia Wannan, Li Xinyi, et al. Advances in detection of infectious agents by aptamer-based technologies[J]. Emerging Microbes and Infections,2020,9(1):1671−1681. doi: 10.1080/22221751.2020.1792352
[9] Zon G. Mini-Review: Recent advances in aptamer applications[J]. Journal of Cancer Treatment and Diagnosis,2020,4(3):1−5.
[10] Devsing S M, Sarode R, Khandelwal S, et al. Aptamer as a targeted drug delivery[J]. Asian Journal of Pharmaceutical Research and Development,2020,8(4):150−159.
[11] Li Fengqin, Yu Zhigang, Han Xianda, et al. Electrochemical aptamer-based sensors for food and water analysis: A review[J]. Analytica Chimica Acta,2019,1051:1−23. doi: 10.1016/j.aca.2018.10.058
[12] Suman P, Chandra P. Immunodiagnostic technologies from laboratory to point-of-care testing[M]. Springer Singapore Pte. Limited, 2020.
[13] Wang Bin. A new design for the fixed primer regions in an oligonucleotide library for SELEX aptamer screening[J]. Frontiers in Chemistry,2020,8:475. doi: 10.3389/fchem.2020.00475
[14] Wang Lijun, Wang Ronghui, Wei Hua, et al. Selection of aptamers against pathogenic bacteria and their diagnostics application[J]. World Journal of Microbiology and Biotechnology,2018,34(10):1−11.
[15] Torres-Chavolla E, Alocilja E C. Aptasensors for detection of microbial and viral pathogens[J]. Biosensors and Bioelectronics,2018,24(11):3175−3182.
[16] 秦川. SELEX技术筛选青霉素类抗生素适体及其运用方法的初步探索[D]. 重庆: 西南大学, 2008. Qin Chuan. Screening of affinity DNA aptamer binding to the penicillin-antibiotic by SELEX and preliminary exploration of utilization methods[D]. Chongqing: Southwest University, 2008.
[17] 徐龙峰, 王丽. 核酸适体筛选方法的研究进展[J]. 中国生物制品学杂志,2015,28(4):429−433. [Xu Longfeng, Wang Li. Advance in research on method for screening of aptamers[J]. Chinese Journal of Biologicals,2015,28(4):429−433. [18] Yan Jianhua, Xiong Hongjie, Cai Shundong, et al. Advances in aptamer screening technologies[J]. Talanta,2019,200:124−144. doi: 10.1016/j.talanta.2019.03.015
[19] Ye Mao, Hu Jun, Peng Minyuan, et al. Generating aptamers by cell-SELEX for applications in molecular medicine[J]. International Journal of Molecular Sciences,2012,13(3):3341−3353. doi: 10.3390/ijms13033341
[20] Moon J, Kim G, Park S B, et al. Comparison of whole-cell SELEX methods for the identification of Staphylococcus aureus-specific DNA aptamers[J]. Sensors,2015,15(4):8884−8897. doi: 10.3390/s150408884
[21] Ramlal S, Mondal B, Lavu P S, et al. Capture and detection of Staphylococcus aureus with dual labeled aptamers to cell surface components[J]. International Journal of Food Microbiology,2018,265:74−83. doi: 10.1016/j.ijfoodmicro.2017.11.002
[22] Yazdi Yahyaabadi M, Dorraj G S, Heiat M, et al. Utilizing cell-SELEX, as a promising strategy to isolate ssDNA aptamer probes for detection of Staphylococcus aureus[J]. Journal of Applied Biotechnology Reports,2017,4(3):633−638.
[23] Stoltenburg R, Strehlitz B. Refining the results of a classical SELEX experiment by expanding the sequence data set of an aptamer pool selected for protein a[J]. International Journal of Molecular Sciences,2018,19(2):642.
[24] Han S R, Lee S W. In vitro selection of RNA aptamer specific to Staphylococcus aureus[J]. Annals of Microbiology,2014,64(2):883−885. doi: 10.1007/s13213-013-0720-z
[25] Zhang Xuzhi, Wang Xiaochun, Yang Qianqian, et al. Conductometric sensor for viable Escherichia coli and Staphylococcus aureus based on magnetic analyte separation via aptamer[J]. Microchimica Acta,2020,187:43.
[26] Xu Yueshuang, Wang Huan, Luan Chengxin, et al. Aptamer-based hydrogel barcodes for the capture and detection of multiple types of pathogenic bacteria[J]. Biosensors and Bioelectronics,2018,100:404−410. doi: 10.1016/j.bios.2017.09.032
[27] Liu Juewen, Cao Zehui, Lu Yi. Functional nucleic acid sensors[J]. Chemical Reviews,2009,109(5):1948−1998. doi: 10.1021/cr030183i
[28] Wu Shijia, Wang Yinqiu, Duan Nuo, et al. Colorimetric aptasensor based on enzyme for the detection of Vibrio parahemolyticus[J]. Journal of Agricultural and Food Chemistry,2015,63(35):7849−7854. doi: 10.1021/acs.jafc.5b03224
[29] Hu Jingting, Ni Pengjuan, Dai Haichao, et al. Aptamer-based colorimetric biosensing of abrin using catalytic gold nanoparticles[J]. Analyst,2015,140(10):3581−3586. doi: 10.1039/C5AN00107B
[30] Yousefi S, Saraji M. Optical aptasensor based on silver nanoparticles for the colorimetric detection of adenosine[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2019,213:1−5.
[31] Yu Tianxiao, Xu Hong, Zhao Yan, et al. Aptamer based high throughput colorimetric biosensor for detection of Staphylococcus aureus[J]. Scientific Reports,2020,10(1):9190.
[32] Raji M A, Suaifan G, Shibl A, et al. Aptasensor for the detection of methicillin resistant Staphylococcus aureus on contaminated surfaces[J]. Biosensors and Bioelectronics,2020,176:112910.
[33] Fan Yaofang, Cui Mengyu, Liu Yanming, et al. Selection and characterization of DNA aptamers for constructing colorimetric biosensor for detection of PBP2a[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2020,228:117735. doi: 10.1016/j.saa.2019.117735
[34] Sang Fuming, Zhang Xue, Liu Jia, et al. A label-free hairpin aptamer probe for colorimetric detection of adenosine triphosphate based on the anti-aggregation of gold nanoparticles[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2019,217:122−127. doi: 10.1016/j.saa.2019.03.081
[35] Lan Lingyi, Yao Yao, Ping Jianfeng, et al. Recent progress in nanomaterial-based optical aptamer assay for the detection of food chemical contaminants[J]. ACS Applied Materials and Interfaces,2017,9(28):23287−23301.
[36] Yao Shuo, Li Juan, Pang Bo, et al. Colorimetric immunoassay for rapid detection of Staphylococcus aureus based on etching-enhanced peroxidase-like catalytic activity of gold nanoparticles[J]. Microchimica Acta,2020,187:504. doi: 10.1007/s00604-020-04473-7
[37] Pla L, Santiago-Felipe S, Tormo-Mas M Á, et al. Aptamer-capped nanoporous anodic alumina for Staphylococcus aureus detection[J]. Sensors and Actuators B: Chemical,2020,320:128281. doi: 10.1016/j.snb.2020.128281
[38] Cai Rongfeng, Yin Fan, Chen Haohan, et al. A fluorescent aptasensor for Staphylococcus aureus based on strand displacement amplification and self-assembled DNA hexagonal structure[J]. Microchimica Acta,2020,187:304. doi: 10.1007/s00604-020-04293-9
[39] Arvand M, Mirroshandel A A. An efficient fluorescence resonance energy transfer system from quantum dots to graphene oxide nano sheets: application in a photoluminescence aptasensing probe for the sensitive detection of diazinon[J]. Food Chemistry,2019,280:115−122. doi: 10.1016/j.foodchem.2018.12.069
[40] Tao Xiaoqi, Liao Ziyi, Zhang Yaqing, et al. Aptamer-quantum dots and teicoplanin-gold nanoparticles constructed FRET sensor for sensitive detection of Staphylococcus aureus[J]. Chinese Chemical Letters,2021,32(2):791−795. doi: 10.1016/j.cclet.2020.07.020
[41] Pebdeni A B, Hosseini M, Ganjali M R. Fluorescent turn-on aptasensor of Staphylococcus aureus based on th e FRET between green carbon quantum dot and gold nanoparticle[J]. Food Analytical Methods,2020,13(11):2070−2079. doi: 10.1007/s12161-020-01821-4
[42] Zhang Xueyan, Khan I M, Ji Hua, et al. A label-free fluorescent aptasensor for detection of staphylococcal enterotoxin A based on aptamer-functionalized silver nanoclusters[J]. Polymers,2020,12:152. doi: 10.3390/polym12010152
[43] Han Daobin, Yan Yurong, Wang Jianmin, et al. An enzyme-free electrochemiluminesce aptasensor for the rapid detection of Staphylococcus aureus by the quenching effect of MoS2-PtNPs-vancomycin to S2O82−/O2 system[J]. Sensors and Actuators B: Chemical,2019,288:586−593. doi: 10.1016/j.snb.2019.03.050
[44] Cai Rongfeng, Zhang Zhongwen, Chen Haohan, et al. A versatile signal-on electrochemical biosensor for Staphylococcus aureus based on triple-helix molecular switch[J]. Sensors and Actuators B: Chemical,2021,326:128842. doi: 10.1016/j.snb.2020.128842
[45] Kumar A, Malinee M, Dhiman A, et al. Aptamer technology for the detection of foodborne pathogens and toxins[M]. Advanced Biosensors for Health Care Applications, 2019: 45-69.
[46] Zhu Afang, Ali S, Xu Yi, et al. A SERS aptasensor based on AuNPs functionalized PDMS film for selective and sensitive detection of Staphylococcus aureus[J]. Biosensors and Bioelectronics,2020,172:112806.
[47] Pang Yuanfeng, Wan Nan, Shi Luoluo, et al. Dual-recognition surface-enhanced Raman scattering (SERS) biosensor for pathogenic bacteria detection by using vancomycin-SERS tags and aptamer-Fe3O4@ Au[J]. Analytica Chimica Acta,2019,1077:288−296. doi: 10.1016/j.aca.2019.05.059
[48] Lei Milan, Xu Chunxiang, Shan Yaqi, et al. Plasmon-coupled microcavity aptasensors for visual and ultra-sensitive simultaneous detection of Staphylococcus aureus and Escherichia coli[J]. Analytical and Bioanalytical Chemistry,2020,412(29):8117−8126. doi: 10.1007/s00216-020-02942-9
[49] Khateb H, Klös G, Meyer R L, et al. Development of a label-free LSPR-apta sensor for Staphylococcus aureus detection[J]. ACS Applied Bio Materials,2020,3(5):3066−3077. doi: 10.1021/acsabm.0c00110
[50] Lu Chunxia, Gao Xiaoxu, Chen Ya, et al. Aptamer-based lateral flow test strip for the simultaneous detection of Salmonella typhimurium, Escherichia coli O157: H7 and Staphylococcus aureus[J]. Analytical Letters,2020,53(4):646−659. doi: 10.1080/00032719.2019.1663528
[51] Lu Yunhao, Yuan Zilan, Bai Jinrong, et al. Directly profiling intact Staphylococcus aureus in water and foods via enzymatic cleavage aptasensor[J]. Analytica Chimica Acta,2020,1132:28−35. doi: 10.1016/j.aca.2020.07.058
[52] Yang Yuemeng, Wu Tingting, Xu Liping, et al. Portable detection of Staphylococcus aureus using personal glucose meter based on hybridization chain reaction strategy[J]. Talanta,2021,226:122132. doi: 10.1016/j.talanta.2021.122132
-
期刊类型引用(1)
1. 胡玥,孙红男,张苗,木泰华. 食物源肽与淀粉相互作用的研究进展. 食品科学. 2023(09): 163-169 .  百度学术
百度学术
其他类型引用(7)





 下载:
下载:
 下载:
下载:



