Optimization of Extraction Process, Structural Characterization and Component Analysis of Total Flavonoids from Mesembryanthemum crystallinum
-
摘要: 本研究优化了超声辅助法提取水晶冰菜总黄酮的条件并对其结构和组成成分进行了深入分析。以得率为指标,在单因素实验基础上,对料液比、浸提时间、温度和功率四个因素进行正交试验,得出最优提取条件;在此条件下采用D101大孔树脂纯化水晶冰菜总黄酮,通过紫外可见光谱(UV-Vis)、傅立叶变换红外光谱(FT-IR)对纯化前后总黄酮的结构表征,最后采用超高效液相色谱串联质谱法(UPLC-MS/MS)分析纯化物组成成分。结果表明:最优提取条件为乙醇浓度60%,料液比1:25 mg/mL,超声温度45 ℃,时间120 min,功率250 W,得率可达2.776%;通过UV-Vis分析水晶冰菜总黄酮具有C6-C3-C6特征结构,傅立叶变换红外光谱FT-IR也显示其含有O-H、C-H、C=O、C=C、酚羟基等多种特征官能团的振动吸收峰,符合黄酮类化合物的典型结构;通过UPLC-MS/MS检测到纯化物中含有桔皮素、川橙皮素、杜鹃素、原儿茶醛、地奥司明、柚皮苷查尔酮、甜橙黄酮、柚皮素、芦丁等30多种黄酮类化合物,其中桔皮素的相对百分含量最高,为50.854%±0.089%。本研究将为水晶冰菜功能性的开发利用提供理论依据。Abstract: In this study, the ultrasound-assisted extraction conditions of total flavonoids were optimized, and the structure and composition of total flavonoids were further analyzed. On the basis of single factor experiments, orthogonal experiments was carried out on four factors, including solid-liquid ratio, extraction time, temperature and power to obtain the optimal extraction conditions based on extraction yield. Under these conditions, total flavonoids were purified by D101 macroporous resin. The structure of total flavonoids before and after purification was characterized by UV-Vis and Fourier transform infrared spectroscopy (FT-IR). Finally, the constituents of the purified compounds were analyzed by ultra-performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS). The results showed that the optimal extraction conditions were as follows: Ethanol concentration of 60%, solid-liquid ratio of 1:25 mg/mL, ultrasonic temperature of 45 ℃, time of 120 min, power of 250 W, and extraction yield of 2.776%. The characteristic structure of total flavonoids was analyzed by UV-Vis spectroscopy (UV-Vis). Fourier transform infrared spectroscopy (FT-IR) also showed that the total flavonoids contained O-H, C-H, C=O, C=C, phenolic hydroxyl groups and other characteristic functional groups, which was consistent with the typical structure of flavonoids. Thirty flavonoids were detected in the purified products by UPLC-MS/MS, including citrinin, hesperetin, azalea, protocatechualdehyde, diosmin, naringin chalcone, sweet orange flavone, naringin and rutin. The relative content of citrinin was the highest, which was 50.854%±0.089% . This study would provide a theoretical basis for the functional development and utilization of crystal Mesembryanthemum crystallinum.
-
水晶冰菜(Mesembryanthemum crystallinum)又名冰叶日中花、冰花、冰草等,是番杏科(Aizoaceae)日中花属(Mesembryanthemum)中一种一年生或二年生草本植物[1]。水晶冰菜原产自南非纳米比亚沙漠等干旱地区,近年来才逐渐引入中国,成为了一款倍受消费者青睐的新型绿色蔬菜[2]。其生食口感清脆,伴有淡淡的咸味儿,不仅含有蛋白质、脂肪、膳食纤维、氨基酸等基本成分,而且还含有一些功能性的营养物质,其中以黄酮类化合物含量最甚,占比约为2.45%[3-4];黄酮类化合物具有抗肿瘤、抗氧化、提高人体免疫力等多重功效,如果通过现代技术手段提取水晶冰菜中的总黄酮并对其成分深入分析,可以针对性地应用于相关保健产品的开发,提高经济效益。
目前实验室常见的叶菜黄酮类化合物的提取方法主要有热水提取法、溶剂提取法、超声辅助法、酶辅助法等,其中超声辅助提取是一种相对现代的黄酮类化合物提取法,利用超声波产生的空化、振动和粉碎等综合效应,破坏植物细胞壁,增加通透性,不但加速黄酮类化合物的扩散速度,而且增加了提取溶剂的穿透能力,该方法因操作简便、节约时间成本且提取效率高而成为实验室常用的一种类黄酮提取方法[5-6]。由于植物次生代谢物的丰度较低且具有化学多样性,因此需要灵敏度高且选择性的分析方法进行结构表征和组分分析[7],而黄酮类化合物独有的的芳香环和酚羟基使它们易于用紫外可见光谱(ultraviolet-visible spectrum,UV-Vis) 、傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR) 表征结构,同时用超高效液相色谱串联质谱法(Ultra performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS)对植物类黄酮的定性定量分析的应用在近年中越来越频繁。但目前国内外对于水晶冰菜的研究相对较少,且多集中在种植栽培[8]和景天酸代谢等方面[9],对其总黄酮的提取纯化工艺、结构表征和组成成分尚未报导。本文以水晶冰菜为原料,通过正交试验优化超声提取条件,采用D101大孔树脂纯化水晶冰菜总黄酮,通过UV-Vis、FT-IR对纯化前后总黄酮的结构表征,最后采用UPLC-MS/MS分析纯化物组成成分,以期为水晶冰菜功能性的利用和相关保健食品的开发提供相应的理论支持。
1. 材料与方法
1.1 材料与仪器
水晶冰菜 北京新发地农产品市场;芦丁标准品、大孔树脂 均购自北京中科生邦有限公司;亚硝酸钠、硝酸铝、氢氧化钠、乙醇(99.7%)、乙酸(≥99.5%)、乙酸乙酯(≥99.5%)、丙酮(≥99.5%)、石油醚(≥99.5%)、溴化钾 均为分析纯,购自北京畅华志诚科技有限公司。
XMTD-8222恒温鼓风干燥箱 北京博宇宝威实验设备公司;FT135中草药粉碎机 天津市泰斯特仪器有限公司;AL204电子天平 梅特勒-托利多仪器有限公司;KQ-500DE超声波清洗机 昆山市超声仪器有限公司;L530台式离心机 湖南赫西仪器装备有限公司;RE-2000B旋转蒸发仪 上海亚荣生化仪器厂;BK-FD10T台式冷冻干燥机 济南欧莱博科学仪器有限公司;UV795CRT紫外可见分光光度计 上海佑科仪器仪表有限公司;Nicolet iS5傅立叶变换红外光谱仪 赛默飞世尔科技公司;XCIEX AD超高效液相、QTrap 6500高灵敏度质谱 AB Sciex。
1.2 实验方法
1.2.1 水晶冰菜总黄酮的提取
参考刘亚倩等[10]的方法稍作修改,将新鲜水晶冰菜清洗干净,在60 ℃下于真空干燥箱内干燥48 h,用中草药粉碎机碾碎,过40目筛得水晶冰菜干粉末;按一定的料液比和浸提液浓度,于一定的温度下采用一定的功率超声处理一定的时间,10000 r/min下离心10 min,残渣重复提取2次,合并上清液至旋转蒸发仪内蒸至无醇味,低温冷冻干燥24 h,得水晶冰菜总黄酮粗提物(以下简称粗提物)。
1.2.2 浸提液的筛选
固定料液比1:25 mg/mL,超声温度60 ℃,时间60 min,功率250 W,选取乙醇、乙酸、乙酸乙酯、丙酮和石油醚五种浸提液对冰菜总黄酮进行提取,测定含量并计算得率,筛选出最优浸提液。
1.2.3 单因素实验
1.2.3.1 不同浓度对冰菜总黄酮得率的影响
根据上述实验结果,固定料液比1:25 mg/mL,超声温度60 ℃,时间60 min,功率250 W,选择体积分数40%、50%、60%、70%、80%乙醇作为浸提液对冰菜总黄酮进行提取,测定含量并计算得率。
1.2.3.2 不同料液比对冰菜总黄酮得率的影响
固定乙醇体积分数60%,超声温度60 ℃,时间60 min,功率250 W,在料液比分别为1:10、1:15、1:20、1:25、1:30 mg/mL时对冰菜总黄酮进行提取,测定含量并计算得率。
1.2.3.3 不同超声时间对冰菜总黄酮得率的影响
固定料液比1:25 mg/mL,乙醇体积分数60%,超声温度60 ℃,功率250 W,在超声时间分别为30、60、90、120、150 min时对冰菜总黄酮进行提取,测定含量并计算得率。
1.2.3.4 不同超声温度对冰菜总黄酮得率的影响
固定料液比1:25 mg/mL,乙醇体积分数60%,超声时间60 min,功率250 W,在超声温度分别为30、45、60、75、90 ℃时对冰菜总黄酮进行提取,测定含量并计算得率。
1.2.3.5 不同超声功率对冰菜总黄酮得率的影响
固定料液比1:25 mg/mL,乙醇体积分数60%,超声温度60 ℃,时间60 min,在超声功率分别为150、200、250、300、350 W时对冰菜总黄酮进行提取,测定含量并计算得率。
1.2.4 正交试验
根据单因素实验结果,确定体积分数为60%的乙醇为浸提液,以料液比、超声时间、温度、功率为因素,以总黄酮得率为指标,设计四因素三水平的正交试验,对提取工艺进行优化,因素水平表如表1所示。
表 1 正交试验因素和水平设计Table 1. Factor and levels of orthogonal experiment
水平因素 A料液比
(mg/mL)B超声时间
(min)C超声温度
(℃)D超声功率
(W)1 1:20 90 45 250 2 1:25 120 60 300 3 1:30 150 75 350 1.2.5 水晶冰菜总黄酮含量和得率的测定
参考荆常亮[11]的方法稍作修改,采用NaNO2-Al(NO3)3比色法,得到芦丁标准曲线的线性回归方程为:y=0.1021x+0.0002,R2=0.9998。参考荆常亮[11]的方法稍作修改,测定水晶冰菜总黄酮质量浓度,计算水晶冰菜总黄酮的含量和得率:
Y(mg/g)=C×V×NM (1) Q(%)=C×V×NM×103×100 (2) 式中:C为冰菜总黄酮质量浓度,mg/mL;V为待测样液体积,mL;N为原样液稀释倍数;M冰菜粉质量,g;Y为总黄酮含量,mg/g;Q为总黄酮得率,%。
1.2.6 水晶冰菜总黄酮的纯化
本课题组前期[12]采用D101大孔树脂纯化粗提物,通过静态、动态吸附和解吸试验得到最佳纯化条件为:粗提物质量浓度0.30 g/L,pH4,上样流速60 mL/h,上样体积56 mL,洗脱液为体积分数80%乙醇溶液,pH6,洗脱流速60 mL/h,体积128 mL,在该条件处理下收集全部洗脱液转至旋转蒸发仪内蒸至无醇味,低温冷冻干燥24 h,得水晶冰菜总黄酮纯化物(以下简称纯化物)。
1.2.7 水晶冰菜总黄酮的结构表征
1.2.7.1 紫外可见光谱扫描
参考李侠等[13]的方法稍作修改,将2 mg的芦丁标准品、粗提物、纯化物分别溶于体积分数80%乙醇中,并定容至10 mL,稀释5倍后,在200~800 nm的波长下,用紫外分光光度计进行紫外可见光谱扫描。
1.2.7.2 傅立叶红外光谱扫描
将芦丁标准品、粗提物、纯化物分别与干燥的KBr粉末以1:100的质量比混合并研细均匀,置于磨具内,在压片机上制成透明薄片。以空白KBr片作背景,利用傅立叶变换红外光谱仪扫描,波数范围4000~400 cm−1,扫描次数32,分辨率4 cm−1。
1.2.8 水晶冰菜总黄酮纯化物的组成成分测定
采用超高效液相色谱-串联质谱法(UPLC-MS/MS)检测纯化物中黄酮类化合物组成成分和相对含量。
样品溶液制备:取纯化物粉末100 mg溶于50 mL体积分数80%的乙醇中,超声处理 30 min,放至室温。摇匀后取适量在4 ℃,12000 r/min条件下离心20 min,上清液上机检测。
色谱条件:色谱柱为UPLC BEH C18色谱柱(1.7 μm,2.1×150 mm);流动相:A相0.1%甲酸水溶液+B相乙腈;柱温箱温度设为40 ℃,自动进样器温度设为8 ℃,进样体积为2 μL。色谱梯度如表2所示。
表 2 液相色谱流动相条件Table 2. Mobile phase conditions of liquid chromatography时间(min) 流速(μL/min) A相(%) B相(%) 0 300 90 10 0.5 300 90 10 15 300 40 60 16.01 300 2 98 18.00 300 2 98 18.01 300 90 10 20.00 300 90 10 质谱条件:AB Sciex QTrap 6500+质谱仪器参数设置:数据采集时,以多反应监测(MRM)模式进行质谱分析。离子源参数如下:IonSpray Voltage:+5000/−4500 V,Curtain Gas:35 psi,Temperature: 500 ℃,Ion Source Gas 1:55 psi,Ion Source Gas 2:60 psi。
1.3 数据处理
每组试验重复3次,试验结果以均值±标准差表示,用SPSS Statistics 21和Origin8.5软件进行试验数据分析和绘图;对质谱数据,使用Skyline软件对MRM数据进行处理。
2. 结果与分析
2.1 不同浸提液对水晶冰菜总黄酮得率的对比分析
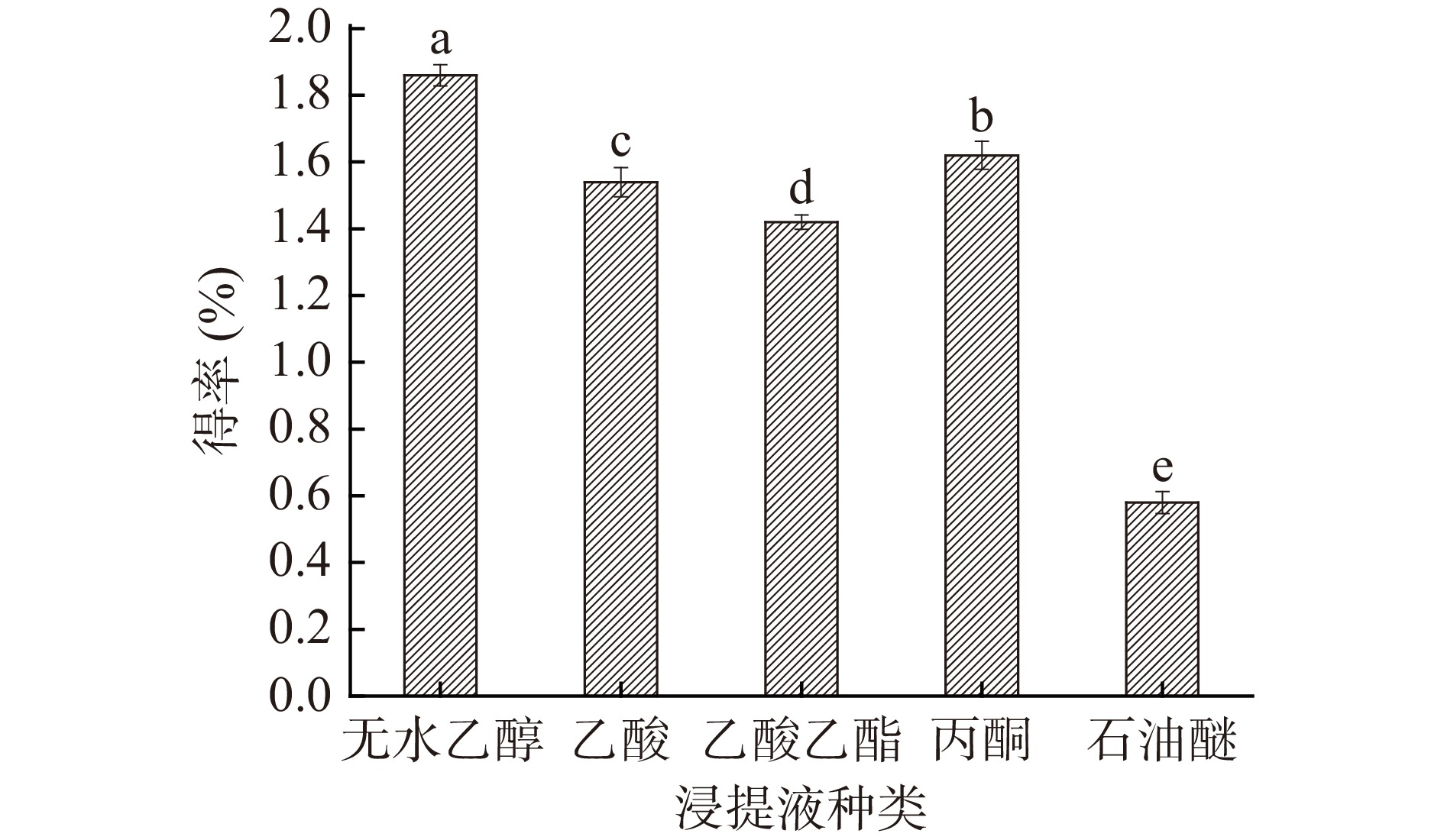
由图1可以看出,无水乙醇对水晶冰菜总黄酮的得率最高,为1.86%,丙酮、乙酸、乙酸乙酯次之,石油醚的提取效果最差,所以在后续单因素试验中选择无水乙醇作为浸提液。陈代秀等[14]也曾做出了类似的报道,认为无水乙醇对刺梨中黄酮类活性物质的浸提效果最好,约为次级浸提液乙酸的3.33倍。
![]() 图 1 不同浸提液种类对水晶冰菜总黄酮得率的影响注:不同组小写字母代表差异显著,P<0.05;图2同。Figure 1. Different extracting solution on extraction rate of total flavonoids
图 1 不同浸提液种类对水晶冰菜总黄酮得率的影响注:不同组小写字母代表差异显著,P<0.05;图2同。Figure 1. Different extracting solution on extraction rate of total flavonoids2.2 单因素对水晶冰菜总黄酮得率的影响
2.2.1 不同乙醇体积分数对水晶冰菜总黄酮得率的影响
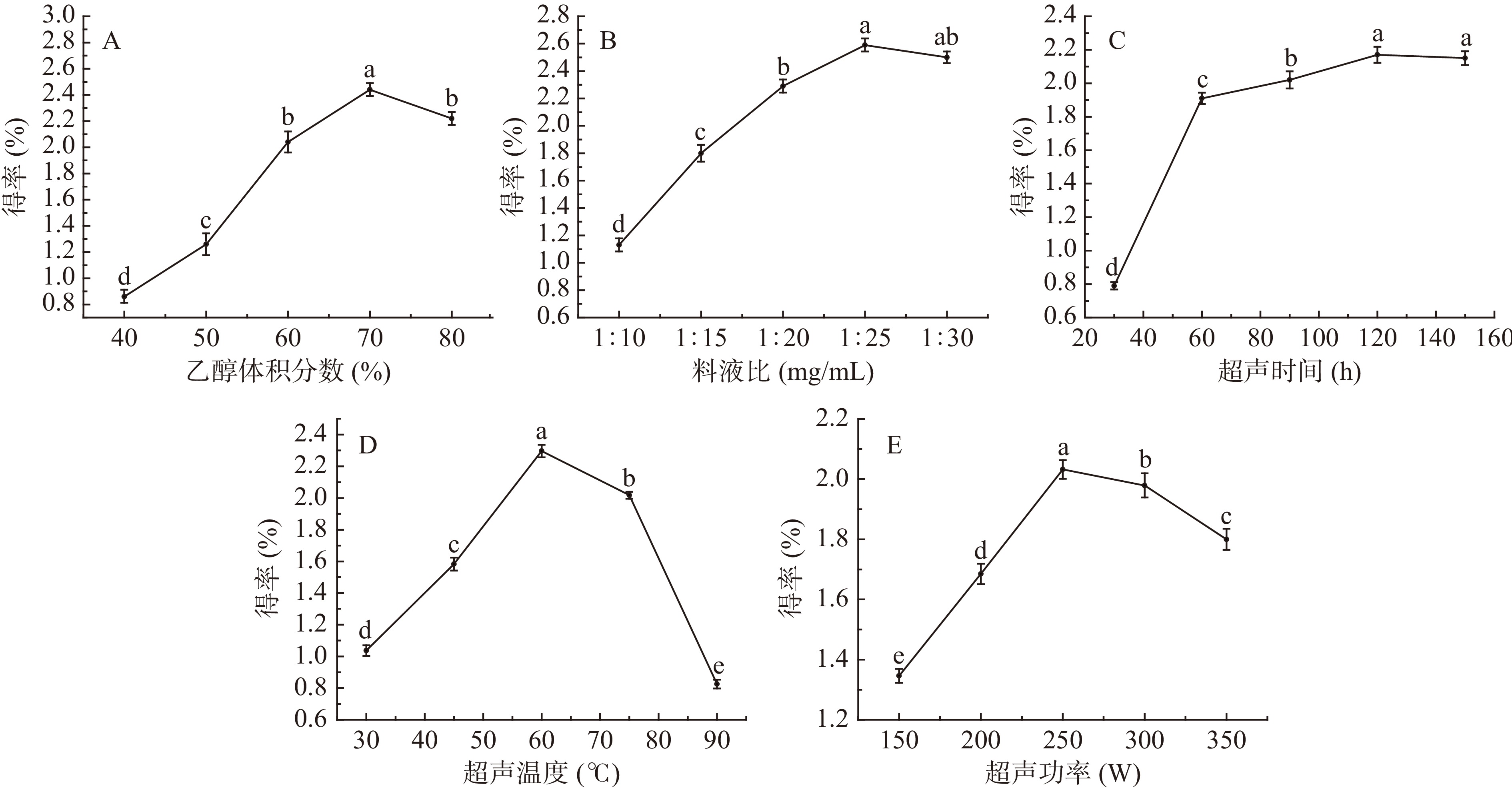
从图2A可以看出,当乙醇体积分数在40~70%范围内,水晶冰菜总黄酮得率随体积分数的增加而提高,且在70%时达到峰值2.441%,此后随乙醇体积分数的增加,得率反而呈下降趋势。可以利用相似相溶原理进行解释,黄酮作为一种极性化合物,可以在一定的体积分数范围内和乙醇有效结合,但是当体积分数过高时,结合能力下降[15]。因此,乙醇体积分数确定为70%。
2.2.2 不同料液比对水晶冰菜总黄酮得率的影响
由图2B可知,水晶冰菜总黄酮得率随料液比增加而提高,在1:25时得率最高,为2.589%,此后料液比继续增大,得率缓慢下降。该结果与千春录等[16]对水芹黄酮提取的结果一致,原因可能是当料液比小时,溶剂与物料接触面积小,造成提取不完全;而当物料比增大时,乙醇和冰菜粉的接触面积、物料内外浓度差增大,从而得率提高;但当物料比超过一定的限度时,会导致物料中其他醇溶性物质溶出,降低得率。因此,液料比选择为1:25 mg/mL。
2.2.3 不同超声时间对水晶冰菜总黄酮得率的影响
由图2C可知,水晶冰菜总黄酮得率随着超声时间的增大而提高,且在30~60 min内急剧增长,60~120 min内缓慢增长,120 min时达到峰值2.170%,此后随着超声时间的延长,得率无明显变化,说明在120 min时黄酮已经基本溶出。因此,超声时间选择为120 min。
2.2.4 不同超声温度对水晶冰菜总黄酮得率的影响
由图2D可知,随着超声温度的上升,水晶冰菜总黄酮得率先上升后下降,在60℃时的得率最高为2.296%,这与秦晶晶等[17]报道的不同提取温度对柿叶黄酮提取工艺的影响结果一致,原因可能是在一定的温度范围内,升温会加快分子运动,有利于水晶冰菜黄酮在无水乙醇中溶解,但是当温度过高时,会对黄酮结构造成破坏,降低得率。因此,超声温度选择为60 ℃。
2.2.5 不同超声功率对水晶冰菜总黄酮得率的影响
由图2E可知,水晶冰菜总黄酮的得率随着超声功率的增强先上升后下降,在250 W处的得率最高为2.032%。可能是由于超声波的机械剪切力破坏了细胞结构,有利于黄酮类物质的溶出,但超声功率达到一定限值时,会破坏部分黄酮类物质的结构,致使总黄酮得率缓慢下降[18]。由于200 W时总黄酮得率较低,因此选择250~350 W进行后续试验。
2.3 正交试验结果
表3显示正交试验的极差R1>R3>R4>R2,所以对水晶冰菜总黄酮得率影响最大的因素为料液比,其次是超声温度、功率和时间,该结果与吴迪等[19]对辣木叶总黄酮提取的研究结果一致。表4的方差分析结果表明料液比对得率的影响达到显著水平(P<0.05),与极差分析结果一致。由正交试验得出水晶冰菜总黄酮的最佳提取组合为A2B2C1D1,即乙醇浓度为70%、料液比1:25 mg/mL、温度45℃、功率250 W的条件下超声120 min,对上述提取工艺进行验证,获得最大得率2.776%,说明由正交试验得到的最佳工艺条件可利用性高。
表 3 正交试验结果Table 3. Results of orthogonal experiment实验号 A料液比(mg/mL) B超声时间(min) C超声温度(℃) D超声功率(W) 黄酮得率(%) 1 1 1 1 1 1.944 2 1 2 2 2 1.512 3 1 3 3 3 1.358 4 2 1 2 3 2.196 5 2 2 3 1 2.592 6 2 3 1 2 2.286 7 3 1 3 2 1.752 8 3 2 1 3 2.378 9 3 3 2 1 1.938 K1 1.604 1.964 2.202 2.158 K2 2.358 2.160 1.882 1.850 K3 2.022 1.860 1.900 1.978 R 0.377 0.150 0.160 0.154 表 4 正交试验方差分析Table 4. Orthogonal test variance analysis方差来源 偏差平方和 自由度 F比 P值 显著性 A 0.214 2 2.563 0.046 * B 0.035 2 0.419 0.718 C 0.049 2 0.587 0.623 D 0.036 2 0.431 0.710 误差 0.33 8 注:*表示结果达到显著水平(P<0.05)。 2.4 水晶冰菜总黄酮的结构表征结果
2.4.1 紫外可见光谱结果分析
黄酮类化合物(flavonoids)泛指两个苯环通过三个碳原子通过相互连接形成的一系列化合物的统称,即具有C6-C3-C6基本结构的一类化合物的统称[20]。这种特殊的结构特点使大部分黄酮类化合物的紫外光谱在200~400 nm波长范围内由两个主要的吸收峰组成,一个在220~280 nm范围内,称为带Ⅱ,可以认为是由A环的苯甲酰基体系的电子跃迁产生的吸收带,而另一个在300~400 nm范围内,称为带Ⅰ,一般认为是由B环肉桂酰基体系的电子跃迁产生的吸收带[21-22]。不同类型的黄酮类化合物,其带Ⅰ和带Ⅱ的峰形、峰位和吸收强度存在差异,因此可以通过紫外吸收光谱来判断黄酮类化合物的类型[23]。由图3可知,粗提物的吸收峰带Ⅱ为267 nm,吸收峰带Ⅰ为324 nm;纯化物的吸收峰带Ⅱ为278 nm,吸收峰带Ⅰ为320 nm。其中267与278 nm处的吸收峰说明水晶冰菜总黄酮提取物中可能含有A环苯甲酰基体系,324与320 nm处的吸收峰说明其可能含有B环肉桂酰基体系。水晶冰菜总黄酮粗提物和纯化物的吸收峰带II的强度稍强于峰带I,且峰带I的峰型较平缓,可能的原因是A环的苯甲酰基体系上取代基的种类和位置较复杂,符合异黄酮的紫外吸收光谱特征[24],而且通过对比发现纯化物中黄酮含量明显高于粗提物。两种物质在200~230 nm范围内吸收峰显著说明其中可能含有糖类化合物[25]。以上分析只是对水晶冰菜总黄酮结构的初步表征,具体结论还需后续试验进一步探究。
2.4.2 傅立叶红外光谱结果分析
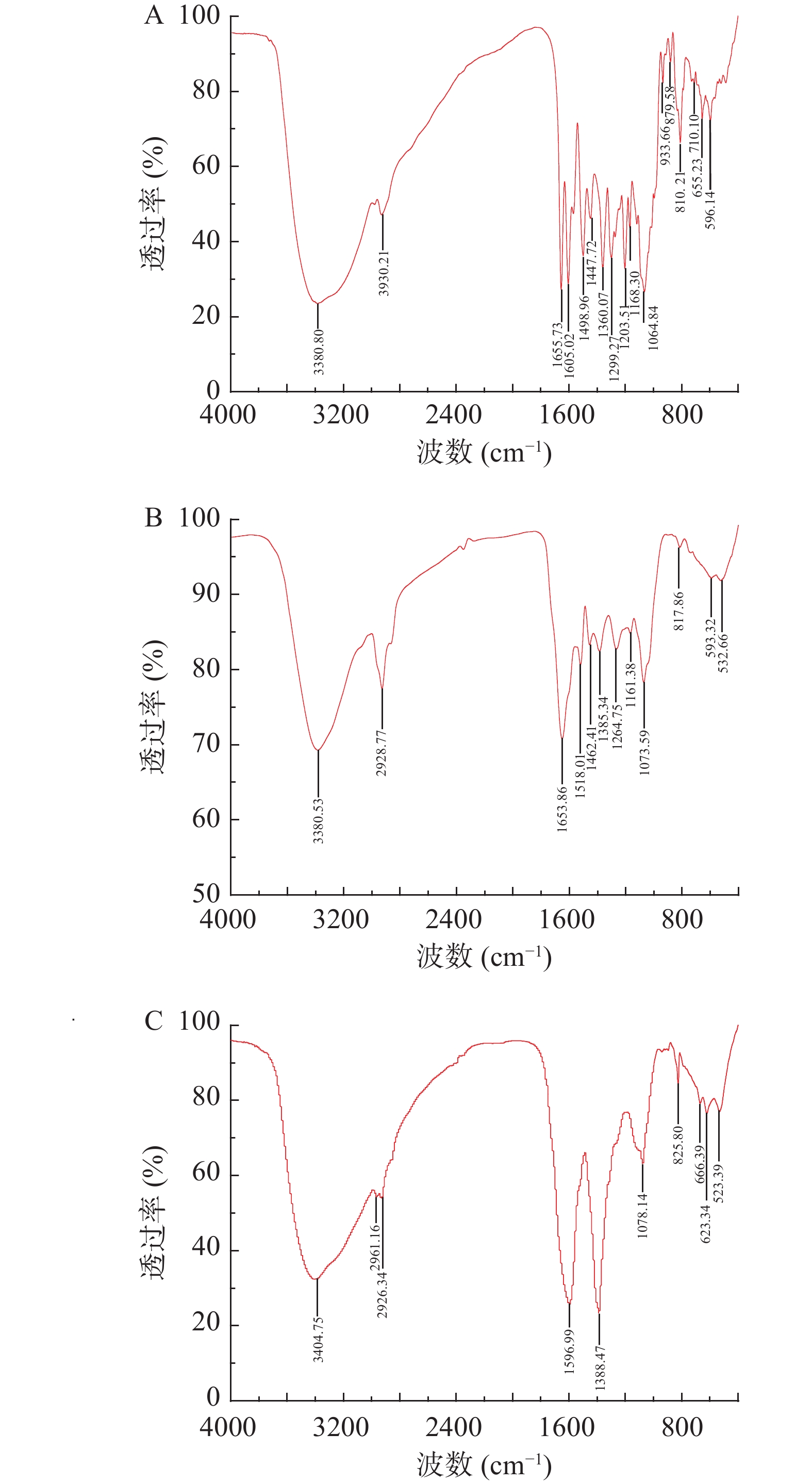
当测试样品受到频率连续变化的红外线辐照时,其分子吸收了某些频率的光波而获得能量,随后分子产生振动或进行由基态向激发态的能级跃迁,使被吸收波段的透射光强度减弱,该特点与分子中存在的官能团或分子骨架有关[26]。芦丁标准品、水晶冰菜总黄酮粗提物和纯化物的傅立叶红外光谱图如图4所示,可以看出粗提物和纯化物在4000~400 cm−1范围内存在多处峰值,说明其具备黄酮类化合物的特征官能团。
在官能团区,芦丁标准品在3380.80 cm−1处,粗提物在3380.53 cm−1处,纯化物在3404.75 cm−1处都存有宽大的吸收峰,属于羟基的特征吸收峰(3000~3750 cm−1),推测此处为分子间氢键O-H伸缩振动,说明了酚羟基或糖环上羟基的存在[27];芦丁标准品在2930.21 cm−1处,粗提物在2928.77 cm−1处,纯化物在2929.34、2961.16 cm−1处存有吸收峰,这和C-H键吸收峰(2950~2850 cm−1)一致,故推测此处为亚甲基的C-H伸缩振动,与芦丁标准品和粗提物相比,纯化物峰强度明显弱,可能是其饱和碳上的氢较少;芦丁标准品在1655.73 cm−1处,粗提物在1653.86 cm−1处存在芳酮C=O伸缩振动峰,两者位置、峰型接近[28],但纯化物在该位置没有明显的吸收峰,可能是含有该结构的物质较少,经过纯化处理后损失严重;芦丁标准品在1605.02、1498.96 cm−1处,粗提物在1518.01、1462.41 cm−1处存有苯环骨架振动吸收特征峰,而纯化物仅在1596.99 cm−1处有一个吸收峰,但是峰宽;芦丁标准品在1447.72、1360.07 cm−1处,粗提物在1385.34 cm−1处,纯化物在1388.47 cm−1处有吸收峰,这符合O-H面内弯曲振动吸收峰(1450~1300 cm−1)的波数范围[29]。在指纹区,C-O的伸缩振动在1300~1060 cm−1波数范围内易识别,芦丁标准品有4个吸收峰,粗提物有3个吸收峰,纯化物仅在1078.14 cm−1处有一个强度较弱的吸收峰;芦丁标准品在810.21 cm−1处,粗提物在817.86 cm−1处,纯化物在825.80 cm−1处的吸收峰是O-H面外弯曲振动的结果[30]。芦丁标准品、粗提物和纯化物在800 ~532 cm−1波数范围内存在的不同程度的吸收峰是由于苯环上存在不同类型的取代基和取代位点[31]。
结合对官能团区和指纹区吸收峰的分析,可以看出纯化物比粗提物的红外光谱分辨率高,出峰位置和峰型更加明确,特征官能团更为突出,可以进一步说明纯化物的黄酮含量与品质较粗提物有了极大的提高。同时水晶冰菜总黄酮粗提物、纯化物与芦丁标准品的红外光谱图存在多处相似,可以推测其中一定含有黄酮醇,可能含有芦丁单体,但具体的成分还需要进一步的研究。
2.4.3 水晶冰菜总黄酮纯化物的组成成分分析
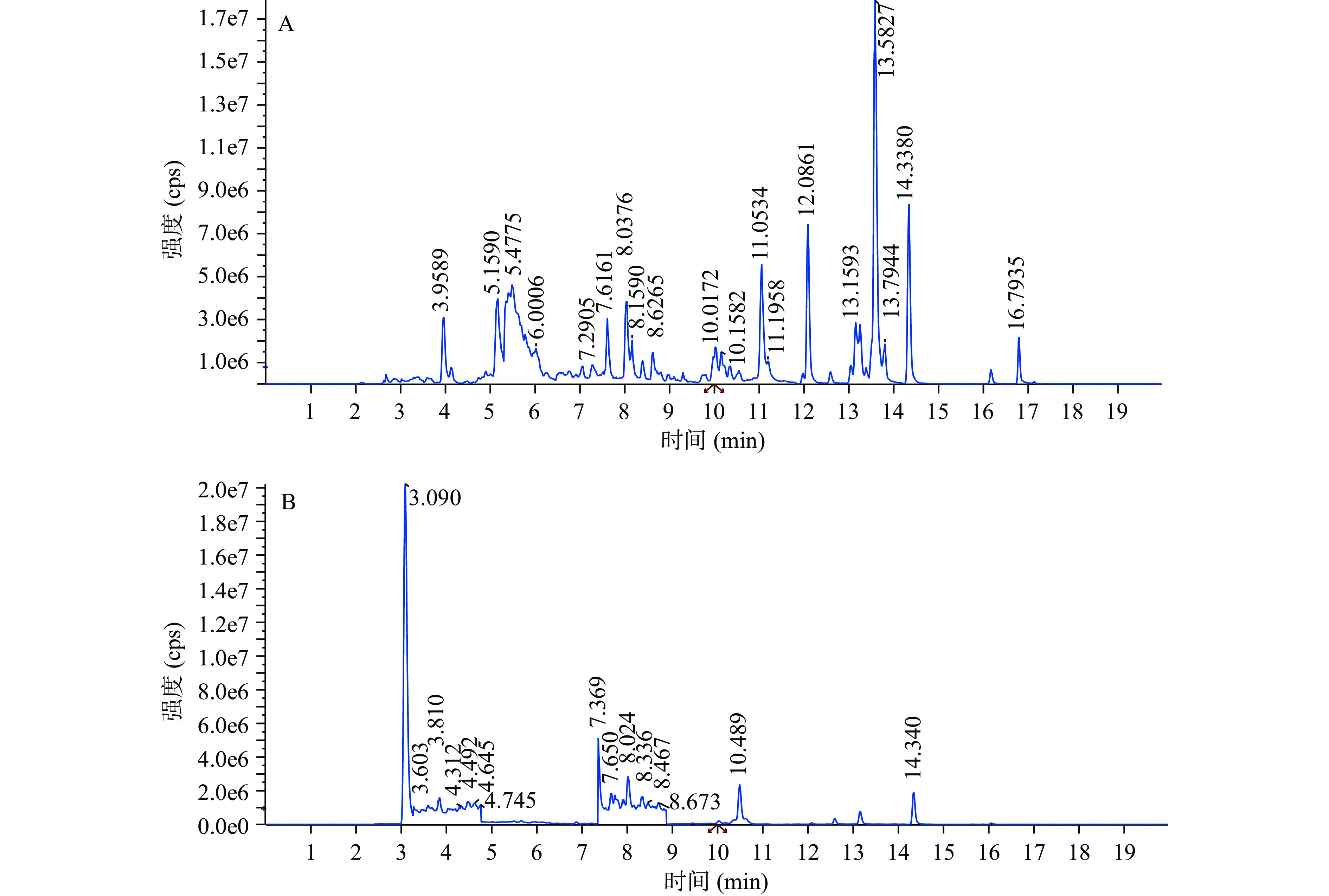
按照1.2.8的色谱和质谱条件对水晶冰菜总黄酮纯化物进行分析,UPLC在20 min内的分离效果较好,并得到图5B所示的总离子流图,对比图5A的混合标准品总离子流图,可看出纯化物在3.090、3.603、3.810、4.312、4.492、4.645、4.745、7.369、7.650、8.024、8.336、8.467、8.673、10.489和14.340 min时存在明显的质谱峰,通过MRM模式进行质谱分析,基于鉴定母离子和子离子对,检测特异性母离子,并选定相应的特异性子离子,去除其他子离子干扰,结合文献[32-34]报道的黄酮类化合物信息和实验室自建的黄酮标准品数据库比对,确定了纯化物中所含部分黄酮的具体信息,其组成成分和相对含量表如表5所示,从水晶冰菜总黄酮纯化物中鉴定出30多种黄酮类化合物,其中以桔皮素的相对百分含量最多,为50.854%±0.089%,其次为川橙皮素、杜鹃素、原儿茶醛、地奥司明、柚皮苷查尔酮、甜橙黄酮、柚皮素、芦丁,8种物质占比分别为20.949%±0.115%、8.781%±0.072%、3.962%±0.107%、2.875%±0.079%、2.523%±0.054%、2.241%±0.056%、2.151%±0.066%、1.723%±0.052%。根据三碳键(C3)结构的氧化程度和B环的连接位置等特点,可以将鉴定出的物质分为黄酮醇类、二氢黄酮类、黄酮类、黄烷醇、异黄酮和二氢查尔酮这6类,其中以黄酮类占比最大,为74.307%。该结果与紫外可见光谱和傅立叶红外光谱扫描的结果基本一致,目前未见其他关于水晶冰菜总黄酮组成成分和相对含量的报道。
表 5 水晶冰菜总黄酮纯化物组成成分及相对百分含量Table 5. Components and relative contents of total flavonoids purified from Mesembryanthemum crystallinum
序号
英文名称
中文名称
化学式MRM离子对
保留时间(min)
峰面积(mAU·min)
相对百分含量(%)母离子 正负离子模式 子离子 1 Tangeretin 桔皮素 C20H20O7 372.781 1 342.901 14.340 8183934 50.854±0.089a 2 Nobiletin 川橙皮素 C21H22O8 403.4 1 372.801 13.153 3369730 20.949±0.115b 3 Farrerol 杜鹃素 C17H16O5 301.3 1 180.901 12.611 1413145 8.781±0.072c 4 Protocatechualdehyde 原儿茶醛 C7H6O3 138.862 1 93.101 3.090 637589 3.962±0.107d 5 Diosmin 地奥司明 C28H32O15 609.062 1 463.001 6.880 462651 2.875±0.079e 6 Chalconaringenin 柚皮苷查尔酮 C27H34O14 272.913 1 152.901 10.489 409064 2.523±0.054e 7 sinensetin 甜橙黄酮 C20H20O7 372.955 1 342.901 12.097 360637 2.241±0.056ef 8 Naringenin 柚皮素 C15H12O5 273.3 1 152.801 10.043 346185 2.151±0.066f 9 Rutin 芦丁 C27H30O16 610.974 1 302.901 4.645 177213 1.723±0.052g 注:不同组小写字母代表差异显著,P<0.05。 3. 讨论与结论
本文通过超声辅助法提取水晶冰菜总黄酮,最优条件为:乙醇体积分数60%,料液比1:25 mg/mL,超声温度45 ℃,时间120 min,功率250 W,此条件下的实际得率可达2.776%,该结果优于练冬梅等[4]的得率,可能是因为传统提取方法耗时长,导致水晶冰菜中黄酮类化合物大量损失,同时杂质含量高也会导致整体的得率降低。目前尚未发现对水晶冰菜其他提取方法和得率的报道,但是符群等[35]采用减压-超声辅助醇法提取薇菜黄酮,得率为1.189%,陈建福等[36]采用优化超声辅助提取芥菜总黄酮的条件,得到的得率为2.682%,两者均低于本结果,可能是水晶冰菜作为一种新型绿色蔬菜,与常见的叶菜相比,水分更充足,活性成分更丰富且组织脆嫩,更有利于超声波对组织细胞的破坏,加速黄酮成分的扩散。
采用D101大孔树脂纯化水晶冰菜总黄酮得到纯化物,通过UV-Vis扫描发现水晶冰菜总黄酮纯化物在278 nm和320 nm处有两个明显的吸收峰,通过与芦丁标准品图谱的接近程度和峰带I、II的峰宽特征,可以初步推测其中可能含有黄酮、黄酮醇、异黄酮类化合物;通过FT-IR扫描也发现其含有O-H、C-H、C=O、C=C、酚羟基等多种特征官能团的振动吸收峰,符合黄酮类化合物的典型结构,从与芦丁标准品吸收峰的接近程度推测其含有黄酮醇类化合物,可能含有芦丁单体;UPLC-MS/MS的检测表明,纯化物中含有桔皮素、川橙皮素、杜鹃素、原儿茶醛、地奥司明、柚皮苷查尔酮、甜橙黄酮、柚皮素、芦丁等30多种黄酮类化合物,其中桔皮素的相对百分含量最高,为50.854%±0.089%。从黄酮种类上看,纯化物中共含有6种黄酮类化合物,其中以黄酮类占比最大,为74.307%,其次是黄酮醇、二氢黄酮、二氢查尔酮、异黄酮和黄烷醇类。本研究充分说明了水晶冰菜中黄酮种类和含量丰富,可以作为一种极具潜力的提取黄酮类化合物的纯天然植物资源,后续研究重点可以放在其生物活性的研究上,有利于其在功能性保健食品领域的开发研究,对提高水晶冰菜的综合经济效益具有深远意义。
-
图 1 不同浸提液种类对水晶冰菜总黄酮得率的影响
注:不同组小写字母代表差异显著,P<0.05;图2同。
Figure 1. Different extracting solution on extraction rate of total flavonoids
表 1 正交试验因素和水平设计
Table 1 Factor and levels of orthogonal experiment
水平因素 A料液比
(mg/mL)B超声时间
(min)C超声温度
(℃)D超声功率
(W)1 1:20 90 45 250 2 1:25 120 60 300 3 1:30 150 75 350 表 2 液相色谱流动相条件
Table 2 Mobile phase conditions of liquid chromatography
时间(min) 流速(μL/min) A相(%) B相(%) 0 300 90 10 0.5 300 90 10 15 300 40 60 16.01 300 2 98 18.00 300 2 98 18.01 300 90 10 20.00 300 90 10 表 3 正交试验结果
Table 3 Results of orthogonal experiment
实验号 A料液比(mg/mL) B超声时间(min) C超声温度(℃) D超声功率(W) 黄酮得率(%) 1 1 1 1 1 1.944 2 1 2 2 2 1.512 3 1 3 3 3 1.358 4 2 1 2 3 2.196 5 2 2 3 1 2.592 6 2 3 1 2 2.286 7 3 1 3 2 1.752 8 3 2 1 3 2.378 9 3 3 2 1 1.938 K1 1.604 1.964 2.202 2.158 K2 2.358 2.160 1.882 1.850 K3 2.022 1.860 1.900 1.978 R 0.377 0.150 0.160 0.154 表 4 正交试验方差分析
Table 4 Orthogonal test variance analysis
方差来源 偏差平方和 自由度 F比 P值 显著性 A 0.214 2 2.563 0.046 * B 0.035 2 0.419 0.718 C 0.049 2 0.587 0.623 D 0.036 2 0.431 0.710 误差 0.33 8 注:*表示结果达到显著水平(P<0.05)。 表 5 水晶冰菜总黄酮纯化物组成成分及相对百分含量
Table 5 Components and relative contents of total flavonoids purified from Mesembryanthemum crystallinum
序号
英文名称
中文名称
化学式MRM离子对
保留时间(min)
峰面积(mAU·min)
相对百分含量(%)母离子 正负离子模式 子离子 1 Tangeretin 桔皮素 C20H20O7 372.781 1 342.901 14.340 8183934 50.854±0.089a 2 Nobiletin 川橙皮素 C21H22O8 403.4 1 372.801 13.153 3369730 20.949±0.115b 3 Farrerol 杜鹃素 C17H16O5 301.3 1 180.901 12.611 1413145 8.781±0.072c 4 Protocatechualdehyde 原儿茶醛 C7H6O3 138.862 1 93.101 3.090 637589 3.962±0.107d 5 Diosmin 地奥司明 C28H32O15 609.062 1 463.001 6.880 462651 2.875±0.079e 6 Chalconaringenin 柚皮苷查尔酮 C27H34O14 272.913 1 152.901 10.489 409064 2.523±0.054e 7 sinensetin 甜橙黄酮 C20H20O7 372.955 1 342.901 12.097 360637 2.241±0.056ef 8 Naringenin 柚皮素 C15H12O5 273.3 1 152.801 10.043 346185 2.151±0.066f 9 Rutin 芦丁 C27H30O16 610.974 1 302.901 4.645 177213 1.723±0.052g 注:不同组小写字母代表差异显著,P<0.05。 -
[1] 张洪磊, 刘孟霞. 冰菜特征特性及控盐高产栽培技术[J]. 陕西农业科学,2015(3):122. [ZHANG H L, LIU M X. Characteristics and cultivation techniques of salt control and high yield of Mesembryanthemum crystallinum[J]. Shaanxi Journal of Agricultural Sciences,2015(3):122. doi: 10.3969/j.issn.0488-5368.2015.03.041 [2] 祁永琼, 王莉丽, 彭健. 冰菜大棚栽培技术[J]. 吉林农业,2016(21):98. [QI Y Q, WANG L L, PENG J. Cultivation technology of Mesembryanthemum crystallinum[J]. Agriculture of Jilin,2016(21):98. [3] 于丽艳. 非洲冰菜高效栽培技术[J]. 北方园艺,2016(17):62−63. [YU L Y. The high-yield cultivation technique of African Mesembryanthemum crystallinum L[J]. Northern Horticulture,2016(17):62−63. [4] 练冬梅, 姚运法, 赖正锋, 等. 冰菜主要营养成分及抗氧化活性分析[J]. 农业科学, 2020, 10(5): 225−230. LIAN D M, YAO Y F, LAI Z F, et al. Analysis of main nutrients and antioxidant activity of Mesembryanthemum crystallinum Linn. Hans Journal of Agricultural Sciences, 2020, 10(5): 225−230.
[5] YOU X W, YIN S J, SUO F Y, et al. Biochar and fertilizer improved the growth and quality of the ice plant (Mesembryanthemum crystallinum L. ) shoots in a coastal soil of Yellow River Delta, China[J]. Science of the Total Environment,2021:775.
[6] KONG W W, ZHU D, NOBLE J D, et al. Molecular changes in Mesembryanthemum crystallinum guard cells underlying the C3 to CAM transition. [J]. Plant Molecular Biology, 2020, 103(6): doi: 10.1007/s11103-020-01016-9.
[7] 王远, 郑雯, 袁田青, 等. 辣木叶总黄酮微波辅助提取工艺优化及其抑制α-葡萄糖苷酶活性研究[J]. 核农学报,2018,32(1):84−94. [WANG Y, ZHANG W, YUAN T Q, et al. Optimization of microwave-assisted extraction process of total flavonoids from Moringa oleifera Lam. leaves and its inhibition on α-glucosidase activity[J]. Journal of Nuclear Agricultural Sciences,2018,32(1):84−94. doi: 10.11869/j.issn.100-8551.2018.01.0084 [8] 李晓雪. 紫苏黄酮的提取工艺优化、含量分析及降糖活性研究[D]. 哈尔滨: 东北林业大学, 2020. LI X X. Study on extraction technology optimization, content analysis and hypoglycemic activity of flavonoids from Perilla[D]. Harbin: Northeast Forestry University, 2020.
[9] 冯艺飞. 茵陈黄酮提取纯化及特性研究[D]. 天津: 天津科技大学, 2019. FENG Y F. Study on extraction, purification and characteristics of flavonoids from Artemisia capillaris[D]. Tianjin: Tianjin University of Science and Technology, 2019.
[10] 刘亚倩, 魏华, 李贵, 等. 荠菜总黄酮质量分数测定及超声提取工艺优化[J]. 吉首大学学报(自然科学版),2016,37(1):74−79. [LIU Y Q, WEI H, LI G, et al. Content determination and ultrasonic extraction techniques of total flavonoids from Capsellae bursa-pastoris[J]. Journal of Jishou University(Natural Sciences Edition),2016,37(1):74−79. [11] 荆常亮. 紫花苜蓿总黄酮的提取、纯化及其抗氧化活性研究[D]. 北京: 中国农业科学院, 2016. JING C L. Extraction, purification and antioxidant activity of total flavonoids from alfalfa [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[12] 孙美玲, 冯晓光, 侯雪飞, 等. 水晶冰菜总黄酮大孔树脂纯化工艺及体外降糖活性研究[J/OL]. 河南农业大学学报: 1−12 [2021-05-30]. https: //doi. org/10.16445/j. cnki. 1000-2340.20210521. 001. SUN M L, FENG X G, HOU X F, et al. Purification technology and in vitro hypoglycemic activity of total flavonoids macroporous resins from Mesembryanthemum crystallinum[J/OL]. Journal of Henan Agricultural University: 1−12 [2021-05-30].https://doi.org/10.16445/j.cnki. 000-2340. 20210521. 001.
[13] 李侠, 臧学丽, 徐祎博, 等. AB-8大孔树脂纯化绿豆皮黄酮工艺优化及纯化前后抗氧化能力比较[J]. 食品科学,2018,39(10):283−290. [LI X, ZANG X L, XU Y B, et al. Optimization of purification of flavonoids from Mung bean coat by AB-8 macroporous resin and comparison of antioxidant capacity of crude and purified flavonoids[J]. Food Science,2018,39(10):283−290. doi: 10.7506/spkx1002-6630-201810043 [14] 陈代秀, 夏伟丽, 胡思前, 等. 刺梨中活性物质的提取与性能探讨[J]. 化肥设计,2020,58(2):13−17. [CHEN D X, XIA W L, HU S Q, et al. Extraction of active substances from roxburgh rose and discussion on its properties[J]. Chemical Fertilizer Design,2020,58(2):13−17. doi: 10.3969/j.issn.1004-8901.2020.02.004 [15] 许玲玉, 陆兰宁, 陈冉, 等. 超声辅助提取牛角瓜中多酚工艺的研究[J]. 中国食品添加剂,2020,31(9):28−32. [XU L Y, LU L N, CHEN R, et al. Ultrasound-assisted extraction of polyphenols fromCalotropis gigantea[J]. China Food Additives,2020,31(9):28−32. [16] 千春录, 侯顺超, 殷健东, 等. 响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J]. 食品科学,2016,37(10):76−81. [QIAN C L, HOU S C, YIN J D, et al. Optimization of ultrasonic-assisted extraction of flavonoids from Oenanthe javanica and there antioxidant activity[J]. Food Science,2016,37(10):76−81. [17] 秦晶晶, 钱慧琴, 赵媛, 等. 柿叶总黄酮提取工艺优化及其抗氧化活性[J]. 食品工业科技,2020,41(13):32−38,45. [QIN J J, QIAN H Q, ZHAO Y, et al. Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from persimmon leaves[J]. Science and Technology of Food Industry,2020,41(13):32−38,45. [18] 陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学,2016,37(2):45−50. [CHEN H M, XIE L. Optimization of extraction process for flavonoid from Soutellaria barbata by response surface methodology and evaluation of its antioxidant activity[J]. Food Science,2016,37(2):45−50. doi: 10.7506/spkx1002-6630-201602008 [19] 吴迪, 赵贝贝, 耿曼璐, 等. 正交试验优化超声提取辣木叶总黄酮及其抗氧化活性研究[J]. 粮食与油脂,2017,30(8):96−99. [WU D, ZHAO B B, GENG M L, et al. Optimization of utrasonic extraction of total flavonoids fromMoringa oleifera leaves and their antioxidant activities by orthogonal test[J]. Cereals & Oils,2017,30(8):96−99. doi: 10.3969/j.issn.1008-9578.2017.08.025 [20] 王珊珊. 芫荽黄酮的提取、分离纯化及生物活性研究[D]. 哈尔滨: 哈尔滨商业大学, 2014. WANG S S. Study on extraction, isolation and purification biological activity of flavonoids in Coriandrum sativum[D]. Harbin: Harbin University of Commerce, 2014.
[21] GAO C, DAVIN G C, LIU H Y, et al. Development of a thiolysis HPLC method for the analysis of procyanidins in cranberry products[J]. Journal of agricultural and food chemistry, 2018, 66(9):2159-2167.
[22] 陈瑾, 陈晶华, 刘利平, 等. 枸杞叶黄酮提取物的纯化及组成结构分析[J]. 食品工业科技,2019,40(18):28−34,40. [CHEN J, CHEN J H, LIU L P. Purification and structural analysis of flavonoids from Lycium barbarum leaves[J]. Science and Technology of Food Industry,2019,40(18):28−34,40. [23] 王维维, 王亦军, 侯圣龙, 等. 昆仑雪菊中黄酮类化合物提取与纯化[J]. 广州化学,2014,39(4):22−27. [WANG W W, WANG Y J, HOU S L, et al. Extraction and isolation for flavonoids in Coreopsis tinctoria[J]. Guangzhou Chemistry,2014,39(4):22−27. doi: 10.3969/j.issn.1009-220X.2014.04.005 [24] 赵光远, 许艳华, 敬思群, 等. 高压微射流对葡聚糖理化性质和结构的影响[J]. 食品科技,2017,42(12):240−244. [ZHAO G Y, XU Y H, JING S Q, et al. Effect of high pressure microjet on physicochemical properties and structure of dextran[J]. Food Science and Technology,2017,42(12):240−244. [25] 宋站立. 爪瓣山柑黄酮的优化提取、纯化、鉴定与生物活性研究[D]. 天津: 天津科技大学, 2019. SONG Z L. Optimization of extraction, purification, identification and biological activities of flavonoids from Cappairs himalayensis[D]. Tianjin: Tianjin University of Science and Technology, 2019.
[26] 杨小慧, 石光波, 拜晓彬, 等. 文冠果落果黄酮成分分析及抑菌性评价[J]. 食品科学,2018,39(10):53−58. [YANG X H, SHI G B, BAI X B, et al. Flavonoid content and antibacterial activity ofXanthoceras sorbifolia Bunge fruit drop[J]. Food Science,2018,39(10):53−58. doi: 10.7506/spkx1002-6630-201810009 [27] WANG Y J , YAO S J, GUANG Y X, et al. A novel process for preparation of (1→3)-β-D-glucan sulphate by a heterogeneous reaction and its structural elucidation[J]. Carbohydrate Polymers, 2005, 59(1):93-99.
[28] ZHANG Y L, XIA Y. Study on different extracts of Chrysanthemum indicum by fourier transform infrared spectroscopy[J]. Spectroscopy and Spectral Analysis,2012,32(12):3225−3228.
[29] 蔡冬宝, 施月, 马娇, 等. 高钙菜黄酮的分级分离各级分的抗氧化活性[J]. 食品工业科技,2019,40(5):108−113,123. [CAI D B, SHI Y, MA J, et al. Antioxidant activity of flavonoids fractionation extracts from Sedum aizoon L [J]. Science and Technology of Food Industry,2019,40(5):108−113,123. [30] ZHAO R M, ZHAO J, DUAN H X, et al. Green and efficient extraction of four bioactive flavonoids from pollen typhae by ultrasound-assisted deep eutectic solvents extraction[J]. Journal of Pharmaceutical and Biomedical Analysis,2018,161:246−253. doi: 10.1016/j.jpba.2018.08.048
[31] 何书美, 乔兰侠, 刘敬兰. 红外光谱法测定芹菜叶提取物中总黄酮的含量[J]. 分析科学学报,2008(2):201−204. [HE S M, QIAO L X, LIU J L. Quantitative determination of total flavonoids in the extraction of celery leaves by IR[J]. Journal of Analytical Science,2008(2):201−204. [32] LEI Z T, SUMMER B W, BHATIA A, et al. UHPLC-MS analyses of plant flavonoids[J]. Current Protocols in Plant Biology, 2018.
[33] 王雯皓, 梁雪, 焦莹莹, 等. 黄芫花黄酮提取物的制备、结构鉴定、含量测定和抗氧化活性研究[J/OL]. 山西大学学报(自然科学版): 1-9[2021-05-29].https://doi.org/10.13451/j.sxu.ns. 2020099. WANG W H, LIANG X, JIAO Y Y, et al. Preparation, structure identification, content determination and antioxidant activity of the flavonoid extracts from buds of Wikstroemia chamaedaphne[J/OL]. Journal of Shanxi University(Natural Science Edition): 1-9[2021-05-29].https://doi.org/10.13451/j.sxu.ns. 2020099.
[34] LEE J I, NARAYAN M, BARRETT J S. Analysis and comparison of active constituents in commercial standardized silymarin extracts by liquid chromatography-electrospray ionization mass spectrometry[J]. Journal of Chromatography B, 2006, 845(1):95-103.
[35] 符群, 李卉, 王振宇, 等. 减压-超声辅助醇法提取薇菜黄酮及其对抗氧化活性的影响[J]. 现代食品科技,2018,34(3):113−120, 130. [FU Q, LI H, WANG Z Y, et al. The effect of decompression-ultrasonic assisted alcoholic extraction on the flavonoids from Osmunda japonica Thunb and its antioxidant activity[J]. Modern Food Science and Technology,2018,34(3):113−120, 130. [36] 陈建福, 陈健旋, 林媛, 等. 芥菜总黄酮超声辅助提取工艺优化及其脂质抗氧化研究[J]. 食品研究与开发,2021,42(8):93−100. [CHEN J F, CHEN J X, LIN Y, et al. Optimization of ultrasound-assisted total flavonoid extraction from Brassica juncea and lipid antioxidant activity of the extract[J]. Food Research and Development,2021,42(8):93−100.





 下载:
下载:



 下载:
下载:
