Adsorption Characteristics of Rosin-based Macroporous Adsorption Resin for Panax notoginseng Saponin
-
摘要: 为了开发出一种分离纯化三七总皂苷的绿色新型吸附剂,本文合成了分别带有羧基(-COOH)、酯基(-OR)、羟基(-OH)的3种松香基大孔吸附树脂,采用静态吸附法对制备的三种松香基大孔树脂吸附性能进行初步筛选,优选最佳树脂并研究其对三七总皂苷的吸附机理。结果表明,以-COOH为功能基的大孔树脂吸附效果最优;其对三七总皂苷的吸附过程符合Langmuir模型,吸附动力学与准二级方程更吻合,吸附热力学参数ΔS为159.46 J·mol−1·K−1,ΔH为30.73 kJ·mol−1,表明吸附是熵驱动的自发吸热过程;用40%乙醇解吸三七总皂苷,其纯度可由粗提液的35.37%提升到74.56%,树脂重复使用10次后吸附量几乎没有变化;通过量子化学计算验证了以-COOH为功能基的大孔吸附树脂在吸附三七总皂苷时表现出的优异性能主要原因是氢键的作用;细胞毒性实验显示树脂安全环保,且安全性优于商业化树脂D-101。因此,制备的带有羧基的松香基大孔树脂适用于三七总皂苷的分离纯化,并具有一定的应用前景。Abstract: In this paper, three kinds of rosin-based macroporous adsorption resins with carboxyl group (-COOH), ester group (-OR) and hydroxyl group (-OH) were synthesized. The adsorption characteristics of the three resins for Panax notoginseng saponins were investigated by static adsorption method. The results showed that the adsorption effect of the macroporous resin with -COOH as functional group was the best, the adsorption process accorded with the Langmuir model, and the adsorption kinetics was more consistent with the quasi-second order equation, the adsorption thermodynamic parameters ΔS was 159.46 J·mol−1·K−1, ΔH was 30.73 kJ·mol−1, indicating that the adsorption was a spontaneous endothermic process driven by entropy. When Panax notoginseng saponins were desorbed with 40% ethanol, the purity of Panax notoginseng saponins could be increased from 35.37% to 74.56%. The adsorption capacity of the resin was almost unchanged after being reused for 10 times. Through quantum chemical calculation, it was proved that the excellent performance of the macroporous adsorption resin with-COOH as functional group in the adsorption of Panax notoginseng saponins was mainly due to the role of hydrogen bond. The cytotoxicity test showed that the resin was safe and environmentally friendly, and the safety of the resin was better than that of the commercial resin D-101. Therefore, the prepared rosin-based macroporous resin with carboxyl groups was suitable for the separation and purification of Panax notoginseng saponins, and had certain application prospects.
-
三七(Panax notoginseng(Burkill)F. H. Chen)为五加科人参属植物的干燥根及根茎,俗称“三七”或“田七”,是一种药食两用的植物,具有活血化瘀、止血养血、消肿止痛、抗炎等功效,已成为许多药物和保健食品的主要原料[1-3]。三七总皂苷是三七的主要活性成分,主要包括三七皂苷R1、人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1和人参皂苷Rd[4-5]。高纯度的三七总皂苷能用于注射针剂快速消除血栓,目前应用于三七总皂苷的纯化方法有沉淀、萃取、膜分离等。这些方法都存在一定的不足,如溶剂浪费过多、溶剂残留、污染环境、成本高、耗时长、吸附量小等,且分离出的三七总皂苷的纯度也较低[6-8]。
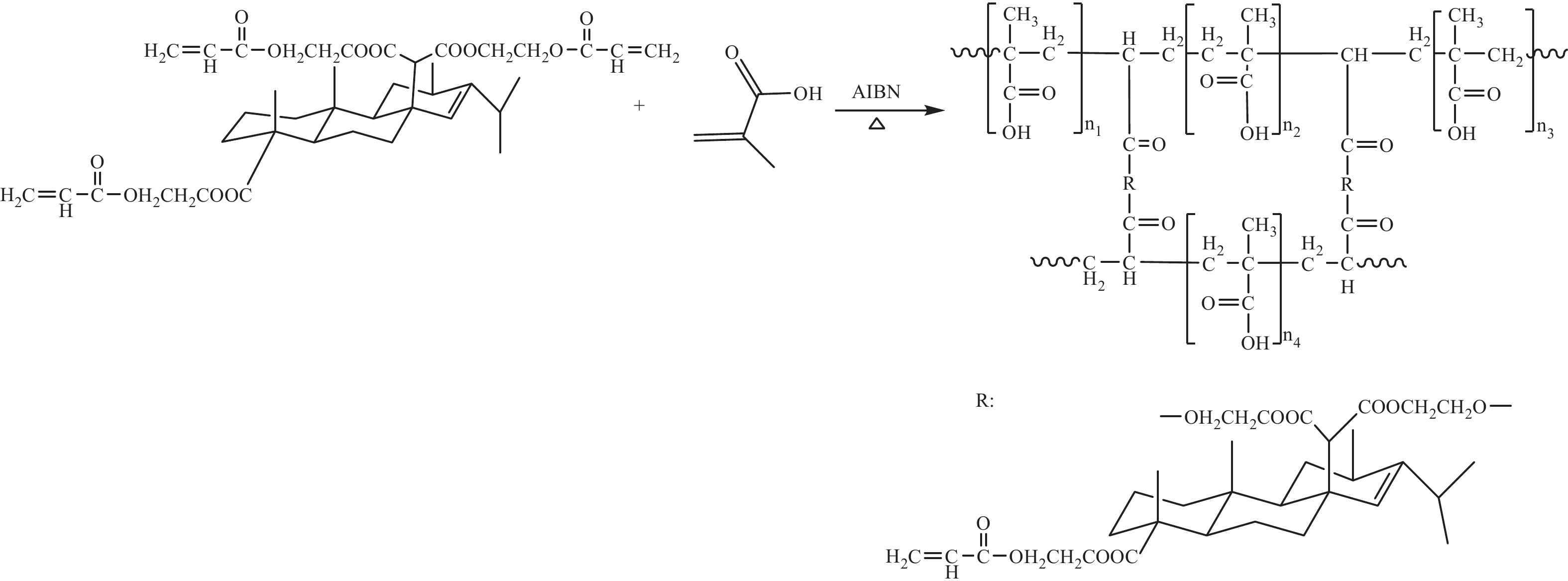
大孔吸附树脂工艺方便、吸附容量大、纯度高,已成功应用于许多天然产物中活性化合物的分离和富集[9-12]。商业化的大孔树脂大都是以芳香系化合物为骨架,如苯乙烯和二乙烯基苯,单体残留对分离物质有二次污染[13-15]。因此本课题组以可再生、无毒、易降解的松香为原料通过Diels-Alder反应合成了一种新型交联剂马来海松酸丙烯酸乙二醇酯(EGMRA)[16],代替二乙烯基苯交联剂,其类菲环骨架与天然药物骨架类似,能够改善聚合物的刚性、疏水性和化学稳定性,本课题组已利用松香交联剂成功合成各类功能性吸附树脂,在分离天然产物活性成分中也取得较好的成果,如Li等[17]利用松香基大孔树脂将粗提液中盐酸小檗碱的纯度由34.2%提纯到91.0%,覃丽婷等[18]制备的含糖基松香树脂可将银杏提取物黄酮的含量由25%提纯到80.9%,均表现出了松香基大孔树脂的优越性。本文以松香交联剂EGMRA分别与3种不同单体甲基丙烯酸(MAA)、甲基丙烯酸甲酯(MMA)、甲基丙烯酸羟乙酯(HEMA)共聚得到3种松香基大孔树脂(R-COOH、R-COOCH3、R-COOCH2CH2OH),研究其对三七总皂苷的吸附性能,对其吸附机制进行了讨论,以期为拓展松香资源在天然产物分离纯化中的应用以及为三七总皂苷的纯化提供理论依据和参考。
1. 材料与方法
1.1 材料与仪器
三七干燥根 购于云南文山;对照品三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd HPLC≥98%,南京源植生物科技有限公司;马来海松酸丙烯酸乙二醇酯 广西梧州日成林产化工股份有限公司;甲基丙烯酸、甲基丙烯酸甲酯、甲基丙烯酸羟乙酯 均为分析纯,国药集团化学试剂有限公司;偶氮二异丁腈(简称AIBN) 上海阿拉丁生化科技股份有限公司;聚乙烯醇 国药集团化学试剂有限公司;十二烷基硫酸钠 化学纯,国药集团化学试剂有限公司;乙酸乙酯 分析纯,西陇科学有限公司;无水乙醇 分析纯,西陇科学有限公司;GES-1细胞 上海赛柏慷生物;去离子水 实验室自制。
SE-750高速粉碎机 永康市圣象电器有限公司;SQP型电子天平 赛多利斯科学仪器有限公司;ASAP 2020M比表面积及微孔物理吸附仪 美国Micromeritic公司;SHZ-88水浴恒温振荡器 江苏金怡仪器科技有限公司;LC-15C高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 松香基大孔树脂的制备
采用悬浮聚合法制备三种树脂[17],具体操作为称取0.04 g聚乙烯醇、0.04 g十二烷基硫酸钠、150 mL去离子水作为水相于三口烧瓶中,置油浴锅中加热搅拌;称取6.30 g MAA或7.34 g MMA或9.54 g HEMA、3 g EGMRA、0.06 g偶氮二异丁腈、2.50 g致孔剂、10.30 g乙酸乙酯作为油相于烧杯中超声均匀,待水相温度升至60 ℃时加入称量好的油相,并将反应体系升温至90 ℃聚合120 min。反应结束后将所得三种白色球状树脂分别过20~60目的筛板,依次用乙酸乙酯、无水乙醇、去离子水索提12 h去除未反应的单体,最后用蒸馏水浸泡保存[19]。以MAA制备的羧基树脂为例,反应过程如图1所示。
1.2.2 三七提取液的制备
取40 g三七干燥根用粉碎机粉碎后过100目筛,用70%无水乙醇在80 ℃下回流提取三次,合并滤液,减压浓缩至无醇味,加入去离子水稀释至生药浓度(药材投料量/药液体积)为0.2 g/mL,4 ℃下冷藏备用[20]。
1.2.3 三七总皂苷含量的测定
1.2.3.1 标准曲线的绘制
参照文献[21]所述方法,分别精密称取三七皂苷R1 5.00 mg,人参皂苷Rg1 10.00 mg,人参皂苷Re 5.00 mg,人参皂苷Rb1 5.00 mg,人参皂苷Rd 5.00 mg于10 mL容量瓶中,用甲醇溶解并稀释至刻度,得对照品溶液。精密吸取各对照品溶液1 mL置于5 mL容量瓶中,得0.10 mg/mL三七皂苷R1、0.20 mg/mL人参皂苷Rg1、0.10 mg/mL人参皂苷Re、0.10 mg/mL人参皂苷Rb1、0.10 mg/mL人参皂苷Rd的混合对照品溶液。按照1.2.3.2色谱条件,以5、10、15、20、25 μL不同进样量进样检测,得到5种皂苷进样量对峰面积的线性关系如下,三七皂苷R1:y=39281.1067x−5212.0002(R2=0.9996),人参皂苷Rg1:y=76519.0199x−11955.0335(R2=0.9997),人参皂苷Rd:y=32639.8067x−18707.7671(R2=0.9995),人参皂苷Re:y=31630.6267x−17695.4668(R2=0.9998),人参皂苷Rb1:y=30048.0333x−18318.3001(R2=0.9997)。
1.2.3.2 色谱条件
ZORBAX Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm),检测波长203 nm,流速1.5 mL∙min−1,柱温25 ℃,进样量20 μL。流动相乙腈(A)-水(B)梯度洗脱(0~22 min,20% A;20~45 min,20%~46% A;45~55 min,46%~55% A;55~60 min,55% A),此色谱条件参照《中国药典》2020年版。
1.2.4 大孔树脂对三七总皂苷的静态吸附实验
1.2.4.1 松香基大孔树脂的筛选
分别称取R-COOH、R-COOCH3、R-COOCH2CH2OH松香基树脂各0.5 g于50 mL锥形瓶中,加入20 mL质量浓度5 mg/mL的三七总皂苷溶液于308 K下恒温水浴摇床中振荡24 h后,取吸附后溶液测定浓度,计算树脂的吸附率和吸附量。将吸附后的树脂用滤纸吸干表面液体,加入体积分数70%的乙醇溶液20 mL,308 K下恒温振荡24 h后取解吸后溶液测定浓度,计算解吸率。分别采用式(1)、(2)、(3)计算大孔树脂的吸附量、吸附率、解吸率[7,22]。
吸附量=(C0−C1)×V0M (1) 吸附率(%)=C0−C1C0×100 (2) 解吸率(%)=C2×V2(C0−C1)×V0×100 (3) 式中:C0、C1、C2分别为初始样液浓度、平衡浓度和解吸液浓度,mg/mL;V0、V2分别为初始样液体积和解吸液体积,mL;M为树脂干重,g。
1.2.4.2 吸附动力学
称取2 g树脂于500 mL的锥形瓶中,加入质量浓度为5 mg/mL的三七总皂苷溶液200 mL,于308 K下恒温水浴摇床中振荡吸附,24 h内隔点取样,每1 h取一次样测定浓度并计算吸附量,绘制吸附动力学曲线。
1.2.4.3 吸附等温线与热力学
称取0.5 g树脂于50 mL的锥形瓶中,加入质量浓度(1~7 mg/mL)的三七总皂苷溶液20 mL分别于298、308、318 K下恒温水浴摇床中振荡吸附24 h,取吸附后溶液测定浓度并计算吸附量,绘制吸附等温线,并根据所得数据拟合计算出热力学数据。
1.2.4.4 树脂的解吸与再生
取吸附饱和后的树脂,水洗2~3次,抽滤去除树脂表面水分,加入20 mL不同体积分数的无水乙醇于恒温水浴摇床中振荡解吸24 h,取解吸液测定浓度计算解吸率,并利用面积归一化法计算纯度[18],计算公式为式(4)。将解吸后的树脂用无水乙醇浸泡24 h,水洗至无乙醇味,抽滤干燥,再次加入一定质量浓度的三七总皂苷溶液于水浴摇床中震荡吸附,重复吸附解吸10次,通过吸附量考察树脂的重复使用性能。
纯度(%)=AiA1+A2+A3+⋅⋅⋅+An×100 (4) 式中:Ai为单个组分峰的色谱峰面积。
1.2.5 量子化学计算
量子化学可以详细揭示微观反应机理,其中密度泛函理论可以从分子水平研究分子间的相互作用,并通过吸附位点、吸附能等参数确定吸附质在吸附剂表面的方式,进而确定吸附机制[23]。本文为了确定树脂吸附三七总皂苷的作用机制,利用量子化学计算了树脂与三七总皂苷结构之间的相互作用能,采用Gaussian09E.01软件包,M06-2X密度泛函理论计算,6-31g(d)基组对两者相互作用的结合体进行结构优化,def2tzvp基组下对优化好的结构进行了能量计算,确保优化得到的为能量最低最稳定的结构。
1.2.6 细胞毒性实验
采用CCK8法评价R-COOH对GES-1细胞毒性的影响[13]。GES-1细胞复苏后,将不同浓度的树脂浸提液(10、100、200 μg/mL)加入到细胞培养瓶中,并设置空白对照组,在37 ℃下5% CO2恒温培养箱内培养72 h。最后用酶标仪测吸光度,计算细胞存活率并且使用激光共聚焦显微镜拍摄细胞存活情况。
1.3 数据处理
实验结果取三次平行实验的平均值,数据表示为平均值±标准偏差;使用SPSS 19.0软件进行数据显著性差异检验,采用单因素方差分析并用LSD法(最小显著差异法)进行比较,P<0.05,表示差异显著;使用OriginPro 2018软件进行数据统计分析以及绘制图形。
2. 结果与分析
2.1 松香基大孔树脂的筛选
利用比表面积及微孔物理吸附仪测定3种树脂的比表面积和平均孔径,并考察它们对三七总皂苷的吸附效果。由表1可知,在悬浮聚合比例和反应条件相同的制备情况下,3种松香基树脂的比表面积和平均孔径无显著性差异,均属于大孔材料,但三种树脂的吸附量、吸附率与解吸率之间存在显著性差异,R-COOH树脂的吸附率可达到86.56%;70%的乙醇解吸条件下解吸率可达80.10%,均优于另外两种树脂。因此后续选用R-COOH树脂进行三七总皂苷的吸附等温线、热动力学特征以及最佳纯化条件研究。由于3种树脂在结构上几乎没有差异,它们在吸附过程的外扩散、内扩散等传质进程是近乎一致的[24],吸附率和解吸率的差异,可能是由功能单体(MAA、MMA、HEMA)上的不同官能团使得制备出的3种树脂特征基团与三七总皂苷分子的吸附作用力不同造成的,故需采用量子化学从化学结构的结合力上探讨其吸附机制。
表 1 松香基树脂对三七总皂苷的吸附解吸性能比较(ˉx ±s, n=3)Table 1. Comparison of adsorption and desorption properties of rosin-based resin for Panax notoginseng saponins (ˉx ±s, n=3)树脂种类 比表面积(m2∙g−1) 平均孔径(nm) 吸附量(mg/g) 吸附率(%) 解吸率(%) R-COOH 36.55±1.23a 24.86±1.33a 37.61±1.24c 86.56±2.31c 80.10±1.42b R-COOCH3 34.82±0.78a 23.88±1.42a 14.48±1.67a 40.52±1.67a 63.32±2.64a R-COOCH2CH2OH 36.80±1.42a 25.95±1.56a 25.82±2.12b 52.52±2.29b 76.45±2.20b 注:平均值±标准差,同列不同小写字母表示存在显著性差异(P<0.05)。 2.2 吸附动力学和吸附热力学研究
2.2.1 吸附动力学
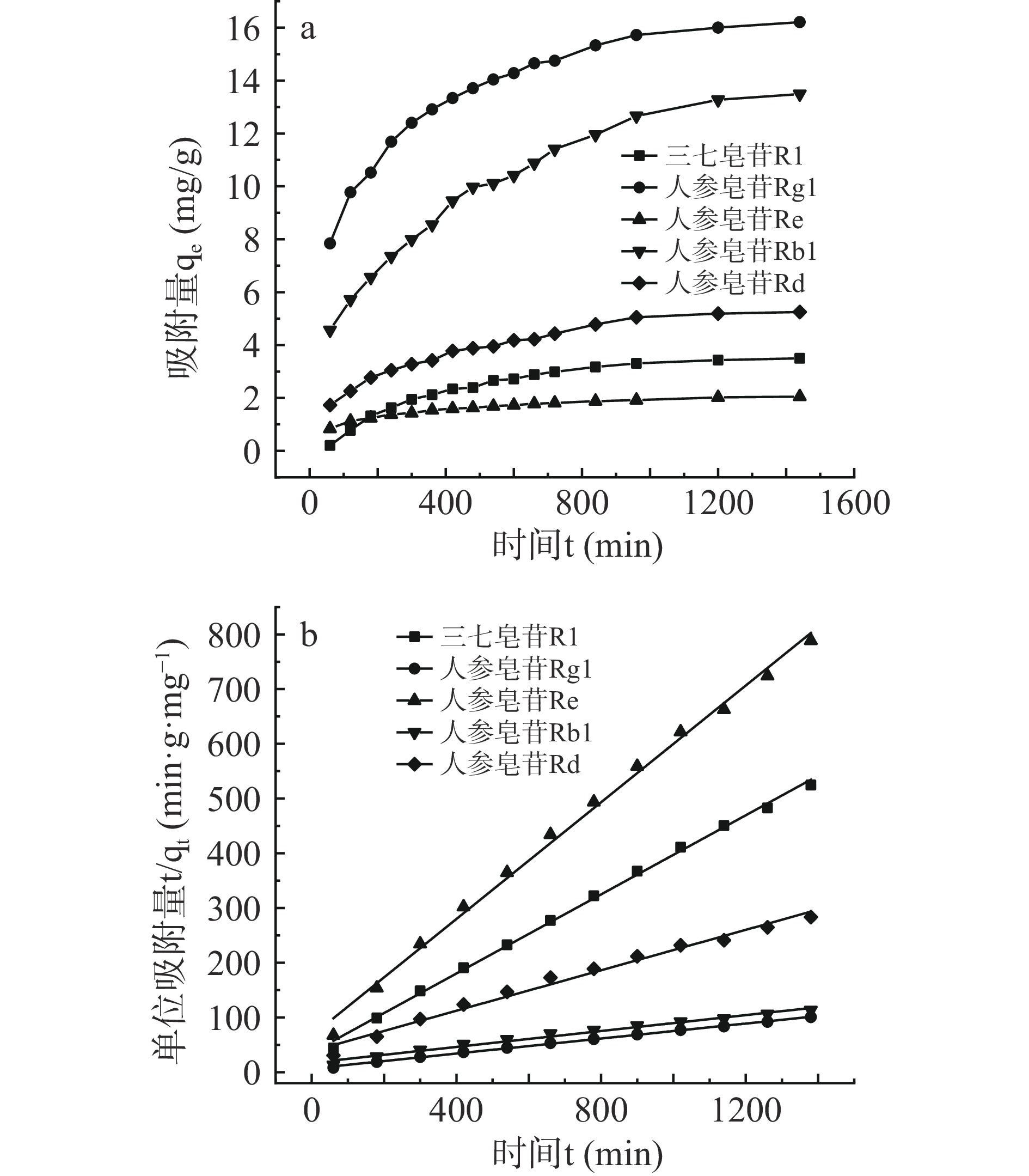
吸附等温实验对于优化吸附剂用量、预测吸附结果有重要的意义。由图2a可知R-COOH对三七总皂苷的5种皂苷成分等温吸附过程呈现同一趋势,初期吸附量随着时间快速上升,随后经过一个拐点后逐渐放缓,后期五种皂苷成分的吸附量都是在700 min处开始达到饱和。为了探究三七总皂苷5种成分的吸附量随时间的变化规律,分别采用准一级动力学和准二级动力学模型对308 K下的动力学数据进行分析拟合。准一级动力学模型的表达式为式(5),准二级动力学模型的表达式为式(6)。
lg(qe−qt)=lgqe−k12.303t (5) tqt=1k2q2e+tqe (6) 式中:qe和qt分别为平衡吸附量和t时刻三七总皂苷的吸附量,mg/g;k1为准一级动力学常数,1/min;k2为准二级动力学常数g/(mg∙min)。
准一级动力学和准二级动力学模型的拟合参数见表2,从表2中可知,准二级动力学模型不仅拟合所得的线性相关度较高(图2b),而且拟合所得的平衡吸附量与实验所得值较为接近,这说明该模型更适用于描述R-COOH对三七总皂苷5种成分的吸附过程。准二级动力学模型认为吸附速率主要受化学吸附机理的控制,这种吸附往往意味着吸附剂表面存在着饱和吸附位点,而且吸附过程涉及吸附质与吸附位点之间的化学反应,可认为吸附速率与体系中剩余吸附位点的二次方成正比[24]。这也可以解释2.1中,功能单体中的基团与三七总皂苷的化学结构的结合力相关,使得3种在结构上几乎相同而唯有甲基丙烯酸(MAA)制备的含-COOH的树脂吸附效果最好。
表 2 准一级动力学和准二级动力学模型的拟合参数Table 2. Fitting parameters of quasi-first-order and quasi-second-order kinetic models指标成分 模型 方程 R2 qe k 三七皂苷R1 准一级动力学 y=−0.0027x+0.4358 0.9213 1.55 k1=0.0027 准二级动力学 y=0.3614x+35.6846 0.9981 2.77 k2=0.0036 人参皂苷Rg1 准一级动力学 y=−0.0040x+2.5154 0.9071 12.37 k1=0.0040 准二级动力学 y=0.0686x+6.5920 0.9983 14.71 k2=0.0007 人参皂苷Re 准一级动力学 y=−0.0031x+0.3194 0.9152 1.38 k1=0.0031 准二级动力学 y=0.5334x+66.5634 0.9957 1.87 k2=0.0043 人参皂苷Rb1 准一级动力学 y=−0.0028x+2.5727 0.8829 13.10 k1=0.0028 准二级动力学 y=0.0726x+17.1251 0.9964 13.89 k2=0.0003 人参皂苷Rd 准一级动力学 y=−0.0033x+1.7920 0.8981 6.00 k1=0.0033 准二级动力学 y=0.1846x+38.4260 0.9921 5.56 k2=0.0009 2.2.2 吸附等温线
298、308、318 K下R-COOH树脂吸附三七总皂苷的吸附等温线如图3所示。采用Langmuir和Freundlich等温吸附模型[25]对吸附数据进行拟合分析,其模型如式(7)和(8)所示,结果见表3。
表 3 Langmuir和Freundlich模型的拟合参数Table 3. Fitting parameters of Langmuir and Freundlich modelsT/K Langmuir Freundlich qm/(mg·g−1) KL R2 KF 1/n R2 298 34.1097 0.4432 0.9826 11.7802 0.4200 0.9368 308 39.2718 0.4975 0.9763 14.5684 0.3970 0.9326 318 46.5578 0.4161 0.9802 15.3407 0.4363 0.9527 Langmuir 吸附模型:
qe=qmKLCe1+KLCe (7) 式中:qe为平衡吸附容量,mg/g;qm为单层饱和吸附量,mg/g;Ce为吸附平衡时三七总皂苷质量浓度,mg/mL;KL为Langmuir结合常数,mL/mg。
Freundlich吸附模型:
qe=KFC1ne (8) 式中:KF为Freundlich常数,((mg/g)∙(mL/mg))1/n;1/n为不均匀系数。
等温吸附实验的结果如图3所示,三七总皂苷的吸附量随着温度的增大而增大,可知反应是一个吸热过程,升高温度有利于吸附的进行。比较表3相关系数R2可知,Langmuir模型比Freundlich模型拟合性更好,意味着吸附大多是基于单层吸附的,前期树脂吸附位点多,后期吸附位点被三七总皂苷分子占据[8];也正因为吸附树脂有着有限的吸附位点,所以属于单分子层化学吸附占据主导的体系[26],这与Langmuir模型的假设是相符合的。
2.2.3 吸附热力学
采用Van’t-Hoff方程对热力学实验数据进行拟合分析,得出吉布斯自由能变∆G、焓变∆H和熵变∆S等热力学参数,见表4。Van’t-Hoff方程的表达式:
表 4 吸附过程热力学参数Table 4. Thermodynamic parameters of adsorption processT/K ΔH(kJ·mol−1) ΔS(J·mol−1·K−1) ΔG(kJ·mol−1) 298K 30.73 159.46 −16.79 308K −18.39 318K −19.98 328K −21.58 lnKad=−ΔHR⋅1T+ΔSR (9) ΔG=ΔH−TΔS (10) 式中:Kad(qe/Ce)为分配系数;R为理想气体常数,8.314 J/(mol∙K)。
由表4可知,∆H>0,说明R-COOH树脂对三七总皂苷的吸附为吸热过程,这与等温吸附曲线(图3)的结果相一致,高温有利于吸附。R-COOH中羧羟基是强的氢键给体,羧羰基氧原子是氢键受体,并且吸附焓值超出范德华力范围(∆H=4.2~8.4 kJ/moL)[27],而属于氢键范围(∆H=8~50 kJ/moL),表明R-COOH是通过氢键吸附三七总皂苷[28-29]。∆G<0说明该吸附过程是自发的,这符合常规大孔吸附树脂的吸附规律[30]。∆S>0,这是由于树脂在前期以氢键的形式吸附大量水分子,三七皂苷分子的吸附必然伴随着大量水分子的解吸,而水的摩尔体积小,交换下来的比较多,导致了整体的混乱度增加[31-32],又因为|∆H|<|T∆S|,因此吸附属于熵驱动过程而不属于焓驱动[33]。
2.3 解吸和再生
2.3.1 解吸液浓度对解吸率和纯度的影响
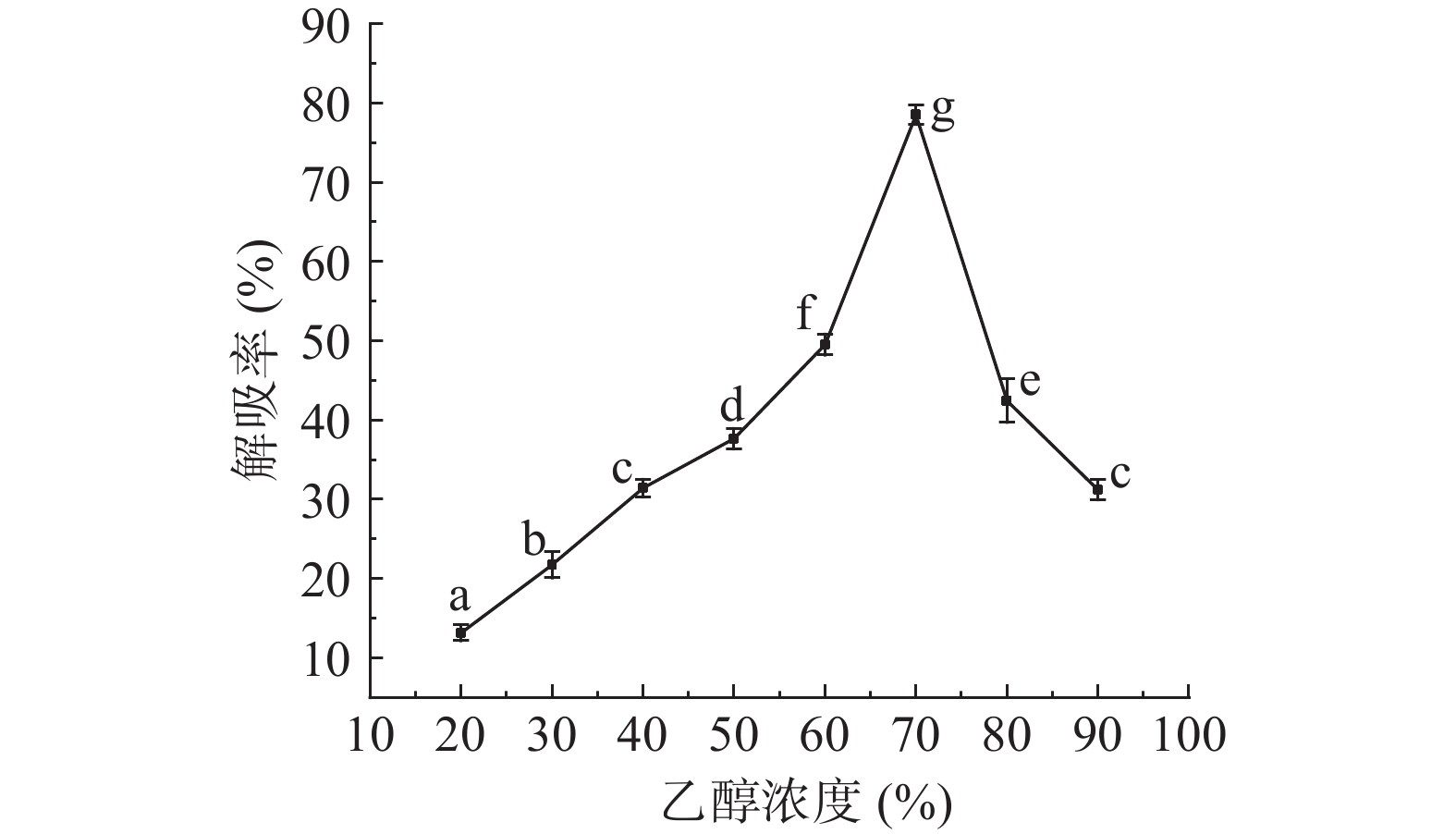
乙醇无毒安全易于回收,并且能够降低树脂与被吸附物质之间的作用力(范德华力或氢键)[34],使树脂上的被吸附物质容易解吸下来,因此实验中常用其作为解吸剂,本文探究不同浓度的乙醇对三七总皂苷的解吸率和纯化效果影响。由图4可知,三七总皂苷的解吸率随着乙醇浓度的增加呈先增加后减小的趋势,并在乙醇浓度为70%时,R-COOH对三七总皂苷的解吸率达到最大值80.10%,其原因是随乙醇浓度的增加,三七总皂苷在乙醇中的溶解度增加,树脂与三七总皂苷之间的氢键作用力小于乙醇与三七总皂苷之间的氢键作用力,但随着乙醇浓度的增加,使得其他醇溶性杂质解吸下来,降低了三七总皂苷在解吸液中的溶解度,因此解吸率先增大后减小[35]。
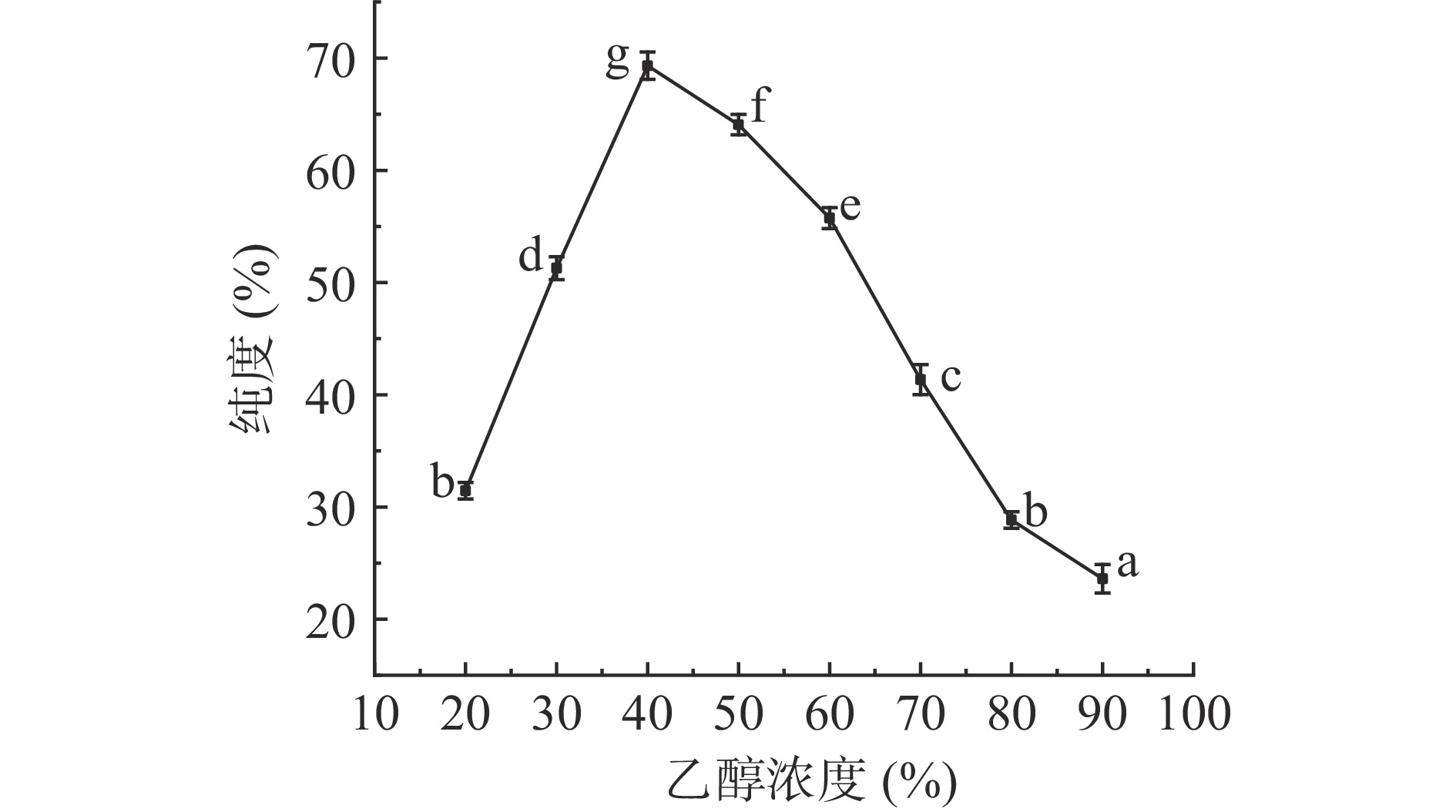
如图5所示,随着乙醇浓度的增大,静态解吸液中三七总皂苷的纯度呈先增大后减小的趋势,当乙醇浓度为40%时,解吸液中三七总皂苷的纯度最高,此浓度下杂质被洗下来较少;而70%的乙醇虽然解吸率高,但乙醇浓度过高,溶液极性较低,解吸出的醇溶性杂质增多[22],使得三七总皂苷的纯度降低,不利于后续纯度的提升和三七总皂苷的精制,因此在后续静态吸附纯化实验中选择40%的乙醇溶液作为解吸溶剂。
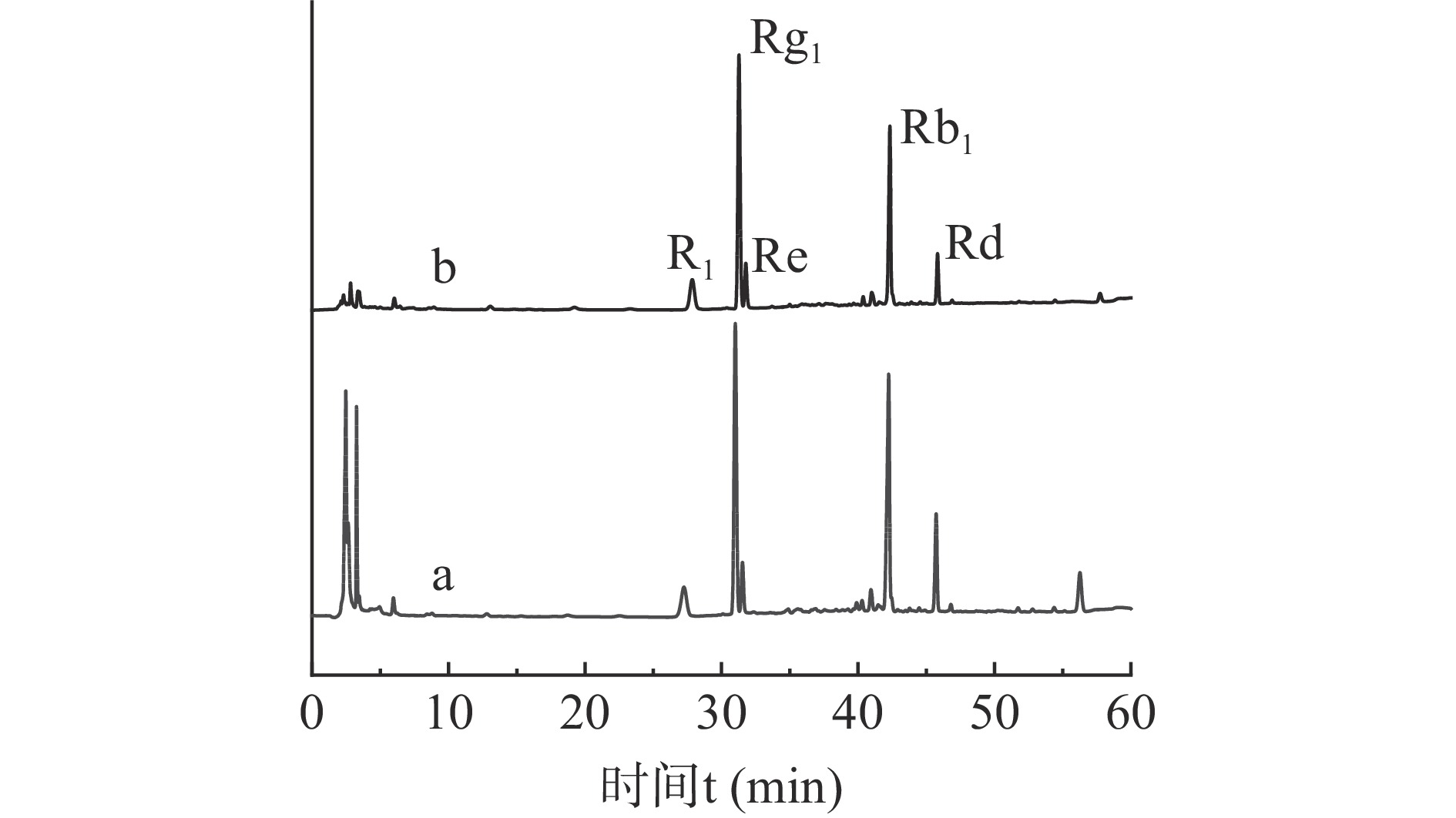
如图6所示,纯化前的三七总皂苷提取液色谱图在0~5 min时有较多的杂质峰,三七总皂苷初提液纯度为35.37%,经R-COOH吸附后,水冲洗2~3次,40%的无水乙醇解吸后,0~5 min的杂质峰明显降低,利用面积归一化法计算三七总皂苷的纯度为69.26%。将一次树脂吸附解吸后所得溶液循环吸附解吸两次后,三七总皂苷的纯度可达最大值74.56%,纯度较初提液提高了2.11倍,表明了松香基树脂R-COOH对三七总皂苷具有良好的纯化效果。
2.3.2 树脂的重复使用性能
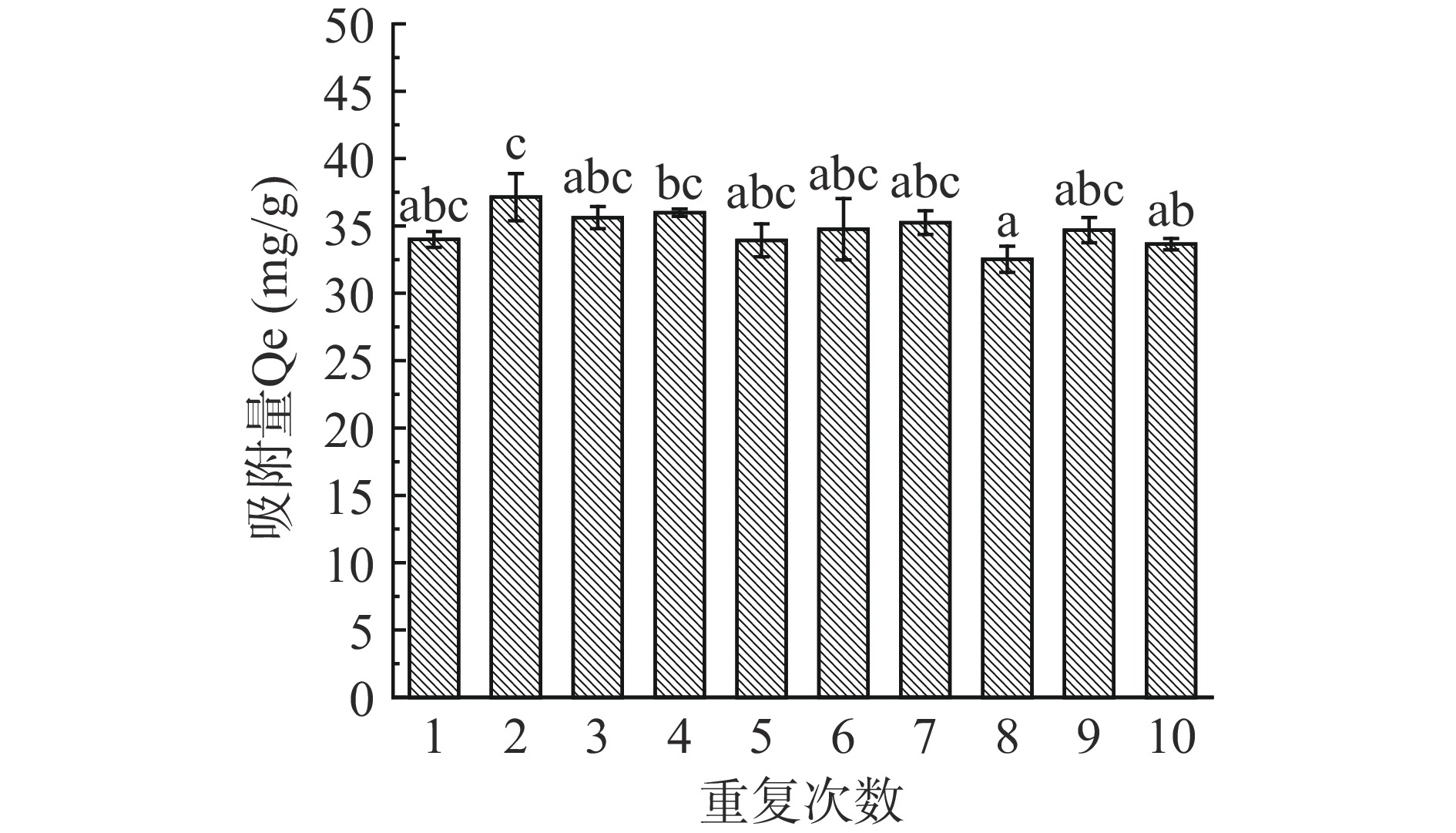
以40%的无水乙醇溶液作为解吸液,将解吸后的树脂用无水乙醇浸泡24 h,水洗至无乙醇味,抽滤干燥,再次加入一定质量浓度的三七总皂苷溶液于水浴摇床中震荡吸附,重复吸附解吸10次,如图7所示,R-COOH树脂经过10次循环后其吸附量无显著性差异(P˃0.05),说明该树脂具有良好的重复使用性能和稳定的物化性质。
2.4 吸附机制
根据三七总皂苷与松香基树脂的结构可知,二者之间作用力主要为氢键和分子间力,且2.2.3实验数据所得吸附焓值也证明了R-COOH与三七总皂苷主要作用力为氢键,因此利用计算化学从分子角度来计算功能基与三七总皂苷氢键作用的模式和大小,明确松香基树脂与三七总皂苷的吸附机制。
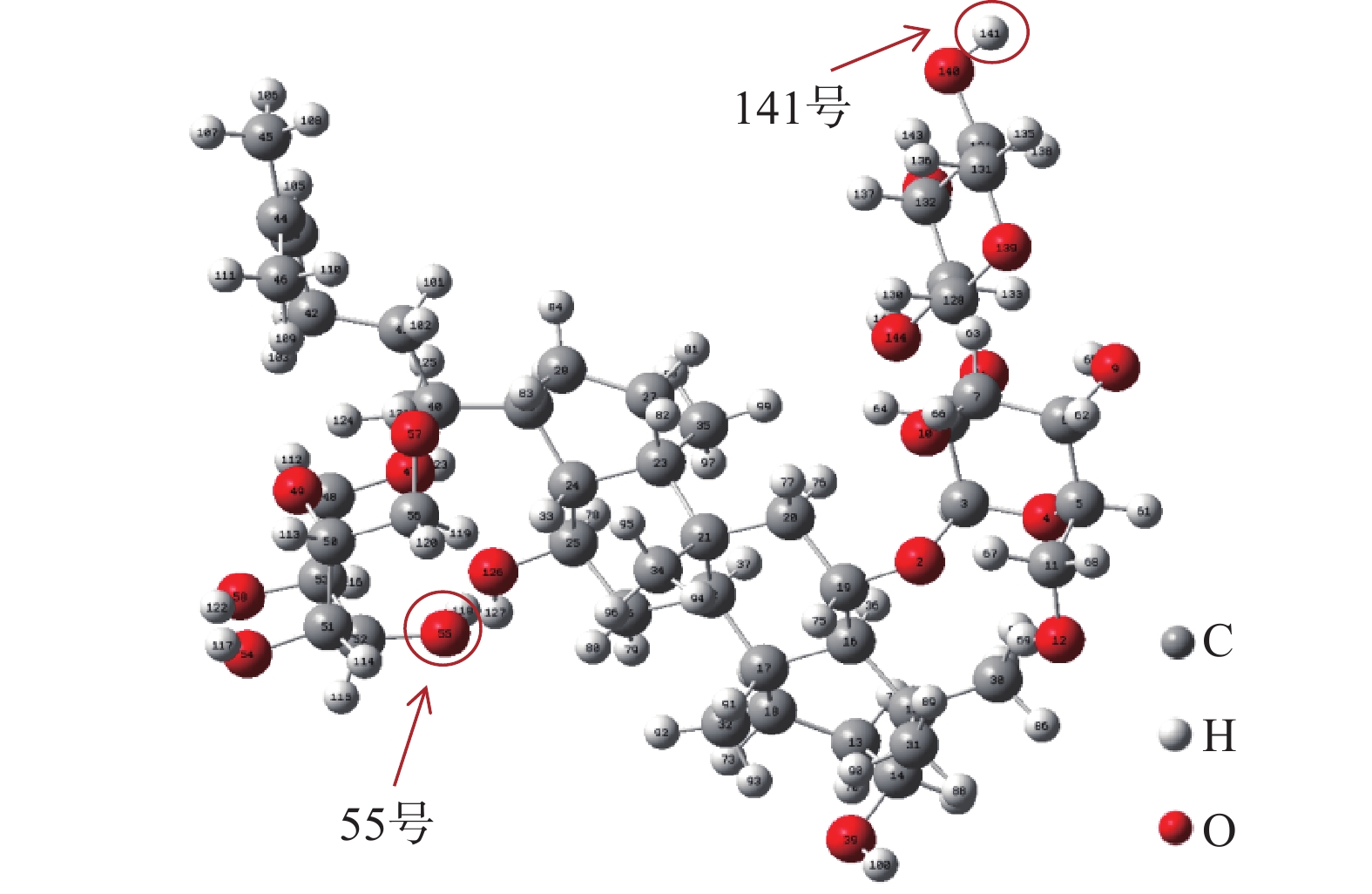
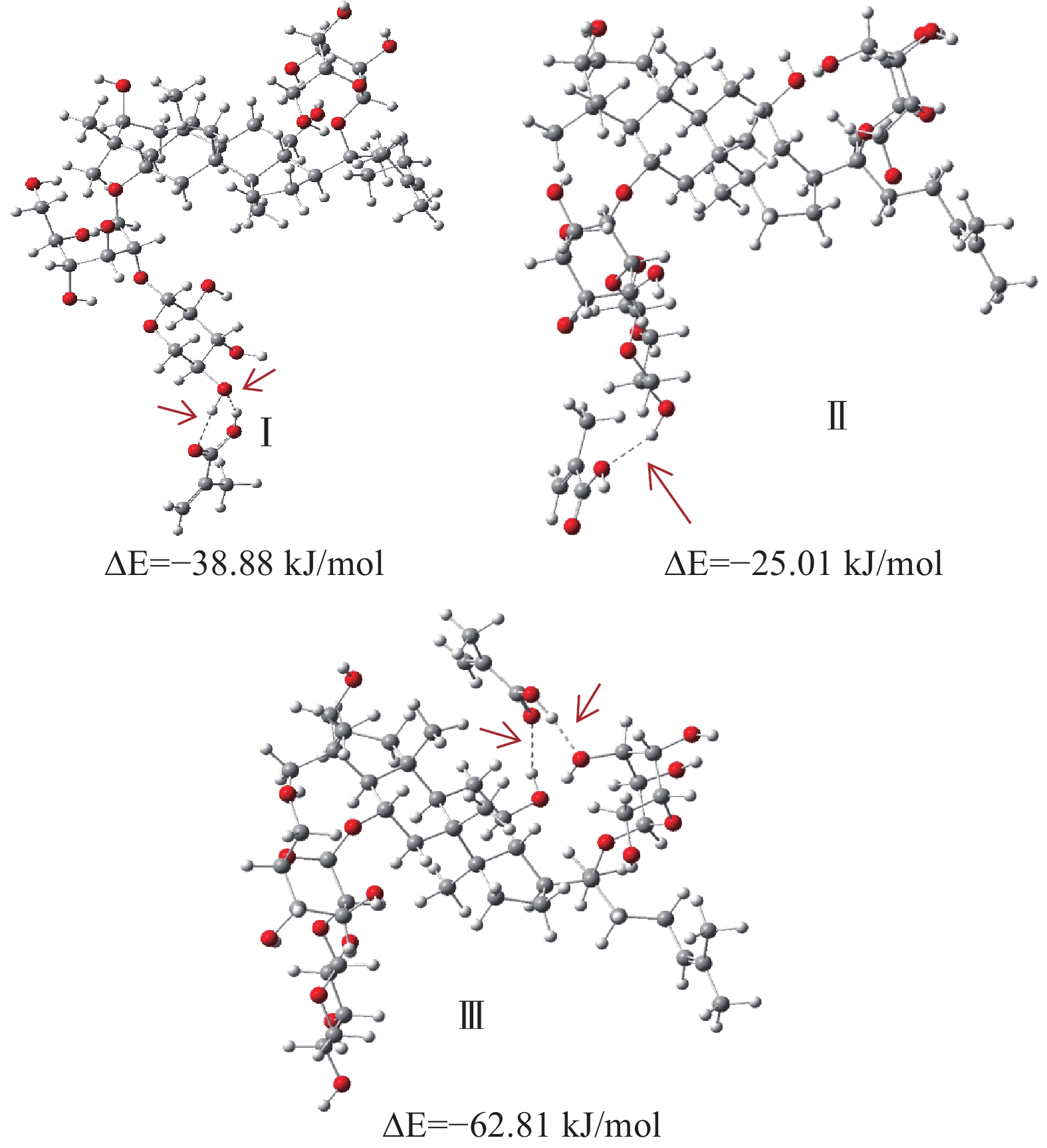
上述讨论的3种松香基大孔树脂的主要区别在于单体的功能基不同,分别为羧基、羟基和酯基,因此利用高斯软件,以三七皂苷R1为例计算其与3种松香基树脂功能单体的氢键作用力,计算结果如图8所示,三七皂苷R1分子中141号H原子表现出能量最正(电荷值0.450),55号的O原子表现出能量最负(电荷值−0.734)。由于分子之间的作用力只能发生在分子能量最正或能量最负的部位[36],141号的氢原子和55号氧原子可以分别作为氢键供体和受体与三七皂苷R1上的羟基氢和羟基氧形成氢键。对R-COOH吸附三七皂苷R1进行结构优化并计算氢键作用能,结果如图9所示:R-COOH分子中的功能单体MAA与三七皂苷R1作用模式有三种,模式I、II、III的结合能分别为−38.88、−25.01、−62.81 kJ/mol。热力学理论表明,结合能是负值,且结合能的绝对值越大,相互吸引的作用力越强[37-38],显然模型III对R-COOH吸附三七皂苷R1起决定作用。同样计算出R-COOCH3、R-COOCH2CH2OH功能单体MMA与HEMA对三七皂苷R1的氢键作用能为−25.60 kJ/mol、−35.82 kJ/mol,3种大孔吸附树脂对三七皂苷R1的作用力大小依次是R-COOH>R-COOCH2CH2OH>R-COOCH3,作用力大小与3种树脂对三七总皂苷的吸附量大小(表1)具有正向相关性,因此验证了氢键是松香基大孔吸附树脂对三七总皂苷吸附的主要作用力。
2.5 R-COOH细胞毒性结果
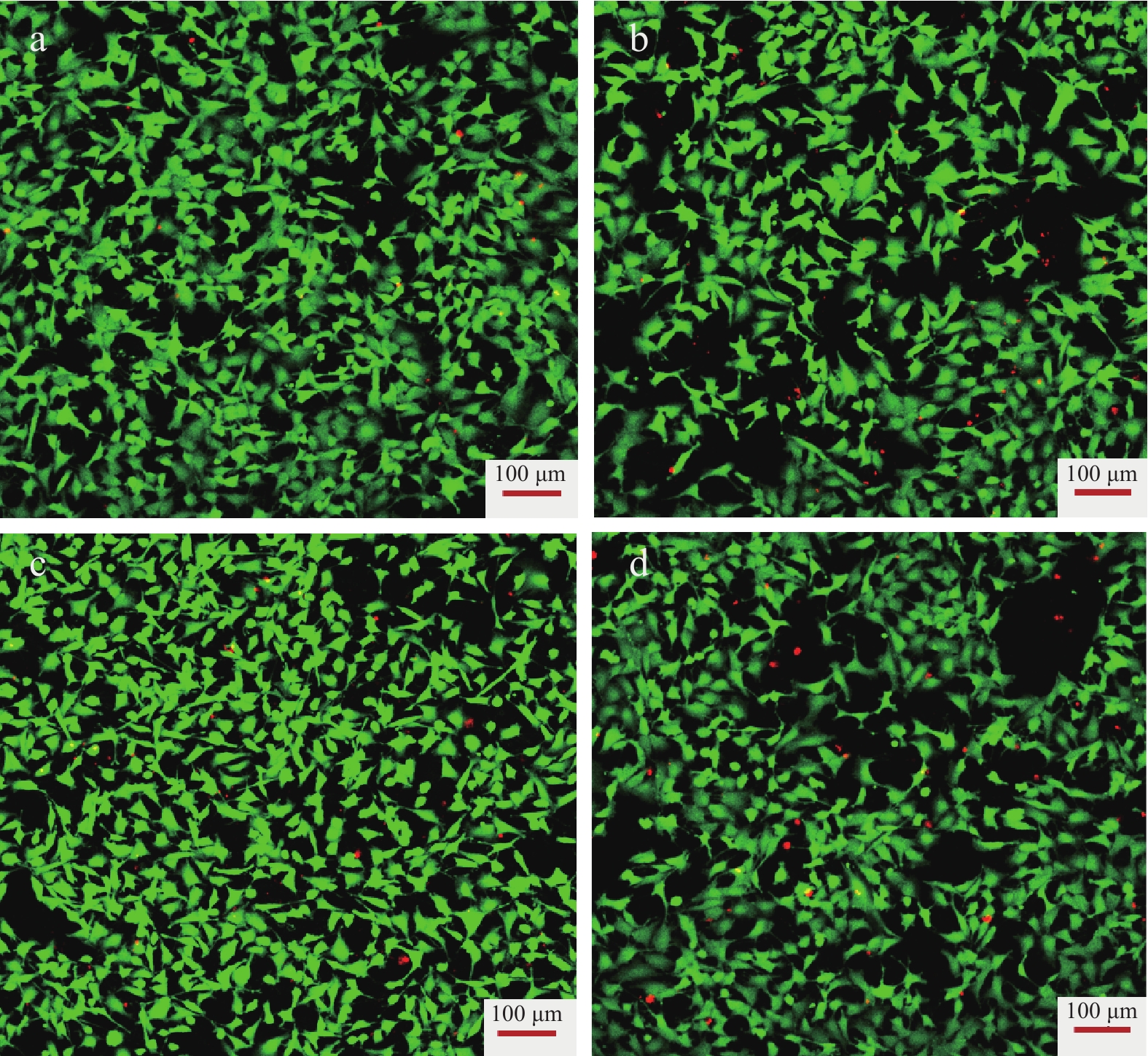
苯乙烯基大孔树脂D-101是一种公认的绿色吸附剂,文献中也大都使用此树脂来分离纯化三七总皂苷。但D-101的原料苯乙烯属于石油产品,而石油为不可再生资源,这限制了D-101的发展。作为一种可再生资源型吸附剂,R-COOH应具有与D-101相似的食品安全性,为此对两种树脂进行了细胞毒性对比试验:将GES-1细胞与R-COOH和D-101浸提液共同培养,细胞毒性试验结果如图10所示,红点表示死亡细胞,绿点表示存活细胞。图10a和图10b显示,10 μg/mLR-COOH提取物培养的细胞活力明显好于D-101提取物培养的细胞,经计算,R-COOH和D-101的细胞存活率分别为97.51%和93.76%,两种提取物均无毒;图10c和图10d显示当提取物浓度增加到200 μg/mL时,R-COOH细胞存活率保持在96.59%,仍高于D-101的细胞存活率91.72%。因此,松香基大孔吸附树脂R-COOH在分离纯化天然产物活性成分方面是一种比D-101更安全的绿色无毒吸附剂。
3. 结论
松香基大孔吸附树脂R-COOH对三七总皂苷的吸附效果最佳,吸附过程符合准二级动力学和Langumir等温吸附模型,热力学参数表明此吸附过程为熵驱动的,自发吸热反应。通过量子化学,从微观上初步明确了R-COOH吸附三七总皂苷的作用机制,验证了氢键对R-COOH吸附三七总皂苷具有决定作用,对研究吸附剂和吸附质之间的相互作用具有一定的理论指导意义。乙醇溶液浓度为70%时,解吸率可达80.10%;而乙醇浓度为40%时,解吸液中三七总皂苷的纯度最高,其中R-COOH可将三七粗提液中的三七总皂苷的纯度由35.37%提高到74.56%。将树脂循环吸附使用10次,树脂的吸附量几乎没有发生改变,且R-COOH树脂绿色环保安全,适用于天然产物活性成分的分离。
-
表 1 松香基树脂对三七总皂苷的吸附解吸性能比较(
ˉx ±s, n=3)Table 1 Comparison of adsorption and desorption properties of rosin-based resin for Panax notoginseng saponins (
ˉx ±s, n=3)树脂种类 比表面积(m2∙g−1) 平均孔径(nm) 吸附量(mg/g) 吸附率(%) 解吸率(%) R-COOH 36.55±1.23a 24.86±1.33a 37.61±1.24c 86.56±2.31c 80.10±1.42b R-COOCH3 34.82±0.78a 23.88±1.42a 14.48±1.67a 40.52±1.67a 63.32±2.64a R-COOCH2CH2OH 36.80±1.42a 25.95±1.56a 25.82±2.12b 52.52±2.29b 76.45±2.20b 注:平均值±标准差,同列不同小写字母表示存在显著性差异(P<0.05)。 表 2 准一级动力学和准二级动力学模型的拟合参数
Table 2 Fitting parameters of quasi-first-order and quasi-second-order kinetic models
指标成分 模型 方程 R2 qe k 三七皂苷R1 准一级动力学 y=−0.0027x+0.4358 0.9213 1.55 k1=0.0027 准二级动力学 y=0.3614x+35.6846 0.9981 2.77 k2=0.0036 人参皂苷Rg1 准一级动力学 y=−0.0040x+2.5154 0.9071 12.37 k1=0.0040 准二级动力学 y=0.0686x+6.5920 0.9983 14.71 k2=0.0007 人参皂苷Re 准一级动力学 y=−0.0031x+0.3194 0.9152 1.38 k1=0.0031 准二级动力学 y=0.5334x+66.5634 0.9957 1.87 k2=0.0043 人参皂苷Rb1 准一级动力学 y=−0.0028x+2.5727 0.8829 13.10 k1=0.0028 准二级动力学 y=0.0726x+17.1251 0.9964 13.89 k2=0.0003 人参皂苷Rd 准一级动力学 y=−0.0033x+1.7920 0.8981 6.00 k1=0.0033 准二级动力学 y=0.1846x+38.4260 0.9921 5.56 k2=0.0009 表 3 Langmuir和Freundlich模型的拟合参数
Table 3 Fitting parameters of Langmuir and Freundlich models
T/K Langmuir Freundlich qm/(mg·g−1) KL R2 KF 1/n R2 298 34.1097 0.4432 0.9826 11.7802 0.4200 0.9368 308 39.2718 0.4975 0.9763 14.5684 0.3970 0.9326 318 46.5578 0.4161 0.9802 15.3407 0.4363 0.9527 表 4 吸附过程热力学参数
Table 4 Thermodynamic parameters of adsorption process
T/K ΔH(kJ·mol−1) ΔS(J·mol−1·K−1) ΔG(kJ·mol−1) 298K 30.73 159.46 −16.79 308K −18.39 318K −19.98 328K −21.58 -
[1] XIA P G, GUO H B, RU M, et al. Accumulation of saponins in Panax notoginseng during its growing seasons[J]. Industrial Crops & Products,2017,104:287−292.
[2] ZHUANG L W, DING Y, SAFIANMURAD M, et al. Continuous chromatography with multi-zone and multi-column dynamic tandem techniques for the isolation and enrichment of class compounds from natural products of Panax notoginseng[J]. Journal of Chromatography A,2020,1629:461499. doi: 10.1016/j.chroma.2020.461499
[3] PENG M, YI Y X, ZHANG T, et al. Stereoisomers of saponins in Panax notoginseng (sanqi): A review[J]. Frontiers in Pharmacology,2018,9:188. doi: 10.3389/fphar.2018.00188
[4] LIU F, MA N, XIA F B, et al. Preparative separation of minor saponins from Panax notoginseng leaves using biotransformation, macroporous resins, and preparative high-performance liquid chromatography[J]. Journal of Ginseng Research,2019,43(1):105−115. doi: 10.1016/j.jgr.2017.09.003
[5] YANG F, MA Q, MATSABISA M G, et al. Panax notoginseng for cerebral Ischemia: A systematic review[J]. The American Journal of Chinese Medicine,2020,48(6):1331−1351. doi: 10.1142/S0192415X20500652
[6] ZHOU Y L, GAO X, FU Q, et al. Enrichment of total steroidal saponins from the extracts of Trillium tschonoskii maxim by macroporous resin and the simultaneous determination of eight steroidal saponins in the final product by HPLC[J]. Journal of Separation Science,2017,40(5):1115−1124. doi: 10.1002/jssc.201600884
[7] 陆敏, 马海乐, 朱莉萍, 等. D301-G大孔树脂吸附菊芋多糖色素机理探究[J]. 食品工业科技,2019,40(16):58−63,70. [LU M, MA H L, ZHU L P, et al. Adsorption mechanism research on Jerusalem artichoke polysaccharide pigment with D301-G macroporous resin[J]. Science and Technology of Food Industry,2019,40(16):58−63,70. [8] LI Y N, YIN L H, XU L N, et al. A simple and efficient protocol for large-scale preparation of three flavonoids from the flower of Daphne genkwa by combination of macroporous resin and counter-current chromatography[J]. Journal of Separation Science,2010,33(14):2168−2175. doi: 10.1002/jssc.201000054
[9] WU X Y, TANG Y, SUN Y X, et al. Extraction of flavonoids and kinetics of purification by macroporous resins from quinoa[J]. Journal of Nanoparticle Research,2020,22(7):181. doi: 10.1007/s11051-020-04906-7
[10] TANG D, ZHU J X, NIE H, et al. Simple and efficient approach for enrichment of major isoflavonoids from Astragalus membranaceus with macroporous resins and their nephroprotective activities[J]. Industrial Crops & Products,2018,125:276−283.
[11] GUO C X, QIAO J P, ZHANG S W, et al. Purification of polyphenols from kiwi fruit peel extracts using macroporous resins and high-performance liquid chromatography analysis[J]. International Journal of Food Science & Technology,2018,53(6):1486−1493.
[12] 刘冲英, 周宁, 崔涛, 等. 响应面法优化大孔树脂纯化地黄多糖工艺[J]. 食品工业科技,2021,42(6):202−207,232. [LIU C Y, ZHOU N, CUI T, et al. Optimization of purification process of polysaccharides from Rehmannia glutinosa libosch. with macroporous adsorption resins by response surface methodology[J]. Science and Technology of Food Industry,2021,42(6):202−207,232. [13] LI W, E Y Y, CHENG L Y, et al. Rosin-based polymer@silica core–shell adsorbent: Preparation, characterization, and application to melanoidin adsorption[J]. LWT-Food Science and Technology,2020,132(2):109937.
[14] WANG T, LI P F, SUN Y, et al. Camptothecin-imprinted polymer microspheres with rosin-based cross-linker for separation of camptothecin from Camptotheca acuminata fruit[J]. Separation and Purification Technology,2020,234:116085. doi: 10.1016/j.seppur.2019.116085
[15] LI P F, WANG T, LEI F H, et al. Preparation and evaluation of paclitaxel-imprinted polymers with a rosin-based crosslinker as the stationary phase in high-performance liquid chromatography[J]. Journal of Chromatography A,2017,1502:30−37. doi: 10.1016/j.chroma.2017.04.048
[16] 雷福厚, 卢建芳, 李鹏飞. 一种松香基功能高分子及其制备方法: 中国, CN101319036A[P]. 2008-06-18. LEI F H, LU J F, LI P F. Rosin-based functional polymer and preparation method thereof: China, CN101319036A[P]. 2008-06-18.
[17] LI P F, QIN L T, WANG T, et al. Preparation and adsorption characteristics of rosin-based polymer microspheres for berberine hydrochloride and separation of total alkaloids from coptidis rhizoma[J]. Chemical Engineering Journal,2020,392:12370.
[18] 覃丽婷, 张冬民, 李浩, 等. 含糖基大孔吸附树脂的合成及对银杏黄酮的吸附性能研究[J]. 化学研究与应用,2020,32(7):138−146. [QIN L T, ZHANG D M, LI H, et al. Synthesis of glycosyl macroporous adsorption resin and adsorption properties of Ginkgo biloba[J]. Chemical Research and Application,2020,32(7):138−146. [19] 雷福厚, 李鹏飞, 卢建芳. 一种含松香基的三元共聚物及其制备方法: 中国, CN101768240A[P]. 2010-07-07. LEI F H, LI P F, LU J F. Ternary copolymer containing rosin group and preparation method thereof: China, CN101768240A[P]. 2010-07-07.
[20] 欧来良, 史作清, 施荣富, 等. 强极性大孔吸附树脂对三七皂苷的分离纯化研究[J]. 中草药,2003,34(10):44−46. [OU L L, SHI Z Q, SHI R F, et al. Studies on separation and purification of saponins from Panax notoginseng with strongly polar macroporous adsorption resin[J]. Chinese Traditional and Herbal Drugs,2003,34(10):44−46. [21] 赵凤平, 张琳, 蒋瑶, 等. 大孔树脂与氧化铝联用分离纯化三七总皂苷的工艺研究[J]. 应用化工,2017,46(4):706−710,714. [ZHAO F P, ZHANG L, JIANG Y, et al. Optimization of purification technology of total saponins from Panax notoginseng with macroporous resin and aluminum oxide column[J]. Applied Chemical Industry,2017,46(4):706−710,714. [22] 刘宛玲, 肖建辉, 黄占旺, 等. 大孔树脂分离纯化麦胚黄酮研究[J]. 食品工业科技,2017,38(2):293−296. [LIU W L, XIAO J H, HUANG Z W, et al. Purification of flavonoids from wheat germ by macroporous resin[J]. Science and Technology of Food Industry,2017,38(2):293−296. doi: 10.1590/1678-457x.34416 [23] EMAMIAN S, LU T, KRUSE H, et al. Exploring nature and predicting strength of hydrogen bonds: A correlation analysis between atoms-in-molecules descriptors, binding energies, and energy components of symmetry-adapted perturbation theory[J]. Journal of Computational Chemistry,2019,40(32):2868−2881. doi: 10.1002/jcc.26068
[24] 刘家祺. 分离过程与模拟[M]. 北京: 清华大学出版社, 2007: 163-175. LIU J Q. Separation processes and simulation[M]. Beijing: Tsinghua University Press, 2007: 163-175.
[25] 欧阳玉祝, 张辞海, 魏燕. 大孔树脂对倍花单宁酸的吸附特性及其动力学模型[J]. 食品科学,2013(11):122−125. [OUYANG Y Z, ZHANG C H, WEI Y. A kinetic model for adsorption characteristics of tannic acid from chinese gall “Beihua” on macroporous resin[J]. Food Science,2013(11):122−125. doi: 10.7506/spkx1002-6630-201311027 [26] LIU B Y, DONG B T, YUAN X F, et al. Enrichment and separation of chlorogenic acid from the extract of Eupatorium adenophorum spreng by macroporous resin[J]. Journal of Chromatography B,2016,1008:58−64. doi: 10.1016/j.jchromb.2015.10.026
[27] CAO X Y, PANG H L, YANG G P, et al. Sorption behaviour of norfloxacin on marine sediments[J]. Journal of Soils and Sediments,2015,15:1635−1643. doi: 10.1007/s11368-015-1124-4
[28] 李家政, 欧来良, 史作清, 等. 水介质中氢键吸附与疏水吸附协同作用的研究[J]. 离子交换与吸附,2005,21(2):97−102. [LI J Z, OU L L, SHI Z Q, et al. Study on the synergistic effect of hydrogen bond adsorption and hydrophobic adsorption in aqueous medium[J]. Ion Exchange and Adsorption,2005,21(2):97−102. doi: 10.3321/j.issn:1001-5493.2005.02.001 [29] 刘红梅, 张元, 韩永萍, 等. S-8大孔树脂对灰树花子实体多糖酶解液色素吸附的影响[J]. 中成药,2014,36(10):2064−2070. [LIU H M, ZHANG Y, HAN Y P, et al. Adsorption improvement of enzyme extract pigments from Grifola frondosa fruiting body by S-8 macroporous resin[J]. Chinese Traditional Patent Medicine,2014,36(10):2064−2070. doi: 10.3969/j.issn.1001-1528.2014.10.012 [30] 刘淑萍, 王蕾. AB-8型大孔吸附树脂对栗蓬总黄酮的分离纯化及吸附热力学研究[J]. 中国食品添加剂,2017(1):115−120. [LIU S P, WANG L. Separation and purification of total flavonoids from chestnut by AB-8 macroporous adsorption resin and research on adsorption thermodynamics[J]. China Food Additives,2017(1):115−120. doi: 10.3969/j.issn.1006-2513.2017.01.011 [31] WU Y F, ZHANG L, MAO J W, et al. Kinetic and thermodynamic studies of sulforaphane adsorption on macroporous resin[J]. Journal of Chromatography B,2016,1028:231−236. doi: 10.1016/j.jchromb.2016.06.035
[32] 徐祖伟, 于朝生, 窦烁. AB-8大孔树脂对柴胡总黄酮的吸附行为研究[J]. 化学工程,2013,41(2):33−37. [XU Z W, YU C S, DOU S. Adsorption behavior of AB-8 macroporous resin for total flavonoids in Bupleurum[J]. Chemical Engineering(China),2013,41(2):33−37. doi: 10.3969/j.issn.1005-9954.2013.02.008 [33] 姜桂明, 高保娇, 许文梅, 等. 亚胺二乙酸型复合材料对重金属及稀土离子的吸附行为与吸附动力学[J]. 物理化学学报,2011,27(6):1474−1481. [JIANG G M, GAO B J, XU W M, et al. Adsorption behavior and kinetics of iminodiacetic acid composites for heavy metals and rare earth ions[J]. Acta Physico-Chimica Sinica,2011,27(6):1474−1481. doi: 10.3866/PKU.WHXB20110529 [34] 周婧琦, 罗双群, 王晶晶, 等. 秋葵黄酮的纯化和体外抗氧化活性研究[J]. 食品研究与开发,2018,39(15):61−66. [ZHOU J Q, LUO S Q, WANG J J, et al. Purification and antioxidant activity in vitro of flavonoids from okra[J]. Food Research and Development,2018,39(15):61−66. doi: 10.3969/j.issn.1005-6521.2018.15.012 [35] 栾朝霞. 肉苁蓉总多酚纯化工艺及其抗运动性疲劳作用研究[J]. 食品工业科技,2020,41(15):59−64. [LUAN Z X. Purification and anti-motor fatigue effect of total polyphenols from Cistanche extraction[J]. Science and Technology of Food Industry,2020,41(15):59−64. [36] 董佳伟, 刘雪虎, 黎璋焰, 等. 聚马来酸酐树脂的制备及其对水中环丙沙星的吸附行为和机制[J]. 环境科学学报,2021,41(2):548−556. [DONG J W, LIU X H, LI Z Y, et al. Synthesis of a polymaleic anhydride based resin and its adsorption characteristics and mechanisms for removal of ciprofloxacin from aqueous solutions[J]. Acta Scientiae Circumstantiae,2021,41(2):548−556. [37] WANG L C, CAO Y H. Adsorption behavior of phenanthrene on CTAB-modified polystyrene microspheres[J]. Colloids and Surfaces A,2018,553:689−694. doi: 10.1016/j.colsurfa.2018.05.088
[38] 王珏, 黄琦夫, 刘绍刚, 等. 胺化松香基大孔树脂吸附水中抗生素性能研究[J]. 水处理技术,2019,45(10):40−45,51. [WANG Y, HUANG Q F, LIU S G, et al. Study on the adsorption of antibiotics in water by aminated rosin-based macroporous resin[J]. Technology of Water Treatment,2019,45(10):40−45,51. -
期刊类型引用(6)
1. 冯博,邵毅,黄柳娟,禹建虎,龚新武,白冰. 不同处理方式对‘大泡’青皮核桃采后保鲜效果的影响. 上海农业学报. 2024(01): 103-108 .  百度学术
百度学术
2. 王盼盼,管维良,孙志栋,蔡路昀. 芥末精油复合1-甲基环丙烯保鲜处理对绿花菜贮藏期间品质的影响. 食品工业科技. 2024(11): 270-279 .  本站查看
本站查看
3. 李金金,李春媛,罗铮,张鹏,张爱琳,吴迪,李江阔. 高值果蔬采后保鲜技术研究进展. 保鲜与加工. 2024(06): 109-119 .  百度学术
百度学术
4. 张玉萍,莫丽媛,丁惠敏,史君彦,王文亮,王延圣,乔丽萍. 双乙酰处理对鲜切西兰花贮藏品质及抗氧化能力的影响. 食品与发酵工业. 2024(24): 114-122 .  百度学术
百度学术
5. 钱井,郑鄢燕,李蔚,满杰,郑丽静,韦强,赵立群. 1-甲基环丙烯结合寡雄腐霉菌对番茄贮藏品质的影响. 食品科技. 2023(09): 23-29 .  百度学术
百度学术
6. 刘培秀,赵美萱,杨梅,雷晓英,刘文强,杨敏,李玉鹏. 西兰花粉营养成分及理化性质研究. 食品工业科技. 2022(11): 326-333 .  本站查看
本站查看
其他类型引用(7)





 下载:
下载:













 下载:
下载:



