Effects of Xanthan Gum on Rheological Properties and Microstructure of Soy Protein Isolate Gel
-
摘要: 以黄原胶(XG)和大豆分离蛋白(SPI)为试验原料,通过超声波预处理和葡萄糖酸内酯诱导的方式制备XG-SPI复合凝胶,采用流变测试和扫描电镜等方式研究不同浓度XG对SPI凝胶粘弹性能、自修复能力、热稳定性以及微观结构的影响。结果表明,SPI凝胶是典型的粘弹材料,具有较强的频率依赖性。随着XG浓度(1%~5%)的增加,复合凝胶的弹性模量和粘性模量随之增加,损耗因子随之减小,凝胶强度不断增强。XG的添加影响了SPI凝胶的自修复能力,虽延长了修复时间,但可以提高恢复率。SPI单一凝胶经加热(25~100 ℃)后结构破坏严重,发生了凝胶-溶胶状态的转变,而XG-SPI复合凝胶热稳定性明显提高。SPI单一凝胶和XG-SPI复合凝胶在电镜下未观察到微观结构上的显著变化。本研究结果可为开发具有改良质地的新型大豆分离蛋白凝胶产品提供重要信息。Abstract: Xanthan gum (XG) and soybean protein isolate (SPI) were used as raw materials to prepare XG-SPI mixed gel by ultrasonic pretreatment and glucolactone induction. Rheological tests and scanning electron microscopy were used to study the effects of different concentrations of XG on viscoelasticity, self-healing ability, thermal stability and microstructure of SPI gel. Results showed that SPI gel was a typical viscoelastic material with strong frequency dependence. With the increasing of XG concentration (1%~5%), the elastic modulus and viscous modulus of the mixed gel increased, and the loss tangent decreased, and the gel strength increased. The addition of XG affected the self-healing ability of SPI gel, although the healing time was prolonged, the recovery rate increased. The SPI single gel which was heated (25~100 ℃) occurred a transition of gel-sol state and it structure was extremely damaged. Comparatively, the thermal stability of XG-SPI mix gel increased significantly. The microstructural changes of SPI single gel and XG-SPI mixed gel were not observed under electron microscope. The results of this study could provide important information for developing new soy protein isolate gels with improved quality.
-
大豆分离蛋白(Soy protein isolate, SPI)是从脱脂豆渣中分离出来的主要副产物,具有良好的加工性能、优异的营养价值和较低的生产成本,在食品行业内得到广泛应用[1-2]。SPI的凝胶性是其最重要的功能特性之一,蛋白质分子通过疏水相互作用、静电作用、氢键以及二硫键等作用力聚集并形成网络结构,可以作为多种食物成分的载体如水、脂肪、糖以及风味成分等,对于提高食品品质和改善食品质构具有重要的作用,因此无论是作为天然食品原料还是辅料,SPI都可用于食品加工中[3]。
SPI的凝胶特性不仅和蛋白质组成和结构有关,还受其他因素的影响,如蛋白质浓度、变性程度、离子强度、加热条件和pH等[4]。虽然有很多方法可以改善SPI凝胶的性能,但提高SPI凝胶的自修复性能和获得优异的力学性能仍然是目前研究难点问题[3]。为了进一步改善SPI的凝胶特性,将其制备成多糖-蛋白质复合体系是一种有效的措施。与单一蛋白质凝胶体系相比,蛋白质-多糖的相互作用对多组分体系的界面性质有重要作用,并能影响食品的结构、质地、功能和稳定性,这种复合方式通常能更有效地调节凝胶质地[5-7]。目前,SPI已经成为植物蛋白和多糖构建复合凝胶的典范。Zhao等[8]研究表明,在大豆蛋白中加入棉子糖和大豆多糖,可显著提高凝胶硬度和保水能力。Zhao等[9]发现魔芋胶、结冷胶和可得兰胶可以提高SPI凝胶的硬度和保水性,增强了凝胶强度,有利于凝胶形成,并改善微观结构。Perrechil等[10]研究表明,刺槐豆胶的加入导致SPI凝胶的强度和持水能力的增加,而不依赖于蛋白质的状态(天然或变性)。Monteiro等[11]研究了半乳甘露聚糖对大豆蛋白热诱导凝胶特性的影响,结果表明,随着多糖链的长度增加,凝胶速率增加,凝胶起始温度降低,凝胶硬度和弹性增加。
黄原胶(Xanthan gum,XG)是由黄单胞菌产生的一种胞外分支多糖。它的主链由β-1,4糖苷键连接的D-葡萄糖构成,每两个葡萄糖单位连接一个三糖分支(甘露糖-葡萄糖-甘露糖),属于阴离子多糖[12]。黄原胶由于其刚性结构,在酸性和碱性条件下都能保持稳定,并具有独特的功能特性,常用于乳化剂、稳定剂和发泡剂应用于食品、药品等领域,但其本身不具有胶凝特性,属于非凝胶型多糖,不能单独做凝胶剂使用[13]。对于SPI和非凝胶性多糖的混合物,添加非胶凝性多糖通常用于促进SPI凝胶化或调节SPI凝胶结构,主要形成半互穿网络凝胶[1]。然而,关于XG对SPI凝胶特性的影响的报道相对较少。因此本实验以XG和SPI复合体系为基础,研究添加XG对SPI复合凝胶体系流变性能和微观结构的影响,旨在获得具有更加优质性能的SPI复合凝胶,以拓宽SPI的应用领域。
1. 材料与方法
1.1 材料与仪器
SPI 高唐蓝山基团有限公司;葡萄糖酸内酯 国产分析纯。
DHR-1型旋转流变仪 美国TA;JY92-Ⅱ超声波细胞粉碎机 宁波新艺超声设备有限公司;ZNCL-BS 140 mm智能磁力搅拌器 上海弘懿仪器设备有限公司;SB-2000水浴锅 日本EYELA;EVO-LS10扫描电镜 德国ZEISSE Oberkochen。
1.2 实验方法
1.2.1 超声波处理XG-SPI分散液
超声波处理参考刘冉等[3]的方法。准确称取5 g SPI置于烧杯中,加入超纯水配制成10%(m/V)SPI分散液50 mL,在室温下磁力搅拌2 h至充分溶解,并放置于4 ℃冰箱中备用。用直径为0.636 cm的超声波探头深入大豆蛋白溶液表面1~2 cm来处理SPI分散液,超声功率为400 W,超声时间10 min。在SPI分散液中加入XG,超声处理5 min,使其混合均匀,获得复合分散液。SPI的最终浓度为10%,XG的最终浓度为0.1%、0.3%和0.5%,未加XG作为对照组。
1.2.2 XG-SPI凝胶制备
参考曹连鹏等[14]方法并略有改动。将复合分散液在80 ℃水浴锅中加热20 min,加入葡萄糖酸内酯充分搅拌,葡萄糖酸内酯最终浓度为0.1%,样品冷却至室温后,放入4 ℃冰箱中,静置过夜,即获得复合凝胶。
1.2.3 流变特性试验
1.2.3.1 样品准备
参考Brito-Oliveira等[15]方法并略有改动,进行流变特性试验,选择直径40 mm平板夹具,将样品放置在流变仪的平板上,平板间距设置为1.0 mm。用刮刀去除外板上多余的样品,表面涂硅油,防止水分蒸发。样品在测试前平衡5 min,以卸载试样添加过程中的残余应力,并保持恒温。流变测试项目包括应变扫描,频率扫描,温度扫描和时间扫描所有样品测试3次。
1.2.3.2 应变扫描试验
应变扫描是振荡试验中的第一个测试,可以确定样品线性黏弹区,程序参数:应变范围为1%~1000%,频率1 Hz,温度25 ℃[15]。
1.2.3.3 频率扫描试验
频率扫描参数:应变2%(处于线性黏弹区域内),温度25 ℃,频率0.1~10 Hz[15]。测定G′、G′′和tanδ随频率的变化。G′和G′′角频率变化的趋势可以采用Power-law流变模型来进行拟合[9]。
幂律方程:G′=K′⋅ωn′ (1) G″=K″⋅ωn″ (2) 式中:K′和K′′—幂律常数;n′ 和n′′—频率指数,可以表示模量对频率的依赖程度;ω—角频率。
1.2.3.4 时间扫描试验
先将凝胶样品按照1.2.3.1进行应变扫描,随后马上进行时间扫描,从流变指标G′和G′′的变化情况分析凝胶样品的自修复能力。时间扫描参数:应变2%,频率1 Hz,温度25 ℃,时间600 s。
1.2.3.5 应变阶跃试验
参考刘瑞雪等[16]方法并略有改动。应变阶跃扫描参数:频率1 Hz,温度25 ℃。测定程序为:a.对凝胶施加2%应变,时间为45 s;b.对凝胶施加500%应变,时间为30 s;c.重复前两步试验,测定G′、G′′的变化。
恢复率(%)=G′/G′0×100 (3) 式中:G′为第二次(或第三次)小应变的G′;G′0为第一次小应变初始G′。恢复率可以反映凝胶自修复程度。
1.2.3.6 温度扫描试验
温度扫描参数:应变2%,频率1 Hz,温度以3 ℃/min的升温速率从25 ℃升高到100 ℃。测定G′和G′′随温度的变化。
1.2.4 宏观凝胶自修复能力测试
参考黄河等[17]方法并略有改动。将凝胶平均分为两部分,一部分使用罗丹明B染液浸没染色,之后使两部分断面充分相互接触。并使用聚乙烯薄膜将试样密封在培养皿中,以确保试样在试验过程中不丢失水分。一段时间后检测自修复效果。
1.2.5 复合凝胶微观结构的观察
参考江连洲等[18]方法并略有改动。将冻干后的凝胶(SPI凝胶和0.5% XG-SPI凝胶)切成大小均匀的正方块贴于导电胶上,喷金后,将带有样品的载物台放入扫描电镜的进样室,在真空条件下进行观察,电压为5 kV,放大倍数为100和200。
1.3 数据处理
所有试验均重复3次,结果表示为平均值±标准差(mean±SD)。利用minitab 17.0软件进行单因素(ANOVA)方差分析。
2. 结果与分析
2.1 黄原胶对大豆分离蛋白复合凝胶黏弹性的影响
商用SPI因蛋白质变性程度较大,降低了蛋白之间相互聚集的能力,从而导致凝胶性能变差[19]。对SPI进行超声波预处理,可以改变变性SPI的聚集程度,将包埋在蛋白分子内部的疏水基团和巯基暴露出来,随后再进行预加热和酸化,凝胶化就能顺利进行[20]。预加热可以使蛋白之间形成聚集体,但此时体系为中性环境,蛋白之间具有较大的静电斥力。随后通过葡萄糖酸内酯缓慢分解,逐渐降低了体系的pH,蛋白之间静电斥力逐渐减小,蛋白之间更大程度地进行聚集和交联,形成凝胶网络结构[21]。据报道,在凝胶pH4.8时,带负电荷的XG与蛋白质聚集物相互作用更强[22]。
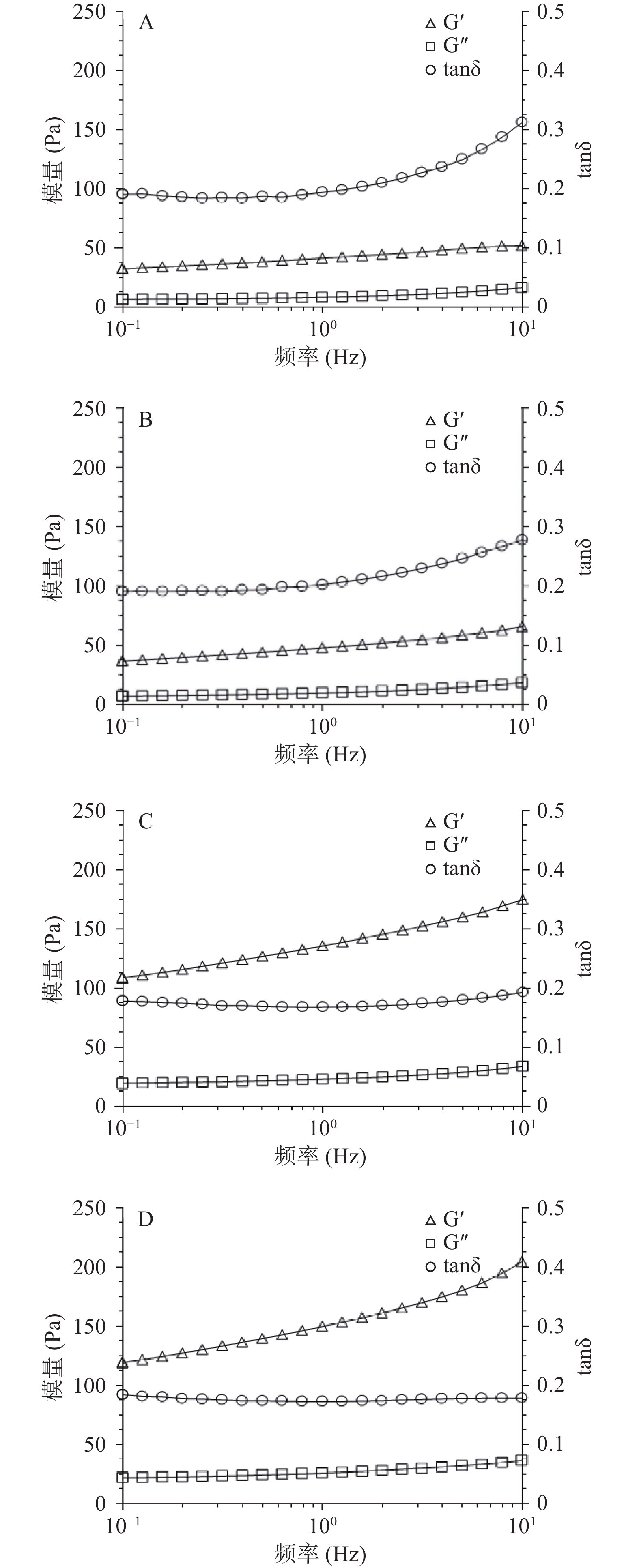
通过小应变振荡实验研究了不同浓度XG对凝胶流变特性的影响。频率扫描可以反映凝胶的黏弹性,图1为不同浓度XG-SPI复合凝胶频率扫描图。结果显示,无论是SPI凝胶还是XG-SPI凝胶样品在频率扫描过程中弹性模量(Storage modulus, Gʹ)均高于黏性模量(Loss modulus, Gʺ),表明样品的弹性性能强于粘性性能,损耗因子(tanδ=Gʹ/Gʺ)在0.3左右,表明具有良好的凝胶网络结构。XG-SPI复合凝胶的Gʹ和Gʺ值随XG浓度(0.1%~0.5%)的增大而增大,tanδ随XG浓度(0.1%~0.5%)的增大而减小。与SPI单一凝胶相比,XG-SPI复合凝胶具有更高的Gʹ和Gʺ,更低的tanδ,其粘弹性能得到明显提高。
从图1看出,SPI和XG-SPI凝胶的Gʹ和Gʺ会随频率增大而增大,均表现出一定的频率依赖性,此类型的凝胶介于弱凝胶和强凝胶之间,属于物理型凝胶。频率扫描结果拟合幂率模型结果如表1所示,XG的加入显著改变了SPI凝胶的动态流变性能(P<0.05)。n'和n''表示Gʹ和Gʺ随频率变化的程度,可以反应材料的黏弹信息[23]。随着XG浓度的增大,凝胶的K′和K′′值增大以及n'和n''值减小,表明XG降低了凝胶对频率的依赖程度,XG-SPI复合凝胶逐渐从弱凝胶向强凝胶转变。Chang等[24]研究也发现在SPI中添加XG显著改变了XG-SPI的流变特性,XG-SPI混合凝胶的K′和K′′值远高于SPI单一凝胶。由此可以看出XG的添加有利于SPI凝胶形成更加强壮的网络结构。
表 1 XG-SPI凝胶的幂率模型参数Table 1. Parameters of power law model of XG-SPI gelsXG浓度
(%)G′=K′·ωn′ G′′=K′′·ωn′′ K′(Pa·sn) n′ R2 K′′(Pa·sn) n′′ R2 0 34.4547±0.4967D 0.1170±0.0050A 0.9917 5.9173±0.0137D 0.2037±0.0050A 0.9349 0.1 51.9047±1.4931C 0.1076±0.0063AB 0.9917 8.4316±1.0082C 0.1839±0.0135A 0.9569 0.3 117.0867±9.3731B 0.1044±0.0032B 0.9991 19.9110±1.4884B 0.1264±0.0044B 0.9747 0.5 136.2933±14.8381A 0.1028±0.0022B 0.9994 24.6647±2.7950A 0.0975±0.0103C 0.9596 注:同列不同大写字母表示不同浓度XG样品的显著性差异(P<0.05)。 2.2 自修复能力
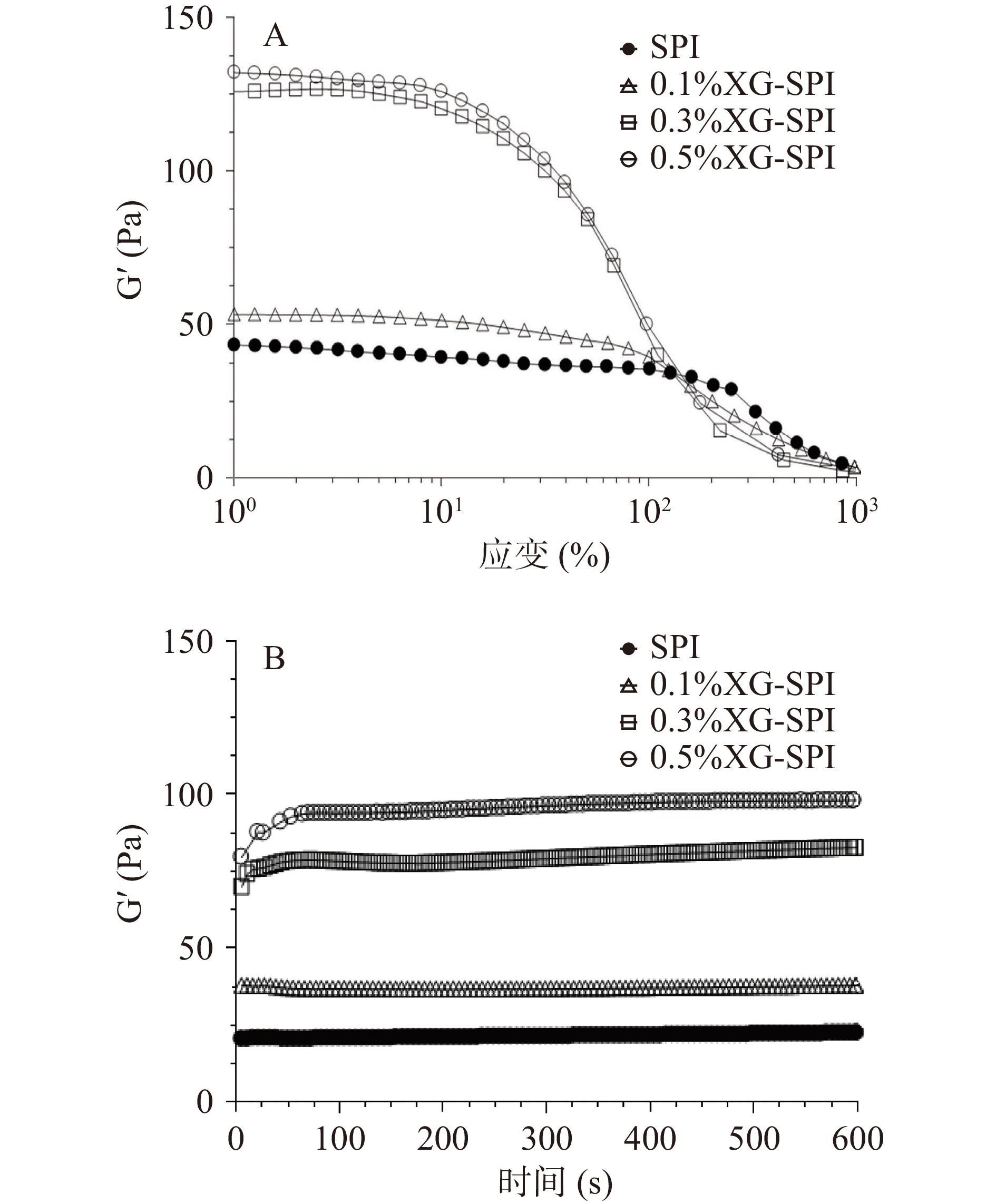
目前评价自修复凝胶主要采用宏观评测和流变学评价两种方法[25-26]。宏观评测是人为地给凝胶制造损伤后观察其愈合状况,该方法可以直观评价凝胶自修复过程,但是难以定量表征自修复程度。流变学评价可以弥补宏观评测的缺点,是采用流变仪给凝胶施加一定的形变,造成其损伤后分析Gʹ和Gʺ的变化,定量表征凝胶内部结构的自修复程度[25]。首先,先通过宏观观测评价SPI凝胶修复性能,一部分SPI凝胶样品用罗丹明B进行染色,并将两部分不同颜色的凝胶切断(图2A),再将两块不同颜色凝胶断面贴合在一起颜色界限清晰(图2B),室温放置4 h后断面完全消失,颜色界限变模糊,两部分凝胶融合在一起(图2C),说明SPI凝胶具有自修复性能。
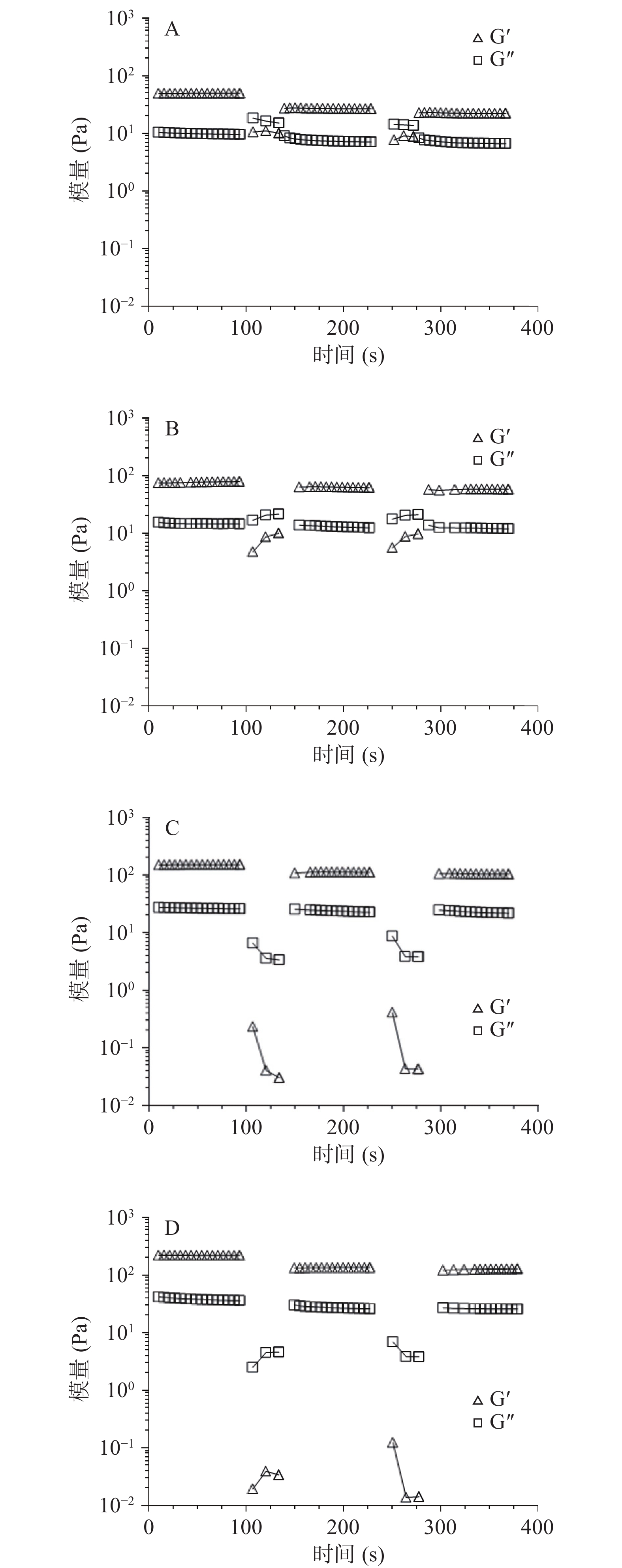
为了进一步验证SPI凝胶自修复能力,利用流变仪进行应变扫描和时间扫描测试(图3)。所有的凝胶样品在应变达到500%时,Gʹ小于Gʺ,凝胶结构完全被破坏,由凝胶(gel)转变为溶胶(sol)。在达到1000%应变后,立即在线性黏弹区(γ=2%)进行时间扫描,凝胶样品的模量迅速增大,恢复到凝胶状态,SPI凝胶Gʹ仅能恢复56%,随XG浓度的增大恢复率有所增加,0.5% XG-SPI凝胶Gʹ恢复率能达到77%。多糖-蛋白混合凝胶主要通过动态的非共价键(静电相互作用和氢键)实现自修复性能,凝胶自修复的时间跟凝胶样品的浓度、破损程度和内部结构有关[27-28]。由图4B也可以看出自修复时间的差别,SPI凝胶和0.1% XG-SPI凝胶由于凝胶黏弹结构相对较弱,流动性较强,因此在小应变时间扫描中模量在6 s内就恢复稳定。而0.3% XG-SPI和0.5% XG-SPI凝胶由于结构相对较强,流动性相对较差,自修复时间相对较长。0.3% XG-SPI需要大约50 s恢复稳定状态,0.5% XG-SPI则需要更长的时间大约100 s。
为进一步表征凝胶自修复性能的可重复性,对凝胶进行阶跃式应变扫描。由图4可知,在第一次小应变扫描下,由于凝胶为初始状态,Gʹ和Gʺ为初始值。在第一次大应变扫描下,SPI凝胶和0.1% XG-SPI凝胶Gʹ下降,Gʺ增加;0.3%和0.5% XG-SPI凝胶Gʹ和Gʺ均下降。同一凝胶Gʹ小于Gʺ,即大应变下样品处于溶胶状态。凝胶经历第二次小应变扫描时,Gʹ大于Gʺ,样品从溶胶重新转变成凝胶状态,与初始值相比,Gʺ几乎完全恢复,而Gʹ恢复率相对较小,依次为56%、63%、66%和76%。第二次大应变扫描情况跟第一次相同。第三次小应变扫描跟第二次具有相同的趋势,Gʹ恢复率依次为45%、56%、60%和73%。阶跃式应变扫描结果表明,SPI和XG-SPI凝胶可重复在大应变下结构破坏变成溶胶,在小应变下依靠可逆的非共价键作用,结构能重新建立,从溶胶转变成凝胶,其自修复行为可重复。同时可以看出,SPI凝胶遭受大应力损伤后,凝胶结构不能完全恢复,且随着大应变次数增加,即损伤次数的增加,恢复率会持续降低,而XG的加入有利于提高SPI凝胶的恢复率,且随着浓度的增加,恢复率也随之增加。XG的添加提高了SPI凝胶的粘弹性,使其网络结构更加稳固,因此力学性能增强,流动性能减弱,导致凝胶结构损伤后,自修复时间延长,这是XG给SPI自修复性能带来的不利因素,但与此同时XG可以帮助SPI凝胶结构重新建立,有利于提高恢复率。
2.3 热稳定性
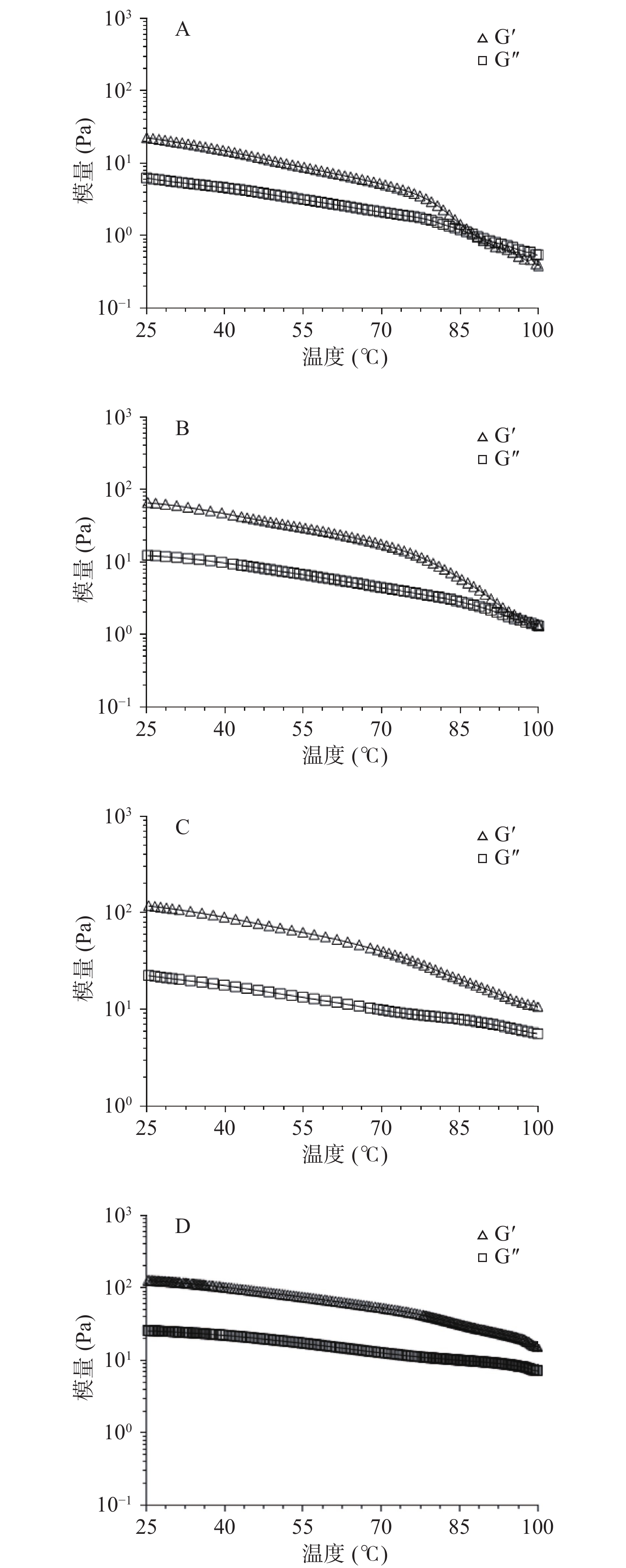
为了研究XG对SPI凝胶热稳定性的影响,利用流变仪对凝胶样品进行了升温扫描。蛋白凝胶结构与温度有关,当温度升高会造成分子运动速率的增加,蛋白肽链间的相互作用(如氢键和静电作用)会减弱,交联结构遭到破坏,表现为Gʹ和Gʺ下降,当温度持续升高或高温作用时间增长时可能会引起凝胶结构全面崩解,出现凝胶到溶胶(Gʹ=Gʺ)状态的转变,此时即达到凝胶转变温度(Tgel-sol)[19,29]。如图5所示,所有的凝胶样品随温度的升高Gʹ和Gʺ均表现出下降的趋势,在相对低的温度范围内(25~75 ℃)模量下降速率相对较慢;在相对高的温度范围内(75~100 ℃)模量下降速率相对较快。对于SPI凝胶经过加热后结构破坏比较严重,当温度升高到88 ℃时,达到Tgel-sol。0.1% XG-SPI复合凝胶在温度达到75 ℃后Gʹ下降速率也非常快,但Gʹ仍略高于Gʺ,未出现Tgel-sol,其结构未完全崩塌。0.3%和0.5% XG-SPI复合凝胶模量下降的速率明显低于前两者,Gʹ一直大于Gʺ,虽然高温对复合凝胶结构有一定的破坏,但其仍维持着相对稳定的网络结构。XG的分子量大且分枝多,多糖主链和侧链穿插在蛋白网络里面,起到稳定蛋白的网络结构的作用,从而缓解高温对蛋白网络的损坏。推测多糖的添加可以加强蛋白质之间的相互作用,从而提高蛋白凝胶网络结构的稳定性[8]。
2.4 扫描电镜
SPI和XG-SPI凝胶的扫描电镜图如图6所示。SPI和XG-SPI凝胶都具有疏松、多孔的海绵状网络结构。通过对比两种凝胶样品的微观结构未见明显的差别。许多报道都指出多糖会影响蛋白凝胶的微观结构。Zhao等[9]发现,0.3%和0.5%魔芋胶、结冷胶和卡德兰胶与SPI形成的复合凝胶均比单一的SPI凝胶具有更加均匀和致密的微观结构。Chang等[24]在对SPI凝胶进行研究时发现,XG、瓜儿豆胶(Guar gum, GG)的存在对SPI的微观结构影响较大,SPI单凝胶的微观结构更加均匀,而混合凝胶的微观结构则较为粗糙。Perrechil等[10]研究发现,SPI单一凝胶与刺槐豆胶-SPI凝胶的微观结构相似,但添加刺槐豆胶促进了蛋白质更强烈的聚集,并导致了更紧密的相互连接结构。多糖-蛋白质凝胶最终的微观结构是由于蛋白质聚集的凝胶化和两种生物聚合物之间的相分离之间的相互竞争与平衡的结果[24]。本研究添加XG没有影响SPI凝胶的微观结构,可能是由于XG-SPI凝胶在制备时经过超声波处理,而超声波处理会改善凝胶微观结构,从而减弱了XG对SPI凝胶结构的影响,也有可能XG对SPI凝胶结构的影响不是体现在亚微米水平而是体现在超微米水平或者更小水平[18]。
根据多糖性质的不同,基于SPI的混合凝胶类型可以分为互穿网络凝胶或半互穿网络凝胶[1]。对于SPI和凝胶类多糖如卡拉胶、果胶等,主要形成互穿网络凝胶;对于SPI和非胶凝多糖如半乳甘露聚糖、XG等,主要形成半互穿网络凝胶[11,30]。XG-SPI复合凝胶形成的过程分成两个阶段,首先通过超声波将SPI蛋白颗粒分散,此后将XG混合进入SPI分散液中,之后通过加热和酸化作用开始进行凝胶化过程,最终形成多糖-蛋白的二元凝胶网络结构。在这个过程中,添加XG通常起到促进SPI凝胶化或调节凝胶结构的作用。非凝胶多糖因不具有凝胶特性,其在蛋白基体系中可能通过体积排斥效应促进了蛋白质分子之间的吸引,并通过减少蛋白质分子与周围溶液接触的机会促进了蛋白质分子的排列[31]。因此,非凝胶多糖掺入导致的蛋白质相互作用和蛋白质聚集的改变可能是凝胶质构参数改善的原因。
3. 结论
XG作为功能性食品配料,具有潜在的促进健康的作用。本研究研究了XG的加入对酸诱导的SPI凝胶流变性能和微观结构的影响。结果表明,XG可以提高SPI的粘弹性,降低Gʹ和Gʺ对频率的依赖性。其次,在自修复性能测试中XG可以帮助SPI凝胶提高恢复率。此外,XG可以提高SPI凝胶的热稳定性,缓解高温对网络结构的破坏性。通过对凝胶进行电镜扫描未发现其微观结构上的差异。XG与SPI形成二元凝胶,可以弥补SPI单凝胶的缺点,有利于提高凝胶的稳定性和力学性能,还能为开发具有自修复性能的SPI凝胶提供思路。本研究结果为SPI凝胶的品质调控和应用拓展提供了理论依据。
-
表 1 XG-SPI凝胶的幂率模型参数
Table 1 Parameters of power law model of XG-SPI gels
XG浓度
(%)G′=K′·ωn′ G′′=K′′·ωn′′ K′(Pa·sn) n′ R2 K′′(Pa·sn) n′′ R2 0 34.4547±0.4967D 0.1170±0.0050A 0.9917 5.9173±0.0137D 0.2037±0.0050A 0.9349 0.1 51.9047±1.4931C 0.1076±0.0063AB 0.9917 8.4316±1.0082C 0.1839±0.0135A 0.9569 0.3 117.0867±9.3731B 0.1044±0.0032B 0.9991 19.9110±1.4884B 0.1264±0.0044B 0.9747 0.5 136.2933±14.8381A 0.1028±0.0022B 0.9994 24.6647±2.7950A 0.0975±0.0103C 0.9596 注:同列不同大写字母表示不同浓度XG样品的显著性差异(P<0.05)。 -
[1] XI Y A, AL A, DAN L A, et al. Applications of mixed polysaccharide-protein systems in fabricating multi-structures of binary food gels—A review[J]. Trends in Food Science & Technology,2021,109:197−210.
[2] LOPES-DA-SILVA J A, MONTEIRO S R. Gelling and emulsifying properties of soy protein hydrolysates in the presence of a neutral polysaccharide[J]. Food Chemistry, 2019, 294: 216−223.
[3] 刘冉, 曾庆华, 王振宇, 等. 超声波处理对大豆分离蛋白凝胶流变性和凝胶形成的影响[J]. 食品工业科技,2020,41(21):95−100,106. [LIU R, ZENG Q H, WANG Z Y, et al. Effects of ultrasonic treatment on gel rheological properties and gel formation of soybean protein isolate[J]. Science and Technology of Food Industry,2020,41(21):95−100,106. [4] INGRASSIA R, PALAZOLO G G, WAGNER J R, et al. Heat treatments of defatted soy flour: Impact on protein structure, aggregation, and cold-set gelation properties[J]. Food Structure,2019,22:100130. doi: 10.1016/j.foostr.2019.100130
[5] NICOLAI T. Gelation of food protein-protein mixtures[J]. Advances in Colloid and Interface Science,2019,270:147−164. doi: 10.1016/j.cis.2019.06.006
[6] YANG X, LI A, LI X, et al. An overview of classifications, properties of food polysaccharides and their links to applications in improving food textures[J]. Trends in Food Science & Technology,2020,102:1−15.
[7] LAKEMOND C, JONGH H, PAQUES M, et al. Gelation of soy glycinin; influence of pH and ionic strength on network structure in relation to protein conformation[J]. Food Hydrocolloids,2003,17(3):365−377. doi: 10.1016/S0268-005X(02)00100-5
[8] ZHAO H, WANG Y, LI W, et al. Effects of oligosaccharides and soy soluble polysaccharide on the rheological and textural properties of calcium sulfate-induced soy protein gels[J]. Food and Bioprocess Technology,2017,10(3):556−567. doi: 10.1007/s11947-016-1826-7
[9] ZHAO H, CHEN J, HEMAR Y, et al. Improvement of the rheological and textural properties of calcium sulfate- induced soy protein isolate gels by the incorporation of different polysaccharides[J]. Food Chemistry,2020,310(25):125983.1−125983.8.
[10] PERRECHIL F A, BRAGA A, CUNHA R L. Acid gelation of native and heat-denatured soy proteins and locust bean gum[J]. International Journal of Food Science & Technology,2013,48(3):620−627.
[11] MONTEIRO S R, LOPES-DA-SILVA J A. Effect of the molecular weight of a neutral polysaccharide on soy protein gelation[J]. Food Research International,2017,102:14−24. doi: 10.1016/j.foodres.2017.09.066
[12] LEELA J K, SHARMA G. Studies on xanthan production from Xanthomonas campestris[J]. Bioprocess Engineering,2000,23(6):687−689. doi: 10.1007/s004499900054
[13] SINGHVI G, HANS N, SHIVA N, et al. Natural polysaccharides in drug delivery and biomedical applications[M]. Academic press, 2019: 121−144.
[14] 曹连鹏, 傅玉颖, 李欣, 等. 酸诱导大豆蛋白凝胶动态变化与流变特性[J]. 中国食品学报,2017,17(11):36−43. [CAO L P, FU Y Y, LI X, et al. Dynamic behavior of acid-induced soybean protein gls and their rheological properties[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(11):36−43. [15] BRITO-OLIVEIRA T C, BISPO M, MORAES I, et al. Stability of curcumin encapsulated in solid lipid microparticles incorporated in cold-set emulsion filled gels of soy protein isolate and xanthan gum[J]. Food Research International,2017,102:759−767. doi: 10.1016/j.foodres.2017.09.071
[16] 刘瑞雪, 周腾, 利月珍, 等. pH调节法制备自愈合明胶/聚甲基丙烯酸甲酯-甲基丙烯酸复合水凝胶[J]. 化工新型材料,2019,47(12):254−257. [LIU R X, ZHOU T, LI Y Z, et al. Preparation of self-healing gelation/PMMS composite hydrogel by pH adjustment[J]. New Chemistry Materials,2019,47(12):254−257. [17] 黄河, 李雅瑜, 郭子砚, 等. 双重响应性生物基自修复凝胶的制备及其性能[J]. 应用化学,2019,36(2):146−154. [HUANG H, LI Y Y, GUO Z Y, et al. Preparation and properties of dual responsive self-healing bio-based hydrogels[J]. Chinese Journal of Applied Chemistry,2019,36(2):146−154. doi: 10.11944/j.issn.1000-0518.2019.02.180106 [18] 江连洲, 张潇元, 潘悦, 等. 超声处理大豆分离蛋白与肌原纤维蛋白共混体系乳化性及凝胶性研究[J]. 中国食物与营养,2018,24(2):43−48. [JIANG L Z, ZHANG X Y, PAN Y, et al. Effect of emulsibility and gel properties of ultrasonication treated between soy protein isolate and myofibrillar protein[J]. Food and Nutrition in China,2018,24(2):43−48. doi: 10.3969/j.issn.1006-9577.2018.02.010 [19] CHRONAKIS I S. Network formation and viscoelastic properties of commercial soy protein dispersions: Effect of heat treatment, pH and calcium ions[J]. Food Research International,1996,29(2):123−134. doi: 10.1016/0963-9969(96)00018-X
[20] HU H, LI-CHAN E C Y, WAN L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids,2013,32(2):303−311. doi: 10.1016/j.foodhyd.2013.01.016
[21] CAVALLIERI A, CUNHA R. The effects of acidification rate, pH and ageing time on the acidic cold set gelation of whey proteins[J]. Food Hydrocolloids,2008,22(3):439−448. doi: 10.1016/j.foodhyd.2007.01.001
[22] BERG L, ROSENBERG Y, BOEKEL M, et al. Microstructural features of composite whey protein/polysaccharide gels characterized at different length scales[J]. Food Hydrocolloids,2009,23(5):1288−1298. doi: 10.1016/j.foodhyd.2008.10.013
[23] ÖZKAN N, XIN H, CHEN X D. Application of a depth sensing indentation hardness test to evaluate the mechanical properties of food materials[J]. Journal of Food Science,2002,67(5):1814−1820. doi: 10.1111/j.1365-2621.2002.tb08728.x
[24] CHANG Y Y, LI D, WANG L J, et al. Effect of gums on the rheological characteristics and microstructure of acid-induced SPI-gum mixed gels[J]. Carbohydrate Polymers,2014,108:183−191. doi: 10.1016/j.carbpol.2014.02.089
[25] 董坤, 魏钊, 杨志懋, 等. 自愈合凝胶: 结构、性能及展望[J]. 中国科学:化学,2012,42(6):741−756. [DONG K, WEI D, YANG Z M, et al. Self-healing gels: Structure, performance and future perspective[J]. Science China,2012,42(6):741−756. [26] LONG Y, JRS A, GEYA C. Viscoelastic behaviour of rapid and slow self-healing hydrogels formed by densely branched arabinoxylans from Plantago ovata seed mucilage[J]. Carbohydrate Polymers,2021,296:118318.
[27] 王俊, 张丽冰, 李海燕, 等. 自修复凝胶体系研究进展[J]. 高分子材料科学与工程,2014,30(7):184−190. [WANG J, ZHANG L B, LI H Y, et al. Progress in self-healing gel systems[J]. Polymer Materials Science and Engineering,2014,30(7):184−190. [28] BLAISZIK B J, KRAMER S, OLUGEBEFOLA S C, et al. Self-healing polymers and composites[J]. Annual Review of Materials Research,2010,40:179−211. doi: 10.1146/annurev-matsci-070909-104532
[29] 刘圣雅, 彭媛媛, 张甫生, 等. 酸诱导对大豆蛋白/高酯果胶复合体系凝胶特性的影响[J]. 食品与发酵工业,2019,45(6):104−109. [LIU S Y, PENG Y Y, ZHANG P S, et al. Effect of acid induction on gelling properties of soy protein isolate/high-methoxy pectin complex system[J]. Food and Fermentation Industries,2019,45(6):104−109. [30] HOU J J, GUO J, WANG J M, et al. Edible double-network gels based on soy protein and sugar beet pectin with hierarchical microstructure[J]. Food Hydrocolloids,2015,50:94−101. doi: 10.1016/j.foodhyd.2015.04.012
[31] TSENG Y C, XIONG Y L. Effect of inulin on the rheological properties of silken tofu coagulated with glucono-delta-lactone[J]. Journal of Food Engineering,2009,90(4):511−516. doi: 10.1016/j.jfoodeng.2008.07.017
-
期刊类型引用(6)
1. 田歌,蒋亦佳,张赟. 侧流层析技术在大肠杆菌O157:H7检测中的应用. 中国食品卫生杂志. 2024(01): 107-112 .  百度学术
百度学术
2. 彭晶晶,王淑云,侯配斌,胡彬. 致泻大肠埃希菌快速检测技术的研究进展. 预防医学论坛. 2024(06): 476-480 .  百度学术
百度学术
3. 李爽,赵云珠,王明慧,姜欣彤,吴昊璁,何思涵. 免疫测定法检测农药残留的研究进展. 食品研究与开发. 2024(21): 210-216 .  百度学术
百度学术
4. 陈洋,杨湛森,王鑫,宋光春,黄荟娴,徐瑗聪,罗云波,黄昆仑,程楠. 纸上微型实验室在食品检测领域的研究进展. 食品科学. 2023(03): 246-257 .  百度学术
百度学术
5. 王天予,叶凯霖,焦雪. 核酸可视化检测技术研究进展. 生物化工. 2023(01): 163-166+183 .  百度学术
百度学术
6. 马永强,张丝瑶,遇世友,王鑫,黎晨晨. 蜂蜜中抗生素残留的检测方法研究进展. 食品工业科技. 2022(20): 454-463 .  本站查看
本站查看
其他类型引用(9)








 下载:
下载:


 下载:
下载:



