Screening of Producing Polyphenol Oxidase Strains from the Fermentation Process of Liupao Tea and Purification of Polyphenol Oxidase
-
摘要: 本研究采用传统分离法从渥堆六堡茶中共分离出42株菌,然后利用平板初筛和液体发酵进行复筛,从42株微生物中筛选出10株产PPO的微生物并测定其酶活。用盐析及透析法对产酶活性最高的菌株所产的多酚氧化酶进行纯化,纯化后的酶液用SDS-PAGE及Native-PAGE电泳方法确定PPO的分子量范围和PPO种类。结果表明,渥堆六堡茶中发现的10株产多酚氧化酶菌株,其中,细菌的产酶活性普遍要高于霉菌;Pantoea vagans(成团泛菌)菌株产酶活性最高,酶活高达37 U/mL,其所产的多酚氧化酶分子量在16~48 kDa之间,属于漆酶。此研究为微生物对六堡茶茶叶品质作用的后续研究奠定了基础,同时也为功能六堡茶的研发提供资料数据。Abstract: In this study, 42 strains of microorganisms were isolated by traditional culture methods from the fermentation process of Liupao tea. The agar plate screening and liquid culture second round of screening was used to select microorganisms from 42 strains of microorganisms that could produce PPO. Then, the activity of PPO produced by microorganisms was measured. Salting out and dialysis were used to purify the microbial fermentation broth with the highest enzyme activity. The SDS-PAGE and Native-PAGE method was applied to determine the molecular weight and type of the PPO. The results identified 10 screened strains with PPO activity and No.16 (Pantoea vagans) with the highest activity. The enzyme activity of Pantoea vagans was 37 U/mL. The enzyme-producing activity of bacteria was generally higher than the fungus. The molecular weight of PPO between 16~48 kDa, the result showed that the enzyme was laccase. This study supplies a basis for exploring the relationship between Liupao tea quality and microorganisms. It can also provide data for the research and development of functional Liubao tea.
-
Keywords:
- Liupao tea /
- microorganisms /
- polyphenol oxidase /
- laccase
-
六堡茶是一种后发酵茶,其色泽表现为黑褐色,茶汤色红浓明亮,滋味甘醇,香气醇陈并具有独特的槟榔香气,其以“红、浓、陈、醇”四绝著称[1- 2]。六堡茶是地理标志产品,以其原料发现地——广西省梧州市六堡镇命名。六堡茶以苍梧县群体种、广西大中叶种及其分离选育出来的品种、品系的茶树鲜叶作为加工原料,茶叶中含有大量的茶多酚等活性成分。渥堆后的六堡茶具有丰富的次级代谢产物,如茶多酚、茶色素、茶多糖等活性成分,因此六堡茶具有降血糖、减肥、抗氧化等多种功能[3-5]。六堡茶的渥堆是微生物参与品质形成的重要阶段,在这一过程中由于微生物的加入,生化成分发生改变,对茶叶品质的形成有极大影响。
多酚氧化酶(polyphenol oxidase,PPO)是自然界分布极广的一种氧化还原酶,能够通过催化分子氧氧化酚或多酚形成对应的醌。广义上的多酚氧化酶包括酪氨酸酶(tyrosinase,EC.1.14.18.1)、儿茶酚酶(catechol oxidse,EC.1.10.3.1)和漆酶(laccase,EC.1.10.3.2)[6-8],其广泛存在于动物、植物、真菌及细菌中,其中,儿茶酚酶主要分布于植物中,微生物可产生的多酚氧化酶主要包括漆酶和酪氨酸酶。多酚氧化酶对于后发酵茶茶叶品质形成的过程有举足轻重的作用,因此研究六堡茶发酵阶段产多酚氧化酶微生物的多样性,对探索六堡茶品质形成原因具有实际意义。在茶叶渥堆发酵过程中,多酚氧化酶首先作用于茶多酚,尤其是儿茶素等物质,能够使儿茶素氧化成醌,进一步氧化聚合而成茶黄素(TF)[9-12]与茶红素(TR),TF与TR继续与其他物质进行氧化聚合,形成茶褐素(TB)[13]。而茶色素的存在会影响茶汤颜色及滋味。其中,TF与茶的涩味、亮度、颜色(黄色)及鲜爽味有密切关系;TR与茶的滋味、口感厚重度及颜色(红棕色)有密切关系[14]。
本研究拟从渥堆六堡茶茶样分离的微生物中,筛选产多酚氧化酶菌株,研究六堡茶渥堆阶段可以产生PPO菌的微生物多样性。并利用盐析和透析初步纯化PPO,再利用SDS-PAGE电泳并染色结合Native-PAGE电泳对酶进行活体染色从而判断酶的分子量和酶的种类。PPO酶可以影响茶汤颜色和滋味,因此,了解产PPO酶的微生物种类,可以更好地了解六堡茶品质形成的原因,同时对六堡茶新品的研发提供理论基础。
1. 材料与方法
1.1 材料与仪器
六堡茶渥堆茶样 取自梧州市一家茶厂加工厂;儿茶素、葡萄糖、硫酸镁、硝酸钠、氯化钾、磷酸氢二钾、胰蛋白胨、琼脂、明胶、牛肉膏、酵母膏、牛肉粉、蛋白胨、植物蛋白胨、酵母浸粉、制霉菌素、氯化钠、邻苯二酚、氯四环素、硫酸铵 均为分析纯,国药集团化学试剂有限公司;SDS-PAGE标准蛋白质、牛血清蛋白 美国Sigma公司;引物27 F、1492 R、ITS1、ITS4、Gold view I染色剂 上海生工有限公司;细菌分离培养基 采用:牛肉膏蛋白胨培养基、LB培养基、TSA培养基、肉液肉浸汤培养基、酵母膏胨葡萄糖(YPD)琼脂培养基;真菌分离培养基 采用:马铃薯葡萄糖(PDA)琼脂培养基、氯硝胺18%甘油(DG18)琼脂培养基与DRBC培养基;真菌纯化活化培养基 使用PDA;细菌纯化活化培养基 NA培养基。
G180TW高温高压灭菌锅 美国ZEALWAY公司;ZQWY-200F振荡培养箱 上海知楚仪器有限公司;Power PacTM Basic电泳仪 伯乐生命科学发展有限公司;SW-CJ-2FD型净化工作台 苏州安泰空气技术有限公司;UV-1601PC紫外分光光度计 日本岛津。
1.2 实验方法
1.2.1 菌种分离、纯化及活化
菌种为课题组分离纯化得到。分离方法简述如下:用十字交叉法称取磨碎后的茶样25 g,加入含有225 mL的灭菌生理盐水的锥形瓶中,用漩涡振荡器振荡25 min后,将得到的菌悬液按照10倍比例进行稀释,直到稀释至10−7,稀释后的菌悬液备用。采用稀释平板涂布法进行接种,用移液枪分别吸取0.1 mL的每个稀释度的样品菌悬液,均匀涂布于已经配置好的平板培养基上。细菌在37 ℃培养箱中培养48 h。其中,好氧细菌在37 ℃的恒温培养箱中培养48 h后计数分离,厌氧细菌则是在37 ℃的厌氧培养箱中培养48 h后分离计数。真菌培养基在28 ℃放置5 d,观察生长状况。待菌落长出后,根据菌落的生长特征进行分离纯化。
菌种纯化:挑出平板培养基上的单个菌落,用接种针将其接种于适合生长的培养基上划线培养,反复接种分离2~3次直至得到纯的菌株,至恒温培养箱中培养,记录编号后于4 ℃保存。
菌种活化:取保存于4 ℃冰箱的培养平板,挑选单菌落在活化培养基上划线培养,细菌于37 ℃培养24 h,真菌于28 ℃ 培养箱培养3~4 d,待用。
1.2.2 产多酚氧化酶菌株的初筛
细菌初筛培养基:儿茶素2 g,牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,加蒸馏水1000 mL,121 ℃灭菌20 min;真菌初筛培养基:儿茶素2 g,葡萄糖30 g,MgSO4·7H2O 0.5 g,NaNO3 3.0 g,KCl 0.5 g,K2HPO4 1.0 g,琼脂20 g,加蒸馏水至1000 mL,121 ℃灭菌20 min。
初筛参考胡沛然[15]的方法并稍作修改。经活化后的菌株,采用三点接种法点接于初筛培养基上。细菌与酵母培养48 h,霉菌培养4 d,并随时观察、记录各个平板上菌落周围产生褐色素的情况。周围产生褐色素直径和菌株直径比(R)越大则表明多酚氧化酶的活力越大。取周围产生褐色素直径和菌株直径比值大的微生物制备菌悬液。
1.2.3 产多酚氧化酶菌株的复筛
细菌菌悬液的制备:将初筛得到的细菌菌株用NA液体培养基于37 ℃培养24 h,活化2代,在4 ℃、8000 r/min条件下离心10 min;并用无菌生理盐水洗涤2次,重悬,使菌悬液OD600 nm值为0.8。
真菌孢子菌悬液的制备:将初筛得到的霉菌接种到PDA斜面上,在28 ℃下培养4 d后,加入无菌生理盐水,刮落真菌菌落表面的孢子,为去除菌丝等杂质,利用灭菌后的4层纱布过滤,用血球计数板计数,将孢子浓度调整至106 CFU/mL。
酵母菌悬液的制备:将初筛得到的酵母接种到PDA斜面上,用3 mL无菌生理水冲洗斜面, 在28 ℃,150 r/min的条件下摇床培养1 d,用血球计数板计数,浓度调整至106 CFU/mL备用。
复筛液体培养基:晒青毛茶粉碎,称取2 g,加水50 mL于250 mL三角瓶中,调pH6,110 ℃灭菌20 min,121 ℃灭菌20 min。
粗酶液制备及PPO活性测定:将菌悬液以3%接种量分别接种于复筛培养基中进行摇瓶培养,250 mL锥形瓶中装复筛培养基50 mL,细菌37 ℃培养2 d;霉菌28 ℃培养4 d,酵母28 ℃培养3 d。取发酵液在4 ℃下10000 r/min离心10 min,上清液即为粗酶液。酶活测定取磷酸缓冲液(pH7,0.2 mmol/L)2.85 mL,加入100 μL粗酶液,50 μL邻苯二酚(60 mmol/L)。于420 nm处测吸光值,每隔30 s读数一次,测量时间3 min。空白对照用50 μL磷酸缓冲液(pH7,0.2 mmol/L)代替50 μL的邻苯二酚。以每分钟A420变化0.01为一个酶活单位U 。
1.2.4 微生物的鉴定
将复筛后检出有PPO酶活的微生物进行微生物分子鉴定。并选取多酚氧化酶酶活最大的一株微生物进行透析,SDS-PAGE电泳,Native-PAGE电泳和活性染色。微生物分子鉴定方法如下。
1.2.4.1 细菌形态学及生理生化
参照东秀珠,蔡妙英《常见细菌系统鉴定手册》。对细菌的形态进行观察:观察菌落颜色、大小、形态,并记录菌落形态特征。
菌种的生理生化:革兰氏染色发参考Hucker法[16];明胶液化和吲哚试验[17];柠檬酸盐试验和糖、醇发酵试验[18]。
1.2.4.2 DNA提取
在无菌操作台,取50 μL灭菌的树脂于无菌八连管中,用灭菌的牙签挑取少部分上述活化的单菌落在装有树脂的八连管中研磨,金属浴10 min后离心10 min取上清液制得模板DNA以备用。
另取一条八连管,制成25 μL体系。细菌扩增酶体系制备如下:将100 μL Mix酶,88 μL无菌水,4 μL引物27 F,4 μL引物1492 R混合均匀,均分为8份,每份混合液24.5 μL。真菌体系制备如下:将100 μL Mix酶,88 μL无菌水,4 μL引物ITS1,4 μL引物ITS4混合均匀,均分为8份,每份混合液24.5 μL。
1.2.4.3 PCR扩增
向扩增酶体系中加入0.5 μL上清液模板DNA。细菌PCR条件:95 ℃预变性8 min;94 ℃变性50 s,55 ℃退火45 s,72 ℃延伸1.5 min,31个循环,最后72 ℃延伸10 min。−20 ℃保存备用。真菌PCR条件:95 ℃预变性8 min,94 ℃变性 50 s,52 ℃退火45 s;72 ℃延伸1.5 min,30个循环,最后72 ℃延伸10 min。−20 ℃保存备用。
1.2.4.4 微生物鉴定
配制质量分数为1%的琼脂糖凝胶,在110 V,100 mA 在1×TAE电泳缓冲液中进行电泳,电泳时间为25 min,采用Gold view I染色剂进行染色,电泳结束后在凝胶成像仪上观察PCR扩增条带是否清晰完整。将PCR扩增产物送往上海美吉有限公司进行序列测定。并将测序后的结果在NCBI上用Blast软件序列比对,选择同源性较高的菌株,采用MEGA6.0进行进化树的建立,确定所分离菌株的种属。
1.2.5 菌株多酚氧化酶初步纯化
1.2.5.1 试验方法
取1.2.3制备好的100 mL粗酶液,磁力搅拌器搅拌,缓慢均匀加入硫酸铵,使其饱和度分别达到10%、20%、30%、40%、50%、60%、70%、80%、90%(W/V),均匀搅拌待沉淀充分后,10000 r/min,4 ℃下离心10 min,取离心后的少量上清液,测定残余的酶活及蛋白质含量,确定最佳的盐析浓度。
1.2.5.2 蛋白质含量测定
采用Brodford的考马斯亮蓝法测定蛋白质含量,用牛血清蛋白作为标准制作蛋白质标准曲线[19]。
1.2.5.3 多酚氧化酶初步纯化
选择合适的盐析浓度后,在粗酶液中缓慢加入硫酸铵不停搅拌,至完全沉淀后,静置得到盐析溶液。盐析液10000 r/min,4 ℃下离心15 min。去除上清液,取沉淀用磷酸缓冲液(pH7,0.1 mol/L)溶解,溶解后溶液再次在10000 r/min,4 ℃下离心15 min。收集上清液,在相同的磷酸缓冲液中透析(分子截留量3500 D)过夜,间隔一段时间更换透析液,用2% BaCl2溶液检测硫酸铵,直到不再产生白色沉淀则为透析结束。透析后酶液在冰箱中4 ℃保存。
1.2.5.4 SDS-PAGE与Native-PAGE确定菌株PPO种类
SDS-PAGE参照LAEMMLI等[20]的方法,浓缩胶浓度5%,分离胶浓度10%。Native-PAGE参照VALIEV等[21]的方法,浓缩胶5%,分离胶10%,不加SDS,电泳后,对多酚氧化酶进行活性染色,N-二乙基对苯二胺(ADA)进行漆酶染色,对叔丁基邻苯二酚(tBC)进行酪氨酸酶以及儿茶酚酶的染色。
1.3 数据处理
分别采用Excel 2019、Origin 2019软件分析和处理数据,结果表示为平均值±标准差。菌株的测序结果用BLAST(NCBI)软件及MEGA 6.0(Sudhir Kumar)软件构建系统发育树。
2. 结果与分析
2.1 产多酚氧化酶初筛
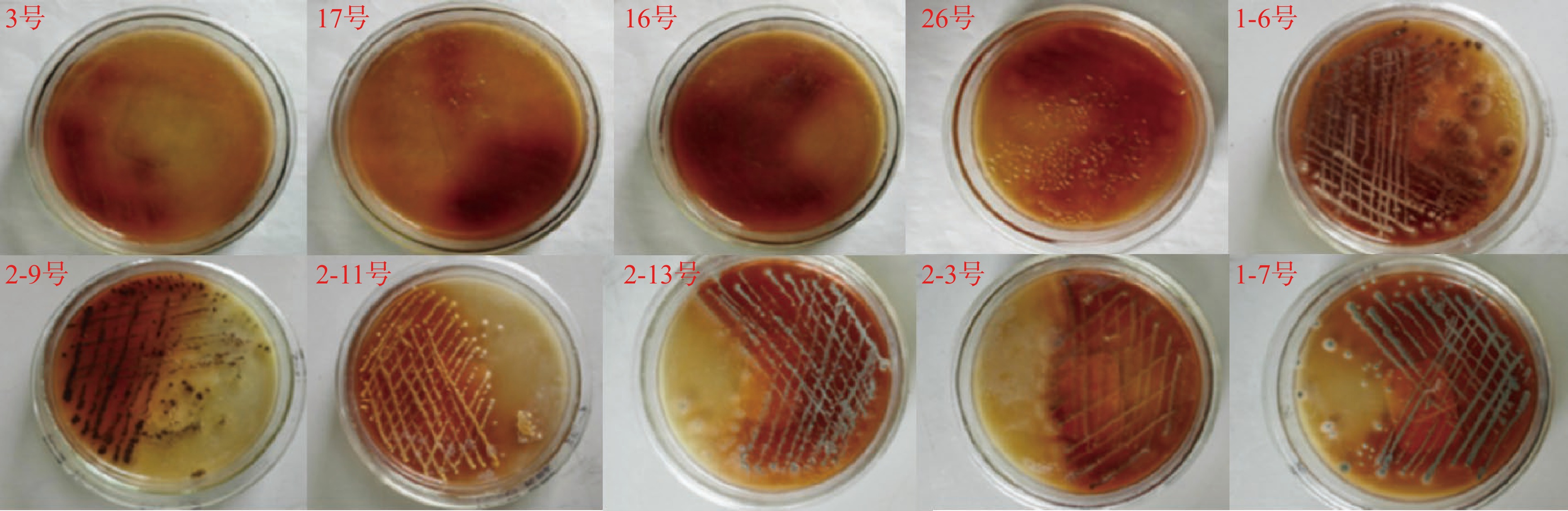
儿茶素在多酚氧化酶的作用下可生成黄红色的氧化聚合物。产多酚氧化酶的菌株能氧化培养基中的儿茶素,生成颜色较深的氧化变色圈(图1)。六堡茶渥堆过程中筛选得到的42株微生物中有4株细菌褐变明显,分别为3、16、26、17号;6株霉菌褐变明显,分别为1-6、2-9、2-11、2-13、2-3、1-7号,从中可以看出细菌产酶菌数量明显少于霉菌产酶菌数量。初步判断这10株菌有产多酚氧化酶的能力,选择这10株菌进行复筛。
2.2 产多酚氧化酶菌株复筛
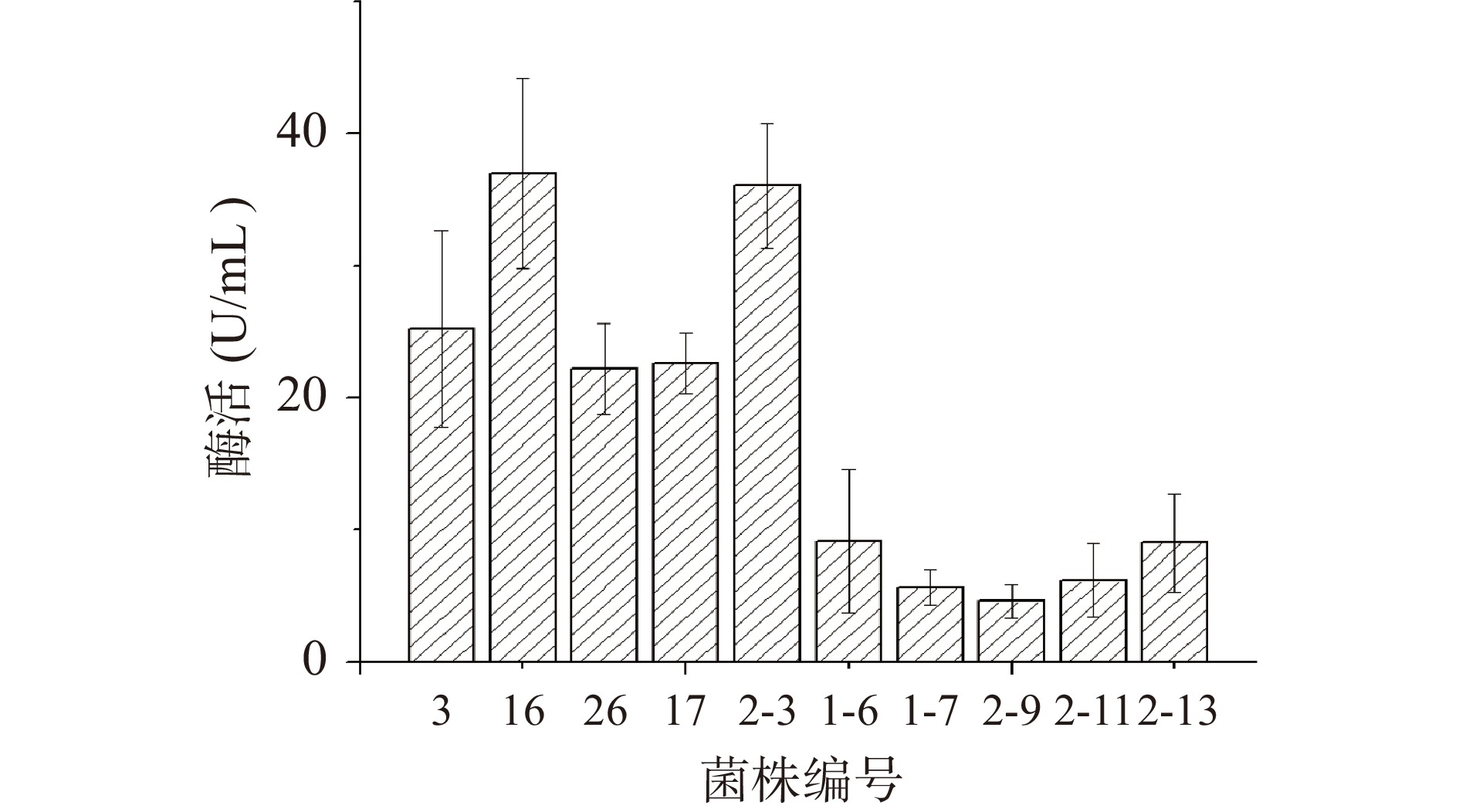
将10株初筛的产多酚氧化酶菌株进行产酶液体发酵,然后测定其产酶活性。不同菌株产酶活性结果见图2。同时选择这10株微生物进行分子学鉴定。由图2可知,初筛选择的菌株均能在液体培养时产生多酚氧化酶,其中,细菌的产酶能力整体上大于霉菌的产酶能力,细菌的产酶产量均超过20 U/mL。除了2-3号霉菌的产酶活力较大外其余产酶霉菌的产酶活力均小于15 U/mL。16号与2-3号菌株产酶量均超过35 U/mL。根据检测的酶活数据,选择16号菌株(酶活37 U/mL)进行下一步多酚氧化酶的初步分离纯化。
2.3 产多酚氧化酶菌株生理生化及分子鉴定
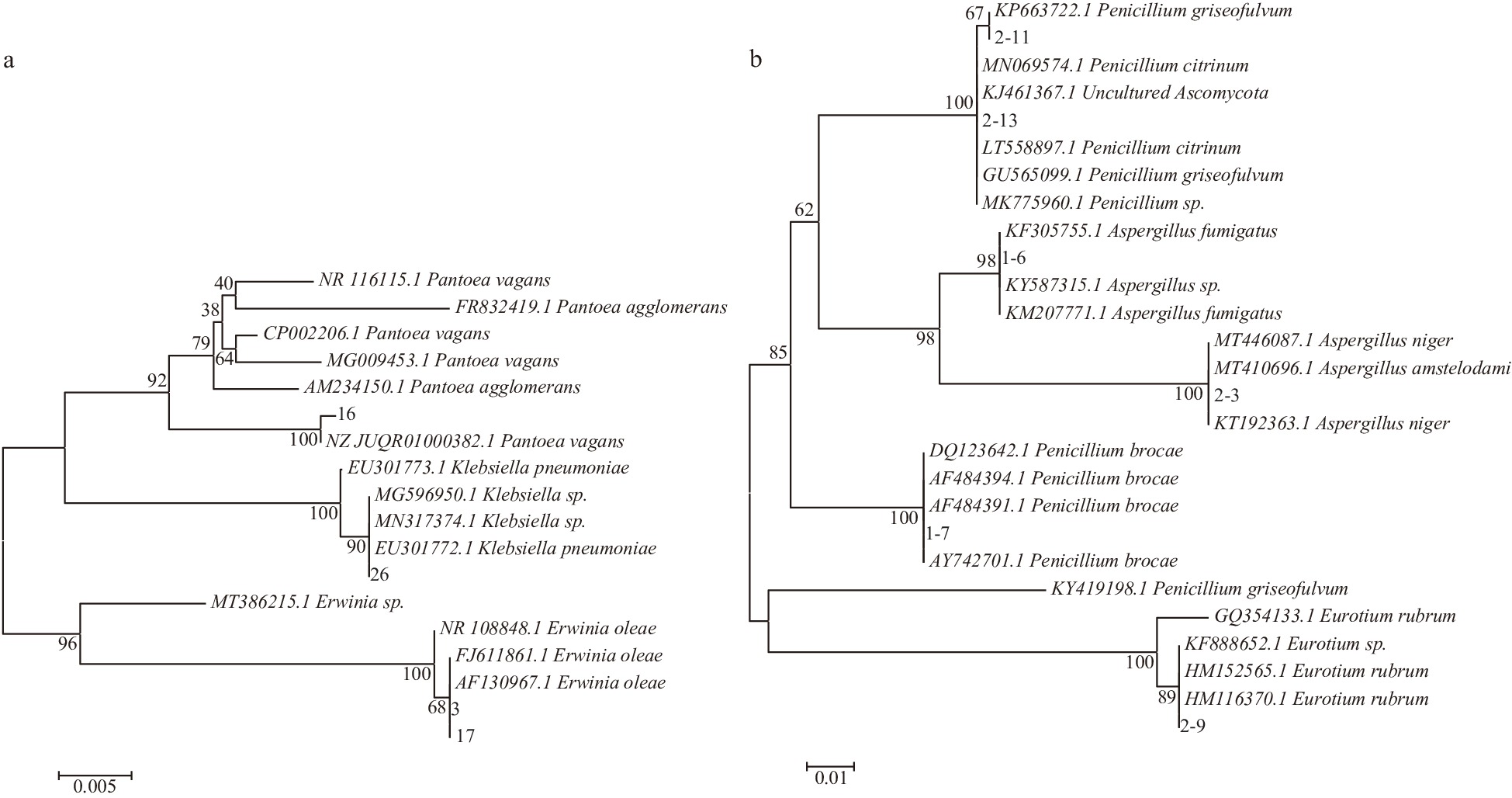
对细菌进行菌落观察和生理生化实验。菌落形态观察如表1,生理生化结果见表2。同时对微生物DNA提取和PCR扩增后,对DNA进行纯化、检测。测序得到结果提交至Genbank,根据比对结果选取同源性较高的菌株利用MEGA 6软件构建进化树。鉴定结果如表3,系统进化树如图3。
表 1 发酵六堡茶中细菌的特征Table 1. Characteristics of bacteria in fermented Liupao tea菌号 形状 革兰氏染色 菌落形态 菌落颜色 菌落隆起度 菌落边缘形状 菌落表面状态与光泽度 菌落干湿 菌落透明度 3 短棒状 − 圆形 米白色 凸起 边缘光滑 粘稠有光泽 湿润 透明 17 短棒状 − 圆形 米白色 凸起 边缘光滑 粘稠有光泽 湿润 透明 26 球状 − 圆形 白色 中间凸起 边缘光滑 光滑有光泽 湿润 半透明 16 短棒状 − 圆形 灰白色 中间凸起 边缘光滑 光滑有光泽 湿润 不透明 注: “−”表示为阴性。 表 2 六堡茶分离细菌的理化特性Table 2. Physiological characteristic of bacteria isolated from Liupao tea属 种 编号 生理生化 革兰氏染色 明胶液化 吲哚试验 柠檬酸盐试验 D-阿拉伯糖 D-阿拉伯糖醇 甘油 肌醇 D-甘露糖 L-鼠李糖 欧文氏菌属 Erwinia oleae 3 − ND ND ND + + − − + + 17 − ND ND ND + + − − + + 克雷伯氏菌属 Klebsiella pneumoniae 26 − − − + + + ND + + + 泛菌属 Pantoea vegans 16 − + + ND + ND + − + + 注:“+”表示为阳性;“−”表示为阴性;“ND”表示为未检测到。 表 3 微生物分子鉴定结果Table 3. The results of microbial molecular identification微生物 编号 属 种 Max identity(%) 登录号(Genmank) 细菌 3 欧文氏菌属 Erwinia oleae 94 FJ611861 17 94 FJ611861 26 克雷伯氏菌属 Klebsiella pneumoniae 99 EU301772 16 泛菌属 Pantoea vagans 98 NZ_JUQR01000382
霉菌2-3 曲霉属 Aspergillus nige 100 KT192363 1-6 Aspergillus fumigatus 100 KM207771 1-7 青霉属 Penicillium brocae 100 DQ123642 2-11 Penicillium griseofulvum 99 KP663722 2-13 Penicillium griseofulvum 100 GU565099 2-9 散囊菌属 Eurotium rubrum 97 KF888652 传统发酵工艺的六堡茶中微生物来源广,微生物种类多且杂。此次通过传统分离纯化和特异性选择,从课题组内的27株细菌、14株霉菌和1株酵母中筛选细菌4株3个属,霉菌6株5个属在六堡茶固态发酵阶段中可以产生多酚氧化酶,分别为Erwinia oleae、肺炎克雷伯氏菌(Klebsiella pneumoniae)、成团泛菌(Pantoea vagans)、黑曲霉(Aspergillus nige)、烟曲霉(Aspergillus fumigatus)、Penicillium brocae、灰黄青霉(Penicillium griseofulvum)、赤散囊菌(Eurotium rubrum)。其中,细菌的泛菌属、真菌的曲霉属和青霉属都是黑茶发酵过程的优势微生物[22-23]。
有研究表明Klebsiella pneumoniae[24-25]、黑曲霉[26-28]、烟曲霉[13,29]可以产生多酚氧化酶,因此在六堡茶发酵阶段,这些微生物可以通过分泌多酚氧化酶,进行酶促反应氧化儿茶素为茶黄素和茶红素,进而影响茶汤颜色和滋味[11]。而成团泛菌、赤散囊菌等微生物可以分泌多酚氧化酶未见详细研究。本研究通过筛选产PPO微生物,可以初步推断影响六堡茶茶汤颜色的微生物群落组成,这为进一步分析六堡茶品质形成提供了理论依据。
2.4 确定蛋白酶盐析浓度
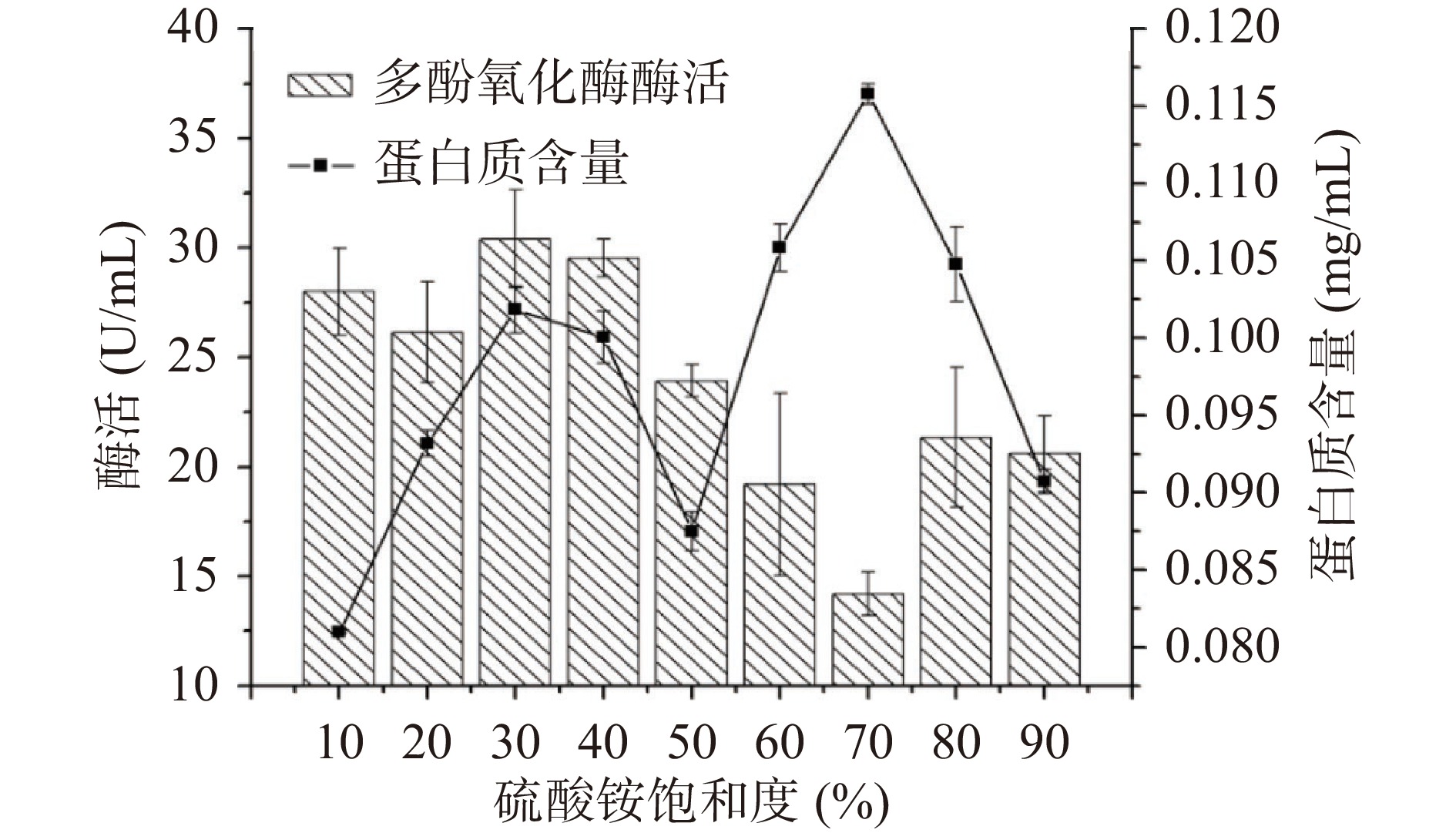
通过不同浓度的硫酸铵溶液盐析成团泛菌离心后的发酵液,盐析结果如图4。参考Brodford的考马斯亮蓝法按照Y=0.5151+8.385X(R2=0.9917)计算蛋白质含量。从图4可知,经过不同饱和度的硫酸盐沉淀后,上清液酶活从40%开始下降,当盐浓度达到70%时,酶活最低;上清液蛋白质含量在盐饱和度为10%至30%时逐渐增加,在饱和度为30%~50%逐渐下降。盐浓度为40%时酶主要存在于上清液中,而蛋白质含量有所下降,因此选择盐浓度为40%时除去酶液中的杂蛋白;盐浓度为70%时,上清液中酶含量最低,蛋白质含量较高,因此,选择70%盐浓度沉淀目标蛋白。将盐析所获得目标沉淀,用磷酸盐溶解,透析(分子截留量3500 D)除盐后,得到初步纯化的酶液在4 ℃冰箱中贮存备用。
2.5 酶液的SDS-PAGE以及Native-PAGE分析
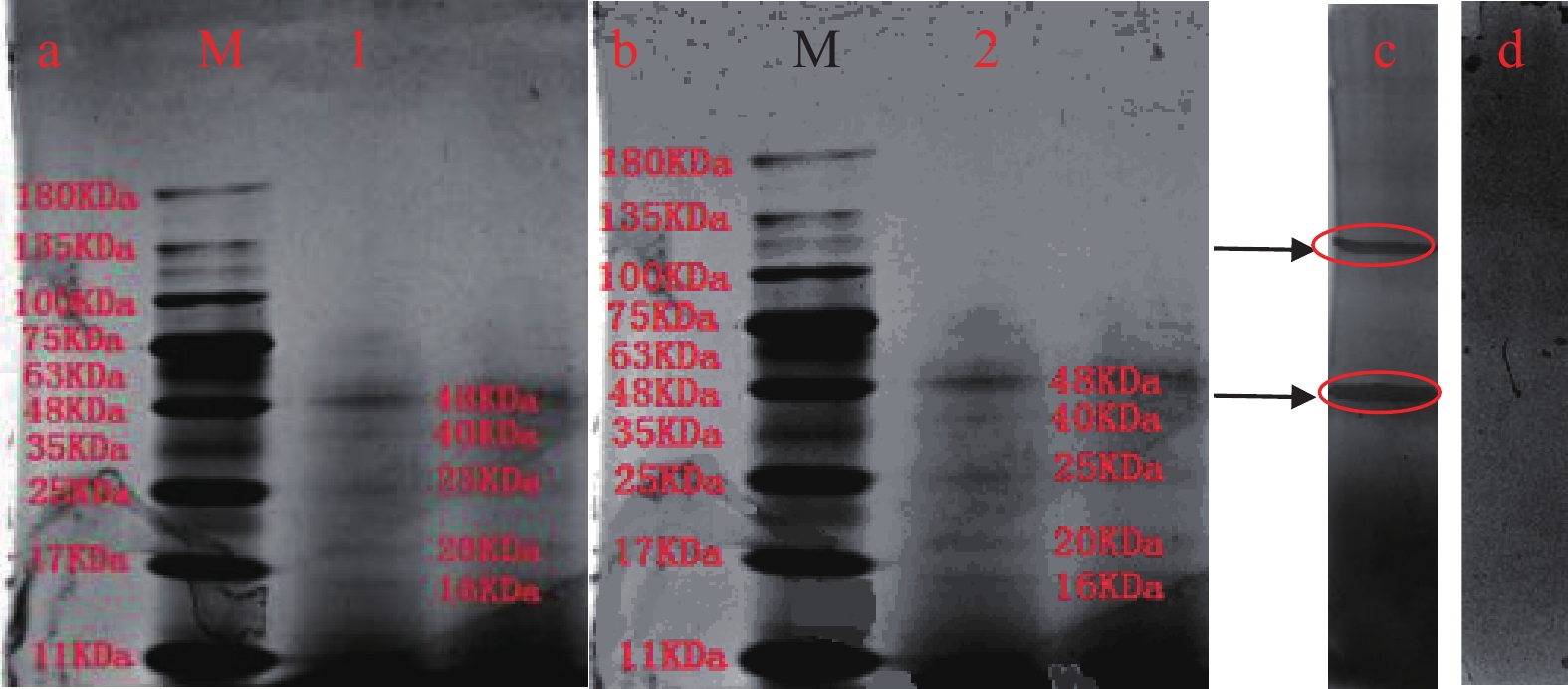
成团泛菌液体发酵后经过硫酸铵沉淀后,沉淀物用磷酸缓冲液(0.1 mol/L pH7)溶解后,透析后的酶液分别用于SDS-PAGE及Native-PAGE电泳。
由图5a和图5b可知,透析后的酶液,经过SDS-PAGE电泳和Native-PAGE电泳,染色后均可以看到5条清晰的条带,显示漆酶分子量在16~48 kDa之间。5个蛋白条带分子量分别为16、20、25、40和48 kDa,推测PPO样品尚未完全纯化。钱磊[30]、陈琼华[31]等研究发现存在漆酶分子量约为40 kDa,而且漆酶分子量的测定存在10~20 kDa的差异,因此此次测定符合已有报道的漆酶分子量范围。图5c是N-N二乙基对苯二胺(ADA)溶液进行的漆酶活性染色图,若被测酶不具有漆酶活性则无法染色,但图中可以看到两条清晰的条带,这表明该酶是具有两种不同构型的漆酶。而图5d为对叔丁基邻苯二酚(tBC)溶液进行的儿茶酚酶及酪氨酸酶活性染色图,在活性染色图中,没有发现条带,表明成团泛菌所产PPO不具有儿茶酚酶和酪氨酸酶活性。由图5可以初步判断成团泛菌所产生的PPO酶是漆酶。漆酶可以作用于六堡茶中的木质素[32],还可以将酚类物质氧化为醌类化合物或自由基等[33]。茶黄素的合成受漆酶的影响[34]。漆酶在30~50 ℃间活性较强,而六堡茶发酵时的堆温约为45~50 ℃,这有利于漆酶作用。泛菌属又作为六堡茶发酵过程的优势微生物[2],对六堡茶茶色素的形成可能有极大的影响。
3. 结论
本研究对渥堆六堡茶中分离得到的微生物进行了产多酚氧化酶的筛选,得到了10株产酶菌,其中包括4株3个属的细菌和6株5个属的霉菌,其中编号为16号菌株的成团泛菌产酶活性最高。这10株微生物中尚未报道可以产生多酚氧化酶的细菌为Erwinia oleae、成团泛菌(Pantoea vagans)和真菌Penicillium brocae、灰黄青霉(Penicillium griseofulvum)、赤散囊菌(Eurotium rubrum)。对16号菌株所产的多酚氧化酶进行了初步纯化,选择饱和度为40%的硫酸盐去除杂蛋白,饱和度为70%的硫酸盐溶液沉淀目标蛋白。通过SDS-PAGE,Native-PAGE电泳和ADA漆酶染色,tBC儿茶酚酶和络氨酸酶染色分析,判断16号菌株所产的PPO酶属于漆酶,分子量在16~48 kDa之间;本实验证明了渥堆过程中存在产多酚氧化酶微生物,其中,微生物所产的漆酶可以作用于茶多酚生成茶黄素,从而影响六堡茶品质的形成。本研究为六堡茶茶汤品质的形成提供了一定的理论基础,为今后研究微生物多酚氧化酶作用于茶叶酚类物质的产物与茶叶品质的关系做了铺垫。
-
表 1 发酵六堡茶中细菌的特征
Table 1 Characteristics of bacteria in fermented Liupao tea
菌号 形状 革兰氏染色 菌落形态 菌落颜色 菌落隆起度 菌落边缘形状 菌落表面状态与光泽度 菌落干湿 菌落透明度 3 短棒状 − 圆形 米白色 凸起 边缘光滑 粘稠有光泽 湿润 透明 17 短棒状 − 圆形 米白色 凸起 边缘光滑 粘稠有光泽 湿润 透明 26 球状 − 圆形 白色 中间凸起 边缘光滑 光滑有光泽 湿润 半透明 16 短棒状 − 圆形 灰白色 中间凸起 边缘光滑 光滑有光泽 湿润 不透明 注: “−”表示为阴性。 表 2 六堡茶分离细菌的理化特性
Table 2 Physiological characteristic of bacteria isolated from Liupao tea
属 种 编号 生理生化 革兰氏染色 明胶液化 吲哚试验 柠檬酸盐试验 D-阿拉伯糖 D-阿拉伯糖醇 甘油 肌醇 D-甘露糖 L-鼠李糖 欧文氏菌属 Erwinia oleae 3 − ND ND ND + + − − + + 17 − ND ND ND + + − − + + 克雷伯氏菌属 Klebsiella pneumoniae 26 − − − + + + ND + + + 泛菌属 Pantoea vegans 16 − + + ND + ND + − + + 注:“+”表示为阳性;“−”表示为阴性;“ND”表示为未检测到。 表 3 微生物分子鉴定结果
Table 3 The results of microbial molecular identification
微生物 编号 属 种 Max identity(%) 登录号(Genmank) 细菌 3 欧文氏菌属 Erwinia oleae 94 FJ611861 17 94 FJ611861 26 克雷伯氏菌属 Klebsiella pneumoniae 99 EU301772 16 泛菌属 Pantoea vagans 98 NZ_JUQR01000382
霉菌2-3 曲霉属 Aspergillus nige 100 KT192363 1-6 Aspergillus fumigatus 100 KM207771 1-7 青霉属 Penicillium brocae 100 DQ123642 2-11 Penicillium griseofulvum 99 KP663722 2-13 Penicillium griseofulvum 100 GU565099 2-9 散囊菌属 Eurotium rubrum 97 KF888652 -
[1] 何梅珍. 六堡茶快速陈化新工艺对茶叶品质的影响[J]. 大众科技,2013,15(165):157−158. [HE M Z. Liubao tea rapid aging of new technology on the quality of tea[J]. Popular Science & Technology,2013,15(165):157−158. [2] 龙峻瑶, 张均伟, 黄丽, 等. 六堡茶乳酸菌多样性及其降胆固醇特性分析[J]. 食品科学,2021,42(18):58−64. [LONG J Y, ZHANG J W, HUANG L, et al. Diversity and cholesterol lowering characteristics of lactic acid bacteria in Liupao tea[J]. Food Science,2021,42(18):58−64. [3] DING Q Z, ZHANG B W, ZHANG W, et al. Liupao tea extract alleviates diabetes mellitus and modulates gut microbiota in rats induced by streptozotocin and high-fat, high-sugar diet[J]. Biomedicine & Pharmacotherapy,2019,118:109262.
[4] WU Y, SUN H L, YI R K, et al. Anti-obesity effect of Liupao tea extract by modulating lipid metabolism and oxidative stress in high-fat-diet-induced obese mice[J]. Journal of Food Science,2021,86(1):215−227. doi: 10.1111/1750-3841.15551
[5] MAO Y, WEI B Y, TENG J W, et al. Polysaccharides from Chinese Liupao dark tea and their protective effect against hyperlipidemia[J]. International Journal of Food Science & Technology,2018,53(3):599−607.
[6] 李忠光, 龚明. 植物多酚氧化酶活性测定方法的改进[J]. 云南师范大学学报(自然科学版),2005,25(1):44−45,49. [LI Z G, GONG M. Improvement of measurement method of polyphenol oxidase activities in plant[J]. Journal of Yunnan Normal University (Natural Sciences Edition),2005,25(1):44−45,49. [7] 许传俊, 李玲. 植物多酚氧化酶的研究进展[J]. 生命科学研究,2002,6(1):45−48. [XU C J, LI L. A review of recent advances on polyphenol oxidase in plant[J]. Life Science Research,2002,6(1):45−48. [8] 贺立红, 宾金华. 高等植物中的多酚氧化酶[J]. 植物生理学通讯,2001,37(4):340−345. [HE L H, BIN J H. Polyphenol oxidase in higher plants[J]. Plant Physiology Communications,2001,37(4):340−345. [9] 薛金金, 尹鹏, 张建勇, 等. 植物源多酚氧化酶氧化儿茶素形成茶黄素和聚酯型儿茶素的研究[J]. 食品工业科技,2019,40(20):76−81. [XUE J J, YIN P, ZHANG J Y, et al. Screening of plant-derived polyphenol oxidase for the formation of theaflavins and theasinensins from the oxidation of catechins[J]. Science and Technology of Food Industry,2019,40(20):76−81. [10] 岳鹍, 揣玉多, 孙勇民. 固定化漆酶酶促合成茶黄素工艺的研究[J]. 安徽农业科学,2011,39(35):21755−21756. [YUE K, CHUAI Y D, SUN Y M. Study on technology of synthesizing theaflavins through enzyme-catalysing oxidation with immobilized laccase[J]. Journal of Anhui Agricultural Sciences,2011,39(35):21755−21756. doi: 10.3969/j.issn.0517-6611.2011.35.074 [11] 李洁媛, 李东, 童凯, 等. 马铃薯多酚氧化酶的分离纯化、酶学性质及酶促合成茶黄素性能研究[J]. 食品与发酵工业,2021,47(11):26−31. [LI J Y, LI D, TONG K, et al. Enzymatic properties of purified polyphenol oxidase from potato and its ability to enzymatic synthesis theaflavins[J]. Food and Fermentation Industries,2021,47(11):26−31. [12] MOHAMMAD F G, ALIREZA T. Isolation and characterization of polyphenol oxidase- and peroxidase-producing Bacillus strains from fully fermented tea (Camellia sinensis)[J]. World Journal of Microbiology and Biotechnology,2007,23(9):1327−1332. doi: 10.1007/s11274-007-9363-1
[13] WANG Q P, GONG J S, CHISTI Y, et al. Bioconversion of tea polyphenols to bioactive theabrownins by Aspergillus fumigatus[J]. Biotechnology Letters,2014,36(12):2515−2522. doi: 10.1007/s10529-014-1632-0
[14] BISWAS A K, BISWAS A K, SARKAR A R. Biological and chemical factors affecting the valuations of north-east indian plains teas II. *-Statistical evaluation of the biochemical constituents and their effects on briskness, quality and cash valuations of black teas[J]. Science of Food and Agriculture,1971,22(4):196−204. doi: 10.1002/jsfa.2740220412
[15] 胡沛然. 六堡茶多酚氧化酶及其产生菌对茶叶品质的应用[D]. 南宁: 广西大学, 2019. HU P R. Research on polyphenol oxidase in Liupao tea and the application of PPO producing microorganism to tea quality[D]. Nanning: Guangxi University, 2019.
[16] AGUIAR D C, BARROS V L, PEREIRA W L, et al. Immunodetection of Helicobacter sp. and the associated expression of ABO blood group antigens in the gastric mucosa of captive and free-living New World primates in the Amazon region[J]. Mem Inst Oswaldo Cruz,2011,106(8):936−941. doi: 10.1590/S0074-02762011000800007
[17] 万倩, 李启明, 吴华星, 等. 传统发酵食品中乳酸菌的安全性评估[J]. 现代食品科技,2021,37(6):276−286. [WANG Q, LI Q M, WU H X, et al. Evaluation for lactic acid bacteria safety in traditional fermented food[J]. Modern Food Science and Technology,2021,37(6):276−286. [18] 郭建华, 刘冀, 郭宏文, 等. 白酒酒醅中纤维素酶产生菌的产酶活力与其生理生化特性的研究[J]. 食品工业科技,2013,34(5):177−180. [GUO J H, LIU J, GUO H W, et al. Study on cellulase activity production and physiological and biochemical characteristics of cellulase producing bacteria isolated from wine fermented grains[J]. Science and Technology of Food Industry,2013,34(5):177−180. [19] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1-2):248−254. doi: 10.1016/0003-2697(76)90527-3
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[21] VALIEV A, OGEL Z B, KLEPZIG K D. Analysis of cellulase and polyphenol oxidase production by southern pine beetle associated fungi[J]. Symbiosis,2009,49(1):37−42. doi: 10.1007/s13199-009-0007-0
[22] 吕嘉枥, 杨柳青, 孟雁南. 茯砖茶中金花菌群的研究进展[J]. 食品科学,2020,41(9):316−322. [LV J L, YANG L Q, MENG Y N. Development of golden flower fungus community in fuzhuan brick tea: A review[J]. Food Science,2020,41(9):316−322. doi: 10.7506/spkx1002-6630-20190423-320 [23] 赵仁亮, 胥伟, 吴丹, 等. 基于Illumina MiSeq 技术分析不同地域加工的茯砖茶中微生物群落多样性[J]. 生态学杂志,2017,36(7):1865−1876. [ZHAO R L, XU W, WU D, et al. Microbial community diversity of Fu brick tea produced in different regions by Illumina MiSeq technology[J]. Chinese Journal of Ecology,2017,36(7):1865−1876. [24] GAUR I, SHARMA P D, PUAL P K. Effect of Klebsiella pneumoniae on speck disease development in Solanum lycopersicum[J]. Indian Journal of Agricultural Research,2017,51(5):431−436.
[25] 黄俊, 王行国. Klebsiella sp. 601细菌漆酶的鉴定及性质[J]. 化学与生物工程,2006,23(3):31−34. [HUANG J, WANG X G. Laccase activity Klebsiella sp. 601 isolated from soil and its enzymatic properties[J]. Chemistry & Bioengineering,2006,23(3):31−34. doi: 10.3969/j.issn.1672-5425.2006.03.012 [26] 周才碧, 张敏星, 蒋陈凯, 等. 黑曲霉及其与普洱茶品质关系研究进展[J]. 微生物学杂志, 2014, 34(2): 88−91. ZHOU C B, ZHANG M X, JIANG C K, et al. Advanced in Aspergillus niger & its relationship with quality of Puer tea[J]. 2014, 34(2): 88−91.
[27] 冯玲然, 王强, 罗玮, 等. 普洱茶中转化茶多酚的优势菌株筛选与鉴定[J]. 食品与生物技术学报,2014,33(7):762−766. [FENG L R, WANG Q, LUO W, et al. Screening and identification of strains with tea polyphenols conversion activity in Puer tea samples[J]. Journal of Food Science and Biotechnology,2014,33(7):762−766. [28] 谢美华, 陈华红, 陈玉红, 等. 几种普洱茶发酵微生物对茶多酚代谢的初步研究[J]. 食品科技,2013,38(5):82−85. [XIE M H, CHEN H H, CHEN Y H, et al. A primary study on tea polyphenol metabolism of some fungi strains isolated from Puer tea[J]. Food Science and Technology,2013,38(5):82−85. [29] WANG Q P, GONG J S, CHISTI Y, et al. Fungal isolates from a Puerh type tea fermentation and their ability to convert tea polyphenols to theabrownins[J]. Journal of Food Science,2015,80(4):809−817. doi: 10.1111/1750-3841.12831
[30] 钱磊, 张业尼, 陈雪, 等. 大球盖菇漆酶的分离纯化及酶学性质研究[J]. 生物技术通报,2018,34(4):127−132. [QIAN L, ZHANG Y N, CHEN X, et al. Purification and enzymatic characterization of laccase from Stropharia rugosoannulata[J]. Biotechnology Bulletin,2018,34(4):127−132. [31] 陈琼华, 周玉萍, 陈晓, 等. 韦伯灵芝漆酶的分离纯化及其性质[J]. 食品科学,2010,31(5):201−205. [CHEN Q H, ZHOU Y P, CHEN X, et al. Purification and characterization of laccase from Ganoderma weberianum[J]. Food Science,2010,31(5):201−205. [32] 吴怡. 灵芝属漆酶高产菌株的筛选及其所产漆酶的纯化和性质分析[D]. 北京: 北京林业大学, 2020. WU Y. Screening of high-yielding laccase-producing strains from Ganoderma species and its laccase purification and feature characterization[D]. Beijing: Beijing Forestry University, 2020.
[33] 胡可欣, 李国英. 漆酶催化没食子酸改性胶原蛋白膜的研究[J]. 皮革科学与工程,2021,31(3):7−13. [HU K X, LI G Y. Modification of collagen membrane by laccase-catalyzed gallic acid[J]. Leather Science and Engineering,2021,31(3):7−13. [34] 王坤波. 茶黄素的酶促合成、分离鉴定及功能研究[D]. 长沙: 湖南农业大学, 2007. WANG K B. Enzymatic synthesis, purification, identification and bioactivity of theafiavins[D]. Changsha: Hunan Agricultural University, 2007.
-
期刊类型引用(3)
1. 王玉净,都治香,张霞,王旭,王娜. 沙棘黄酮通过调控TLR4/NF-κB信号通路改善大鼠多囊卵巢综合征的作用. 食品工业科技. 2024(16): 340-347 .  本站查看
本站查看
2. 王杰,常晨城,杨彦达,郭丽丽,张景萍,付绍印,石彩霞,张文广. 黄酮在反刍动物生产中的应用研究进展. 饲料研究. 2023(12): 144-147 .  百度学术
百度学术
3. 陈美庆,朱卫丰,管咏梅,冯育林,张艳丽,景秀村,彭万钱,欧阳辉,李琼. 基于UPLC-Q-TOF-MS/MS技术分析葛根配方颗粒的化学成分. 中国实验方剂学杂志. 2023(19): 176-186 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:
 下载:
下载:



