Effect of Ginsenoside Rb1 on the Disorder of Glucose and Lipid Metabolism in Type 2 Diabetic Mice
-
摘要: 目的:研究人参皂苷Rb1(Ginsenoside Rb1)对2型糖尿病大鼠糖脂代谢紊乱、氧化应激和炎症反应的影响。方法:采用高糖高脂饮食诱导,腹腔注射链脲佐菌素(Streptozotocin,STZ)构建2型糖尿病大鼠模型。大鼠随机分成空白对照组、模型组、人参皂苷Rb1高、中、低剂量组(45、30、15 mg/kg)和阳性对照组。实验期间记录大鼠体重变化,测定空腹血糖(FBG);给药8周后进行口服葡萄糖耐量实验(OGTT);测定大鼠血清糖脂代谢生化指标;采用酶联免疫法测定血清胰岛素(INS)并计算胰岛素抵抗指数(HOMA-IR)、肝脏组织中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)水平;测定大鼠血清及肝脏组织肿瘤坏死因子α(TNF-α)和白介素6(IL-6)水平。结果:与模型组相比,人参皂苷Rb1给药组均可不同程度降低模型大鼠空腹血糖值,显著降低胰岛素水平和胰岛素抵抗指数(P<0.05);中、高剂量组可以显著降低血清TC、TG、LDL-C含量,HDL-C含量极显著增多(P<0.01);肝脏指标异常程度明显缓解,ALT、AST含量明显下降,有效降低MDA水平,CAT、SOD和GSH-Px活性明显增强;促炎因子TNF-α和IL-6含量极显著减少(P<0.01)。结论:人参皂苷Rb1可有效调节2糖尿病大鼠血清血脂水平紊乱,改善胰岛素抵抗,增强机体抗氧化能力,降低炎症反应,以中、高剂量为佳。Abstract: Objective: To study the effects of ginsenoside Rb1 on glucose and lipid metabolism disorder, oxidative stress and inflammatory reaction in type 2 diabetic rats. Methods: The rat model of type 2 diabetes was induced by high glucose and high fat diet and intraperitoneal injection of streptozotocin (STZ). Rats were randomly divided into blank control group, model group, ginsenoside Rb1 high, medium and low dose groups (45, 30 and 15 mg/kg) and positive control group. During the experiment, the changes of body weight and fasting blood glucose (FBG) were recorded; Oral glucose tolerance test (OGTT) was performed 8 weeks after administration. The serum insulin (INS), HOMA-IR, MDA, SOD, GSH-Px and CAT in liver tissue were measured by enzyme-linked immunosorbent assay (ELISA), and tumor necrosis factor α (TNF-α ) and interleukin-6 (IL-6) levels in serum and liver tissue were measured. Results: Compared with the model group, ginsenoside Rb1 group could reduce the fasting blood glucose, insulin level and insulin resistance index (P<0.05); The contents of TC, TG and LDL-C in serum were significantly decreased and the content of HDL-C was significantly increased in middle and high dose groups (P<0.01). The abnormal degree of liver index was significantly relieved, the content of ALT and AST decreased significantly, the level of MDA decreased effectively, and the activities of CAT, SOD and GSH-Px increased significantly. Proinflammatory factor TNF-α and IL-6 levels were significantly decreased (P<0.01). Conclusion: Ginsenoside Rb1 can effectively regulate the disorder of serum and lipid level, improve insulin resistance, enhance the body's antioxidant capacity, and reduce inflammation in 2-diabetic rats, with medium and high doses as the best.
-
2型糖尿病(T2DM)属于非胰岛素依赖型糖尿病(NIDDM),以高血糖、胰岛素抵抗、低级别炎症为主要特征,是一种影响糖、脂、蛋白质代谢的慢性代谢性疾病[1-3],这种慢性代谢性疾病被认为是由遗传和环境的交互作用引起的。目前,糖尿病的治疗手段主要以口服降糖药物或注射胰岛素为主的西药治疗[4],用于治疗T2DM的药物有:胰岛素、双胍类、胰高血糖素样肽(GLP-1)、磺脲类、噻唑烷二酮类等[5-7]。目前上述各类药物在使用过程中均有不良反应的报道。而中医药改善T2DM具有疗效显著、不良反应小等优点,目前已成为T2DM治疗领域的研究热点。
近年来发现的具有改善胰岛素抵抗(IR)作用的中药活性成分有萜类、黄酮类、生物碱类、多糖核苷类等,它们可通过抑制氧化应激、抵抗炎症反应、促进葡萄糖转运等多种方式降低血糖,缓解T2DM胰岛素抵抗的症状。人参包含有30多种皂苷,其中人参皂苷Rb1(Ginsenoside Rb1)被认为是人参中最丰富和最重要的四环三萜类皂苷,其对心血管系统、内分泌系统、神经系统等有明显的作用效果[8]。张志良等[9]研究发现人参皂苷Rb1可以显著改善糖尿病大鼠心肌细胞的凋亡,改善糖尿病心肌病的预后。赵丹丹等[10]通过构建肥胖模型小鼠,研究发现人参皂苷Rb1能通过激活骨骼肌AMPK信号通路相关蛋白,达到减轻肥胖小鼠体质量并降低血脂水平的目的。近年来一系列的细胞和动物实验证明人参皂苷Rb1具有降糖和胰岛素增敏作用[11-12]。但人参皂苷Rb1改善T2DM氧化应激和炎症因子表达的作用目前还没有系统的研究。本实验主要研究G-Rb1对T2DM大鼠糖脂代谢紊乱、氧化应激和促炎因子的影响,以期为糖尿病的治疗提供参考数据。
1. 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 48只,体重(200±20)g,动物实验在齐齐哈尔医学院实验动物中心进行,动物饲养许可证(SYXK(黑)2016-001),在温度(22±2)℃、湿度35%自动空气清洁设备条件下饲养,整个实验期间自由饮水摄食,适应性饲养1周,昼夜节律正常;人参皂苷Rb1(含量>98%) 索莱宝科技有限公司;链脲佐菌素(STZ) Osharp公司;二甲双胍(0.5 g/片) 施贵宝制药有限公司;血清生化检测指标试剂盒、ELISA检测试剂盒 南京建成生物科技有限公司。
580/590血糖测定仪及其配套的血糖试纸 江苏鱼跃医疗设备股份有限公司;754 紫外可见分光光度计 上海光谱仪器有限公司;Infinite M Plex多功能微孔检测酶标仪 瑞士Tecan公司;MS200多管涡旋震荡仪 杭州瑞成仪器有限公司;Centrifuge 5424R小型高速冷冻离心机 德国艾本德股份公司。
1.2 实验方法
1.2.1 动物分组及T2DM大鼠模型的建立
48只SPF级雄性SD大鼠进行1周适应生活后,随机分为对照组(NC,n=8)和高脂高糖饮食组(n=40),每8只相同组的小鼠被单独关在一个笼子里。高脂饲料喂养4周后,禁食1晚(12 h),腹腔注射链脲佐菌素,剂量为35 mg/(kg·bw)[13-14];对照组大鼠注射相同体积的缓冲液。STZ注射5 d后,禁食不禁水12 h后,空腹血糖水平超过11.1 mmol/L被确诊2型糖尿病(T2DM)模型,随机分为5组(每组n=8):2型糖尿病模型组(MD);人参皂苷Rb1高剂量给药组(Rb1-H);人参皂苷Rb1中剂量给药组(Rb1-M);人参皂苷Rb1低剂量给药组(Rb1-L);二甲双胍对照组(MET)。治疗组每日灌胃1次,Rb1-L组、Rb1-M组和Rb1-H组给药剂量分别为15、30、45 mg/(kg·bw)[11],二甲双胍对照组每日灌胃1次45 mg/(kg·bw)的二甲双胍,连续给药8周。
1.2.2 大鼠体重及血糖的测定
在SD大鼠造模前、造模后及给药第8周测定一次大鼠体质量。在造模后及第8周给药结束后测定空腹血糖(FBG),禁食不禁水12 h,尾尖采血[15],测定FBG值并记录。给大鼠灌胃葡萄糖溶液2.00 g/(kg·bw),于0、0.5、1、2 h测定血糖值,进行糖耐量(OGTT)检测并绘制血糖-时间变化曲线,计算血糖曲线下面积(AUC)[16]。
1.2.3 大鼠血清胰岛素(INS)测定及胰岛素抵抗指数(HOMA-IR)测定
采用酶联免疫吸附(ELISA)法严格按照试剂盒进行操作测定INS,并计算胰岛素抵抗指数:HOMA-IR=FBG×INS/22.5[17]。
1.2.4 血清指标及肝功能指标的测定
第8周给药结束后,收集大鼠全血,离心后取血清,测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)和谷草转氨酶(AST),检测严格按照试剂盒说明书进行操作。
1.2.5 肝脏组织氧化应激水平测定
末次给药后,快速解剖后取肝脏组织在冰上剪碎,制备10%肝脏匀浆,按照1 g肝脏组织加入9 mL生理盐水配置,放入匀浆器中制备,保存备用。氧化应激相关指标丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)应用酶标仪进行检测,测定过程严格按照说明书进行。
1.2.6 血清及肝脏组织促炎因子测定
末次给药后采集血清样本及制备肝脏匀浆,按照试剂盒说明,应用酶标仪进行血清和肝脏促炎因子白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的测定。
解剖后,按照试剂盒说明书快速提取肝脏组织总RNA,逆转录合成cDNA,应用实时定量PCR(real-time PCR)仪测定IL-6和TNF-α表达量。引物序列如下:TNF-α,F:5′-AGGGAATTGTGGCTCTGGT-3′,R:5′-AGGCCACTACTTCAGCGTCT-3′,扩增片段为190 bp;IL-6,F:5′-ATTCTGTCTCGAGCCCACCA-3′,R:5′-AGGCAACTGGCTGGAAGTCT-3′,扩增片段为133 bp;GAPDH,F:5′-GACAAGATGGTGAACTGTCGGT-3′,R:5′-CTTTGGCATCGTGGAAGGGCTC-3′,扩增片段为108 bp。扩增条件为95 ℃预变性2 min,95 ℃变性30 s,58 ℃退火30 s、72 ℃延伸30 s,共进行38个循环[18]。
1.3 统计分析
采用SPSS20.0统计学软件对研究数据进行统计分析,数据以“平均值±标准偏差”表示,单因素方差分析与Tukey多重比较检验比较组间差异,P<0.05为差异具有统计学意义。
2. 结果与分析
2.1 不同处理大鼠体重的变化
造模前,各组大鼠适应性喂养一周,平均体重在180.51~187.45 g之间,各组间大鼠体重没有统计学差异(P>0.05);对照组(NC)大鼠一般性喂养,模型组(MD)、二甲双胍组(MET)和人参皂苷Rb1-L、Rb1-M、Rb1-H组高脂饲料喂养4周后,给予STZ注射造模后,各组大鼠体重均极显著高于NC组(P<0.01);连续给药8周后,NC组大鼠体重保持一定增长,糖尿病模型造模成功后,模型组的大鼠出现T2DM体重减轻临床表现,大鼠体重极显著低于NC组(P<0.01);对比MD组,MET、Rb1-M、Rb1-H组大鼠体重减轻缓慢,体重极显著高于MD组(P<0.01),Rb1-L组大鼠体重显著低于MET组(P<0.05),与MD组对比没有统计学差异(P>0.05),结果见表1。
表 1 人参皂苷Rb1对T2DM模型大鼠体重的影响Table 1. Effect of ginsenoside Rb1 on body weight of T2DM model rats组别 体重(g) 造模前 造模后 给药后 NC 186.47±11.31 348.32±11.12 471.67±14.67 MD 185.03±14.45 403.76±15.38** 366.67±16.48** MET 182.61±8.15 397.33±13.61** 413.86±14.58**ΔΔ Rb1-L 180.51±12.71 397.58±14.68** 387.86±13.29**# Rb1-M 183.35±11.90 404.97±14.04** 409.48±18.66**ΔΔ Rb1-H 187.45±14.34 404.62±11.21** 394.97±12.56**ΔΔ 注:与正常组比较,**P<0.01,与模型组比较,ΔΔP<0.01,与盐酸二甲双胍组比较,#P<0.05,##P<0.01;表3、表4同。 2.2 人参皂苷Rb1对T2DM大鼠血糖的影响
空腹血糖能够反应糖尿病患者的基本胰岛功能,空腹血糖高于11.1 mmol/L 则被诊断为糖尿病;葡萄糖耐量实验则可以很好地反应出机体对血糖的调节能力以及胰岛β细胞的功能情况。人参多种活性物质均已被证实具有降低血糖、改善葡萄糖耐量的作用,其作用机制涉及糖脂代谢途径多个方面[18-20]。由表2可知,STZ注射造模后,模型组大鼠空腹血糖均大于11.1 mmol/L,说明造模成功。连续给药后,对比MD组,Rb1-L、Rb1-M、Rb1-H组大鼠的FBG值均极显著降低(P<0.01),其中,Rb1-L、Rb1-M和Rb1-H组其降糖效应与化学药物盐酸二甲双胍基本相当,人参皂苷高、中低剂量组的大鼠OGTT 0.5、1.0、2.0 h血糖值及AUC均明显降低(P<0.01),与MET组间没有统计学差异(P>0.05)。
表 2 人参皂苷Rb1对大鼠FBG、OGTT及AUC的影响Table 2. Effects of ginsenoside Rb1 on FBG, OGTT and AUC of rats组别 FBG(mmol/L) OGTT(mmol/L) AUC 造模后 给药后
(0 h)0.5 h 1.0 h 2.0 h NC 5.37±0.74 5.63±0.82 10.05±1.31 7.29±1.02 5.58±1.08 17.54±1.49 MD 21.04±1.96** 23.56±2.69** 30.70±2.85** 26.65±2.08** 23.69±2.06** 64.92±2.85** MET 20.68±2.11 15.93±3.12ΔΔ 22.91±3.18ΔΔ 18.78±2.40ΔΔ 16.20±2.92ΔΔ 45.72±4.89ΔΔ Rb1-L 21.95±1.47 17.50±4.26ΔΔ 23.80±2.84ΔΔ 21.34±1.76ΔΔ 17.99±2.38ΔΔ 50.28±5.14ΔΔ Rb1-M 19.78±3.57 15.03±2.71ΔΔ 19.61±3.13ΔΔ 17.73±3.26ΔΔ 15.26±3.11ΔΔ 42.12±5.67ΔΔ Rb1-H 19.59±2.40 14.60±2.79ΔΔ 19.01±2.20ΔΔ 16.71±2.36ΔΔ 14.84±2.51ΔΔ 40.53±4.71ΔΔ 注:模型组与正常组比较,**P<0.01;与模型组比较,ΔΔP<0.01。 2.3 人参皂苷Rb1对T2DM大鼠INS、HOMA-IR的影响
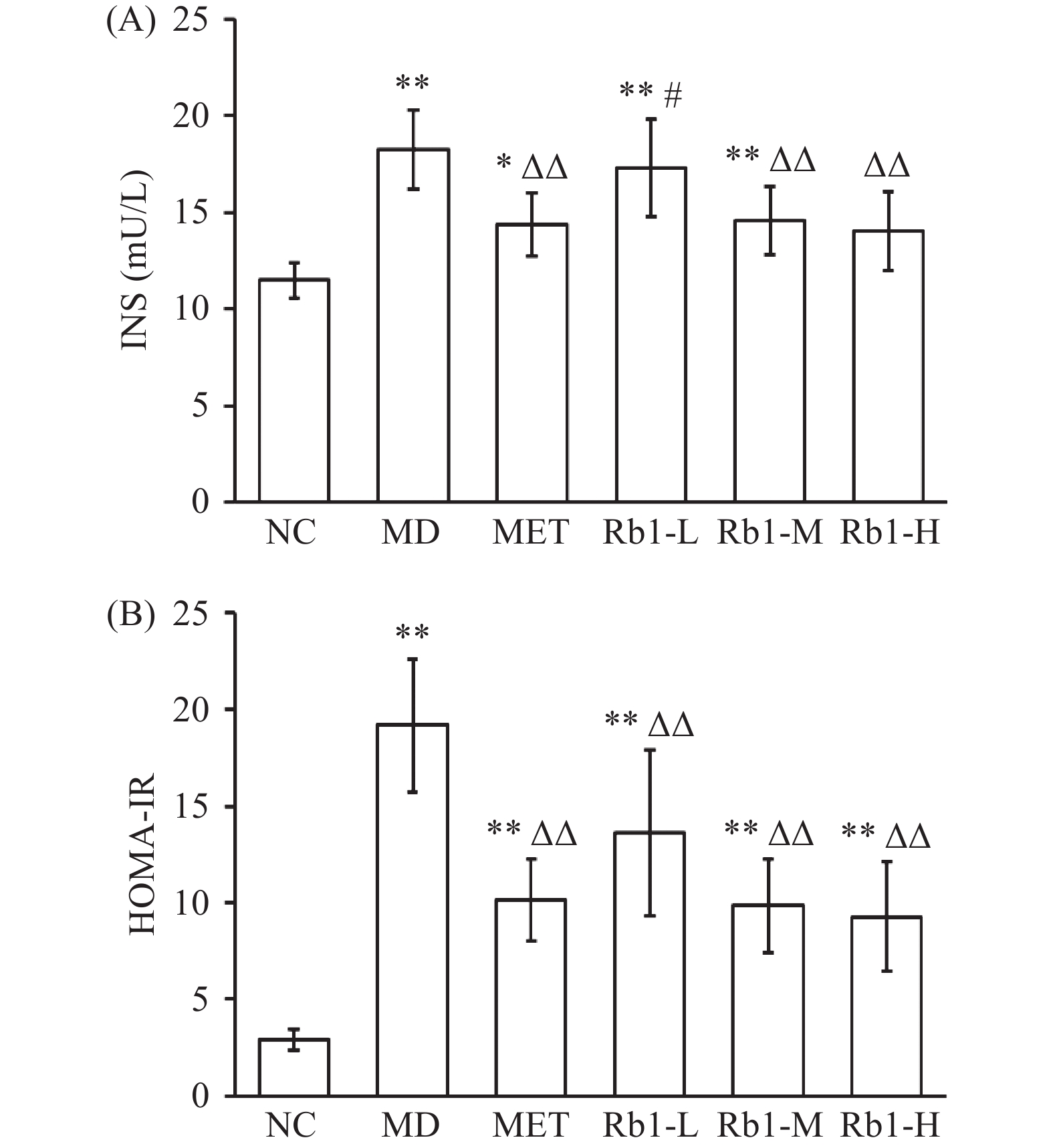
胰岛功能受损和胰岛素抵抗是2型糖尿病主要病理学特征之一,尚文斌等[21]研究指出,人参皂苷Rb1可以显著改善糖尿病小鼠的胰岛素敏感性指数,并且能够增加脂肪细胞葡萄糖的消耗利用,对血糖降低具有一定的作用。
本研究结果显示(见图1),与NC组相比,MD组大鼠的血清胰岛素水平、胰岛素抵抗指数均极显著增高(P<0.01);与MD相比,Rb1-L胰岛素水平没有统计学差异(P>0.05),Rb1-M和Rb1-H组胰岛素、胰岛素抵抗指数均极显著降低(P<0.01);与MET组相比,Rb1-M和Rb1-H胰岛素水平没有统计学差异(P>0.05),而Rb1-L胰岛素水平显著高于MET组(P<0.05)。HOMA-IR不同给药组间没有统计学差异(P>0.05),与MD组比较HOMA-IR极显著降低(P<0.01)。结果显示人参皂苷Rb1可以显著改善糖尿病小鼠的胰岛素分泌水平,并有效降低胰岛素抵抗指数。
![]() 图 1 人参皂苷Rb1对血清胰岛素、胰岛素抵抗指数的影响注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,ΔP<0.05,ΔΔP<0.01;与盐酸二甲双胍组比较,#P<0.05,##P<0.01;图2同。Figure 1. Effect of ginsenoside Rb1 on serum insulin and insulin resistance index of rats
图 1 人参皂苷Rb1对血清胰岛素、胰岛素抵抗指数的影响注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,ΔP<0.05,ΔΔP<0.01;与盐酸二甲双胍组比较,#P<0.05,##P<0.01;图2同。Figure 1. Effect of ginsenoside Rb1 on serum insulin and insulin resistance index of rats2.4 人参皂苷Rb1对T2DM大鼠血清血脂及肝功能指标的影响
2型糖尿病患者大多数是肥胖人群,并且伴有机体糖脂代谢的紊乱,血液中除血糖会升高外,甘油三酯、胆固醇及低密度脂蛋白含量均会显著升高,而起保护作用的高密度脂蛋白浓度下降。过多的脂肪积累不仅会诱发糖尿病的发生,也会导致肝脏损伤的发生[22-23]。临床上常将AST和ALT作为评价肝功能的联合检测指标。LIU等[24]研究结果表明人参皂苷Rg1能够有效降低高脂饮食诱导的肥胖小鼠模型总胆固醇、总甘油三酯含量,通过诱导AMPK活化减少脂质沉积达到保护肝脏的作用。
本研究结果表明,与NC组相比,模型组TC、TG、LDL-C含量和ALT、AST活性极显著增高(P<0.01),HDL-C含量极显著减少(P<0.01),说明模型组大鼠出现脂代谢异常;与MD组相比,人参皂苷Rb1各给药组TC和TG含量显著降低(P<0.05),ALT、AST活性极显著降低(P<0.01),HDL-C含量显著增多(P<0.05),Rb1-L组LDL-C的含量与MD组没有统计学差异(P>0.05);与MET组对比,Rb1-L组TC和ALT、AST活性显著高于MET组(P<0.05),HDL-C含量极显著低于MET组(P<0.01)。结果提示人参皂苷Rb1能够有效改善糖尿病大鼠脂代谢异常,与曹萌[25]研究结果一致。并且中、高剂量给药组改善效果优于低剂量给药组,结果见表3。
表 3 人参皂苷Rb1对大鼠血清生化指标的影响Table 3. Effects of ginsenoside Rb1 on serum biochemical indexes of rats组别 TC
(mmol/L)TG
(mmol/L)LDL-C(mmol/L) HDL-C(mmol/L) ALT
(U/L)AST
(U/L)NC 1.77±0.29 0.47±0.11 0.42±0.10 1.39±0.14 35.90±8.40 51.15±8.26 MD 4.27±0.66** 1.14±0.22**ΔΔ 0.84±0.14** 0.57±0.10** 71.30±7.64** 128.07±15.05** MET 2.16±0.54ΔΔ 0.64±0.12ΔΔ 0.59±0.14ΔΔ 1.13±0.18**ΔΔ 55.10±6.96ΔΔ 64.96±9.55*ΔΔ Rb1-L 3.30±0.66**Δ# 0.76±0.17**ΔΔ 0.70±0.14** 0.78±0.12**Δ## 61.13±8.85**ΔΔ## 92.68±13.64**ΔΔ## Rb1-M 2.80±0.84*ΔΔ 0.68±0.16ΔΔ 0.51±0.11ΔΔ 0.93±0.12**ΔΔ# 54.52±12.75**ΔΔ 76.76±14.11**ΔΔ Rb1-H 2.34±0.69ΔΔ 0.71±0.14*ΔΔ 0.49±0.12ΔΔ 1.03±0.14**ΔΔ 55.78±8.50**ΔΔ 75.74±9.21**ΔΔ 2.5 人参皂苷Rb1对T2DM大鼠氧化应激水平的影响
相关研究表明通过调节氧化应激通路中的相关分子可以改善胰岛细胞的功能,促进葡萄糖的代谢,减少对肝组织的损伤[26-27]。研究发现T2DM患者体内MDA含量增多、SOD活性减弱,氧化应激升高[28],同时体内氧化应激反应的有效抑制可以减轻糖尿病病症。
由表4可知,与NC组相比,MD组MDA水平极显著增高(P<0.01);CAT、SOD和GSH-Px水平极显著降低(P<0.01);与MD组相比,各给药组MDA水平极显著降低(P<0.01),SOD活力极显著升高(P<0.01),Rb1-M和Rb1-H组CAT和GSH-Px活性极显著升高(P<0.01),Rb1-L组与MD组没有统计学差异(P>0.05)。与MET组相比,Rb1-L组MDA水平极显著高于MET组(P<0.01),CAT、SOD和GSH-Px活性不同给药组间无统计学差异(P>0.05)。结果提示,人参皂苷Rb1中、高剂量给药组对降低大鼠氧化应激反应的作用优于低剂量给药组,表明人参皂苷Rb1能够抑制T2DM大鼠氧化应激反应,起到保护作用。
表 4 人参皂苷Rb1对大鼠氧化应激水平的影响Table 4. Effects of ginsenoside Rb1 on oxidative stress of rats组别 MDA(nmol/mL) CAT(U/mL) SOD(U/mL) GSH-Px (U/mL) NC 5.62±1.28 4.63±0.76 167.13±14.23 899.93±73.33 MD 11.79±1.73** 1.85±0.81** 118.61±16.78** 516.01±76.37** MET 6.67±0.91ΔΔ 3.31±0.61**ΔΔ 142.26±11.06**ΔΔ 669.67±87.66**ΔΔ Rb1-L 9.22±0.85**ΔΔ## 2.48±0.57** 148.37±13.69ΔΔ 598.88±87.33** Rb1-M 6.81±1.37ΔΔ 4.21±0.36ΔΔ 152.06±14.02ΔΔ 749.55±89.99*ΔΔ Rb1-H 6.02±1.49ΔΔ 3.47±0.61**ΔΔ 155.38±7.25ΔΔ 692.71±95.64**ΔΔ 2.6 人参皂苷Rb1对T2DM大鼠血清和肝脏IL-6,TNF-α的影响
本研究分别应用ELISA法测定了血清及肝脏组织促炎因子IL-6、TNF-α的含量(如图2),并应用real-time PCR法检测了肝脏组织两种炎症因子的mRNA表达水平。ELISA法研究结果发现,与NC组相比,MD组血清和肝脏中IL-6、TNF-α极显著升高(P<0.01);与MD组相比,Rb1-M和Rb1-H组血清和肝脏中IL-6、TNF-α极显著降低(P<0.01),Rb1-L组血清TNF-α和肝脏IL-6、TNF-α与MD组间没有统计学差异(P>0.05);与MET组相比,Rb1-L组血清IL-6、TNF-α及肝脏TNF-α显著高于MET组(P<0.05),Rb1-M和Rb1-H组与MET组间无统计学差异(P>0.05)。结果提示,人参皂苷Rb1低剂量给药对血清促炎因子指标作用不明显,中、高剂量给药药效与二甲双胍相近。Real-time PCR法检测结果与ELISA法相近,其中与MD组相比,人参皂苷给药组均能显著降低肝脏中IL-6、TNF-α表达水平(P<0.05)。
TNF-α和IL-6是由多种炎症细胞合成并分泌的炎症因子。T2DM主要特征中包括慢性低级别炎症,也是产生胰岛素抵抗的主要发生机制。相关研究[29-30]均表明降低血清中TNF-α、IL-6的水平,可以降低胰岛素抵抗。结合以上结果发现人参皂苷Rb1能够减轻炎症反应,并降低胰岛素抵抗。
3. 结论
本实验采用高糖高脂饮食诱导,腹腔注射链脲佐菌素(Streptozotocin,STZ)构建2型糖尿病大鼠模型。研究人参皂苷Rb1对2型糖尿病大鼠的影响。结果表明人参皂苷Rb1可以有效地缓解T2DM大鼠体重减轻的症状,在实验中,经过人参皂苷Rb1中、高剂量治疗后,可显著改善大鼠糖脂代谢异常,能够显著降低T2DM大鼠空腹血糖水平,提高葡萄糖耐量能力并有效改善胰岛素抵抗;显著降低血清TG、TC和LDL-C含量,提高HDL-C含量;人参皂苷Rb1给药可缓解大鼠肝功能损伤,有效降低血清ALT和AST水平;能够有效抑制氧化应激反应,显著降低大鼠肝脏MDA水平,上调CAT、SOD和GSH-Px活性;同时可以降低大鼠血清及肝脏组织中炎症因子TNF-α和IL-6的含量,揭示人参皂苷Rb1具有良好的抗氧化及抗炎活性。
总体来说,人参皂苷Rb1对改善2型糖尿病大鼠糖脂代谢异常、抑制氧化应激反应、降低炎症反应具有一定的治疗效果,并以中、高剂量为佳。但其具体的降糖机制并未通过分子水平进行深入研究,未来应针对具体降糖机制进行重点研究,为人参皂苷Rb1的开发和利用提供实验依据。
-
图 1 人参皂苷Rb1对血清胰岛素、胰岛素抵抗指数的影响
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,ΔP<0.05,ΔΔP<0.01;与盐酸二甲双胍组比较,#P<0.05,##P<0.01;图2同。
Figure 1. Effect of ginsenoside Rb1 on serum insulin and insulin resistance index of rats
表 1 人参皂苷Rb1对T2DM模型大鼠体重的影响
Table 1 Effect of ginsenoside Rb1 on body weight of T2DM model rats
组别 体重(g) 造模前 造模后 给药后 NC 186.47±11.31 348.32±11.12 471.67±14.67 MD 185.03±14.45 403.76±15.38** 366.67±16.48** MET 182.61±8.15 397.33±13.61** 413.86±14.58**ΔΔ Rb1-L 180.51±12.71 397.58±14.68** 387.86±13.29**# Rb1-M 183.35±11.90 404.97±14.04** 409.48±18.66**ΔΔ Rb1-H 187.45±14.34 404.62±11.21** 394.97±12.56**ΔΔ 注:与正常组比较,**P<0.01,与模型组比较,ΔΔP<0.01,与盐酸二甲双胍组比较,#P<0.05,##P<0.01;表3、表4同。 表 2 人参皂苷Rb1对大鼠FBG、OGTT及AUC的影响
Table 2 Effects of ginsenoside Rb1 on FBG, OGTT and AUC of rats
组别 FBG(mmol/L) OGTT(mmol/L) AUC 造模后 给药后
(0 h)0.5 h 1.0 h 2.0 h NC 5.37±0.74 5.63±0.82 10.05±1.31 7.29±1.02 5.58±1.08 17.54±1.49 MD 21.04±1.96** 23.56±2.69** 30.70±2.85** 26.65±2.08** 23.69±2.06** 64.92±2.85** MET 20.68±2.11 15.93±3.12ΔΔ 22.91±3.18ΔΔ 18.78±2.40ΔΔ 16.20±2.92ΔΔ 45.72±4.89ΔΔ Rb1-L 21.95±1.47 17.50±4.26ΔΔ 23.80±2.84ΔΔ 21.34±1.76ΔΔ 17.99±2.38ΔΔ 50.28±5.14ΔΔ Rb1-M 19.78±3.57 15.03±2.71ΔΔ 19.61±3.13ΔΔ 17.73±3.26ΔΔ 15.26±3.11ΔΔ 42.12±5.67ΔΔ Rb1-H 19.59±2.40 14.60±2.79ΔΔ 19.01±2.20ΔΔ 16.71±2.36ΔΔ 14.84±2.51ΔΔ 40.53±4.71ΔΔ 注:模型组与正常组比较,**P<0.01;与模型组比较,ΔΔP<0.01。 表 3 人参皂苷Rb1对大鼠血清生化指标的影响
Table 3 Effects of ginsenoside Rb1 on serum biochemical indexes of rats
组别 TC
(mmol/L)TG
(mmol/L)LDL-C(mmol/L) HDL-C(mmol/L) ALT
(U/L)AST
(U/L)NC 1.77±0.29 0.47±0.11 0.42±0.10 1.39±0.14 35.90±8.40 51.15±8.26 MD 4.27±0.66** 1.14±0.22**ΔΔ 0.84±0.14** 0.57±0.10** 71.30±7.64** 128.07±15.05** MET 2.16±0.54ΔΔ 0.64±0.12ΔΔ 0.59±0.14ΔΔ 1.13±0.18**ΔΔ 55.10±6.96ΔΔ 64.96±9.55*ΔΔ Rb1-L 3.30±0.66**Δ# 0.76±0.17**ΔΔ 0.70±0.14** 0.78±0.12**Δ## 61.13±8.85**ΔΔ## 92.68±13.64**ΔΔ## Rb1-M 2.80±0.84*ΔΔ 0.68±0.16ΔΔ 0.51±0.11ΔΔ 0.93±0.12**ΔΔ# 54.52±12.75**ΔΔ 76.76±14.11**ΔΔ Rb1-H 2.34±0.69ΔΔ 0.71±0.14*ΔΔ 0.49±0.12ΔΔ 1.03±0.14**ΔΔ 55.78±8.50**ΔΔ 75.74±9.21**ΔΔ 表 4 人参皂苷Rb1对大鼠氧化应激水平的影响
Table 4 Effects of ginsenoside Rb1 on oxidative stress of rats
组别 MDA(nmol/mL) CAT(U/mL) SOD(U/mL) GSH-Px (U/mL) NC 5.62±1.28 4.63±0.76 167.13±14.23 899.93±73.33 MD 11.79±1.73** 1.85±0.81** 118.61±16.78** 516.01±76.37** MET 6.67±0.91ΔΔ 3.31±0.61**ΔΔ 142.26±11.06**ΔΔ 669.67±87.66**ΔΔ Rb1-L 9.22±0.85**ΔΔ## 2.48±0.57** 148.37±13.69ΔΔ 598.88±87.33** Rb1-M 6.81±1.37ΔΔ 4.21±0.36ΔΔ 152.06±14.02ΔΔ 749.55±89.99*ΔΔ Rb1-H 6.02±1.49ΔΔ 3.47±0.61**ΔΔ 155.38±7.25ΔΔ 692.71±95.64**ΔΔ -
[1] SABICO S, AL-MASHHARAWI A, AL-DAGHRI N M, et al. Effects of a 6-month multi-strain probiotics supplementation in endotoxemic, inflammatory and cardiometabolic status of T2DM patients: A randomized, double-blind, placebo-controlled trial[J]. Clinical Nutrition (Edinburgh, Scotland),2019,38(4):1561−1569. doi: 10.1016/j.clnu.2018.08.009
[2] SENTHILKUMAR G P, ANITHALEKSHMI M S, YASIR M, et al. Role of omentin 1 and IL-6 in type 2 diabetes mellitus patients with diabetic nephropathy[J]. Diabetes & Metabolic Syndrome,2018,12(1):23−26.
[3] HU Z, YANG M, LIU Y, et al. Effect of Huang-Lian Jie-Du decoction on glucose and lipid metabolism in type 2 diabetes mellitus: A systematic review and meta-analysis[J]. Frontiers in Pharmacology,2021,12:648861. doi: 10.3389/fphar.2021.648861
[4] 田霖林. 血糖控制不佳的2型糖尿病患者加用利拉鲁肽疗效及安全性的临床观察[D]. 长春: 吉林大学, 2016. TIAN Linlin. Clinical observation of liraglutide efficacy and safety in patients with poor glycemic controlled type 2 diabetes[D]. Changchun: Jilin University, 2016.
[5] CHEN W, WANG J, LUO Y, et al. Ginsenoside Rb1 and compound K improve insulin signaling and inhibit ER stress-associated NLRP3 inflammasome activation in adipose tissue[J]. Journal of Ginseng Research,2016,40(4):351−358. doi: 10.1016/j.jgr.2015.11.002
[6] QIU Z, DONG J, XUE C, et al. Liuwei Dihuang Pills alleviate the polycystic ovary syndrome with improved insulin sensitivity through PI3K/Akt signaling pathway[J]. Journal of Ethnopharmacology,2020,250:111965. doi: 10.1016/j.jep.2019.111965
[7] MA S, LIANG W, YANG H, et al. Emerging technologies to achieve oral delivery of GLP-1 and GLP-1 analogs for treatment of type 2 diabetes mellitus (T2DM)[J]. Canadian Journal of Biotechnology,2017,1(1):1−10. doi: 10.24870/cjb.2017-000107
[8] 黄妍丽. 人参皂苷Rb1对代谢综合征小鼠糖脂代谢的干预作用及机理研究[D]. 广州: 暨南大学, 2015. HANG Yanli. Effect of ginsenoside Rb1 on modulating the glycolipid metabolism in a murine model of metabolic syndrome and its mechanism[D]. Guangzhou: Jinan University, 2015.
[9] 张志良, 王嘉睿, 赵云跃, 等. 人参皂苷Rb1对糖尿病大鼠心脏功能和心肌细胞凋亡的影响[J]. 热带医学杂志,2021,21(3):261−265,275,393. [ZHANG Zhiliang, WANG Jiarui, ZHAO Yunyue, et al. The effects of ginsenoside Rb1 on cardiac function and cardiocyte apoptosis in diabetes rat[J]. Trop Med,2021,21(3):261−265,275,393. doi: 10.3969/j.issn.1672-3619.2021.03.002 [10] 赵丹丹, 白颖, 吴瑞, 等. 人参皂苷Rb1对肥胖小鼠骨骼肌胰岛素抵抗及AMPK信号通路的影响[J]. 世界中医药,2019,14(4):852−858. [ZHAO Dandan, BAI Ying, WU Rui, et al. Effects of ginsenoside Rb1 on insulin resistance and AMPK signal pathway of muscular tissues of obese mice[J]. World Chinese Medicine,2019,14(4):852−858. doi: 10.3969/j.issn.1673-7202.2019.04.013 [11] 庞博. 人参皂苷Rb1保护糖尿病大鼠心肌损伤的尿液代谢组学研究[D]. 长春: 吉林大学, 2017 PANG Bo. A metabonomics research on the myocardial protective effect of ginsenoside Rb1 treated diabetic rats[D]. Changchun: Jilin University, 2017.
[12] 王嘉睿, 李苏华, 罗艳婷, 等. SIRT1/NF-κB 通路在人参皂苷Rb1 对高糖处理的H9C2 细胞凋亡与炎症反应作用的研究[J]. 新医学,2019,50(4):61−67. [WANG Jiarui, LI Suhua, LUO Yanting, et al. Role of SIRT1/NF-κB pathway in the effect of ginsenoside Rb1 on apoptosis and inflammation of H9C2 cells treated with high glucose[J]. Journal of New Medicine,2019,50(4):61−67. [13] MCAB C, DAN X A, WEN L A, et al. Intake of Ganoderma lucidum polysaccharides reverses the disturbed gut microbiota and metabolism in type 2 diabetic rats[J]. International Journal of Biological Macromolecules,2020,155:890−902. doi: 10.1016/j.ijbiomac.2019.11.047
[14] LIU G, JIA B, LI L, et al. Stachyose improves inflammation through modulating gut microbiota of high-fat diet/streptozotocin induced type 2 diabetes in rats[J]. Molecular Nutrition & Food Research,2018,62(6):1700954.
[15] LEE P S, TENG C Y, KALYANAM N, et al. Garcinol reduces obesity in high-fat-diet-fed mice by modulating gut microbiota composition[J]. Molecular Nutrition & Food Research,2019,63(2):e1800390.
[16] ZENG Z, YUAN Q, YU R, et al. Ameliorative effects of probiotic Lactobacillus paracasei NL41 on insulin sensitivity, oxidative stress, and beta-cell function in a type 2 diabetes mellitus rat model[J]. Molecular Nutrition & Food Research,2019,63(22):1900457.
[17] YAN S, SHI R, LI L, et al. Mannan oligosaccharide suppresses lipid accumulation and appetite in western-diet-induced obese mice via reshaping gut microbiome and enhancing short-chain fatty acids production[J]. Molecular Nutrition & Food Research,2019,63(23):1900521.
[18] 吴丽娜, 范晓萌, 武爽, 等. 人参皂苷Rg1调节氧化应激和炎症因子表达改善糖尿病大鼠周围神经损伤[J]. 中国免疫学杂志,2021,37(4):486−491. [WU Lina, FAN Xiaomeng, WU Shuang, et al. Ginsenoside Rg1 attenuates diabetic peripheral neuropathy in rats via antioxidant and anti-inflammatory mechanisms[J]. Chinese Journal of Immunology,2021,37(4):486−491. doi: 10.3969/j.issn.1000-484X.2021.04.020 [19] YANG D, LI X, FU Y, et al. Metabolic study of ginsenoside Rg3 and glimepiride in type 2 diabetic rats by liquid chromatography coupled with quadrupole-Orbitrap mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2021, 35(11): e9083.
[20] LIU Y, DENG J, FAN D. Ginsenoside Rk3 ameliorates high-fat-diet/streptozocin induced type 2 diabetes mellitus in mice via the AMPK/Akt signaling pathway[J]. Food & Function,2019,10(5):2538−2551.
[21] 尚文斌, 郭超, 赵娟, 等. 人参皂苷Rb1通过上调脂肪组织葡萄糖转运体促进葡萄糖消耗[J]. 中国中药杂志,2014,39(22):4448−4452. [SHANG Wenbin, GUO Chao, ZHAO Juan, et al. Ginsenoside Rb1 upregulates expressions of GLUTs to promote glucose consumption in adiopcytes[J]. China Journal of Chinese Materia Medica,2014,39(22):4448−4452. [22] ZHU Y, SU Y, ZHANG J, et al. Astragaloside IV alleviates liver injury in type 2 diabetes due to promotion of AMPK/mTOR mediated autophagy[J]. Molecular Medicine Reports, 2021, 23(6): 437.
[23] YANG L, ZHANG X, LIAO M, et al. Echinacoside improves liver injury by regulating the AMPK/SIRT1 signaling pathway in db/db mice[J]. Life Sciences,2021,271(1):119237.
[24] LIU H, WANG J, LIU M, et al. Antiobesity effects of ginsennoside Rg1 on 3T3-L1 preadipocytes and high fat diet induced obese mice mediated by AMPK[J]. J Nutrients,2018,10(7):830. doi: 10.3390/nu10070830
[25] 曹萌. 人参皂苷Rb1通过抑制JNK信号通路改善糖尿病大鼠肝脏糖脂代谢异常[J]. 中国免疫学杂志,2018,34(4):531−536, 548. [CAO Meng. Ginsenoside Rb1 ameliorates abnormal glucolipid metabolism of liver through inhibition of JNK signal pathway in diabetic rats[J]. Chinese Journal of Immunology,2018,34(4):531−536, 548. doi: 10.3969/j.issn.1000-484X.2018.04.011 [26] SASIDHARAKURUP H, DIWAKAR S. Computational modelling of TNFα related pathways regulated by neuroinflammation, oxidative stress and insulin resistance in neurodegeneration[J]. Applied Network Science,2020,5(1):72. doi: 10.1007/s41109-020-00307-w
[27] SUN B, JIA Y, YANG S, et al. Sodium butyrate protects against high-fat diet-induced oxidative stress in rat liver by promoting expression of nuclear factor E2-related factor 2[J]. British Journal of Nutrition,2019,122(4):1−29.
[28] PANAHI Y, KHALILI N, SAHEBI E, et al. Antioxidant effects of curcuminoids in patients with type 2 diabetes mellitus: A randomized controlled trial[J]. Inflammopharmacology,2017,25(1):25−31. doi: 10.1007/s10787-016-0301-4
[29] TIMPER K, DENSON J L, STECULORUM S M, et al. IL-6 improves energy and glucose homeostasis in obesity via enhanced central IL-6 trans-signaling[J]. Cell Reports,2017,19(2):267−280. doi: 10.1016/j.celrep.2017.03.043
[30] WEI X, YANG B, CHEN X, et al. Zanthoxylum alkylamides ameliorate protein metabolism in type 2 diabetes mellitus rats by regulating multiple signaling pathways[J]. Food & Function,2021,12(8):3740−3753.
-
期刊类型引用(7)
1. 刘冀黔,旦正杰,韩丽娟,桂林生,侯生珍,王志有,杨葆春. 不同月龄黑藏羊肉品质及风味评价分析. 饲料研究. 2024(13): 105-111 .  百度学术
百度学术
2. 宁舒娴,曾金秀,沙小梅,丁红秀. 不同生境来源的鳙鱼肉挥发性物质组成比较分析. 食品工业科技. 2024(18): 265-272 .  本站查看
本站查看
3. 董平,范文教,朱开宪,吴华昌,邓静. 不同复热方式对咸烧白风味的影响. 食品科技. 2023(02): 122-129 .  百度学术
百度学术
4. 陈方雪,邓祎,谌玲薇,李冬生,乔宇,吴文锦,熊光权,汪兰,李新,石柳,丁安子. 预制冷风风干武昌鱼干制过程中的品质变化及香气形成. 现代食品科技. 2023(02): 9-17 .  百度学术
百度学术
5. 张蓝月,孙万成,罗毅皓. 基于气相色谱-离子迁移谱分析不同地区羊肉的挥发性风味化合物. 食品与发酵工业. 2023(10): 265-272 .  百度学术
百度学术
6. 火玉明,柯汉杰,吴晨昕,姜红贺,梁鹏,汪晴,陈小辉. 海鲈鱼鱼松加工工艺研究. 食品安全质量检测学报. 2022(10): 3367-3374 .  百度学术
百度学术
7. 戴振庭,周惠敏,殷泽生,周瑜,陈舜胜. 添加植物油对鲣鱼鱼松滋味的影响. 甘肃农业大学学报. 2022(06): 227-234 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:

 下载:
下载:



