Gel Properties of Large Yellow Croaker (Pseudosciaena crocea) Roe Protein Isolate
-
摘要: 本文以大黄鱼卵盐溶蛋白为原料,在85 ℃加热20 min后于室温下放置12 h制备大黄鱼卵分离蛋白凝胶,并对其凝胶特性进行分析,同时探究了pH对大黄鱼卵分离蛋白凝胶特性的影响。结果显示,大黄鱼卵分离蛋白成胶的最低浓度为100 mg/mL,且在pH8条件下的制备的大黄鱼卵分离蛋白凝胶具有更好的流变特性。低场核磁和扫描电镜的结果表明,随着pH的增加,大黄鱼卵分离蛋白凝胶与水分子的结合增强,且凝胶的网络结构更加连续。结果表明,大黄鱼卵分离蛋白具有良好的凝胶特性,且在pH8条件下制备的大黄鱼卵分离蛋白凝胶表现更加优异。Abstract: The large yellow croaker (Pseudosciaena crocea) roe protein isolate gels were prepared under the condition of heating at 85 ℃ for 20 min and placed at room temperature for 12 h. The gel properties of P. crocea roe protein isolate gels were analyzed, and the effect of pH on the gel properties of P. crocea roe protein isolate gels was explored. The results showed that the minimum concentration of the P. crocea roe protein isolate of forming gels was 100 mg/mL, and the P. crocea roe protein isolate gel prepared at pH8 had better rheological properties. The results of low-field NMR and scanning electron microscopy showed that as the pH increased, the binding force of the water in the P. crocea roe protein isolate gels increased, and the network structure of the gels was more continuous. These results indicated that the P. crocea roe protein isolate had excellent gel properties, and the P. crocea roe protein isolate gel prepared at pH8 performed better.
-
Keywords:
- large yellow croaker (Pseudosciaena crocea) /
- roe /
- protein isolates /
- gel properties /
- pH
-
大黄鱼是我国近海主要经济鱼类,其因味道鲜美,营养丰富而深受广大消费者喜爱。2020年,我国大黄鱼产量高达25.4万吨。目前,大黄鱼的主要加工方式是鲜食或加工成鱼罐头等,鱼卵约占鱼体总质量的15%~20%[1],加工过程中,大黄鱼卵大多作为副产物被丢弃或制备成低值饲料,而鱼卵中蛋白含量丰富,这就造成了严重的资源浪费。前期研究发现,通过盐溶法可以从大黄鱼卵中获得分离蛋白。经鉴定,分离蛋白的主要组成为卵黄蛋白原、卵黄蛋白原B和卵黄蛋白原C,且其具有良好的持水特性[2]。因此,进一步研究大黄鱼卵分离蛋白的凝胶特性对大黄鱼的高值化利用具有重要意义。
近年来,有关蛋白质凝胶特性的研究日益增多。凝胶特性是蛋白质的重要特性之一,在食品工业中,蛋白质的凝胶化会影响产品的感官特性,尤其是产品质地,因此适当添加具有凝胶能力的蛋白质可以改善食品品质[3]。研究显示,大豆蛋白[4]、花生蛋白[4]、乳清蛋白[5]、猪肉[6]、鸡肉[7]、鱼类肌原纤维蛋白[8]、鸡蛋蛋白[9]等均具有良好的凝胶特性。LI等[10]研究发现从大黄鱼(Pseudosciaena crocea)肌肉中获取的肌原纤维蛋白表现出较好的凝胶特性。然而,关于大黄鱼卵分离蛋白凝胶特性的研究,还未见报道。
因此,本研究以大黄鱼卵分离蛋白为研究对象,利用热诱导凝胶化的方法制备大黄鱼卵分离蛋白凝胶,并对其成胶条件和凝胶特性进行研究,以期为进一步开发利用大黄鱼卵奠定理论基础。
1. 材料与方法
1.1 材料与仪器
大黄鱼卵 山东青岛鱼姐有限公司,经匀浆、冷冻干燥后获得均匀的大黄鱼卵冻干粉,于−30 ℃冷冻保存;其他试剂均为国产分析纯。
Discovery HR-1流变仪 美国TA公司;MesoMR23-060V-1核磁共振成像分析仪 上海纽迈公司;Hitachi冷场发射扫描电子显微镜 日本株式会社日立制作所;PP3010T cryo-SEM扫描电镜冷冻传输系统 英国Quorum科技公司;PHS-3精密pH计 上海雷磁仪器公司;Frontier红外光谱仪 美国PerkinElmer公司。
1.2 实验方法
1.2.1 大黄鱼卵分离蛋白的制备
参照前期的研究方法制备大黄鱼卵分离蛋白[2]。取10 g大黄鱼卵冻干粉,按照1:10(w/v)的料液比加入0.6 mol/L的NaCl溶液,搅拌浸提2 h,离心(8000 r/min,15 min)后除去上层油脂并收集中间层清液。剩余固体物质再按照1:10(w/v)的料液比加入相同溶液搅拌浸提1 h后再次离心,混合两次离心以后的中间层清液。将溶液于4 ℃条件下用去离子水透析除盐72 h后冻干,即得大黄鱼卵分离蛋白。
1.2.2 大黄鱼卵分离蛋白最低凝胶浓度的确定
制备浓度为50、75和100 mg/mL的大黄鱼卵分离蛋白溶液,并用0.5 mol/L的NaOH溶液调整pH至9.0,将溶液置于85 ℃水浴中加热20 min,于室温下放置12 h稳定凝胶后测定其流变特性。
1.2.3 大黄鱼卵分离蛋白凝胶的制备
参照DÀVILA等[11]的方法制备大黄鱼卵分离蛋白凝胶。首先制备浓度为100 mg/mL的大黄鱼卵分离蛋白溶液,并用0.5 mol/L的HCl溶液或0.5 mol/L的NaOH溶液调整pH至4.0、5.0、6.0、7.0、8.0、9.0,后将溶液置于85 ℃水浴中加热20 min使其凝胶化制得大黄鱼卵分离蛋白凝胶,在进行其他实验前将大黄鱼卵分离蛋白凝胶于室温下放置12 h使其稳定。
1.2.4 大黄鱼卵分离蛋白凝胶的特性分析
1.2.4.1 流变特性
参照YAN等[12]的方法进行测定。用流变仪对不同pH条件下制备的大黄鱼卵分离蛋白凝胶的流变特性进行分析。测试参数为:40 mm的平行板夹具,温度:25 ℃,进行频率扫描模式的测量,扫描范围分别为:频率:0.1~10 Hz,应变:0.3%。此外还探究了温度对大黄鱼卵分离蛋白凝胶的影响,将样品直接放置于流变仪上,测试参数设置为:40 mm的平行板夹具,温度范围:4~80 ℃,升温/降温速率:4 ℃/min,保留时间:3 min,频率:1 Hz,应变:0.3%,进行温度扫描模式的测量。所设应变值在蛋白凝胶的线性黏弹区内。
1.2.4.2 大黄鱼卵分离蛋白凝胶中的水分分布测定
参照YAN等[13]的方法进行测定。将2 g凝胶样品放入特定塑料管中,并插入核磁共振成像分析仪的样品床中,设定参数分别为:τ值:100,回波NECH的数量:5000,TW:3000 ms,扫描之间的重复时间:8 s。每个样品至少重复测定三次并通过MultiExp Inv分析软件拟合Carr-Purcell-Meiboom-Gill衰变曲线的NMR T2数据分布。
1.2.4.3 扫描电镜(SEM)测定
将不同处理的凝胶样品用液氮淬断,在Hitachi冷场发射扫描电子显微镜下放大5000倍,观察凝胶截面的微观形态。每组不同部位重复扫描3次。
1.2.4.4 红外光谱测定
将1 mg凝胶冻干粉与100 mg干燥的溴化钾粉末混匀,研磨并压制成薄盘。通过红外光谱仪记录样品在4000~400 cm−1之间的红外光谱,并使用OMNIC 8.2软件分析光谱中的峰值信号。
1.3 数据处理
试验数据均进行3次重复试验,进行平均值计算,利用Origin 2017 软件作图。
2. 结果与分析
2.1 大黄鱼卵分离蛋白的最低凝胶浓度
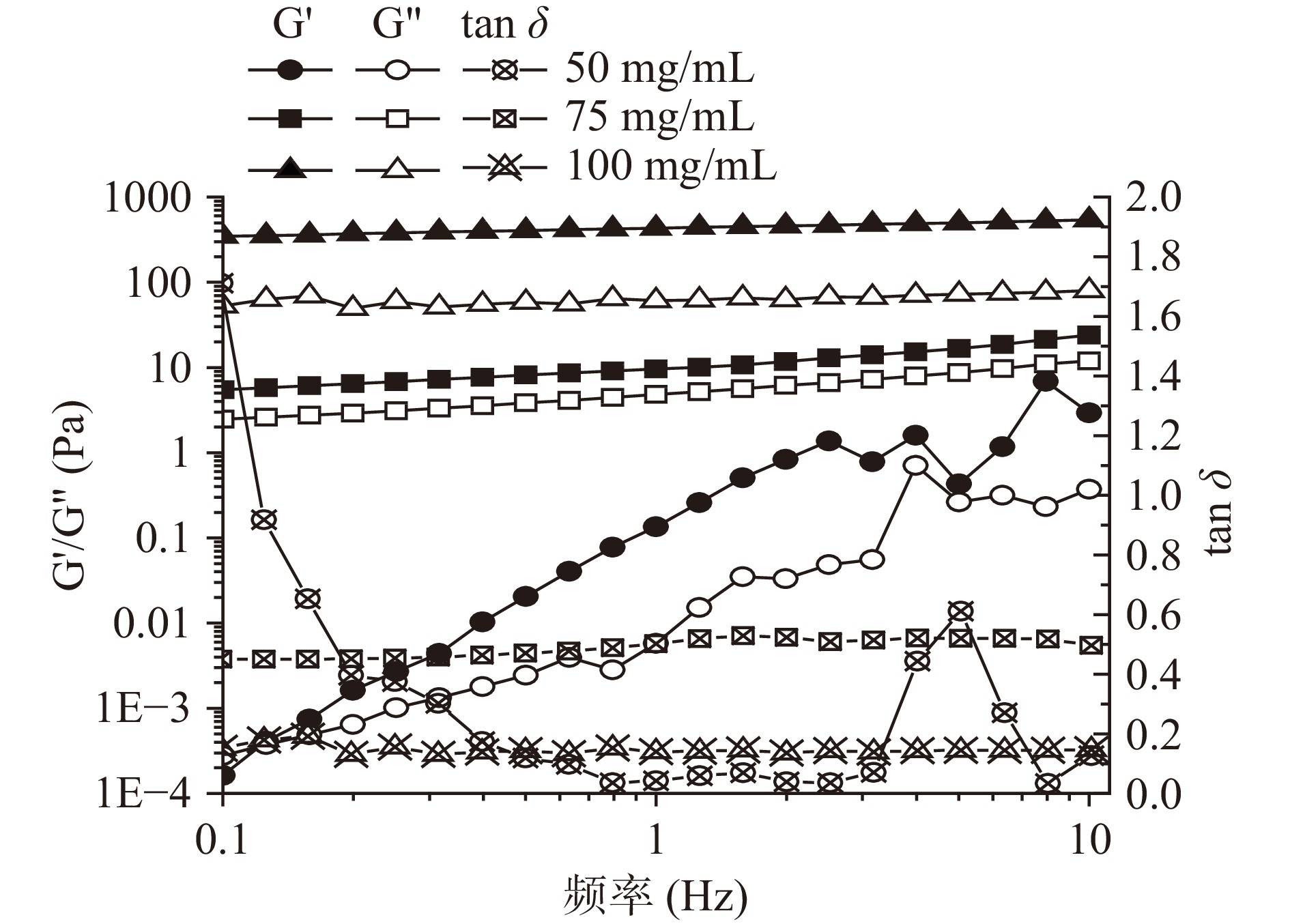
采用流变仪对不同浓度制备的大黄鱼卵分离蛋白的流变特性进行分析。由图1可知,随着分离蛋白浓度的增加,凝胶的储能模量(G’)和损耗模量(G”)都增加,表明凝胶的黏性和弹性都与浓度呈现出一定的依赖关系。且在75及100 mg/mL的浓度条件下,G’和G”平行且与频率之间呈现出线性相关关系,这是一种典型的凝胶频率扫描结果[14]。此外,在50 mg/mL的浓度条件下,样品的tan δ不稳定,而75、100 mg/mL条件下制得的样品其tan δ分别稳定在0.50和0.14左右,表明75 mg/mL的样品相对黏性较强,因而呈现出一定的流动状态,而在100 mg/mL浓度条件下凝胶的tan δ值较小,表明凝胶形成更为紧密的网络结构,使得蛋白热诱导凝胶倾向于固体,更有弹性。因此,这些结果表明本实验探究的大黄鱼卵分离蛋白最低凝胶浓度是100 mg/mL。
2.2 大黄鱼卵分离蛋白凝胶的流变特性分析
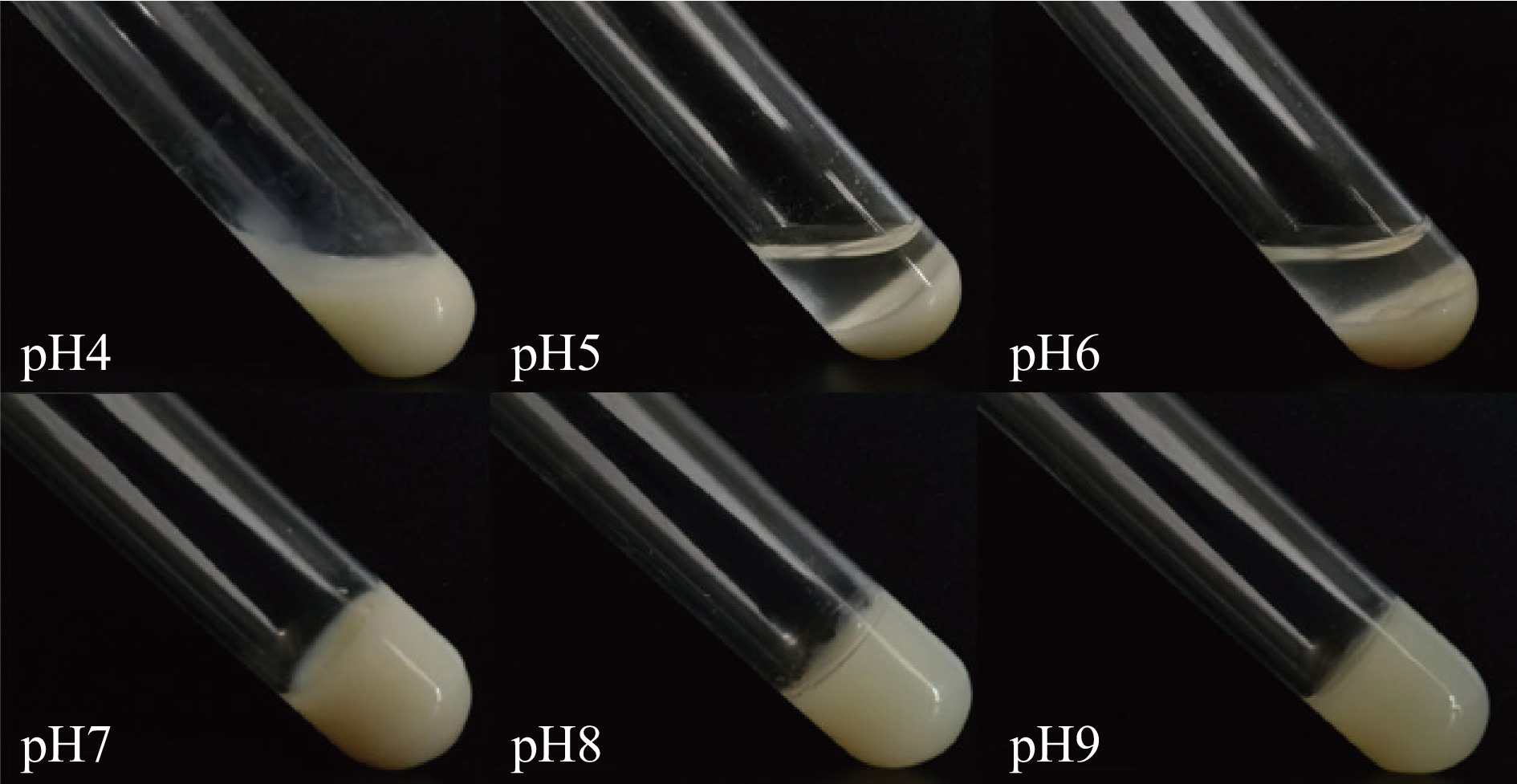
在大黄鱼卵分离蛋白浓度为100 mg/mL的条件下,分离蛋白在pH4.0~6.0的条件下无法形成凝胶,呈现流动状态,在pH7.0~9.0的条件下可以形成凝胶,结果如图2所示。因此进一步探究pH对大黄鱼卵分离蛋白凝胶特性的影响。
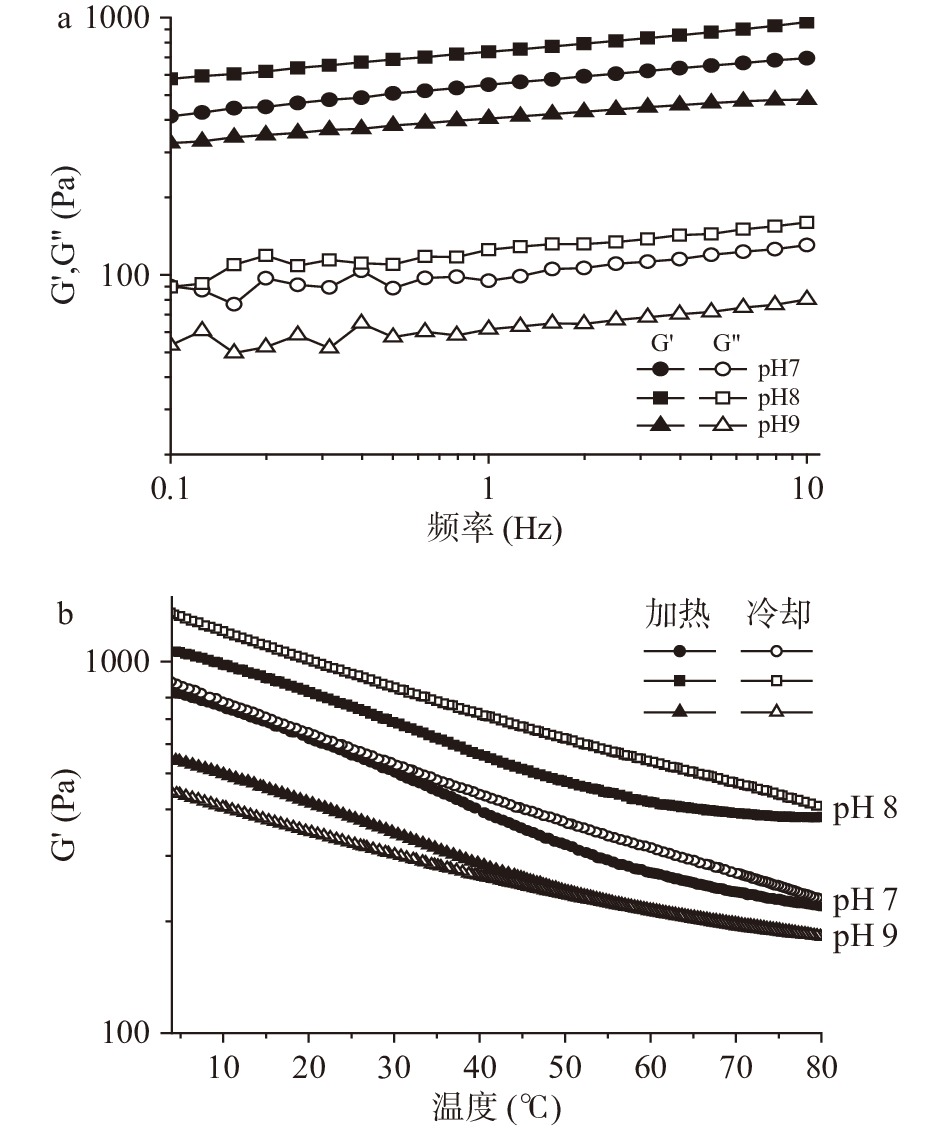
流变特性是胶体的重要特性之一,可以用来表现流体的弹性特征和黏性特征[15-16]。图3a是不同pH条件下制备的大黄鱼卵分离蛋白凝胶的储能模量(G’)和损耗模量(G”)与振荡频率关系的实验结果。在pH8.0条件下制得的蛋白质凝胶的储能模量和损耗模量均高于其他pH条件下制得的分离蛋白凝胶。这主要是由于大黄鱼卵分离蛋白的等电点约为pH6.0左右,溶液的pH增加会促进蛋白质的溶解度,从而改善凝胶性质[17]。但是,当溶液的pH较高时,会产生更多的负电荷,这会影响蛋白质分子之间的静电相互作用,而静电相互作用是形成凝胶的主要动力[18]。所以大黄鱼卵分离蛋白的黏性和弹性随着pH的增加呈现先增加后下降的趋势。
温度扫描进一步评估了温度变化对大黄鱼卵分离蛋白凝胶流变特性的影响。如图3b所示,在加热过程中,大黄鱼卵分离蛋白凝胶的储能模量均有所下降,但是在冷却后能够再次升高,甚至高于初始的模量强度,除了在pH9.0条件下制备的大黄鱼卵分离蛋白凝胶在经过加热冷却后的储能模量稍低于初始状态。这是由于随着温度的升高,蛋白质凝胶体系的黏度降低,流动性增大,蛋白质分子间的相互作用减弱,其储能模量随之降低,但是一直维持在100 Pa以上,随后随着温度的下降,蛋白质分子间相互作用逐渐增强,使其能够恢复到初始的凝胶状态。此外,在pH8.0条件下制备的大黄鱼卵分离蛋白凝胶的储能模量明显高于在其他pH条件下制备的分离蛋白凝胶,这与频率扫描的结果相一致。RENKEMA等[19]发现,大豆分离蛋白凝胶的储能模量也在加热过程中下降,在冷却后会再次增加。这些结果表明,大黄鱼卵分离蛋白凝胶在加热和冷却条件下是比较稳定的,可应用于某些需要加热制备的食品中以改善其凝胶特性。
2.3 大黄鱼卵分离蛋白凝胶的水分分布
低场核磁共振技术已被广泛应用于肉制品、果蔬等食品领域的检测,可以无损高效的检测产品的水分状态及含量[20-21]。从大黄鱼卵分离蛋白凝胶的弛豫时间图谱(图4)可以看出,大黄鱼卵分离蛋白凝胶的T2在0.01~10000 ms范围内只有一个峰,出现于100~1000 ms之间,代表自由水[13]。进一步通过在8000 r/min离心10 min的方法检测其持水性,结果表明,在pH7.0条件下制得的凝胶持水力为(94.1%±0.4%),而在pH8.0和pH9.0条件下制得的凝胶经过离心后无水分析出,持水力接近100%,该结果表明尽管样品中含有的水分组成主要为自由水,但蛋白凝胶仍具有较好的持水能力,这可能主要是由于蛋白质通过凝胶网络结构而截留了较多的水分子。此外,随着pH的增加,大黄鱼卵分离蛋白凝胶的弛豫时间曲线向左偏移,表明分离蛋白凝胶与水的结合力增加。这一结果与LI等[22]的研究结果相似,他们发现随着pH的增加,热诱导制备的鸡蛋清蛋白凝胶的弛豫时间曲线也呈现向左偏移的趋势。前期研究表明,大黄鱼卵分离蛋白的等电点约为pH6.0,在溶液的pH逐渐远离等电点时,蛋白质具有更大的溶解性,且在pH7.0~9.0的条件下,蛋白质溶解度为86.9%~97.4%[2]。因此,随着成胶pH的增大,蛋白质溶解度增加可能会促进了更多的水分子与蛋白质结合。此外,pH的上升增加了蛋白质携带的净电荷数量,促进蛋白质之间形成了更加致密的网络结构,从而增强了凝胶的保水能力[17]。
2.4 大黄鱼卵分离蛋白凝胶的微观结构
冷场扫描电镜因其可以直观地显示蛋白质的内部结构而被广泛用于研究蛋白质凝胶的微观结构[23-24]。如图5所示,大黄鱼卵分离蛋白经热诱导后可以形成具有连续网络结构的凝胶。在pH7.0条件下制备的分离蛋白凝胶表面相对粗糙,出现断裂,但是在pH8.0和pH9.0条件下制备的凝胶具有更加光滑的表面,网络结构更加连续。这主要是由于pH可以影响蛋白质的溶解度并改变蛋白质凝胶的微观结构。此外,大黄鱼卵分离蛋白凝胶结构在较高pH条件下更加细化紧致,对水分流动的阻滞能力更强,因而持水力更强,这与持水力的结果一致。热诱导的羊肌原纤维蛋白[25]、乳清蛋白和大豆蛋白的混合物[26]、血浆蛋白和鸡肉肌原纤维的混合蛋白[27]凝胶也表现出与本研究相似的多孔结构。ZHANG等[28]也发现,pH的增加会导致鸡肉肌原纤维蛋白凝胶形成更加有序、多孔的三维网络结构。这些结果表明在碱性条件下制备的大黄鱼卵分离蛋白凝胶结构更加连续,这也可能是其能够保留更多自由水的原因。
2.5 大黄鱼卵分离蛋白凝胶的红外光谱
红外光谱可以进一步用来探究蛋白质结构的改变及其特征基团的变化[29]。如图6所示,大黄鱼卵分离蛋白红外光谱特征峰出现于1531 cm−1(酰胺II带),1657 cm−1(酰胺I带)和3293 cm−1(酰胺A带)。与大黄鱼卵分离蛋白冻干粉的红外光谱相比,在不同pH下制备的分离蛋白凝胶光谱中特征峰的位置没有明显变化,表明溶液的pH改变对分离蛋白的特征基团没有明显的作用。SONG等[30]的研究也发现大豆分离蛋白的FTIR谱图中特征峰位置与其热诱导凝胶之间没有明显差异。
3. 结论
本文研究了pH对大黄鱼卵分离蛋白凝胶特性的影响,结果表明,大黄鱼卵分离蛋白在pH4.0~6.0的条件下无法形成凝胶,在pH7.0~9.0的条件下可以形成热诱导凝胶,且分离蛋白最低成胶浓度为100 mg/mL,在pH8.0条件下制备的分离蛋白凝胶具有最大的储能模量G’。此外随着成胶pH的增加,蛋白凝胶具有更高的持水能力和更加致密均匀的网络结构。因此,后续研究将围绕大黄鱼卵分离蛋白的成胶机制及其在食品加工中的应用进行深入探讨。
-
-
[1] LIANG P, CHENG X, XU Y, et al. Determination of fatty acids composition and phospholipid molecular species of large yellow croaker (Pseudosciaena crocea) roe from China[J]. Journal of Aquatic Food Product Technology,2016,26(10):1259−1265.
[2] DU Y N, XUE S, HAN J R, et al. Simultaneous extraction by acidic and saline solutions and characteristics of the lipids and proteins from large yellow croaker (Pseudosciaena crocea) roes[J]. Food Chemistry,2020,310:125928. doi: 10.1016/j.foodchem.2019.125928
[3] CHEN N, ZHAO M, CHASSENIEUX C, et al. The effect of adding nacl on thermal aggregation and gelation of soy protein isolate[J]. Food Hydrocolloids,2017,70:88−95. doi: 10.1016/j.foodhyd.2017.03.024
[4] SHAN H, LU S W, JIANG L Z, et al. Gelation property of alcohol-extracted soy protein isolate and effects of various reagents on the firmness of heat-induced gels[J]. International Journal of Food Properties,2015,18(3):627−37. doi: 10.1080/10942912.2013.850508
[5] JACEK D, DOROTA N L, ILONA W S, et al. Influence of milk protein cross-linking by transglutaminase on the rennet coagulation time and the gel properties[J]. Journal of the Science of Food and Agriculture,2016,96(10):3500−3507. doi: 10.1002/jsfa.7534
[6] HUANG Y, GUO L, XIONG S, et al. Property and structure changes of myofibril protein in pork treated by high pressure combined with heat[J]. Food Science & Technology International,2016,22(7):647−663.
[7] WEI S, YANG Y, FENG X, et al. Structures and properties of chicken myofibrillar protein gel induced by microwave heating[J]. International Journal of Food Science and Technology,2020,55(7):2691−2699. doi: 10.1111/ijfs.14522
[8] CERCEL F, SROIU M, ALEXE P. Characterization of myofibrillar proteins obtained from fresh abramis brama (Common bream) meat[J]. Scientific Papers,2015:355−362.
[9] ZHANG H, YANG L, TU Y, et al. Changes in texture and molecular forces of heated-induced egg white gel with adding xanthan gum[J]. Journal of Food Process Engineering,2019,42(4):e13071.
[10] LI X, LIU C, WANG J, et al. Effect of hydroxyl radicals on biochemical and functional characteristics of myofibrillar protein from large yellow croaker (Pseudosciaena crocea)[J]. Journal of Food Biochemistry,2020,44(1):E13084.
[11] DÀVILA E, PARÉS D, HOWELL N K. Fourier transform raman spectroscopy study of heat-induced gelation of plasma proteins as influenced by pH[J]. Journal of Agricultural & Food Chemistry,2006,54(20):7890.
[12] YAN J N, ZHANG M, ZHAO J, et al. Gel properties of protein hydrolysates from trypsin-treated male gonad of scallop (Patinopecten yessoensis)[J]. Food Hydrocolloids,2019,90:452−61. doi: 10.1016/j.foodhyd.2018.12.050
[13] YAN J N, SHANG W H, ZHAO J, et al. Gelation and microstructural properties of protein hydrolysates from trypsin-treated male gonad of scallop (patinopecten yessoensis) modified by κ-carrageenan/k+[J]. Food Hydrocolloids,2019,91:182−189. doi: 10.1016/j.foodhyd.2019.01.024
[14] PEYRANO F, LAMBALLERIE M de, SPERONI F, et al. Rheological characterization of thermal gelation of cowpea protein isolates: Effect of processing conditions[J]. LWT-Food Science and Technology,2019,109:406−14. doi: 10.1016/j.lwt.2019.04.048
[15] RUZENGWE F M, AMONSOU E O, KUDANGA T. Rheological and microstructural properties of Bambara groundnut protein gels[J]. LWT-Food Science and Technology,2020,123:109070. doi: 10.1016/j.lwt.2020.109070
[16] SHAN Y Y, TANG D Y, WANG R, et al. Rheological and structural properties of ovomucin from chicken eggs with different interior quality[J]. Food Hydrocolloids,2020,100:105393. doi: 10.1016/j.foodhyd.2019.105393
[17] XIONG Y L, BREKKE C J. Changes in protein solubility and gelation properties of chicken myofibrils during storage[J]. Journal of Food Science,1989,54(5):1141−1146. doi: 10.1111/j.1365-2621.1989.tb05941.x
[18] TOLANO-VILLAVERDE I J, TORRES-ARREOLA W, OCAO-HIGUERA V M, et al. Thermal gelation of myofibrillar proteins from aquatic organisms[J]. Cyta Journal of Food,2015,14:1−7.
[19] RENKEMA J M S, GRUPPEN H, VAN VLIET T. Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J]. Journal of Agricultural and Food Chemistry,2002,50(21):6064−6071. doi: 10.1021/jf020061b
[20] ZHU H, O'FARRELL M, HANSEN E W, et al. The potential for predicting purge in packaged meat using low field NMR[J]. Journal of Food Engineering,2017,206:98−105. doi: 10.1016/j.jfoodeng.2017.03.008
[21] LI L, ZHANG M, BHANDARI B, et al. LF-NMR online detection of water dynamics in apple cubes during microwave vacuum drying[J]. Drying Technology,2018,36:2006−2015. doi: 10.1080/07373937.2018.1432643
[22] LI J, ZHANG M, CHANG C, et al. Molecular forces and gelling properties of heat-set whole chicken egg protein gel as affected by NaCl or pH[J]. Food Chemistry,2018,261(30):36−41.
[23] NGUYEN H, SCHWENDEL H, HARLAND D, et al. Differences in the yoghurt gel microstructure and physicochemical properties of bovine milk containing A1 A1 and A2 A2 β-casein phenotypes[J]. Food Research International,2018,112(OCT.):217−224.
[24] ZHOU X, JIANG S, ZHAO D, et al. Changes in physicochemical properties and protein structure of surimi enhanced with camellia tea oil[J]. LWT-Food Science and Technology,2017:562−571.
[25] NA N, WANG Z, FAN H, et al. Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J]. Process Biochemistry,2014,49(4):631−636. doi: 10.1016/j.procbio.2014.01.017
[26] JOSE J, POUVREAU L, MARTIN A H. Mixing whey and soy proteins: Consequences for the gel mechanical response and water holding[J]. Food Hydrocolloids,2016,60:216−224. doi: 10.1016/j.foodhyd.2016.03.031
[27] WANG P, HAN M, XU X, et al. Rheological and nuclear magnetic resonance study on heat-induced gel properties of spent-hen myofibrillar protein affected by porcine plasma protein[J]. Journal of Texture Studies,2014,45(3):195−205. doi: 10.1111/jtxs.12063
[28] ZHANG X, YANG Y, MA Y, et al. Effects of pH on the non-covalent forces and structure of myofibrillar protein and heat induced gel[J]. Scientia Agricultura Sinica,2017,50(3):564−73.
[29] SVENJA M B, KAI K, JAYASHREE A. Effect of low moisture extrusion on a pea protein isolate's expansion, solubility, molecular weight distribution and secondary structure as determined by Fourier Transform Infrared Spectroscopy (FTIR)[J]. Journal of Food Engineering,2017,214:166−174. doi: 10.1016/j.jfoodeng.2017.06.037
[30] SONG F, ZHANG L. Gelation modification of soy protein isolate by a naturally occurring cross-linking agent and its potential biomedical application[J]. Industrial & Engineering Chemistry Research,2009,48(15):7077−7083.





 下载:
下载:



 下载:
下载:



