Optimization of Extraction Process of Polysaccharides from Plumeria rubra L.cv. Acutifolia and Evaluation of Biological Activity
-
摘要: 目的:优化鸡蛋花(Plumeria rubra L. cv. Acutifolia)多糖的提取工艺,并对鸡蛋花多糖(PRLAP)体外抗氧化、抗菌、抗肿瘤活性进行评价。方法:通过单因素实验设计正交试验,确定PRLAP的最佳提取条件;通过测PRLAP对DPPH、ABTS和OH自由基清除能力来评价PRLAP的抗氧化活性;采用微量肉汤稀释法测PRLAP对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、鲍曼不动杆菌(Acinetobacter baumannii)、肺炎克雷伯菌(Klebsiella pneumoniae)的最小抑菌浓度(minimal inhibit concentration,MIC)来评价PRLAP的抑菌活性;此外,通过CCK-8法检测PRLAP对人黑色素瘤细胞(A375)、小鼠黑色素瘤细胞(B16)、人结直肠癌上皮细胞(DLD-1)、人乳腺癌细胞(MCF-7)细胞活力的影响来评价PRLAP的抗肿瘤能力。结果:PRLAP最佳提取条件:超声功率264 W、料液比1:50(g/mL)、提取时间40 min、提取温度35 ℃。此条件下,PRLAP的得率为14.01%±0.22%。PRLAP清除DPPH、ABTS、OH自由基的半抑制浓度(IC50)分别为0.1934、0.2315、2.469 mg/mL。PRLAP对大肠杆菌和金黄色葡萄球菌的MIC分别为0.391和0.195 mg/mL,对铜绿假单胞菌、肺炎克雷伯菌和鲍曼不动杆菌的MIC均为1.562 mg/mL。细胞活力实验结果表明,在一定浓度范围内,除DLD-1细胞外,PRLAP对A357、B16和MCF-7细胞活力有一定的抑制作用且与浓度均呈剂量依赖性,IC50分别为101.3、285.6、423.1 μg/mL。结论:本文首次对鸡蛋花多糖提取工艺进行了优化,通过一系列实验证明PRLAP具有良好的体外抗氧化、抑菌以及一定的抗肿瘤活性,为进一步研究开发鸡蛋花提供科学理论支撑。Abstract: Objective: To optimize the extraction process of polysaccharides from Plumeria rubra L. cv. Acutifolia, and make acomment about antioxidant, antibacterial and anti-tumor activities of Plumeria polysaccharide. Methods: The orthogonal experiment was designed by single factor experiment and the optimal extraction conditions were determined. The antioxidant activity was evaluated by measuring its scavenging ability to DPPH, ABTS, and OH free radical assays. The minimum inhibitory concentration of Plumeria polysaccharide against Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Acinetobacter baumannii, and Klebsiella pneumoniae was measured by the micro broth dilution method to evaluate the antibacterial activity of Plumeria polysaccharide. In addition, CCK-8 assay was used to evaluate the inhibitory effect of Plumeria polysaccharide on human melanoma cells (A375), mouse melanoma cells (B16), human colorectal cancer epithelial cells (DLD-1) and human breast cancer cells (MCF-7). Results: The optimum conditions of Plumeria polysaccharide were as follows:Ultrasonic power was 264 W, solid-liquid ratio was 1:50 (g/mL), extraction time was 40 min, extraction temperature was 35 ℃. Under these conditions, the yield of Plumeria polysaccharide was 14.01%±0.22%. The half-inhibitory concentrations of Plumeria polysaccharide in scavenging DPPH, ABTS and OH free radicals were 0.1934, 0.2315 and 2.469 mg/mL, respectively. The minimum inhibitory concentrations of Plumeria polysaccharide against Escherichia coli and Staphylococcus aureus was 0.391 and 0.195 mg/mL, respectively, and the minimum inhibitory concentrations against Pseudomonas aerugino, Klebsiella pneumoniae and Acinetobacter baumannii were all 1.562 mg/mL. The results of cell viability experiments showed that within a certain concentration range, except for DLD-1 cells, Plumeria polysaccharide had a certain inhibitory effect on the viability of A357, B16 and MCF-7 cells and was dose-dependent with the concentration, with IC50 of 101.3, 285.6 and 423.1 μg/mL. Conclusion: This article optimizes the extraction process of Plumeria polysaccharides for the first time. A series of experiments prove that Plumeria polysaccharide has good antioxidant, antibacterial and anti-tumor activities in vitro. This research provides a certaindata theoretical support for the further development and utilization of Plumeria.
-
Keywords:
- Plumeria polysaccharide /
- extraction process /
- antioxidant /
- antibacterial /
- anti-tumor
-
鸡蛋花为夹竹桃科(Apocynaceae)鸡蛋花属植物鸡蛋花(Plumeria rubra Linn.cv. Acutifolia)的干燥花,别名缅栀子、蛋黄花等。原产于墨西哥,在我国主要分布于广东、广西、海南等省区[1]。鸡蛋花是岭南地区常用药材,具有清热、利湿、解暑之功效。民间常采其泡茶、煲汤,用于消暑。鸡蛋花是“王老吉凉茶”、“五花茶”等广式凉茶的主要配方材料之一[2]。由于鸡蛋花的特殊香气,其提取物可用作高级化妆品、香皂和食品添加剂。化学成分研究表明鸡蛋花主要含有三萜[3]、环烯醚萜[4-5]、黄酮[6]、糖类、脂肪族类等化合物[7-8]。现代药理研究表明鸡蛋花提取物具有抗氧化[6]、抗菌[9]、抗肿瘤[10]、降血糖[11]等活性。多糖是广泛存在于植物、动物和微生物中一种分子结构复杂且庞大的糖类物质,具有抗氧化[12]、免疫调节[13]、抗肿瘤[14]、抗菌[15]、抗炎[16]、抗病毒[17]、降血糖及降血脂[18-19]等广泛的生物活性。
不同鸡蛋花属的不同部位、不同溶剂提取物具有不同的药理活性,如P. acuminate (leaves)甲醇提取物具有抗氧化和清除自由基的活性[20],DAWOOD等[21]从白鸡蛋花(Plumeria alba L.)叶中提取了粗多糖,并证明其具有较强的抗氧化能力。引入我国药食同源的是黄鸡蛋花(Plumeria rubra Linn.cv. Acutifolia)。广式凉茶具有祛暑败火气,清热解毒、生津止渴的功效。何蓉蓉等[22]以王老吉凉茶为药物,通过葡萄糖耐受实验来观察应激和血糖代谢的关系,测定小鼠体内氧化水平和抗氧化能力的变化。结果表明:王老吉凉茶不仅能降低血浆中丙二醛(MDA)的含量,同时能够显著提高体内的抗氧化能力指数(ORAC)水平,可明显缓解机体内的氧化应激状态,改善糖代谢不足。
目前,对鸡蛋花的研究主要集中在环烯醚萜类和挥发油方面,而关于鸡蛋花多糖的研究鲜有报道。因此,本文首次对鸡蛋花多糖提取工艺及抗氧化、抗菌、抗肿瘤活性进行研究,为鸡蛋花在食品、医药方面的进一步开发利用提供科学依据。
1. 材料与方法
1.1 材料与仪器
鸡蛋花干燥花 采于中国科学院南海生物医学药科技产业中心;葡萄糖、苯酚、过硫酸钾、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、二甲基亚砜 上海麦克林生化科技有限公司;CCK-8细胞毒性检测试剂盒 亚科因(武汉)生物技术有限公司;LB培养基 青岛海博生物技术有限公司;DMEM培养基和胎牛血清 Biological Industries;胰酶、PBS 美国Gibco公司;青霉素、链霉素 上海抚生有限公司;菌种(大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌) 广东省微生物菌种保藏中心;细胞(A375细胞、B16细胞、MCF-7细胞、DLD-1细胞) 中国科学院上海细胞中心;其它化学试剂 均为分析纯。
060ST超声波清洗器 深圳市华策科技有限公司;TG16-WS低温高速离心机 美国Beckman公司;UV-2700 紫外分光光度计 岛津企业管理(中国)有限公司;EPOCH 酶标仪 美国Bio Tek公司;LRH-150 智能生化培养箱 郑州生元仪器有限公司;BB 5060 二氧化碳培养箱 致微(厦门)仪器有限公司。
1.2 实验方法
1.2.1 鸡蛋花多糖(PRLAP)提取工艺
取鸡蛋花干燥花粉末→石油醚脱脂→超声辅助水提→提取液浓缩→离心→ Sevage法除蛋白质→体积分数95%乙醇沉淀→洗涤沉淀→冷冻干燥→鸡蛋花多糖(PRLAP)。
将晒干的鸡蛋花干燥花粉碎,过60目筛,得鸡蛋花粉末,取500 g鸡蛋花粉末放入10 L的三口瓶中,加入10倍体积的石油醚进行脱脂、脱色至石油醚颜色接近无色,过滤,将鸡蛋花滤渣放置烘箱中烘干,常温下冷却后,混匀转移到保鲜袋中备用。称取上述处理后的鸡蛋花粉末1 g放置于50 mL三角瓶中。在一定超声功率、液料比、提取时间和提取温度下进行PRLAP的提取,待提取液冷却到室温,在10000 r/min条件下离心1 min,用Sevage法除蛋白质:取PRLAP溶液4 mL,氯仿-正丁醇(预先配制成体积比为4:1混合液)溶液1 mL,置于具塞试管中,充分振摇30 min后,10000 r/min离心1 min,然后将水相与氯仿相分开,将水相再加入相当于其体积1/4的氯仿-正丁醇溶液,重复上述过程,直至蛋白质除掉。将除蛋白后的提取液用95%的乙醇4 ℃醇沉12 h,之后在10000 r/min条件下离心1 min,弃去上清液,将得到的醇沉物溶解于水中,最后冷冻干燥得鸡蛋花多糖。
1.2.2 单因素实验设计
称取1 g鸡蛋花粉末3份,固定料液比1:40(g/mL)、提取时间30 min,提取温度40 ℃,分别测定超声功率在216、240、264、288、312 W时PRLAP得率。
称取1 g鸡蛋花粉末3份,固定超声功率288 W、提取时间30 min、提取温度40 ℃,分别测定料液比在1:20、1:30、1:40、1:50、1:60(g/mL)时PRLAP得率。
称取1 g鸡蛋花粉末3份,固定超声功率288 W、料液比1:50(g/mL)、提取温度40 ℃,分别测定提取时间在10、20、30、40、50 min时PRLAP得率。
称取1 g鸡蛋花粉末3份,固定超声功率288 W、料液比1:50(g/mL)、提取时间40 min,分别测定提取温度在35、40、45、50、55 ℃时PRLAP得率。
1.2.3 正交试验优化
鸡蛋花多糖提取工艺根据单因素实验结果选择超声功率、料液比、提取时间、提取温度为自变量,多糖得率为因变量,进行四因素三水平正交试验,试验因素设置见表1。
表 1 L9(34)正交试验因素水平及编码Table 1. The factors and levels of L9(34)orthogonal experiment水平 因素 A超声功率
(W)B料液比
(g/mL)C提取时间
(min)D提取温度
(℃)1 264 1:40 20 35 2 288 1:50 30 40 3 312 1:60 40 45 1.2.4 PRLAP的测定
1.2.4.1 葡萄糖标准曲线的绘制
称取真空干燥的葡萄糖标准品10 mg定容到100 mL容量瓶中,配成0.1 mg/mL的葡萄糖标准溶液。分别精密移取葡萄糖标准溶液0、0.2、0.4、0.6、0.8 mL于大试管中,补加蒸馏水至1 mL,分别加入1 mL 5%苯酚,摇匀,再分别加入5 mL浓硫酸,于37 ℃水浴静置30 min,在488 nm测吸光值。以葡萄糖浓度C为横坐标(mg/mL),吸光值A为纵坐标,绘制葡萄糖标准曲线回归方程为:A=0.0094C+0.0928,R2=0.993。
1.2.4.2 PRLAP含量测定
采用苯酚-硫酸法[23]进行PRLAP含量的测定。准确吸取样品溶液1 mL于试管中,分别加5%苯酚溶液1 mL,振荡摇匀,再分别加入浓硫酸5 mL,振荡摇匀,于37 ℃水浴放置30 min,488 nm测定吸光值。根据测得的吸光值带入标准曲线回归方程,计算PRLAP浓度。根据公式(1)计算PRLAP得率。
多糖得率(%)=c×V×nm×100 (1) 式中:c表示根据吸光度值计算出的鸡蛋花多糖质量浓度,g/mL;V表示提取液总体积,mL;n表示稀释倍数;m表示鸡蛋花取样量,g。
1.2.5 PRLAP体外抗氧化活性研究
1.2.5.1 DPPH自由基清除率测定
根据WANG等[24]的方法稍作修改。取不同浓度(0.01562、0.03125、0.0625、0.125、0.25、0.5、1 mg/mL)的PRLAP溶液以及相同浓度下的阳性对照VC对DPPH自由基清除率进行测定。步骤如下:实验组于96孔板中依次加入上述浓度下的PRLAP或VC 50 μL、0.1 mmol/L的DPPH溶液150 μL;实验对照组依次加入上述浓度下的PRLAP或VC 50 μL、蒸馏水150 μL;空白对照组依次加入蒸馏水50 μL、0.1 mmol/L的DPPH溶液150 μL。室温避光处理30 min,517 nm处测其吸光度,根据公式(2)计算PRLAP和VC的清除率:
清除率(%)=(1−A1−A2A0)×100 (2) 式中: A1:不同浓度的PRLAP或VC加DPPH测得的吸光值;A2:不同浓度的PRLAP或VC加水测得的吸光值;A0:只加水和DPPH所测得的吸光度值。
1.2.5.2 ABTS自由基清除率测定
根据TANG等[25]的方法稍作修改。取不同浓度(0.01562、0.03125、0.0625、0.125、0.25、0.5、1 mg/mL)的PRLAP溶液以及相同浓度下的阳性对照VC对ABTS自由基清除率进行测定。步骤如下:实验组于96孔板中依次加入上述浓度下的PRLAP或VC 50 μL、7 mmol/L ABTS和4.95 mmol/L K2S2O8混合液150 μL;实验对照组依次加入上述浓度下的PRLAP或VC 50 μL、蒸馏水150 μL;空白对照组依次加入蒸馏水50 μL、7 mmol/L ABTS和4.95 mmol/L K2S2O8混合液150 μL。室温避光处理30 min,734 nm处测其吸光值,根据公式(3)计算PRLAP和VC的清除率:
清除率(%)=(1−A1−A2A0)×100 (3) 式中:A1表示不同浓度的PRLAP或VC加ABTS和K2S2O8混合液测得的吸光值;A2表示不同浓度的PRLAP或VC加水测得的吸光值;A0表示只加水和ABTS和K2S2O8混合液所测得的吸光度值。
1.2.5.3 OH自由基清除率测定
根据王迦琦等[26]的方法稍作修改。取不同浓度(0.01562、0.03125、0.0625、0.125、0.25、0.5、1 mg/mL)的PRLAP溶液以及相同浓度下的阳性对照VC对OH自由基清除率进行测定。步骤如下:实验组于96孔板中依次加入预先配制9 mmol/L的FeSO4、上述浓度下的PRLAP或VC、9 mmol/L水杨酸以及8.8 mmol/L 30% H2O2 各50 μL;实验对照组依次加入9 mmol/L的FeSO4、上述浓度下的PRLAP或VC、蒸馏水以及8.8 mmol/L 30% H2O2各50 μL;空白对照组依次加入9 mmol/L的FeSO4、蒸馏水、9 mmol/L水杨酸以及8.8 mmol/L 30% H2O2各50 μL。摇床混匀,室温静置30 min后,510 nm处测其吸光度值,根据公式(4)计算PRLAP和VC的清除率:
清除率(%)=(1−A1−A2A0)×100 (4) 式中:A1表示不同浓度的PRLAP或VC加入FeSO4、水杨酸、H2O2测得的吸光值;A2表示不同浓度的PRLAP或VC加入FeSO4、蒸馏水、H2O2测得的吸光值;A0表示蒸馏水加入FeSO4、水杨酸、H2O2测得的吸光度值。
1.2.6 PRLAP抑菌活性测定
采用微量肉汤稀释法测PRLAP对供试菌的MIC。具体步骤如下:将大肠杆菌(Eco)、金黄色葡萄球菌(Sau)、铜绿假单胞菌(Pae)、肺炎克雷伯菌(Kpn)、鲍曼不动杆菌(Ab)在牛肉膏蛋白胨培养基接种后,于37 ℃培养24 h,制备105 CFU/mL菌悬液和50 mg/mL PRLAP溶液。在96孔板中进行样品稀释和接种,2~11孔每孔加入营养肉汤100 μL,第12孔中加入营养肉汤200 μL;第1孔中加入50 mg/mL PRLAP溶液200 μL,倍比稀释至第10孔;1~11孔均加入100 μL菌液;37 ℃培养箱孵育16~18 h。此外需设置色素对照,96孔板中第1孔中加入50 mg/mL PRLAP溶液200 μL,2~11孔每孔加入营养肉汤100 μL,第12孔加入营养肉汤200 μL,最后1~11孔均加入100 μL菌液,用酶标仪在600 nm测吸收值,将试验组1~10孔吸光值与色素对照组1~10孔吸光值做差,然后将差值与试验组第11孔(阳性对照组)和第12孔(阴性对照组)结果作比较,差值接近试验组第12孔与色素对照第12孔之差的最小浓度为MIC。
1.2.7 PRLAP对肿瘤细胞活力的影响
采用CCK-8法测定PRLAP对肿瘤细胞活力抑制率。首先用DMEM基础培养基将PRLAP配制成0、3.125、6.25、12.5、25、50、100 μg/mL 7个给药浓度。在37 ℃饱和湿度、5% CO2条件下培养A375、DLD-1、B16和MCF-7细胞。取对数生长期的细胞,分装到96孔板中,调整细胞浓度使每孔约5000个细胞,在CO2培养箱中培养24 h。取不同浓度(0、3.125、6.25、12.5、25、50、100 μg/mL)的PRLAP溶液,依次从低浓度到高浓度加入96孔板中,每孔100 μL,在37 ℃培养箱中培养48 h。吸出孔内溶液,然后向每孔内加入100 μL含10% CCK-8试剂的基础培养基,在37 ℃培养箱内培养1~2 h,用酶标仪在450 nm处检测吸收值,根据公式(5)计算细胞活力。
细胞活力(%)=A0−AnA0×100 (5) 式中:A0表示空白对照吸光值;An表示加入样品溶液吸光值。
1.3 数据处理
实验结果均为三次平行实验,数据表示为Mean(平均值)±SD(标准差)。并采用Microsoft Office Excel 2019、SPSS 23.0及GraphPad Prism 8软件进行实验数据的处理、分析及绘图。
2. 结果与分析
2.1 单因素实验结果
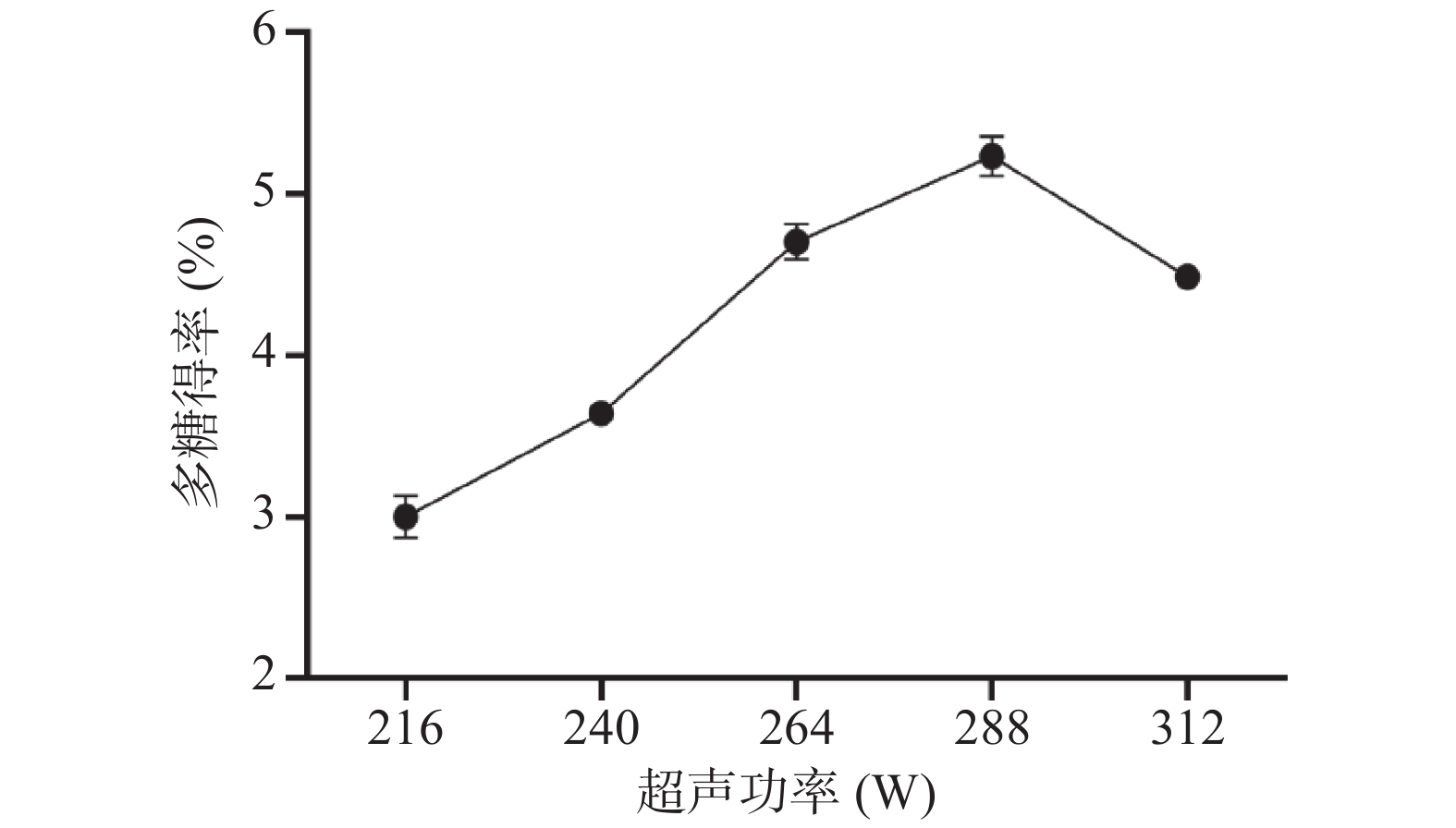
2.1.1 超声功率对PRLAP得率的影响
从图1可以看出,超声功率在216~288 W范围内多糖得率随功率升高而增大,到288 W时达到最大值为5.24%±0.12%,这是由于超声波的空化作用使细胞易于破碎,有利于多糖析出。当功率超过288 W时多糖得率下降,这可能是因为超声功率过大,对细胞的破坏作用增大,使多糖的糖苷键断裂,引起多糖解聚从而使得得率降低[27-28]。因此,选取264、288、312 W进行正交试验。
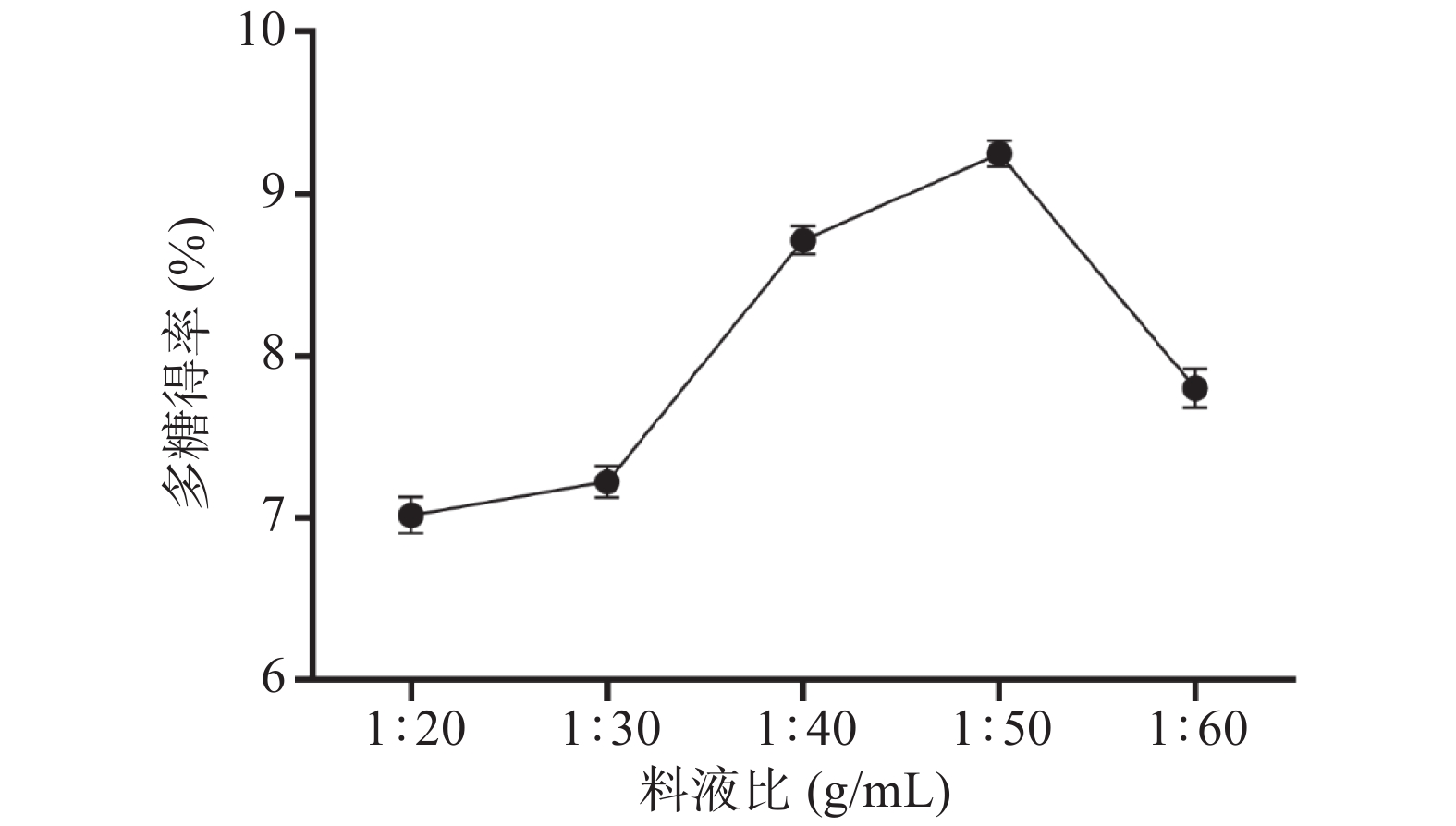
2.1.2 料液比对PRLAP得率的影响
由图2可知,多糖得率随料液比得增大而提高,到1:50(g/mL)时达到最大值为9.25%±0.08%,之后得率开始下降。原因可能是溶剂与原料的比例越大,植物细胞内部与外部溶剂的浓度差异越大,多糖的扩散速度也越快,更多的多糖分子可溶于水中,从而提高得率。但如果继续增加溶剂与原料的比例,水溶性多糖的浓度也会降低,导致溶剂挥发量增加,能量消耗增加,得率下降[29]。因此,选取1:40、1:50、1:60(g/mL)进行正交试验。
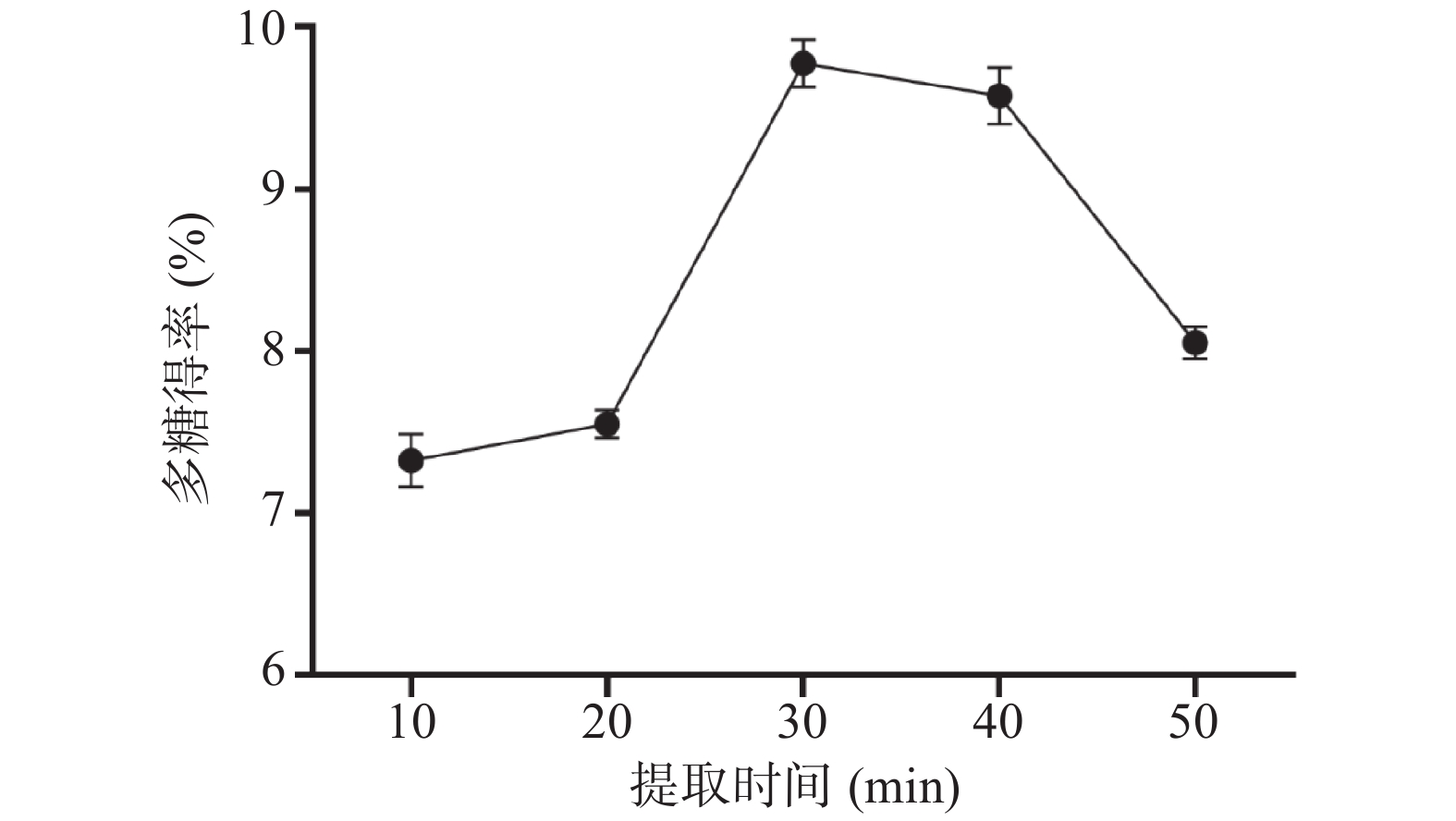
2.1.3 提取时间对PRLAP得率的影响
从图3可以看出,多糖得率在10~30 min范围内随时间的增加而提高,随着时间的延长,鸡蛋花细胞破碎使多糖释放,到30 min时达到最大值为9.78%±0.14%,但超声波作用时间过长,空化作用力会使得提取物中部分多糖糖链受到破坏,导致得率下降[30]。因此选择20、30、40 min进行正交试验。
2.1.4 提取温度对PRLAP得率的影响
从图4可以看出,鸡蛋花多糖得率在40 ℃时达到最高值为13.34% ± 0.18%,随着温度的升高,多糖溶解度增加,因此多糖得率提高。当提取温度超过40 ℃时,多糖得率降低;可能是因为较高温度会导致空化气泡数目减少,空化效应减弱从而导致多糖得率降低[31]。因此,选择35、40、45 ℃进行正交试验。
2.2 正交试验结果分析
按1.2.3给出的水平来设计L9(34)正交试验,得鸡蛋花多糖最佳提取工艺参数,并考察各因素对鸡蛋花多糖得率影响的主次顺序。正交试验结果见表2,方差分析见表3。
表 2 正交试验结果Table 2. Orthogonal experiment results试验号 A超声功率 B料液比 C提取时间 D提取温度 得率(%) 1 1 1 1 1 10.78±0.012 2 1 2 2 2 11.04±0.027 3 1 3 3 3 10.20±0.045 4 2 1 2 3 9.34±0.023 5 2 2 3 1 13.03±0.004 6 2 3 1 2 7.50±0.037 7 3 1 3 2 9.85±0.010 8 3 2 1 3 9.43±0.007 9 3 3 2 1 11.17±0.013 K1 32.74 29.94 27.99 34.91 K2 30.12 33.59 31.50 28.92 K3 30.12 29.62 33.66 29.33 k1 10.91 9.98 9.33 11.64 k2 10.04 11.20 10.50 9.64 k3 10.10 9.87 11.22 9.78 R 0.87 1.32 1.89 2.00 因素主次 D>C>B>A 最佳工艺 A1B2C3D1 表 3 PRLAP正交试验方差分析Table 3. Variance analysis of orthogonal experiment of PRLAP方差来源 III类平方和 自由度 均方 F P A超声功率 3.33 2 1.665 29.82 ** B料液比 8.262 2 4.131 73.983 ** C提取时间 16.185 2 8.092 144.918 ** D提取温度 23.735 2 11.867 212.523 ** 误差 1.005 18 0.056 总计 2926.225 27 修正后总计 52.517 26 R2=0 .981(调整后R2=0.972) 注:** P<0.01,表示差异性极显著;* P<0.05,表示差异性显著。 如表2所示,通过直观分析得出影响鸡蛋花多糖得率主次因素依次是提取温度(D)>提取时间(C)>料液比(B)>超声功率(A),最佳提取工艺组合为A1B2C3D1,即超声功率为264 W、料液比为1:50(g/mL)、提取时间为40 min、提取温度为35 ℃。由表3方差分析可得,超声功率、料液比、提取时间、提取温度达到极显著水平(P<0.01),说明主效应存在,四种因素会对鸡蛋花多糖得率产生差异关系。
为了评价最佳提取工艺的稳定性,称取鸡蛋花干燥花粉末3 g进行重复实验,多糖提取率分别为13.95%、13.98%和14.11%,平均值为14.01%±0.22%。相对偏差(RSD)为1.6%,表明该工艺重复性良好,适合鸡蛋花多糖的提取。
2.3 PRLAP体外抗氧化活性测定
2.3.1 DPPH自由基清除能力
由图5可知,PRLAP对DPPH的清除作用呈浓度依赖型,在0.016~0.500 mg/mL范围内随着浓度的升高清除作用显著增强,质量浓度大于0.500 mg/mL后,清除作用增强缓慢,浓度到1 mg/mL时清除率可达到94.44%±0.17%,此浓度下VC对DPPH自由基的清除率为94.95%±0.63%,这时PRLAP对DPPH的清除率与VC相当,说明PRLAP具有较强的清除DPPH自由基的作用。PRLAP清除DPPH自由基的IC50为0.1934 mg/mL。DAWOOD等[21]研究表明白鸡蛋花叶多糖浓度在3 mg/mL时,对DPPH自由基清除率为84.18%。由此可知,PRLAP清除DPPH自由基的作用远强于白鸡蛋花叶多糖。PRLAP可作为抗氧化剂进一步开发利用。
2.3.2 ABTS自由基清除能力
由图6可知,PRLAP在0.016~0.500 mg/mL范围内随着浓度的升高对ABTS自由基清除率显著增强,质量浓度大于0.500 mg/mL后,清除作用趋于平缓,多糖浓度为1 mg/mL时其对ABTS自由基的清除作用与VC接近,说明PRLAP对ABTS自由基的清除能力较强。PRLAP清除ABTS自由基的IC50为0.2315 mg/mL。由此可知,PRLAP对ABTS自由基和DPPH自由基都具有较强的清除能力,这与文献报道的金针菇多糖[24]具有相似的抗氧化活性。
2.3.3 OH自由基清除能力
由图7可知,PRLAP对OH自由基具有一定的清除能力,随着PRLAP浓度升高,清除率增强。当浓度为1 mg/mL时OH自由基清除率可达到35.38%±3.20%,其清除效果与文献报道的绿球藻多糖[32]和滑子菇多糖[33]相当。PRLAP清除OH自由基的IC50为2.469 mg/mL。虽然PRLAP对OH自由基清除效果弱于VC,但具有一定的清除作用。上述可知,PRLAP对ABTS自由基和DPPH自由基具有较强的清除作用,而对OH自由基清除效果较弱,这是因为多糖含有较多羟基,可提供质子与ABTS自由基和DPPH自由基反应,达到抗氧化作用[34]。而OH自由基通常是以氧化其它物质(亲电加成反应)而达到清除作用[35],因此PRLAP对OH自由基的清除作用弱于ABTS自由基和DPPH自由基。
2.4 PRLAP体外抗菌活性评价
由表4可知,五种菌种的MIC顺序为铜绿假单胞菌=肺炎克雷伯菌=鲍曼不动杆菌>大肠杆菌>金黄色葡萄球菌,金黄色葡萄球菌的MIC最低为0.195 mg/mL,大肠杆菌的MIC相对较低为0.391 mg/mL,PRLAP对铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌的MIC相同均为1.562 mg/mL。结果表明PRLAP对以上五种菌种都有一定的抑制作用,其中对金黄色葡萄球菌的抑制效果最好。该结果与THIN等[36]提取的Plumeria acutifolia Poir.茎皮水提物抑菌活性具有一致性,其对金黄色葡萄球菌抑菌效果最好,抑菌圈为12 mm。
表 4 PRLAP的MICTable 4. Minimum inhibitory concentration of PRLAP供试菌种 PRLAP浓度(mg/mL) 50 25 12.5 6.25 3.125 1.562 0.781 0.391 0.195 0.098 大肠杆菌 — — — — — — — — ++ +++ 金黄色葡萄球菌 — — — — — — — — — ++ 铜绿假单胞菌 — — — — — — ++ +++ ++++ ++++ 肺炎克雷伯菌 — — — — — — ++ +++ ++++ ++++ 鲍曼不动杆菌 — — — — — — ++ +++ ++++ ++++ 注:“—”无菌生长;“+”与菌落呈正相关。 2.5 PRLAP体外抗肿瘤活性评价
从图8可以看出,在3.125~100 μg/mL浓度范围内,A375、B16、MCF-7细胞活力与多糖溶液浓度呈剂量依赖性,随多糖浓度的增大而减小且与对照组相比具有显著性差异(P<0.05),说明PRLAP对这三种肿瘤细胞增殖具有一定的抑制作用,其中对MCF-7细胞活力抑制效果与DAWOOD等[37]研究结果近似,在6.25~100 µg/mL浓度范围内短穗鱼尾葵果实和丛榈果实多糖对MCF-7细胞活力都有较好的抑制作用。而DLD-1细胞活力与空白对照相比变化不大,PRLAP对DLD-1细胞增殖抑制效果不明显,说明在此浓度范围内DLD-1对PRLAP不敏感。经计算A375、B16、MCF-7细胞的IC50值分别为101.3、285.6、423.1 μg/mL。
3. 结论
本研究通过单因素实验和L9(34)正交试验优化了PRLAP提取工艺,分析得出超声功率、料液比、提取时间、提取温度对鸡蛋花多糖得率的影响,并确定了最佳提取工艺:超声功率264 W、料液比1:50(g/mL)、提取时间40 min、提取温度35 ℃,在此条件下多糖得率为14.01%±0.22%,说明此工艺提取参数可靠,提取效率高,适合PRLAP的提取。此外,PRLAP具有良好的体外抗氧化、抗菌、抗肿瘤活性。抗氧化实验结果表明,PRLAP对DPPH、ABTS自由基具有较强的体外抗氧化活性,当浓度为1 mg/mL时,PRLAP对这两种自由基的清除率可达90%以上,接近VC的效果,与DPPH和ABTS清除率相比PRLAP对OH自由基的清除能力稍弱,但也具有一定的抑制作用,由此可见,PRLAP可作为一种潜在的天然抗氧化剂应用在食品、医药等领域。此外,通过大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌的MIC测定结果可知,鸡蛋花多糖对上述供试菌均有一定的抑制作用,MIC分别为0.391、0.195、1.562、1.562、1.562 mg/mL,其中对金黄色葡萄球菌的抑制效果最好,其MIC最小。本研究选取了A375、B16、DLD-1、MCF-7细胞来检测PRLAP对肿瘤细胞增殖的抑制作用,结果表明除DLD-1细胞外,此多糖对A375、B16、MCF-7细胞活力均有一定的抑制效果,细胞活力随PRLAP浓度的增大而减小,但其作用机制还有待深入研究。
本研究主要集中在鸡蛋花多糖提取工艺、体外活性方面。此后还需要对PRLAP进行分离纯化和结构鉴定,并进一步研究PRLAP与其活性之间的关系。此外,为了更好地确定PRLAP对人体健康的影响,必须进行体内实验和临床研究,使其在食品、医药和医学领域得到更广泛的应用。
-
表 1 L9(34)正交试验因素水平及编码
Table 1 The factors and levels of L9(34)orthogonal experiment
水平 因素 A超声功率
(W)B料液比
(g/mL)C提取时间
(min)D提取温度
(℃)1 264 1:40 20 35 2 288 1:50 30 40 3 312 1:60 40 45 表 2 正交试验结果
Table 2 Orthogonal experiment results
试验号 A超声功率 B料液比 C提取时间 D提取温度 得率(%) 1 1 1 1 1 10.78±0.012 2 1 2 2 2 11.04±0.027 3 1 3 3 3 10.20±0.045 4 2 1 2 3 9.34±0.023 5 2 2 3 1 13.03±0.004 6 2 3 1 2 7.50±0.037 7 3 1 3 2 9.85±0.010 8 3 2 1 3 9.43±0.007 9 3 3 2 1 11.17±0.013 K1 32.74 29.94 27.99 34.91 K2 30.12 33.59 31.50 28.92 K3 30.12 29.62 33.66 29.33 k1 10.91 9.98 9.33 11.64 k2 10.04 11.20 10.50 9.64 k3 10.10 9.87 11.22 9.78 R 0.87 1.32 1.89 2.00 因素主次 D>C>B>A 最佳工艺 A1B2C3D1 表 3 PRLAP正交试验方差分析
Table 3 Variance analysis of orthogonal experiment of PRLAP
方差来源 III类平方和 自由度 均方 F P A超声功率 3.33 2 1.665 29.82 ** B料液比 8.262 2 4.131 73.983 ** C提取时间 16.185 2 8.092 144.918 ** D提取温度 23.735 2 11.867 212.523 ** 误差 1.005 18 0.056 总计 2926.225 27 修正后总计 52.517 26 R2=0 .981(调整后R2=0.972) 注:** P<0.01,表示差异性极显著;* P<0.05,表示差异性显著。 表 4 PRLAP的MIC
Table 4 Minimum inhibitory concentration of PRLAP
供试菌种 PRLAP浓度(mg/mL) 50 25 12.5 6.25 3.125 1.562 0.781 0.391 0.195 0.098 大肠杆菌 — — — — — — — — ++ +++ 金黄色葡萄球菌 — — — — — — — — — ++ 铜绿假单胞菌 — — — — — — ++ +++ ++++ ++++ 肺炎克雷伯菌 — — — — — — ++ +++ ++++ ++++ 鲍曼不动杆菌 — — — — — — ++ +++ ++++ ++++ 注:“—”无菌生长;“+”与菌落呈正相关。 -
[1] 武爱龙, 吴建阳, 卓海容. 鸡蛋花的研究进展[J]. 农业科技通讯,2017(7):55−58. [WU A L, WU J Y, ZHU H R. Research progress of Plumeria[J]. Agricultural Science and Technology Newsletter,2017(7):55−58. doi: 10.3969/j.issn.1000-6400.2017.07.020 [2] 邓仙梅, 刘敬, 谢文琼, 等. 凉茶常用药材鸡蛋花的研究进展[J]. 时珍国医国药,2014,25(1):198−200. [DENG X M, LIU J, XIE W Q, et al. The research progress of medicinal herbs Plumeria commonly used herbal tea[J]. Lishizhen Medicine and Materia Medica Research,2014,25(1):198−200. [3] BACAR J N B, TAN M C S, SHEN C C, et al. Triterpenes from Plumeria rubra L. flowers[J]. International Journal of Pharmacognosy and Phytochemical Research,2017,9(2):248−252.
[4] 洪挺, 余勃, 陆豫, 等. 鸡蛋花中化学成分及生物活性研究进展[J]. 天然产物研究与开发,2011,23(3):565-568, 570-589. [HONG T, YU B, LU Y, et al. Research progress on chemical constituents and biological activities of Plumeria[J]. Natural Product Research and Development,2011,23(3):565-568, 570-589. [5] XIA Y Y, LIN C Z, LU X J, et al. New iridoids from the flowers of Plumeria rubra “acutifolia”[J]. Phytochemistry Letters,2018,25:81−85. doi: 10.1016/j.phytol.2018.02.003
[6] MOHAMED ISA S S P, ABLAT A, MOH AMAD J. The antioxidant and xanthine oxidase inhibitory activity of Plumeria rubra flowers[J]. Molecules,2018,23(2):400−417. doi: 10.3390/molecules23020400
[7] DOBHAL M P, HASAN A M, SHARMA M C, et al. Ferulic acid esters from Plumeria bicolor[J]. Phytochemistry,1999,51(2):319−321. doi: 10.1016/S0031-9422(99)00006-0
[8] KUMARSHARMA S, KUMAR N, SULTANA S, et al. Chemical constituents from the stem barks of Plumeria rubra L.[J]. Research Journal of Pharmacognosy,2018,5(3):69−78.
[9] ALHOZAIMY A G, ALSHEDDI E S, IBRAHIM T A. Biological activity and isolation of compounds from stem bark of Plumeria acutifolia[J]. Pharmacognosy Magazine, 2017, 13(Suppl 3): S505-S511.
[10] YOGESH N. Evaluation of in vivo anticancer activity of ethanolic extract of leaf of Plumeria acutifolia on daltons ascites lymphoma induced cancer in mice[D]. Komarapalayam: JKK Nattraja College of Pharmacy, 2017.
[11] YADAV A V, UNDALE V R. Antidiabetic effect of Plumeria rubra Linn. in streptozotocin induced diabetic rats[J]. Intenational Journal of Ternational Pharmaceutical Science and Research,2017,8(4):1806−1812.
[12] LIU Y, SUN Y Y, HUANG G L. Preparation and antioxidant activities of important traditional plant polysaccharides[J]. International Journal of Biological Macromolecules,2018,111:780−786. doi: 10.1016/j.ijbiomac.2018.01.086
[13] CHEN F, HUANG G L. Preparation and immunological activity of polysaccharides and their derivatives[J]. International Journal of Biological Macromolecules,2018,112:211−216. doi: 10.1016/j.ijbiomac.2018.01.169
[14] FU Y, SHI L, DING K. Structure elucidation and anti-tumor activity in vivo of a polysaccharide from spores of Ganoderma lucidum(Fr.) Karst[J]. International Journal of Biological Macromolecules,2019,141:693−699. doi: 10.1016/j.ijbiomac.2019.09.046
[15] KHEMAKHEM I, ABDELHEDI O, TRIGUI I, et al. Structural, antioxidant and antibacterial activities of polysaccharides extracted from olive leaves[J]. International Journal of Biological Macromolecules,2018,106:425−432. doi: 10.1016/j.ijbiomac.2017.08.037
[16] XIE Z L, WANG Y, HUANG J Q, et al. Anti-inflammatory activity of polysaccharides from Phellinus linteus by regulating the NF-kappaB translocation in LPS-stimulated RAW264.7 macrophages[J]. International Journal of Biological Macromolecules,2019,129:61−67. doi: 10.1016/j.ijbiomac.2019.02.023
[17] SUN Y H, CHEN X L, ZHANG L L, et al. The antiviral property of Sargassum fusiforme polysaccharide for avian leukosis virus subgroup J in vitro and in vivo[J]. International Journal of Biological Macromolecules,2019,138:70−78. doi: 10.1016/j.ijbiomac.2019.07.073
[18] SHANG H M, ZHAO J C, GUO Y, et al. Extraction, purification, emulsifying property, hypoglycemic activity, and antioxidant activity of polysaccharides from comfrey[J]. Industrial Crops and Products,2020,146:112183−112194. doi: 10.1016/j.indcrop.2020.112183
[19] WANG W S, SONG X L, GAO Z, et al. Anti-hyperlipidemic, antioxidant and organic protection effects of acidic-extractable polysaccharides from Dictyophora indusiata[J]. International Journal of Biological Macromolecules,2019,129:281−292. doi: 10.1016/j.ijbiomac.2019.01.182
[20] SHARMA G, CHAHAR M K, DOBHAL S, et al. Phytochemical constituents, traditional uses, and pharmacological properties of the genus Plumeria[J]. Chemistry & Biodiversity,2011,8(8):1357−1369.
[21] DAWOOD D, HASSAN R. Antioxidant activity evaluation of methanolic extract and crude polysaccharides from Plumeria alba L. leaves[J]. Journal of Agricultural Chemistry Biotechnology,2015,6(11):489−507. doi: 10.21608/jacb.2015.48461
[22] 何蓉蓉, 栗原博, 宝丽, 等. 王老吉凉茶对应激小鼠糖代谢机能及体内过氧化状态的影响[J]. 中成药,2008(8):1111−1114. [HE R R, LI Y B, BAO L, et al. Effect of Wanglaoji Cool Tea on plasma glucometabaolism and peroxidative state in stress mice[J]. Chinese Traditonal Patent Medicine,2008(8):1111−1114. doi: 10.3969/j.issn.1001-1528.2008.08.007 [23] 梁雪, 倪秀珍, 汉丽萍. 响应面法优化超声辅助提取桦剥管菌多糖及其抗氧化活性研究[J]. 中国食品添加剂,2019,30(6):65−72. [LIANG X, NI X Z, HAN L P. Optimization of ultrasonic-assisted extraction of polysaccharides from Piptoporus betulinus by response surface methodology and the study of its antioxidant activity[J]. China Food Additives,2019,30(6):65−72. doi: 10.3969/j.issn.1006-2513.2019.06.008 [24] WANG Y F, JIA J X, REN X J, et al. Extraction, preliminary characterization andin vitro antioxidant activity of polysaccharides from Oudemansiella radicata mushroom[J]. International Journal of Biological Macromolecules,2018,120:1760−1769. doi: 10.1016/j.ijbiomac.2018.09.209
[25] TANG Q L, HUANG G L. Preparation and antioxidant activities of cuaurbit polysaccharide[J]. International Journal of Biological Macromolecules,2018,117(10):362−365.
[26] 王迦琦, 许梦然, 高婧文, 等. 北虫草多糖提取工艺优化及其细胞氧化损伤保护作用[J]. 食品工业科技,2020,41(13):141−147. [WANG J Q, XU M R, GAO J W, et al. Optimization of extraction process of Cordyceps militaris polysaccharide and its protective effect on cellular oxidative damage[J]. Science and Technology of Food Industry,2020,41(13):141−147. [27] SUQUILA F A C, SCHEEL G L, DE OLIVEIR F M, et al. Assessment of ultrasound-assisted extraction combined with supramolecular solvent-based microextraction for highly sensitive cadmium determination in medicinal plant sample by TS-FF-AAS[J]. Microchemical Journal,2019,145:1071−1077. doi: 10.1016/j.microc.2018.12.011
[28] ZHANG L, ZHOU C S, WANG B, et al. Study of ultrasonic cavitation during extraction of the peanut oil at varying frequencies[J]. Ultrasonics Sonochemistry,2017,37:106−113. doi: 10.1016/j.ultsonch.2016.12.034
[29] NUERXIATI R, ABUDUWAILI A, MUTAILIFU P, et al. Optimization of ultrasonic-assisted extraction, characterization and biological activities of polysaccharides from Orchischusua D. Don (Salep)[J]. International Journal of Biological Macromolecules,2019,141:431−443. doi: 10.1016/j.ijbiomac.2019.08.112
[30] CHEN R Z, LI Y, DONG H, et al. Optimization of ultrasonic extraction process of polysaccharides from Ornithogalum caudatum Ait and evaluation of its biological activities[J]. Ultrasonics Sonochemistry,2012,19(6):1160−1168. doi: 10.1016/j.ultsonch.2012.03.008
[31] SURIN S, YOU S G, SEESURIYACHAN P, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from purple glutinous rice bran (Oryza sativa L.) and their antioxidant activities[J]. Scientific Reports,2020,10(1):1−10. doi: 10.1038/s41598-019-56847-4
[32] 李旭东. 绿球藻多糖的分离纯化、抗氧化和抑菌活性研究[D]. 太原: 山西大学, 2020. LI X D. Study on isolation and purification, antioxidation and antibacterial activity of Chlorococcum sp. GD polysaccharide[D]. Taiyuan: Shanxi University, 2020.
[33] 韩丹. 滑子菇多糖提取、结构及体外抗氧化活性研究[D]. 天津: 天津科技大学, 2018. HAN D. Extraction structural properties and antioxidant activity of polysaccharides from Pholiota nameko[D]. Tianjin: Tianjin University of Science and Technology, 2018.
[34] 李现日, 张杰, 张英美, 等. 金花葵花黄酮提取物不同溶剂萃取物的抗氧化活性[J]. 食品工业科技,2019,40(11):120−125. [LI X R, ZHANG J, ZHANG Y X, et al. Antioxidant activity of extracts from different polar solvents of flavonoid extract of Aurea helianthus flower[J]. Science and Technology of Food Industry,2019,40(11):120−125. [35] 李灵香玉, 马香娟. 羟基自由基(·OH)的特性及其在光化学氧化中的反应机理[J]. 化工技术与开发,2006,4(8):27−29. [LI L X Y, MA X J. Characteristics of hydroxide radical and its reaction mechanism in photochemistry oxidation process[J]. Technology and Development of Chemical Industry,2006,4(8):27−29. doi: 10.3969/j.issn.1671-9905.2006.08.010 [36] SINT T T, TUN A A, HTAY M M. Evaluation of antipyretic activity and structural identification of chemical constituent from the bark of Plumeria acutifolia Poir.(Tayoke Saga)[J]. 3rd Myanmar Korea Conference Research Journal,2020,3(5):1944−1952.
[37] DAWOOD D H, ELMONGY M S, NEGM A, et al. Extraction and chemical characterization of novel water-soluble polysaccharides from two palm species and their antioxidant and antitumor activities[J]. Egyptian Journal of Basic and Applied Sciences,2020,7(1):141−158. doi: 10.1080/2314808X.2020.1773126
-
期刊类型引用(5)
1. 尚学钰,美合日班,苏玲,王琦. 黑木耳可溶性膳食纤维功能特性和降脂活性研究. 食品工业科技. 2025(02): 112-121 .  本站查看
本站查看
2. 张潇予,王丹妮,柴欣,于卉娟,崔英,王跃飞. 补骨脂的质量特征解析及其在减毒工艺中的应用. 中草药. 2024(08): 2784-2791 .  百度学术
百度学术
3. 马力亚,李梅梅,黄玉卓,舒劲. 四神丸治疗溃疡性结肠炎的研究概况. 中医药临床杂志. 2024(05): 987-994 .  百度学术
百度学术
4. 徐波,陈天天,杜薛平,张海峰,陈伟,黄凯健,董大勇. 益肾化痰祛瘀方治疗绝经后骨质疏松症(肾虚血瘀型)的效果及对氧化应激的影响. 中医药学报. 2024(09): 60-63 .  百度学术
百度学术
5. 钟婉滢,苗建银,叶灏铎,马凤,胡一晨. 藜麦蛋白肽的酶解制备及体外降血脂与降尿酸活性研究. 食品工业科技. 2023(23): 156-166 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:










 下载:
下载:



