Optimization of Preparation Process of Antioxidant Peptides in the Visceral Mass of Cucumaria frondosa by Response Surface Methodology and Its Composition Analysis
-
摘要: 以冰岛刺参内脏团蛋白为原料,利用复合蛋白酶酶解制备抗氧化肽。在单因素实验基础上,通过响应面法优化酶解工艺条件,并分析其抗氧化活性、分子量分布和氨基酸组成。结果表明,最佳工艺条件为底物质量分数4.4%,加酶量4887 U/g,pH7.0,酶解温度56 ℃,酶解时间4.2 h,在该条件下,2 mg/mL酶解产物的DPPH自由基清除率可达89.18%±0.11%,0.5 mg/mL酶解产物的ABTS自由基清除率和Fe2+螯合率分别为68.11%±0.12%、72.59%±0.08%,1.5 mg/mL酶解产物的羟基自由基清除率和还原力分别为71.86%±0.09%、0.7473±0.0105;分子量分布和氨基酸分析表明,冰岛刺参内脏团抗氧化肽中分子量低于1000 Da的肽占94.26%,富含酸性氨基酸和疏水性氨基酸,具有较高的抗氧化活性和营养价值。该研究为冰岛刺参深加工产业的发展提供了技术参考。Abstract: Using the protein of Cucumaria frondosa visceral mass as raw material, antio-xidant peptides were prepared by enzymatic hydrolysis with complex protease. On the basis of single factor experiments, the enzymatic hydrolysis process conditions were optimized by response surface methodology, and its antioxidant activity, molecular weight distribution and amino acid composition were analyzed. The results showed that the optimum process conditions were substrate mass fraction 4.4%, enzyme dosage 4887 U/g, pH7.0, enzymolysis temperature 56 ℃ and enzymolysis time 4.2 h. Under these conditions, the DPPH radical scavenging rate of 2 mg/mL hydrolysate was 89.18%±0.11%, the ABTS free radical scavenging rate and Fe2+ chelating rate of 0.5 mg/mL hydrolysate were 68.11%±0.12% and 72.59%±0.08%, the hydroxyl radical scavenging rate and reducing power of 1.5 mg/mL hydrolysate were 71.86%±0.09% and 0.7473±0.0105; Molecular weight distribution and amino acid analysis showed that the antioxidant peptides in the visceral mass of Cucumaria frondosa, peptides with a molecular weight of less than 1000 Da accounted for 94.26%, they were rich in acidic and hydrophobic amino acids and had high antioxidant activity and nutritional value. This study provides a technical reference for the development of deep processing industry of Cucumaria frondosa.
-
冰岛刺参(Cucumaria frondosa)属棘皮动物门(Echinodermata)海参纲(Holothuroidea)枝手目(Dendrochirotida)瓜参科(Cucumariidae)海洋动物[1],主要分布在冰岛、挪威及俄罗斯等国家附近海域[2],其富含蛋白质、多糖、三萜糖苷、脂类等活性物质,具有抗癌、抗炎、降血糖、抗衰老和免疫调节等多种功能活性[3-4]。冰岛刺参内脏团是冰岛刺参初级加工过程中的副产物,其蛋白质、氨基酸含量丰富,是优质的动物蛋白资源[5-6],但由于缺乏深层次的研究和利用,冰岛刺参内脏团多被当作废弃物丢弃或售卖给饲料加工企业,不仅无法有效提高冰岛刺参的附加值,而且造成资源的严重浪费。
生物活性肽是一类对人体生命活动有益或具有生理作用的肽类化合物[7]。相较于蛋白质,生物活性肽不仅易于消化吸收,还具有抗氧化、抗菌、降血压、免疫调节等多种生理功效[8-11],已然成为近年来的研究热点。目前,关于以海洋生物制备抗氧化肽的研究较为广泛,制备方法主要有酶解法、微生物发酵法、化学合成法等,其中酶解法因其特异性强,工艺较为成熟而备受关注,如李娜等[12]利用酶解法制备鳕鱼鱼鳔抗氧化肽,其具有良好的羟基自由基清除能力和亚铁离子螯合能力,显示出较强的抗氧化活性;李亚会等[13]通过动物蛋白酶和风味蛋白酶联合水解远东拟沙丁鱼制备抗氧化肽,分离纯化得到氨基酸序列为Arg-Phe-Asp和Phe-Ala-His-Asp-Asp-Pro的两个多肽组分,其ABTS自由基清除率分别为81.22%±4.12%和76.35%±3.32%;SIERRA等[14]酶解红罗非鱼鳞片并研究其抗氧化活性,结果表明,分子量3~10 kDa的组分具有最强的抗氧化活性。但以冰岛刺参内脏团为原料,制备抗氧化肽的研究则鲜见报道,因此,利用冰岛刺参内脏团制备生物活性肽,不仅可以为资源的不合理利用提供解决方案,还能为冰岛刺参加工产业的发展提供新的方向。
本研究以冰岛刺参内脏团为原料,以DPPH自由基清除率为评价指标,采用复合蛋白酶酶解制备冰岛刺参内脏团抗氧化肽,通过单因素实验和响应面法优化冰岛刺参内脏团蛋白的酶解条件,并分析其抗氧化活性、分子质量分布和氨基酸组成,旨在为利用冰岛刺参内脏团生产抗氧化肽提供理论依据,并进一步促进冰岛刺参深加工产业的发展。
1. 材料与方法
1.1 材料与仪器
冰岛刺参内脏团(含性腺、呼吸道、肠道等) 山东中硕海洋科技有限公司;复合蛋白酶(经预实验由胰蛋白酶、中性蛋白酶以及氨肽酶按50:49.9:0.1复配而成,1.2×105 U/g) 北京索莱宝科技有限公司;过氧化氢(H2O2)、三氯乙酸(TCA)、硫酸亚铁(FeSO4·7 H2O)、氯化亚铁(FeCl2)、铁氰化钾(K3[Fe(CN)6])、氯化铁(FeCl3)、L-色氨酸、对二氨基苯甲醛 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2´-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS) 上海阿拉丁生化科技股份有限公司;1,10-菲啰啉、菲啰嗪 美国Sigma公司;其他试剂 均为国产分析纯。
FA1004型电子天平 上海上平仪器有限公司;HH型数显恒温水浴锅 常州国宇仪器制造有限公司;TG16-WS型台式高速离心机 湖南湘仪实验室仪器开发有限公司;UV-9000型紫外可见分光光度计 上海元析仪器有限公司;SCIENTZ-18N型真空冷冻干燥机 宁波新芝生物科技股份有限公司;L-8900型高速氨基酸分析仪 日本日立有限公司;e2695型高效液相色谱仪 美国waters公司。
1.2 实验方法
1.2.1 冰岛刺参内脏团基本成分的测定
水分按照国标GB5009.3—2016直接干燥法测定;粗蛋白按照国标GB5009.5—2016凯氏定氮法测定;脂肪按照国标GB5009.6—2016索氏抽提法测定;灰分按照国标GB5009.4—2016第一法测定;多糖含量参照罗春萍等[15]描述的苯酚-硫酸法测定。
1.2.2 冰岛刺参内脏团蛋白提取
参照李云嵌等[16]的方法并略作修改。冰岛刺参内脏团冷冻干燥后,通过亚临界法脱除油脂,然后按料液比1:40 g/mL加入蒸馏水,调pH至10.0(1.0 mol/L的 NaOH溶液调节),设置超声功率50 W,温度50 ℃,超声提取30 min;冷却至室温,4 ℃,5000 r/min条件下离心10 min,取上清液调pH至3.0(1.0 mol/L的HCl溶液调节),在同样条件下离心,沉淀水洗3次,加水复溶后调pH至中性(1.0 mol/L的 NaOH溶液调节),离心取上清液,在冷阱温度−55 ℃,真空度1 Pa的条件下,冷冻干燥24 h得到冰岛刺参内脏团蛋白粉。
1.2.3 冰岛刺参内脏团抗氧化肽的制备
参照包斐等[17]的方法并略作修改。取适量冰岛刺参内脏团蛋白溶于蒸馏水中,配制成一定浓度的蛋白质溶液,调节酶反应条件,加入适量复合蛋白酶充分振荡后,置于恒温水浴锅中酶解,反应过程中维持相应pH条件,酶解结束后沸水浴灭酶10 min,冷却,4000 r/min离心10 min,收集上清液,即为冰岛刺参内脏团酶解产物,在冷阱温度−55 ℃,真空度1 Pa条件下,冷冻干燥24 h得到冰岛刺参内脏团肽粉。
1.2.4 单因素实验
固定酶解条件:底物质量分数1%、加酶量3000 U/g、pH7.0、酶解温度50 ℃、酶解时间2 h;分别对底物质量分数(1%、2%、3%、4%、5%、6%)、加酶量(1000、2000、3000、4000、5000、6000 U/g)、pH(5.5、6.0、6.5、7.0、7.5、8.0)、酶解温度(35、40、45、50、55、60 ℃)、酶解时间(1、2、3、4、5、6 h)5个因素进行单因素实验,以DPPH自由基清除率为评价指标,研究各因素对DPPH自由基清除率的影响。
1.2.5 响应面试验设计
在单因素实验基础上,固定酶解pH7.0,以A(底物质量分数)、B(加酶量)、C(酶解温度)、D(酶解时间)为自变量,DPPH自由基清除率为响应值进行优化,试验因素与水平编码见表1。
表 1 响应面试验因素与水平编码Table 1. Factors and level coding of response surface experiment水平 因素 A 底物质量
分数(%)B 加酶量
(U/g)C 酶解温
度(℃)D 酶解时
间(h)-1 3 4000 50 3 0 4 5000 55 4 1 5 6000 60 5 1.2.6 测定指标
1.2.6.1 DPPH自由基清除率的测定
参照ZHUANG等[18]的方法略作修改。将DPPH用95%乙醇配制成0.1 mmol/L的溶液,取2 mL浓度为2 mg/mL的样品溶液,加入2 mL DPPH溶液,暗处反应30 min,在517 nm处测定吸光值(A1);空白组用蒸馏水代替样品(A0);对照组用95%乙醇代替DPPH溶液(A2),每组测定重复3次。DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=[1−A1−A2A0]×100 式中,A1为样品组吸光值;A2为对照组吸光值;A0为空白组吸光值。
1.2.6.2 ABTS自由基清除率的测定
参照SARABABDI等[19]的方法略作修改。向烧杯中加入200 mL浓度为7 mmol/L的ABTS溶液和3.52 mL浓度为2.45 mmol/L的过硫酸钾,超声5 min混匀,避光反应12~16 h,之后用0.05 mol/L的磷酸盐缓冲液(pH7.4)稀释使其在734 nm处的吸光值为0.70±0.02,即为ABTS溶液,室温静置30 min即可使用。取0.15 mL浓度为0.5 mg/mL的样品溶液与2.85 mL ABTS溶液混合均匀,避光反应10 min,在734 nm处测定样品的吸光值A1。空白组用0.15 mL蒸馏水代替样品测定吸光值A0,每组测定重复3次。ABTS自由基清除率计算公式如下:
ABTS自由基清除率(%)=A0−A1A0×100 式中,A1为样品组吸光值;A0为空白组吸光值。
1.2.6.3 羟基自由基清除率的测定
参照李斌等[20]的方法略作修改。依次取1 mL 0.75 mmol/L的1,10-菲啰啉、2 mL 0.2 mol/L的磷酸盐缓冲液(pH7.4)、1 mL 0.75 mmol/L 的FeSO4·7H2O和1 mL浓度为1.5 mg/mL的样品溶液混匀,最后加入1 mL 0.01%(v/v)H2O2溶液,37 ℃水浴反应1 h,在536 nm处测定溶液的吸光值A1;空白组用1 mL蒸馏水代替样品测定吸光值A2;对照组用2 mL蒸馏水代替样品和H2O2测定吸光值A3,每组测定重复3次。羟基自由基清除率计算公式如下:
羟基自由基清除率(%)=A1−A2A3−A2×100 式中,A1为样品组吸光值;A2为空白组吸光值;A3为对照组吸光值。
1.2.6.4 Fe2+鳌合能力的测定
参照ZHENG等[21]的方法略作修改。取1 mL浓度为0.5 mg/mL的样品溶液与2 mL 0.05 mmol/L的 FeCl2溶液及2 mL 0.05 mmol/L的菲啰嗪溶液混匀,室温反应15 min,在562 nm处测定吸光值A1。空白组用1 mL蒸馏水代替样品测定吸光值A0,每组测定重复3次。Fe2+鳌合率计算公式如下:
Fe2+鳌合率(%)=A0−A1A0×100 式中,A1为样品组吸光值;A0为空白组吸光值。
1.2.6.5 还原力的测定
参照YOU等[22]的方法略作修改。取1 mL浓度为1.5 mg/mL的样品溶液与2.5 mL 0.2 mol/L的磷酸盐缓冲液(pH6.6)及2.5 mL 1%的 K3[Fe(CN)6]溶液,50 ℃水浴反应20 min,迅速冷却,并加入2.5 mL 10%的TCA溶液,3000 r/min离心10 min后取上清液2.5 mL,加入2.5 mL的蒸馏水及0.5 mL 0.1% 的FeCl3溶液,混匀,室温反应10 min,在700 nm处测定吸光值,用蒸馏水调零,重复测定3次。
1.2.6.6 分子量分布的测定
根据林栋等[23]的方法略作修改。配制浓度为10 mg/mL的样品溶液,采用Waters高效液相色谱仪(配2489紫外检测器),对样品溶液的分子量分布进行测定。色谱条件为:色谱柱:TSKgelG2000SWXL(300 mm×7.8 mm,5 μm);流动相:乙腈-水-三氟乙酸45∶55∶0.1(v/v/v);检测波长:220 nm;流速:0.5 mL/min;柱温:30 ℃;进样量10 μL。
1.2.6.7 氨基酸组成的测定
参照王颖颖等[24]的方法略作修改。称取0.05 g样品于水解管中,加入10 mL 6 mol/L的HCl混匀,连续吹入氮气后封口,在110 ℃下酸水解22~24 h。水解结束后过滤并用超纯水定容至50 mL,取适量滤液用0.02 mol/L HCl稀释5倍,最后通过0.22 μm微滤膜过滤上样,使用全自动氨基酸分析仪测定除色氨酸以外的氨基酸。
色氨酸的测定参照何峰等[25]的方法略作修改。标准曲线的绘制:准确称取10 mg L-色氨酸,加入0.1 mL 10% NaOH和少量水溶解并定容至100 mL。取0.2、0.4、0.6、0.8和1.0 mL色氨酸溶液并分别用蒸馏水定容至1 mL,加1 mL 6 mol/L的NaOH和5 mL 1%对二氨基苯甲醛(用9 mol/L硫酸溶解),摇匀,避光反应1 h,加入0.05 mL 0.2% NaNO2溶液,摇匀,室温放置30 min备用,以空白调零,在595 nm处测定各溶液的吸光值,得标准曲线方程为y=7.9317x+0.0195,R2=0.9981。
样品测定:取适量样品置于25 mL水解管中,加5 mL 6 mol/L NaOH溶液,110 ℃水解24 h,过滤水解液,调节pH6.0~8.0,并定容至100 mL。取2 mL上清液放入具塞试管中,加入5 mL 1%对二氨基苯甲醛溶液,摇匀。另取2 mL上清液加入5 mL 9 mol/L H2SO4作样品空白,摇匀,避光反应1 h。向每支试管加入0.05 mL 0.2% NaNO2溶液,摇匀,室温放置30 min。以样品空白调零,在595 nm处测定样品溶液的吸光值。
1.3 数据处理
采用IBM SPSS Statistics 21软件对单因素实验结果进行显著性差异分析;采用Design- Expert 11软件进行响应面试验设计及优化分析;所有实验均重复3次,实验数据以平均值±标准差(X±SD)表示。
2. 结果与分析
2.1 基本成分分析
鲜活冰岛刺参内脏团水分达到87.04%±0.21%,其他主要成分粗蛋白、多糖、脂肪、灰分分别占干重的比例如表2所示。
表 2 冰岛刺参内脏团基本成分表Table 2. Basic composition of Cucumaria frondosa visceral mass成分 粗蛋白 多糖 脂肪 灰分 含量(以干基计,%) 48.54±0.11 4.90±0.02 26.68±0.07 13.16±0.04 2.2 单因素实验
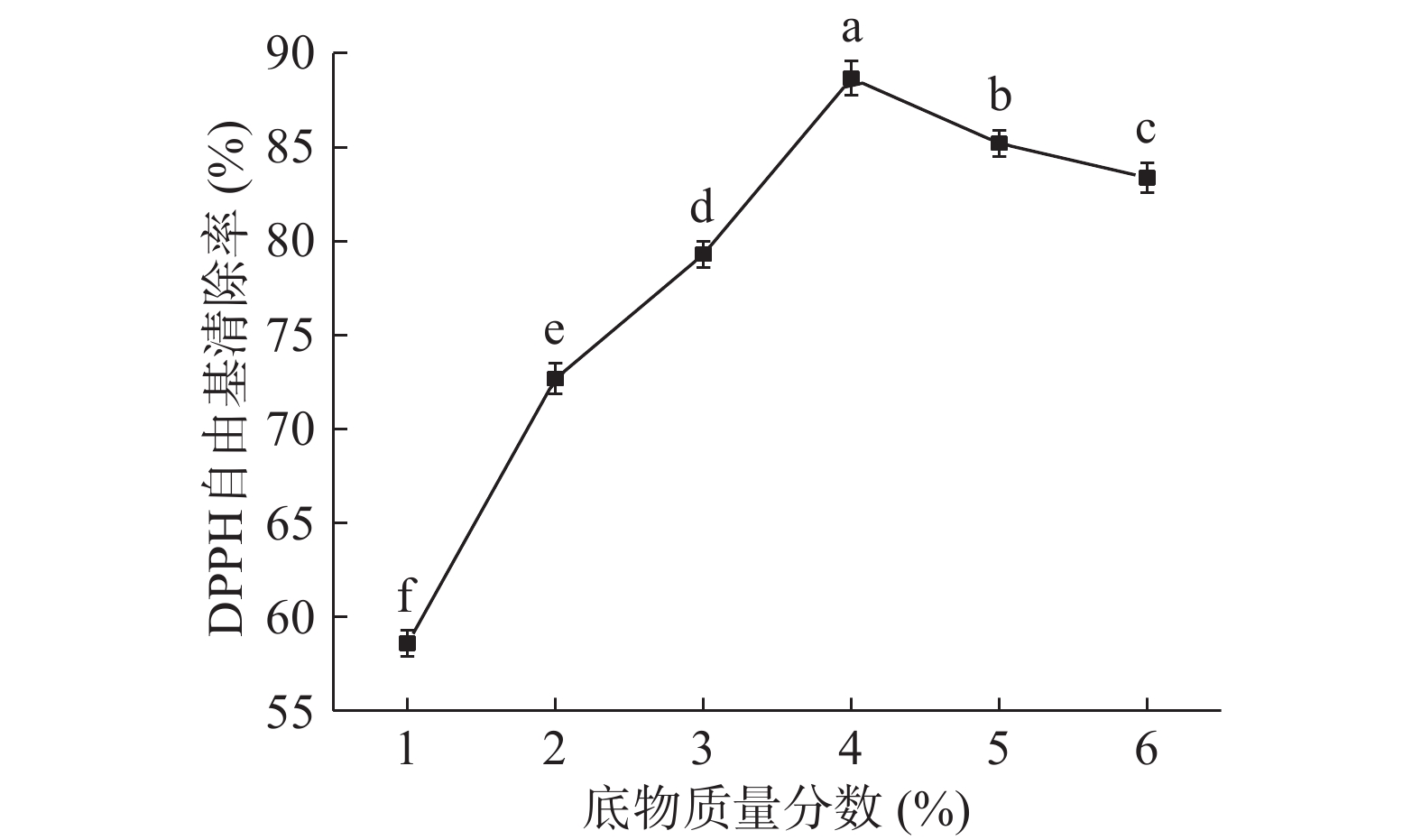
2.2.1 底物质量分数对DPPH自由基清除率的影响
由图1可知,当底物质量分数从1%增加到4%时,DPPH自由基清除率显著上升(P<0.05),随着底物质量分数的增加,酶与底物结合的机会增大,从而提高酶解速率,小分子抗氧化活性肽含量增加,抗氧化活性显著增强;当底物质量分数为4%时,DPPH自由基清除率达到最大值88.67%;继续增加底物质量分数,DPPH自由基清除率显著下降(P<0.05),这可能是由于底物质量分数较高时,蛋白吸水溶胀导致流动性变差,与蛋白酶接触不完全,酶解速率降低,抗氧化活性减弱。
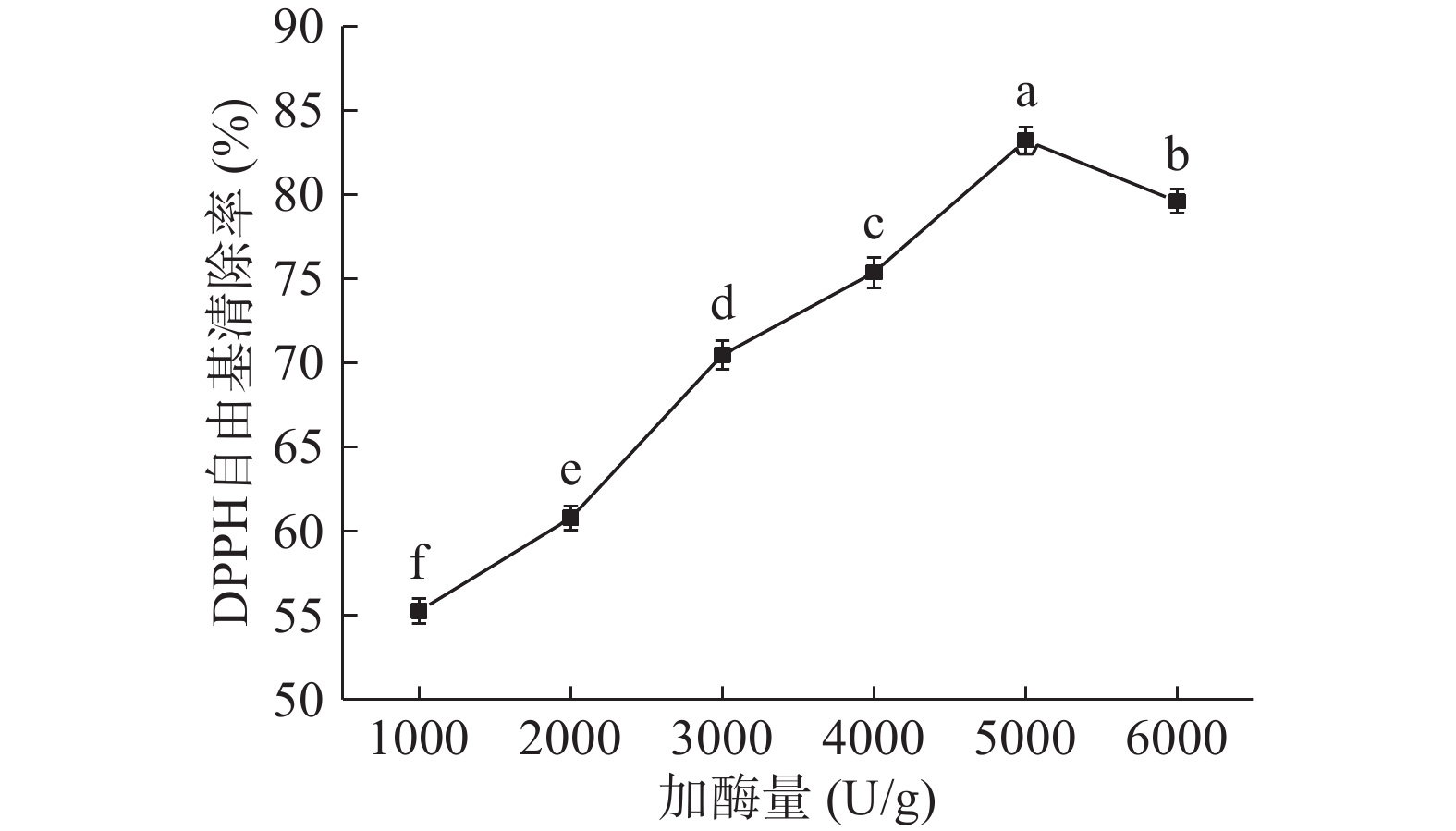
2.2.2 加酶量对DPPH自由基清除率的影响
由图2可知,当加酶量在1000~5000 U/g之间逐渐增加时,DPPH自由基清除率显著上升(P<0.05);当加酶量为5000 U/g时,DPPH自由基清除率达到最大值83.21%;继续提高加酶量,DPPH自由基清除率显著下降(P<0.05)。在底物质量分数一定时,加酶量从1000 U/g增加到5000 U/g,酶与底物接触完全,蛋白酶解充分,抗氧化肽含量增加,抗氧化活性增强;酶量过多,酶与底物结合位点达到过饱和,进而酶解已生成的抗氧化肽,抗氧化活性减弱。
2.2.3 pH对DPPH自由基清除率的影响
由图3可知,当pH处于5.5~7.0范围内时,DPPH自由基清除率随pH增加而增大;当pH为7.0时,DPPH自由基清除率达到最大值68.35%;当pH超过7.0时,DPPH自由基清除率逐渐减小。蛋白酶在适宜pH范围内才可以发挥较佳的酶解效果,偏酸或偏碱会使酶活力减弱甚至失活,导致酶解速率降低,抗氧化活性减弱。
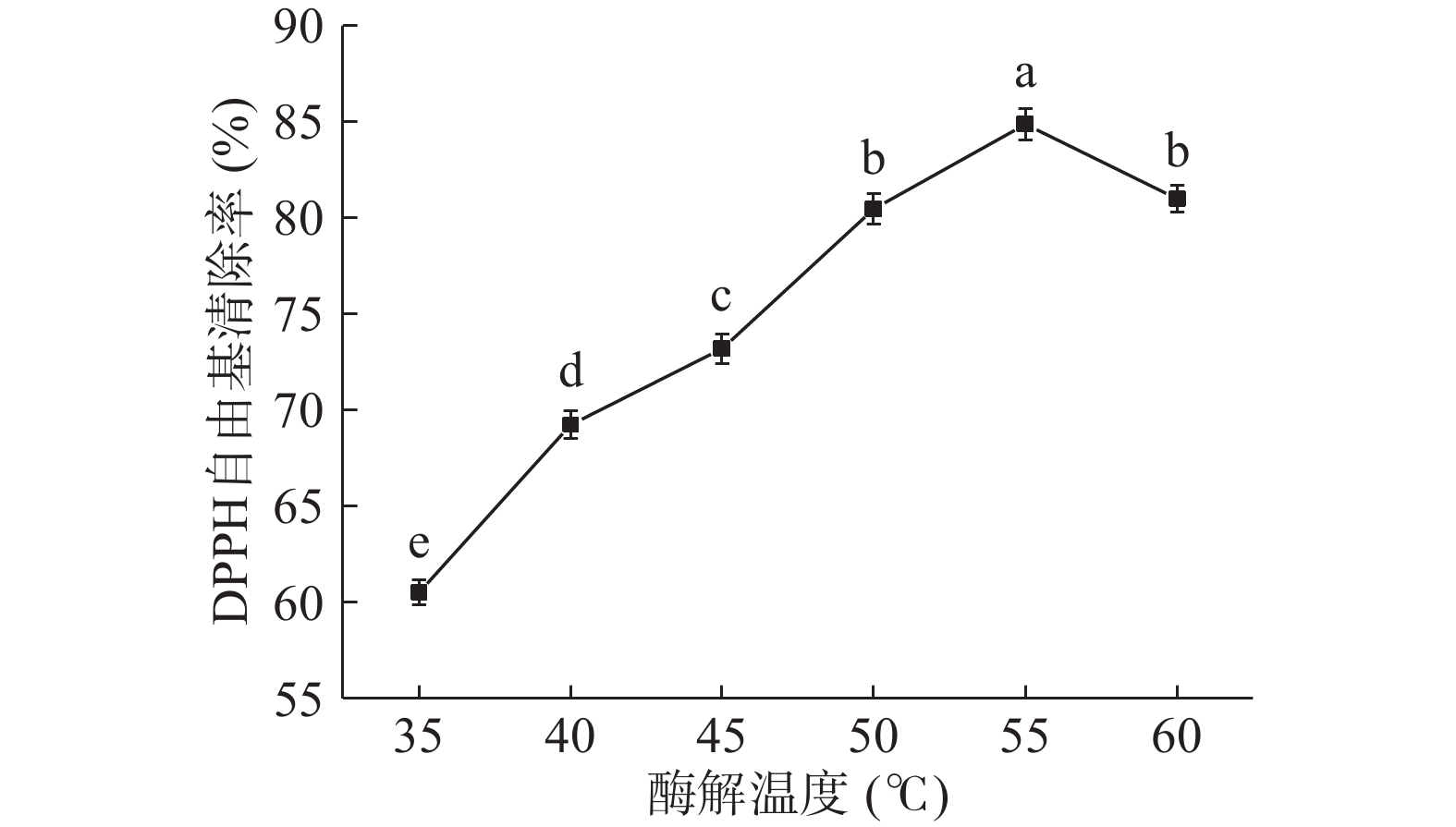
2.2.4 酶解温度对DPPH自由基清除率的影响
由图4可知,当酶解温度在35~55 ℃之间逐渐增加时,DPPH自由基清除率显著上升(P<0.05);当酶解温度为55 ℃时,DPPH自由基清除率达到最大值84.86%;继续提高温度,DPPH自由基清除率显著下降(P<0.05)。温度较低时,酶解速率较低,酶解反应不彻底,抗氧化活性较弱;随着温度的增加,有助于蛋白酶达到最适酶解温度,从而使酶解反应加快,抗氧化活性增加;而温度较高时,则会抑制蛋白酶的活性,导致酶解效果变差,无法使蛋白完全水解成具有抗氧化活性的小分子肽,抗氧化活性减弱。
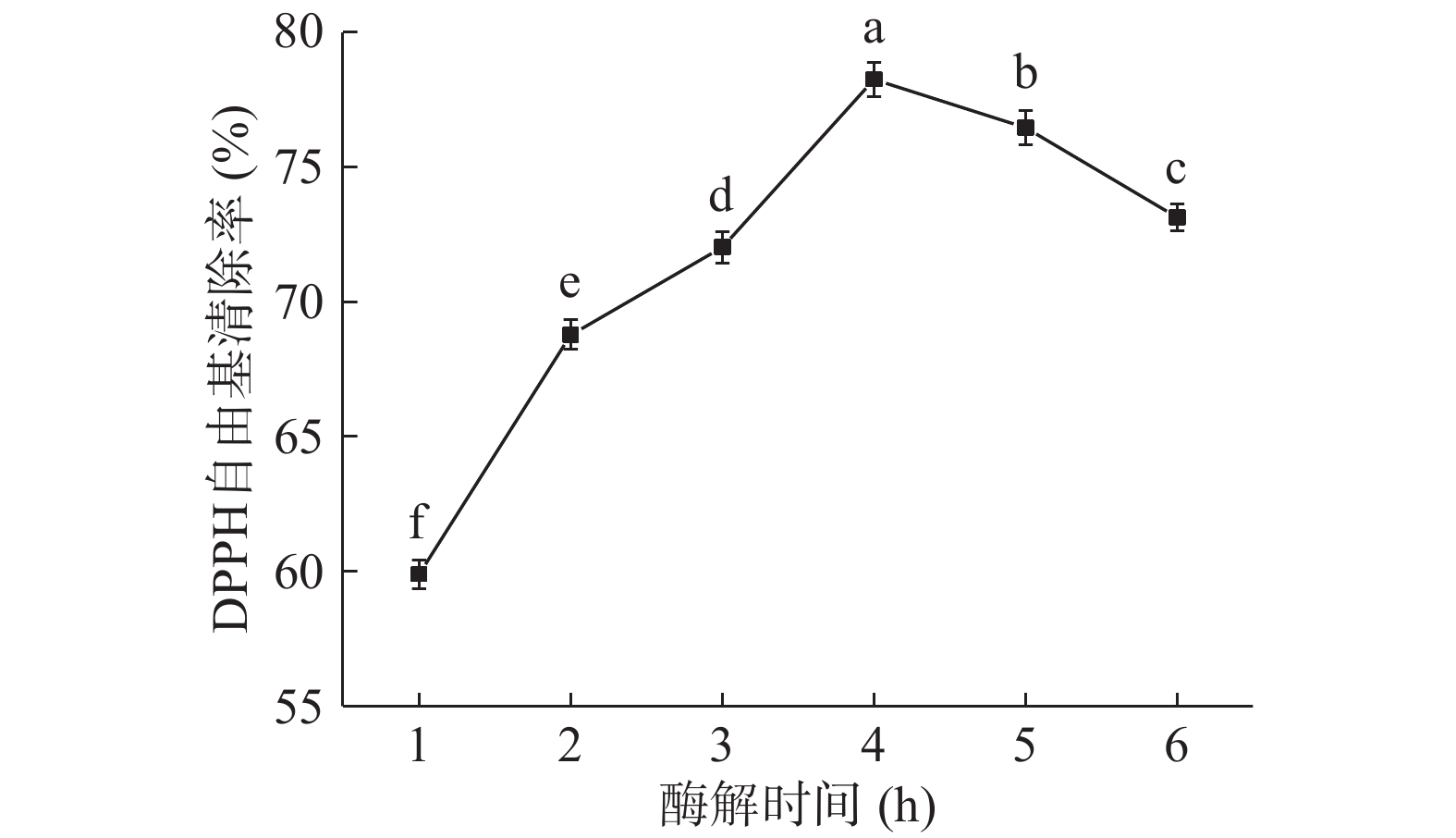
2.2.5 酶解时间对DPPH自由基清除率的影响
由图5可知,当酶解时间从1 h增加到4 h时,DPPH自由基清除率显著上升(P<0.05),在酶解反应初期酶与底物充足,酶解速率较快,蛋白大分子逐渐水解成具有抗氧化活性的小分子肽,抗氧化活性增强;当酶解时间为4 h时,DPPH自由基清除率达到最大值78.25%;继续增加酶解时间,DPPH自由基清除率显著下降(P<0.05),酶解时间过长,底物不再充足,从而过度水解已生成的抗氧化肽,生成抗氧化活性较低甚至不具备抗氧化活性的短肽或游离氨基酸,抗氧化活性减弱。
2.3 响应面试验结果分析
2.3.1 响应面试验设计及结果
在单因素实验基础上,以A(底物质量分数)、B(加酶量)、C(酶解温度)、D(酶解时间)为自变量,Y(DPPH自由基清除率)为响应值,按照中心组合设计响应面试验,试验方案与结果见表3。
表 3 响应面试验设计与结果Table 3. Design and results of response surface experiment试验号 因素 Y DPPH自由基清除率
(%)A 底物质量
分数B 加酶量 C 酶解
温度D 酶解
时间1 0 1 0 −1 75.74 2 0 0 1 −1 81.70 3 0 0 1 1 83.26 4 0 −1 0 1 83.09 5 −1 0 0 −1 78.08 6 −1 0 0 1 75.09 7 0 1 1 0 82.35 8 0 0 0 0 89.96 9 0 −1 1 0 78.82 10 1 −1 0 0 82.57 11 −1 1 0 0 74.89 12 0 0 0 0 89.89 13 1 0 0 1 85.63 14 0 1 −1 0 71.31 15 0 0 0 0 88.87 16 1 0 0 −1 79.64 17 1 0 −1 0 82.80 18 0 0 0 0 88.59 19 −1 −1 0 0 76.82 20 0 1 0 −1 78.13 21 1 0 1 0 84.39 22 0 0 −1 −1 76.90 23 0 −1 0 −1 78.17 24 0 0 0 0 88.31 25 0 0 −1 1 80.39 26 1 1 0 0 79.68 27 −1 0 −1 0 72.37 28 0 −1 −1 0 80.21 29 −1 0 1 0 81.50 2.3.2 回归模型的建立及方差分析
利用Design-Expert 11软件对表3结果进行回归分析,得到二次多项回归方程:
Y=89.12+3.00A−1.47B+2.34C+1.28D−0.24AB−1.88AC+2.24AD+3.11BC−0.63BD−0.48CD−4.69A2−6.15B2−4.38C2−4.40D2。
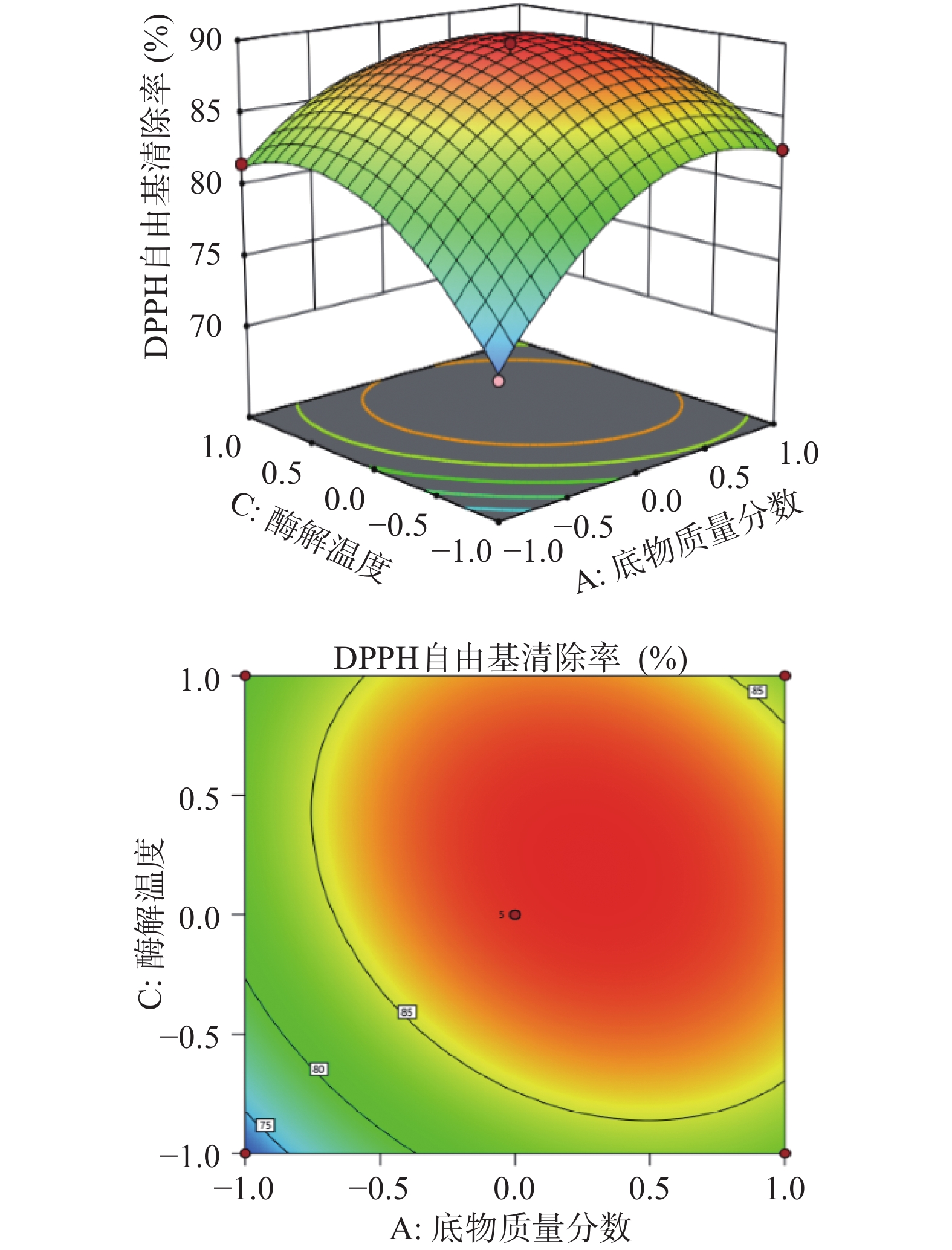
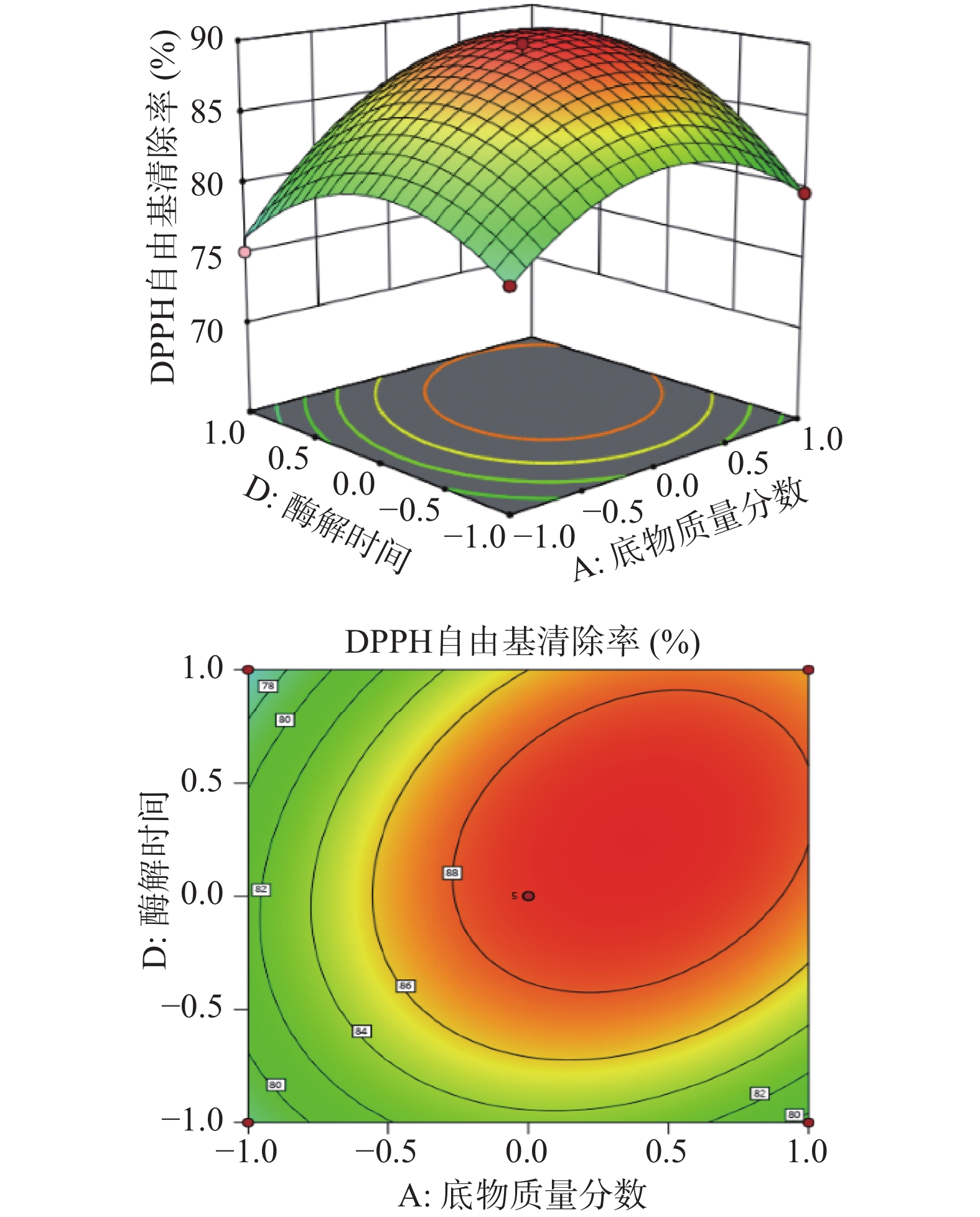
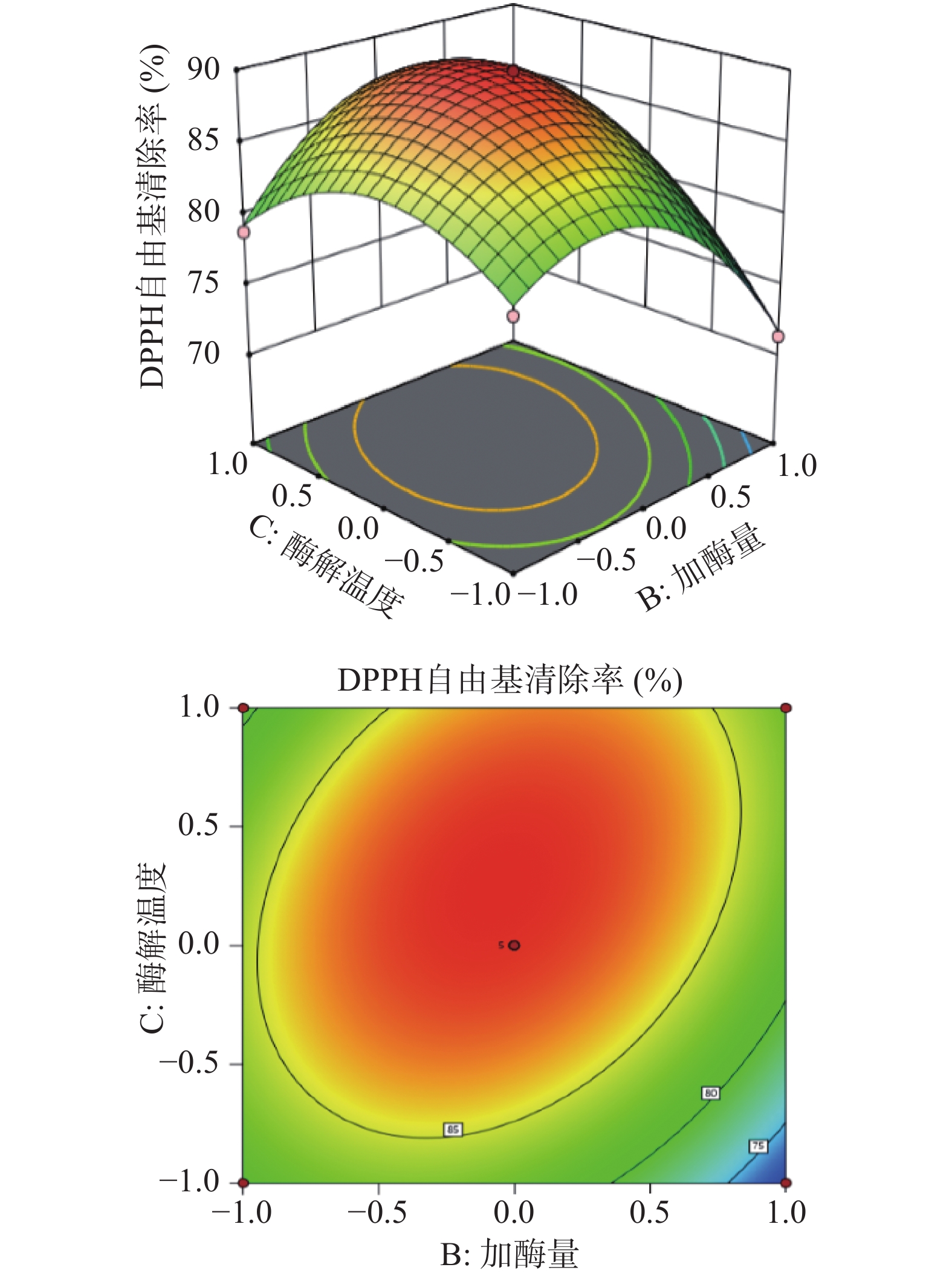
由表4可知,模型P<0.0001,表示该模型差异极显著;失拟项P=0.4261>0.05,不显著,说明模型拟合程度好,所选模型适宜;模型决定系数R2=0.9863,校正系数R2Adj=0.9726,说明试验结果与模型预测结果一致性良好,模型可靠,误差较小,可用于冰岛刺参内脏团酶解产物DPPH自由基清除率的分析和预测。由F值可知,各因素对冰岛刺参内脏团酶解产物DPPH自由基清除率影响的主次顺序为A(底物质量分数)> C(酶解温度)> B(加酶量)> D(酶解时间)。
表 4 回归模型的方差分析Table 4. Analysis of variance of the regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 709.81 14 50.70 72.08 <0.0001 ** A 107.76 1 107.76 153.20 <0.0001 ** B 25.75 1 25.75 36.61 <0.0001 ** C 65.52 1 65.52 93.15 <0.0001 ** D 19.66 1 19.66 27.95 0.0001 ** AB 0.23 1 0.23 0.33 0.5762 AC 14.21 1 14.21 20.21 0.0005 ** AD 20.16 1 20.16 28.66 0.0001 ** BC 38.63 1 38.63 54.91 <0.0001 ** BD 1.60 1 1.60 2.27 0.1537 CD 0.93 1 0.93 1.32 0.2692 A2 142.88 1 142.88 203.12 <0.0001 ** B2 245.59 1 245.59 349.15 <0.0001 ** C2 124.20 1 124.20 176.57 <0.0001 ** D2 125.48 1 125.48 1778.39 <0.0001 ** 残差 9.85 14 0.70 失拟项 7.55 10 0.76 1.31 0.4261 不显著 纯误差 2.30 4 0.57 总和 719.66 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01);R2=0.9863,R2Adj=0.9726。 2.3.3 各因素交互作用分析
由图6~图8可知,三个响应曲面坡度均较陡峭且等高线为椭圆形,说明底物质量分数与酶解温度、底物质量分数与酶解时间、加酶量与酶解温度的交互作用对DPPH自由基清除率的影响较大,而且根据曲面坡度陡峭程度可以看出,底物质量分数对DPPH自由基清除率的影响最大,其次是酶解温度、加酶量,酶解时间对DPPH自由基清除率的影响最小,与响应面方差分析一致。
2.3.4 最佳酶解工艺验证实验
利用Design- Expert 11对响应面结果进行分析,得到冰岛刺参内脏团抗氧化肽的最佳酶解工艺为底物质量分数4.373%,加酶量4887 U/g,酶解温度55.66 ℃,酶解时间4.22 h,预测DPPH自由基清除率为90.03%。在最佳酶解工艺下进行验证实验,为方便操作,将其调整为底物质量分数4.4%,加酶量4887 U/g,酶解温度56 ℃,酶解时间4.2 h。进行3次验证实验,结果如表5所示,得到酶解产物的DPPH自由基清除率为89.18%±0.11%,与模型预测值的相对误差是0.95%,说明模型与实验结果相符,能够较好地优化酶解工艺条件。此外,在最佳酶解工艺下制得的抗氧化肽,0.5 mg/mL样品的ABTS自由基清除率和Fe2+螯合率分别为68.11%±0.12%、72.59%±0.08%;1.5 mg/mL样品的羟基自由基清除率和还原力A700分别为71.86%±0.09%、0.7473±0.0105,表现出较强的综合抗氧化活性。
表 5 抗氧化肽活性评价Table 5. Evaluation of antioxidant peptide activity抗氧化指标 数值 DPPH自由基清除率(%,2 mg/mL) 89.18±0.11 ABTS自由基清除率(%,0.5 mg/mL) 68.11±0.12 羟基自由基清除率(%,1.5 mg/mL) 71.86±0.09 Fe2+螯合率(%,0.5 mg/mL) 72.59±0.08 还原力(A700,1.5 mg/mL) 0.7473±0.0105 2.4 分子量分布
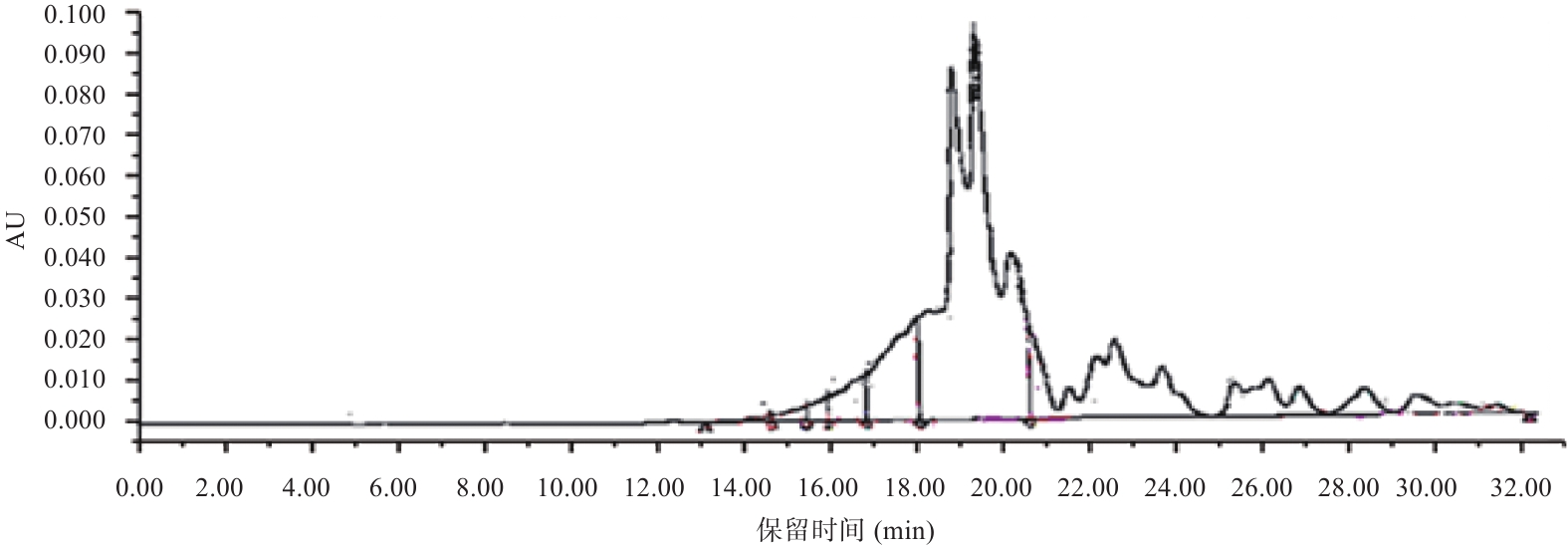
由图9和表6可知,冰岛刺参内脏团抗氧化肽中分子量低于1000 Da的肽占94.26%,分子量低于500 Da的肽占83.86%,说明在最佳酶解工艺下酶解效果较好,得到小分子低聚寡肽含量高。肽段长短与抗氧化能力高低密切相关,分子量在500~2500 Da的寡肽比多肽具有更强的抗氧化能力,分子量为200~500 Da的二肽或三肽与单个氨基酸相比也表现出较强的抗氧化能力[26]。因此,推测冰岛刺参内脏团抗氧化肽表现出的抗氧化能力与其较低的分子量分布有关。
表 6 冰岛刺参内脏团抗氧化肽分子量分布结果Table 6. Results of molecular weight distribution of antioxidant peptides in the visceral mass of Cucumaria frondosa分子质量分布范围(Da) 峰位保留时间(min) 峰面积 峰面积百分比
λ220 nm(%)>5000 14.877 48801 0.36 5000~3000 15.680 112866 0.87 3000~2000 16.197 145547 1.13 2000~1000 17.055 437342 3.38 1000~500 18.299 1343378 10.40 500~189 19.827 7120908 55.10 <189 20.833 3714921 28.75 2.5 氨基酸分析
酸性氨基酸因其侧链有氨基或羧基而具有螯合金属离子和作为质子供体的能力,对肽抗氧化能力大小有一定的影响[27],源于红色黄貂鱼的抗氧化肽以及太平洋鲱鱼抗氧化肽中的Glu残基,其金属螯合作用使多肽具有良好的抗氧化活性[28-29]。由表7可知,冰岛刺参内脏团抗氧化肽中酸性氨基酸含量丰富,占氨基酸总量的29.68%,其中,Glu含量较高,占氨基酸总量的18.87%,对肽的抗氧化能力有一定贡献。研究表明,疏水性氨基酸在抗氧化肽序列中出现的频率较高,这类氨基酸有助于抗氧化肽接近自由基,向自由基提供质子或电子以保持活性氧的稳定,对清除自由基和抑制脂质过氧化有积极作用[30],包斐[31]从长蛇鲻鱼肉中得到的抗氧化肽富含Pro、Met、Val、Phe、Ile、Leu、Trp等疏水性氨基酸;UMAYAPARVATHI等[32]从牡蛎中分离纯化出三种抗氧化肽均含有疏水性氨基酸,对DPPH自由基具有较强的清除能力。冰岛刺参内脏团提取出来的抗氧化肽也含有大量的疏水性氨基酸(40.27%),使冰岛刺参内脏团抗氧化肽具有较强的抗氧化活性。由此推断,冰岛刺参内脏团抗氧化肽表现出较强的抗氧化活性与其氨基酸组成密不可分。
表 7 冰岛刺参内脏团抗氧化肽的氨基酸组成Table 7. Amino acid composition of antioxidant peptides in the visceral mass of Cucumaria frondosa氨基酸种类 含量(%) 天冬氨酸(Asp)b 10.81 苏氨酸(Thr)a 6.12 丝氨酸(Ser) 6.20 谷氨酸(Glu)b 18.87 甘氨酸(Gly)c 10.01 丙氨酸(Ala)c 8.23 半胱氨酸(Cys) 0.25 缬氨酸(Val)ac 4.71 甲硫氨酸(Met)ac 0.72 异亮氨酸(Ile)ac 2.59 亮氨酸(Leu)ac 4.59 酪氨酸(Tyr) 1.37 苯丙氨酸(Phe)ac 3.28 赖氨酸(Lys)a 8.28 组氨酸(His) 1.43 精氨酸(Arg) 6.40 脯氨酸(Pro)c 3.00 色氨酸(Trp)ac 3.14 必需氨基酸 33.43 酸性氨基酸 29.68 疏水性氨基酸 40.27 注:a:必需氨基酸;b:酸性氨基酸;c:疏水性氨基酸。 3. 结论
本研究以DPPH自由基清除率为评价指标,通过单因素实验和响应面法优化得到复合蛋白酶酶解冰岛刺参内脏团制备抗氧化肽的最佳工艺条件:底物质量分数4.4%,加酶量4887 U/g,pH7.0,酶解温度56 ℃,酶解时间4.2 h,由此条件得到的酶解产物的DPPH自由基清除率为89.18%±0.11%(2 mg/mL),ABTS自由基清除率68.11%±0.12%(0.5 mg/mL),羟基自由基清除率为71.86%±0.09%(1.5 mg/mL),Fe2+螯合率为72.59%±0.08%(0.5 mg/mL),还原力为0.7473±0.0105(1.5 mg/mL)。此外,分子量分布和氨基酸结果表明,冰岛刺参内脏团抗氧化肽中分子量低于1000 Da的肽占94.26%、低于500 Da的肽占83.86%,大部分为小分子低聚寡肽,并且酸性氨基酸、疏水性氨基酸含量丰富,分别占氨基酸总量的29.68%和40.27%,显示出良好的抗氧化活性。本研究为酶解冰岛刺参内脏团蛋白制备抗氧化肽的工业化生产提供了理论基础,也为冰岛刺参加工产业提供新的发展方向。
-
表 1 响应面试验因素与水平编码
Table 1 Factors and level coding of response surface experiment
水平 因素 A 底物质量
分数(%)B 加酶量
(U/g)C 酶解温
度(℃)D 酶解时
间(h)-1 3 4000 50 3 0 4 5000 55 4 1 5 6000 60 5 表 2 冰岛刺参内脏团基本成分表
Table 2 Basic composition of Cucumaria frondosa visceral mass
成分 粗蛋白 多糖 脂肪 灰分 含量(以干基计,%) 48.54±0.11 4.90±0.02 26.68±0.07 13.16±0.04 表 3 响应面试验设计与结果
Table 3 Design and results of response surface experiment
试验号 因素 Y DPPH自由基清除率
(%)A 底物质量
分数B 加酶量 C 酶解
温度D 酶解
时间1 0 1 0 −1 75.74 2 0 0 1 −1 81.70 3 0 0 1 1 83.26 4 0 −1 0 1 83.09 5 −1 0 0 −1 78.08 6 −1 0 0 1 75.09 7 0 1 1 0 82.35 8 0 0 0 0 89.96 9 0 −1 1 0 78.82 10 1 −1 0 0 82.57 11 −1 1 0 0 74.89 12 0 0 0 0 89.89 13 1 0 0 1 85.63 14 0 1 −1 0 71.31 15 0 0 0 0 88.87 16 1 0 0 −1 79.64 17 1 0 −1 0 82.80 18 0 0 0 0 88.59 19 −1 −1 0 0 76.82 20 0 1 0 −1 78.13 21 1 0 1 0 84.39 22 0 0 −1 −1 76.90 23 0 −1 0 −1 78.17 24 0 0 0 0 88.31 25 0 0 −1 1 80.39 26 1 1 0 0 79.68 27 −1 0 −1 0 72.37 28 0 −1 −1 0 80.21 29 −1 0 1 0 81.50 表 4 回归模型的方差分析
Table 4 Analysis of variance of the regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 709.81 14 50.70 72.08 <0.0001 ** A 107.76 1 107.76 153.20 <0.0001 ** B 25.75 1 25.75 36.61 <0.0001 ** C 65.52 1 65.52 93.15 <0.0001 ** D 19.66 1 19.66 27.95 0.0001 ** AB 0.23 1 0.23 0.33 0.5762 AC 14.21 1 14.21 20.21 0.0005 ** AD 20.16 1 20.16 28.66 0.0001 ** BC 38.63 1 38.63 54.91 <0.0001 ** BD 1.60 1 1.60 2.27 0.1537 CD 0.93 1 0.93 1.32 0.2692 A2 142.88 1 142.88 203.12 <0.0001 ** B2 245.59 1 245.59 349.15 <0.0001 ** C2 124.20 1 124.20 176.57 <0.0001 ** D2 125.48 1 125.48 1778.39 <0.0001 ** 残差 9.85 14 0.70 失拟项 7.55 10 0.76 1.31 0.4261 不显著 纯误差 2.30 4 0.57 总和 719.66 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01);R2=0.9863,R2Adj=0.9726。 表 5 抗氧化肽活性评价
Table 5 Evaluation of antioxidant peptide activity
抗氧化指标 数值 DPPH自由基清除率(%,2 mg/mL) 89.18±0.11 ABTS自由基清除率(%,0.5 mg/mL) 68.11±0.12 羟基自由基清除率(%,1.5 mg/mL) 71.86±0.09 Fe2+螯合率(%,0.5 mg/mL) 72.59±0.08 还原力(A700,1.5 mg/mL) 0.7473±0.0105 表 6 冰岛刺参内脏团抗氧化肽分子量分布结果
Table 6 Results of molecular weight distribution of antioxidant peptides in the visceral mass of Cucumaria frondosa
分子质量分布范围(Da) 峰位保留时间(min) 峰面积 峰面积百分比
λ220 nm(%)>5000 14.877 48801 0.36 5000~3000 15.680 112866 0.87 3000~2000 16.197 145547 1.13 2000~1000 17.055 437342 3.38 1000~500 18.299 1343378 10.40 500~189 19.827 7120908 55.10 <189 20.833 3714921 28.75 表 7 冰岛刺参内脏团抗氧化肽的氨基酸组成
Table 7 Amino acid composition of antioxidant peptides in the visceral mass of Cucumaria frondosa
氨基酸种类 含量(%) 天冬氨酸(Asp)b 10.81 苏氨酸(Thr)a 6.12 丝氨酸(Ser) 6.20 谷氨酸(Glu)b 18.87 甘氨酸(Gly)c 10.01 丙氨酸(Ala)c 8.23 半胱氨酸(Cys) 0.25 缬氨酸(Val)ac 4.71 甲硫氨酸(Met)ac 0.72 异亮氨酸(Ile)ac 2.59 亮氨酸(Leu)ac 4.59 酪氨酸(Tyr) 1.37 苯丙氨酸(Phe)ac 3.28 赖氨酸(Lys)a 8.28 组氨酸(His) 1.43 精氨酸(Arg) 6.40 脯氨酸(Pro)c 3.00 色氨酸(Trp)ac 3.14 必需氨基酸 33.43 酸性氨基酸 29.68 疏水性氨基酸 40.27 注:a:必需氨基酸;b:酸性氨基酸;c:疏水性氨基酸。 -
[1] 曹建, 贾子才, 丛培旭, 等. 冰岛刺参和南非花刺参脑苷脂分子种的比较[J]. 中国海洋大学学报(自然科学版),2016,46(9):38−44. [CAO J, JIA Z C, CONG P X, et al. Comparison of cerebroside molecular species from sea cucumbers Cucumaria frondosa and Stichopus variegatus [J]. Periodical of Ocean University of China,2016,46(9):38−44. [2] 徐梦豪, 侯召华, 林荣芳, 等. 冰岛刺参抗癌物质Frondoside A的研究进展[J]. 特产研究,2020,42(5):71−77. [XU M H, HOU Z H, LIN R F, et al. Advances in research on the anticancer substance Frontoside A of Cucumaria frondosa[J]. Special Wild Economic Animal and Plant Research,2020,42(5):71−77. [3] THARINDU R L S, DEEPLKA D, FEREIDOON S. Antioxidant potential and physicochemical properties of protein hydrolysates from body parts of North Atlantic sea cucumber (Cucumaria frondosa)[J]. Food Production, Processing and Nutrition,2021,3(1):3. doi: 10.1186/s43014-020-00049-3
[4] HOSSAIN A, DAVE D, SHAHIDI F. Northern sea cucumber (Cucumaria frondosa): A potential candidate for functional food, nutraceutical, and pharmaceutical sector[J]. Marine Drugs,2020,18(5):274. doi: 10.3390/md18050274
[5] 徐梦豪, 梁艳, 姚艳艳, 等. 响应面法优化亚临界萃取冰岛刺参内脏油脂工艺[J]. 食品与机械,2021,37(4):165−170. [XU M H, LIANG Y, YAO Y Y, et al. Optimization of subcritical extraction of oil from Cucumaria frondosa visceral by response surface[J]. Food & Machinery,2021,37(4):165−170. [6] LIU Y, DAVE D, TRENHOLM S, et al. Effect of drying on nutritional composition of atlanticsea cucumber (Cucumaria frondosa) viscera derived from new found land fisheries[J]. Processes,2021,9(703):703.
[7] 党仪安, 王文亮, 弓志青, 等. 食用菌生物活性肽制备及功能活性研究进展[J]. 食品工业,2019,40(8):228−231. [DANG Y A, WANG W L, GONG Z Q, et al. Advances in preparation and functional activity of bioactive peptide from edible fungus[J]. The Food Industry,2019,40(8):228−231. [8] HEYMICH M L, NIL L, HAHN D, et al. Antioxidative, antifungal and additive activity of the antimicrobial peptides leg1 and leg2 from chickpea[J]. Foods,2021,10(3):585. doi: 10.3390/foods10030585
[9] BABA W N, BABY B, MUDGIL P, et al. Pepsin generated camel whey protein hydrolysates with potential antihypertensive properties: Identification and molecular docking of antihypertensive peptides[J]. LWT- Food Science and Technology,2021(1):111135.
[10] HUI S, HU X Q, ZHENG H, et al. Two novel antioxidant peptides derived from Arca subcrenata against oxidative stress and extend lifespan in Caenorhabditis elegans[J]. Journal of Functional Foods,2021(81):104462.
[11] 叶盛旺, 杨最素, 李维, 等. 青蛤免疫调节肽的酶解制备工艺研究[J]. 食品工业,2018,39(5):1−4. [YE S W, YANG Z S, LI W, et al. Process optimization for preparation of immunoregulatory peptides from cyclinasinensis by enzymatic hydrolysis[J]. The Food Industry,2018,39(5):1−4. [12] 李娜, 周德庆, 刘楠, 等. 鳕鱼鱼鳔抗氧化肽制备工艺研究[J]. 渔业科学进展,2020,41(2):191−199. [LI N, ZHOU D Q, LIU N, et al. Research on preparation of antioxidant peptides from cod swim bladder[J]. Progress in Fishery Sciences,2020,41(2):191−199. [13] 李亚会, 李积华, 吉宏武, 等. 远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J]. 中国食品学报,2021,21(2):229−238. [LI Y H, LI J H, JI H W, et al. Isolation, purification and structural analysis of antioxidant peptides from Sardinops sagax[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(2):229−238. [14] SIERRA L, FAN H, ZAPATA J, et al. Antioxidant peptides derived from hydrolysates of red tilapia (Oreochromis sp. ) scale[J]. LWT,2021:146.
[15] 罗春萍, 陆友利, 王星星. 苯酚-硫酸法快速测定多糖方法的优化[J]. 化工管理,2021(3):90−91. [LUO C P, LU Y L, WANG X X, et al. Optimization of rapid determination of polysaccharides by phenol-sulfuric acid method[J]. Chemical Enterprise Management,2021(3):90−91. [16] 李云嵌, 杨曦, 刘江, 等. 超声波辅助碱法提取美藤果分离蛋白及其加工性质研究[J]. 食品与发酵工业,2021,47(9):128−135. [LI Y Q, YANG X, LIU J, et al. Ultrasonic-assisted alkaline extraction of Plukenetia volubilis protein isolate and its processing properties[J]. Food and Fermentation Industries,2021,47(9):128−135. [17] 包斐, 孙丽霞, 孙建华, 等. 长蛇鲻鱼蛋白水解制备抗氧化肽工艺研究[J]. 食品科技,2019,44(8):241−247. [BAO F, SUN L X, SUN J H, et al. Optimization of technology conditions for antioxidant peptides from protein hydrolysates of lizard fish[J]. Food Science and Technology,2019,44(8):241−247. [18] ZHUANG H, TANG N, YUAN Y. Purification and identification of antioxidant peptides from corn gluten meal[J]. Journal of Functional Foods,2013,5(4):1810−1821. doi: 10.1016/j.jff.2013.08.013
[19] SARABABDI K, MAHOONAK A K, HAMISHEKAR H, et al. Microencapsulation of casein hydrolysates: Physicochemical, antioxidant and microstructure properties[J]. Jouenal of Food Engineering,2018,23:86−95.
[20] 李斌, 李元甦, 孟宪军, 等. 北五昧子藤茎三萜抗氧化活性研究[J]. 食品工业科技,2012,33(3):121−123. [LI B, LI Y S, MENG X J, et al. Study on antioxidant activity of triterpenes from caculis of Schisandra chinensis (Turcz.) baill[J]. Science and Technology of Food Industry,2012,33(3):121−123. [21] ZHENG Z J, LI J X, LI J W, et al. Physicochemical and antioxidative characteristics of black bean protein hydrolysates obtained from different enzymes[J]. Food Hydrocolloids,2019,97:105222. doi: 10.1016/j.foodhyd.2019.105222
[22] YOU L J, ZHAO M M, CUI C, et al. Effect of degree of hydrolysis on the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates[J]. Innovative Food Science & Emerging Technologies,2009,10(2):235−240.
[23] 林栋, 李丽娟, 何英, 等. 芡实多肽的分步酶解法制备及抗氧化活性研究[J]. 食品科技,2021,46(2):217−224. [LIN D, LI L J, HE Y, et al. Two-step enzymatic preparation and antioxidant activity in vitro of peptides from Euryale ferox[J]. Food Science and Technology,2021,46(2):217−224. [24] 王颖颖, 李迎秋. 酶解牡丹籽蛋白抗氧化特性的研究[J]. 中国调味品,2020,45(12):159−164. [WANG Y Y, LI Y Q. Study on antioxidant characteristics of enzymatic hydrolysis of tree peony seed protein[J]. China Condiment,2020,45(12):159−164. doi: 10.3969/j.issn.1000-9973.2020.12.034 [25] 何峰, 李婉茹, 武贝贝. 对二氨基苯甲醛比色法测定羊肚菌中色氨酸含量[J]. 食品工业,2021,42(5):426−429. [HE F, LI W R, WU B B. Determination of tryptophan in Morchella by p-diaminobenzaldehydecolorimetry[J]. The Food Industry,2021,42(5):426−429. [26] 黄明, 王璐莎. 动物蛋白源抗氧化肽的研究进展[J]. 中国农业科学,2013,46(22):4763−4773. [HUANG M, WANG L S. A review of the antioxidant peptides derived from animal protein[J]. Scientia AgriculturaSinica,2013,46(22):4763−4773. doi: 10.3864/j.issn.0578-1752.2013.22.014 [27] RAJAPAKSE N, MENDIS E, BYUN H G, et al. Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J]. Journal of Nutritional Biochemistry,2005,16(9):562−569. doi: 10.1016/j.jnutbio.2005.02.005
[28] PAN X Y, WANG Y M, LI L, et al. Four antioxidant peptides from protein hydrolysate of red stingray (Dasyatis akajei) cartilages: Isolation, identification, and in vitro activity evaluation[J]. Mar Drugs,2019,17(5):263. doi: 10.3390/md17050263
[29] WANG X Q, YU H H, XING R, et al. Preparation and identification of antioxidative peptides from pacific herring (Clupea pallasii) protein[J]. Molecules,2019,24(10):1946. doi: 10.3390/molecules24101946
[30] ZHANG L, ZHAO G X, ZHAO Y Q, et al. Identification and active evaluation of antioxidant peptides from protein hydrolysates of skipjack tuna(Katsuwonus pelamis) head[J]. Antioxidants (Basel),2019,8(8):318. doi: 10.3390/antiox8080318
[31] 包斐. 长蛇鲻鱼肉蛋白酶解制备抗氧化肽的研究[D]. 南宁: 广西大学, 2019. BAO F. Study on the preparation of antioxidant peptides by enzymatic hydrolysis of anchovy[D]. Nanning: Guangxi University, 2019.
[32] UMAVAPARVATHI S, MEENAKSHI S, VIMALIAJ V, et al. Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J]. Biomedicine & Preventive Nutrition,2014,4(3):343−353.
-
期刊类型引用(1)
1. 何军波,贾庆超. 模糊数学评价结合响应面法优化黑蒜香菇酱制备工艺及抗氧化活性和储藏分析. 食品工业科技. 2023(19): 47-56 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:





 下载:
下载:



