Optimization of Liquid Fermentation Process for Preparation of Silkworm Pupa Peptide by Bacillus natto and Its Anti-inflammatory Activity
-
摘要: 为提高蚕蛹的资源利用率和产品附加值,本研究以蚕蛹蛋白为原料,通过纳豆菌液态发酵制备蚕蛹肽。通过单因素实验和响应面试验确定最佳发酵工艺条件;采用脂多糖诱导RAW264.7巨噬细胞建立细胞炎症模型,对最佳发酵工艺参数组合下获得的蚕蛹肽进行体外抗炎活性研究。结果表明:蚕蛹肽的最佳发酵工艺条件为接种量5.0 mL、蚕蛹蛋白添加量2.6 g、初始pH7.0、发酵温度37 ℃和发酵时间35.4 h,此条件下的多肽得率为14.58%。蚕蛹肽对RAW264.7巨噬细胞无毒性,并且对细胞有显著的增殖作用(P<0.05)。蚕蛹肽可显著抑制LPS诱导的RAW264.7细胞上清液中NO、IL-1β和IL-6的分泌(P<0.05),且呈剂量依赖性。该研究为蚕蛹的高值化利用和食源性抗炎活性肽的研究与开发提供了理论依据。Abstract: In order to improve the utilization rate of silkworm pupa resources and the added value of products, silkworm pupa peptides were prepared from silkworm pupa proteins by liquid fermentation of natto. The optimum fermentation conditions were determined by single-factor experiment and response surface methodology. The inflammatory model of RAW264.7 macrophages was established by lipopolysaccharide, and the anti-inflammatory activity of silkworm pupa peptides were studied in vitro. The results showed that the optimum fermentation conditions of silkworm pupa peptide were inoculation amount 5.0 mL, silkworm pupa protein addition amount 2.6 g, initial pH7.0, fermentation temperature 37 ℃ and fermentation time 35.4 h. Under these conditions, the yield of silkworm pupa peptide was 14.58%. Silkworm pupa peptides were nontoxic to RAW264.7 macrophages and had significant proliferation effect on cells (P<0.05). Silkworm pupa peptides could significantly inhibit the secretion of NO, IL-1β and IL-6 in the supernatant of RAW264.7 cells induced by LPS in a dose-dependent manner (P<0.05). This study provides a theoretical basis for the high value utilization of silkworm pupa and the research and development of food-derived anti-inflammatory peptides.
-
Keywords:
- silkworm pupa /
- Bacillus natto /
- liquid fermentation /
- peptide /
- anti-inflammatory activity
-
蚕蛹是蚕丝的主要副产品,我国蚕蛹年产量达50万吨,约占全球总产量的80%。蚕蛹的蛋白质含量为60%左右,富含18种氨基酸[1]。蚕蛹蛋白是一种营养价值较高的可食用蛋白,还有一定的药用价值。近年来,研究发现蚕蛹蛋白和蚕蛹肽具有抗氧化[2]、降血压[3]、降血脂[4]、抗菌[5]和免疫调节[6]等功能活性,但关于其抗炎活性的研究几乎没有。目前,蚕蛹资源由于深加工技术缺乏,仅用作肥料和动物饲料,甚至被作为工业废弃物处理[7]。因此,蚕蛹的开发利用具有广阔的发展空间,制备蚕蛹肽(silkworm pupa peptides,SPP)对提高蚕蛹资源利用率和挖掘其潜在药用价值具有重要意义。
炎症是机体应对刺激的一种防御反应[8],但不受控制的炎症会诱发多种疾病。炎症性疾病是由于大量促炎性介质,特别是一氧化氮自由基(nitric oxide,NO)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素1β(Interleukin-1β,IL-1β)和白介素6(Interleukin-6,IL-6)等过度分泌引起的[9]。目前,常用的抗炎药物因具有多种副作用而在实际应用中逐渐受到限制。生物活性肽具有吸收速度快、安全性高、无副作用等优点,在炎症性疾病的防治中具有广阔的应用前景[10]。近年来,抗炎活性肽已在多种食物蛋白中得到很好的探索,如鸡肉、鱼肉和大豆蛋白等[10]。目前,蚕蛹肽常用的制备方法有:酶解法、微生物发酵法、化学合成法和基因重组法。例如,LI等[11]通过使用碱性蛋白酶在50 ℃、pH9.0的条件下水解蚕蛹蛋白50 min制备得到蚕蛹肽;XU等[12]采用固相法化学合成蚕蛹肽并对其抗肿瘤活性进行研究。与其他方法相比,微生物发酵法制备蚕蛹肽操作简便,成本较低,更易于产业化生产,应用前景广阔[13]。
本文利用纳豆菌生长过程中分泌的蛋白酶降解蚕蛹蛋白制备蚕蛹肽。在单因素实验基础上,通过响应面试验筛选出最佳发酵工艺参数,并采用脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7巨噬细胞建立炎症模型,测定NO、TNF-α、IL-1β和IL-6的分泌量,对蚕蛹肽的抗炎活性进行初探,以期为蚕蛹肽在医药、食品、农业等领域的工业应用提供研究依据。
1. 材料与方法
1.1 材料与仪器
缫丝冷冻蚕蛹 广西河池桑蚕基地;纳豆菌 本课题组实验室分离保藏菌种;RAW264.7小鼠巨噬细胞 中国科学院生物化学与细胞生物学研究所细胞库;DMEM培养基 美国 Gibco公司;胎牛血清 以色列Bioind公司;脂多糖(LPS,Escherichia coli 055:B5) 北京索莱宝科技有限公司;Cell Counting Kit-8(CCK-8)细胞增殖毒性检测试剂盒 日本同仁化学研究所;一氧化氮(NO)检测试剂盒 上海碧云天生物技术有限公司;小鼠TNF-α、IL-1β 和IL-6 ELISA试剂盒 武汉伊莱瑞特生物科技股份有限公司;氢氧化钠等其他试剂 均为国产分析纯。
T25高速分散均质机 德国IKA公司;GI80TW高压蒸汽灭菌锅 致微(厦门)仪器有限公司;FD-1D-50真空冷冻干燥机 北京博医康实验仪器有限公司;CR21N高速冷冻离心机 日立公司;InfiniteM200PRO酶标仪 奥地利TECAN公司;ZQZY-85CS振荡培养箱 上海知楚仪器有限公司;SQP电子天平 赛多利斯科学仪器有限公司;SW-CJ-2F洁净工作台 苏州安泰空气技术有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;CCL-170B-8二氧化碳培养箱 新加坡艺思高科技有限公司;CKX41倒置显微镜 日本OLYMPUS有限公司。
1.2 实验方法
1.2.1 原料预处理
参照ZHOU等[14]的有机溶剂法对蚕蛹进行脱脂。将缫丝冷冻蚕蛹放于室温下解冻2 h,然后将蚕蛹匀浆后冻干粉碎,过80目筛,取蚕蛹粉置于8倍体积的正己烷中,38 ℃条件下磁力搅拌5 h,8000 r/min室温离心10 min后,弃上清液,通风橱晾干,所得脱脂蚕蛹粉(残油率为1.56%±0.32%)置于阴凉干燥处保存备用。
1.2.2 蚕蛹蛋白粉的制备
参照ZENG等[15]的碱溶酸沉法提取蚕蛹蛋白。脱脂蚕蛹粉→碱溶(10%(W/V),1 mol/L NaOH调pH至10.0)→45 ℃搅拌5 h→8000 r/min离心处理10 min→收集上层清液→酸沉10 min(1 mol/L HCl调pH至4.0)→8000 r/min离心处理10 min→收集沉淀→洗涤并离心2次(蒸馏水搅拌,0.1 mol/L NaOH调pH至7.0)→冷冻干燥→蚕蛹蛋白粉。
1.2.3 纳豆菌液态发酵制备蚕蛹肽
1.2.3.1 纳豆菌生长曲线的测定
斜面培养基:蛋白胨1.0 g、酵母浸粉0.5 g、氯化钠1.0 g、琼脂1.5 g、蒸馏水100 mL,1 mol/L NaOH调节pH至7.0。种子培养基:蛋白胨1.0 g、牛肉粉3.0 g、葡萄糖1.0 g、蒸馏水100 mL,1 mol/L NaOH调节pH至7.0。参考高洁等[16]的方法进行,从试管斜面上挑取2环纳豆菌,立即接入种子培养基,37 ℃,160 r/min,摇床振荡培养。将未接种培养基作为对照组,每隔2 h取出种子液测定其在600 nm处的吸光度(OD),每份样品平行测定3次,取平均值。以培养时间为横坐标,吸光值为纵坐标,绘制生长曲线以确定纳豆菌的生长对数期,测定总时长为40 h。
1.2.3.2 种子液的制备
将从斜面培养基活化好的菌种接至种子培养基,37 ℃、160 r/min摇床振荡培养,培养制得处于对数期的种子液。
1.2.3.3 蚕蛹肽的制备
将种子液(107~108 CFU/mL)以一定比例的接种量接种至发酵培养基(蚕蛹蛋白粉3.0 g、葡萄糖1.0 g、磷酸二氢钾0.1 g、磷酸氢二钾0.25 g、硫酸镁0.5 g、蒸馏水100 mL,调节pH至7.0)中,并置于适宜温度下进行振荡培养。待一定时间后终止发酵,9000 r/min,4 ℃,离心20 min以除去菌体沉淀和未利用的蚕蛹蛋白残渣,取上清液用0.45 μm微孔滤膜过滤,并将其冷冻干燥,即得蚕蛹肽,置于−20 ℃下保存备用。
1.2.4 单因素实验
以多肽得率为评价指标,分别研究各单因素对纳豆菌液态发酵制备蚕蛹肽的影响。初始条件分别取:接种量4 mL、蚕蛹蛋白添加量3 g、初始pH7、发酵温度37 °C、发酵时间32 h。选取各因素变量分别为接种量(2、3、4、5、6 mL)、蚕蛹蛋白添加量(1、2、3、4、5 g)、初始pH(5、6、7、8、9)、发酵温度(31、34、37、40、43 °C)、发酵时间(24、28、32、36、40 h),进行单因素实验。
1.2.5 响应面试验
在单因素实验的基础上,以接种量(A)、蚕蛹蛋白添加量(B)、发酵时间(C)为自变量,以多肽得率(Y)为响应值。采用Design-Expert V 8.0.6进行Box-Behnken试验设计,优化出纳豆菌液态发酵制备蚕蛹肽的工艺。试验因素与水平编码如表1 所示。
表 1 Box-Behnken试验因素与水平Table 1. Factors and levels of Box-Behnken tests因素 编码水平 −1 0 1 A接种量(mL) 3 4 5 B蚕蛹蛋白添加量(g) 2 3 4 C发酵时间(h) 32 36 40 1.2.6 多肽得率的测定
参照鲁伟等[17]的双缩脲法进行多肽浓度的测定。取2.5 mL发酵液于试管中,加入2.5 mL 10%三氯乙酸,混合均匀后静置20 min,然后8000 r/min室温离心20 min,取0.5 mL上清液于另一试管中,再加入2.0 mL双缩脲试剂,混合均匀后静置20 min,再次8000 r/min离心20 min,取上清液于540 nm波长处测吸光度。以加0.5 mL蒸馏水和2.0 mL双缩脲试剂作为空白对照组。
W(%)=c×Vm×100 式中:W表示多肽得率,%;c表示发酵上清液多肽浓度,mg/mL;V表示发酵液体积,mL;m表示蚕蛹蛋白添加量,mg。
1.2.7 抗炎活性
1.2.7.1 细胞培养
RAW264.7巨噬细胞在含有10%胎牛血清、100 μg/mL链霉素和100 μg/mL青霉素的DMEM中培养。将处于对数期的细胞以5×104个/孔的密度接种于96孔板中,每孔100 μL,并在37 ℃、5% CO2的加湿培养箱中过夜培养,用于后续实验[18]。
1.2.7.2 实验分组
设置空白对照组为未经LPS刺激的RAW 264.7巨噬细胞,模型组为LPS刺激的RAW 264.7巨噬细胞,实验组为不同浓度(50、100、150 μg/mL)蚕蛹肽处理LPS刺激的RAW 264.7巨噬细胞。每组设置6个复孔。
1.2.7.3 细胞活力的测定
通过CCK-8法测定细胞活力[19]。在无或有LPS(1 μg/mL)刺激细胞24 h建立细胞炎症模型的情况下,用不同浓度(50、100、150 μg/mL)蚕蛹肽处理RAW 264.7巨噬细胞12 h。然后,每孔放入10 μL CCK-8溶液。在培养箱孵育1 h后,通过用酶标仪测定450 nm处的吸光度计算细胞活力,并根据下式计算:
细胞存活率(%)=As−AbAc−Ab×100 式中:As实验组(含有细胞的培养基、CCK-8、待测样品);Ac对照组(含有细胞的培养基、CCK-8、无待测样品);Ab空白组(不含细胞和待测样品的培养基、CCK-8)。
1.2.7.4 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞形态的影响
用1 μg/mL的LPS刺激细胞24 h建立细胞炎症模型的情况下,用不同浓度(50、100、150 μg/mL)蚕蛹肽处理RAW 264.7巨噬细胞12 h。培养结束后,用倒置显微镜观察并记录细胞形态。
1.2.7.5 一氧化氮(NO)含量的测定
通过格里斯(Griess)法检测NO含量[20]。用1 μg/mL的LPS刺激RAW 264.7巨噬细胞24 h建立炎症模型,然后用不同浓度(50、100、150 μg/mL)的蚕蛹肽处理RAW 264.7巨噬细胞12 h。培养结束后收集细胞培养液上清,用NO检测试剂盒进行NO含量的测定。简而言之,将50 μL上清液铺在96孔板中,并在其中加入等量的Griess试剂,然后用酶标仪测定540 nm处的吸光度。使用亚硝酸钠(NaNO2)标准品绘制标准曲线(0~100 µmol/L),根据标准曲线计算NO的含量。
1.2.7.6 促炎因子TNF-α、IL-1β和IL-6含量的测定
通过ELISA法检测促炎因子TNF-α、IL-1β和IL-6的含量。根据小鼠TNF-α、IL-1β和IL-6的ELISA试剂盒使用说明书,测定细胞培养液上清中促炎因子的水平。
1.3 数据处理
所有实验均重复3次,结果用平均值±标准差表示;采用SPSS Statistics26.0软件对每一组数据进行单因素方差分析(ANOVA),然后进行显著性检验,P<0.05认为具有显著性差异;采用Design Expert 8.0.6软件设计组合试验和利用Origin 9.8进行绘图。
2. 结果与分析
2.1 纳豆菌生长曲线
图1为纳豆菌在种子培养基上的生长曲线。由图可知,纳豆菌的生长曲线大致可分为四个阶段,在0~4 h处于迟缓期,4~12 h处于对数生长期,12~34 h处于稳定期,34 h以后进入衰亡期。用于发酵的纳豆菌应选用处于对数生长期的菌种,因为处于该阶段的菌种生长速率最快、代谢旺盛、酶系丰富活跃、外界适应能力强,因此,选取培养12 h的菌种作为后续实验的种子液。
2.2 单因素实验
2.2.1 接种量对多肽得率的影响
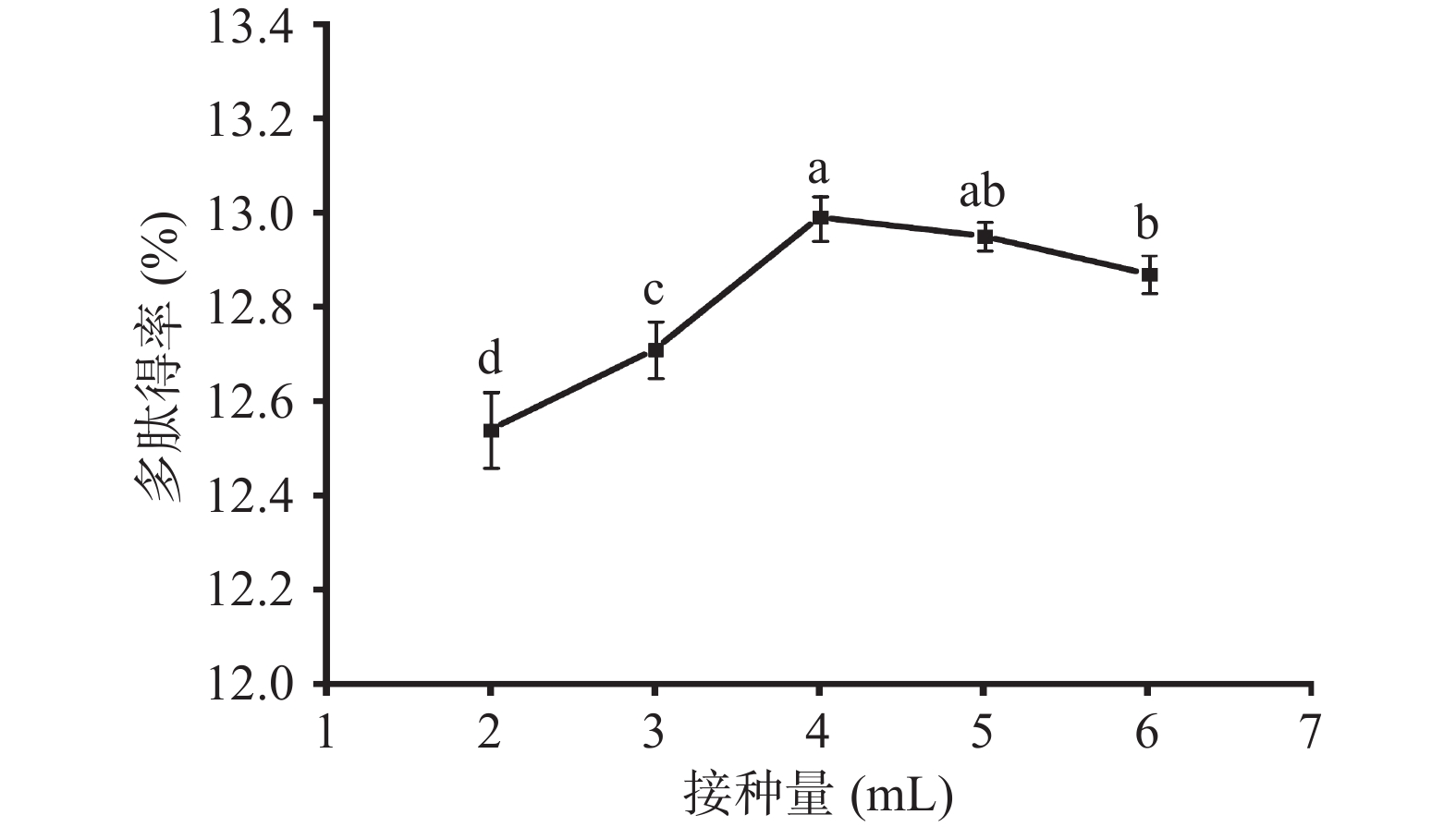
如图2所示,随着接种量的不断增加,多肽得率呈现先升高后下降的趋势,接种量达到4 mL时多肽得率最佳。这可能与纳豆菌的产酶量以及数量有关[16],接种量在2~4 mL时,随着接种量的增加,纳豆菌分泌的蛋白酶也逐渐增多,导致丰富的蛋白酶水解底物而产生大量的蚕蛹肽;接种量4~6 mL时,纳豆菌的大量繁殖需要消耗更多的营养物质,而后期营养物质不足以满足纳豆菌的生长繁殖和产酶,酶解所得的蚕蛹肽优先供自身生长发育,致使多肽得率降低。因此,选取3~5 mL的接种量作为后续响应面试验水平范围。
2.2.2 蚕蛹蛋白添加量对多肽得率的影响
如图3所示,随着蚕蛹蛋白添加量的增加,多肽得率呈现先升高后下降的趋势,蚕蛹蛋白添加量在3 g时达到最大值,多肽得率为13.04%±0.09%。前期蚕蛹蛋白添加量过低时,纳豆菌所需的营养物质不足[16],影响发酵速度,导致多肽得率较低。后期伴随着蚕蛹蛋白添加量的增加,纳豆菌会不断分解蚕蛹蛋白,因纳豆菌本身特性而产生大量粘稠性物质。发酵液的粘度过大会造成底物与蛋白酶无法充分接触[21],进而影响纳豆菌酶解产生多肽。另外,纳豆菌属于嗜氧菌,发酵液粘度过大供氧不足,产酶量减少,酶活降低,多肽得率降低。因此,选取2~4 g的蚕蛹蛋白添加量作为后续响应面试验水平范围。
2.2.3 初始pH对多肽得率的影响
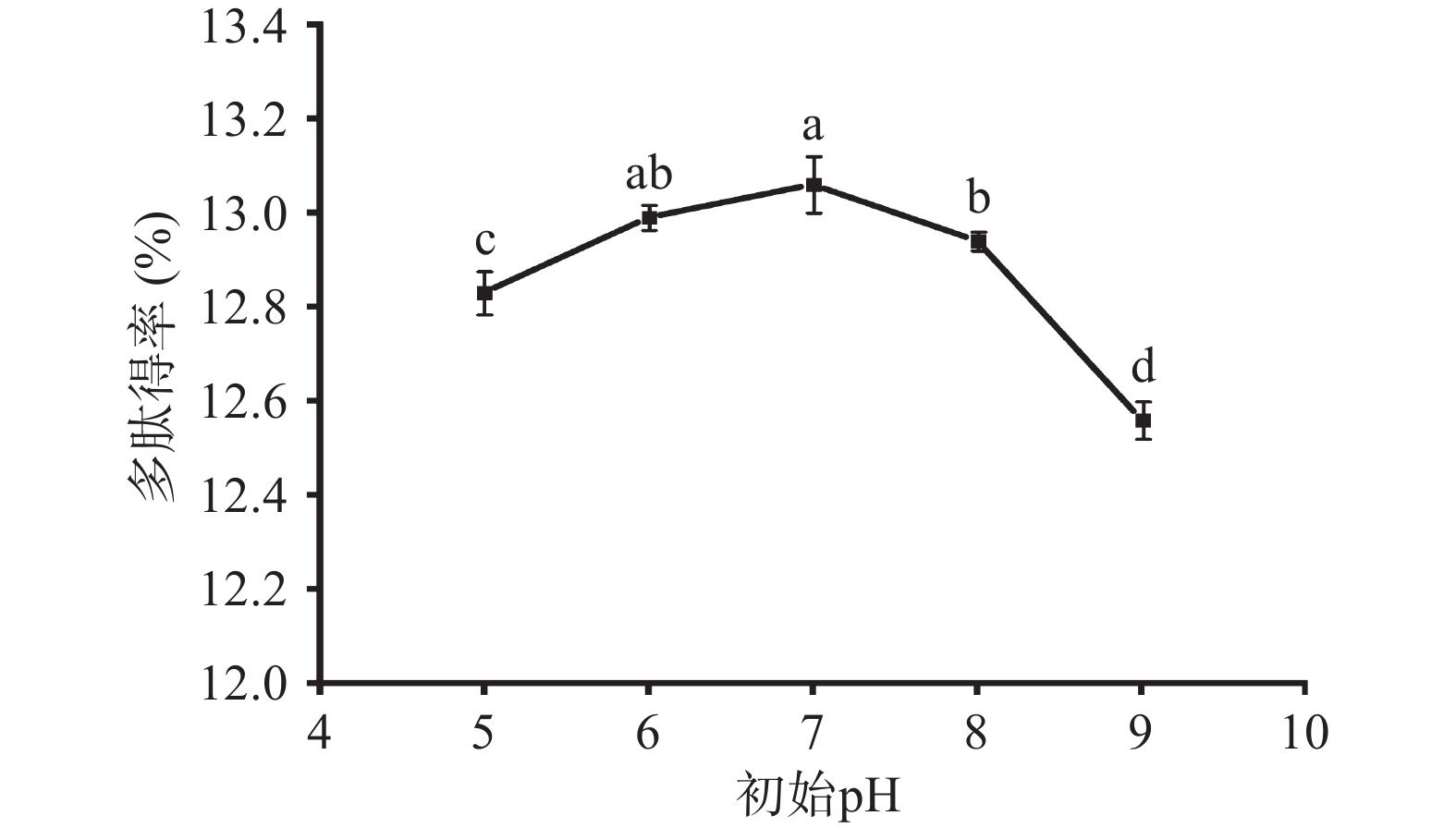
如图4所示,随着初始pH的增加,多肽得率呈现先升高后下降的趋势,初始pH为7时达到最大值,多肽得率为13.06%±0.06%。这可能是因为pH的改变会影响纳豆菌的生长发育、肽的积累及其稳定性;pH也会影响酶的解离程度、底物蚕蛹蛋白的电荷性质、结构和功能,这些因素都会降低酶的活性。因此,纳豆菌液态发酵制备蚕蛹肽的最佳的初始pH为7,过高或过低的pH都不利于蚕蛹肽的生成。
2.2.4 发酵温度对多肽得率的影响
如图5所示,发酵温度的升高会对多肽得率有一定的影响。当发酵温度为37 ℃时,多肽得率最高为13.22%±0.05%。这可能与纳豆菌的自身特性有关,纳豆菌生长温度范围广,最高可达45~55 ℃,最低可达5~20 ℃。当纳豆菌处于最适生长温度时有利于其生长发育,同时也更有利于其产生大量蛋白酶。因此,纳豆菌液态发酵制备蚕蛹多肽的最佳发酵温度为37 ℃。
2.2.5 发酵时间对多肽得率的影响
由图6可知,随着发酵时间的不断增加,多肽得率呈现先升高后下降的趋势,发酵时间在第36 h时达到最大值,多肽得率为12.94%±0.04%。这可能与纳豆菌的产酶有关,随着发酵时间的增加,纳豆菌产酶量不断增多,蚕蛹蛋白得到充分的水解;但在发酵后期,前期得到的多肽会进一步水解,多肽可能被水解为二肽或游离氨基酸。因此,选取32~40 h的发酵时间作为后续响应面试验水平范围。
2.3 蚕蛹肽发酵工艺响应面优化
在单因素实验结果的基础上,以接种量(A)、蚕蛹蛋白添加量(B)和发酵时间(C)3个影响较大的因素为自变量,多肽得率(Y)为响应值,采用Design Expert 8.0.6软件设计了三因素三水平的响应面试验。Box-Behnken试验设计与结果见表2。
表 2 Box-Behnken试验设计与结果Table 2. Design and results of Box-Behnken experimental design试验号 A接种量 B蚕蛹蛋白添加量 C发酵时间 多肽得率(%) 实际值 预测值 1 0 0 0 14.26 14.15 2 0 0 0 14.38 14.15 3 1 0 −1 13.74 13.73 4 −1 1 0 11.76 11.48 5 −1 0 −1 12.38 12.54 6 1 1 0 12.44 12.34 7 0 0 0 14.04 14.15 8 0 0 0 14.12 14.15 9 −1 −1 0 13.04 13.14 10 0 1 1 10.24 10.51 11 1 0 1 13.02 12.86 12 0 0 0 13.95 14.15 13 0 1 −1 11.48 11.6 14 0 −1 1 12.84 12.72 15 0 −1 −1 13.16 12.89 16 −1 0 1 12.13 12.15 17 1 −1 0 13.90 14.18 对接种量(A)、蚕蛹蛋白添加量(B)、发酵时间(C)3个单因素进行二次多项式回归拟合,得出多肽得率(Y)回归方程:
Y=14.15+0.47A−0.88B−0.32C−0.045AB−0.12AC−0.23BC−0.24A2−1.13B2−1.09C2
对回归模型进行方差分析和差异显著性检验如表3所示,回归模型高度显著(P<0.0001),失拟项不显著(P=0.0886>0.05),说明模型建立成功。决定系数R2为0.9753,说明多肽得率与回归模型预测结果有较高一致性。校正决定系数R2Adj为0.9435,说明响应值多肽得率有94.35%受模型中所涉及的各因素的影响[22]。根据F值可知各因素对多肽得率影响的主次顺序为:B>A>C,即蚕蛹蛋白添加量>接种量>发酵时间。纳豆菌液态发酵制备蚕蛹多肽过程中蚕蛹蛋白添加量(B)对多肽得率影响达到高度显著水平(P<0.001),接种量(A)对多肽得率影响达到极显著水平(P<0.01),发酵时间(C)对多肽得率影响达到显著水平(P<0.05)。交互项AB、AC和BC对多肽得率影响均不显著(P>0.05)。二次项B2和C2对多肽得率影响都达到高度显著水平(P<0.001),A2对多肽得率影响不显著(P>0.05)。
表 3 回归模型方差分析Table 3. Analysis of variance of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 20.54 9 2.28 30.66 <0.0001 *** A 1.8 1 1.8 24.13 0.0017 ** B 6.16 1 6.16 82.77 <0.0001 *** C 0.8 1 0.8 10.75 0.0135 * AB 0.081 1 0.081 0.11 0.7511 AC 0.055 1 0.055 0.74 0.4175 BC 0.21 1 0.21 2.84 0.1356 A2 0.24 1 0.24 3.22 0.1156 B2 5.34 1 5.34 71.76 <0.0001 *** C2 5.04 1 5.04 67.68 <0.0001 *** 残差 0.52 7 0.074 失拟项 0.4 3 0.13 4.55 0.0886 不显著 纯误差 0.12 4 0.03 总和 21.06 16 R2=0.9753,R2Adj=0.9435 注:***表示差异高度显著(P<0.001);**表示极显著(P<0.01);*表示显著(P<0.05)。 响应面三维曲面图和等高线图(图7)可直观反映各因素间交互作用对多肽得率的影响结果。由图7(a)可知,发酵时间位于中心水平时,蚕蛹蛋白添加量较接种量对多肽得率的影响更大,当接种量在3.5~5.0 mL、蚕蛹蛋白添加量在2.0~3.3%范围内多肽得率存在最大值;由图7(b)可知,蚕蛹蛋白添加量位于中心水平时,发酵时间较接种量对多肽得率的影响更大,当接种量在3.7~5.0 mL、发酵时间在33~37 h范围内多肽得率存在最大值;由图7(c)可知,接种量位于中心水平时,发酵时间较蚕蛹蛋白添加量对多肽得率的影响更大,当蚕蛹蛋白添加量在2.0~3.3 g、发酵时间在34~38 h范围内多肽得率存在最大值。
2.4 验证实验
经响应面软件Design-Expert 8.0.6分析所得最优工艺条件为:接种量5.0 mL、蚕蛹蛋白添加量2.61 g、发酵时间35.37 h。为验证响应面预测结果的可靠性,并考虑实际操作中条件的设置,按照接种量5.0 mL、蚕蛹蛋白添加量2.6 g、发酵时间35.4 h进行3次验证实验。验证实验所得多肽得率为14.58%±0.16%,与预测值(14.60%)相近,证明用响应面法优化蚕蛹多肽得率的回归模型可靠。
2.5 蚕蛹肽的抗炎活性
2.5.1 蚕蛹肽对RAW264.7巨噬细胞活力的影响
由图8可知,LPS及蚕蛹肽对RAW264.7巨噬细胞均无毒性。RAW264.7巨噬细胞经1 μg/mL的LPS作用24 h后,其细胞存活率为101.33%±0.41%,说明LPS不影响RAW264.7巨噬细胞的增殖活力(P<0.05)。在50~150 μg/mL浓度范围内,蚕蛹肽对RAW264.7巨噬细胞有显著的增殖作用(P<0.05),且有一定的剂量依赖性。
2.5.2 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞活力的影响
图9为不同浓度蚕蛹肽对LPS诱导的RAW264.7巨噬细胞活力的影响。在50~150 μg/mL浓度范围内,蚕蛹肽对LPS诱导的RAW264.7巨噬细胞活力有一定的促进作用。当浓度为150 μg/mL时,细胞存活率达到最大值124.47%±1.81%。这主要是由于生物活性肽具有安全性高、分子量小、易吸收等特点,可以被细胞用作营养物质,促进细胞生长[21]。因此,选用浓度为50、100、150 μg/mL的蚕蛹肽进行后续实验。
2.5.3 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞形态的影响
如图10(a)所示,正常的RAW264.7巨噬细胞接近圆形或椭圆形且表面光滑。当用1 μg/mL的LPS诱导RAW264.7巨噬细胞建立炎症模型后,细胞逐渐变为梭形,细胞表面存在皱纹和大量延伸的伪足,见图10(b)。此时的细胞大部分为树突状细胞,细胞中的气泡和颗粒也增加并分散在系统中[23]。图10(c)~(e)为不同浓度蚕蛹肽处理炎症细胞的实验组,从中可以看出,随着样品浓度的增加细胞表面逐渐变得光滑、收缩,伪足也不断减少,说明蚕蛹肽可有效缓解炎症。当蚕蛹肽的浓度达到150 μg/mL时,大部分细胞的形态恢复正常而且细胞数量明显增加,说明蚕蛹肽可促进细胞的生长繁殖。
2.5.4 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞NO释放量的影响
NO自由基在炎症反应中起着至关重要的作用[24]。正常情况下,巨噬细胞很少表达诱导型一氧化氮合酶(iNOS);在炎症过程中,iNOS将大量表达并产生NO,从而导致细胞损伤和炎症性疾病。细胞的NO分泌量可以间接反映炎症水平,因此用LPS刺激RAW264.7巨噬细胞建立细胞炎症模型,通过测定NO水平来评估蚕蛹肽对炎症的作用[25]。如图11所示,与对照组相比,经LPS刺激的RAW264.7巨噬细胞NO释放量极显著增加(P<0.01),说明LPS诱导的炎症模型建立成功。与模型组相比,经50~150 μg/mL浓度范围内的蚕蛹肽治疗12 h后,极显著降低了NO的释放量(P<0.01)。不同浓度的蚕蛹肽均可减少NO的生成,并且呈剂量依赖性。当蚕蛹肽浓度为150 μg/mL时,与模型组相比,NO的释放量降低了49.98%。
![]() 图 11 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞NO释放量的影响注:与对照组相比,##P<0.01;与模型组相比,**P<0.01;图12同。Figure 11. Effect of silkworm pupa peptides on NO release from RAW264.7 macrophages induced by LPS
图 11 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞NO释放量的影响注:与对照组相比,##P<0.01;与模型组相比,**P<0.01;图12同。Figure 11. Effect of silkworm pupa peptides on NO release from RAW264.7 macrophages induced by LPS2.5.5 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞中炎症因子TNF-α、IL-1β和IL-6分泌的影响
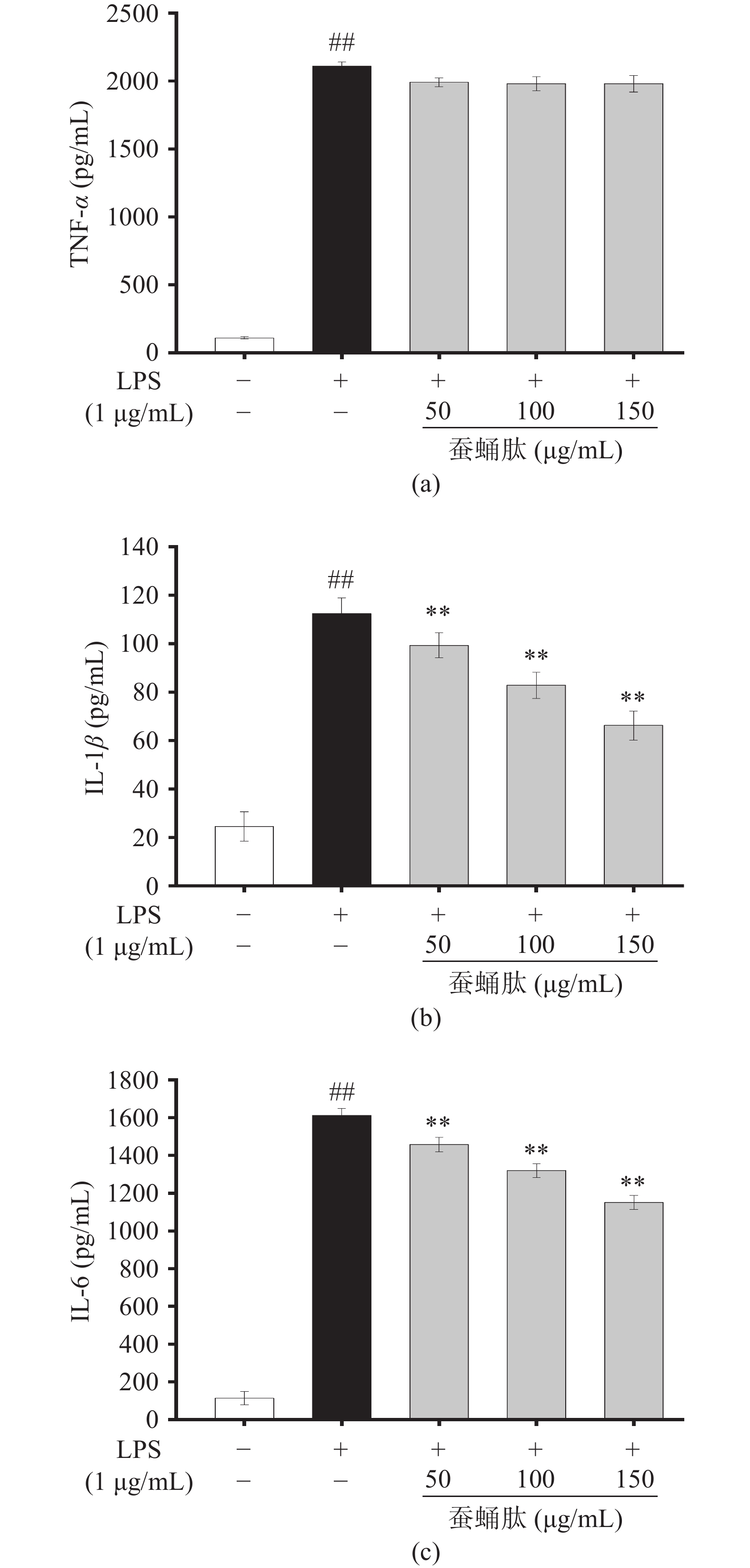
除NO外,一些炎症因子如TNF-α、IL-1β和IL-6在类风湿性关节炎、结肠炎等炎症性疾病的发病机制中也起着关键作用[26]。TNF-α可以通过持续刺激诱导多种炎症基因的转录,促进白细胞迁移,引起上皮细胞凋亡,从而引起全身炎症[27]。IL-1β对巨噬细胞具有趋化作用,大量IL-1β侵入血液会引起发热[28]。IL-6在炎症早期产生,可促进T细胞的分化和活化,在急性和慢性炎症性疾病中都是关键的介质[29]。阻断TNF-α、IL-1β和IL-6等炎症因子的信号传导可有效治疗炎症性疾病,因此可将它们作为评价抗炎活性的指标。如图12所示,未经LPS刺激的空白组细胞中TNF-α(图a)、IL-1β(图b)和IL-6(图c)的检出量很低。经LPS刺激后,蚕蛹肽以剂量依赖性方式极显著降低LPS诱导的RAW264.7细胞中IL-1β和IL-6的分泌(P<0.01),蚕蛹肽对IL-1β和IL-6的最大抑制率分别为42.58%、30.79%。但是,蚕蛹肽不以剂量依赖性方式降低TNF-α的分泌。这可能是由于蚕蛹肽对IL-1β和IL-6的抑制效果比TNF-α更敏感[30]。总的来说,蚕蛹肽的抗炎活性与抑制炎症因子有关。
3. 结论
本研究通过响应面试验优化得到了纳豆菌液态发酵制备蚕蛹肽的最佳工艺条件:接种量5.0 mL、蚕蛹蛋白添加量2.6 g、初始pH7.0、发酵温度37 ℃和发酵时间35.4 h,此条件下的多肽得率为14.58%。此外,最佳发酵工艺参数组合下获得的蚕蛹肽在LPS诱导的RAW264.7巨噬细胞体外炎症模型中表现出较好的抗炎活性,在50~150 μg/mL浓度范围内,蚕蛹肽对RAW264.7巨噬细胞无毒性,并且对细胞有显著的增殖作用(P<0.05)。蚕蛹肽可显著抑制LPS诱导的RAW264.7细胞上清液中NO、IL-1β和IL-6的分泌(P<0.05),且呈剂量依赖性。本研究为微生物发酵法制备抗炎活性肽提供一定的理论基础。经发酵得到的蚕蛹抗炎活性肽是一种混合物,有待于进一步分离、纯化、鉴定并对其作用机理进行探究。
-
图 11 蚕蛹肽对LPS诱导的RAW264.7巨噬细胞NO释放量的影响
注:与对照组相比,##P<0.01;与模型组相比,**P<0.01;图12同。
Figure 11. Effect of silkworm pupa peptides on NO release from RAW264.7 macrophages induced by LPS
表 1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests
因素 编码水平 −1 0 1 A接种量(mL) 3 4 5 B蚕蛹蛋白添加量(g) 2 3 4 C发酵时间(h) 32 36 40 表 2 Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experimental design
试验号 A接种量 B蚕蛹蛋白添加量 C发酵时间 多肽得率(%) 实际值 预测值 1 0 0 0 14.26 14.15 2 0 0 0 14.38 14.15 3 1 0 −1 13.74 13.73 4 −1 1 0 11.76 11.48 5 −1 0 −1 12.38 12.54 6 1 1 0 12.44 12.34 7 0 0 0 14.04 14.15 8 0 0 0 14.12 14.15 9 −1 −1 0 13.04 13.14 10 0 1 1 10.24 10.51 11 1 0 1 13.02 12.86 12 0 0 0 13.95 14.15 13 0 1 −1 11.48 11.6 14 0 −1 1 12.84 12.72 15 0 −1 −1 13.16 12.89 16 −1 0 1 12.13 12.15 17 1 −1 0 13.90 14.18 表 3 回归模型方差分析
Table 3 Analysis of variance of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 20.54 9 2.28 30.66 <0.0001 *** A 1.8 1 1.8 24.13 0.0017 ** B 6.16 1 6.16 82.77 <0.0001 *** C 0.8 1 0.8 10.75 0.0135 * AB 0.081 1 0.081 0.11 0.7511 AC 0.055 1 0.055 0.74 0.4175 BC 0.21 1 0.21 2.84 0.1356 A2 0.24 1 0.24 3.22 0.1156 B2 5.34 1 5.34 71.76 <0.0001 *** C2 5.04 1 5.04 67.68 <0.0001 *** 残差 0.52 7 0.074 失拟项 0.4 3 0.13 4.55 0.0886 不显著 纯误差 0.12 4 0.03 总和 21.06 16 R2=0.9753,R2Adj=0.9435 注:***表示差异高度显著(P<0.001);**表示极显著(P<0.01);*表示显著(P<0.05)。 -
[1] GHOSH A, RAY M, GANGOPADHYAY D. Evaluation of proximate composition and antioxidant properties in silk-industrial byproduct[J]. LWT-Food Science and Technology,2020,132:109900. doi: 10.1016/j.lwt.2020.109900
[2] ZHANG Y, WANG J H, ZHU Z, et al. Identification and characterization of two novel antioxidant peptides from silkworm pupae protein hydrolysates[J]. European Food Research and Technology,2021,247(7):343−352.
[3] TAO M, WANG C, LIAO D, et al. Purification, modification and inhibition mechanism of angiotensin I-converting enzyme inhibitory peptide from silkworm pupa (Bombyx mori) protein hydrolysate[J]. Process Biochemistry,2017,54:172−179. doi: 10.1016/j.procbio.2016.12.022
[4] 杨玉英, 王伟, 张玉, 等. 基于响应面法的蚕蛹蛋白降血脂肽的酶解条件优化[J]. 食品工业科技,2014,35(16):175−179. [YANG Y Y, WANG W, ZHANG Y, et al. Optimization of enzymatic hydrolysis conditions of silkworm pupa protein lipid lowering peptide based on response surface methodology[J]. Science and Technology of Food Industry,2014,35(16):175−179. [5] NAYAK T, MANDAL S M, NEOG K, et al. Characterization of a gloverin-like antimicrobial peptide isolated from muga silkworm, antheraea assamensis[J]. International Journal of Peptide Research & Therapeutics,2017:1−10.
[6] LI Z Y, ZHAO S, XIN X D, et al. Purification, identification and functional analysis of a novel immunomodulatory peptide from silkworm pupa protein[J]. International Journal of Peptide Research and Therapeutics,2019,26(3):243−249.
[7] JAISWAL K K, BANERJEE I, MAYOOKHA V P. Recent trends in the development and diversification of sericulture natural products for innovative and sustainable applications[J]. Bioresource Technology Reports,2021,13:100614. doi: 10.1016/j.biteb.2020.100614
[8] ERDOAN M, KONYA R, ZHAN Y, et al. Secondary metabolites from Scutellaria brevibracteata subsp. subvelutina and their in vitro anti-inflammatory activities[J]. South African Journal of Botany,2021,139(2):12−18.
[9] MAO S, WANG B, YUE L, et al. Effects of citronellol grafted chitosan oligosaccharide derivatives on regulating anti-inflammatory activity[J]. Carbohydrate Polymers,2021,262(6):2−7.
[10] FERNÁNDEZ-TOMÉ S, HERNÁNDEZ-LEDESMA B, CHAPARRO M, et al. Role of food proteins and bioactive peptides in inflammatory bowel disease[J]. Trends in Food Science & Technology,2019,88:194−206.
[11] LI Z Y, ZHAO S, XING X D, et al. Purification and characterization of a novel immunomodulatory hexapeptide from alcalase hydrolysate of ultramicro-pretreated silkworm (Bombyx mori) pupa protein[J]. Journal of Asia-Pacific Entomology,2019,22(3):633−637. doi: 10.1016/j.aspen.2019.04.005
[12] XU P, LV D D, WANG X H, et al. Inhibitory effects of Bombyx mori antimicrobial peptide cecropins on esophageal cancer cells[J]. European Journal of Pharmacology,2020,887(15):173434.
[13] SONG Y, YU J, SONG J, et al. The antihypertensive effect and mechanisms of bioactive peptides from Ruditapes philippinarum fermented with Bacillus natto in spontaneously hypertensive rats[J]. Journal of Functional Foods,2021,79(4):104411.
[14] ZHOU J, ZHENG D D, ZHANG F, et al. Durable grafting of silkworm pupa protein onto the surface of polyethylene terephthalate fibers[J]. Materials Science & Engineering C,2016,69:1290−1296.
[15] ZENG Q L, ZHANG N, ZHANG Y Y, et al. Ionic liquid extraction of silkworm pupa protein and its biological characteristics[J]. Journal of Asia-Pacific Entomology,2021,24(1):363−368. doi: 10.1016/j.aspen.2021.01.014
[16] 高洁, 高翔, 于佳. 纳豆菌发酵扇贝裙边制备ACE抑制肽的工艺优化[J]. 现代食品科技,2018,34(11):165−175. [GAO J, GAO X, YU J. Optimization of preparation of ACE inhibitory peptide from scallop skirt by natto fermentation[J]. Modern Food Science and Technology,2018,34(11):165−175. [17] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005(7):169−171. [LU W, REN G P, SONG J M. Determination method of polypeptide content in protein hydrolysate[J]. Food Science,2005(7):169−171. doi: 10.3321/j.issn:1002-6630.2005.07.039 [18] SSA B, MNA B, LV C, et al. Anti-inflammatory and antioxidant effects of peptides released from germinated amaranth duringin vitro simulated gastrointestinal digestion[J]. Food Chemistry,2020:343.
[19] JI Z W, MAN J Q, CHEN S Q, et al. Antioxidant and anti-inflammatory activity of peptides from foxtail millet (Setaria italica) prolamins in HaCaT cells and RAW264.7 murine macrophages[J]. Food Bioscience,2020,36:100636. doi: 10.1016/j.fbio.2020.100636
[20] GAO R, SHU W, SHEN Y, et al. Sturgeon protein-derived peptides exert anti-inflammatory effects in LPS-stimulated RAW264.7 macrophages via the MAPK pathway[J]. Journal of Functional Foods,2020,72:104044. doi: 10.1016/j.jff.2020.104044
[21] CTA B, YU C A, XIN L A, et al. Anti-inflammatory activity in vitro, extractive process and HPLC-MS characterization of total saponins extract from Tribulus terrestris L. fruits[J]. Industrial Crops and Products,2020,150:112343. doi: 10.1016/j.indcrop.2020.112343
[22] 王銮, 包怡红, 康宁. 混菌固态发酵榛仁粕制备降血压肽工艺优化研究[J]. 中国粮油学报,2018,33(12):35−41. [WANG L, BAO Y H, KANG N. Optimization of preparation of antihypertensive peptides from hazelnut meal by mixed bacteria solid-state fermentation[J]. Chinese Journal of Cereals and Oils,2018,33(12):35−41. doi: 10.3969/j.issn.1003-0174.2018.12.007 [23] AVILÉS-GAXIOLA S, LEÓN-FÉLIX J, JIMÉNEZ-NEVÁREZ Y, et al. Antioxidant and anti-inflammatory properties of novel peptides from Moringa oleifera Lam. leaves[J]. South African Journal of Botany,2021,141:466−473. doi: 10.1016/j.sajb.2021.05.033
[24] CAI X R, SHA F, ZHAO C, et al. Synthesis and anti-inflammatory activity of novel steroidal chalcones with 3β-pregnenolone ester derivatives in RAW 264.7 cells in vitro[J]. Steroids,2021,171:108830. doi: 10.1016/j.steroids.2021.108830
[25] PENG L, KONG X, WANG Z, et al. Baijiu vinasse as a new source of bioactive peptides with antioxidant and anti-inflammatory activity[J]. Food Chemistry,2021,339:128159. doi: 10.1016/j.foodchem.2020.128159
[26] ZHAO L, WANG X, ZHANG X L, et al. Purification and identification of anti-inflammatory peptides derived from simulated gastrointestinal digests of velvet antler protein (Cervus elaphus Linnaeus
)[J]. Journal of Food and Drug Analysis,2016,24(2):376−384. doi: 10.1016/j.jfda.2015.10.003 [27] LIU Y, YE Y F, HU X B, et al. Structural characterization and anti-inflammatory activity of a polysaccharide from the lignified okra[J]. Carbohydrate Polymers,2021,265:118081. doi: 10.1016/j.carbpol.2021.118081
[28] WANG L, JIANG Y, YASEEN A, et al. Steroidal alkaloids from the bulbs of Fritillaria pallidiflora Schrenk
and their anti-inflammatory activity[J]. Bioorganic Chemistry,2021,112:104845. doi: 10.1016/j.bioorg.2021.104845 [29] WATARU K, HISASHI K, KAZUMI Y, et al. Urolithin A attenuates pro-inflammatory mediator production by suppressing PI3-K/Akt/NF-κB and JNK/AP-1 signaling pathways in lipopolysaccharide-stimulated RAW264 macrophages: Possible involvement of NADPH oxidase-derived reactive oxygen species[J]. European Journal of Pharmacology,2018,833:411−424. doi: 10.1016/j.ejphar.2018.06.023
[30] HAN J M, LEE E K, GONG S Y. Sparassis crispa exerts anti-inflammatory activity via suppression of TLR-mediated NF-κB and MAPK signaling pathways in LPS-induced RAW264.7 macrophage cells[J]. Journal of Ethnopharmacology,2018,231:10−18.
-
期刊类型引用(3)
1. 陈嘉敏,黄颂源,梅甜甜,董丽雯,李圣雪,岳文琪,李柳颍,吴海强,余熙,吴序栎. 蚕蛹抗氧化肽的制备及其体内外活性评价. 现代食品科技. 2024(08): 189-198 .  百度学术
百度学术
2. 廖明君,张自然,惠森,陈璐雯,杨春媛,张宗凯,牛改改. 蚕蛹源肽锌纳米粒子的制备及其结构表征. 食品工业科技. 2023(22): 84-91 .  本站查看
本站查看
3. 翟晓娜,裴海生,梁亮,张志民,胡雪芳,李旭锐,孙昊. 菜籽肽的酶法制备、分离纯化及生物功能特性研究进展. 河南工业大学学报(自然科学版). 2022(04): 128-136 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:











 下载:
下载:



