Evolutions of Components Involved in the Catabolic Pathway of Glucosinolates in Broccoli Florets during Air Drying Coupled with Air-borne Ultrasound
-
摘要: 为探究气介式超声对西兰花热风干燥过程中硫苷分解代谢的影响,本文研究了西兰花小花球在气介式超声联合热风干燥(20 kHz,60 ℃,125.2和180.1 W/dm2)过程中的干燥特性以及硫苷、萝卜硫素、抗坏血酸、Fe2+和酚酸含量以及黑芥子酶、体外抗氧化活性的变化规律。结果表明:相比于单独热风干燥,超声处理不仅可以加快干燥进程(125.2和180.1 W/dm2超声处理下干燥时间分别比单独热风干燥缩短11.1%和17.8%),同时,超声联合热风干燥过程中3-吲哚甲基硫苷含量增加且黑芥子酶活力增强。180.1 W/dm2气介式超声联合热风干燥终点样品中3-吲哚甲基硫苷、萝卜硫素含量和黑芥子酶活力分别比单独热风干燥终点的样品高出10.7%、26.0%和15.2%,Fe2+含量比单独热风干燥终点的样品低8.1%,表明超声处理减少了Fe2+对硫苷酶促降解的干扰,能够促进4-甲基硫氧丁基硫苷降解形成萝卜硫素,但超声处理对西兰花干燥过程中抗坏血酸含量、游离酚酸含量和体外抗氧化活性变化影响不明显。本研究表明气介式超声联合热风干燥既能加快西兰花干燥进程,又能促进4-甲基硫氧丁基硫苷的转化,并对生物活性成分具有一定的保护作用。Abstract: In order to understand the effect of air-borne ultrasound on the catabolic pathway of glucosinolates in broccoli florets during air drying, the drying property, contents of key components (glucosinolates, sulforaphane, ascorbic acid, Fe2+ and phenolic acids), myrosinase activity and antioxidant capacity in vitro in broccoli florets during air drying at 60 oC coupled with air-borne ultrasound (20 kHz, 125.2 and 180.1 W/dm2) were analyzed. The results showed that air-borne sonication accelerated the drying process. The drying times were shortened by 11.1% and 17.8% under sonication at 125.2 and 180.1 W/dm2, respectively. Meanwhile, glucobrassicin content and myrosinase activity increased during ultrasound-intensified air drying. In the end of drying, the contents of glucobrassicin and sulforaphane as well as myrosinase activity in ultrasound-treated samples at 180.1 W/dm2 were 10.7%, 26.0% and 15.2% higher than those in samples dried without sonication, respectively. Reversely, sonicated samples at 180.1 W/dm2 possessed 8.1% less amount of Fe2+ than only air-dried samples after drying. The results implied that ultrasound treatment alleviated the interference of Fe2+ on the enzymatic degradation of glucosinolates, as well as promoted the degradation of glucoraphanin to sulforaphane. Besides, air-borne sonication had no significant influence on the contents of ascorbic acid and phenolic acids, and antioxidant capacity in vitro of broccoli under air drying. This study demonstrated that air-borne ultrasound assisted-air drying could not only speed up the drying process of broccoli florets, but also promote the conversion of glucoraphanin and preserve the bioactive components in certain aspects.
-
西兰花(Brassica oleracea L. var. Italica)属于十字花科芸薹属甘蓝变种,富含蛋白质、硫代葡萄糖苷、异硫氰酸酯、酚类化合物、维生素等[1]。近年来,其营养价值受到了越来越多的重视,众多研究表明,长期食用西兰花可以降低胃、肝、膀胱等器官的癌变几率[2]。西兰花的防癌抗癌功能与其含有的含硫化合物——硫苷密切相关[3]。在西兰花加工过程中,硫苷容易发生酶促降解。当黑芥子酶接触到硫苷后,其部分化学键断裂,水解形成D-葡萄糖和不稳定的中间体thiohydroximate-O-sulfonate,该中间体在不同pH和多种专一性蛋白的影响下会进一步形成能赋予西兰花产品特殊风味和较高营养价值的异硫氰酸酯以及硫氰酸酯、腈类化合物和唑恶烷-2-硫酮等物质[2]。4-甲基硫氧丁基硫苷是西兰花中含量最多的硫苷,它在黑芥子酶的作用下会水解产生萝卜硫素,萝卜硫素被认为是一种功能强大的天然抗癌物质,具有抗炎症和化学预防的作用[4]。西兰花中硫苷除发生酶促降解之外,还容易在Fe2+的催化作用下发生非酶促降解,形成功能性较低的腈类物质和硫酰胺[5-6]。在西兰花干燥过程中发生的这两种降解途径与干燥温度、水分含量、抗坏血酸含量、Fe2+含量、酚酸含量以及抗氧化活性密切相关[7]。干燥温度与黑芥子酶、硫苷及其降解产物的热稳定性密切相关,同时水分含量也会影响硫苷热降解过程中的降解率[2]。抗坏血酸作为黑芥子酶的辅因子,可以促进黑芥子酶的活性部位释放葡萄糖分子,使不稳定的糖苷配基发生洛森重排,在不同条件下形成不同的硫苷降解产物[8]。它还可以同酚酸一起将西兰花中的Fe3+还原为能提高专一性蛋白活力并抑制异硫氰酸酯生成的Fe2+[6]。因此,为了靶向调控干燥过程中硫苷及其衍生物的转化,需要针对上述组分和因素对硫苷组分的影响展开研究。
超声波作为一种非热加工技术,在合适的操作条件下并不会引起样品温度的额外升高,故在果蔬干燥领域有广阔的应用前景。其强化果蔬干燥的方式主要有三种,即:超声预处理[9]、接触式超声强化热风干燥[10]和气介式超声强化热风干燥[11]。超声预处理对后续干燥传质的促进作用有限,且容易导致果蔬营养物质的损失[12],而接触式超声波目前因技术原因和成本很难大规模应用到传统热风干燥过程中[13],故本研究选择气介式超声波辅干燥西兰花。目前已有关于气介式超声波应用于十字花科蔬菜干燥的研究报道,但研究主要集中于产品的干燥特性以及干燥前后一些基本理化指标的变化,如颜色、复水性、抗坏血酸含量和抗氧化能力等,对硫苷代谢途径中相关物质变化规律的研究还鲜有报道。目前,Tao等[14]发现甘蓝在超声干燥的过程中部分硫苷类物质的含量出现先降低再升高的现象,故推断在超声场下含硫物质的降解和体外合成反应可能同时发生,且超声样品和未超声样品的变化规律不完全一致。尽管十字花科蔬菜在热加工过程中硫苷的降解机理已有报道[2,15],但超声的机械作用在强化十字花科蔬菜热风干燥过程中对硫苷及其降解产物的影响尚未可知。为了明晰超声强化西兰花热风干燥过程中硫苷代谢途径中相关物质的变化情况,一方面需要分析硫苷及其降解产物和黑芥子酶的变化过程,另一方面需要对影响硫苷酶促降解和非酶促降解途径的因素展开研究,同时需要考虑超声波与物质组分、干燥温度等因素之间的相互作用对硫苷及其降解产物变化的影响。
因此,本研究采用气介式超声波联合热风干燥西兰花小花球,测定干燥过程中的干基含水量、温度、硫苷含量、萝卜硫素含量和黑芥子酶活力,同时测定干燥过程中抗坏血酸、Fe2+、游离酚酸含量以及抗氧化活性,以期为研究超声干燥过程中硫苷的代谢变化提供理论依据,并为超声技术在果蔬干燥中的实际应用提供指导。
1. 材料与方法
1.1 材料与仪器
新鲜绿色的西兰花(品种“优秀”) 产地为南京市江宁区润鸿蔬菜有限公司,协约定购于江苏省南京市苏果超市;4-甲基硫氧丁基硫苷、3-丁烯基硫苷、3-吲哚甲基硫苷、黑芥子苷、萝卜硫素 美国Sigma公司;4-甲氧基-3-吲哚甲基硫苷 上海甄准生物科技有限公司;三氟乙酸、乙腈、甲醇 国药集团化学试剂有限公司;HEPES缓冲液、单体酚标准品 上海源叶生物科技有限公司;D-Fructose/D-Glucose 分析试剂盒 爱尔兰Megazyme。
超声联合热风干燥设备 无锡新上佳生物科技有限公司;LC-2010A岛津高效液相色谱仪 日本岛津公司;Synergy-2型酶标仪 美国Biotek公司;K型/J型热电偶温度计 深圳华盛昌机械实业有限公司;TDL-40B离心机 上海安亭科学仪器厂;UV-5100B紫外-可见光分光光度计 上海元析仪器有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂; Nexera X2超高液相色谱(UHPLC)、LC-2010A高效液相色谱(HPLC) 日本岛津; AB SCIEX TripleTOF 4600 Triple-TOF-MS 系统 USA; Eclipse XDB-C18( 5 μm,4.6 mm×150 mm)、色谱柱ZOBAX-C18(5 μm,4.6 mm×250 mm) Agilent。
1.2 干燥方法
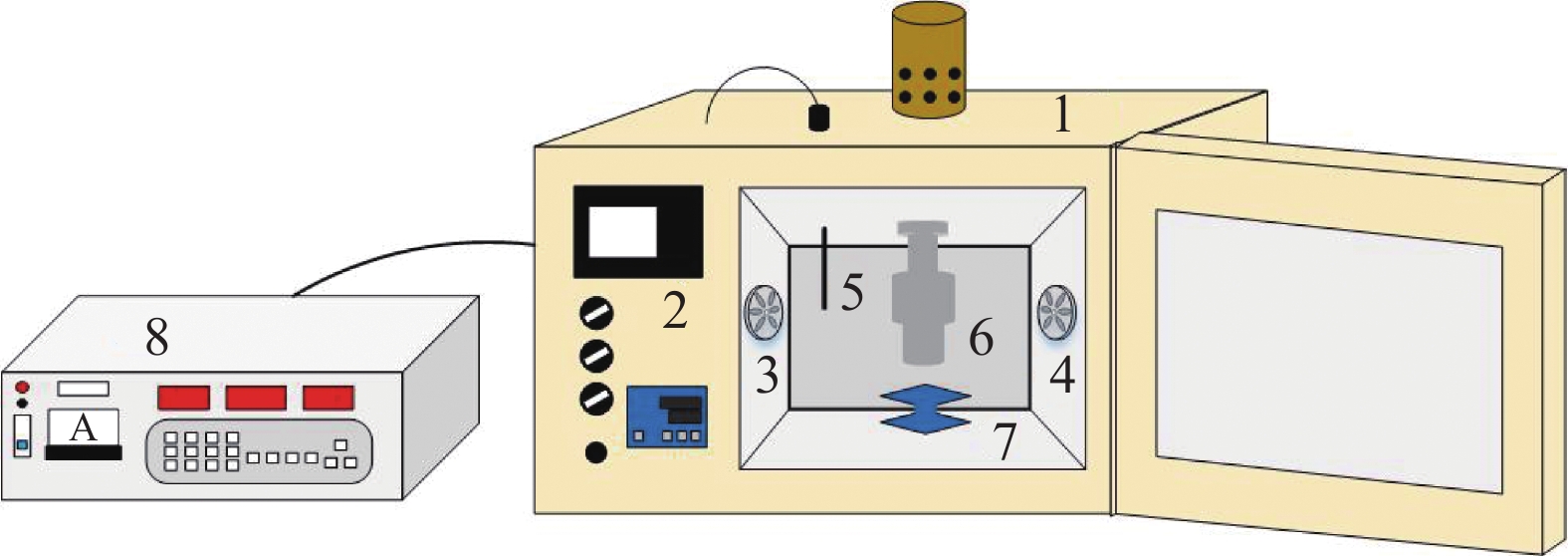
称取切成约1 cm3的西兰花小花球平铺于物料盘,然后将物料盘置于实验室自行研制的超声联合热风干燥箱内的超声探头(超声频率20 kHz,探头直径5 cm)正下方。试验所用设备工作原理示意图见图1。样品距离超声探头约5 mm,设定风速为2 m/s,干燥温度为60 ℃,超声强度为125.2和180.1 W/dm2,超声波模式为5 s开5 s关。除关闭该设备的超声波外,单独热风干燥的其余条件与气介式超声干燥一致。定期检测样品重量直至达到平衡,进而建立干燥动力学曲线。在干燥的同时,采用热电偶温度计记录西兰花茎的表面和中心部位温度的变化。在明确好西兰花干燥特性后,分别在干燥0、0.5、1、2、3、4 h和干燥终点(干燥终点的干基含水量为0.25 kg/kg DW)取样,用于后续的理化分析。理化分析前样品密封保存于−18 ℃。
1.3 理化分析
1.3.1 干基含水量测定
初始干基含水量按照AOAC的方法执行[16],挑选新鲜绿色的西兰花,将花球修剪成约1 cm3的小块,在105 ℃下干燥12 h测定得出。干基含水量的计算公式为:
M=mt−mdmd 式中:M为干基含水量,kg/kg DW;mt为t时刻样品的质量,kg;md为样品的干物质质量,kg。
1.3.2 硫苷含量测定
西兰花硫苷含量的测定参照Baenas等[17]方法并稍作修改。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品,和0.1 g干燥4 h和干燥终点的样品,加3 mL、70%(v/v)的甲醇在70 ℃下水浴20 min充分灭酶,然后取出并充分研磨,再在70 ℃下水浴20 min提取硫苷,用10000 r/min离心10 min后收集上清液,残渣再用70%(v/v)的甲醇重复提取一次并离心,合并两次提取的上清液,在45 ℃下真空干燥至恒重,用2 mL、0.05%(v/v)的三氟乙酸复溶,过0.45 μm水系膜后用于液相检测。提取液先用UHPLC串联Triple-TOF-MS系统进行硫苷鉴定,条件如下:电喷雾离子源(ESI),负离子检测模式,质量扫描范围(m/z)为50~1500,检测波长为280 nm,进样量为2 μL,流动相A为0.1%(v/v)的甲酸,流动相B为乙腈,洗脱梯度:0~2 min,5%B;2~19 min,5%~70%B;19~21 min,70%~90%B;21~25 min,90%B;25~25.1 min,90%~5%B;25.1~30 min,5%B。然后再在HPLC上进行定量检测,液相条件如下:色谱柱为Eclipse XDB-C18(5 μm,4.6 mm×150 mm),检测波长为227 nm,流速为1.0 mL/min,柱温为30 ℃,进样量为20 μL,流动相A为0.05%(v/v)三氟乙酸,流动相B为乙腈,洗脱梯度:0~15 min,0%B;15~25 min,0%~5%B;25~40 min,5%~20%B;40~50 min,20%~35%B;50~55 min,35%~99%B;55~60 min,99%~0%B。硫苷含量表示为mg/g DW。
1.3.3 黑芥子酶活力测定
西兰花黑芥子酶活力的测定参照Guo等[18]的方法并稍作修改。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品,和0.1 g干燥4 h和干燥终点的样品,加3 mL、0.1 mol/L磷酸钠缓冲液(pH6.5)在冰浴中充分研磨,10000 r/min 离心15 min,收集上清液作为粗酶液。将500 μL粗酶液和500 μL、0.25 mmol/L黑芥子苷(sinigrin)溶液混合,37 ℃下反应15 min后,煮沸5 min使酶失活。黑芥子酶和底物反应过程中生成的葡萄糖含量用D-Fructose/D-Glucose分析试剂盒测定。37 ℃下每分钟从黑芥子苷中释放1 μmol葡萄糖的量定义为一个酶活力,黑芥子酶活力单位用U/g DW表示。
1.3.4 萝卜硫素含量测定
西兰花萝卜硫素含量的测定参照Guo等[18]方法并稍作修改。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品,和0.1 g干燥4 h和干燥终点的样品,加入4 mL蒸馏水后充分研磨,然后在37 ℃下恒温水浴振荡水解3 h,再用10 mL乙酸乙酯提取三次,每次提取完用一次性滴管将上层乙酸乙酯组分吸出,合并三次的提取液,加1 g无水硫酸钠除水,让提取液在35 ℃下旋转蒸发至干,最后用2 mL乙腈复溶,过0.45 μm有机膜后用于液相检测。液相测定条件:色谱柱为Eclipse XDB-C18(5 μm,4.6 mm×150 mm),检测波长为254 nm,流速为1.0 mL/min,柱温为30 ℃,进样量为20 μL,流动相A为水,流动相B为乙腈,洗脱梯度:0~15 min,20%~60%B;15~20 min,60%~100%B。萝卜硫素含量表示为mg/g DW。
1.3.5 抗坏血酸含量测定
西兰花抗坏血酸含量的测定参照仇宏伟等[19]方法。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品,和0.1 g干燥4 h和干燥终点的样品,加入4 mL、 2%(w/v)草酸充分研磨,涡旋1 min后10000 r/min离心10 min,收集上清液过0.45 μm水系膜后用于液相检测。液相条件:色谱柱为Agilent ZOBAX-C18(5 μm,4.6 mm×250 mm),检测波长为254 nm,流速为0.8 mL/min,柱温为30 ℃,进样量为20 μL,流动相为0.1%草酸-甲醇溶液(95:5,v/v)。抗坏血酸含量表示为mg/g DW。
1.3.6 亚铁离子(Fe2+)含量测定
西兰花Fe2+含量的测定参照Bellostas等[6]的方法并稍作修改。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品,和0.1 g干燥4 h和干燥终点的样品,加4 mL蒸馏水充分研磨,吸取2 mL研磨液与1 mL非还原性蛋白沉淀溶液混合(配制方法:1 g三氯乙酸和1 mL、 37%盐酸,用蒸馏水定容至10 mL),混合液在室温下静置过夜,然后10000 r/min离心15 min。吸取100 μL上清液、200 μL HEPES缓冲液(0.3 mol/L、pH9.9)和25 μL菲洛嗪溶液(5 mg/mL、水溶)加入96孔板,迅速用酶标仪在570 nm下测定样品的吸光值。用硫酸亚铁标准品绘制标准曲线,Fe2+含量用mg/100 g DW表示。
1.3.7 游离酚酸含量测定
西兰花游离酚酸含量的测定参照Thomas等[20]的方法并稍作修改。分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品以及0.1 g干燥4 h和干燥终点的样品,加4 mL、80%(v/v)甲醇充分研磨,超声处理30 min,在37 ℃下水浴振荡提取4 h,10000 r/min离心10 min后收集上清液,残渣用80%(v/v)甲醇再提取一次,离心后合并两次的上清液,制备好的样品溶液过0.45 μm的有机膜后用于液相检测。液相测定条件参照Wang等[21]:色谱柱为Inertsil ODS-3(3.5 μm,4.6 mm×250 mm),检测波长为280 nm,流速为0.6 mL/min,柱温为25 ℃,进样量为20 μL,流动相A为1%醋酸-水,流动相B为1%醋酸-甲醇,洗脱梯度:0~10 min,10%~26%B;10~25 min,26%~40%B;25~45 min,40%~65%B;45~55 min,65%~95%B;55~58 min,95%~10%B;58~65 min,10%B。根据标准品的色谱图和标准曲线对样品中的游离酚酸进行定性和定量,结果表示为μg/g DW。
1.3.8 体外抗氧化活性(ABTS+·清除能力和铁离子还原能力)测定
分别称取0.4 g鲜样、干燥0.5和1 h的样品,0.2 g干燥2和3 h的样品以及0.1 g干燥4 h和干燥终点的样品,抗氧化活性物质的提取方法同1.3.7,样品提取液中ABTS+·清除能力的测定参照Ling等[22]方法,以Trolox浓度为横坐标,抑制率为纵坐标绘制标准曲线,结果用Trolox当量表示,即μmol Trolox/g DW;样品提取液中铁离子还原能力的测定参照Tao等[12]方法,以FeSO4浓度为横坐标,吸光度为纵坐标绘制标准曲线,结果用Fe2+浓度表示,即μmol Fe2+/g DW。
1.4 数据处理
每组实验重复三次,数据用平均值±标准差表示。采用Origin 2021绘图,采用SAS V8进行方差分析和Duncan’s多重比较,采用SPSS Statistics 25进行相关性分析。
2. 结果与分析
2.1 60 ℃下西兰花干燥特性分析
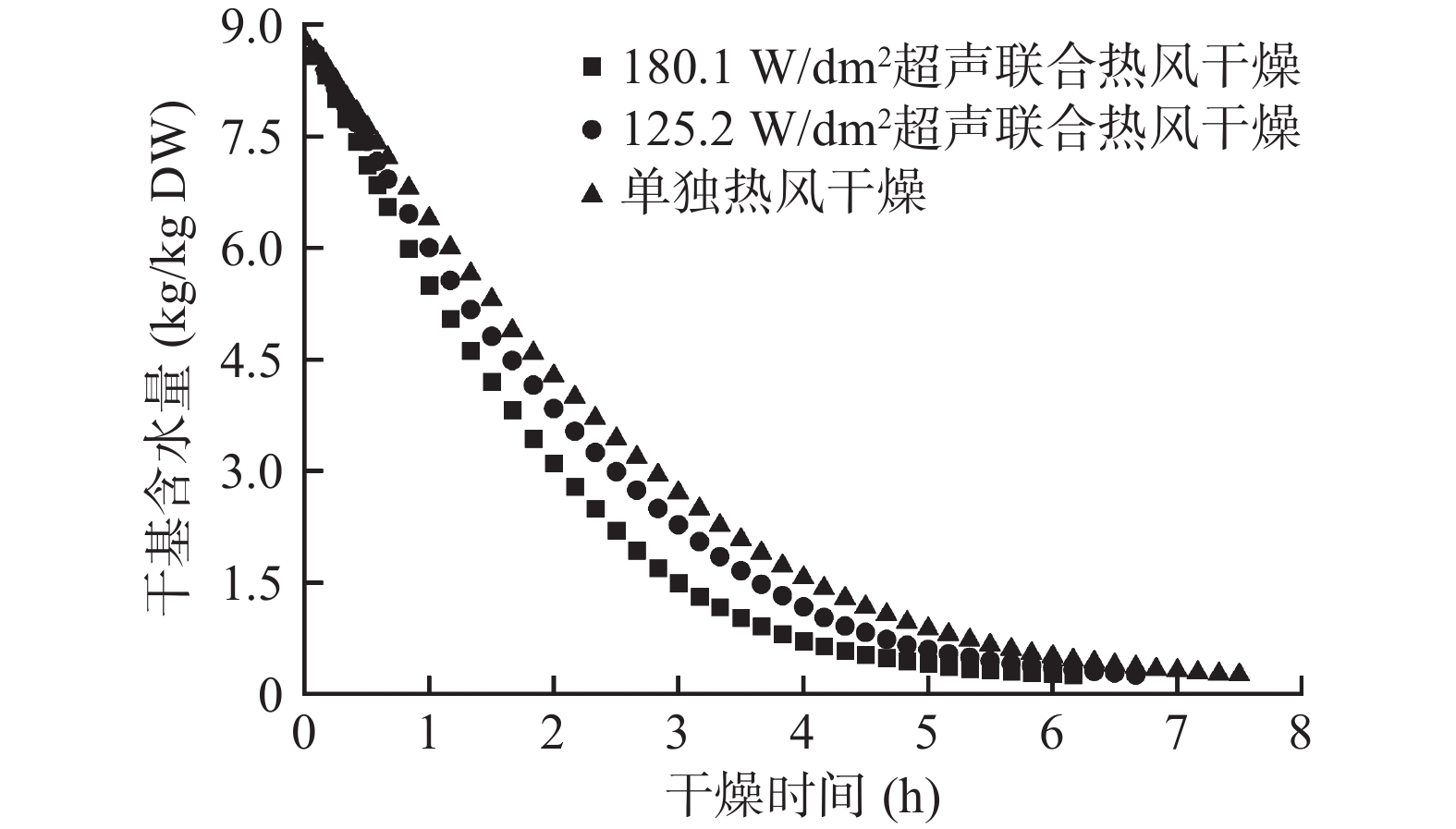
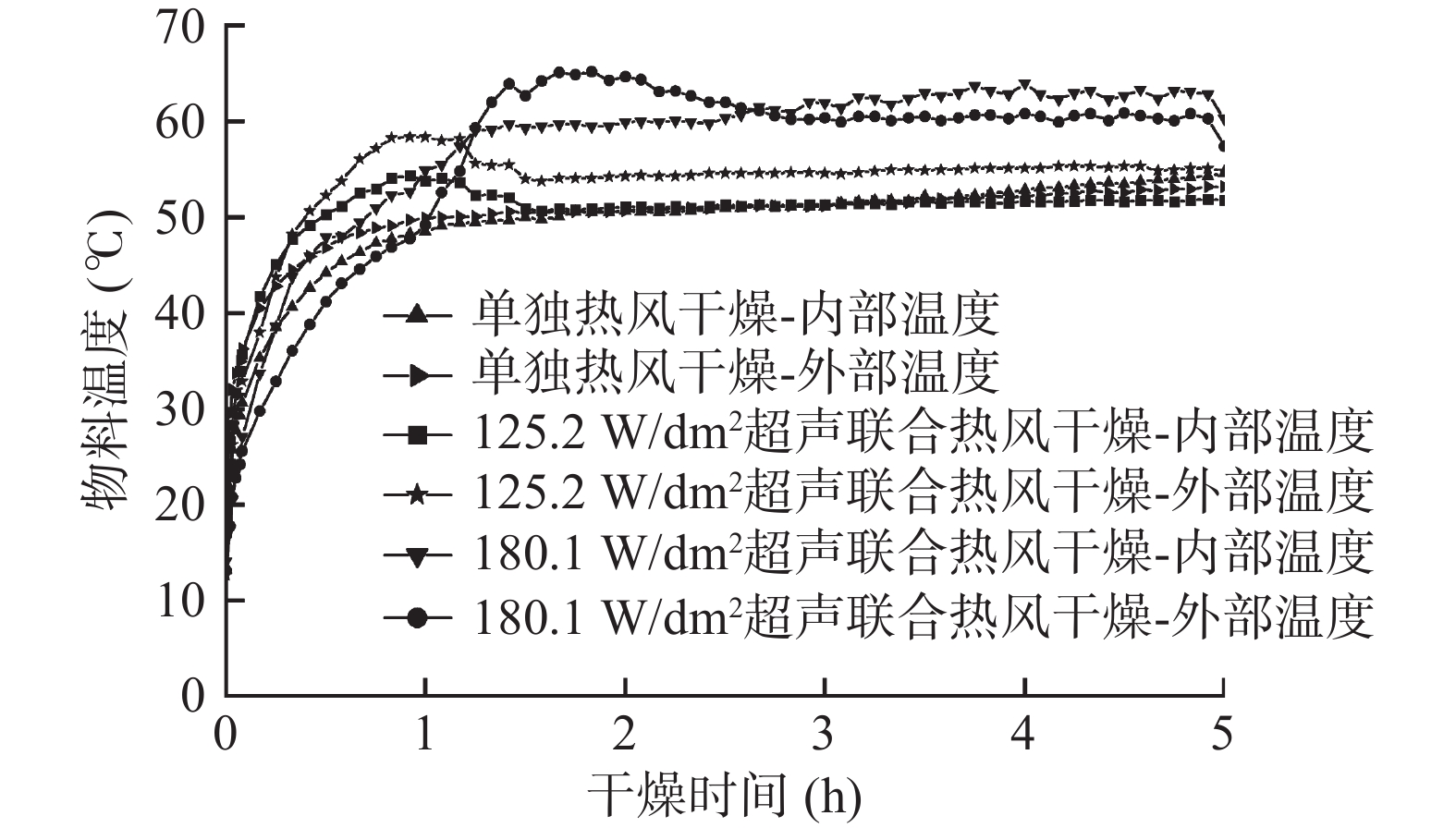
图2和图3分别为西兰花小花球干燥动力学曲线及干燥过程中内外温度的变化情况。选择干基含水量到达0.25 kg/kg DW时对应的时刻作为超声干燥的终点,因为此时的干基含水量接近平衡时的水分含量。由图2可知,当样品到达干燥终点时,单独热风干燥、125.2 W/dm2气介式超声联合热风干燥、180.1 W/dm2气介式超声联合热风干燥分别需要450、400和370 min,即125.2和180.1 W/dm2超声处理使得干燥时间分别缩短了11.1%和17.8%。超声探头发射出的声波不仅能够在气固界面形成一定的压力变化、振荡速度和微湍流,还能在物料内部形成快速的膨胀-压缩交替循环(海绵作用),从而提高水分子的蒸发、传质和扩散速率,有效强化单独热风干燥过程[14]。此外,125.2 W/dm2超声干燥样品的升温速度最快,表面超声处理并未导致西兰花出现过热的现象。
2.2 西兰花干燥过程中硫苷含量变化
表1~表2分别为西兰花小花球在干燥过程中硫苷类物质的鉴定结果及含量的变化。由表可知,西兰花中主要含有以下4种硫苷:4-甲基硫氧丁基硫苷、3-丁烯基硫苷、3-吲哚甲基硫苷及4-甲氧基-3-吲哚甲基硫苷,新鲜样品中含量最高的是4-甲基硫氧丁基硫苷(7.61 mg/g DW),然后依次是3-吲哚甲基硫苷(3.67 mg/g DW)、4-甲氧基-3-吲哚甲基硫苷(3.26 mg/g DW)和3-丁烯基硫苷(0.43 mg/g DW),该结果和Vallejo等[23]及Park等[24]的报道类似。总体上,4-甲氧基-3-吲哚甲基硫苷在干燥0.5 h后含量显著降低,这可能是因为干燥引起的硫苷酶促和非酶促反应使其降解形成不同的产物[7,25]。然而在干燥0~2 h过程中,3-丁烯基硫苷和3-吲哚甲基硫苷含量却出现明显升高现象,尤其是超声干燥的样品,在干燥2 h时其3-丁烯基硫苷和3-吲哚甲基硫苷含量相比鲜样分别增加了67.4%~95.3%和52.3%~78.2%,尽管在干燥后期有所下降,但干燥终点的含量仍然高于鲜样。干燥终点样品中的3-丁烯基硫苷和3-吲哚甲基硫苷含量分别比鲜样中的高出7.0%~34.9%和22.3%~35.4%,且在Yábar等[26]采摘、干燥三种玛卡和Tao等[14]用超声联合热风干燥包心菜的文献中也有类似的报道。西兰花小花球干燥过程中3-丁烯基硫苷和3-吲哚甲基硫苷含量的增加可能与西兰花需要合成更多的硫苷来防御自身免疫机制受到的损伤有关[27]。
表 1 西兰花硫苷成分鉴定Table 1. Identification of glucosinolates in broccoli florets序号 化合物名称 保留时间(min) 质量数 质量数误差(10-6) 分子式 1 4-甲基硫氧丁基硫苷 0.81 437.05 0.6 C12H23NO10S3 2 3-丁烯基硫苷 1.82 373.05 0.5 C11H19NO9S2 3 3-吲哚甲基硫苷 4.85 448.06 1.1 C16H20N2O9S2 4 4-甲氧基-3-吲哚甲基硫苷 7.24 478.07 0.1 C17H22N2O10S2 4-甲基硫氧丁基硫苷又名萝卜硫苷,与黑芥子酶反应可生成萝卜硫素。由表2可以看出,单独热风样品中4-甲基硫氧丁基硫苷含量在干燥2 h后出现了额外的升高,且在干燥后期(4 h~干燥终点)超过了气介式超声联合热风的样品。干燥终点处单独热风、125.2和180.1 W/dm2气介式超声联合热风样品的4-甲基硫氧丁基硫苷含量分别较鲜样降低了42.7%、50.5%和46.9%。Mahn等[4]研究热风干燥西兰花过程中也出现了4-甲基硫氧丁基硫苷含量升高的现象,并将其解释为干燥时物料热收缩使4-甲基硫氧丁基硫苷逐渐释放。更有研究表明,4-甲基硫氧丁基硫苷侧链上的亚砜基会发生可逆性氧化或还原,分别形成4-(甲基磺酰基)丁基硫苷和4-甲硫丁基硫苷,它们可以被黑芥子酶水解形成萝卜硫素、糖芥灵和甘油三芥酸酯的生物活性类似物[28]。
表 2 西兰花干燥过程中硫苷含量的变化Table 2. Variation of glucosinolates contents of broccoli florets during air drying with and without air-borne ultrasonic assistance处理 时间(h) 硫苷含量(mg/g DW) 4-甲基硫氧丁基硫苷 3-丁烯基硫苷 3-吲哚甲基硫苷 4-甲氧基-3-吲哚甲基硫苷 单独热风干燥 0 7.61±0.41Aa 0.43±0.06Ae 3.67±0.18Ab 3.26±0.15Aa 0.5 4.33±0.20Aab 0.85±0.04Aa 1.65±0.05Cd 0.37±0.01Bf 1 5.26±0.60Aab 0.75±0.11Aab 2.81±0.37Bc 0.82±0.09Be 2 3.59±0.15Ab 0.62±0.06Bcd 3.75±0.48Bb 1.05±0.06Cd 3 4.09±0.49Ab 0.73±0.08Aabc 3.20±0.29Cbc 1.77±0.07Ac 4 4.90±0.20Aab 0.65±0.07Abcd 4.97±0.11Ba 2.37±0.09Ab 干燥终点 4.36±0.33Aab 0.58±0.07Ad 4.49±0.20Aa 1.84±0.10Ac 125.2 W/dm2
气介式超声联合热风干燥0 7.61±0.41Aa 0.43±0.06Ae 3.67±0.18Ad 3.26±0.15Aa 0.5 3.68±0.22Ab 0.71±0.09Bb 3.22±0.10Be 0.67±0.02Ad 1 5.35±0.60Aab 0.88±0.06Aa 4.83±0.43ABc 1.93±0.14Ab 2 4.42±0.51Ab 0.72±0.01Bb 5.59±0.31Ab 1.78±0.36Bb 3 4.35±0.25Ab 0.67±0.06Abc 4.93±0.18Bc 1.73±0.07Ab 4 3.74±0.23Ab 0.60±0.05Acd 6.66±0.10Aa 1.83±0.19Bb 干燥终点 3.77±0.35Ab 0.53±0.06ABd 4.82±0.05Ac 1.37±0.12Bc 180.1 W/dm2
气介式超声联合热风干燥0 7.61±0.41Aa 0.43±0.06Ad 3.67±0.18Ac 3.26±0.15Aa 0.5 3.32±0.40Ac 0.92±0.08Aa 5.90±0.52Aab 0.51±0.12Bf 1 4.10±0.32Abc 0.85±0.08Aa 6.48±0.30Aab 1.72±0.15Ac 2 5.68±0.24Ab 0.84±0.09Aa 6.54±0.54Aab 2.06±0.08Ab 3 5.09±0.11Abc 0.73±0.06Ab 7.14±0.12Aa 1.46±0.15Bd 4 4.31±0.21Abc 0.56±0.05Ac 6.04±0.62Aab 1.52±0.04Ccd 干燥终点 4.04±0.31Abc 0.46±0.04Bd 4.97±0.47Abc 0.84±0.11Ce 注:不同大写字母表示同一干燥时间点下不同干燥处理之间存在显著性差异,P<0.05;不同小写字母表示同一干燥处理下不同干燥时间点存在显著性差异,P<0.05;表4同。 此外,不同种类硫苷的热敏性存在差异。研究表明,十字花科蔬菜在进行热处理时,吲哚族硫苷的热稳定性不如脂肪族硫苷[2]。由表2可知,在干燥期间,相比于3-吲哚甲基硫苷和4-甲氧基-3-吲哚甲基硫苷含量的变化,西兰花样品中4-甲基硫氧丁基硫苷和3-丁烯基硫苷的含量出现更大幅度的变化。由于超声处理可以使物料更快地达到设定的温度,故相比于脂肪族硫苷,热稳定性较弱的吲哚族硫苷更容易受超声作用的影响,且温度升高越快,含量变化越明显。Hennig等[15]的研究也曾报道3-吲哚甲基硫苷的热降解速度约为4-甲基硫氧丁基硫苷的2倍。此外,Hanschen等[29]的研究表明,当热处理温度达到62 ℃时三种芸薹属蔬菜(甘蓝、包心菜、紫色包心菜)的细胞均开始融解,而硫苷组分的溶出动力学由各自的化学结构决定,其中,4-甲氧基-3-吲哚甲基硫苷的溶出速率高于脂肪族硫苷。结合上述结论可知,超声处理能加速植物组织细胞壁的破坏,促进了硫苷释放,使其更容易被黑芥子酶水解成葡萄糖和其它不稳定的中间体,或发生非酶促降解形成其它物质[30],而超声样品比单独热风样品拥有更高的3-吲哚甲基硫苷含量可能是超声处理在一定程度上加强了西兰花应对胁迫作用的能力。
2.3 西兰花干燥过程中黑芥子酶活力及萝卜硫素含量变化
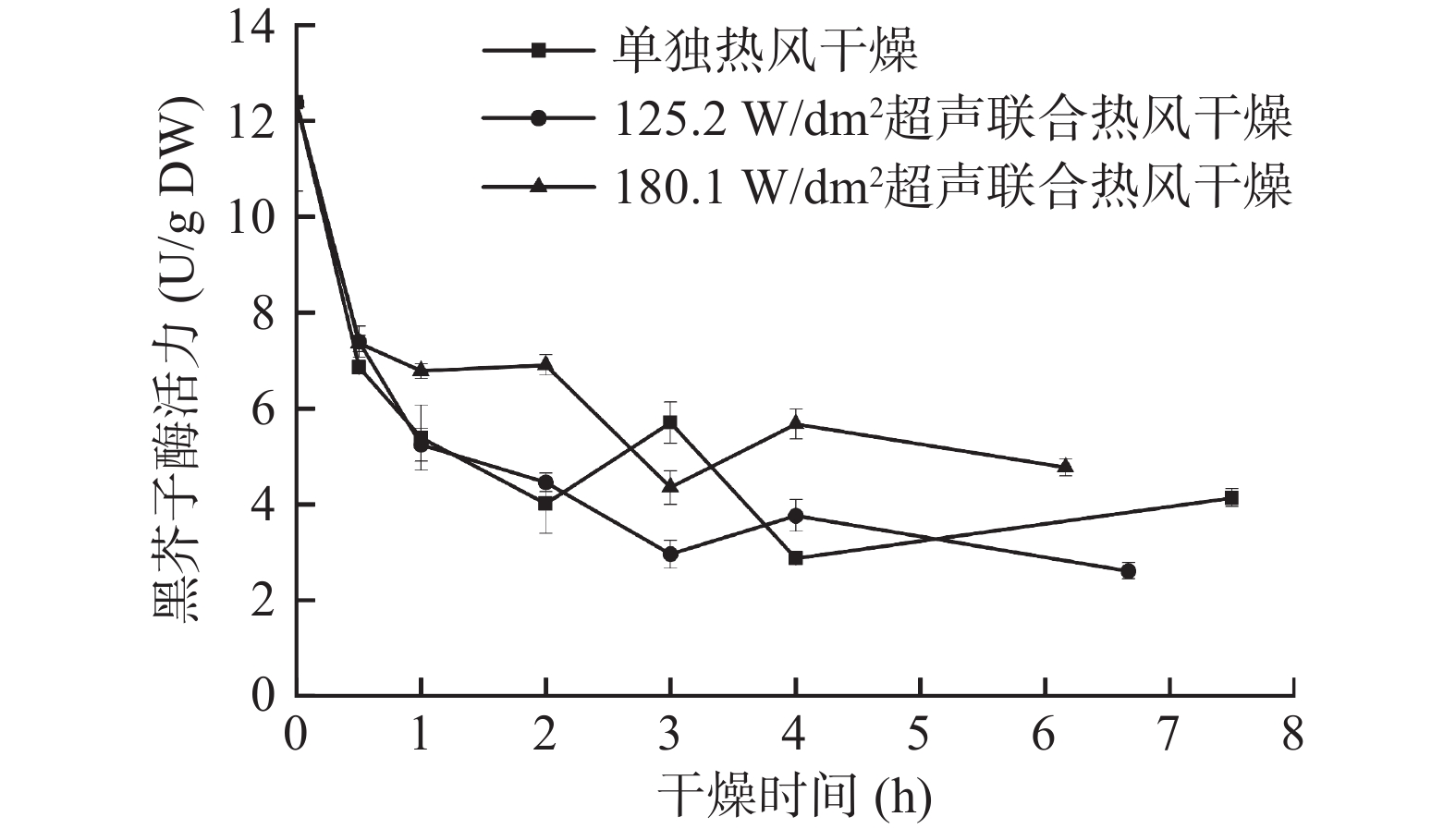
图4和图5分别为西兰花小花球在干燥过程中黑芥子酶活力及萝卜硫素含量的变化。由图4可知,西兰花鲜样中的黑芥子酶活力为12.39±1.86 U/g DW,该结果和Charron等[31]报道的类似。干燥过程中,三种处理下的黑芥子酶活力均呈逐渐下降的趋势。干燥达到终点时,单独热风、125.2 W/dm2气介式超声联合热风、180.1 W/dm2气介式超声联合热风干燥样品的黑芥子酶活力分别为4.14±0.19、2.61±0.17、4.77±0.18 U/g DW,比鲜样低61.5%~78.9%。Oliviero等[32]研究西兰花黑芥子酶活力和热处理之间的关系时也得到了相似的结果。黑芥子酶在干燥过程中酶活性的变化与其分子拥挤/体积排斥效应和构象移动性有关。干燥前,鲜样中充足的水分给予酶构象足够的伸展空间,随着干燥过程的进行,留给蛋白质伸展的体积随着水分的去除逐渐减少,且黑芥子酶会在不断升高的温度下发生不可逆变性[33-34]。此外,在干燥过程中,180.1 W/dm2气介式超声联合热风干燥样品的黑芥子酶活力下降的速度最慢,且残留的黑芥子酶活力最高,比单独热风干燥高出15.2%。该现象不仅与分子拥挤和体积排斥效应相关,还可能和水的增塑作用有关。Oliviero等[32]的研究结果表明,当水分活度下降时,黑芥子酶的稳定性增加。在这三种干燥方式中,180.1 W/dm2气介式超声联合热风干燥能最快除去西兰花样品中的水分,故180.1 W/dm2气介式超声干燥样品在干燥过程中的黑芥子酶稳定性最强。
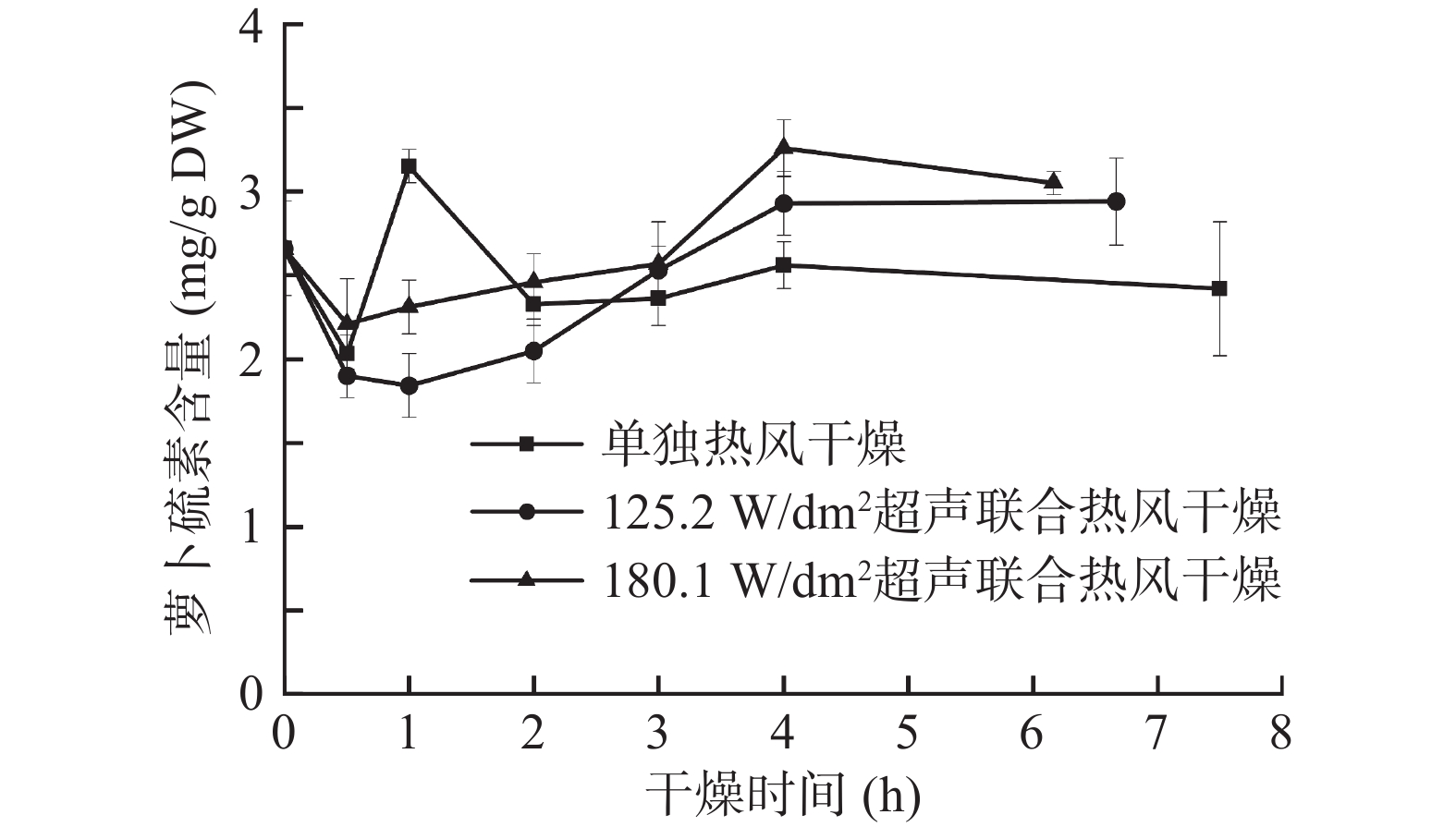
由图5可知,鲜样中萝卜硫素的含量为2.66±0.28 mg/g DW,干燥前0.5 h萝卜硫素含量明显降低。Lekcharoenkul等[35]的研究表明萝卜硫素在样品温度达到42~43 ℃时开始降解,Tanongkankit等[30]也曾报道一旦卷心菜温度达到50.5~53.5 ℃时萝卜硫素就会迅速分解成硫脲,但有时候热处理也会激发萝卜硫素的应激反应,故具体的萝卜硫素降解速度还是取决于物料热处理的方式、温度等多个因素。对于气介式超声联合热风干燥的样品而言,萝卜硫素的含量从1 h左右开始持续升高,并在干燥4 h至干燥终点阶段基本保持稳定,这可能是超声干燥样品中黑芥子酶的活力更强,且超声处理能加速物料内部温度的升高,使促进腈类物质形成的环硫专一性蛋白(ESP)快速失活[35]。Mathsheski等[36]用热风干燥、真空干燥及低压过热蒸汽干燥技术联合干燥卷心菜外叶时发现ESP的活性容易受温度影响,当样品温度超过47~49 ℃时,ESP开始失活,而黑芥子酶在60 ℃时依然存在活性。干燥结束后,单独热风、125.2和180.1 W/dm2气介式超声联合热风干燥的样品中萝卜硫素含量分别为2.42±0.40、2.94±0.26和3.05±0.07 mg/g DW,即超声处理的样品中萝卜硫素含量比单独热风处理的样品高出了21.5%~26.0%。Tian等[37]的研究表明,不同水分含量会影响萝卜硫素的降解机制,即样品的含水量会对萝卜硫素的稳定性产生影响,因为萝卜硫素能和水分子中的羟基反应形成二聚体,加速了萝卜硫素的降解,这可能也是导致单独热风样品中萝卜硫素含量更低的原因之一。
2.4 西兰花干燥过程中抗坏血酸和Fe2+含量变化
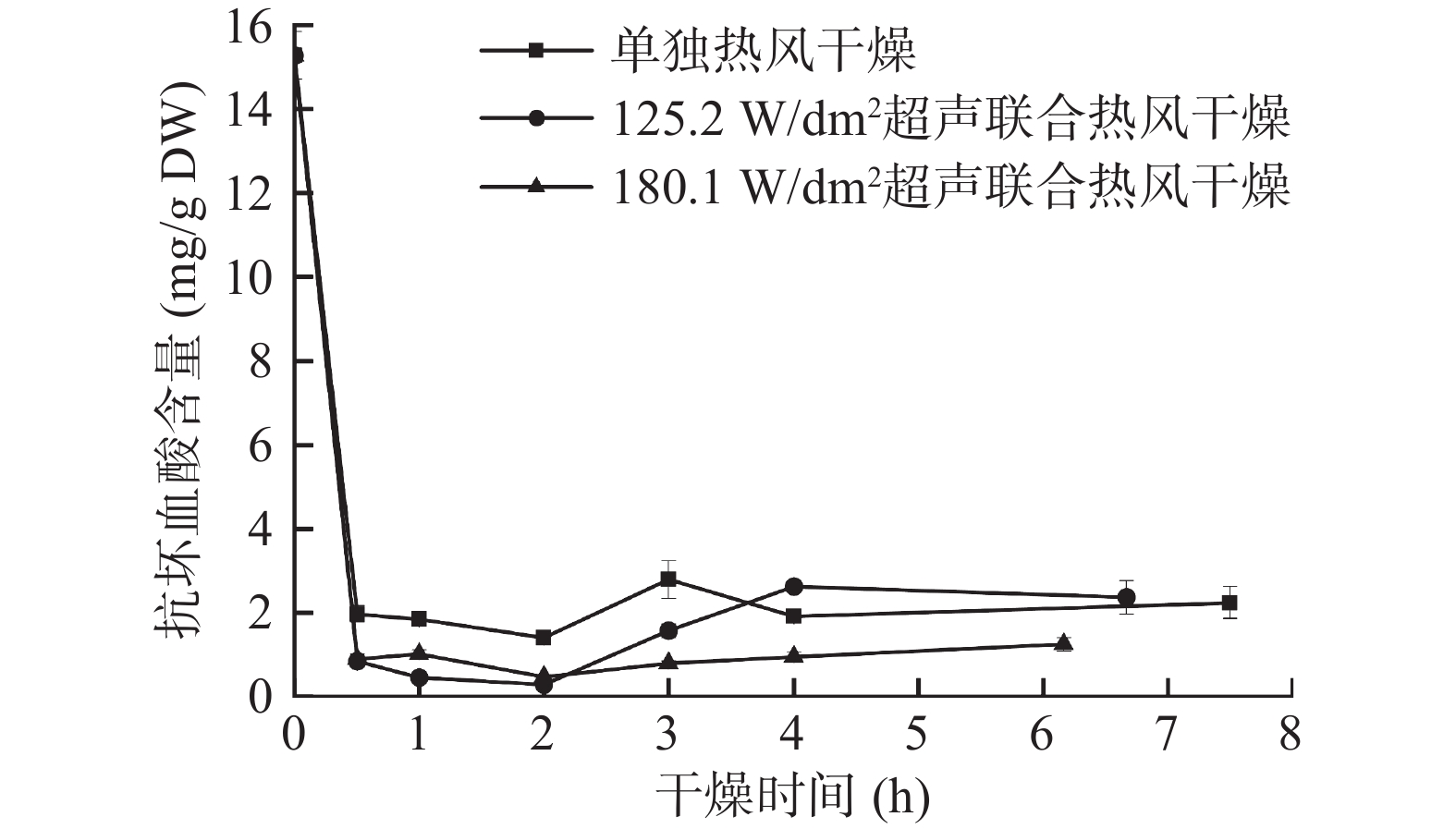
抗坏血酸是黑芥子酶的辅因子,与硫苷酶促降解密切相关[8]。同时,一分子的Fe2+可以和两分子的硫苷结合形成硫苷-金属复合物,从而使硫苷发生非酶促降解[2]。西兰花小花球在干燥过程中抗坏血酸和Fe2+含量的变化见图6和图7。由图6可知,鲜样中抗坏血酸的含量为15.28±0.57 mg/g DW,干燥开始后抗坏血酸含量显著降低。125.2 W/dm2气介式超声联合热风和单独热风干燥的样品在干燥终点处的抗坏血酸保留率分别为15.4%和14.7%,180.1 W/dm2气介式超声联合热风干燥样品在干燥终点处的抗坏血酸保留率最低,为8.1%。该现象一方面可能与高温和氧气的存在相关,样品过热和长时间干燥暴露在氧气中都会导致抗坏血酸的降解[38]。另一方面,抗坏血酸的降解与抗坏血酸氧化酶(AOX)和抗坏血酸过氧化酶(APX)催化的氧化反应有关,该反应可以清除在应激条件下产生的大量ROS自由基,如H2O2等。因为功率超声处理会加速植物基质的破坏,使抗坏血酸更容易同AOX和APX接触,从而加快抗坏血酸的氧化进程[39]。Hanschen等[8]的研究表明抗坏血酸是黑芥子酶的辅因子,在含量充足的情况下能够促进黑芥子酶活性部位释放葡萄糖分子。然而,由表3可知,尽管皮尔森相关系数表明在本实验中抗坏血酸含量和黑芥子酶活力之间存在显著正相关(P<0.01,相关系数为0.661),但抗坏血酸对黑芥子酶活力的促进作用并未体现在本研究结果中,这可能是因为抗坏血酸在热加工过程中很容易降解,保留率相对较低。
表 3 皮尔森相关系数Table 3. Pearson correlation coefficients指标 4-甲基硫氧
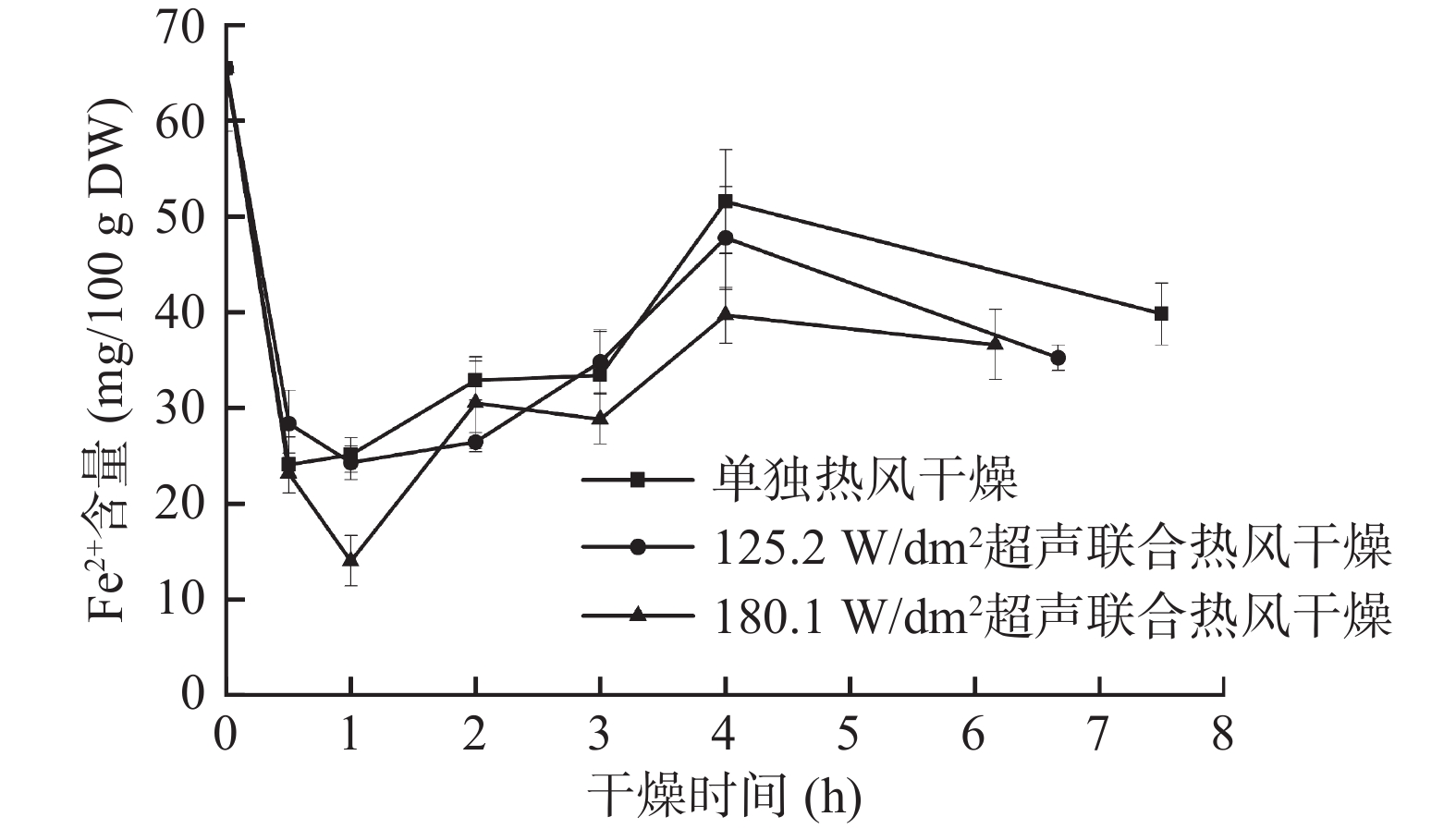
丁基硫苷萝卜硫素 黑芥子酶 抗坏血酸 Fe2+ 4-甲基硫氧丁基硫苷 1 萝卜硫素 0.088 1 黑芥子酶 0.554* −0.190 1 抗坏血酸 0.691** 0.170 0.661** 1 Fe2+ 0.466* 0.420 0.161 0.723** 1 注:*为在0.05水平(双侧)差异有统计学意义;**为在0.01水平(双侧)差异有统计学意义。 由图7可知,单独热风样品的Fe2+含量在干燥过程中始终高于气介式超声联合热风样品,但125.2和180.1 W/dm2气介式超声干燥过程中样品的Fe2+含量之间无明显差异,其中在180.1 W/dm2气介式超声联合热风干燥0.5 h时西兰花样品的Fe2+含量最低,为14.03±2.06 mg/100 g DW。上述情况的产生可能有以下两个原因:一方面,超声波对植物细胞壁的破坏促进了氧气的进入,使Fe2+自发转变为Fe3+;另一方面是因为在干燥前期,单独热风样品的抗坏血酸含量略高于气介式超声联合热风的样品[6]。Hanschen等[40]研究脂肪族硫苷的热降解机制时发现,抗坏血酸的氧化还原作用可以将Fe3+还原为Fe2+,从而促进Fe2+催化硫苷降解过程,使其更容易生成腈类物质。相关性分析结果表明本实验中抗坏血酸和Fe2+含量之间存在显著极正相关(P<0.01,相关系数为0.723)。结合图5可知,干燥0.5 h后,单独热风干燥的样品中Fe2+含量显著增加(P<0.05) ,导致萝卜硫素含量大幅下降,而Fe2+含量相对较低的气介式超声样品在干燥过程中萝卜硫素含量逐渐增多,且在3 h后萝卜硫素含量超过单独热风干燥的样品。Williams等[41]的研究也表明,在水芹中加入Fe2+的螯合剂EDTA能显著抑制苯乙腈的生成,使苯基异硫氰酸酯显著增加。
2.5 西兰花干燥过程中游离酚酸含量变化
酚类化合物是西兰花中除了抗坏血酸之外另一类重要的抗氧化物质。本研究采用HPLC-MS/MS鉴定出干燥过程中西兰花小花球中的5种酚酸,分别是:没食子酸、原儿茶酸、咖啡酸、对香豆酸和阿魏酸,该结果和Gliszczyńska-Świgło等[42]报道的结果类似。表4为西兰花在干燥过程中游离酚酸含量的变化,由表4可知,气介式超声和未超声处理的样品中5种酚酸的含量在干燥初期(0.5~2 h)均呈现下降的趋势,因为酚类物质热不稳定,热处理会导致其发生氧化、聚合或者分解[43]。但随着干燥时间的延长,酚酸含量逐渐增多。这可能是由于随着干燥时间的延长,多酚氧化酶的活力随温度的升高而逐渐下降,甚至变性失活,从而阻止酚类物质被进一步氧化[44]。除此之外,干燥脱水可能会削弱多酚与细胞壁的相互结合作用,导致部分多酚发生解离,由结合酚向游离酚转变[45]。总体而言,气介式超声样品的酚酸降解量要高于单独热风的样品,特别是180.1 W/dm2气介式超声联合热风干燥终点样品中的原儿茶酸和咖啡酸含量,分别为单独热风干燥终点样品的67.7%和65.8%。这可能是因为相比于单独热风干燥导致的样品结构缓慢皱缩,超声波对组织细胞的破坏作用更加彻底,使得各游离酚酸更容易被多酚氧化酶或过氧化酶等氧化。
表 4 西兰花干燥过程中游离酚酸含量的变化Table 4. Variations of free phenolic acid contents of broccoli florets during air drying with and without air-borne ultrasonic assistance处理 时间(h) 游离酚酸含量 (μg/g DW) 没食子酸 原儿茶酸 咖啡酸 对香豆酸 阿魏酸 单独热风干燥 0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 54.15±0.76Bcd 1477.80±223.81Ab 85.61±9.79Be 41.48±9.76Ac 70.50±0.53Ad 1 47.74±6.84Acd 1246.52±94.91Ab 148.83±11.87Bd 45.30±9.16Ac 129.38±18.88Ab 2 37.09±5.99Ad 1450.10±164.45ABb 144.00±10.61Bd 20.68±3.37Bd 98.52±8.09ABbcd 3 59.85±7.24Abc 2268.43±304.67Aa 293.46±14.08Ac 64.48±7.03Ab 118.79±8.53Abc 4 64.77±2.49Aabc 2328.20±189.58Aa 313.44±13.82Bbc 63.78±0.81Ab 134.57±27.29Ab 干燥终点 77.42±12.50Aab 2721.23±79.29Aa 357.09±15.70Ab 29.49±5.65Bcd 76.76±6.42Acd 125.2 W/dm2
气介式超声
联合热风干燥0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 59.80±2.82ABbc 1223.45±165.25Ac 184.15±25.33Ac 31.47±3.17Ac 54.19±5.60ABd 1 47.48±1.14Ac 1490.35±64.18Ac 242.28±23.62Ac 70.66±7.54Ab 81.86±2.91Bcd 2 53.37±4.09Ac 1269.34±18.97Bc 224.11±24.91Bc 34.84±0.71Bc 61.68±0.31Bd 3 67.10±3.35Ab 2114.85±57.37Ab 269.93±16.02Ac 64.65±2.74Ab 108.65±18.62Abc 4 69.65±6.31Aab 2384.16±62.02Aab 449.95±28.08Aa 69.84±8.90Ab 145.61±16.83Ab 干燥终点 69.87±6.42Aab 2400.22±228.33ABab 358.45±43.55Ab 62.71±0.81Ab 127.28±17.12Ab 180.1 W/dm2
气介式超声
联合热风干燥0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 61.66±0.85Ab 1135.02±150.72Ad 196.77±24.50Ad 20.19±1.94Ad 48.89±6.03Bc 1 43.21±3.96Ade 1206.12±207.63Acd 263.39±28.51Acd 49.09±2.73Ac 58.66±7.43Bc 2 51.36±6.09Acd 1775.32±142.45Abc 394.07±35.76Ab 71.57±8.12Ab 130.52±26.60Ab 3 38.53±1.95Be 1932.42±181.47Bb 336.69±31.80Abc 69.58±9.28Abc 149.77±18.30Ab 4 54.97±0.45Abc 2223.47±262.29Aab 371.74±41.30ABb 60.79±12.50Abc 124.50±14.60Ab 干燥终点 61.02±2.43Ab 1843.28±226.48Ab 235.07±25.26Bd 48.74±6.69Ac 103.00±14.66Ab 2.6 西兰花干燥过程中体外抗氧化活性变化
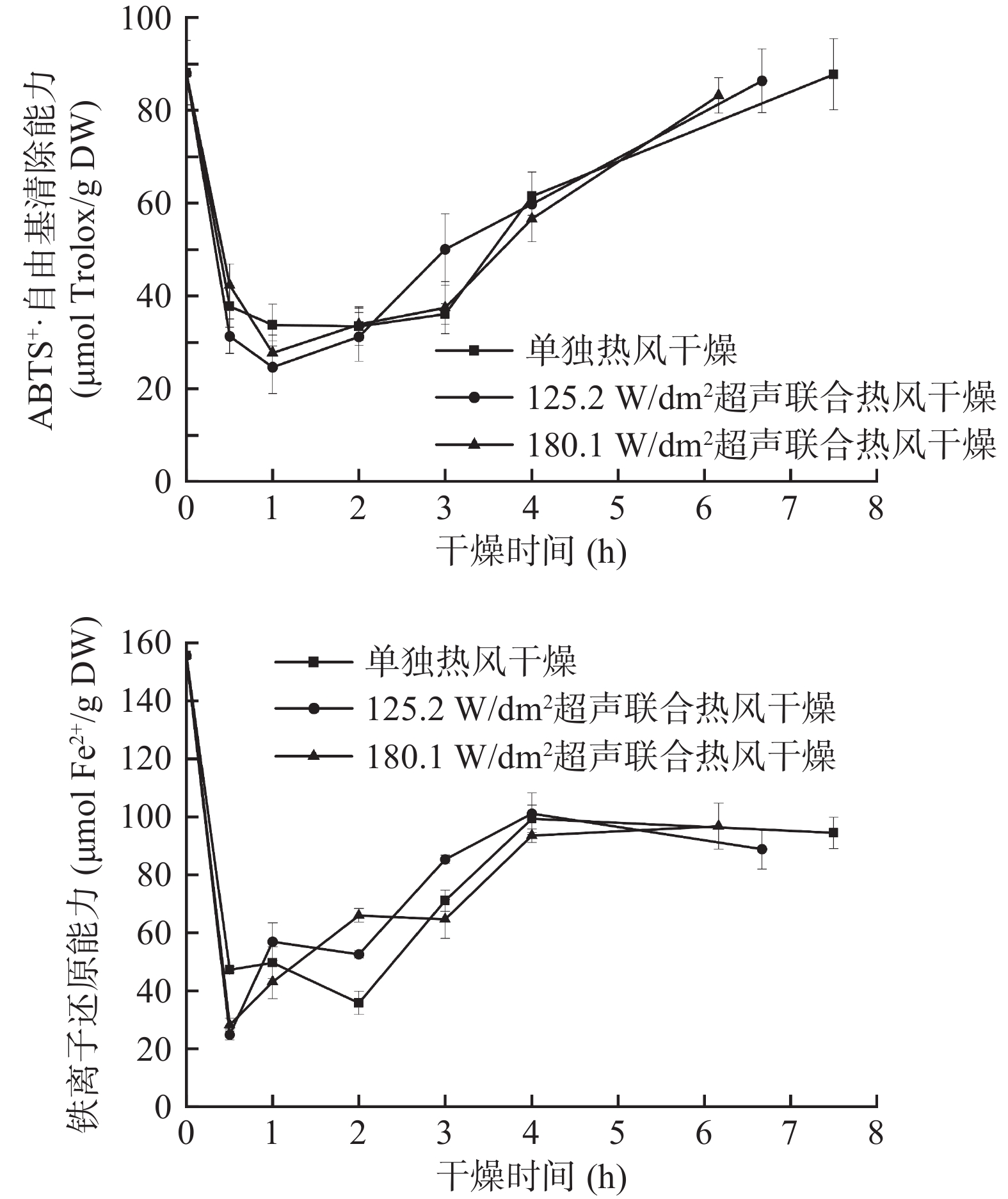
图8为西兰花小花球在干燥过程中ABTS+·清除能力和铁离子还原能力的变化。由图8可知,西兰花鲜样中ABTS+·清除能力和铁离子还原能力分别为88.09±6.93 μmol Trolox/g DW和155.63±5.60 μmol Fe2+/g DW,该结果和Heimler等[46]报道的十字花科蔬菜(甘蓝、西兰花、包菜)类似。西兰花ABTS+·清除能力和铁离子还原能力在干燥过程中均呈现先降低(0~0.5/1 h)后升高(0.5/1 h~干燥终点)的趋势。单独热风干燥、125.2 W/dm2和180.1 W/dm2气介式超声联合热风干燥终点样品的铁离子还原能力分别为94.46±5.43、88.86±6.96和96.78±7.88 μmol Fe2+/g DW,即相比鲜样降低了37.8%~42.9%。然而,鲜样的ABTS+·清除能力和干燥终点的样品之间无显著性差异(P>0.05),这是因为西兰花提取物的抗氧化能力并不仅仅是单体酚抗氧化能力的简单相加,还是它们协同作用的结果[47]。曾有研究表明,超声处理能够引起植物结构的严重改变,降解细胞壁成分并加速多酚氧化酶的释放,使酚类化合物更容易氧化,且水分的快速去除也会增加酚类化合物氧化的敏感性[48-49]。但该结果在本研究中体现的不明显,因为气介式超声和未超声样品间的ABTS+·清除能力和铁离子还原能力无显著性差异。这可能与西兰花小花球的伞状结构有关,该结构削弱了样品干燥时对声波能的吸收,使得超声处理对传质传热的强化作用及组织细胞的破坏作用减弱[50],也可能是干燥前期样品含水量较高使降解反应速度更快,而超声处理能更快除去干燥前期的水分,缩短该过程。
3. 结论
本文研究了气介式超声联合热风干燥(20 kHz,60 ℃,125.2和180.1 W/dm2)对西兰花小花球干燥特性、硫苷及萝卜硫素的衍变以及硫苷分解代谢相关影响因子的影响。研究发现,气介式超声联合热风干燥能够在单独热风干燥的基础上缩短11.1%~17.8%的干燥时间,加快样品的升温进程,且超声干燥样品具有更高的3-吲哚甲基硫苷含量和黑芥子酶活力。尽管干燥过程中气介式超声和未超声样品的抗坏血酸含量、游离酚酸含量和体外抗氧化活性差异不明显,但抗坏血酸和酚类化合物能将Fe3+还原为Fe2+,其中180.1 W/dm2气介式超声样品的Fe2+含量最低,其干燥终点处的萝卜硫素含量也相对较高,为3.05±0.07 mg/g DW。
综上所述,相比于单独热风干燥而言,气介式超声联合热风干燥能够强化西兰花的干燥过程并减少生物活性成分的损失,有利于4-甲基硫氧丁基硫苷向萝卜硫素的方向转化,该研究为揭示超声场下硫苷代谢途径相关物质的变化及在西兰花产品超声干燥应用方面具有重要意义。但本研究仍然存在一些不足,如在西兰花干燥的过程中没有检测专一性蛋白(如环硫专一性蛋白、腈专一性蛋白及硫氰酸酯形成蛋白等)的活力和腈类物质的含量,也没有考虑硫苷降解产物进一步降解的情况,所以无法明确干燥过程中活性物质变化的具体原因。因此,未来在研究超声联合热风干燥西兰花过程中硫苷的代谢机理时,可以着重考虑上述因素,同时通过外源添加的方式验证其它组分对硫苷降解途径的影响,实现对硫苷降解途径的定向调控。
-
表 1 西兰花硫苷成分鉴定
Table 1 Identification of glucosinolates in broccoli florets
序号 化合物名称 保留时间(min) 质量数 质量数误差(10-6) 分子式 1 4-甲基硫氧丁基硫苷 0.81 437.05 0.6 C12H23NO10S3 2 3-丁烯基硫苷 1.82 373.05 0.5 C11H19NO9S2 3 3-吲哚甲基硫苷 4.85 448.06 1.1 C16H20N2O9S2 4 4-甲氧基-3-吲哚甲基硫苷 7.24 478.07 0.1 C17H22N2O10S2 表 2 西兰花干燥过程中硫苷含量的变化
Table 2 Variation of glucosinolates contents of broccoli florets during air drying with and without air-borne ultrasonic assistance
处理 时间(h) 硫苷含量(mg/g DW) 4-甲基硫氧丁基硫苷 3-丁烯基硫苷 3-吲哚甲基硫苷 4-甲氧基-3-吲哚甲基硫苷 单独热风干燥 0 7.61±0.41Aa 0.43±0.06Ae 3.67±0.18Ab 3.26±0.15Aa 0.5 4.33±0.20Aab 0.85±0.04Aa 1.65±0.05Cd 0.37±0.01Bf 1 5.26±0.60Aab 0.75±0.11Aab 2.81±0.37Bc 0.82±0.09Be 2 3.59±0.15Ab 0.62±0.06Bcd 3.75±0.48Bb 1.05±0.06Cd 3 4.09±0.49Ab 0.73±0.08Aabc 3.20±0.29Cbc 1.77±0.07Ac 4 4.90±0.20Aab 0.65±0.07Abcd 4.97±0.11Ba 2.37±0.09Ab 干燥终点 4.36±0.33Aab 0.58±0.07Ad 4.49±0.20Aa 1.84±0.10Ac 125.2 W/dm2
气介式超声联合热风干燥0 7.61±0.41Aa 0.43±0.06Ae 3.67±0.18Ad 3.26±0.15Aa 0.5 3.68±0.22Ab 0.71±0.09Bb 3.22±0.10Be 0.67±0.02Ad 1 5.35±0.60Aab 0.88±0.06Aa 4.83±0.43ABc 1.93±0.14Ab 2 4.42±0.51Ab 0.72±0.01Bb 5.59±0.31Ab 1.78±0.36Bb 3 4.35±0.25Ab 0.67±0.06Abc 4.93±0.18Bc 1.73±0.07Ab 4 3.74±0.23Ab 0.60±0.05Acd 6.66±0.10Aa 1.83±0.19Bb 干燥终点 3.77±0.35Ab 0.53±0.06ABd 4.82±0.05Ac 1.37±0.12Bc 180.1 W/dm2
气介式超声联合热风干燥0 7.61±0.41Aa 0.43±0.06Ad 3.67±0.18Ac 3.26±0.15Aa 0.5 3.32±0.40Ac 0.92±0.08Aa 5.90±0.52Aab 0.51±0.12Bf 1 4.10±0.32Abc 0.85±0.08Aa 6.48±0.30Aab 1.72±0.15Ac 2 5.68±0.24Ab 0.84±0.09Aa 6.54±0.54Aab 2.06±0.08Ab 3 5.09±0.11Abc 0.73±0.06Ab 7.14±0.12Aa 1.46±0.15Bd 4 4.31±0.21Abc 0.56±0.05Ac 6.04±0.62Aab 1.52±0.04Ccd 干燥终点 4.04±0.31Abc 0.46±0.04Bd 4.97±0.47Abc 0.84±0.11Ce 注:不同大写字母表示同一干燥时间点下不同干燥处理之间存在显著性差异,P<0.05;不同小写字母表示同一干燥处理下不同干燥时间点存在显著性差异,P<0.05;表4同。 表 3 皮尔森相关系数
Table 3 Pearson correlation coefficients
指标 4-甲基硫氧
丁基硫苷萝卜硫素 黑芥子酶 抗坏血酸 Fe2+ 4-甲基硫氧丁基硫苷 1 萝卜硫素 0.088 1 黑芥子酶 0.554* −0.190 1 抗坏血酸 0.691** 0.170 0.661** 1 Fe2+ 0.466* 0.420 0.161 0.723** 1 注:*为在0.05水平(双侧)差异有统计学意义;**为在0.01水平(双侧)差异有统计学意义。 表 4 西兰花干燥过程中游离酚酸含量的变化
Table 4 Variations of free phenolic acid contents of broccoli florets during air drying with and without air-borne ultrasonic assistance
处理 时间(h) 游离酚酸含量 (μg/g DW) 没食子酸 原儿茶酸 咖啡酸 对香豆酸 阿魏酸 单独热风干燥 0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 54.15±0.76Bcd 1477.80±223.81Ab 85.61±9.79Be 41.48±9.76Ac 70.50±0.53Ad 1 47.74±6.84Acd 1246.52±94.91Ab 148.83±11.87Bd 45.30±9.16Ac 129.38±18.88Ab 2 37.09±5.99Ad 1450.10±164.45ABb 144.00±10.61Bd 20.68±3.37Bd 98.52±8.09ABbcd 3 59.85±7.24Abc 2268.43±304.67Aa 293.46±14.08Ac 64.48±7.03Ab 118.79±8.53Abc 4 64.77±2.49Aabc 2328.20±189.58Aa 313.44±13.82Bbc 63.78±0.81Ab 134.57±27.29Ab 干燥终点 77.42±12.50Aab 2721.23±79.29Aa 357.09±15.70Ab 29.49±5.65Bcd 76.76±6.42Acd 125.2 W/dm2
气介式超声
联合热风干燥0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 59.80±2.82ABbc 1223.45±165.25Ac 184.15±25.33Ac 31.47±3.17Ac 54.19±5.60ABd 1 47.48±1.14Ac 1490.35±64.18Ac 242.28±23.62Ac 70.66±7.54Ab 81.86±2.91Bcd 2 53.37±4.09Ac 1269.34±18.97Bc 224.11±24.91Bc 34.84±0.71Bc 61.68±0.31Bd 3 67.10±3.35Ab 2114.85±57.37Ab 269.93±16.02Ac 64.65±2.74Ab 108.65±18.62Abc 4 69.65±6.31Aab 2384.16±62.02Aab 449.95±28.08Aa 69.84±8.90Ab 145.61±16.83Ab 干燥终点 69.87±6.42Aab 2400.22±228.33ABab 358.45±43.55Ab 62.71±0.81Ab 127.28±17.12Ab 180.1 W/dm2
气介式超声
联合热风干燥0 80.33±2.49Aa 2636.36±240.76Aa 499.22±30.62Aa 121.21±2.55Aa 313.23±10.37Aa 0.5 61.66±0.85Ab 1135.02±150.72Ad 196.77±24.50Ad 20.19±1.94Ad 48.89±6.03Bc 1 43.21±3.96Ade 1206.12±207.63Acd 263.39±28.51Acd 49.09±2.73Ac 58.66±7.43Bc 2 51.36±6.09Acd 1775.32±142.45Abc 394.07±35.76Ab 71.57±8.12Ab 130.52±26.60Ab 3 38.53±1.95Be 1932.42±181.47Bb 336.69±31.80Abc 69.58±9.28Abc 149.77±18.30Ab 4 54.97±0.45Abc 2223.47±262.29Aab 371.74±41.30ABb 60.79±12.50Abc 124.50±14.60Ab 干燥终点 61.02±2.43Ab 1843.28±226.48Ab 235.07±25.26Bd 48.74±6.69Ac 103.00±14.66Ab -
[1] 王顺玉, 黄小凤, 刘瑶, 等. 不同预冷方式对西兰花货架期品质的影响[J]. 食品工业科技,2020,41(20):266−272. [WANG S Y, HUANG X F, LIU Y, et al. Effect of different precooling methods on shelf life quality of broccoli[J]. Science and Technology of Food Industry,2020,41(20):266−272. [2] HANSCHEN F S, LAMY E, SCHREINER M, et al. Reactivity and stability of glucosinolates and their breakdown products in foods[J]. Angewandte Chemie International Edition,2014,53(43):11430−11450. doi: 10.1002/anie.201402639
[3] 张园园. 油菜和拟南芥中几个硫代葡萄糖苷合成及调控基因的功能分析[D]. 武汉: 华中农业大学, 2015. ZHANG Y Y. Function analyses of several genes involved in biosynthesis and regulation of glucosinolate in Brassica napus and Arabidopsis thaliana[D]. Wuhan: Huazhong Agricultural University, 2015.
[4] MAHN A, MARTIN C, REYES A, et al. Evolution of sulforaphane content in sulforaphane-enriched broccoli during tray drying[J]. Journal of Food Engineering,2016,186:27−33. doi: 10.1016/j.jfoodeng.2016.04.007
[5] MATUSHESKI N, JEFFERY E. Comparison of the bioactivity of two glucoraphanin hydrolysis products found in broccoli, sulforaphane and sulforaphane nitrile[J]. Journal of Agricultural and Food Chemistry,2001,49(12):5743−5749. doi: 10.1021/jf010809a
[6] BELLOSTAS N, SØRENSEN A, SØRENSEN J, et al. Fe2+ -catalyzed formation of nitriles and thionamides from intact glucosinolates[J]. Journal of Natural Products,2008,71:76−80. doi: 10.1021/np070438d
[7] HENNIG K, DE VOS R C H, MALIEPAARD C, et al. A metabolomics approach to identify factors influencing glucosinolate thermal degradation rates in Brassica vegetables[J]. Food Chemistry,2014,155:287−297. doi: 10.1016/j.foodchem.2014.01.062
[8] HANSCHEN F S, KLOPSCH R, OLIVIERO T, et al. Optimizing isothiocyanate formation during enzymatic glucosinolate breakdown by adjusting pH value, temperature and dilution in Brassica vegetables and Arabidopsis thaliana[J]. Scientific Reports,2017,7:40807. doi: 10.1038/srep40807
[9] 任广跃, 靳力为, 段续, 等. 超声处理对果蔬干燥速率及品质的影响[J]. 食品与生物技术学报,2020,39(4):9−17. [REN G Y, JIN L W, DUAN X, et al. Effect of ultrasonic treatment on drying rate and quality of fruits and vegetables[J]. Journal of Food Science and Biotechnology,2020,39(4):9−17. doi: 10.3969/j.issn.1673-1689.2020.04.002 [10] SCHÖSSLER K, JÄGER H, KNORR D. Effect of continuous and intermittent ultrasound on drying time and effective diffusivity during convective drying of apple and red bell pepper[J]. Journal of Food Engineering,2012,108(1):103−110. doi: 10.1016/j.jfoodeng.2011.07.018
[11] GAMBOA SANTOS J, MONTILLA A, CÁRCEL J A, et al. Air-borne ultrasound application in the convective drying of strawberry[J]. Journal of Food Engineering,2014,128:132−139. doi: 10.1016/j.jfoodeng.2013.12.021
[12] TAO Y, WANG P, WANG Y L, et al. Power ultrasound as a pretreatment to convective drying of mulberry (Morus alba L. ) leaves: Impact on drying kinetics and selected quality properties[J]. Ultrasonics Sonochemistry,2016,31:310−318. doi: 10.1016/j.ultsonch.2016.01.012
[13] FAN K, ZHANG M, MUJUMDAR A S. Application of airborne ultrasound in the convective drying of fruits and vegetables: A review[J]. Ultrasonics Sonochemistry,2017,39:47−57. doi: 10.1016/j.ultsonch.2017.04.001
[14] TAO Y, HAN M F, GAO X G, et al. Applications of water blanching, surface contacting ultrasound-assisted air drying, and their combination for dehydration of white cabbage: Drying mechanism, bioactive profile, color and rehydration property[J]. Ultrasonics Sonochemistry,2019,53:192−201. doi: 10.1016/j.ultsonch.2019.01.003
[15] HENNIG K, VERKERK R, DEKKER M, et al. Quantitative trait loci analysis of non-enzymatic glucosinolate degradation rates in Brassica oleracea during food processing[J]. Theoretical and Applied Genetics,2013,126(9):2323−2334. doi: 10.1007/s00122-013-2138-1
[16] AOAC(Association of Official Analytical Chemists). Official methods of analysis[M]. 17th ED. Washington DC USA, 2000.
[17] BAENAS N, VILLAÑO D, GARCÍA VIGUERA C, et al. Optimizing elicitation and seed priming to enrich broccoli and radish sprouts in glucosinolates[J]. Food Chemistry,2016,204:314−319. doi: 10.1016/j.foodchem.2016.02.144
[18] GUO L P, YANG R Q, WANG Z Y, et al. Glucoraphanin, sulforaphane and myrosinase activity in germinating broccoli sprouts as affected by growth temperature and plant organs[J]. Journal of Functional Foods,2014,9(1):70−77.
[19] 仇宏伟, 王宏达, 郭丽萍. 不同解冻方式对速冻西兰花品质影响[J]. 食品工业科技,2020,41(16):266−270. [QIU H W, WANG H D, GUO L P. Effect of different thawing methods on quality of quick-frozen broccoli[J]. Science and Technology of Food Industry,2020,41(16):266−270. [20] THOMAS M, BADR A, DESJARDINS Y, et al. Characterization of industrial broccoli discards (Brassica oleracea var. italica) for their glucosinolate, polyphenol and flavonoid contents using UPLC MS/MS and spectrophotometric methods[J]. Food Chemistry,2018,245:1204−1211. doi: 10.1016/j.foodchem.2017.11.021
[21] WANG Y C, TAO Y, ZHANG X Y, et al. Metabolic profile of ginkgo kernel juice fermented with lactic aicd bacteria: A potential way to degrade ginkgolic acids and enrich terpene lactones and phenolics[J]. Process Biochemistry,2019,76:25−33. doi: 10.1016/j.procbio.2018.11.006
[22] LING B, OUYANG S, WANG S J. Radio-frequency treatment for stabilization of wheat germ: Storage stability and physicochemical properties[J]. Innovative Food Science & Emerging Technologies,2018,52:158−165.
[23] VALLEJO F, TOMÁS-BARBERÁN F, GARCÍA-VIGUERA C. Glucosinolates and vitamin C content in edible parts of broccoli florets after domestic cooking[J]. European Food Research and Technology,2002,215(4):310−316. doi: 10.1007/s00217-002-0560-8
[24] PARK S, ARASU M V, LEE M K, et al. Analysis and metabolite profiling of glucosinolates, anthocyanins and free amino acids in inbred lines of green and red cabbage (Brassica oleracea L.)[J]. LWT- Food Science and Technology,2014,58(1):203−213. doi: 10.1016/j.lwt.2014.03.002
[25] PALANI K, HARBAUM PIAYDA B, MESKE D, et al. Influence of fermentation on glucosinolates and glucobrassicin degradation products in sauerkraut[J]. Food Chemistry,2016,190:755−762. doi: 10.1016/j.foodchem.2015.06.012
[26] YÁBAR E, PEDRESCHI R, CHIRINOS R, et al. Glucosinolate content and myrosinase activity evolution in three maca (Lepidium meyenii Walp. ) ecotypes during preharvest, harvest and postharvest drying[J]. Food Chemistry,2011,127(4):1576−1583. doi: 10.1016/j.foodchem.2011.02.021
[27] 黄慧, 陶立华, 杨静, 等. 高效氯氟氰菊酯对小白菜生长和硫代葡萄糖苷含量的影响[J]. 浙江农业学报,2015,27(1):104−109. [HUANG H, TAO L H, YANG J, et al. The effect of lambda-cyhalothrin on growth and glucosinolates of pakchoi[J]. Acta Agriculturae Zhejiangensis,2015,27(1):104−109. doi: 10.3969/j.issn.1004-1524.2015.01.19 [28] ANGELINO D, JEFFERY E. Glucosinolate hydrolysis and bioavailability of resulting isothiocyanates: Focus on glucoraphanin[J]. Journal of Functional Foods,2014,7:67−76. doi: 10.1016/j.jff.2013.09.029
[29] HANSCHEN F S, KUHN C, NICKEL M, et al. Leaching and degradation kinetics of glucosinolates during boiling of Brassica oleracea vegetables and the formation of their breakdown products[J]. Food Chemistry,2018,263:240−250. doi: 10.1016/j.foodchem.2018.04.069
[30] TANONGKANKIT Y, CHIEWCHAN N, DEVAHASTIN S. Evolution of anticarcinogenic substance in dietary fibre powder from cabbage outer leaves during drying[J]. Food Chemistry,2011,127(1):67−73. doi: 10.1016/j.foodchem.2010.12.088
[31] CHARRON C S, SAXTON A M, SAMS C E. Relationship of climate and genotype to seasonal variation in the glucosinolate–myrosinase system. II. Myrosinase activity in ten cultivars of Brassica oleracea grown in fall and spring seasons[J]. Journal of the Science of Food and Agriculture,2005,85(4):682−690. doi: 10.1002/jsfa.2031
[32] OLIVIERO T, VERKERK R, DEKKER M. Effect of water content and temperature on glucosinolate degradation kinetics in broccoli (Brassica oleracea var. Italica)[J]. Food Chemistry,2012,132(4):2037−2045. doi: 10.1016/j.foodchem.2011.12.045
[33] PENNER M H. Review of kinetic modeling of reactions in foods[J]. Journal of Chemical Education,2012,89(1):15−15. doi: 10.1021/ed200760v
[34] GHAWI S K, METHVEN L, RASTALL R A, et al. Thermal and high hydrostatic pressure inactivation of myrosinase from green cabbage: A kinetic study[J]. Food Chemistry,2012,131(4):1240−1247. doi: 10.1016/j.foodchem.2011.09.111
[35] LEKCHAROENKUL P, TANONGKANKIT Y, CHIEWCHAN N, et al. Enhancement of sulforaphane content in cabbage outer leaves using hybrid drying technique and stepwise change of drying temperature[J]. Journal of Food Engineering,2014,122:56−61. doi: 10.1016/j.jfoodeng.2013.08.037
[36] MATUSHESKI N V, JUVIK J A, JEFFERY E H. Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli[J]. Phytochemistry,2004,65(9):1273−1281. doi: 10.1016/j.phytochem.2004.04.013
[37] TIAN G F, LI Y, CHENG L, et al. The mechanism of sulforaphene degradation to different water contents[J]. Food Chemistry,2016,194:1022−1027. doi: 10.1016/j.foodchem.2015.08.107
[38] NOWACKA M, WIKTOR A, ANUSZEWSKA A, et al. The application of unconventional technologies as pulsed electric field, ultrasound and microwave-vacuum drying in the production of dried cranberry snacks[J]. Ultrasonics Sonochemistry,2019,56:1−13. doi: 10.1016/j.ultsonch.2019.03.023
[39] AGUILAR-CAMACHO M, WELTI-CHANES J, JACOBO-VELAZQUEZ D A. Combined effect of ultrasound treatment and exogenous phytohormones on the accumulation of bioactive compounds in broccoli florets[J]. Ultrasonics Sonochemistry,2019,50:289−301. doi: 10.1016/j.ultsonch.2018.09.031
[40] HANSCHEN F S, PLATZ S, MEWIS I, et al. Thermally induced degradation of sulfur-containing aliphatic glucosinolates in broccoli sprouts (Brassica oleracea var. Italica) and model systems[J]. Journal of Agricultural & Food Chemistry,2012,60(9):2231−2241.
[41] WILLIAMS D J, CRITCHLEY C, PUN S, et al. Differing mechanisms of simple nitrile formation on glucosinolate degradation in Lepidium sativum and Nasturtium officinale seeds[J]. Phytochemistry,2009,70(11−12):1401−1409. doi: 10.1016/j.phytochem.2009.07.035
[42] GLISZCZYNSKA-ŚWIGŁO A, CISKA E, PAWLAK-LEMANSKA K, et al. Changes in the content of health-promoting compounds and antioxidant activity of broccoli after domestic processing[J]. Food Additives & Contaminants,2006,23(11):1088−1098.
[43] 王强, 邓朝芳, 任彦荣, 等. 无核紫葡萄干燥特性及其总酚含量变化研究[J]. 食品科学,2016,37(5):62−66. [WANG Q, DENG C F, REN Y R, et al. Drying characteristics and change in total polyphenol content of seedless purple grapes[J]. Food Science,2016,37(5):62−66. [44] 陈玮琦, 郭玉蓉, 张娟, 等. 干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J]. 食品科学,2015,36(5):33−37. [CHEN W Q, GUO Y R, ZHANG J, et al. Effect of drying methods on polyphenol contents and antioxidant activities of unripe apple fruits[J]. Food Science,2015,36(5):33−37. doi: 10.7506/spkx1002-6630-201505007 [45] TAO Y, LI D D, SIONG C W, et al. Comparison between airborne ultrasound and contact ultrasound to intensify air drying of blackberry: Heat and mass transfer simulation, energy consumption and quality evaluation[J]. Ultrasonics Sonochemistry,2020,72:105410−105410.
[46] HEIMLER D, VIGNOLINi P, DINI M G, et al. Antiradical activity and polyphenol composition of local Brassicaceae edible varieties[J]. Food Chemistry,2005,99(3):464−469.
[47] 沈维治, 廖森泰, 林光月, 等. 桑叶多酚单体化合物的抗氧化活性及其协同作用[J]. 蚕业科学,2015,41(2):342−348. [SHEN W Z, LIAO S T, LIN G Y, et al. Antioxidant activity and synergistic effect of polyphenol monomer substances in mulberry leaves[J]. Acta Sericologica Sinica,2015,41(2):342−348. [48] GARCIA PEREZ J V, ORTUÑO C, PUIG A, et al. Enhancement of water transport and microstructural changes induced by high-intensity ultrasound application on orange peel drying[J]. Food & Bioprocess Technology,2011,5(6):2256−2265.
[49] GHAFOOR K, YONG H C, JU Y J, et al. Optimization of ultrasound-assisted extraction of phenolic compounds, antioxidants, and anthocyanins from grape (Vitis vinifera) seeds[J]. Journal of Agricultural & Food Chemistry,2009,57(11):4988−4994.
[50] CRUZ L, CLEMENTE G, MULET A, et al. Air-borne ultrasonic application in the drying of grape skin: Kinetic and quality considerations[J]. Journal of Food Engineering,2016,168:251−258. doi: 10.1016/j.jfoodeng.2015.08.001





 下载:
下载:

 下载:
下载:
