Optimization of Aqueous Two-phase Extraction Technology of Total Flavonoids from the Flowers of Camellia chrysantha and Analysis of Its Antioxidant Activity
-
摘要: 研究了超声波辅助聚乙二醇(PEG)/(NH4)2SO4双水相提取金花茶花总黄酮工艺及其抗氧化活性。以黄酮萃取率为指标,在单因素实验的基础上,采用正交试验优化提取工艺。通过DPPH·和OH·清除率的测定,评价其抗氧化效果。采用HPLC分析对金花茶花中的芦丁、槲皮素和山奈酚等黄酮化合物进行了确认。实验结果表明,最佳提取条件为:PEG相对分子量600,PEG质量分数19%,硫酸铵质量分数20%,乙醇浓度80%,超声时间30 min, 黄酮的萃取率可达98.50%,黄酮得率可达13.54%。抗氧化实验结果表明,金花茶花黄酮提取物清除DPPH·的IC50为0.070 mg/mL,清除OH·的IC50为0.679 mg/mL。正交试验优化超声波辅助双水相提取金花茶花总黄酮工艺合理,得到的黄酮具有良好的抗氧化活性,可进一步开发利用。Abstract: The ultrasonic assisted PEG/(NH4)2SO4 aqueous two-phase extraction of total flavonoids from the flowers of Camellia chrysantha and its antioxidant activity were studied. Taking the extraction rate of flavonoids as the index, the extraction process was optimized by orthogonal design on the basis of single factor tests. The antioxidant effect was evaluated by the determination of DPPH· and OH· scavenging rates. Flavonoid compounds including rutin, quercetin and kaempferol in Camellia chrysantha were confirmed by HPLC analysis. The results showed that under the optimum extraction conditions (PEG molecular weight 600, PEG mass fraction 19%, ammonium sulfate mass fraction 20%, ethanol concentration 80%, ultrasonic time 30 min), the extraction rate of flavonoids could reach 98.50%, and the yield of flavonoids could reach 13.54%. The results of antioxidant experiments showed that the IC50 of the flavonoid extract from the flowers of Camellia chrysantha to DPPH· and OH· were 0.070 and 0.679 mg/mL, respectively. The results suggest that the technology of ultrasonic assisted aqueous two-phase extraction of total flavonoids from the flowers of Camellia chrysantha is reasonable, the obtained flavonoids exhibiting good antioxidant capacity and can be further developed and utilized.
-
Keywords:
- Camellia chrysantha /
- flavonoids /
- two-phase extraction /
- antioxidation /
- yield
-
金花茶组植物(Camellia sect. Chrysantha) 是山茶科(Theaceae) 山茶属(Camellia)植物,常绿灌木或小乔木[1]。金花茶花是茶花家族中唯一花瓣金黄色的珍稀物种,且花中含有黄酮、茶多酚、茶多糖、皂苷、茶氨酸等活性成分[2],在山茶类群中享有“植物界大熊猫”、“茶族皇后”之美誉。
植物体中的黄酮具有抗肿瘤、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抗辐射等多种药理作用[3-7],工业应用前景广阔。关于金花茶花黄酮化合物的提取已有初步研究,然而,现有方法主要是基于乙醇或乙醇/水体系进行的传统溶液提取[8-9],且相应研究报道较少。双水相提取技术是一种新型的萃取分离技术,根据物质在互不相溶两相间溶解性的差异,实现目标成分的萃取和分离,被广泛用于生物化学产品的分离纯化[10-11]。与传统方法相比,双水相提取技术具有操作条件温和、易于工业放大、成本低、过程连续化等优点。目前,双水相体系已经有效应用于黄酮类化合物[12-14]的提取。但双水相体系在金花茶花总黄酮中的提取应用尚未见公开报道。
综上,本研究采用PEG/(NH4)2SO4双水相体系,在室温(25 ℃)下以超声波辅助提取金花茶花总黄酮,以黄酮的萃取率为指标,考察PEG相对分子量、乙醇浓度、PEG质量分数、硫酸铵质量分数、超声时间等因素的影响,采用正交试验进行工艺优化探索,并研究黄酮提取物的抗氧化活性,以期为金花茶的深度开发和综合利用提供科学依据。
1. 材料与方法
1.1 材料与仪器
金花茶花 购自广西防城港;芦丁(95%)、槲皮素(98.5%)、山奈酚(97%)等标准品 阿拉丁试剂(上海)有限公司;PEG平均相对分子质量分别为 600、1000、1500、2000 国药集团化学试剂有限公司;乙腈 色谱纯,美国TEDIA试剂有限公司;无水乙醇、硫酸铵、硝酸铝、亚硝酸钠、氢氧化钠、磷酸、1,1-二苯基-2-三硝基苯肼(DPPH)、七水合硫酸亚铁、水杨酸、抗坏血酸(Vc)等试剂 分析纯,均购自国药集团化学试剂有限公司;双氧水(30%质量浓度) 上海凌峰化学试剂有限公司;去离子水 为实验室自制。
L6S紫外分光光度计 上海精密科学仪器有限公司;电子分析天平CPA225D分析天平 德国赛多利斯集团公司;DF-101S集热式恒温加热磁力搅拌器 杭州慧创仪器设备有限公司;SK2200H超声波清洗器 上海科导超声仪器有限公司;TDZ5-WS型离心机 长沙湘锐离心机有限公司;DZF型真空干燥箱 上海精宏实验设备有限公司;P230II型高效液相色谱仪 大连依利特分析仪器有限公司。
1.2 实验方法
1.2.1 PEG/(NH4)2SO4双水相体系相图制作
在25 ℃下,用Albertson浊点法[15]测定并制作由PEG600、PEGl000、PEG1500、PEG2000和(NH4)2SO4溶液所形成的相图。
称取3.5 g PEG600配制成质量分数为35%的溶液,定量滴加40%的(NH4)2SO4溶液至混合溶液出现浑浊状态,记录滴入的硫酸铵质量,加水使体系重新变为澄清状态,记录加入水的质量,然后计算出此时(NH4)2SO4和PEG600在体系中的质量分数,即得相图中一个点。不断重复上述操作,以(NH4)2SO4的质量分数为横坐标,PEG600的质量分数为纵坐标作图,即可得到PEG600/(NH4)2SO4双节线图。
按照上述操作,分别测定并得到PEGl000、PEG1500、PEG2000和(NH4)2SO4的双节线图。
1.2.2 PEG/(NH4)2SO4双水相提取金花茶花总黄酮
1.2.2.1 原料预处理
将金花茶花置于60 ℃真空干燥箱恒温脱水干燥3 h,粉碎制成粉末,密封装于自封袋中低温保存备用。
1.2.2.2 金花茶花总黄酮提取工艺
PEG/(NH4)2SO4双水相提取金花茶花总黄酮提取工艺如下[14,16]:称取0.50 g经预处理后的金花茶花粉末于50 mL锥形瓶中,加入80%乙醇25 mL,超声(200 W)30 min,离心(1500 r/min,15 min)分离得粗提液。固定双水相体系总质量为10 g,在10 mL离心管中加入一定量的PEG和(NH4)2SO4,加入乙醇粗提液2 mL,然后加水至10 g。摇匀,离心(1500 r/min,15 min),静置使两相分离。分别测定上下相的体积及上下相中的黄酮含量。
1.2.3 单因素实验
PEG相对分子质量对总黄酮分配行为的影响:在PEG质量分数为15%,(NH4)2SO4质量分数为20%,乙醇浓度80%,超声时间30 min条件下,分别设置PEG相对分子质量为600、1000、1500、2000,测定金花茶花总黄酮的分配系数K和萃取率Y。
乙醇浓度对总黄酮分配行为的影响:在PEG600质量分数15%,(NH4)2SO4质量分数20%,超声时间30 min的条件下,分别设定乙醇浓度为0%、20%、40%、60%、80%、100%,测定金花茶花总黄酮的分配系数K和萃取率Y。
PEG600质量分数对总黄酮分配行为的影响:在(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min的条件下,分别设置PEG600质量分数为12%、15%、18%、21%,测定金花茶花总黄酮的分配系数K和萃取率Y。
(NH4)2SO4质量分数对总黄酮分配行为的影响:在PEG600质量分数18%,乙醇浓度80%,超声时间30 min的条件下,分别设置(NH4)2SO4质量分数为14%、16%、18%、20%,22%,测定金花茶花总黄酮的分配系数K和萃取率Y。
超声时间对总黄酮分配行为的影响:在PEG600质量分数18%,(NH4)2SO4质量分数20%,乙醇浓度80%的条件下,分别设置超声时间为0、15、30、45 min,测定金花茶花总黄酮的分配系数K和萃取率Y。
1.2.4 正交试验
在单因素实验基础上,选取PEG600质量分数、(NH4)2SO4质量分数、乙醇浓度、超声时间四因素三水平[L9(34)]进行正交试验,以金花茶花总黄酮的萃取率为指标,优选出最佳提取条件。正交试验的因素和水平设计如表1所示。
表 1 正交试验设计Table 1. Orthogonal experimental design水平 PEG600质量分数A(%) (NH4)2SO4质量分数B(%) 乙醇浓度C(%) 超声时间D(min) 1 17 19 75 15 2 18 20 80 30 3 19 21 85 45 1.2.5 金花茶花总黄酮含量测定
实验采用NaNO2-Al(NO3)3-NaOH显色法测定总黄酮含量[17]。取芦丁标准品溶液和金花茶花提取液,以乙醇溶液为空白对照,紫外分光光度计在200~700 nm 波长范围内进行扫描,实验结果显示,芦丁标准品和金花茶花提取液在510 nm 波长下均有最大吸收,结合文献报道,确定选用510 nm 为检测波长。
芦丁标准曲线绘制:称取5 mg芦丁于50 mL容量瓶中,加无水乙醇至溶解后,用60%浓度的乙醇定容至刻度,摇匀后,得到质量浓度为0.1 mg/mL的芦丁标准溶液。取6只标记好的10 mL容量瓶分别加入0、1、2、3、4、5 mL芦丁标准溶液,加水至5 mL,加入5%浓度的NaNO2溶液0.3 mL,摇匀后静置5 min,加入10%浓度的Al(NO3)3·9H2O溶液 0.3 mL,摇匀后静置6 min,再加入4%浓度的NaOH溶液2 mL,加水稀释至刻度线,摇匀后静置10 min。以第一管为对照组在510 nm处测定吸光度值。以浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
按上述芦丁标准曲线绘制中的方法,以稀释后的金花茶花提取液代替芦丁标准溶液,测定其吸光度。按照(1)~(3)式计算金花茶花总黄酮的分配系数(K)和萃取率(Y),按照(4)式计算金花茶花总黄酮得率。
R=V1/V2 (1) K=C1/C2 (2) Y(%)=RK/(1+RK)×100 (3) 总黄酮得率(%)=C1V1n/M×100 (4) 式中,R是双水相体系中上、下相的体积比;V1是双水相体系中上相的体积,mL;V2是双水相体系中下相的体积,mL;K为双水相体系的分配系数;C1是双水相体系中上相所含的黄酮浓度,mg/mL;C2是双水相体系中下相所含黄酮浓度,mg/mL;Y为双水相体系中金花茶花总黄酮的萃取率,%;n为稀释倍数;M为金花茶花粉的质量,mg。
1.2.6 HPLC分析
采用HPLC法对金花茶花提取物中的芦丁、槲皮素和山奈酚等三个黄酮化合物进行定性定量分析。
制样:精密称取适量芦丁、槲皮素和山奈酚标准样品,分别配制成浓度为0.306、0.256、0.258 mg/mL的乙醇溶液,按体积比为1:1:1混合后,得到芦丁、槲皮素和山奈酚浓度分别为0.102、0.085、0.086 mg/mL的混标溶液;按照1.2.4的方法所选出的优化条件,制备金花茶花黄酮提取物,加无水乙醇稀释,过0.22 μm滤膜后,得到待测样品溶液。
色谱条件[18]:Hypersil ODS2 C18 色谱柱(4.6 mm×200 mm, 5 μm);流动相(A)为0.2%磷酸溶液,流动相(B)为乙腈;梯度洗脱(0~5 min,20%~22%B;5~10 min,22%~25%B;10~20 min,25%~35%B;20~25 min,35%~40%B;25~30 min,40%~55%B;30~35 min,55%~20%B);检测波长为360 nm;流速为1.0 mL/min;柱温为30 ℃;运行时间为35 min。
标准曲线的绘制:分别吸取混标溶液2、5、10、15、20 μL,在上述色谱条件下进样,以各组分的质量为横坐标,峰面积为纵坐标,分别绘制标准曲线。
1.2.7 金花茶花总黄酮抗氧化性能研究
1.2.7.1 DPPH·清除能力测定
参照文献的方法[19],略有改动。按照1.2.4的方法所选出的优化条件,提取金花茶花总黄酮,得到黄酮质量浓度分别为0.065、0.163、0.26、0.358、0.455、0.553、0.65 mg/mL的样品溶液。在具塞试管中加入2 mL样品溶液,2 mL浓度为0.2 mmol/L的DPPH乙醇溶液,在室温下,避光反应30 min,测定其在517 nm波长下的吸光值,即为Ai;以2 mL无水乙醇代替样品溶液按照相同方法测定吸光值,即为A0;以2 mL无水乙醇代替DPPH溶液,重复上述步骤测定吸光值,即为Aj。自由基清除率(YA)按式(5)计算:
YA(\%)=(1-(Ai−Aj)/A0)×100 (5) 1.2.7.2 OH·清除能力测定
按照文献的方法[20],略有改动。按照1.2.4的方法所选出的优化条件,提取金花茶花总黄酮,得到黄酮质量浓度分别为0.325、0.488、0.65、0.813、0.975、1.14、1.3、1.46 mg/mL的样品溶液。在具塞试管中依次加入2 mL 9 mmol /L 的FeSO4溶液,2 mL样品溶液,再分别加入2 mL 9 mmol/L的水杨酸溶液和2 mL 8 mmol/L的 H2O2溶液,摇匀后静置30 min。测定其在510 nm处的吸光值,即为Ai;以2 mL去离子水代替待测样品溶液按照相同方法测定吸光值,即为A0;以2 mL去离子水代替H2O2溶液,重复上述步骤测定吸光值,即为Aj。自由基清除率(YA)按式(5)计算。
1.3 数据处理
采用Origin8.0数据处理软件进行单因素实验数据分析和图表制作,采用正交设计助手iiv3.1软件进行正交试验设计分析,采用Excel进行相对标准偏差分析。实验中,数据重复测定三次,取平均值。
2. 结果与分析
2.1 PEG600/(NH4)2SO4双水相体系相图
PEG600/(NH4)2SO4双水相体系相图如图1所示。曲线上的点为临界点,单相区在曲线下方,体系为均相,无相分离;两相区在曲线上方。由实验结果可知,当(NH4)2SO4的质量分数一定时,PEG的分子量越大,形成两相所需的PEG质量分数越小,越容易形成双水相体系[21]。而PEG分子量越高,黏度越高,相分离时间就越长[14]。在PEG相对分子量固定、质量分数固定的情况下,(NH4)2SO4质量分数过低,体系不能形成两相;而(NH4)2SO4质量分数过高,则会导致盐析出。因此,实验点应选择在曲线上方的合理区域。
2.2 单因素实验结果
2.2.1 PEG相对分子质量的影响
PEG相对分子质量对金花茶花总黄酮分配行为的影响如表2所示。由表可知,随着PEG分子量的增加,上下相的体积比R减小。PEG600的分配系数K和萃取率Y都较其它相对分子质量的PEG要大,可能的原因是PEG相对分子质量小时,体系的黏度低,传质阻力小[22]。当PEG的相对分子质量大于1000时,随着其相对分子质量的增大,K值逐渐增大,可能的原因是其空间阻力增大,因此,疏水性增大,更利于黄酮类化合物在上相的分配[22];然而,萃取率无明显变化,说明此时PEG相对分子质量对萃取率已无明显影响。由上可知,PEG600的萃取效果最好,因此后续实验采用PEG600做进一步研究。
表 2 PEG相对分子质量对金花茶花总黄酮分配的影响Table 2. Effect of PEG molecular weight on the distribution of total flavonoids from the flowers of Camellia chrysanthaPEG相对分子量 R K Y(%) 600 0.95 32.43 97.07 1000 0.93 25.11 96.09 1500 0.91 28.13 96.16 2000 0.89 28.40 96.02 2.2.2 乙醇浓度的影响
乙醇浓度对金花茶花总黄酮分配行为的影响如表3所示。由表可知,随着粗提液乙醇浓度的增加,上下相的体积比R不断增加,这是因为乙醇主要分布在上相[16],且乙醇具有一定的亲水性。分配系数K和萃取率Y随着乙醇浓度的增加先增加然后下降,当乙醇浓度为80%时,达到最大值。这是因为,一定的乙醇浓度可提高黄酮化合物的溶解度并有利于其在上相中的分配,随着乙醇浓度进一步增加,上相非极性增加,而黄酮苷类物质含有具极性的糖分子结构,此外,一些脂溶性有机物的溶解度也会增加,从而会抑制黄酮类化合物在粗提液中的溶出量以及在双水相体系中上相的分配[23]。由上可知,较佳的乙醇浓度为80%。
表 3 乙醇浓度对金花茶花总黄酮分配的影响Table 3. Effect of ethanol concentration on the distribution of total flavonoids from the flowers of Camellia chrysantha乙醇浓度(%) R K Y(%) 0 0.61 17.86 91.06 20 0.64 19.54 91.89 40 0.70 20.08 92.88 60 0.81 26.22 95.10 80 0.95 32.43 97.07 100 0.98 21.00 95.22 2.2.3 PEG600质量分数的影响
PEG600质量分数对金花茶花总黄酮分配行为的影响如表4所示。由表可知,随着PEG质量分数的增加,上下相的体积比R逐渐增加,分配系数K和萃取率Y也随之增大。随着PEG质量分数的增加,其捕获盐相中水分子的能力随之加强,上相的体积则随之增大,疏水性增加,从而有利于极性较小的黄酮化合物在上相的分布,因此,分配系数和萃取率均逐步增大[14]。当PEG600质量分数大于18%,萃取率增加不明显,且当PEG600质量分数大于21%时,会有盐析出。综合考虑成本的基础上,选取PEG600质量分数为18%进行后续实验研究。
表 4 PEG600质量分数对金花茶花总黄酮分配的影响Table 4. Effect of mass fraction of PEG600 on the distribution of total flavonoids from the flowers of Camellia chrysanthaPEG600质量分数(%) R K Y(%) 12 0.83 26.75 95.69 15 0.95 32.43 97.07 18 1.05 43.20 98.17 21 1.13 45.30 98.21 2.2.4 (NH4)2SO4质量分数的影响
(NH4)2SO4质量分数对金花茶花总黄酮分配行为的影响如表5所示。由表可知,随着(NH4)2SO4质量分数的增加,上下相的体积比R逐渐减小,与文献的研究结论一致[14],黄酮的分配系数K和萃取率Y先增加后减小,当硫酸铵质量分数为20%时,达到最大值。这是由于随着(NH4)2SO4质量分数的增加,上相中PEG600的质量分数逐步增加,从而有利于黄酮类物质的萃取。进一步提高(NH4)2SO4质量分数,(NH4)2SO4在上相中的含量也随之增加,从而不利于黄酮类物质的萃取[21]。因此,选取硫酸铵质量分数为20%进行后续实验研究。
表 5 (NH4)2SO4质量分数对金花茶花总黄酮分配的影响Table 5. Effect of mass fraction of (NH4)2SO4 on the distribution of total flavonoids from the flowers of Camellia chrysantha(NH4)2SO4质量分数(%) R K Y(%) 14 1.26 18.00 95.68 16 1.13 27.29 97.42 18 1.07 36.00 97.78 20 1.05 43.20 98.17 22 0.95 33.78 97.59 2.2.5 超声时间的影响
超声时间对金花茶花总黄酮分配行为的影响如表6所示。由表可知,随着超声时间的延长,黄酮的分配系数K和萃取率Y先逐步增加,当超声时间大于30 min时,分配系数和总黄酮萃取率略有减小的趋势。这可能是因为随着超声时间的增加,细胞破碎更完全,更好地促进了黄酮物质的溶出以及在上下相的分配,但随着超声时间达到一定值后进一步增加,会破坏黄酮物质的结构[6]。因此,上述条件下的最佳超声时间为30 min。
表 6 超声时间对金花茶花总黄酮分配的影响Table 6. Effect of ultrasonic time on the distribution of total flavonoids from the flowers of Camellia chrysantha超声时间(min) R K Y(%) 0 0.93 19.50 94.66 15 0.98 31.33 96.68 30 1.05 43.20 98.17 45 1.05 43.17 98.11 2.3 正交试验结果
正交试验结果见表7。由表可知,根据极差R分析,各因素对金花茶花黄酮类化合物分布的影响顺序为A>D>C>B,即PEG600质量分数>超声时间>乙醇浓度>(NH4)2SO4质量分数。最优条件是A3B2C2D2,即PEG600质量分数19%,(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min。所得的组合为实验组别以外的组合,因此需要进行验证实验,重复三次操作,萃取率分别为98.30%、98.41%、98.78%,平均值98.50%,大于实验表中的任何一组,相对标准偏差(RSD)为0.2553%,重现性好,具有较好的稳定性。在此条件下,总黄酮的得率为13.54%,与文献报道结果接近[1, 9]。
表 7 正交试验结果Table 7. Results of the orthogonal experiments试验号 A B C D 萃取率(%) 1 1 1 1 1 96.07 2 1 2 2 2 97.71 3 1 3 3 3 96.53 4 2 1 2 3 98.14 5 2 2 3 1 97.23 6 2 3 1 2 98.01 7 3 1 3 2 97.65 8 3 2 1 3 98.27 9 3 3 2 1 97.58 K1 96.770 97.287 97.450 96.960 K2 97.793 97.737 97.810 97.790 K3 97.833 97.373 97.137 97.647 R 1.063 0.450 0.673 0.830 2.4 HPLC分析
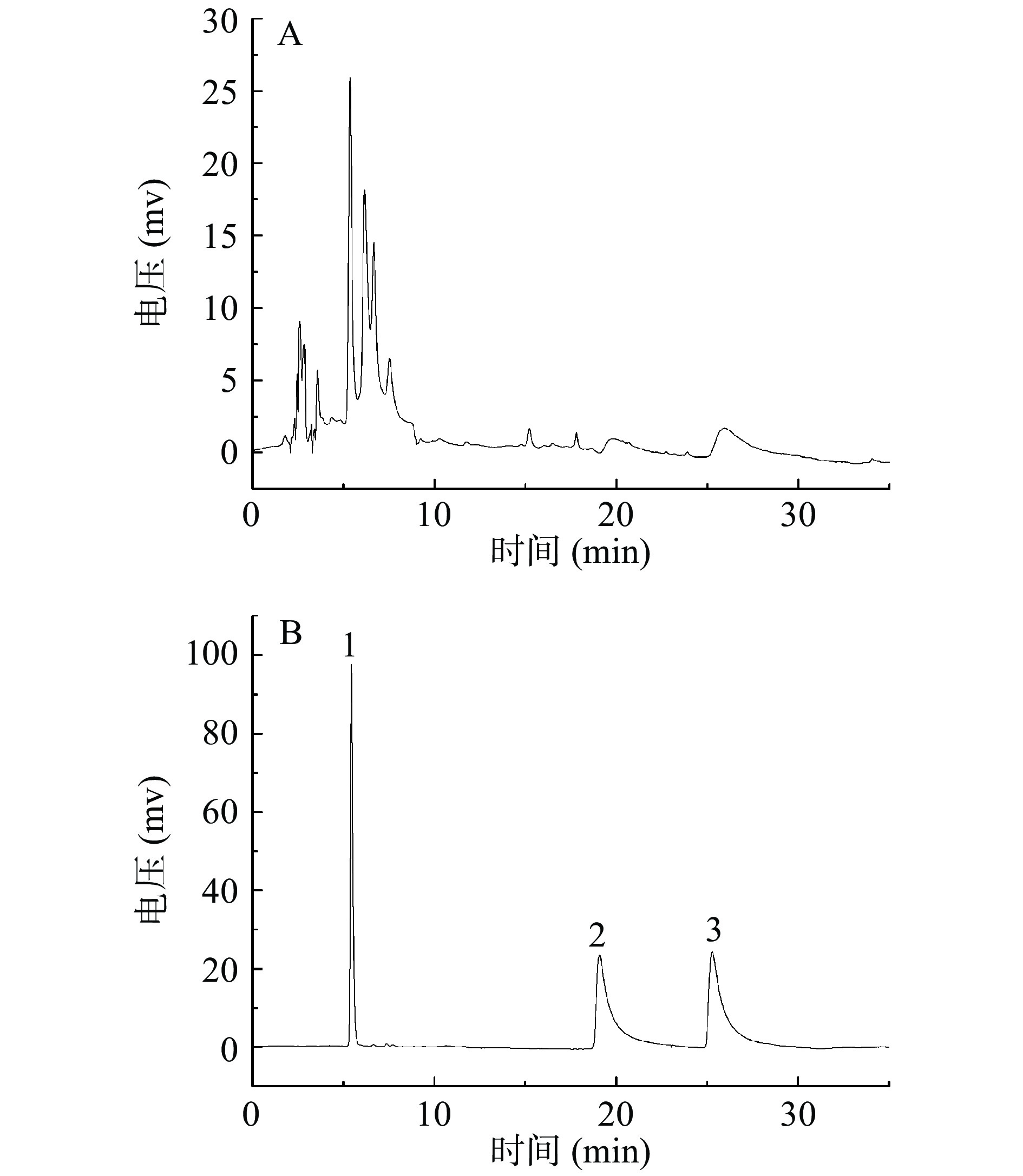
由文献报道[8]可知,芦丁、槲皮素和山奈酚为金花茶花中的代表性黄酮类化合物。图2为样品溶液和混标溶液的HPLC图。根据图中各组分的峰型及保留时间可知,样品中含有芦丁、槲皮素和山奈酚等三个黄酮化合物。经定量分析,金花茶花中芦丁为7.15 mg/g,槲皮素为1.23 mg/g,山奈酚为2.66 mg/g。
2.5 金花茶花黄酮提取物抗氧化性能评价
2.5.1 DPPH·清除能力
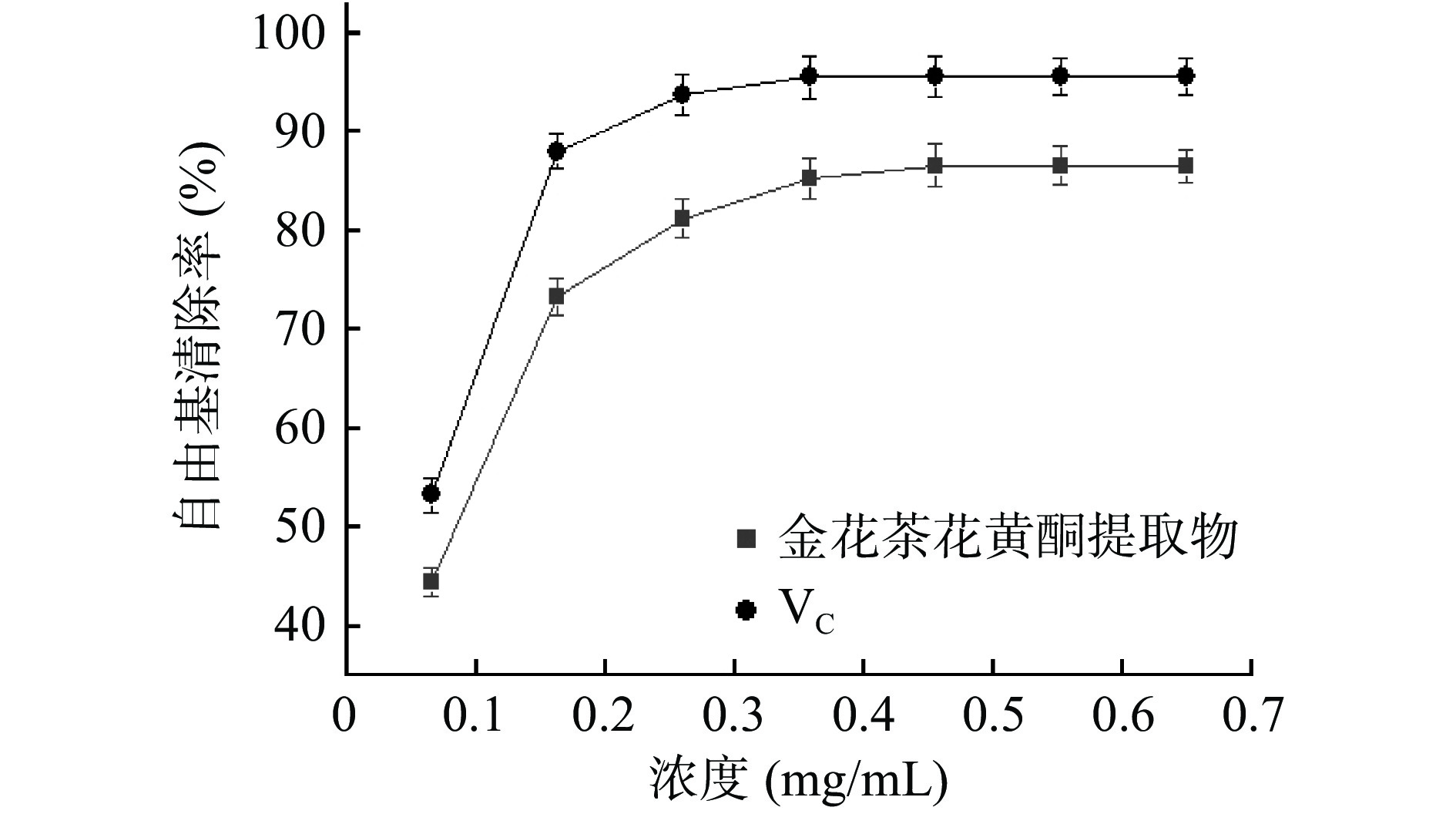
由图3可知,VC清除DPPH·能力随浓度增加而升高,当浓度为0.358 mg/mL时,清除率已达到95.63%,继续增大浓度清除率无明显变化。金花茶花黄酮提取物清除DPPH·能力随浓度的增加而升高,当样品浓度为0.455 mg/mL时,对DPPH·的清除率为86.63%,为VC水平的91%,说明金花茶花黄酮提取物对DPPH·有较强的清除能力[24],文献[9]报道当金花茶花提取物浓度为2 mg/mL时,对DPPH·的清除率为78.05%。采用SPSS 20.0软件分析,VC清除DPPH·的IC50为0.054 mg/mL,金花茶花黄酮提取物清除DPPH·的IC50为0.070 mg/mL。
2.5.2 OH·清除能力
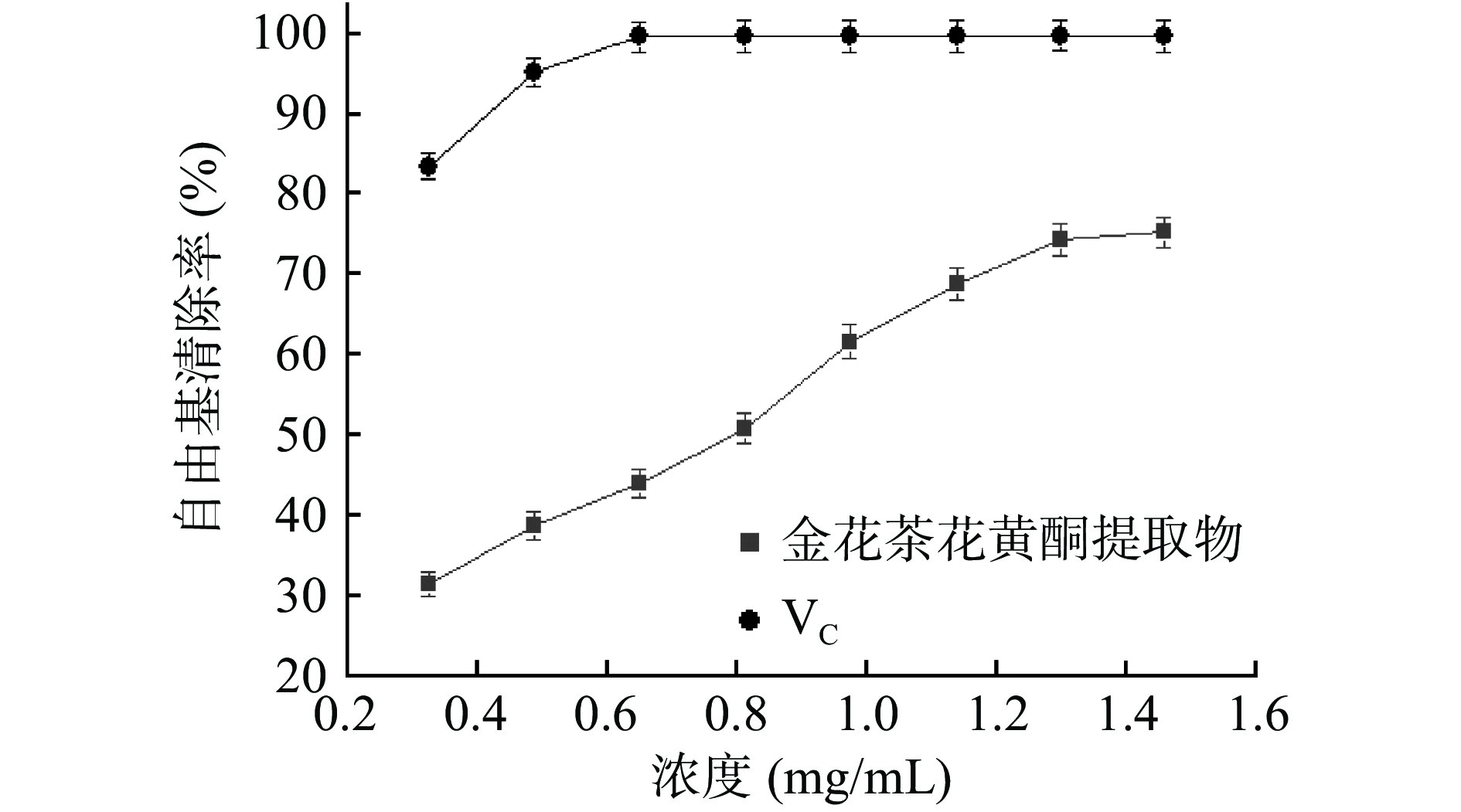
由图4可知,在所测定浓度范围内,VC对OH·始终保持很高的清除能力,当浓度大于0.65 mg/mL时,清除率几乎接近100%[20]。金花茶花黄酮提取物对OH·表现出一定的清除能力,且在一定的浓度范围内,对OH·清除能力与浓度呈明显的量效关系[25]。当样品浓度为1.46 mg/mL时,对OH·的清除率为75.23%,表现出较好的清除能力[26],文献[25]报道当金花茶花黄酮提取物浓度为1.2 mg/mL时,对OH·的清除率为71.3%。采用SPSS 20.0软件分析,VC清除OH·的IC50为0.176 mg/mL,金花茶花黄酮提取物清除OH·的IC50为0.679 mg/mL。
3. 结论
考察了室温下超声波辅助金花茶花总黄酮在PEG/(NH4)2SO4双水相体系中的分配规律。在单因素实验的基础上,采用正交试验优化工艺流程。最佳的萃取条件为PEG600质量分数19%,(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min。在此条件下,总黄酮的萃取率为98.50%,得率为13.54%。该工艺在温和的条件下进行,具有操作简单、绿色的优点,易于工业化。此外,以DPPH·和OH·的清除率为指标,考察了黄酮提取物的抗氧化性能。结果表明,金花茶花黄酮提取物清除DPPH·的IC50为0.070 mg/mL,清除OH·的IC50为0.679 mg/mL,表现出良好的抗氧化活性。该实验结果可为后续黄酮化合物等天然产物的提取及抗氧化性能研究提供参考,具有一定的理论意义及工业化应用价值。
-
表 1 正交试验设计
Table 1 Orthogonal experimental design
水平 PEG600质量分数A(%) (NH4)2SO4质量分数B(%) 乙醇浓度C(%) 超声时间D(min) 1 17 19 75 15 2 18 20 80 30 3 19 21 85 45 表 2 PEG相对分子质量对金花茶花总黄酮分配的影响
Table 2 Effect of PEG molecular weight on the distribution of total flavonoids from the flowers of Camellia chrysantha
PEG相对分子量 R K Y(%) 600 0.95 32.43 97.07 1000 0.93 25.11 96.09 1500 0.91 28.13 96.16 2000 0.89 28.40 96.02 表 3 乙醇浓度对金花茶花总黄酮分配的影响
Table 3 Effect of ethanol concentration on the distribution of total flavonoids from the flowers of Camellia chrysantha
乙醇浓度(%) R K Y(%) 0 0.61 17.86 91.06 20 0.64 19.54 91.89 40 0.70 20.08 92.88 60 0.81 26.22 95.10 80 0.95 32.43 97.07 100 0.98 21.00 95.22 表 4 PEG600质量分数对金花茶花总黄酮分配的影响
Table 4 Effect of mass fraction of PEG600 on the distribution of total flavonoids from the flowers of Camellia chrysantha
PEG600质量分数(%) R K Y(%) 12 0.83 26.75 95.69 15 0.95 32.43 97.07 18 1.05 43.20 98.17 21 1.13 45.30 98.21 表 5 (NH4)2SO4质量分数对金花茶花总黄酮分配的影响
Table 5 Effect of mass fraction of (NH4)2SO4 on the distribution of total flavonoids from the flowers of Camellia chrysantha
(NH4)2SO4质量分数(%) R K Y(%) 14 1.26 18.00 95.68 16 1.13 27.29 97.42 18 1.07 36.00 97.78 20 1.05 43.20 98.17 22 0.95 33.78 97.59 表 6 超声时间对金花茶花总黄酮分配的影响
Table 6 Effect of ultrasonic time on the distribution of total flavonoids from the flowers of Camellia chrysantha
超声时间(min) R K Y(%) 0 0.93 19.50 94.66 15 0.98 31.33 96.68 30 1.05 43.20 98.17 45 1.05 43.17 98.11 表 7 正交试验结果
Table 7 Results of the orthogonal experiments
试验号 A B C D 萃取率(%) 1 1 1 1 1 96.07 2 1 2 2 2 97.71 3 1 3 3 3 96.53 4 2 1 2 3 98.14 5 2 2 3 1 97.23 6 2 3 1 2 98.01 7 3 1 3 2 97.65 8 3 2 1 3 98.27 9 3 3 2 1 97.58 K1 96.770 97.287 97.450 96.960 K2 97.793 97.737 97.810 97.790 K3 97.833 97.373 97.137 97.647 R 1.063 0.450 0.673 0.830 -
[1] 牛广俊, 邢建宏, 朱思, 等. 金花茶活性成分及抗氧化活性测定[J]. 森林与环境学报,2015,35(2):165−168. [NIU G J, XING J H, ZHU S, et al. Determination of active ingredients and antioxidant activities of Camellia sect. Chrysantha by QAMS[J]. Journal of Forest and Environment,2015,35(2):165−168. [2] 贺栋业, 李晓宇, 王丽丽, 等. 金花茶化学成分和药理作用研究进展[J]. 中国实验方剂学杂志,2016,22(3):231−234. [HE D Y, LI X Y, WANG L L, et al. Chemical constituents and pharmacological effects of Camellia nitidissima[J]. Chinese Journal of Experimental Traditional Medical Formulae,2016,22(3):231−234. [3] BEATA O. A review of in vitro studies of the anti-platelet potential of citrus fruit flavonoids[J]. Food and Chemical Toxicology,2021,150:112090. doi: 10.1016/j.fct.2021.112090
[4] KOPUSTINSKIENE D M, JAKSTAS V, SAVICKAS A, et al. Flavonoids as anticancer agents[J]. Nutrients,2020,12(2):457. doi: 10.3390/nu12020457
[5] 时桂芹, 沈佳鑫, 孙新成, 等. 金花茶化学成分和药理作用研究进展芍药种皮黄酮类化合物的超声辅助提取工艺优化及抗氧化活性分析[J]. 中国食品添加剂,2021,32(2):26−34. [SHI G Q, SHEN J X, SUN X C, et al. Optimization of ultrasonic-assisted extraction and antioxidant activity analysis of flavonoids from Paeonia lactiflora seed peel[J]. China Food Additives,2021,32(2):26−34. [6] 刘媛洁, 张良. 响应面法优化复合酶辅助超声波提取柚子皮总黄酮工艺[J]. 食品工业科技,2019,40(23):143−150. [LIU Y J, ZHANG L. Optimization of enzymatic assisted ultrasonic extraction of total flavonoids from grapefruit peel by response surface methodology[J]. Science and Technology of Food Industry,2019,40(23):143−150. [7] MIROSSAY L, VARINSKÁ L, MOJŽIŠ J. Antiangiogenic effect of flavonoids and chalcones: An update[J]. International Journal of Molecular Sciences,2018,19(1):27.
[8] 彭晓, 于大永, 冯宝民, 等. 金花茶花化学成分的研究[J]. 广西植物,2011,31(4):550−553. [PENG X, YU D Y, FENG B M, et al. Chemical constituents from the flowers of Camellia chrysantha[J]. Guihaia,2011,31(4):550−553. doi: 10.3969/j.issn.1000-3142.2011.04.025 [9] 牛广俊, 朱思, 王维华, 等. 金花茶黄酮类成分超声辅助半仿生提取工艺研究[J]. 食品工业科技,2015,36(10):241−248. [NIU G J, ZHU S, WANG W H, et al. Optimization of ultrasonic assisted semi-bionic extraction technology for Camellia chrysantha[J]. Science and Technology of Food Industry,2015,36(10):241−248. [10] 程卓, 刘春平, 卢延斌. 珍珠层可溶性蛋白质的双水相萃取分离方法研究[J]. 食品工业,2018,39(8):64−68. [CHENG Z, LIU C P, LU Y B. Aqueous two-phase system for preliminary purification of proteins from nacre power of the pearl oyster Pinctada fucata[J]. Food Industry,2018,39(8):64−68. [11] 范勇, 卢艳敏, 崔波. 双水相萃取技术在提取纯化生物制品中的应用[J]. 食品与发酵工业,2015,41(7):268−273. [FAN Y, LU Y M, CUI B. Application of aqueous two-phase systems for extraction and purification of biological products[J]. Food and Fermentation Industries,2015,41(7):268−273. [12] MA F Y, GU C B, LI C Y, et al. Microwave-assisted aqueous two-phase extraction of isoflavonoids from Dalbergia odorifera T. Chen leaves[J]. Separation and Purification Technology,2013,115:136−144. doi: 10.1016/j.seppur.2013.05.003
[13] XIE X, ZHU D, ZHANG W, et al. Microwave-assisted aqueous two-phase extraction coupled with high performance liquid chromatography for simultaneous extraction and determination of four flavonoids in Crotalaria sessiliflora L.[J]. Industrial Crops and Products,2017,95:632−642. doi: 10.1016/j.indcrop.2016.11.032
[14] 杨利民, 吕金萍, 冯妍. 蒲公英总黄酮在聚乙二醇-硫酸铵双水相体系中的分配与提取[J]. 化工进展,2014,33(8):1992−1996,2011. [YANG L M, LV J P, FENG Y. Partition and extraction of total flavonoids from Taraxacum mongolicum in PEG/(NH4)2SO4 aqueous two-phase system[J]. Chemical Industry and Engineering Progress,2014,33(8):1992−1996,2011. [15] ALBERTTSONL P A. Partition of cell particles and macromolecules [M]. New York: Wiley Publishing, 1971.
[16] 陈钢, 李栋林, 史建鑫, 等. 响应面试验优化超声耦合双水相体系提取茶多酚工艺[J]. 食品科学,2016,37(6):95−100. [CHENG, LI D L, SHI J X, et al. Optimization of ultrasound-assisted aqueous two-phase extraction of tea polyphenols by response surface design[J]. Food Science,2016,37(6):95−100. doi: 10.7506/spkx1002-6630-201606016 [17] 陈莹, 张巧云, 任丽, 等. 金线莲总黄酮提取工艺优化及不同月龄、品系金线莲黄酮含量比较[J]. 食品工业科技,2019,40(8):184−189. [CHEN Y, ZHANG Q Y, REN L, et al. Optimization of extraction process and comparison of total flavonoids contents of different ages and strains of Anoectochilus roxburghii[J]. Science and Technology of Food Industry,2019,40(8):184−189. [18] 刘帅英, 张晓芹, 王慧玉, 等. HPLC同时测定三叶青中5种黄酮类成分的含量[J]. 中国现代应用药学,2018,35(12):1878−1880. [LIU S Y, ZHANG X Q, WANG H Y, et al. Simultaneous determination of five major flavonoids in Tetrastigma hemsleyanum by HPLC[J]. Chinese Journal of Modern Applied Pharmacy,2018,35(12):1878−1880. [19] 李学玲, 许苑南, 龙佳敏, 等. 黄果茄总黄酮的提取工艺优化与体外抗氧化活性研究[J]. 食品研究与开发,2020,41(23):143−149. [LI X L, XU Y N, LONG J M, et al. Study on optimization of extraction process and antioxidant activity of total flavonoids from Solanum xanthocarpum[J]. Food Research and Development,2020,41(23):143−149. [20] 许远, 魏和平, 吴彦, 等. 响应面优化襄荷总黄酮提取及抗氧化研究[J]. 食品工业科技,2015,36(5):233−239. [XU Y, WEI H P, WU Y, et al. Study on optimization of extraction of total flavonoids from Zingiber strioatum by response surface methodologyand its antioxidant activity[J]. Science and Technology of Food Industry,2015,36(5):233−239. [21] 王艳, 彭奇均. PEG/(NH4)2SO4双水相萃取分离茶氨酸的研究[J]. 应用化工,2011,40(7):1186−1191. [WANG Y, PENG Q J. Study on theanine extraction separation by PEG/(NH4)2SO4 aqueous two-phase system[J]. Applied Chemical Industry,2011,40(7):1186−1191. doi: 10.3969/j.issn.1671-3206.2011.07.020 [22] 赵晓莉, 岳红, 张颖, 等. 柿叶黄酮在双水相体系中的分配行为[J]. 林产化学与工业,2006,26(1):183−186. [ZHAO X L, YUE H, ZHANG Y, et al. Partitional behaviors of flavones of persimmon leaves in two-phase aqueous system[J]. Chemistry and Industry of Forest Products,2006,26(1):183−186. [23] 郝倩. 菠萝蜜叶黄酮类化合物的提取及其浸膏的应用[D]. 北京: 北京林业大学, 2014. HAO Q. Study on flavones extracting from Artocarpus heterophyllus Lam. leaves and the use of the flavones[D]. Beijing: Beijing Forestry University, 2014.
[24] 袁园, 张潇, 陈碧琼, 等. 草果总黄酮的提取及DPPH自由基清除活性研究[J]. 食品研究与开发,2017,38(15):63−68. [YUAN Y, ZHANG X, CHEN B Q, et al. Extraction method and DPPH radical scavenging activity of flavonoids from Amomum tsaoko[J]. Food Research and Development,2017,38(15):63−68. doi: 10.3969/j.issn.1005-6521.2017.15.014 [25] 李石容. 金花茶茶花黄酮类化合物的分离纯化及抗氧化活性的初步研究[D]. 湛江: 广东海洋大学, 2012. LI S R. Study on isolation and antioxidation of flavonoids from the flowers of Camellia chrysantha[D]. Zhanjiang: Guangdong Ocean University, 2012.
[26] 王彦兵, 黄家卫, 李国明, 等. 响应面优化鼓槌石斛花总黄酮提取工艺及其体外抗氧化活性[J]. 福建农业学报,2019,34(6):730−738. [WANG Y B, HUANG J W, LI G M, et al. Response surface optimization of flavonoid extraction and in vitro antioxidant activity of extract from Dendrobium chrysotoxum Lindl. flowers[J]. Fujian Journal of Agricultural Sciences,2019,34(6):730−738. -
期刊类型引用(8)
1. 许天月,张俊杰,魏家乐,成永之,段蕊. 叶酸形式、稳定性及天然化叶酸的研究进展. 食品安全质量检测学报. 2024(02): 266-274 .  百度学术
百度学术
2. 毕晨,游清徽. 雷公藤红素-氨基葡萄糖酰胺偶联物的合成及其减毒调脂作用. 中草药. 2024(04): 1158-1166 .  百度学术
百度学术
3. 林伟明,廖红兴,孙剑光,梁传兴,黄略,李惠民,李灏. 氨基葡萄糖联合膝关节腔注射富血小板血浆治疗膝骨关节炎的临床效果. 中国医药. 2024(03): 420-425 .  百度学术
百度学术
4. 但晓梦,刘晓锋,郭江红,姜红. 氨基葡萄糖类药物的来源、结构及其鉴别技术研究. 中国药师. 2024(04): 551-556 .  百度学术
百度学术
5. 吕昊坤,杨腾辉,吴启赐,潘裕添,薛钰. 利用斑马鱼肝癌模型探究氨基葡萄糖盐酸盐对肝癌的影响. 食品工业科技. 2024(20): 332-340 .  本站查看
本站查看
6. 王锴,林剑浩. 氨基葡萄糖治疗骨关节炎的药理作用及其临床应用研究进展. 中华医学杂志. 2024(43): 4005-4010 .  百度学术
百度学术
7. 张倩如,吴启赐,薛钰,林志超,黄家福,吕昊坤,彭伟,潘裕添,林进妹. 杏鲍菇废弃菌渣中D-氨基葡萄糖盐酸盐的制备工艺及生物学活性分析. 食品工业科技. 2023(17): 263-271 .  本站查看
本站查看
8. 殷光玲,贤欢,肖义然,黄远英. 氨糖软骨素钙片安全性毒理学试验研究. 现代食品. 2023(19): 160-164+172 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:



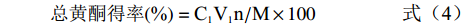
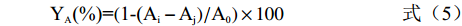

 下载:
下载:



