Optimization of Extraction Process and Composition Identification of Polar Lipids in Milk
-
摘要: 为更好开发利用牛乳中的乳极性脂质,本文采用氯仿-甲醇浸提法对酪乳粉中的极性脂质进行提取研究。以磷脂含量为指标,通过单因素试验对氯仿-甲醇体积比、液料比、提取温度及提取时间四个影响牛乳极性脂质提取的因素参数进行优化,后利用响应面法筛选最优提取条件,并采用薄层层析对所得样品进行了分析鉴定。结果表明,氯仿-甲醇比为2:1(v/v, %)最优的料液比为1:4(v/v, %),提取温度20 ℃,提取时间10 min为极性脂质的最优提取条件,在此条件下测得实际提取磷脂含量为(1.647±0.010)mg/g,且存在磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、神经鞘磷脂等极性脂质。本工艺旨在为乳极性脂质的提取及开发提供研究基础。Abstract: In order to develop and utilize the milk polar lipids, the chloroform-methanol extraction method was used to extract the polar lipids from buttermilk. The phosphorus content as an index, the condition of chloroform-methanol volume ratio, liquid-to-methanol ratio, extraction temperature and time were optimized by single-factor experiment and the analysis of response surface methodology determined the optimum extraction conditions. The obtained samples were analyzed and identified by thin-layer chromatography(TLC). The results indicated that the optimal extraction conditions for polar lipids were: Chloroform-methanol volume ratio 2:1(v/v, %), 1:4(v/v, %) for the ratio of material to liquid, 20 ℃ for extraction temperature, and 10 min for extraction time. The phospholipid contents in the sample under this extracted condition was (1.647±0.010) mg/g, and there were polar lipids such as phosphatidylcholine, phosphatidylethanolamine, phosphatidylserine, and sphingomyelin. This process aims to provide a research basis for the extraction and development of milk polar lipids.
-
极性脂质是所有生物膜中的天然成分,被广泛应用于改善食品的结构和乳化特性,其工业来源主要为大豆和蛋类[1]。研究表明,动物来源的极性脂质中含有丰富的神经鞘磷脂,对细胞代谢和调节有着积极的作用,因此,受到越来越多的关注[2]。然而,由于法律和现实条件的限制,动物源大脑和骨髓的使用相对局限[3],这也进而影响了动物源极性脂质的开发利用。
乳中的极性脂质主要存在于乳脂肪球膜(Milk fat globule membrane,MFGM)上[4-5]。牛乳中含有丰富的MFGM,它是乳中包裹在脂肪球体外部的一层膜[6-7],由极性脂质、膜蛋白、胆固醇等成分构成,其中,乳极性脂质含量约占总乳脂肪含量的1%[8-9]。乳极性脂质主要包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)和神经鞘磷脂(SM)[10]。研究表明,乳极性脂质可以保护肝脏[11],具有促进新生儿肠道成熟和神经生长[12]、改善肠道菌群[13],抗大肠癌等[14]作用。同时由于乳极性脂质特殊的两性分子结构,使其具有一定的功能性应用价值[15-16]。目前,乳极性脂质被广泛应用于化工、食品、医药等领域,如婴幼儿配方奶粉、脂质体等的制备[17]。酪乳和黄油乳清作为乳制品行业的副产物,含有较高的MFGM和较低的甘油三酯[18],同时具有比牛奶更长的贮藏期,因此,更易作为牛乳极性脂质提取的原料[19]。
目前报导的乳极性脂质的提取方式大致可以分为物理提取法和化学提取法[20-21]。物理提取法是利用超临界萃取技术或膜技术进行分离提取,操作简单但价格较昂贵[22]。GASSI等[23]从奶油乳清中经过脱脂、热处理、酸沉淀酪蛋白、再通过透析和超滤法获得极性脂质。化学提取法是通过氯仿、甲醇、乙醚、乙醇等有机溶剂进行提取,氯仿-甲醇作为一种常用的有机溶剂,可以把样品中所有的脂溶性物质完全提取出来,且对中性脂质和极性脂质的提取效率均较高,但步骤较繁琐,耗时较长[22,24]。乳中提取牛乳极性脂质还未建立完善的提取工艺,酪乳粉是乳极性脂质很好的来源。本研究拟建立并优化氯仿-甲醇浸提法从酪乳粉中提取乳极性脂质,采用响应面法对比不同条件下提取样品中磷脂的含量,筛选出最优的提取参数,并通过薄层层析法对提取样品中的极性脂质进行分析与鉴定。该研究旨在于探索适用于酪乳加工业的简单脂质提取方法,一方面可为乳极性脂质的开发提供研究基础,另一方面也可为提升酪乳粉的开发利用价值。
1. 材料与方法
1.1 材料与仪器
酪乳 美国Bob’s Red Mill公司,配料表如表1所示;大豆卵磷脂(纯度>95%) 上海生物工程有限公司;磷脂酰丝氨酸(PS) 标准品,美国Sigma公司;磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、神经鞘磷脂(SM) 标准品,中国食品药品检定研究院;丙酮、氯仿、甲醇、胆固醇、三氯化铁、硫氰酸铵 均为分析纯,国药集团化学试剂有限公司。
表 1 酪乳粉成分Table 1. Ingredient list of buttermilk powder成分 含量(g/100 g) 总脂肪 1.00 饱和脂肪 0.50 反式脂肪 0.00 胆固醇 0.01 钠 0.08 总碳水化合物 8.00 膳食纤维 0.00 糖 6.00 蛋白质 4.00 GL-21M高速冷冻离心机 上海卢湘仪离心机仪器有限公司;V5100型可见分光光度计 上海元析仪器有限公司;RE52CS-1旋转蒸发仪 上海亚荣有限公司;ZNCL-GS型智能磁力搅拌器 上海越众仪器设备有限公司;IS128C型实验室pH计 上海仪迈仪器科技有限公司。
1.2 实验方法
1.2.1 乳极性脂质的提取
参考王然然等[25]的方法并做修改。称取1.5 g酪乳粉配制成质量浓度为10%(m/v)的溶液,置于40 ℃水浴锅中搅拌至全部溶解。使用滴管缓慢滴加3 mol/L乳酸溶液调整pH至4.6,用高速离心机以8000 r/min离心30 min,收集上清液于烧杯中,备用。向烧杯中加入6 mL一定体积比的氯仿-甲醇混合液,然后用磁力搅拌器在不同温度下搅拌一定时间,将混合溶液以8000 r/min离心20 min,收集下层有机相,上层水相继续加入氯仿-甲醇混合液重复上述步骤两次。将收集的下层有机相过滤后用蒸发浓缩至粘稠状,随后转移至小烧杯中,氮气吹干。最后在小烧杯中加入丙酮,搅拌后,过滤收集沉淀,氮气吹干,置于−20 ℃冰箱保存备用。
1.2.2 乳极性脂质提取条件单因素实验及响应面优化
1.2.2.1 单因素实验
称取1.5 g酪乳粉,控制转子转速为300 r/min,以磷脂含量为指标,分别对氯仿-甲醇体积比、料液比、提取温度、提取时间4个因素进行单因素实验,确定各因素对提取样品磷脂含量的影响。实验基本条件为:氯仿-甲醇体积比为2:1,料液比为1:4,提取温度为25 ℃,提取时间为5 min。分别考察氯仿-甲醇体积比(v/v, %)(3:1、5:2、2:1、1:1、2:3);酪乳粉酸沉后的上清液和有机试剂总体积之比即料液比(v/v, %)(1:1、1:2、1:3、1:4、1:5);提取温度(10、20、30、40、50 ℃);提取时间(1、3、5、10、15 min)各因素对提取样品磷脂含量的影响。
1.2.2.2 响应面试验
根据Box-Behnken设计原理,分别选取氯仿-甲醇比(A)、料液比(B)、提取温度(C)、提取时间(D)4个单因素最佳值及其前后相邻值作为试验因素,并选取磷脂含量为响应值,进行响应面优化设计,得到磷脂提取最优条件。试验设计因素与水平见表2,采用Design-Expert 11软件进行数据分析。
表 2 响应面因素水平编码Table 2. Factors and levels of response surface text因素 水平 −1 0 1 A氯仿-甲醇比(v/v, %) 1:1 2:1 3:1 B料液比(v/v, %) 1:3 1:4 1:5 C提取温度(℃) 10 20 30 D提取时间(min) 5 10 15 1.2.3 乳极性脂质含量的测定
乳极性脂质的主要成分为甘油磷脂类,所以采用磷脂测定法测定乳极性脂质的含量。参考龚金炎等[26]的方法并做修改。使用氯仿配制0.2 mg/mL的大豆磷脂标准溶液,分别取0.2、0.4、0.8、1.2、1.6、2.0 mL大豆磷脂标准溶液于具塞离心管中,加氯仿至4 mL,加硫氰亚铁铵显色剂4 mL,振荡混匀1 min,300 r/min离心10 min,取下层。以氯仿为空白,在485 nm处测定吸光值A,以A对浓度C(mg/mL)进行线性回归,绘制大豆磷脂标准曲线,得到回归方程y=5.0883x−0.0011(R2=0.9989)。
随后用氯仿配制1 mg/mL极性脂质样品,按上述方法测定,将测定OD值带入标准曲线计算磷脂浓度C,根据以下公式计算磷脂含量:
式中:V测为测样体积; M测为测样质量; M提取为提取样品质量; M总为酪乳粉总质量。
1.2.4 乳极性脂质的鉴定
使用薄层层析法对乳极性脂质进行鉴定[27]。以氯仿为溶剂,将提取的乳极性脂质样品和PC、PE、PI、PS、SM标准品配制成1 mg/mL的溶液。分别用毛细管吸取半管极性脂质样品和标准品点样在硅胶板下端1 cm左右,点样2~3次,迅速吹干。将点完样的硅胶板立式放入装有展开剂(氯仿-甲醇-水-氨水比例为3:2:0.3:0.1,v/v/v/v)的层析缸中。至展开剂到达硅胶板上端1 cm处拿出硅胶板,吹干后置于碘缸中显色,根据以下公式计算迁移率Rf:
(1) 式中:a为展开后斑点中心到原点之间的距离,mm;b为原点到溶剂前沿的距离,mm。
1.3 数据处理
所有的实验重复3次,实验数据采用SPSS软件进行统计学分析,单因素方差分析检验组件的显著性差异,数据用
2. 结果与分析
2.1 极性脂质提取条件优化
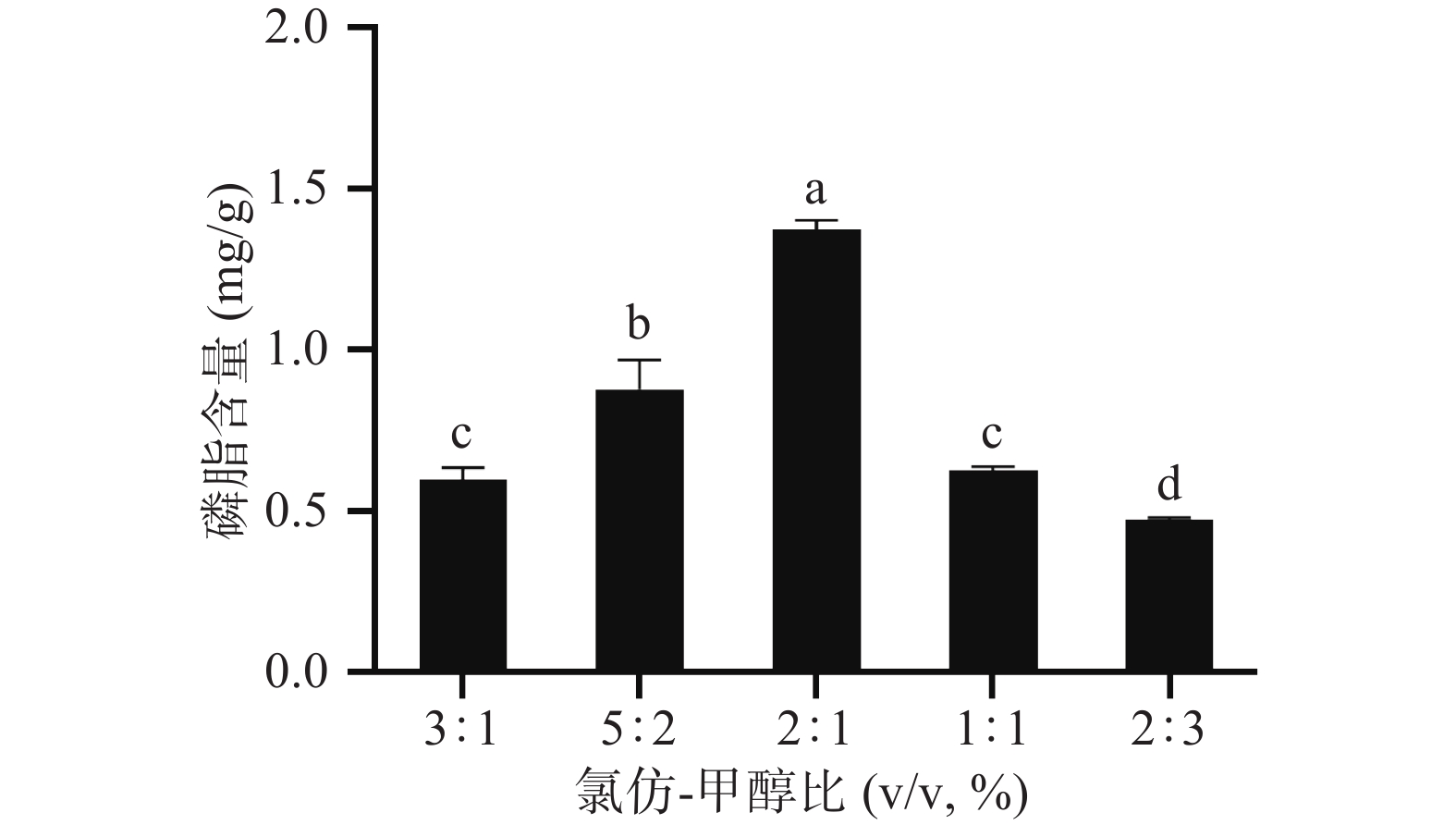
2.1.1 氯仿-甲醇比对极性脂质提取的影响
由图1可看出,在3:1~2:1范围内,磷脂含量随氯仿-甲醇体积比的减小而增加,在2:1~2:3范围内,磷脂含量随着氯仿-甲醇体积比的减小而减小。当氯仿-甲醇体积比为2:1时,磷脂的含量达到最大值,此时磷脂含量为(1.372±0.035)mg/g。
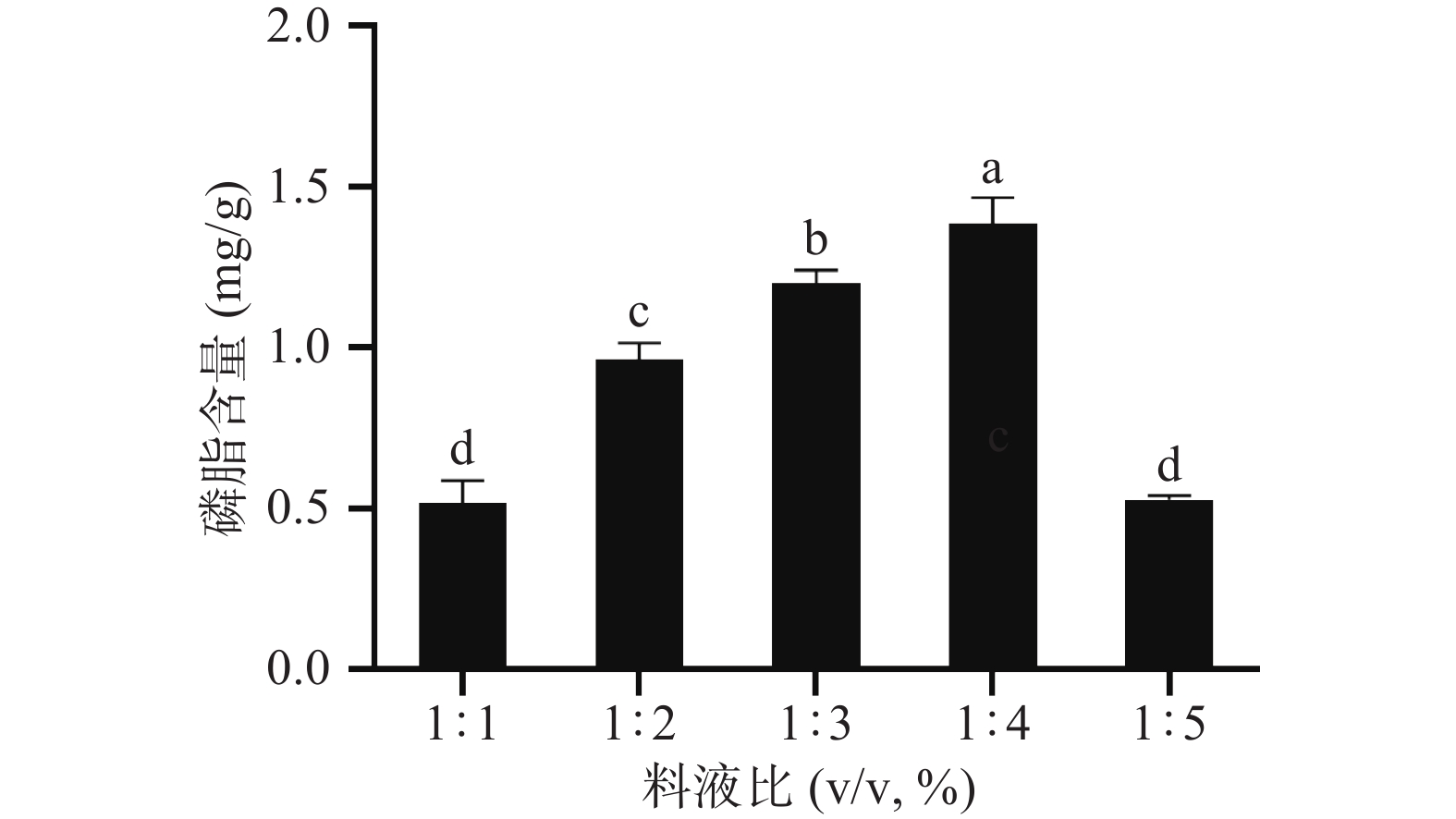
2.1.2 料液比对极性脂质提取的影响
图2为原料酪乳粉与有机溶剂的质量比即料液比对磷脂含量的影响,随着有机溶剂用量的增多,所得磷脂含量也增加,说明有机溶剂用量越多溶解的磷脂越多,提取率越高;但当料液比达到1:4之后,磷脂含量又有所下降。随着料液比增加,不仅总体积增大;而且当料液比达到一定值时,磷脂的溶解达到了饱和状态,增加有机溶剂用量使物料中的非磷脂成分融入溶剂中,影响提取的磷脂含量。陈康等[28]提取南极磷虾磷脂时也发现增加有溶剂用量到一定值后磷脂提取量不会增加。所以从节约材料的角度考虑,最优料液比为1:4。
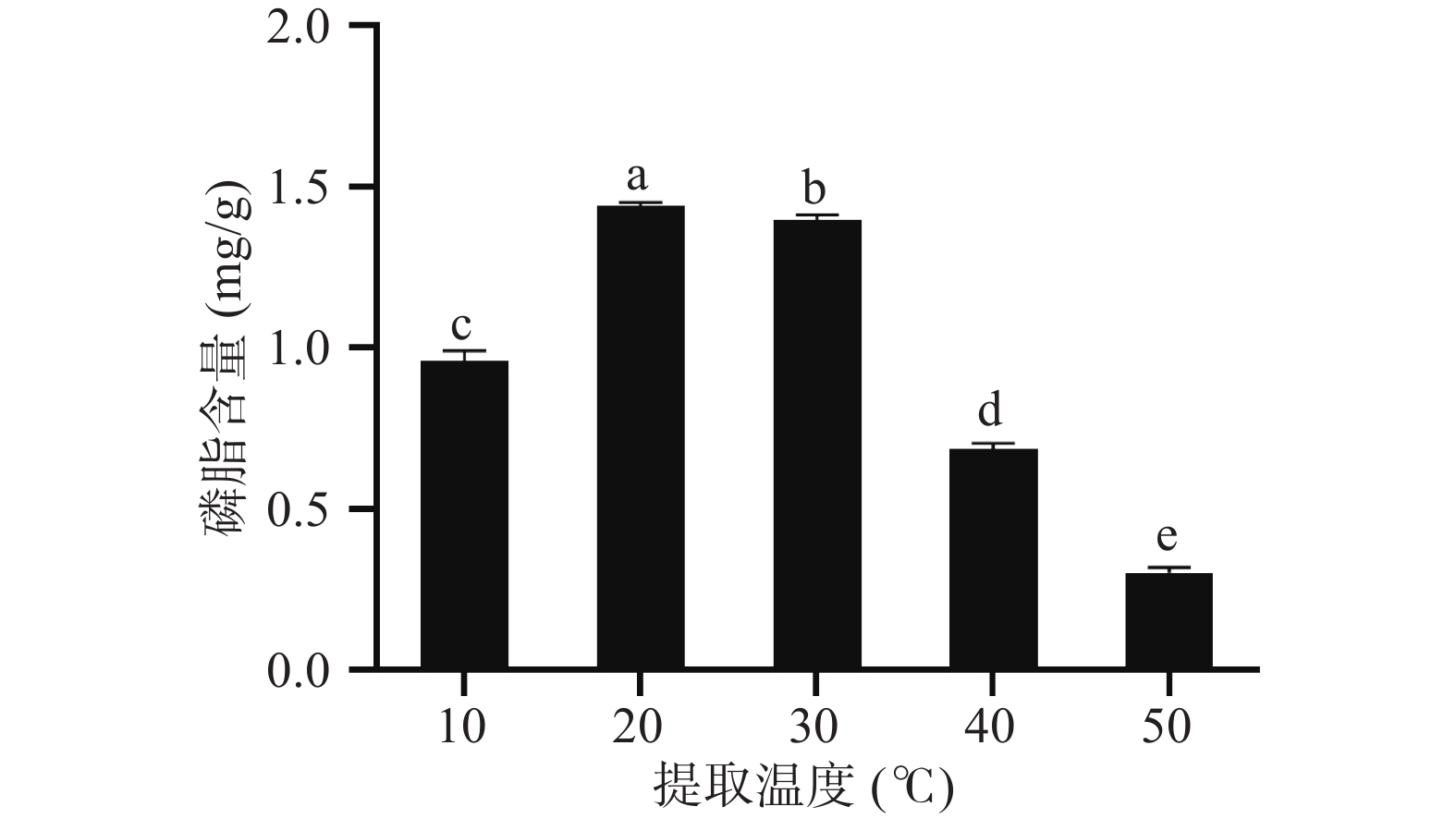
2.1.3 温度对极性脂质提取的影响
由图3可知,提取温度对磷脂含量有很大的影响,在10~50 ℃的范围内,磷脂含量随着温度的升高先增加后降低,在20 ℃时,磷脂的含量达到最高(1.440±0.008)mg/g,与其他组的差异显著(P<0.05),在20~50 ℃范围内,磷脂含量开始减少。酪乳中含有丰富的酪蛋白,并且磷脂主要存在于MFGM上,过高的温度会导致蛋白质热变性,影响磷脂溶出,同时磷脂在高温下易发生氧化作用而被破坏,且温度升高加快了有机试剂的挥发[29]。因此,最佳提取温度选择20 ℃。
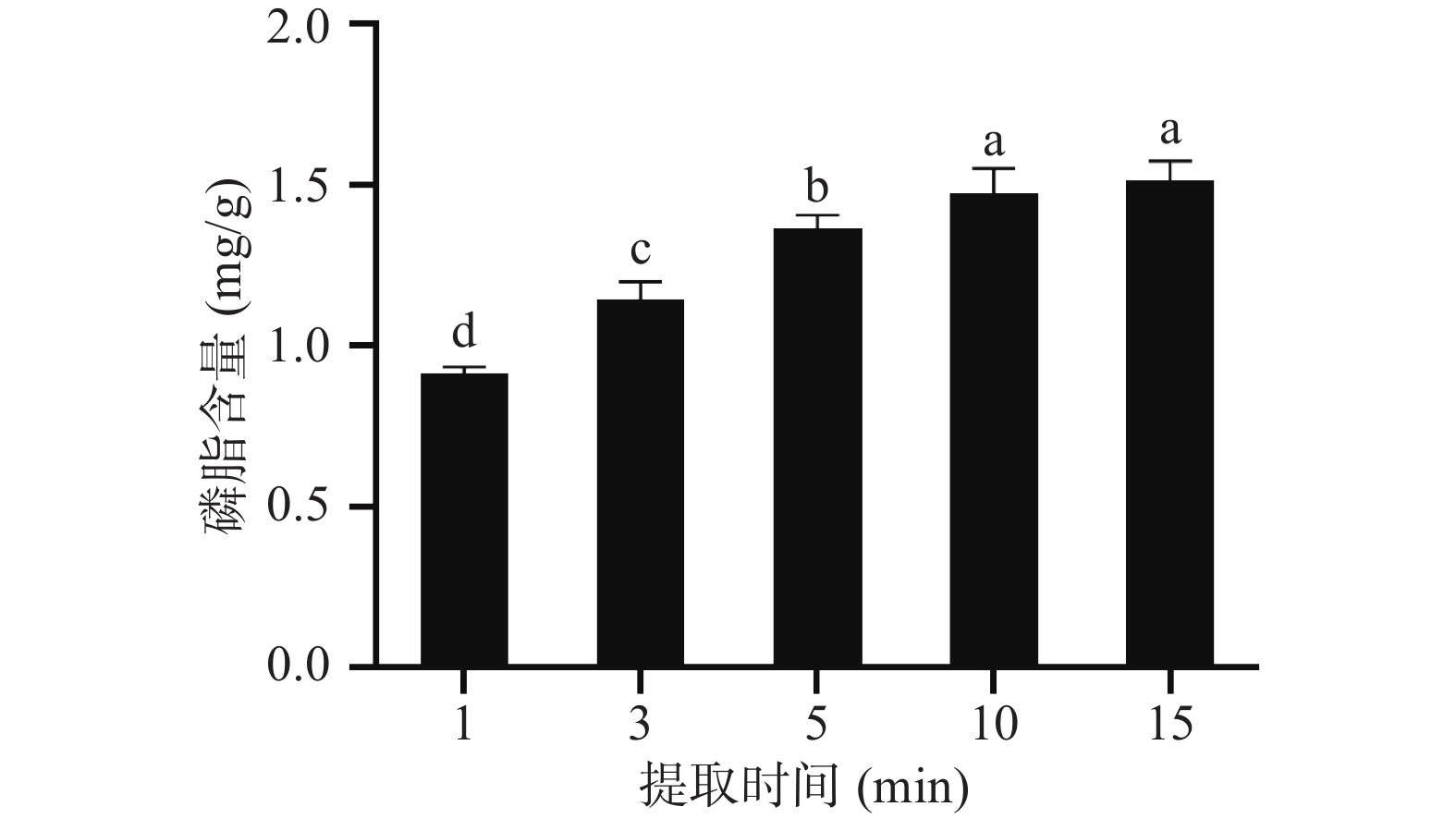
2.1.4 提取时间对极性脂质提取的影响
由图4所示,在1~10 min范围内,磷脂含量随着时间的增加而升高,此后,磷脂含量随提取时间的变化不存在显著性差异(P>0.05)。在固液萃取过程中,磷脂向有机相中扩散需要一定的时间,所以随着时间的增加,样品中磷脂含量会增加,提取率也会随之升高。实验结果表明,当提取时间达到10 min时,磷脂基本已全部扩散至有机相中,此时提取样品中磷脂含量达到最大值(1.474±0.065)mg/g。因此本研究选择提取时间10 min为最佳提取时间。
2.2 响应面试验结果分析
2.2.1 响应面试验设计因素与水平
为了得到牛乳极性脂质提取工艺的最适参数,根据上述单因素实验得到的较优提取参数,采用响应面法对氯仿-甲醇比、料液比、提取温度、提取时间四个因素影响进行响应面试验设计。通过单因素实验确定从酪乳粉中提取极性脂质的四个单因素参数适宜范围,选取样品中磷脂含量为考察指标进行响应面优化。结果见表3。
表 3 Box-Behnken实验设计及结果Table 3. Design and result of Box-Behnken experient试验号 A氯仿-甲醇比 B料液比 C提取温度 D提取时间 Y磷脂含量(mg/g) 1 0 1 1 0 0.5544 2 1 1 0 0 0.0080 3 1 0 1 0 0.5680 4 1 0 0 −1 0.5827 5 1 0 −1 0 0.2115 6 0 −1 0 1 1.3679 7 0 1 0 −1 0.5077 8 0 0 −1 1 1.0477 9 0 0 0 0 1.7078 10 1 0 0 1 0.7380 11 1 − 1 0 0 0.5340 12 0 0 0 0 1.6665 13 −1 −1 0 0 0.6014 14 0 0 0 0 1.7539 15 −1 0 0 −1 0.7149 16 0 −1 0 −1 1.1347 17 0 0 −1 −1 0.8611 18 −1 0 0 1 0.8747 19 −1 1 0 0 0.0008 20 −1 0 1 0 0.7814 21 0 0 0 0 1.7405 22 0 1 −1 0 0.1812 23 0 0 1 −1 1.5285 24 0 −1 −1 0 0.5458 25 0 1 0 1 0.6756 26 0 −1 1 0 1.1875 27 0 0 1 1 1.4675 28 −1 0 −1 0 0.3489 29 0 0 0 0 1.6679 2.2.2 响应面回归模型的建立与分析
利用软件Design-Expert 11软件对表3试验数据进行非线性多元回归拟合,得到回归模型为:
Y=1.707−0.057A−0.29B+0.24C+0.07D+0.019AB−0.019AC−1.125×10−3AD−0.07BC−0.016BD−0.062CD− 0.82A2−0.65B2−0.40C2−0.13D2
由表4可知,本实验选用的二次多项式模型差异极显著(P<0.01),失拟项差异不显著(P>0.05),说明方程可靠,此模型的拟合度好,可通过此响应面模型来确定最佳提取工艺条件。A、B、C、D及A2、B2、C2、D2对Y具有显著影响(P<0.05)。同时显著性检验显示回归模型的R2为0.9900,调整后的R2为0.9800,残差的平方和为0.0821,纯误差的平方和仅为0.0065,进一步说明该模型的拟合效果好。
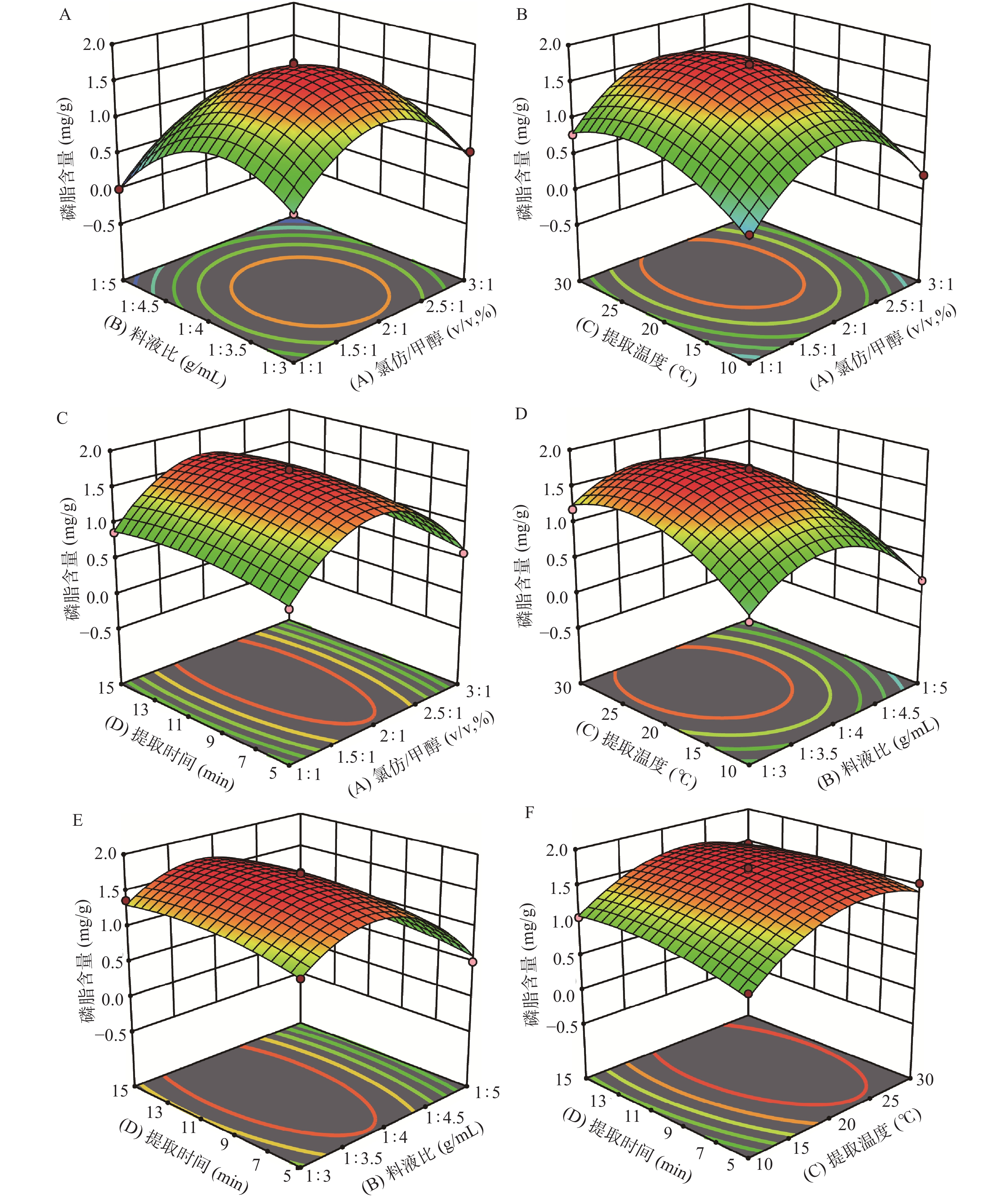
表 4 回归方程模型的方差分析及系数的显著性检验Table 4. ANOVA for regression equation model and significance test of the coefficient来源 平方和 自由度 均方和 F值 P值 显著性 模型 8.13 14 0.5805 99.05 <0.0001 ** A 0.0385 1 0.0385 6.57 0.0225 * B 0.9882 1 0.9882 168.60 <0.0001 ** C 0.6965 1 0.6965 118.84 <0.0001 ** D 0.0591 1 0.0591 10.08 0.0068 ** AB 1.4×10−3 1 1.4×10−3 0.2374 0.6336 AC 1.4×10−3 1 1.4×10−3 0.2464 0.6273 AD 5.062×10−6 1 5.062×10−6 0.0009 0.9770 BC 0.0180 1 0.0180 3.08 0.1014 BD 1.1×10−3 1 1.1×10−3 0.1819 0.6762 CD 0.0153 1 0.0153 2.61 0.1282 A2 4.33 1 4.33 739.53 <0.0001 ** B2 2.75 1 2.75 468.47 <0.0001 ** C2 1.05 1 1.05 179.34 <0.0001 ** D2 0.1019 1 0.1019 17.39 0.0009 ** 残差 0.0821 14 0.0059 失拟项 0.0756 10 0.0076 4.66 0.0758 不显著 纯误差 0.0065 4 0.0016 合计 8.21 28 SD=0.0766 R2=0.9900 R2Adj=0.9800 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05。 图5为任意两个因素的交互作用对磷脂含量的影响,结合表4结果,交互项AB、AC、AD、BC、BD、CD对试验结果的显著性分析均为P>0.05,表明氯仿-甲醇比、料液比、提取温度和提取时间这4个因素的两两交互作用不显著。上述回归模型的最佳值存在响应面最高点,等高线图的圆心,即提取磷脂含量最大时的稳定点,与之对应的因素水平即为最佳工艺条件。
运用Design Expert 11软件分析得最优乳极性脂质提取工艺条件为:酪乳粉1.5 g,氯仿体积4 mL,甲醇体积2 mL,料液比为1:4,磁力搅拌器提取温度20 ℃,转速300 r/min,提取时间10 min。在此条件下进行,进行3次磷脂提取实验,测得实际提取磷脂含量为(1.647±0.010)mg/g。同时,实际提取量与模型所预测的1.707 mg/g理论值误差在3.64%之内,说明所得结果可靠。
2.3 薄层层析定性分析
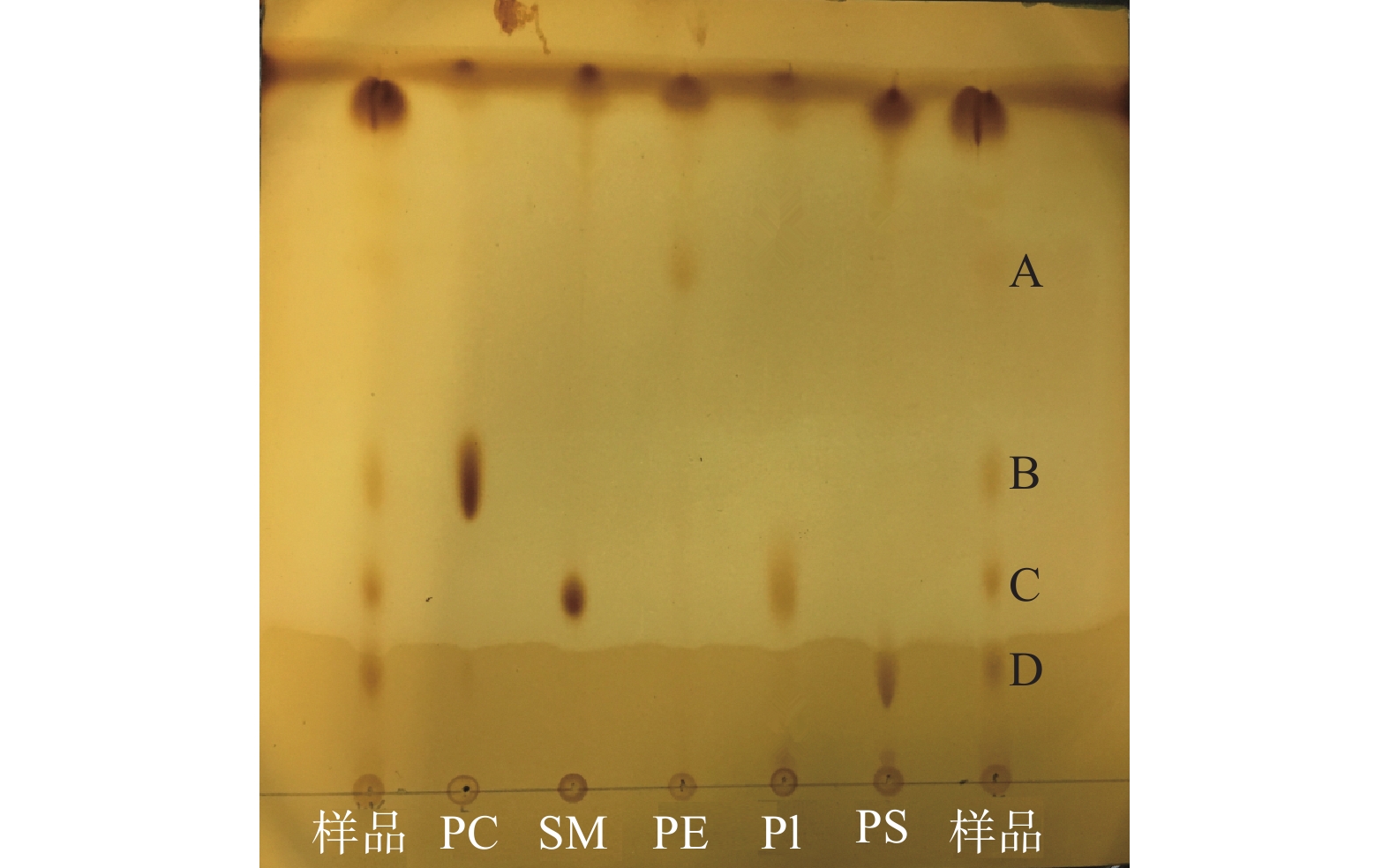
通过薄层层析,鉴定出的乳极性脂质主要有5种,为磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)和神经鞘磷脂(SM)。从图6中可以看出,样品中各组分展开效果好,无拖尾现象,区分度好。其中PC、SM、PE、PI、PS五种标准物质仅有一个斑点,样品中有四个斑点,标注为A、B、C、D。五种标准物质和样品的各色斑的Rf值测算结果如表5所示:样品中A、B、C、D点的Rf值分别为0.74、0.45、0.30、0.15,标准品PE的Rf值为0.73,PC的Rf值为0.44,PI和SM的Rf值均为0.29,未区分开,PS的Rf值为0.14。因此可初步定性推断出A点物质为PE,B点物质为PC,C点物质为PI或SM,D点物质为PS。由此可得,从酪乳粉中提取的极性脂质,至少含有磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)等。
表 5 薄层层析各色斑的Rf值测算结果Table 5. The Rf values of each components类别 a b Rf(迁移率) PC 31.0 70.0 0.44 SM 20.0 69.8 0.29 PE 51.0 69.5 0.73 PI 20.0 69.3 0.29 PS 10.0 69.0 0.14 物质A 51.0 68.8 0.74 物质B 31.5 68.8 0.45 物质 C 20.3 68.8 0.30 物质 D 10.5 68.8 0.15 3. 结论
本实验建立了从酪乳粉中提取乳极性脂质的方法,通过单因素试验和响应面分析对提取工艺进行优化,得到了从酪乳粉中提取乳极性脂质的最优条件:氯仿-甲醇比为2:1,料液比1:4,提取温度和时间分别为20 ℃和10 min,磁力搅拌器最佳提取温度为20 ℃,转速为300 r/min,在此条件下进行乳极性脂质提取实验,提取样品的磷脂含量可达到(1.647±0.010)mg/g。该提取工艺磷脂提取率较高,提取速度快,工艺流程简单,易于规模化生产。此外,通过薄层层析法分析,可以确定提取样品中有磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、神经鞘磷脂等极性脂质的存在。该提取工艺安全性高,适用于食品工业生产,很好地增加了酪乳粉的附加利用值,并为乳极性脂质的提取提供了研究基础。
-
表 1 酪乳粉成分
Table 1 Ingredient list of buttermilk powder
成分 含量(g/100 g) 总脂肪 1.00 饱和脂肪 0.50 反式脂肪 0.00 胆固醇 0.01 钠 0.08 总碳水化合物 8.00 膳食纤维 0.00 糖 6.00 蛋白质 4.00 表 2 响应面因素水平编码
Table 2 Factors and levels of response surface text
因素 水平 −1 0 1 A氯仿-甲醇比(v/v, %) 1:1 2:1 3:1 B料液比(v/v, %) 1:3 1:4 1:5 C提取温度(℃) 10 20 30 D提取时间(min) 5 10 15 表 3 Box-Behnken实验设计及结果
Table 3 Design and result of Box-Behnken experient
试验号 A氯仿-甲醇比 B料液比 C提取温度 D提取时间 Y磷脂含量(mg/g) 1 0 1 1 0 0.5544 2 1 1 0 0 0.0080 3 1 0 1 0 0.5680 4 1 0 0 −1 0.5827 5 1 0 −1 0 0.2115 6 0 −1 0 1 1.3679 7 0 1 0 −1 0.5077 8 0 0 −1 1 1.0477 9 0 0 0 0 1.7078 10 1 0 0 1 0.7380 11 1 − 1 0 0 0.5340 12 0 0 0 0 1.6665 13 −1 −1 0 0 0.6014 14 0 0 0 0 1.7539 15 −1 0 0 −1 0.7149 16 0 −1 0 −1 1.1347 17 0 0 −1 −1 0.8611 18 −1 0 0 1 0.8747 19 −1 1 0 0 0.0008 20 −1 0 1 0 0.7814 21 0 0 0 0 1.7405 22 0 1 −1 0 0.1812 23 0 0 1 −1 1.5285 24 0 −1 −1 0 0.5458 25 0 1 0 1 0.6756 26 0 −1 1 0 1.1875 27 0 0 1 1 1.4675 28 −1 0 −1 0 0.3489 29 0 0 0 0 1.6679 表 4 回归方程模型的方差分析及系数的显著性检验
Table 4 ANOVA for regression equation model and significance test of the coefficient
来源 平方和 自由度 均方和 F值 P值 显著性 模型 8.13 14 0.5805 99.05 <0.0001 ** A 0.0385 1 0.0385 6.57 0.0225 * B 0.9882 1 0.9882 168.60 <0.0001 ** C 0.6965 1 0.6965 118.84 <0.0001 ** D 0.0591 1 0.0591 10.08 0.0068 ** AB 1.4×10−3 1 1.4×10−3 0.2374 0.6336 AC 1.4×10−3 1 1.4×10−3 0.2464 0.6273 AD 5.062×10−6 1 5.062×10−6 0.0009 0.9770 BC 0.0180 1 0.0180 3.08 0.1014 BD 1.1×10−3 1 1.1×10−3 0.1819 0.6762 CD 0.0153 1 0.0153 2.61 0.1282 A2 4.33 1 4.33 739.53 <0.0001 ** B2 2.75 1 2.75 468.47 <0.0001 ** C2 1.05 1 1.05 179.34 <0.0001 ** D2 0.1019 1 0.1019 17.39 0.0009 ** 残差 0.0821 14 0.0059 失拟项 0.0756 10 0.0076 4.66 0.0758 不显著 纯误差 0.0065 4 0.0016 合计 8.21 28 SD=0.0766 R2=0.9900 R2Adj=0.9800 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05。 表 5 薄层层析各色斑的Rf值测算结果
Table 5 The Rf values of each components
类别 a b Rf(迁移率) PC 31.0 70.0 0.44 SM 20.0 69.8 0.29 PE 51.0 69.5 0.73 PI 20.0 69.3 0.29 PS 10.0 69.0 0.14 物质A 51.0 68.8 0.74 物质B 31.5 68.8 0.45 物质 C 20.3 68.8 0.30 物质 D 10.5 68.8 0.15 -
[1] BURLING H, GRAVERHOLT G. Milk-a new source for bioactive phospholipids for use in food formulations[J]. Lipid Technology,2008,20(10):229−231. doi: 10.1002/lite.200800058
[2] 薛山. 动物源肌内磷脂及其脂肪酸含量、组成与生理功效研究进展[J]. 肉类研究,2016,30(9):40−44. [XUE Shan. A review of the current knowledge of fatty acid contents, composition and physiological functions of animal-derived intramuscular phospholipids[J]. Meat Research,2016,30(9):40−44. [3] ITALY E. Scientific opinion on the revision of the quantitative risk assessment (QRA) of the BSE risk posed by processed animal proteins (PAPs)[J]. EFSA Journal,2011,9(1):1947−1963. doi: 10.2903/j.efsa.2011.1947
[4] 姚磊. 乳脂球膜蛋白的研究与应用进展[J]. 中国食品添加剂,2020,31(12):117−121. [YAO Lei. The research of milk fat globule membrane protein and its development[J]. China Food Additives,2020,31(12):117−121. [5] 乔发东. 乳脂肪球膜的组成与应用研究进展[J]. 中国乳品工业,2011,39(11):35−38. [QIAO Fadong. Research development of composition and application of milk fat globule membrane[J]. China Dairy Industry,2011,39(11):35−38. doi: 10.3969/j.issn.1001-2230.2011.11.010 [6] PATTON S, KEENAN T W. The milk fat globule membrane[J]. BBA - Reviews on Biomembranes,1975,415(3):273−309.
[7] 张雪, 杨洁, 韦伟, 等. 乳脂肪球膜的组成, 营养及制备研究进展[J]. 食品科学,2019,40(1):292−302. [ZHANG Xue, YANG Jie, WEI wei, el at. Recent advances in composition, nutrition and preparation of milk fat globule membrane[J]. Food Science,2019,40(1):292−302. doi: 10.7506/spkx1002-6630-20170829-337 [8] JENSEN R G. The composition of bovine milk lipids: January 1995 to december 2000[J]. Journal of Dairy Science,2002,85(2):295−350. doi: 10.3168/jds.S0022-0302(02)74079-4
[9] 张瑞明, 刘梦霞, 王祎, 等. 不同均质工艺处理对巴氏杀菌乳脂肪球膜蛋白质组成的影响[J]. 食品科学,2019,40(17):156−161. [ZHANG Ruiming, LIU Mengxia, WANG Yi, et al. Effects of different homogenization processes on fat globule membrane protein composition of pasteunized milk[J]. Food Science,2019,40(17):156−161. doi: 10.7506/spkx1002-6630-20180927-306 [10] ZHOU A L, WARD R E. Milk polar lipids modulate lipid metabolism, gut permeability, and systemic inflammation in high-fat-fed C57BL/6J ob/ob mice, a model of severe obesity[J]. Journal of Dairy Science,2019,102(6):4816−4831. doi: 10.3168/jds.2018-15949
[11] NORRIS G H, PORTER C M, JIANG C, et al. Dietary sphingomyelin attenuates hepatic steatosis and adipose tissue inflammation in high-fat-diet-induced obese mice[J]. Journal of Nutritional Biochemistry,2017,40:36−43. doi: 10.1016/j.jnutbio.2016.09.017
[12] YANG Y, ZHANG T, ZHOU G, et al. Prevention of necrotizing enterocolitis through milk polar lipids reducing intestinal epithelial apoptosis[J]. Journal of Agricultural and Food Chemistry,2020,68(26):7014−7023. doi: 10.1021/acs.jafc.0c02629
[13] NEJRUP R G, LICHT T R, HELLGREN L I. Fatty acid composition and phospholipid types used in infant formulas modifies the establishment of human gut bacteria in germ-free mice[J]. Scientific Reports,2017,7(1):3975−3991. doi: 10.1038/s41598-017-04298-0
[14] LI T, DU M, WANG H, et al. Milk fat globule membrane and its component phosphatidylcholine induce adipose browning both in vivo andin vitro[J]. The Journal of Nutritional Biochemistry,2020,81:108372−87. doi: 10.1016/j.jnutbio.2020.108372
[15] 何胜华, 李海梅, 马莺. 乳脂肪球膜(MFGM)的组成及生理特性[J]. 中国乳品工业,2009(4):38−41. [HE Shenghua, LI Haimei, MA Ying. Composition and physiological characteristics of milk fat globule membrane[J]. China Dairy Industry,2009(4):38−41. doi: 10.3969/j.issn.1001-2230.2009.04.011 [16] TANG H, HE S, PENG F, et al. The effects of milk fat globule membrane and its individual components on dough properties and bread quality[J]. RSC Advances,2016,6(104):102617−102625. doi: 10.1039/C6RA21611K
[17] ZHANG T, SU M, LIU M, et al. Optimization of encapsulation using milk polar lipid liposomes with s-layer protein and transport study of the ace-inhibitory peptide RLSFNP[J]. Journal of Agricultural and Food Chemistry,2021,69(25):7049−7056. doi: 10.1021/acs.jafc.1c02216
[18] HOLZMÜLLER W, KULOZIK U. Isolation of milk fat globule membrane (MFGM) material by coagulation and diafiltration of buttermilk[J]. International Dairy Journal,2016,63:88−91. doi: 10.1016/j.idairyj.2016.08.002
[19] 郭宇星, 潘道东, 王彤文, 等. 一种乳极性脂质的提取方法及其应用: 中国, 201810047792.6[P]. 2018-01-18. GUO Yuxing, PAN Daodong, WANG Tongwen, et al. A method for extracting milk polar lipids and its application: China, 201810047792.6[P]. 2018-01-18.
[20] ROESCH R, RINCON A, CORREDIG M. Emulsifying properties of fractions prepared from commercial buttermilk by microfiltration[J]. Journal of Dairy Science,2004,87(12):4080−4087. doi: 10.3168/jds.S0022-0302(04)73550-X
[21] CORREDIG M, ROESCH R, DALGLEISH D. Production of a novel ingredient from buttermilk[J]. Journal of Dairy Science,2003,86(9):2744−2750. doi: 10.3168/jds.S0022-0302(03)73870-3
[22] 曹文慧, 高增丽, 乌云, 等. 乳脂肪球膜组成及分离提取技术研究进展[J]. 乳业科学与技术,2020,43(5):37−42. [CAO Wenhui, GAO Zengli, WU Yun, et al. A review of recent studies on milk fat globule membrane: Composition and separation techniques[J]. Journal of Dairy Science and Technology,2020,43(5):37−42. [23] GASSI J Y, BLOT M, BEAUCHER E, et al. Preparation and characterisation of a milk polar lipids enriched ingredient from fresh industrial liquid butter serum: Combination of physico-chemical modifications and technological treatments[J]. International Dairy Journal,2016,52:26−34. doi: 10.1016/j.idairyj.2015.08.012
[24] SHEN Q, CHEUNG H Y. TiO2/SiO2 core-shell composite-based sample preparation method for selective extraction of phospholipids from shrimp waste followed by hydrophilic interaction chromatography coupled with quadrupole time-of-flight/mass spectrometry analysis[J]. Journal of Agricultural and Food Chemistry,2014,62(36):8944−8951. doi: 10.1021/jf503040p
[25] 王然然, 王琦, 王学东, 等. 鲢鱼头磷脂的提取工艺优化及乳化性能研究[J]. 中国油脂,2020,350(4):109−115. [WANG Ranran, WANG Qi, WANG Xuedong, et al. Preparation process optimization and emulsification properties of phospholipids from silver carp head[J]. China Oils and Fats,2020,350(4):109−115. doi: 10.12166/j.zgyz.1003-7969/2020.04.022 [26] 龚金炎, 靳羽晓, 王静静, 等. 硫氰亚铁铵比色法测定蛋黄卵磷脂中总磷脂含量[J]. 食品工业,2018,39(8):319−322. [GONG Jinyan, JIN Yuxiao, WANG Jingjing, et al. Determination of total phospholipids in egg yolk lecithin by thiocyanuric ammonium spectrophotometry[J]. The Food Industry,2018,39(8):319−322. [27] 古再丽努尔·阿尔肯, 刘然, 侯俊峰, 等. 基于高效薄层色谱法的胡麻卵磷脂质量分析[J]. 食品科学,2014,16:160−164. [GUZAILINUER AERKEN, LIU Ran, HOU Junfeng, et al. Quality analysis of flax lecithin based on high performance thin layer chromatography[J]. Food Science,2014,16:160−164. doi: 10.7506/spkx1002-6630-201417031 [28] 陈康, 戴志远, 沈清, 等. 响应面法提取南极磷虾磷脂及其分子种组成的测定[J]. 南方水产科学,2017,13(3):104−112. [CHEN Kang, DAI Zhiyuan, SHEN Qing, et al. Extraction of phospholipid from Euphausia superba by response surface method and determination of phospholipid molecular species[J]. South China Fisheries Science,2017,13(3):104−112. doi: 10.3969/j.issn.2095-0780.2017.03.014 [29] 俞喜娜、陈康、张燕平, 等. 酶辅助提取南极磷虾磷脂及脂质组学研究[J]. 中国食品学报,2020,20(11):103−112. [YU Xina, CHEN Kang, ZHANG Yanping, et al. Enzyme-assisted extraction of phospholipids from antarctic krill and it's lipidomics[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(11):103−112. -
期刊类型引用(2)
1. 宋露露,李云飞,刘鑫源,徐睿绮,郑郭芳,秦楠. 阿胶中驴血清白蛋白的提取纯化、功能特性及抗氧化活性分析. 食品工业科技. 2024(23): 179-188 .  本站查看
本站查看
2. 刘贵涛,权煜,饶欢,赵丹丹,赵霞,郝建雄,刘学强. 亚麻籽粕蛋白多肽的制备及其抗氧化性. 食品研究与开发. 2024(24): 84-91 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:



 下载:
下载:



