Study on Total Plate Count Detection in Beverage by 3M PetrifilmTM Rapid Aerobic Count Plate
-
摘要: 使用3M PetrifilmTM快速测试片法(3M测试法)和滤膜法对饮料中的菌落总数进行定量测定,分析两种方法的一致性程度。选用大肠埃希氏菌、金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌、Asia Siamensis、白色念珠菌和黑曲霉七种菌,对饮料样本进行人工接种并测试。实验结果显示,对于不同菌株及不同污染水平的测试,3M测试法和滤膜法的线性拟合度较好(决定系数R2均>0.95)。且3M测试片法结果回收率均>70%,RSD值(2.9%~34.3%)也均在2020《中国药典》的规定范围内,说明3M测试片法的准确度及精密度较好。对于细菌、真菌分别污染的专属性检验和不同批次的3M测试片的重复性测试中,3M测试片法的回收率>70%,且RSD值(3.6%~34.3%)均在可接受范围之内,表现出良好的专属性和重现性。使用相对正确度和精度剖面分析方法对3M测试片法和滤膜法的结果进行分析,结果显示两种方法具有较好的一致性和等效性。综合以上分析结果,3M测试片法可等效于滤膜法,进行饮料中的菌落总数测定。
-
关键词:
- 饮料 /
- 3M快速菌落总数测试片法 /
- 滤膜法 /
- 菌落总数 /
- 方法确认
Abstract: The 3M PetriFilmTM rapid aerobic count plate method (3M test plate method) and filter membrane method were used to quantitatively determine the total number of bacterial colonies in the beverage, and the consistency of the two methods was analyzed. Seven kinds of bacteria including Escherichia coli, Staphylococcus aureus, Paenibacillus ehimensis, Bacillus subtilis, Asia Siamensis, Candida albicans and Aspergillus niger were used to artificially inoculate and test the beverage samples. The experimental results showed that for different strains and different pollution levels, the linear fitting degree of 3M test plate method and filter membrane method was better (determination coefficient R2>0.95). And the recovery rate of 3M test plate method was more than 70%, and the RSD values (2.9%~34.3%) were within the prescribed range of Pharmacopoeia of the People's Republic of China 2020, indicating that 3M test plate method had better accuracy and precision. For the specificity test of bacterial and fungal contamination and the repeatability test of different batches of 3M test plates, the recovery rate of 3M test plate method was more than 70%, and the RSD values (3.6%~34.3%) were within the acceptable range, showing good specificity and repeatability. The results of 3M test plate method and filter membrane method were analyzed by using relatively trueness and accuracy profileanalysis method. The results showed that the two methods had good consistency and equivalence. Based on the above analysis results, 3M test plate method is equivalent to filter membrane method to determine the total number of colonies in beverages. -
菌落总数是食品卫生检查中的重要指标,代表着食品受污染的程度[1]。在饮料的质量控制中,菌落总数是必检项目,当前菌落总数的权威检测方法是GB 4789.2-2016中的平板计数法及T/CBIA 005-2019中的滤膜法[2-6],由于饮料行业对于微生物的控制非常严格,在满足国标平板法的基础上,普遍利用滤膜法作为内控方法用于产品的放行控制。以上两种方法操作复杂,检测周期长,存在检测效率低下的问题,严重影响了对微生物污染控制的时效性,制约了企业产品放行速度及运转效率,这是所有食品饮料行业所面临的共同难题。
随着消费观念的改变,人们对饮料的健康要求越来越高。其中维生素饮料可调整各维生素的比例和含量,在一定程度上调节人体功能,是目前消费者所喜爱的饮料品类。而结合健康和安全性的综合考虑,维生素饮料在富含多种维生素的前提下,一般防腐剂含量较低,需要严格的微生物质量控制措施来保证产品的出厂合格性[7]。因此寻求一种准确性和效率相结合的微生物检验方法,是对产品质量的有力保障。而近年来随着现代生物科技水平的不断提高,许多快速测检测方法不断出现,如电阻抗法、流式细胞技术、激光扫描技术、ATP生物荧光、快检纸片法等[8],在简化操作步骤、缩短培养时间和检测大批量样本上具有明显的优势。其中3M PetrifilmTM快速测试片以其操作简便、准确度高、结果出具快速等特点受到广泛关注。3M PetrifilmTM菌落总数快速测试片培养时间仅需24 h,而平板法及滤膜法需要2 d左右。目前3M PetrifilmTM菌落总数快速测试片应用非常广泛且早已获得认可,但是仅针对于其与国标平板法的替代,行业内关于滤膜法与3M PetrifilmTM测试片法直接检测维生素类饮料(pH<4.6)菌落总数方面的替代研究,还鲜有报道。随着2015年国家食品安全法的大力提倡,利用快速检测方法快速放行产品已成为行业趋势,因此进行3M PetrifilmTM菌落总数测试片与滤膜法的一致性研究对于饮料行业具有非常重大的经济价值与现实意义,可以缩短培养时间,加快产品放行,提高产品新鲜度和降低库存成本。
因此,依据《中国药典》中微生物替代方法验证菌株选用原则以及此类维生素饮料(pH<4.6)中可能存在的高污染风险菌株。本实验选择了四株标准菌株(大肠埃希氏菌、金黄色葡萄球菌、枯草芽孢杆菌、黑曲霉)和三株自主分离的野生型菌株(爱媛类芽孢杆菌、Asia Siamensis、白色念珠菌),使用滤膜法和3M PetrifilmTM快速测试片法进行菌落总数的定量测定,通过线性拟合度、准确度、重现性、精密度、专属性、等效性分析判断两种方法的一致性程度,确定3M PetrifilmTM快速测试片法作为饮料中菌落总数检测方法使用的可行性[9]。
1. 材料与方法
1.1 材料与仪器
维生素类饮料(pH<4.6) 脉动 市场购买;平板计数琼脂(PCA)培养基、马铃薯葡萄糖琼脂(PDA)培养基 广东环凯微生物科技有限公司;3M PetrifilmTM快速菌落总数测试片 美国3M公司;滤膜(白色底、黑色网格、纤维素酯、直径47 mm、孔径0.45 μm) 密理博(中国)公司;60 mm培养皿 广东环凯微生物科技有限公司;菌株:金黄色葡萄球菌(ATCC 6538)、大肠埃希氏菌(ATCC 25922)、枯草芽孢杆菌(ATCC 6633)、黑曲霉(ATCC 16404) 美国Microbiologics公司;爱媛类芽孢杆菌、Asia Siamensis、白色念珠菌 达能集团自主分离鉴定。
ICP 500生化培养箱 美墨尔特(上海)贸易有限公司;MDF-86V188E超低温冰箱 安徽中科都菱商用电器股份有限公司;BSC-1300ⅡA2生物安全柜/SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;DENSIMAT比浊仪 生物梅里埃(中国)公司;EZ-STREAM, EZ-FI三联过滤装置 密理博(中国)有限公司。
1.2 实验方法
1.2.1 菌悬液的制备
细菌菌悬液的制备[10]:将供试菌(大肠埃希氏菌、金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌)分别接种到平板计数琼脂(PCA)培养基上,于(36±1)℃的培养箱中培养24~48 h。使用接种环取一环活化好的菌种于10 mL 0.85%的生理盐水中,震荡混匀,使用细菌比浊仪测定菌悬液菌落数,备用。
真菌菌悬液的制备[10]:将供试菌(白色念珠菌、Asia Siamensis、黑曲霉)分别接种到马铃薯葡萄糖琼脂PDA培养基上,于(28±1)℃的培养箱中培养3~5 d。使用接种环取一环活化好的菌种于10 mL 0.85%的生理盐水中,震荡混匀,使用血细胞计数法确定菌悬液菌落数,备用。
1.2.2 多梯度水平测试
将1.2.1中制备的大肠埃希氏菌和金黄色葡萄球菌菌悬液混合(因大肠埃希氏菌和金黄色葡萄球菌均为致病菌,在pH4.6的环境下基本不存在风险,因此将2者归为一类进行研究)接入维生素类饮料(pH<4.6)中,为组A(大肠埃希氏菌与金黄色葡萄球菌的比例为1:1),其余5种菌悬液(爱媛类芽孢杆菌、枯草芽孢杆菌、Asia Siamensis、白色念珠菌、黑曲霉)则分别接入维生素类饮料(pH<4.6)中,记为组B、C、D、E、F。六组样品均制备终菌含量为5、25、50、75及100 CFU/25 mL的待测样品(结合酸性(pH<4.6)的饮料微生物污染的风险较低,一般不超过102和3M测试片的指导使用方法建议两方面的实际情况,按照合适的限量进行低中高水平设置)。使用滤膜法及3M测试片法进行测试。同时使用两种方法对未接种的饮料样本进行空白测试。
滤膜法:使用无菌镊子夹住滤膜的边缘,网格面朝上,贴放在已灭菌的滤床上,固定好滤杯。向滤杯中倒入25 mL待测样品,打开抽滤泵开关,打开过滤阀门进行抽滤。水样抽滤完全后,关闭抽滤泵及抽滤阀门,取下滤杯,使用无菌镊子夹住滤膜边缘,网格朝上贴片于平板计数琼脂(PCA)培养基上,(36±1)℃培养48 h[11]。
3M测试片法:以滤膜法抽滤25 mL样品,随后将测试片放置于平坦表面,揭开上层膜,用无菌镊子夹住滤膜边缘,网格朝上贴片于测试片培养面积内,添加1 mL无菌水,使上层膜直接落下,利用压板轻轻下压,随后于(36±1)℃培养24 h[12]。
以上测试结果均需进行回收率计算,计算公式如下:
回收率(%)=A0A1×100 式中:A0表示3M测试片法计数结果平均值(CFU/25 mL);A1表示滤膜法计数结果平均值(CFU/25 mL)。
1.2.3 混合菌液测试
将1.2.1中的菌悬液按照细菌、真菌类别混合。细菌组为大肠埃希氏菌、金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌按照1:1:1:1混合,真菌组为Asia Siamensis、白色念珠菌、黑曲霉按照1:1:1混合,这两组分别接入维生素类饮料(pH<4.6)中,因20~80 CFU/25 mL为3M测试片法最具代表性且最能清晰计数的区间(3M测试片生产商针对3M测试片使用给出的使用建议),则将以上两组均制备为最终菌含量为20~80 CFU/25 mL的待测样品。使用滤膜法和3M测试片法进行测试,并按照式(1)进行回收率计算。同时使用两种方法对未接种的饮料样本进行空白测试。
1.2.4 重现性测试
将1.2.1中制备的大肠埃希氏菌和金黄色葡萄球菌菌悬液混合接入维生素类饮料(pH<4.6)中,其余5种菌悬液(爱媛类芽孢杆菌、枯草芽孢杆菌、Asia Siamensis、白色念珠菌、黑曲霉)则分别接入维生素类饮料(pH<4.6)中。六组样品均制备菌含量为5、50、150 CFU/25 mL的待测样品。使用滤膜法及两个不同批次的3M测试片法进行测试[13]。同时使用两种方法对未接种的饮料样本进行空白测试。
1.3 数据处理
所有实验均进行5次平行测定。使用MedCalc软件及Excel 2010进行实验数据分析处理。
2. 结果与分析
2.1 线性分析
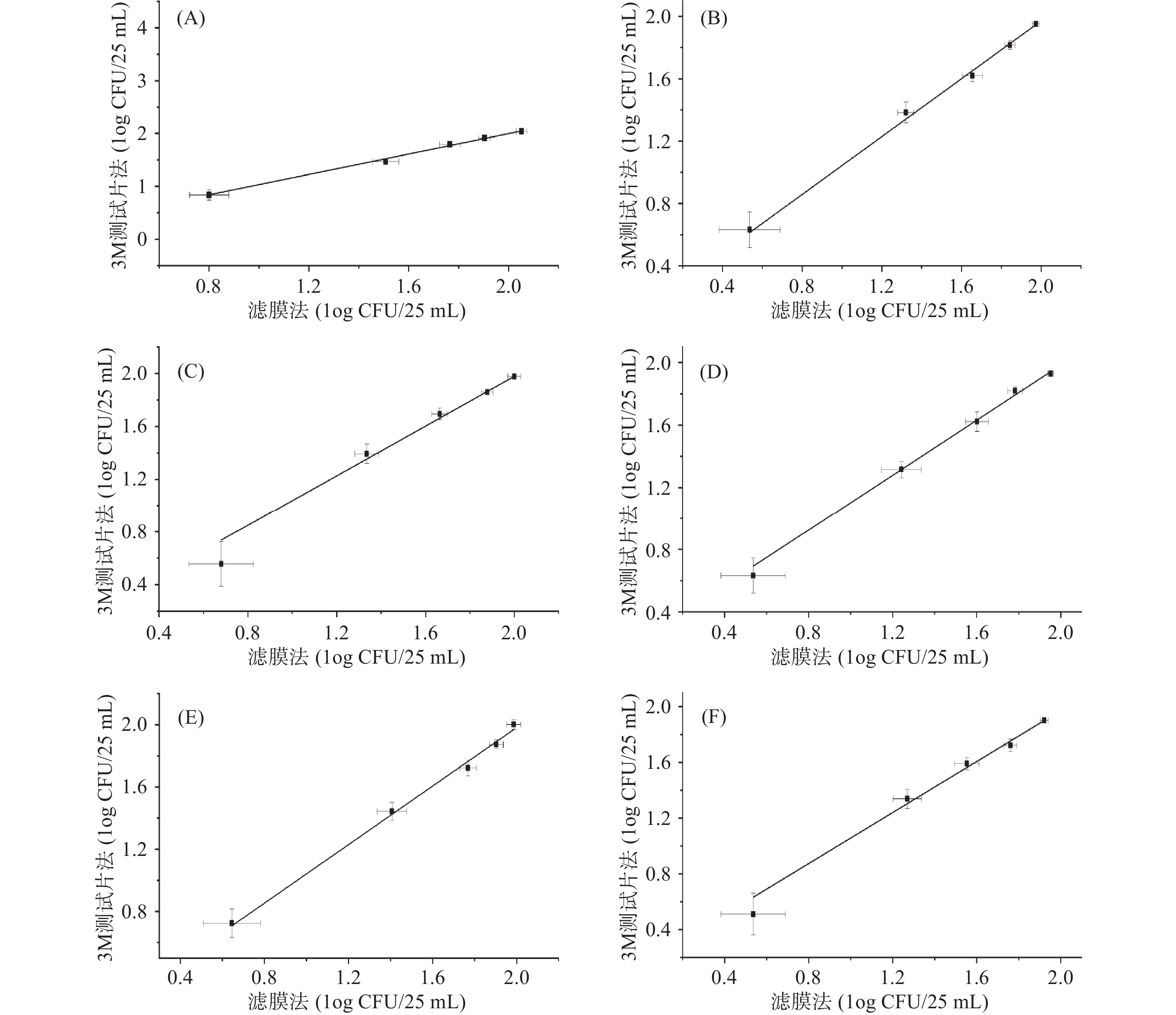
实验结果显示3M测试片法和滤膜法测试的空白组均无菌检出,表明接种前饮料中无其他微生物的干扰。将接种组中检测获得的菌含量换算为log形式,以3M测试片法结果为Y轴,滤膜法结果为X轴绘制曲线,计算决定系数R2,R2不得低于0.95[14]。使用滤膜法和3M测试片法对进行人工污染的维生素类饮料(pH<4.6)中的大肠埃希氏菌和金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌、Asia Siamensis、白色念珠菌、黑曲霉菌菌落计数后的线性拟合结果见图1和表1,决定系数R2分别为0.9934、0.9932、0.9822、0.9892、0.9858、0.9878,均大于0.95,表明两种方法线性拟合关系良好[15]。在线性拟合情况良好的情况下,可计算得出6组测试组的线性范围,分别为0.85~2.04、0.64~1.95、0.58~1.98、0.64~1.93、0.73~2.00及0.53~1.90(log CFU/25 mL)。
![]() 图 1 3M测试片法与滤膜法检测6组菌的拟合曲线注:A:金黄色葡萄球菌&大肠埃希氏菌(Escherichia coli & Staphylococcus aureus);B:爱媛类芽孢杆菌(Paenibacillus ehimensis);C:枯草芽孢杆菌(Bacillus subtilis);D:Asia Siamensis;E:白色念珠菌(Candida albicans);F:黑曲霉(Aspergillus niger);图2~图3同。Figure 1. Fitting curve of the 6 groups of bacteria determined by the filter membrane method and the 3M test tablet method表 1 3M测试片法与滤膜法检测6组菌的拟合结果Table 1. Fitting results of the 6 groups of bacteria determined by the filter membrane method and the 3M test plate method
图 1 3M测试片法与滤膜法检测6组菌的拟合曲线注:A:金黄色葡萄球菌&大肠埃希氏菌(Escherichia coli & Staphylococcus aureus);B:爱媛类芽孢杆菌(Paenibacillus ehimensis);C:枯草芽孢杆菌(Bacillus subtilis);D:Asia Siamensis;E:白色念珠菌(Candida albicans);F:黑曲霉(Aspergillus niger);图2~图3同。Figure 1. Fitting curve of the 6 groups of bacteria determined by the filter membrane method and the 3M test tablet method表 1 3M测试片法与滤膜法检测6组菌的拟合结果Table 1. Fitting results of the 6 groups of bacteria determined by the filter membrane method and the 3M test plate method分组 线性方程 决定系数R2 线性范围(log CFU/25 mL) 大肠埃希氏菌+金黄色葡萄球菌 Y=0.96542X+0.03831 0.9934 0.85~2.04 爱媛类芽孢杆菌 Y=0.92772X+0.11569 0.9932 0.64~1.95 枯草芽孢杆菌 Y=0.94039X+0.09774 0.9822 0.58~1.98 Asia Siamensis Y=0.88296X+0.21842 0.9892 0.64~1.93 白色念珠菌 Y=0.94128X+0.10110 0.9858 0.73~2.00 黑曲霉 Y=0.91512X+0.14216 0.9878 0.53~1.90 2.2 准确度及专属性分析
准确度指的是被测量物的测量值与指定值之间的一致性程度。微生物的定量检测方法的准确度则需在一定的检测范围内使用待确认方法与已被认可方法共同测试,使用回收率来评估待确认方法与已被认可方法的一致性程度,其中回收率要求≥70%[14,16]。本实验则是根据1.2.2中的测试结果,将3M测试片法相对于滤膜法的回收率(%)进行计算,以评估两种方法的一致性程度。由表2可知,人工污染的六组维生素类饮料(pH<4.6)在五个不同菌浓度梯度下的3M测试片法回收率范围在76.0%~122.2%之间,均>70%,表明3M测试片法的准确度较高,该方法与滤膜法具有较好的一致性。
表 2 6组菌株在不同测试水平下的菌落总数的回收率Table 2. Recoveries of total colonies of the 6 groups of strains at different test levels分组 3M测试片法不同测试水平下的回收率 5 CFU/25 mL 25 CFU/25 mL 50 CFU/25 mL 75 CFU/25 mL 100 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 109.4% 92.0% 107.2% 102.7% 97.3% 爱媛类芽孢杆菌 122.2% 116.2% 92.1% 94.0% 94.9% 枯草芽孢杆菌 76.0% 114.7% 107.4% 95.8% 94.8% Asia Siamensis 122.2% 116.9% 105.0% 108.6% 94.9% 白色念珠菌 117.4% 108.5% 90.1% 93.5% 103.9% 黑曲霉 94.4% 117.0% 108.9% 91.7% 95.2% 微生物定量检测方法的专属性是通过检测与方法相适应的菌株,分析该方法可定量检出目标微生物的能力。检测能力评估方式则是与已被认可和广泛接受的相关方法相比较,要求待确认方法检出结果不得少于已被认可的相关方法的70%[17-18]。本实验则是根据1.2.3中的测试结果,将3M测试片法相对于滤膜法的回收率(%)进行计算,以评估该方法的专属性。空白组均无菌检出,表明接种前饮料不存在其他微生物的干扰。由表3可知,细菌混合组和真菌混合组的3M测试片法回收率分别为99.4%和95.6%,均大于70%,表明3M测试片法对于细菌及真菌的定量检验专属性较好。
表 3 两类混合菌株的菌落总数回收率Table 3. Recoveries of total colonies of the two mixed strains分组 3M测试片法回收率 20~80 CFU/25 mL 细菌混合组
(大肠埃希氏菌、金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌)99.4% 真菌混合组
(白色念珠菌、Asia Siamensis、黑曲霉)95.6% 2.3 精密度和重现性分析
微生物方法定量的精密度评估是通过检验一定数量的目标菌,计算多次重复下结果的一致性程度[19-21]。将1.2.2中的实验方法结果计算分析得到相应的RSD值,可知滤膜法和3M测试片法分别测试人工污染的维生素类饮料(pH<4.6)中菌落总数的精密度(表4)。根据2020《中国药典》中的规定,不同菌浓度下预期的RSD见表5。3M测试片法五个浓度测试水平(5、25、50、75、100 CFU/25 mL)下的RSD值范围分别为21.1%~34.3%、12.4%~17.2%、7.2%~14.2%、4.2%~10.5%、2.9%~7.1%,滤膜法五个浓度测试水平(5、25、50、75、100 CFU/25 mL)下的RSD值范围分别为17.8%~33.0%、9.5%~21.5%、8.0%~13.9%、5.5%~7.8%、3.0%~7.6%。可见3M测试片法的测试RSD值均满足要求,且其与滤膜法的RSD值相近,表明3M测试片法的精密度较好。
表 4 滤膜法与3M测试片法的精密度比较分析Table 4. Comparison analysis of precision between filter membrane method and 3M test tablet method分组 测试方法 不同测试水平下的RSD 5 CFU/25 mL 25 CFU/25 mL 50 CFU/25 mL 75 CFU/25 mL 100 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 滤膜法 17.8% 12.1% 9.6% 5.5% 5.0% 3M测试片法 22.6% 13.3% 7.2% 5.0% 4.2% 爱媛类芽孢杆菌 滤膜法 31.7% 9.5% 11.7% 6.2% 4.1% 3M测试片法 25.9% 14.7% 8.9% 6.3% 3.2% 枯草芽孢杆菌 滤膜法 31.6% 12.7% 8.0% 6.2% 6.8% 3M测试片法 34.3% 17.2% 10.2% 4.2% 4.3% Asia Siamensis 滤膜法 31.7% 21.5% 12.7% 7.8% 3.0% 3M测试片法 25.9% 12.4% 14.2% 5.6% 4.3% 白色念珠菌 滤膜法 33.0% 15.8% 9.2% 7.6% 7.6% 3M测试片法 21.1% 13.1% 11.2% 6.3% 7.1% 黑曲霉 滤膜法 31.7% 15.2% 13.9% 7.2% 4.2% 3M测试片法 33.5% 16.1% 10.1% 10.5% 2.9% 微生物定量方法的重现性分析是在实验基质不变的情况下,当实验条件发生变化时,实验结果的精密度分析[22-23]。本实验使用人工污染的维生素类饮料(pH<4.6)样品进行测试,判断两个批次生产的3M测试片法测试结果的一致性程度。空白组均无菌检出,表明接种前饮料不存在其他微生物的干扰。实验组数据分测试水平及批次计算RSD值见表6,批次1在三个测试水平下(5、50、150 CFU/25 mL)的RSD值分别为21.1%~34.3%、7.2%~14.2%、3.6%~8.2%,批次2在三个测试水平下(5、50、150 CFU/25 mL)的RSD值分别为17.3%~34.3%、9.0%~14.4%、3.9%~7.9%。结果显示RSD值均满足表5要求,表明3M测试片法的重现性良好。
表 6 3M测试片法两个批次测试片的重现性比较分析Table 6. Comparative analysis of reproducibility of two batches of 3M test tablets分组 3M测试片批次 不同测试水平下的RSD 5 CFU/25 mL 50 CFU/25 mL 150 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 批次1 22.6% 7.2% 4.0% 批次2 17.3% 10.8% 3.9% 爱媛类芽孢杆菌 批次1 25.9% 8.9% 3.6% 批次2 30.6% 14.4% 4.6% 枯草芽孢杆菌 批次1 34.3% 10.2% 6.2% 批次2 31.0% 13.1% 7.1% Asia Siamensis 批次1 25.9% 14.2% 5.4% 批次2 33.0% 12.8% 5.7% 白色念珠菌 批次1 21.1% 11.2% 6.6% 批次2 25.6% 13.1% 6.0% 黑曲霉 批次1 33.5% 10.1% 8.2% 批次2 34.3% 9.0% 7.9% 2.4 相对正确度(Relatively trueness)分析
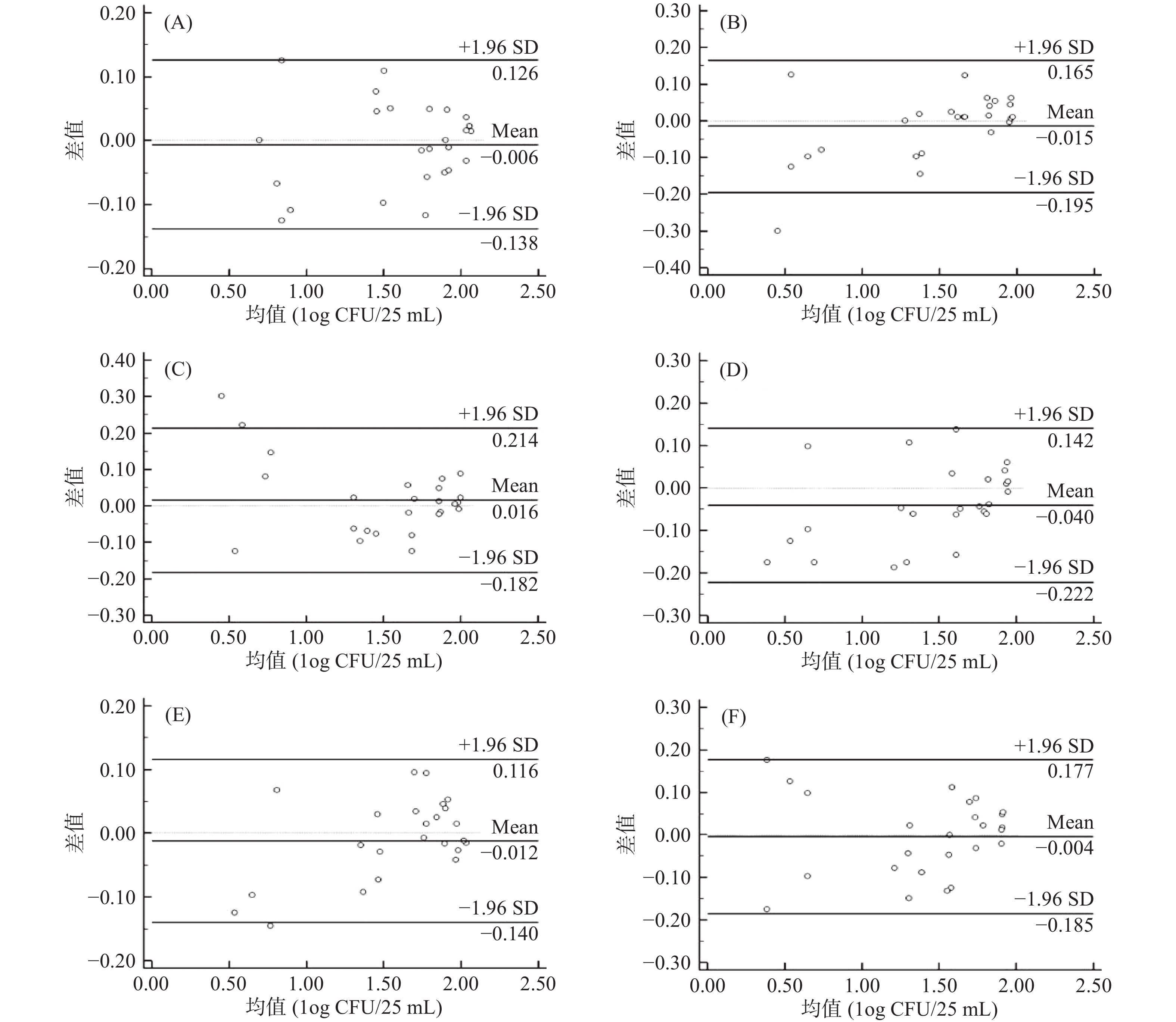
相对正确度研究是利用Bland-Altman分析法对已被认可方法的结果与待确认方法的结果之间的比较研究[24-25]。可使用MedCalc软件对1.2.2中获得的数据进行分析,对滤膜法和3M测试片法测试人工污染的维生素类饮料(pH<4.6)中的菌落总数的一致性进行评价。均数线(Mean)越靠近Y=0的虚线,表明两种方法的系统误差越小[26],且当图中大部分的点落在一致性区间内时,可认为两种方法的一致性较好,可以将两种方法替换使用[27-28]。
滤膜法和3M法测试人工污染的维生素类饮料(pH<4.6)中的大肠埃希氏菌和金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌、Asia Siamensis、白色念珠菌、黑曲霉的B-A分析如图2所示。六组菌株测试组的配对数据的均数值分别为−0.006、−0.015、0.016、−0.040、−0.012、−0.004,与Y=0的虚线接近,且六组菌株测试组分别仅有0%、4%、8%、0%、4%和0%的点落在了一致性区间以外。表明两种方法测量结果的的系统误差小,一致性程度高。
2.5 精度剖面(Accuracy profile)分析
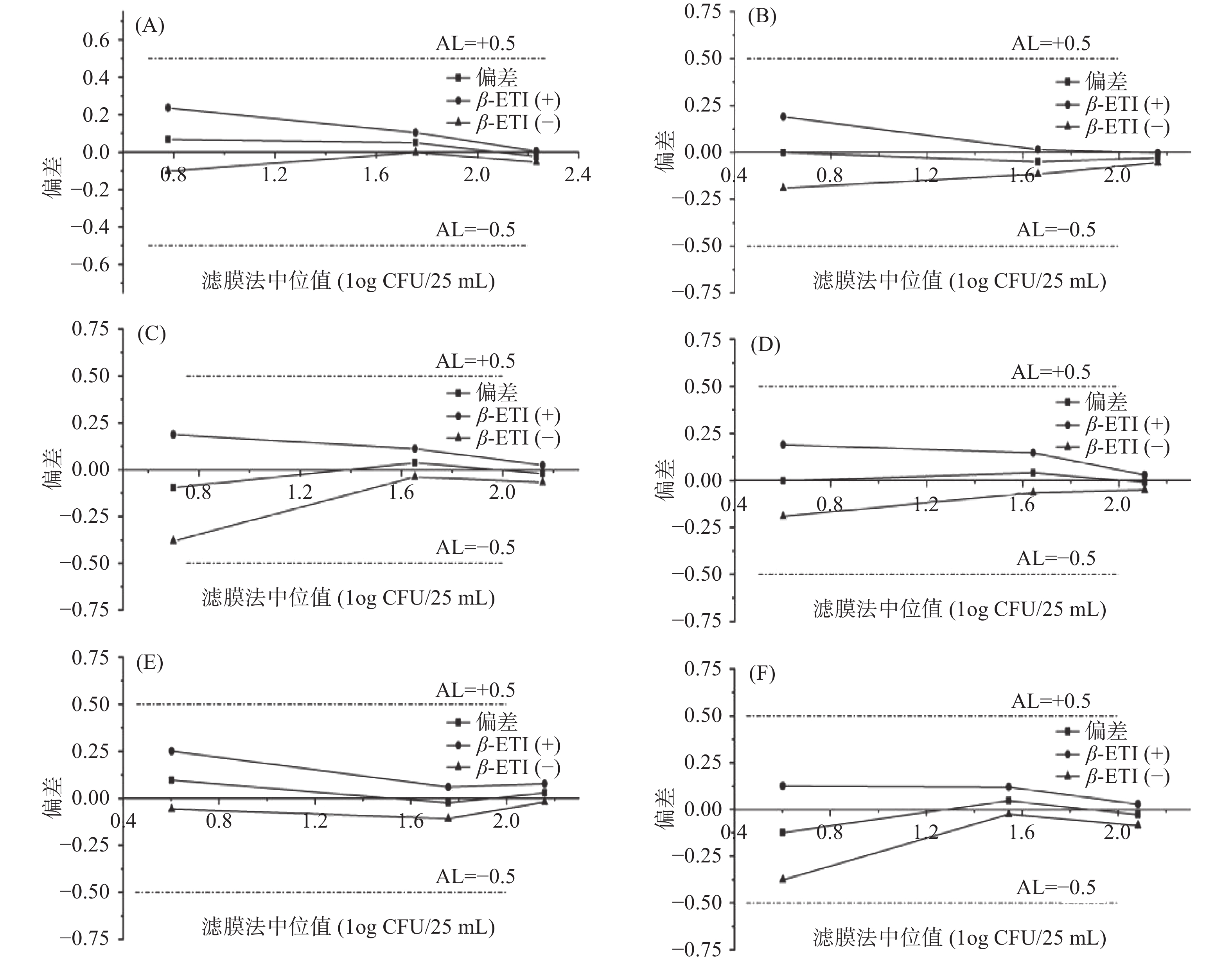
精度剖面分析是使用两种方法对至少三个污染浓度梯度的样品进行的重复性定量检验[24]。对于所有污染水平,需将β-期望容忍区间(β-Expected tolerance interval, β-ETI)与可接受限(Acceptable limit, AL)相比较,即β-ETI的上限值≤AL和下限值≥-AL时,该方法被认为与基准方法相当[29-30]。
将1.2.4中的测试结果转换为对数值后,以滤膜法中位值为横坐标,偏差(Bias,Bi)为纵坐标,绘制包括Bi、上下限β-ETI分析线的分析图谱。而准确度的可接受性限制为AL=±0.5log10单位。结合表7及图3可知,六组菌株人工污染组的3个水平的上下限β-ETI均在可接受限制范围以内,表明滤膜法和3M测试片法测定人工污染的维生素类饮料(pH<4.6)中菌落总数的方法等效。
表 7 AP分析结果Table 7. AP analysis results分组 水平 中位值 中位值 偏差 上限 下限 上限AL 下限AL CFU/25 mL (滤膜法) (3M法) Bias β-ETI β-ETI 大肠埃希氏菌+金黄色葡萄球菌 5 0.78 0.85 0.07 0.24 −0.10 Yes Yes 50 1.76 1.81 0.05 0.10 0.00 Yes Yes 100 2.23 2.21 −0.02 0.01 −0.05 Yes Yes 爱媛类芽孢杆菌 5 0.60 0.60 0.00 0.19 −0.19 Yes Yes 50 1.66 1.61 −0.05 0.01 −0.11 Yes Yes 100 2.16 2.13 −0.03 0.00 −0.05 Yes Yes 枯草芽孢杆菌 5 0.70 0.60 −0.10 0.19 −0.38 Yes Yes 50 1.65 1.69 0.04 0.11 −0.04 Yes Yes 100 2.16 2.14 −0.02 0.02 −0.07 Yes Yes Asia Siamensis 5 0.60 0.60 0.00 0.19 −0.19 Yes Yes 50 1.60 1.64 0.04 0.15 −0.06 Yes Yes 100 2.12 2.11 −0.01 0.03 −0.05 Yes Yes 白色念珠菌 5 0.60 0.70 0.10 0.25 −0.06 Yes Yes 50 1.76 1.73 −0.02 0.06 −0.11 Yes Yes 100 2.16 2.19 0.03 0.08 −0.02 Yes Yes 黑曲霉 5 0.60 0.48 −0.12 0.13 −0.38 Yes Yes 50 1.54 1.59 0.05 0.12 −0.03 Yes Yes 100 2.08 2.05 −0.03 0.03 −0.09 Yes Yes 注:当β-ETI的上限值≤AL,则在“上限AL”用Yes表示;当β-ETI的下限值≥-AL,则在“下限AL”用Yes表示。 3. 结论
本研究采用3M PetrifilmTM菌落总数测试片法替代滤膜法定量检测维生素类饮料(pH<4.6)的菌落总数,通过添加不同类型的7种菌株进行验证。将7种菌株进行分组后人工添加不同浓度梯度的菌悬液至维生素类饮料(pH<4.6)中,分别运用3M PetrifilmTM菌落总数测试片法及滤膜法对比检测。结果显示,两种方法的线性拟合R2均大于0.95,且在梯度水平测试、菌株分类接种污染及批次符合度的测试中,3M PetrifilmTM菌落总数测试片法检测数据的回收率及RSD结果均满足《中国药典》中对于微生物方法确认的要求。相对正确度和精度剖面分析中,两种方法也显现出较好的一致性和等效性。表明3M PetrifilmTM菌落总数测试片法可等同替代滤膜法进行维生素饮料(pH<4.6)中菌落总数的检测。除此之外,张芬[4]将3M菌落总数测试片法、国家标准法(4789.2-2016)及ISO(4833-1:2013)在检测面粉、花生和香辛料上进行了对比研究,通过线性分析和相关性分析,得出三种方法具有良好的一致性。许金榜[31]使用VRBA平板和3M大肠菌群测试片对8株菌进行了定性定量分析,在生长率测试、选择性、质控样品和能力验证样品测试中,3M测试片法都表现出与VRBA平板测试法的高度一致性,显示两种方法可以无差异使用。由此可知对于工业生产来说,3M测试片法具有很高的检测可靠度,并且该方法可以略去检测前处理的繁杂操作,并能缩短检测周期,在一定程度上可降低产品的库存压力,保障产品流通至市场的新鲜度。进一步可对3M测试片进行其他品类及其他目标菌株检测的相关验证工作,对传统的检测方法做出可靠的替代方法补充,这一类领域的开发将在食品企业中具有很好的应用前景。
-
图 1 3M测试片法与滤膜法检测6组菌的拟合曲线
注:A:金黄色葡萄球菌&大肠埃希氏菌(Escherichia coli & Staphylococcus aureus);B:爱媛类芽孢杆菌(Paenibacillus ehimensis);C:枯草芽孢杆菌(Bacillus subtilis);D:Asia Siamensis;E:白色念珠菌(Candida albicans);F:黑曲霉(Aspergillus niger);图2~图3同。
Figure 1. Fitting curve of the 6 groups of bacteria determined by the filter membrane method and the 3M test tablet method
表 1 3M测试片法与滤膜法检测6组菌的拟合结果
Table 1 Fitting results of the 6 groups of bacteria determined by the filter membrane method and the 3M test plate method
分组 线性方程 决定系数R2 线性范围(log CFU/25 mL) 大肠埃希氏菌+金黄色葡萄球菌 Y=0.96542X+0.03831 0.9934 0.85~2.04 爱媛类芽孢杆菌 Y=0.92772X+0.11569 0.9932 0.64~1.95 枯草芽孢杆菌 Y=0.94039X+0.09774 0.9822 0.58~1.98 Asia Siamensis Y=0.88296X+0.21842 0.9892 0.64~1.93 白色念珠菌 Y=0.94128X+0.10110 0.9858 0.73~2.00 黑曲霉 Y=0.91512X+0.14216 0.9878 0.53~1.90 表 2 6组菌株在不同测试水平下的菌落总数的回收率
Table 2 Recoveries of total colonies of the 6 groups of strains at different test levels
分组 3M测试片法不同测试水平下的回收率 5 CFU/25 mL 25 CFU/25 mL 50 CFU/25 mL 75 CFU/25 mL 100 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 109.4% 92.0% 107.2% 102.7% 97.3% 爱媛类芽孢杆菌 122.2% 116.2% 92.1% 94.0% 94.9% 枯草芽孢杆菌 76.0% 114.7% 107.4% 95.8% 94.8% Asia Siamensis 122.2% 116.9% 105.0% 108.6% 94.9% 白色念珠菌 117.4% 108.5% 90.1% 93.5% 103.9% 黑曲霉 94.4% 117.0% 108.9% 91.7% 95.2% 表 3 两类混合菌株的菌落总数回收率
Table 3 Recoveries of total colonies of the two mixed strains
分组 3M测试片法回收率 20~80 CFU/25 mL 细菌混合组
(大肠埃希氏菌、金黄色葡萄球菌、爱媛类芽孢杆菌、枯草芽孢杆菌)99.4% 真菌混合组
(白色念珠菌、Asia Siamensis、黑曲霉)95.6% 表 4 滤膜法与3M测试片法的精密度比较分析
Table 4 Comparison analysis of precision between filter membrane method and 3M test tablet method
分组 测试方法 不同测试水平下的RSD 5 CFU/25 mL 25 CFU/25 mL 50 CFU/25 mL 75 CFU/25 mL 100 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 滤膜法 17.8% 12.1% 9.6% 5.5% 5.0% 3M测试片法 22.6% 13.3% 7.2% 5.0% 4.2% 爱媛类芽孢杆菌 滤膜法 31.7% 9.5% 11.7% 6.2% 4.1% 3M测试片法 25.9% 14.7% 8.9% 6.3% 3.2% 枯草芽孢杆菌 滤膜法 31.6% 12.7% 8.0% 6.2% 6.8% 3M测试片法 34.3% 17.2% 10.2% 4.2% 4.3% Asia Siamensis 滤膜法 31.7% 21.5% 12.7% 7.8% 3.0% 3M测试片法 25.9% 12.4% 14.2% 5.6% 4.3% 白色念珠菌 滤膜法 33.0% 15.8% 9.2% 7.6% 7.6% 3M测试片法 21.1% 13.1% 11.2% 6.3% 7.1% 黑曲霉 滤膜法 31.7% 15.2% 13.9% 7.2% 4.2% 3M测试片法 33.5% 16.1% 10.1% 10.5% 2.9% 表 5 不同含菌浓度下预期的相对标准偏差[14]
Table 5 Expected relative standard deviations at different concentrations of bacteria[14]
CFU/皿 预期RSD <10 <35% 10~30 <25% 30~300 <15% 表 6 3M测试片法两个批次测试片的重现性比较分析
Table 6 Comparative analysis of reproducibility of two batches of 3M test tablets
分组 3M测试片批次 不同测试水平下的RSD 5 CFU/25 mL 50 CFU/25 mL 150 CFU/25 mL 大肠埃希氏菌+金黄色葡萄球菌 批次1 22.6% 7.2% 4.0% 批次2 17.3% 10.8% 3.9% 爱媛类芽孢杆菌 批次1 25.9% 8.9% 3.6% 批次2 30.6% 14.4% 4.6% 枯草芽孢杆菌 批次1 34.3% 10.2% 6.2% 批次2 31.0% 13.1% 7.1% Asia Siamensis 批次1 25.9% 14.2% 5.4% 批次2 33.0% 12.8% 5.7% 白色念珠菌 批次1 21.1% 11.2% 6.6% 批次2 25.6% 13.1% 6.0% 黑曲霉 批次1 33.5% 10.1% 8.2% 批次2 34.3% 9.0% 7.9% 表 7 AP分析结果
Table 7 AP analysis results
分组 水平 中位值 中位值 偏差 上限 下限 上限AL 下限AL CFU/25 mL (滤膜法) (3M法) Bias β-ETI β-ETI 大肠埃希氏菌+金黄色葡萄球菌 5 0.78 0.85 0.07 0.24 −0.10 Yes Yes 50 1.76 1.81 0.05 0.10 0.00 Yes Yes 100 2.23 2.21 −0.02 0.01 −0.05 Yes Yes 爱媛类芽孢杆菌 5 0.60 0.60 0.00 0.19 −0.19 Yes Yes 50 1.66 1.61 −0.05 0.01 −0.11 Yes Yes 100 2.16 2.13 −0.03 0.00 −0.05 Yes Yes 枯草芽孢杆菌 5 0.70 0.60 −0.10 0.19 −0.38 Yes Yes 50 1.65 1.69 0.04 0.11 −0.04 Yes Yes 100 2.16 2.14 −0.02 0.02 −0.07 Yes Yes Asia Siamensis 5 0.60 0.60 0.00 0.19 −0.19 Yes Yes 50 1.60 1.64 0.04 0.15 −0.06 Yes Yes 100 2.12 2.11 −0.01 0.03 −0.05 Yes Yes 白色念珠菌 5 0.60 0.70 0.10 0.25 −0.06 Yes Yes 50 1.76 1.73 −0.02 0.06 −0.11 Yes Yes 100 2.16 2.19 0.03 0.08 −0.02 Yes Yes 黑曲霉 5 0.60 0.48 −0.12 0.13 −0.38 Yes Yes 50 1.54 1.59 0.05 0.12 −0.03 Yes Yes 100 2.08 2.05 −0.03 0.03 −0.09 Yes Yes 注:当β-ETI的上限值≤AL,则在“上限AL”用Yes表示;当β-ETI的下限值≥-AL,则在“下限AL”用Yes表示。 -
[1] 范蕊, 王文文, 卢彬, 等. 食品中菌落总数、大肠菌群的检测技术探讨[J]. 现代食品,2021(4):212−214. [FAN Rui, WANG Wenwen, LU Bin, et al. Discussion on the detection technology of total number of colonies and coliform in food[J]. Modern Food,2021(4):212−214. [2] 高翔, 马鹏飞, 崔亚宁. 食品微生物检验菌落总数测定方法的效果探讨[J]. 食品安全导刊,2021(3):94−95, 97. [GAO Xiang, MA Pengfei, CUI Yaning. The effect of the method for determination of the total number of bacterial colonies in food microbiological inspection[J]. Food Safety Guide,2021(3):94−95, 97. [3] 刘凤会. 食品中菌落总数测定研究进展[J]. 食品安全导刊,2021(3):171. [LIU Fenghui. Research progress on determination of total number of bacterial colonies in food[J]. Food Safety Guide,2021(3):171. [4] 张芬. 3种方法检测食品中菌落总数的比较研究[J]. 现代食品,2020(10):214−216. [ZHANG Fen. Comparative study on the total number of bacterial colonies in food by three methods[J]. Modern Food,2020(10):214−216. [5] 中华人民共和国卫生部. GB 4789.2-2016 食品安全国家标准食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社, 2016. Ministry of Health, People's Republic of China. GB 4789.2-2016 National standard for food safety: Determination of total number of bacterial colonies in food microbiology[S]. Beijing: Standards Press of China, 2016.
[6] 中国饮料工业协会技术工作委员会. T/CBIA 005-2019饮料中微生物的检验(滤膜前处理法)[S]. 北京: 中国标准出版社, 2019. Techbical Working Committee of China Beverage Industry Association. T/CBIA 005-2019 Determination of microorganisms in beverages(filter membrane pretreatment method)[S]. Beijing: Standards Press of China, 2019.
[7] 徐红, 刘小波, 郭伟鹏, 等. 六株霉菌对维生素功能饮料理化性质的影响[J]. 现代食品科技,2015,31(10):263−268. [XU Hong, LIU Xiaobo, GUO Weipeng, et al. Effects of six strains of fungi on physical and chemical properties of vitamin energy drinks[J]. Modern Food Science and Technology,2015,31(10):263−268. [8] 吴磊磊. 食品微生物快检技术的发展[J]. 粮食流通技术,2016(17):25−27. [WU Leilei. Development of rapid detection technology of food microorganism[J]. Grain circulation technology,2016(17):25−27. [9] PERIS-VICENTEJ, CA RDA-BROCH S, ESTEVE-ROMERO J. Validation of rapid microbiological methods[J]. Journal of Laboratory Automation,2015,20(3):259−64. doi: 10.1177/2211068214554612
[10] 马尚玄, 郭刚军, 黄克昌, 等. 不同分子量澳洲坚果多肽氨基酸组成与抑菌活性[J]. 食品工业科技,2021,42(7):83−88. [MA Shangxuan, GUO Gangjun, HUANG Kechang, et al. Amino acid composition and antimicrobial activity of macadamia polypeptides with different molecular weights[J]. Science and Technology of Food Industry,2021,42(7):83−88. [11] 张兰, 徐红, 翁文川, 等. 流式细胞技术检测酸性饮料中菌落总数的研究[J]. 食品工业科技,2018,39(4):235−239. [ZHANG Lan, XU Hong, WENG Wenchuan, et al. Determination of total number of bacterial colonies in acidic beverages by flow cytometry[J]. Science and Technology of Food Industry,2018,39(4):235−239. [12] 池福敏, 罗章, 辜雪冬, 等. 3M测试片法在西藏牦牛乳制品微生物检测中的应用[J]. 食品工业,2015,36(12):201−203. [CHI Fumin, LUO Zhang, GU Xuedong, et al. Application of 3M test plate method in microbial detection of Xizang yak dairy products[J]. Food Industry,2015,36(12):201−203. [13] 张宏伟, 郑文杰, 赵宏, 等. AOAC食品微生物定量分析方法确认要求[J]. 食品工业科技,2007(4):241−243. [ZHANG Hongwei, ZHENG Wenjie, ZHAO Hong, et al. Requirements for validation of AOAC methods for the quantitative analysis of food microorganisms[J]. Food Science and Technology,2007(4):241−243. doi: 10.3969/j.issn.1002-0306.2007.04.073 [14] 国家药典委员会. 中华人民共和国药典, 三部[S]. 北京: 中国医药科技出版社, 2015: 216−218. Natinal Pharmacopoeia Commission. Pharmacopoeia of the People's Repunlic of China, Three[S]. Beijing: China Medical Science and Technology Press, 2015: 216−218.
[15] PUM J. A practical guide to validation and verification of analytical methods in the clinical laboratory[J]. Advances in Clinical Chemistry,2019:215−281.
[16] 李辉, 杨晓莉, 刘立科, 等. 3种咪唑类抗真菌乳膏剂微生物限度检查方法学研究[J]. 药物评价研究,2021,44(4):721−727. [LI Hui, YANG Xiaoli, LIU Like, et al. Microbial limit test methodology of three imidazole antifungal creams[J]. Drug Evaluation Research,2021,44(4):721−727. [17] 翟磊, 葛媛媛, 崔生辉, 等. ATP生物荧光增幅法在化妆品微生物检测中的验证研究[J]. 日用化学工业,2020,50(11):771−775,782. [ZHAI Lei, GE Yuanyuan, CUI Shenghui, et al. Validation of ATP bioluminescence enhancement method in microbial detection of cosmetics[J]. China Detergent Chemical Industry,2020,50(11):771−775,782. doi: 10.3969/j.issn.1001-1803.2020.11.006 [18] 吴琼, 姚东, 胡北, 等. 决明降脂灵咀嚼片的质量标准及微生物限度检查[J]. 西北药学杂志,2015,34(4):417−422. [WU Qiong, YAO Dong, HU Bei, et al. Study on the quality standard and microbial limit of CasinJiangzhiling chewable tablets[J]. Journal of Microbiology and Biotechnology,2015,34(4):417−422. [19] 梁春梅, 喻东威, 吴玉秋, 等. 测试片法快速检测乳品中的菌落总数[J]. 中国乳品工业,2017,45(1):47−49. [LIANG Chunmei, YU Dongwei, WU Yuqiu, et al. Rapid detection of total number of bacterial colonies in milk by test plate method[J]. China Dairy Industry,2017,45(1):47−49. doi: 10.3969/j.issn.1001-2230.2017.01.012 [20] 苏晓燕, 杨菲, 刘万敏, 等. 测试片法在细菌菌落总数检测中的应用价值研究[J]. 人民军医,2019,62(7):628−631. [SU Xiaoyan, YANG Fei, LIU Wanmin, et al. Study on the application value of test plate method in the detection of total number of bacterial colonies[J]. People's Military Medical Journal,2019,62(7):628−631. [21] 程苏云, 任锦玉, 童哲, 等. 实验室菌落计数精密度控制的研究——Ⅰ影响精密度的因素[J]. 中国食品卫生杂志,2001(5):11−13. [CHENG Suyun, REN Jinyu, TONG Zhe, et al. Study on precision control of laboratory colony count——Ⅰ factors affecting precision[J]. Chinese Journal of Food Hygiene,2001(5):11−13. doi: 10.3969/j.issn.1004-8456.2001.05.004 [22] 伏广伟, 张珍竹, 崔绮嫦, 等. 全自动菌落计数仪在纺织检测中的应用研究[J]. 中国纤检,2021(2):66−69. [FU Guangwei, ZHANG Zhenzhu, CUI Qichang, et al. Research on application of automatic colony counter in textile testing[J]. China Fiber Inspection,2021(2):66−69. [23] 梁春梅, 常建军, 喻东威, 等. 自动菌落计数仪在乳品检测中的应用研究[J]. 食品安全质量检测学报,2020,11(1):146−152. [LIANG Chunmei, CHANG Jianjun, YU Dongwei, et al. Study on the application of automatic colony counting instrument in milk detection[J]. Journal of Food Safety and Quality,2020,11(1):146−152. [24] ISO. Microbiology of the food chain—Method validation—Part 2: Protocol for the validation of alternative (proprietary) methods against a reference method[S]. 2016.
[25] NÖ DOĞAN. Bland-Altman analysis: A paradigm to understand correlation and agreement[J]. Turkish Journal of Emergency Medicine,2018,18(4):139−141. doi: 10.1016/j.tjem.2018.09.001
[26] MANSOURNIA M A, WATERS R, NAZEMIPOUR M, et al. Bland-Altman methods for comparing methods of measurement and response to criticisms[J]. Global Epidemiology,2020,3:100045.
[27] CAO X, BAI Z, SUN C, et al. Bland–Altman analysis of different radiographic measurements of the hallux valgus angle and the intermetatarsal angle after distal osteotomy[J]. Orthopaedic Surgery,2020,12(6):1621−1626. doi: 10.1111/os.12759
[28] OHNLUDBROOK J. Confidence in Altman–Bland plots: A critical review of the method of differences[J]. Clinical and Experimental Pharmacology and Physiology,2010,37(2):143−149. doi: 10.1111/j.1440-1681.2009.05288.x
[29] MFEINBERG. Validation of analytical methods based on accuracy profiles[J]. Journal of Chromatography A, 2007, 1158 (1–2): 174−183.
[30] HUBERT P, NGUYEN-HUU J J, BOULANGER B, et al. Validation of quantitative analytical procedure, Harmonization of approaches[J]. STP Pharma Pratiques,2003,13(3):101−138.
[31] 许金榜. VRBA和3M PetrifilmTM快速测试片定量检测大肠菌群的性能比较研究[J]. 质量技术监督研究,2021(1):17−22. [XU Jinbang. Comparative study on the performance of VRBA and 3M PetriFilmTM rapid aerobic count plate for quantitative detection of coliforms[J]. Research on Quality and Technical Supervision,2021(1):17−22. doi: 10.3969/j.issn.1674-5981.2021.01.004 -
期刊类型引用(8)
1. 洪嘉敏,张琼丹,黄慧思. 食品中菌落总数纸片法的方法验证及结果分析. 广东化工. 2024(07): 151-154 .  百度学术
百度学术
2. 谢清华,吴小凤,陈韵妍. 寿司中菌落总数检测的不确定度评定. 中国卫生标准管理. 2024(08): 17-20 .  百度学术
百度学术
3. 易小利,陈玟妃. 食品中金黄色葡萄球菌检测能力验证结果分析与讨论. 现代食品. 2024(07): 168-172 .  百度学术
百度学术
4. 杨睿,蔡琳,卢灿鑫,李乐诗,张洁吟,刘晓晗,王韦达. 致病菌测试片质量评价方法研究. 食品安全质量检测学报. 2024(23): 41-51 .  百度学术
百度学术
5. 赵晓美,王娉,曲天铭,梁丽姣,姬庆龙,陈颖. 基于流式细胞仪技术的快速检测试剂盒在生乳菌落总数检测中的应用. 质量安全与检验检测. 2023(01): 7-15 .  百度学术
百度学术
6. 周敏,高志城,苏水娇,宁礼信,张任广,黎子林. 定量测试在食品微生物检测内部质量监控中的应用. 食品与发酵科技. 2023(03): 121-126 .  百度学术
百度学术
7. 宁礼信,周敏,黎子林,苏水娇,高志城,张任广. 三文鱼刺身中菌落总数不确定度评定. 食品工业. 2023(08): 320-323 .  百度学术
百度学术
8. 翁国永,王海荣,项兆邦,周正. 酶底物法检测水中菌落总数培养24h和48h的比较试验. 净水技术. 2023(S2): 147-151 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:
 下载:
下载:



