Optimization of Enzymatic Hydrolysis of ACE Inhibitory Peptide from Jujube Kernel
-
摘要: 本试验以脱脂后的酸枣仁渣通过碱溶酸沉法提取得到的酸枣仁蛋白为研究对象,以血管紧张素转化酶(ACE)抑制率和水解度为指标,筛选复合酶种类,采用响应面分析法,以中性蛋白酶/碱性蛋白酶比例、pH、底物浓度、酶解温度、酶解时间为试验因素,优化酸枣仁ACE抑制肽最佳酶解工艺参数。结果表明:筛选出中性蛋白酶和碱性蛋白酶作为复合酶,最适酶添加量确定为6000 U/g,5个因素对ACE抑制率和水解度的影响由大到小的顺序为:酶解温度、酶解时间、pH、中性蛋白酶/碱性蛋白酶比例、底物浓度。通过拟合方程分析,得到酸枣仁ACE抑制肽酶解的最佳工艺条件为:中性蛋白酶/碱性蛋白酶比例为2.1:1、酶解温度为54 ℃,底物浓度为3.1%,pH为7.5,酶解时间为62 min。在此条件下,复合酶解酸枣仁蛋白酶解液的实际ACE抑制率和水解度分别为(79.46%±0.49%)和(31.45%±0.85%),与理论值接近。制备得到酸枣仁ACE抑制肽与阳性对照组卡托普利对比,酸枣仁ACE抑制肽的ACE抑制率大小为(79.46%±0.49%),与卡托普利的ACE抑制率偏差为(19.28%±0.12%),证明酸枣仁ACE抑制肽具有显著降压效果。本研究证明了酸枣仁蛋白通过酶解有效得到ACE抑制肽并优化其酶解工艺,旨在为酸枣仁渣废物再利用提供参考方向和理论依据。Abstract: In this experiment, jujube kernel protein was extracted from defatted jujube kernel residue by alkali solution and acid precipitation, taking the inhibition rate of angiotensin converting enzyme (ACE) and degree of hydrolysis as indicators to screen the compound enzyme species. Using the response surface method, with proportion of neutral protease/alkaline protease, pH, substrate concentration, enzymolysis temperature, digestion time as test factors, the optimum enzymatic hydrolysis parameters of ACE inhibitory peptide from jujube kernel were optimized. The results showed that neutral protease and alkaline protease were selected as complex enzymes, and the optimal amount of enzyme was determined to be 6000 U/g. The order of influence of five factors on the ACE inhibition rate and hydrolysis degree was: Enzymatic hydrolysis temperature, enzymatic hydrolysis time, pH, ratio of neutral protease to alkaline protease, substrate concentration. Through the fitting equation analysis, the optimum conditions of ACE inhibition of peptidyl enzymatic hydrolysis of jujube kernel were as follows: Neutral protease/alkaline protease ratio 2.1:1, hydrolysis temperature 54 ℃, substrate concentration 3.1%, pH7.5, hydrolysis time 62 min. Under these conditions, the actual ACE inhibition rate and hydrolysis degree of the hydrolysate were (79.46%±0.49%) and (31.45%±0.85%), respectively, which were close to the theoretical values. Compared with captopril, the ACE inhibitory rate of the prepared ACE inhibitory peptide was (79.46%±0.49%), and the deviation from captopril was (19.28%±0.12%), which proved that the ACE inhibitory peptide had a significant antihypertensive effect. This study proved that the ACE inhibitory peptide could be effectively obtained by enzymatic hydrolysis of jujube kernel protein and optimized the enzymatic hydrolysis process, aiming to provide reference direction and theoretical basis for the reuse of jujube kernel residue.
-
酸枣仁(Ziziphus jujuba Mill.var.spinosa)是将酸枣去除果核,从果核中分离得到种子即为酸枣仁[1],华北地区、陕西、内蒙古等地产量丰富。酸枣仁作为一种药食同源食品,营养价值高,同时具有镇静、安神的作用[2]。
ACE即为血管紧张素转化酶,而ACE抑制肽是一类可以抑制血管紧张素转化酶的小分子肽段,ACE抑制肽具有安全、高效、易吸收等优点。世界上第一种ACE抑制剂是从南美蝮蛇的毒液中得到[3],而目前常见的降压药物如:卡托普利、赖诺普利等都是从蛇的毒液中获取[4]。目前天然ACE抑制肽主要有动物来源和植物来源,已发现的具有ACE抑制作用的植物源如:大豆、豌豆、玉米、魔芋、核桃、大蒜、苦瓜种子等[5-12];动物源如:蛋清、鲢鱼、猪血红等[13-15]。从植物中获取的ACE抑制肽相较于动物中获取的ACE抑制肽具有成本低、绿色可持续等优点。近年来。从植物中获取ACE抑制肽的相关研究一直是研究热点。
目前ACE抑制肽的制备主要从酶法、化学合成法、DNA重组法来提取和合成ACE抑制肽[16],根据不同蛋白种类采取不同制备方法,而植物来源蛋白大多采取酶法制备ACE抑制肽。酶法常见的蛋白酶如碱性蛋白酶、中性蛋白酶、胃蛋白酶、胰蛋白酶、α-糜蛋白酶、胃蛋白酶、细菌蛋白酶、真菌蛋白酶等[17-18],而酶的种类、温度、酶解时间和酶添加量都是ACE抑制肽产生的关键因素[19-20]。由于酶的特异性,不同酶的共同作用也会使ACE抑制能力有着不同程度的增强[21-22]。Sari等[23]以脱脂菜籽粕为原料通过碱性蛋白酶制备ACE抑制肽,发现碱性蛋白酶水解产物中的ACE抑制肽在人体胃液和十二指肠液的体外消化模型中表现出良好的稳定性;Pihlanto等[24]通过碱性蛋白酶、中性蛋白酶和胃蛋白酶酶解不同生理状态的马铃薯块茎中分离蛋白,发现酶解产物具有较强的ACE抑制作用和自由基清除活性;徐敏等[25]通过碱性蛋白酶复合中性蛋白酶来酶解米渣蛋白,制备ACE抑制肽。
现阶段,关于酸枣仁的研究主要集中于酸枣仁皂苷、酸枣仁黄酮等方面[26],关于酸枣仁蛋白的研究较少,针对酸枣仁蛋白的生物活性研究集中在抗氧化方面,较为单一。在酶解方面,目前酸枣仁蛋白酶解仅局限于单一种类酶,且关于酸枣仁蛋白ACE抑制肽的研究鲜有报道。本文对酸枣仁蛋白进行复合酶解,筛选复合酶种类,并对复合酶添加比例、酶解温度、底物浓度、pH、酶解时间进行单因素实验,在此基础上进行响应面研究,以ACE抑制率、水解度DH为指标,优化酸枣仁蛋白酶解工艺参数,旨在为酸枣仁蛋白酶解加工奠定一定的理论基础,为酸枣仁副产物再利用提供一个新的开发方向。
1. 材料与方法
1.1 材料与仪器
酸枣仁渣 河北省邢台市润玉食品有限公司提供;碱性蛋白酶(20000 U/g)、血管紧张素转化酶、卡托普利 生化纯,北京索莱宝科技有限公司;中性蛋白酶(5000 U/g)、胃蛋白酶(3000 U/g)、胰蛋白酶(250000 U/g)、木瓜蛋白酶(100000 U/g)、α-糜蛋白酶(1200000 U/g) 生化纯,北京奥博星生物技术有限公司;马脲酰-组氨酸-亮氨酸 生化纯,上海鼓臣生物技术有限公司;盐酸、氢氧化钠、硼砂 分析纯,天津市永大化学试剂有限公司;氯化钠、硼酸 分析纯,天津博迪化工股份有限公司;乙酸乙酯 分析纯,天津欧博凯化工有限公司;石油醚 分析纯,国药集团化学试剂有限公司。
DF-101集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;HC-3018高速离心机 安徽中科中佳科学仪器有限公司;RT-25型气流式超微粉碎机 荣聪精密科技有限公司;LGJ-10D型冷冻干燥机 北京四环科学仪器厂有限公司;SPECTRO star Nano酶标仪 德国BMG LABTECH公司;MC-ACPH-30ApH自动控制仪计 北京满仓科技有限公司;J09626石英96孔板 上海百千生物科技有限公司。
1.2 实验方法
1.2.1 酸枣仁蛋白的制备
参考赵节昌[27]的方法,略有改进。取200 g酸枣仁渣以液氮为冷源通入粉碎机,打粉1 min,过80目筛。将粗粉碎的酸枣仁渣放入气流式超微粉碎机,以液氮为冷源通入超微粉碎机,电流设置5 A,粉碎1 min,过150目筛,收集密封放入4 ℃冰箱备用。
将粉碎好的酸枣仁粉与石油醚按料液比1:3 g/mL,50 ℃水浴浸提30 min,4 ℃离心(4000 r/min、10 min)去除上清液,重复多次,直到上清液完全澄清透明,室温通风12 h,40 ℃干燥12 h,得到脱脂酸枣仁粉,收集密封放入−20 ℃冰箱备用。
称取1 g脱脂酸枣仁粉,按液料比32:1(mL/g)溶解于蒸馏水中,用1 mol/L的盐酸或氢氧化钠溶液调节溶液pH为11.4,51 ℃下水浴搅拌浸提58 min,4 ℃离心(5000 r/min、20 min)得上清液,用1 mol/L的盐酸或氢氧化钠调节溶液pH至酸枣仁蛋白等电点即pH4.6,4 ℃静置2 h,4 ℃离心(5000 r/min、15 min)得到酸枣仁蛋白沉淀,冷冻干燥得到酸枣仁蛋白粉。
1.2.2 酸枣仁蛋白酶解液的制备
称取1 g冻干后酸枣仁蛋白粉,按比例溶解于蒸馏水中,加入一定量的蛋白酶,调节溶液pH,在一定温度下水浴搅拌浸提一定时间,酶解过程中保持酶解液pH、温度不变。酶解结束后灭酶活,沸水浴10 min,待酶解液冷却至室温后置于−20 ℃冰箱备用。
1.2.3 复合酶筛选
选取碱性蛋白酶、中性蛋白酶、α-糜蛋白酶、胰蛋白酶、木瓜蛋白酶、胃蛋白酶分别酶解酸枣仁蛋白,考察不同蛋白酶对ACE抑制率和水解度的影响,各蛋白酶酶解条件见表1。筛选得到最优的两种酶,为了确定复合酶与单一酶对ACE抑制率和水解度的影响,选择将这两种酶按1:1比例复合,测定单一酶与复合酶对ACE抑制率和水解度的影响,后续再测定复合酶的具体比例。
表 1 6种蛋白酶酶解条件Table 1. Conditions for enzymatic hydrolysis of six proteases酶种类 加酶量(U/g) 酶解温度(℃) 底物浓度(%) pH 时间(min) 碱性蛋白酶 5000 55 3.0 7.0 60 中性蛋白酶 5000 55 3.0 7.0 60 胃蛋白酶 5000 37 3.0 4.5 60 胰蛋白酶 5000 37 3.0 8.0 60 木瓜蛋白酶 5000 55 3.0 7.0 60 α-糜蛋白酶 5000 37 3.0 7.5 60 1.2.4 单因素实验
考察酸枣仁蛋白酶解过程中加酶量、中性蛋白酶和碱性蛋白酶的添加比例、酶解温度、底物浓度、pH、酶解时间,六种因素对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响,并设置重复试验。
1.2.4.1 酶添加量对酸枣仁蛋白酶解产物ACE抑制率和水解度的影响
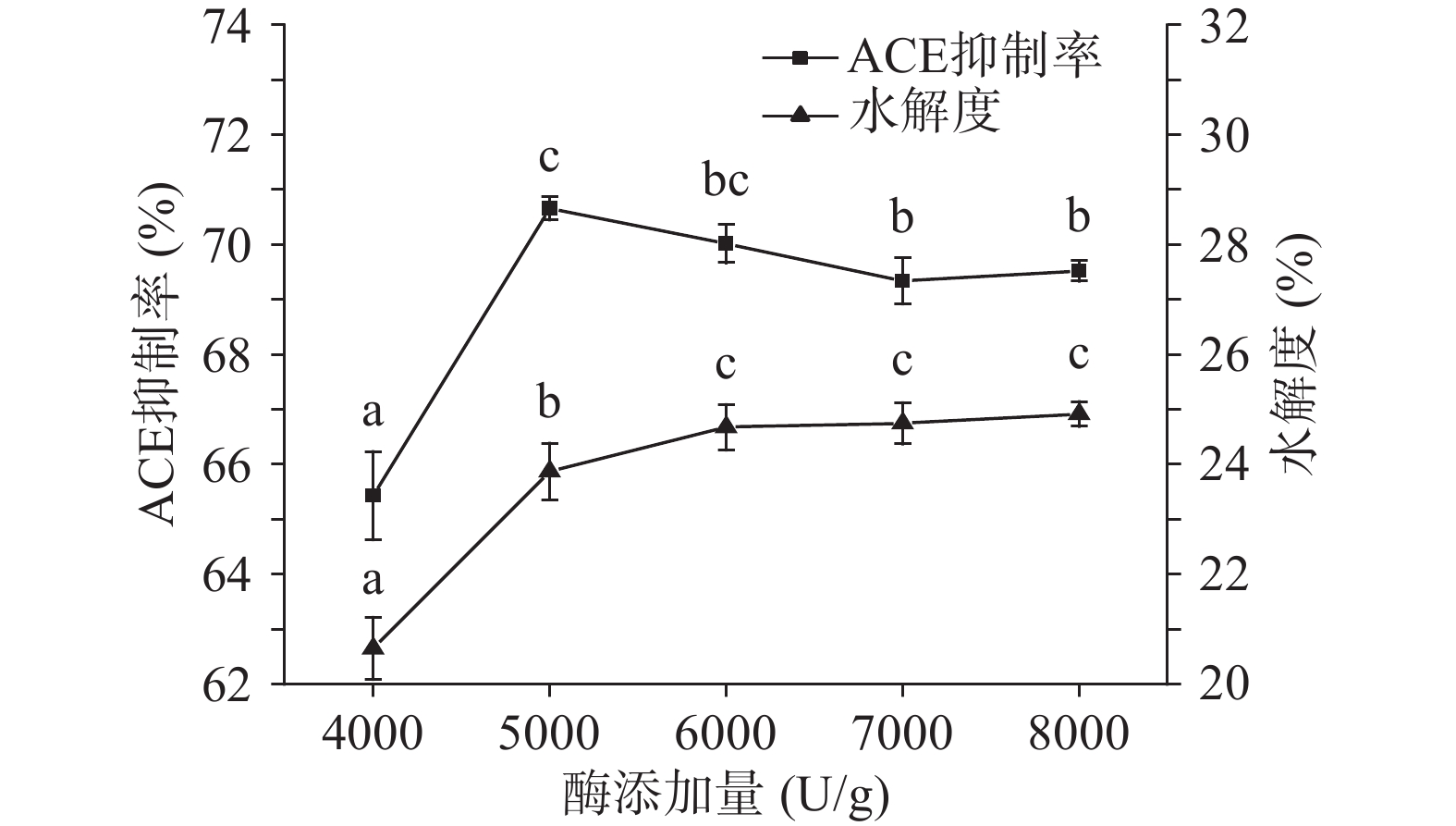
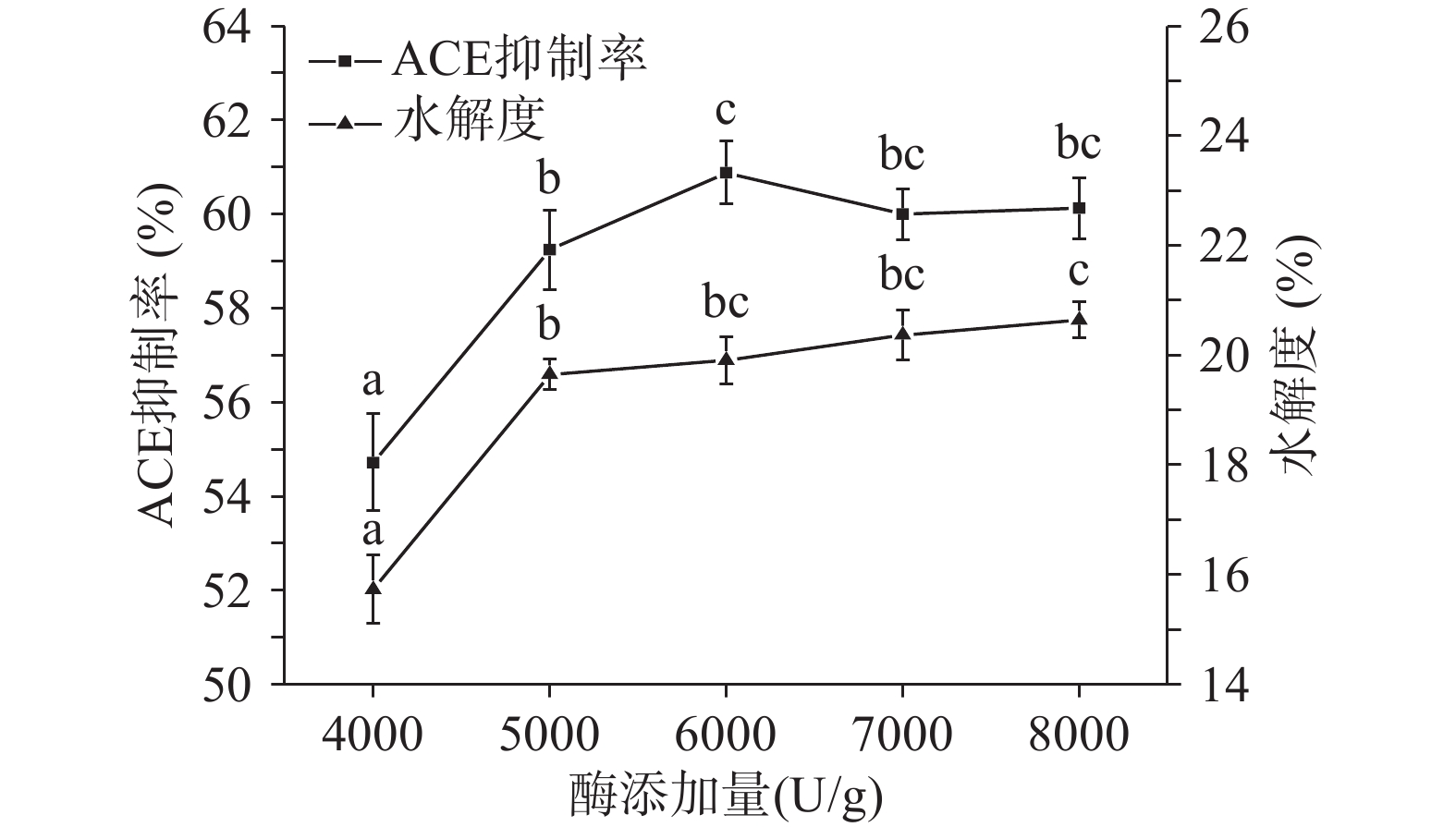
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标。中性蛋白酶的酶解条件确定为:酶解温度为55 ℃,底物浓度为3%,pH为7.0,酶解时间为60 min,加酶量分别设定为4000、5000、6000、7000、8000 U/g;碱性蛋白酶的酶解条件确定为:酶解温度为55 ℃,底物浓度为3%,pH为7.0,酶解时间为60 min,加酶量分别设定为4000、5000、6000、7000、8000 U/g。考察两者各自的酶添加量对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。
1.2.4.2 中性蛋白酶/碱性蛋白酶比例对酸枣仁蛋白酶解产物ACE抑制率和水解度的影响
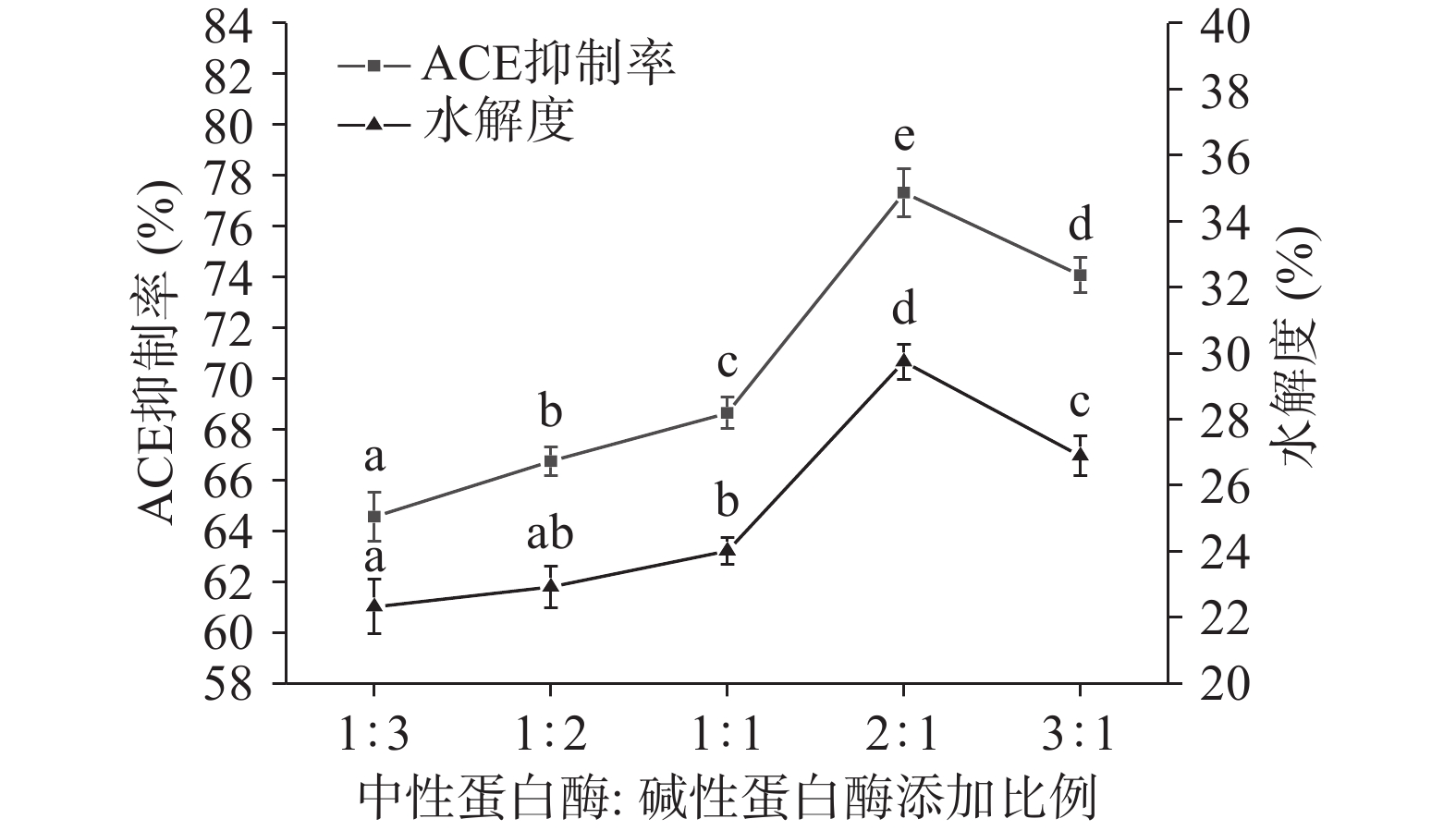
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标,酶解条件确定为:以中性蛋白酶和碱性蛋白酶为复合酶,复合酶加酶量为6000 U/g,酶解温度为55 ℃,底物浓度为3%,pH为7.0,酶解时间为60 min,中性蛋白酶和碱性蛋白酶比例分别设定为1:3、1:2、1:1、2:1、3:1,考察中性蛋白酶和碱性蛋白酶添加比例对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。
1.2.4.3 酶解温度对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响
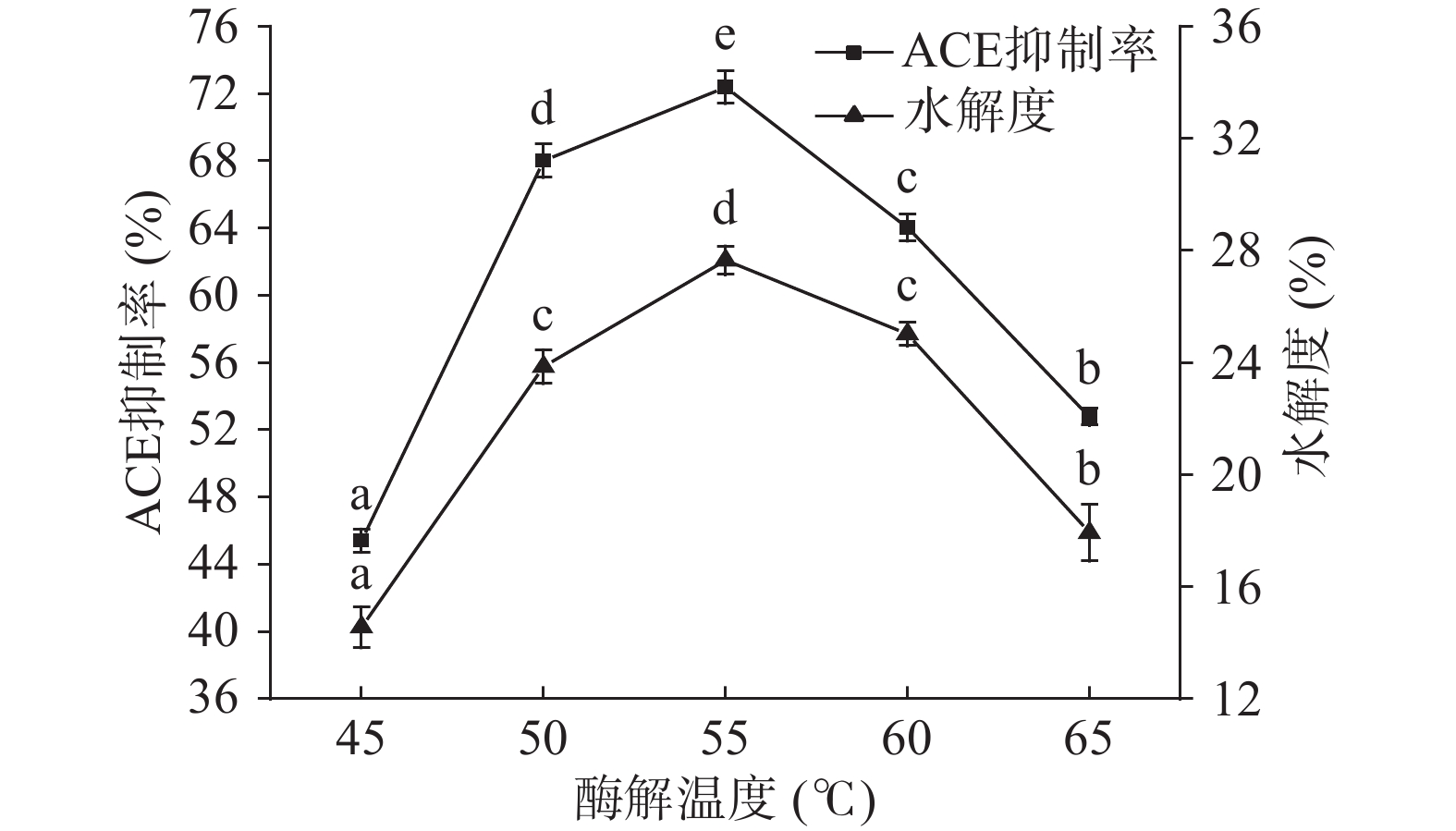
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标,固定条件为中性蛋白酶/碱性蛋白酶比例为1:1,加酶量为6000 U/g。考察酶解温度对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。按底物浓度为3%,pH为7.0,酶解时间为60 min,酶解温度分别设定为45、50、55、60、65 ℃试验。
1.2.4.4 底物浓度对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标,固定条件为中性蛋白酶/碱性蛋白酶比例为1:1,加酶量为6000 U/g。考察底物浓度对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。按酶解温度为55 ℃,pH为7.0,酶解时间为60 min,底物浓度分别设定为2.0%、3.0%、4.0%、5.0%、6.0%试验。
1.2.4.5 pH对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标,固定条件为中性蛋白酶/碱性蛋白酶比例为1:1,加酶量为6000 U/g。考察pH对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。按酶解温度为55 ℃,酶解时间为60 min,pH分别设定为6.0、6.5、7.0、7.5、8.0试验。
1.2.4.6 酶解时间对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响
以酸枣仁蛋白酶解产物的ACE抑制率和水解度为测量指标,固定条件为中性蛋白酶/碱性蛋白酶比例为1:1,加酶量为6000 U/g。考察酶解时间对酸枣仁蛋白酶解产物的ACE抑制率和水解度的影响。按底物浓度为3%,酶解温度为55 ℃,pH为7.0,酶解时间分别设定为40、50、60、70、80 min试验。
1.2.5 响应面试验
基于单因素实验基础上,采用Box-Behnken原理设计试验方案,以中性蛋白酶/碱性蛋白酶比例(A)、酶解温度(B)、底物浓度(C)、pH(D)、酶解时间(E)为影响因素,ACE抑制率(R1)、水解度DH(R2)为响应值,试验因素水平见表2。
表 2 因素水平表Table 2. Factor level table因素 水平 −1 0 1 A 中性蛋白酶/碱性蛋白酶比例 1:1 2:1 3:1 B 酶解温度(℃) 50 55 60 C 底物浓度(%) 2.0 3.0 4.0 D pH 7.0 7.5 8.0 E 时间(min) 50 60 70 1.2.6 ACE抑制率测定
采用Cushman等[28]测定方法,略有改进。配制0.1 mol/L硼酸盐缓冲液(pH8.3,含0.3 mol/L氯化钠):称取12.37 g硼酸溶于1 L去离子水中即为0.2 mol/L硼酸溶液;称取19.07 g硼砂溶于1 L去离子水中即为0.05 mol/L硼砂溶液;量取175 mL硼砂溶液和352 mL硼酸溶液混溶,加入17.532 g氯化钠,用1 mol/L的氢氧化钠或盐酸溶液调节溶液pH至8.3,同时用1 mol/L的氢氧化钠或盐酸溶液调节pH为8.3的去离子水定容至1 L,保证溶液pH的稳定。
马脲酰-组氨酸-亮氨酸(HHL)溶液配制:称取一定量HHL溶于硼酸盐缓冲溶液,配制成5 mg/mL的HHL溶液。取1 mL该浓度的HHL溶液,溶于1.4 mL硼酸盐缓冲溶液,配制成5 mmol/L的HHL溶液。
ACE抑制率测定步骤见表3,按表3中顺序和剂量依次加入试剂,在37 ℃恒温水浴锅水浴5 min后,加入一定量的ACE溶液混匀,再置于37 ℃恒温水浴锅水浴40 min,后加入50 μL、1 mol/L盐酸溶液使反应停止。随后加入0.9 mL乙酸乙酯,振荡混匀后静置,量取0.5 mL乙酸乙酯层液体置于1.5 mL离心管中,放置于100 ℃烘箱中充分挥发30 min。取出冷却至室温,加入1 mL去离子水,振荡混匀,每个孔打200 μL于石英96孔板中,用酶标仪测量228 nm波长下的吸光度值。ACE抑制率计算:
表 3 ACE抑制率测定步骤Table 3. Test procedure of ACE inhibition rate试剂 (μL) 样品 A1 A2 A3 25 mU/mL ACE 0 0 10 1 mol/L HCl 0 0 50 5 mmol/L HHL 30 30 30 ACE抑制剂 10 0 10 0.1 mol/L硼酸盐缓冲液 0 10 0 37 ℃恒温水浴锅水浴5 min 25 mU/mL ACE 10 10 0 37 ℃恒温水浴锅水浴40 min 1 mol/L HCl 50 50 0 乙酸乙酯 900 900 900 (1) 式中:A1表示加入ACE和酶解液的吸光度值;A2表示不加酶解液的吸光度值;A3表示加入盐酸使ACE失活后,加入酶解液的吸光度值。
1.2.7 水解度(DH)的测定
采用Adlernissen[29]的pH-stat法测定酸枣仁蛋白酶解液的水解度,略有改动。利用pH自动控制仪调节酶解过程中酶解液的pH变化,统计碱液消耗量,计算水解度。计算公式为:
(2) 式中:V表示消耗的碱液体积,L;C表示碱液浓度,mol/L;α表示氨基平均解离度;M表示酸枣仁蛋白质量,g;htot表示酸枣仁蛋白肽键含量,mol/g。
1.2.8 ACE抑制作用实验
样品组为最优条件下酸枣仁蛋白酶解液,酶解前底物浓度为3%。阳性对照组为卡托普利,对照组浓度为3%。分别进行ACE抑制率实验,对比两组ACE抑制率。
1.3 数据处理
所有试验均重复3次,试验结果用平均值±标准差表示,使用OriginPro8.0、SPSS Statistics22.0对试验数据进行处理和分析。
2. 结果与分析
2.1 复合酶筛选结果
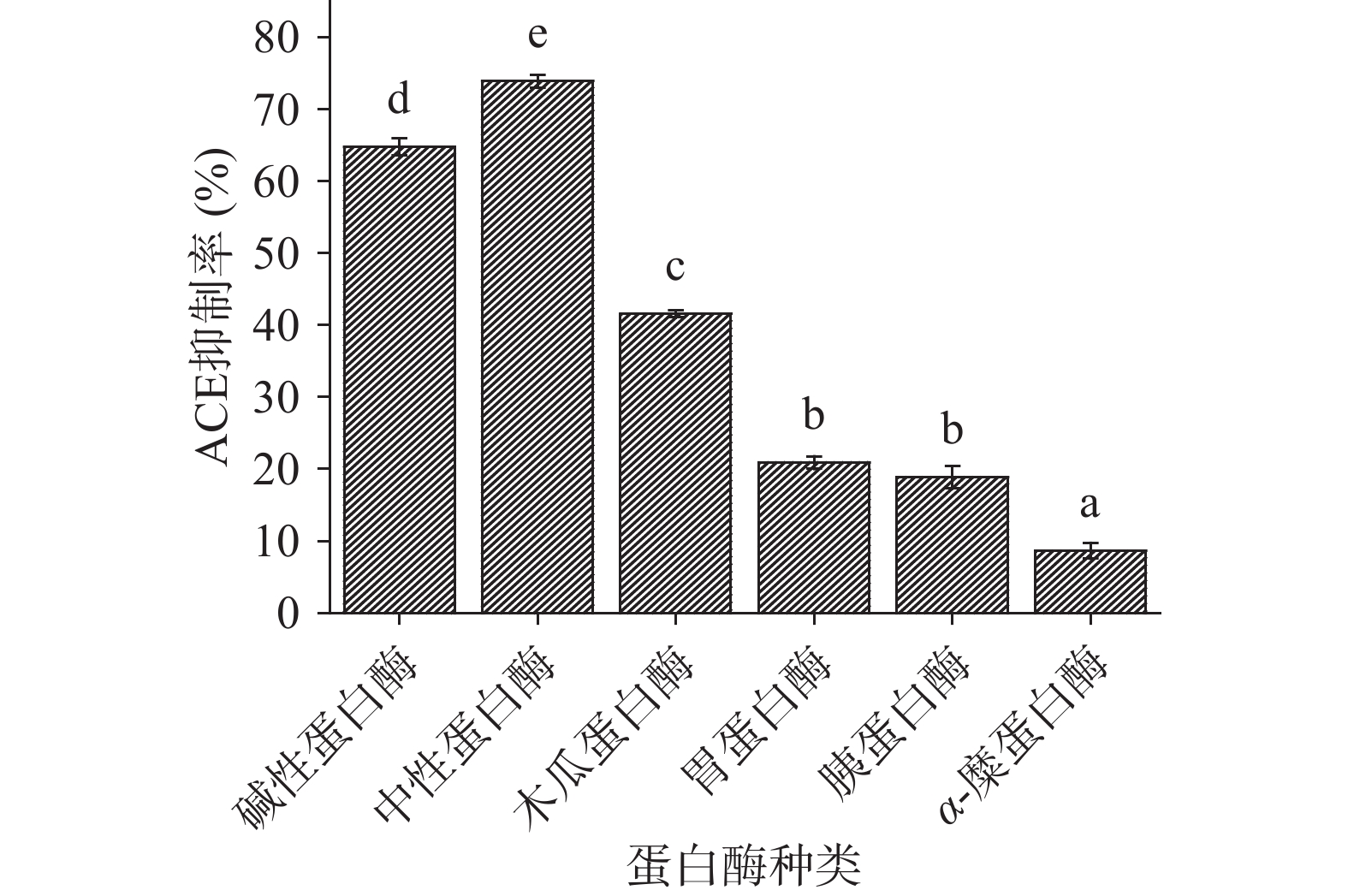
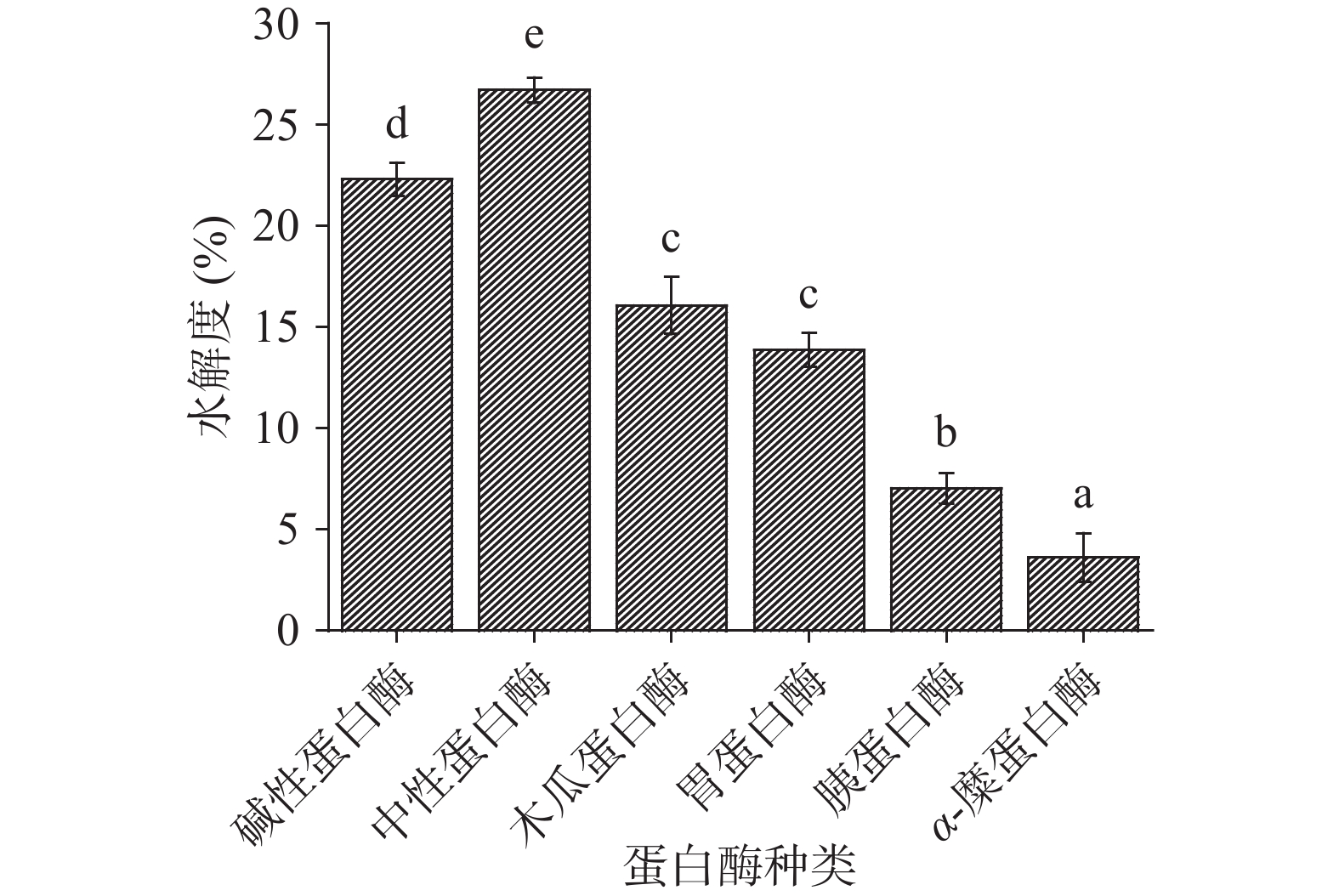
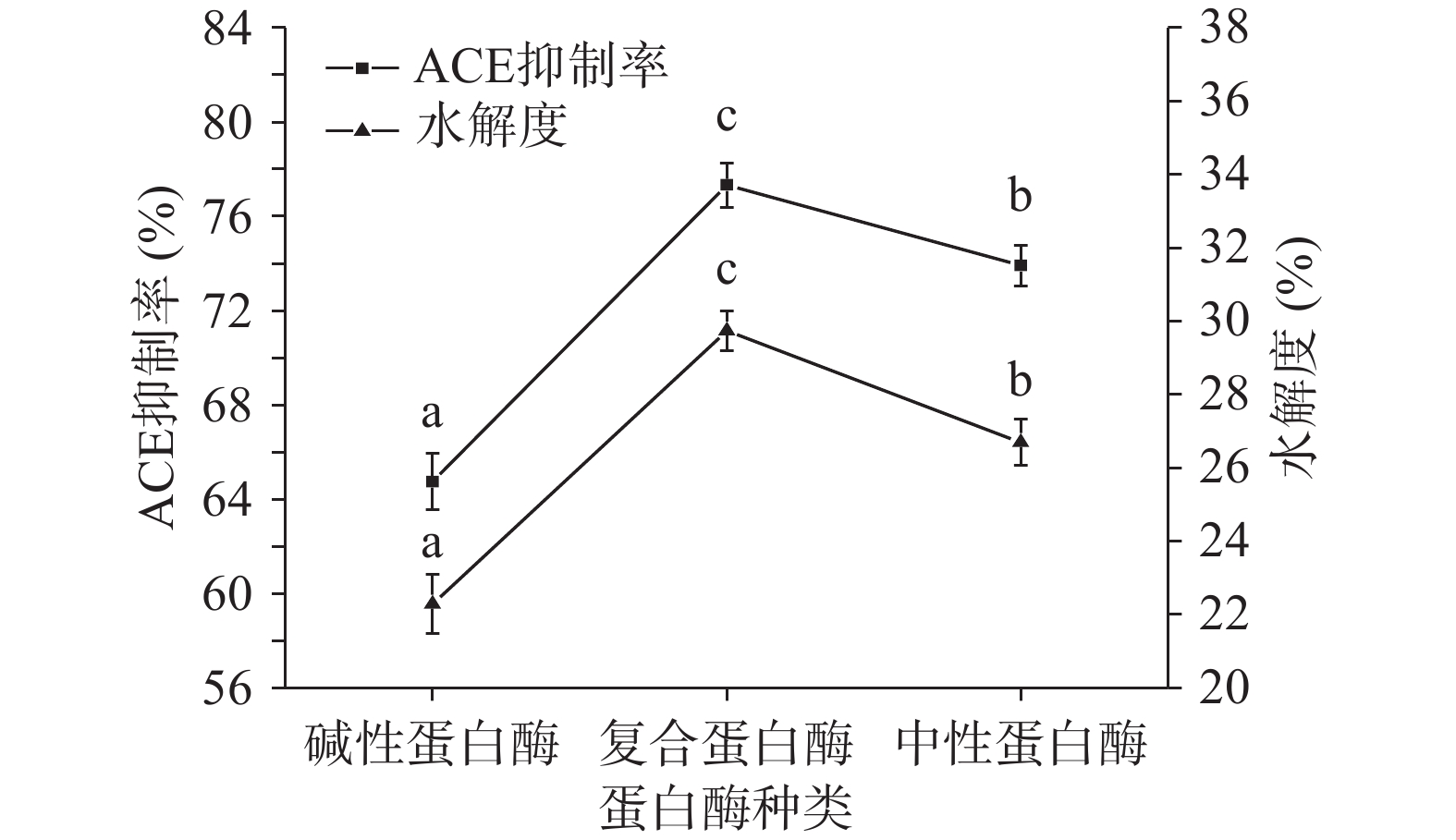
分别利用碱性蛋白酶、中性蛋白酶、α-糜蛋白酶、胰蛋白酶、木瓜蛋白酶、胃蛋白酶分别酶解酸枣仁蛋白,得到六种酶解液,测定各酶解液的ACE抑制率及水解度,测定结果如图1~图3所示。
由于不同蛋白酶对肽链的剪切位点不同,具有特异性,导致酶解得到的小分子肽段的分子量大小、分子量分布、极性基团、氨基酸组成都存在差异,进而功能性存在差异。由图1可知,对比六种蛋白酶对ACE抑制率的影响,发现使用中性蛋白酶后,其ACE抑制率最高且为(73.91%±1.26%),中性蛋白酶与其他蛋白酶的酶解产物的ACE抑制率方面存在显著性差异(P<0.05),其次是使用碱性蛋白酶后的ACE抑制率大小为(64.75%±1.21%),仅次于中性蛋白酶,且与其余4种酶存在显著性差异(P<0.05)。由图2可知,对比六种蛋白酶对水解度的影响,发现使用中性蛋白酶后,其水解度最高且为(26.70%±1.43%),中性蛋白酶与其他蛋白酶的酶解产物的水解度存在显著性差异(P<0.05),其次是使用碱性蛋白酶后的水解度为(22.29%±1.55%),仅次于中性蛋白酶,且与其余4种酶存在显著性差异(P<0.05),ACE抑制率和水解度反映出不同蛋白酶存在特异性。由图3可知,通过碱性蛋白酶、复合蛋白酶(中性蛋白酶/碱性蛋白酶比例为1:1)、中性蛋白酶分别酶解酸枣仁蛋白,比较其对ACE抑制率和水解度的影响,发现复合蛋白酶酶解产物的ACE抑制率和水解度的影响显著(P<0.05)高于碱性蛋白酶和中性蛋白酶。综合考虑,选择复合酶即中性蛋白酶和碱性蛋白酶复合,进行后续酶比例的单因素试验和酸枣仁蛋白制备ACE抑制肽酶解工艺优化。
2.2 单因素实验
2.2.1 酶添加量对ACE抑制率和水解度的影响
由图4和图5可知随着中性蛋白酶和碱性蛋白酶的添加量增加,ACE抑制率和水解度随之升高,在酶添加量分别为5000 U/g和6000 U/g时,ACE抑制率开始降低后趋于平缓,这是因为过量的中性蛋白酶开始分解具有ACE抑制活性的多肽,使其功能活性发生改变,ACE抑制率升高,但酶的结合位点具有特异性,酶与蛋白质的结合达到饱和状态,使酶添加量继续升高而趋于平缓。由于中性蛋白酶添加量为5000和6000 U/g时无明显差异,所以在ACE抑制率方面选择中性蛋白酶和碱性蛋白酶复合酶添加量同为6000 U/g。水解度在中性蛋白酶和碱性蛋白酶的酶添加量分别为6000和5000 U/g时则趋于平缓,且两种酶添加量在6000、7000、8000 U/g不存在显著性差异(P˃0.05),推测是由于在6000 U/g时溶液里的酶达到饱和,再增加酶量只会提高酶解速率而不会提高水解程度,所以从实际生产成本考虑,在水解度方面选择中性蛋白酶和碱性蛋白酶的最适酶添加量为6000 U/g,综合确定最适酶添加量为6000 U/g。由于水解度越高,说明酶解越充分,其主要酶解产物为3000 Da以下小分子蛋白含量越高,相关研究表明具备降压效果的多肽分子量主要集中在1000~3000 Da[30-32],所以ACE抑制率与水解度变化趋势相近。
2.2.2 中性蛋白酶/碱性蛋白酶比例对ACE抑制率和水解度的影响
由图6可知,中性蛋白酶和碱性蛋白酶添加比例为2:1时,ACE抑制率和水解度最高且分别为(77.33%±1.37%)和(29.74%±0.92%),且与其他比例和单一酶解的ACE抑制率和水解度均存在显著性差异。这是由于两种蛋白酶分别作用于不同位点,且共同作用比单一作用所得到的酶解产物更为复杂,导致酶解产物的空间结构和生物活性改变,所以在ACE抑制率和水解度方面均有提高。故选择复合酶添加比例即中性蛋白酶和碱性蛋白酶两者的添加比例为2:1为最优比例。
2.2.3 酶解温度对ACE抑制率和水解度的影响
由图7可知,ACE抑制率和水解度随着温度的升高而增大,当温度为55 ℃时,ACE抑制率和水解度分别达到最高,此时酶活达到最优。后续ACE抑制率和水解度随着温度的升高而降低,这是由于温度继续升高,蛋白酶结构遭到破坏而导致酶活减弱,且酶解产物的活性、稳定性降低[33],所以ACE抑制率和水解度随之降低。故选择最优酶解温度为55 ℃。
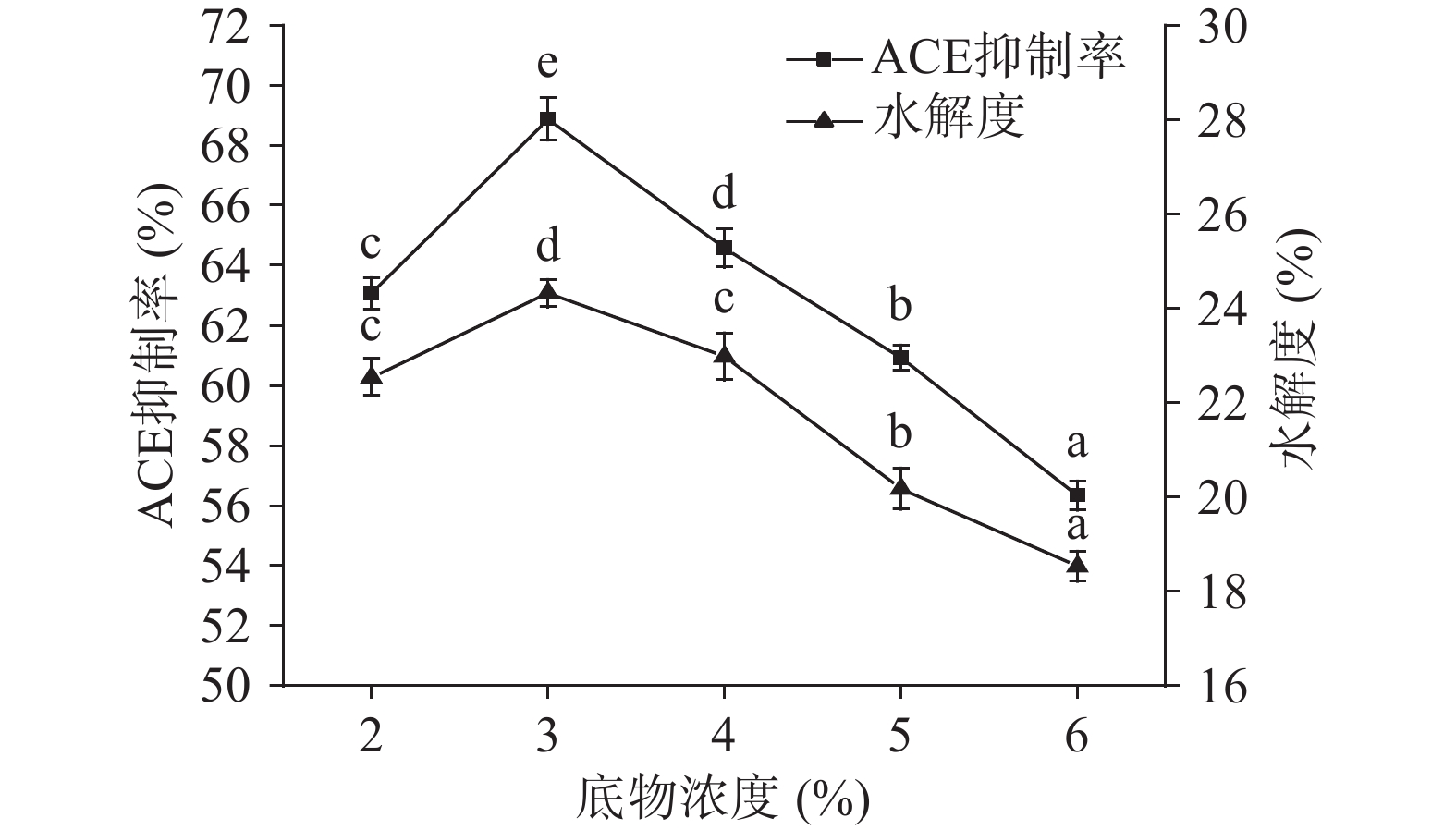
2.2.4 底物浓度对ACE抑制率和水解度的影响
由图8可知,ACE抑制率和水解度随着底物浓度的升高而增大,当底物浓度为3%时两者同时达到最高,随后ACE抑制率和水解度随着底物浓度的升高随之下降,这是因为底物浓度过高导致体系黏度升高,从而使酶分子与底物扩散不充分,所以不利于酶解反应[34]。故选择3%为最优底物浓度。
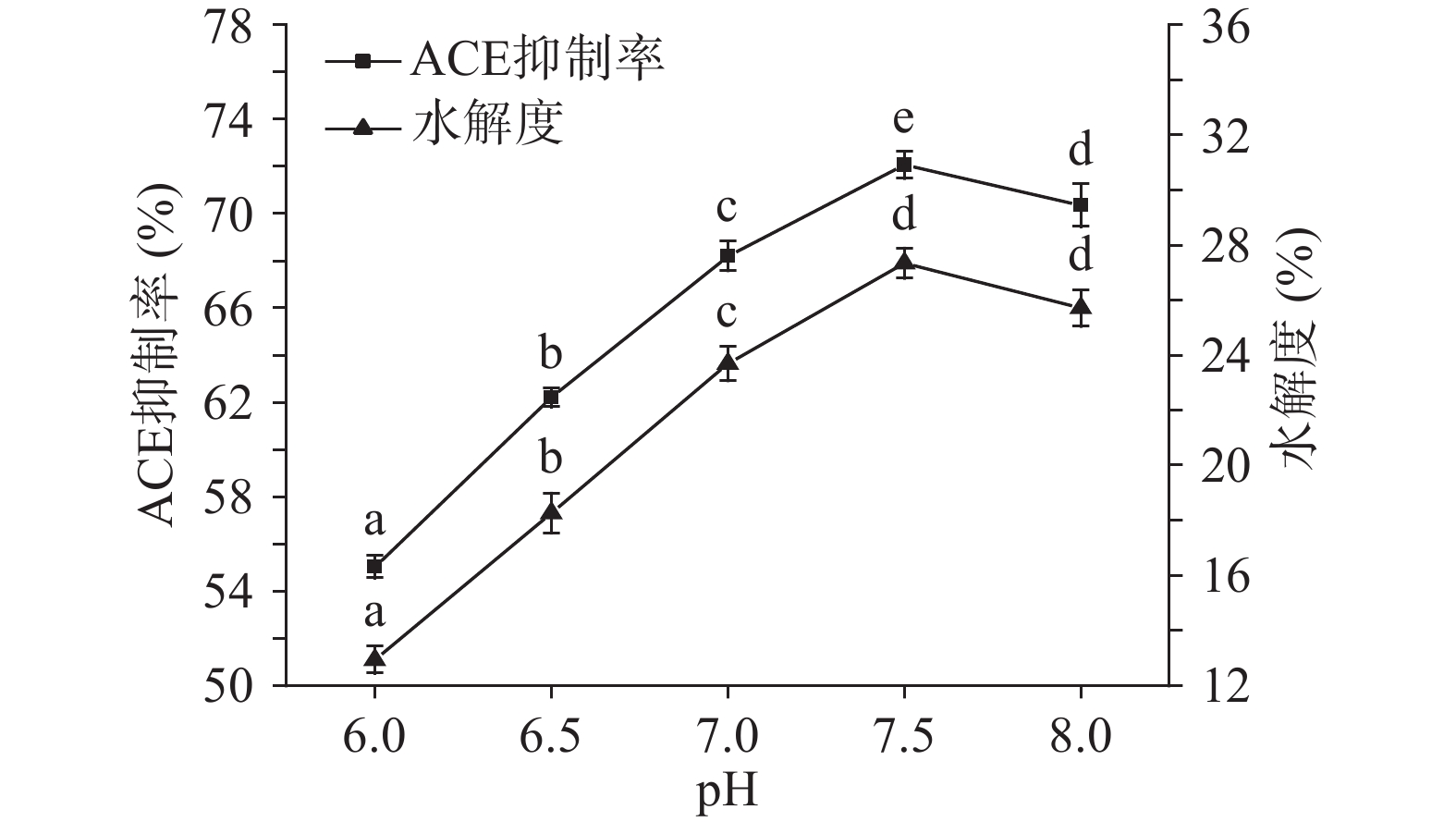
2.2.5 pH对ACE抑制率和水解度的影响
由图9可知,ACE抑制率和水解度随着pH的升高而增大,在pH为7.5时两者同时达到最高,且此时酶活最高。后随着pH的升高ACE抑制率和水解度也随之降低,这是因为酶具有最适pH,不适pH会导致酶的空间结构遭到不同程度的破坏,致使酶活降低,进而影响ACE抑制率和水解度。故选择最优pH为7.5。
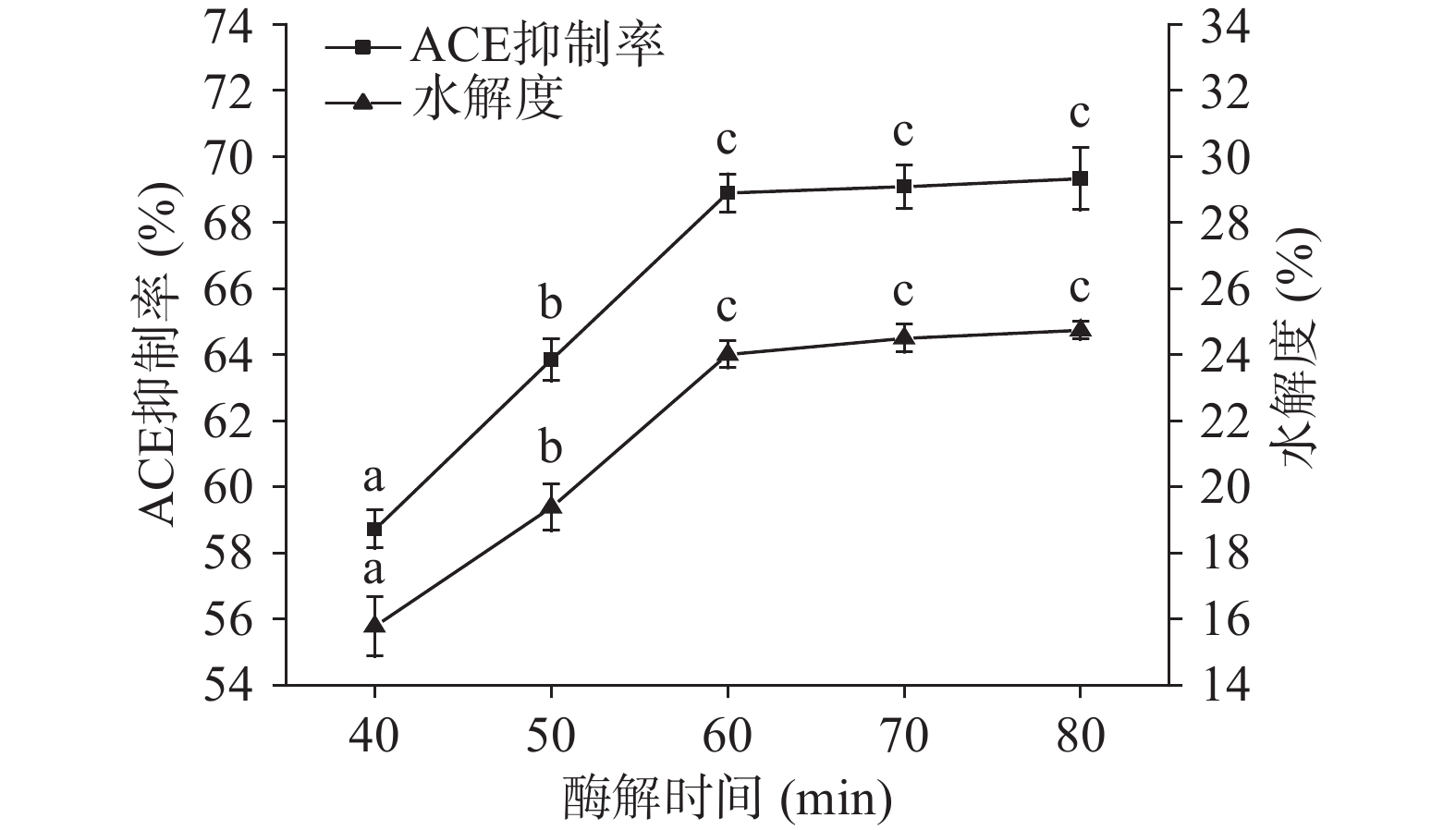
2.2.6 酶解时间对ACE抑制率和水解度的影响
由图10可知,随着酶解时间的增加,ACE抑制率和水解度逐渐升高,60 min后随着酶解时间的增加,ACE抑制率和水解度逐渐趋于平缓。水解度的变化原因是因为酶解时间较短时,蛋白分子被分解为质量分数较大的肽段,肽键快速断裂,酶解速度较快,随着酶解时间的增加,大分子的肽段被充分水解,剩余可水解的肽键数量减少,且底物与酶结合导致产生竞争性抑制作用[35]。而相关研究发现ACE抑制率与时间的关系常常随着水解度的变化而变化[36-38]。故选择最优酶解时间为60 min。
2.3 响应面试验结果
在单因素实验的基础上,根据Box-Behnken试验设计原理,确定5因素3水平的响应面分析方法,酸枣仁蛋白酶解响应面试验设计与结果见表4。
表 4 响应面试验设计与结果Table 4. Experimental design and results实验号 A B C D E ACE抑制率(R1,%) 水解度(R2,%) 1 0 0 1 0 1 73.98±1.41 26.41±1.09 2 0 −1 0 0 −1 69.66±1.72 26.74±1.34 3 0 0 0 0 0 79.18±0.88 31.13±1.23 4 1 0 0 0 −1 70.73±1.25 27.94±1.49 5 −1 0 0 0 −1 69.94±0.97 25.39±1.05 6 0 −1 1 0 0 73.15±1.01 27.54±0.82 7 −1 1 0 0 0 66.91±1.95 23.54±1.39 8 0 0 0 0 0 79.04±1.02 31.28±0.99 9 0 0 0 −1 1 71.12±0.84 25.51±1.21 10 0 0 0 −1 −1 68.46±1.55 24.29±1.37 11 0 0 1 −1 0 71.47±1.26 23.93±0.54 12 0 1 0 0 −1 64.57±1.33 24.11±1.28 13 0 0 −1 0 1 73.11±0.41 27.94±1.05 14 0 0 −1 1 0 71.34±1.27 24.45±1.36 15 −1 0 0 1 0 70.17±0.89 24.62±0.74 16 1 0 1 0 0 73.68±1.31 27.21±0.96 17 −1 0 0 −1 0 71.37±1.43 25.61±1.10 18 0 0 0 0 0 78.91±1.07 31.36±0.97 19 0 0 −1 0 −1 70.16±1.38 24.41±0.90 20 0 0 0 0 0 79.11±0.91 31.47±0.84 21 1 0 0 0 1 75.07±0.85 27.75±0.67 22 0 1 1 0 0 66.71±1.94 22.96±1.02 23 0 1 0 0 1 68.43±1.27 24.42±1.49 24 −1 0 1 0 0 72.65±1.20 26.09±1.24 25 0 0 0 1 −1 69.05±0.97 25.89±0.77 26 0 0 0 0 0 79.27±0.74 31.17±1.16 27 0 −1 −1 0 0 70.18±1.54 26.12±1.12 28 0 0 −1 −1 0 70.14±1.31 24.71±0.86 29 0 −1 0 −1 0 69.35±0.91 25.47±1.23 30 0 0 1 1 0 72.32±1.33 26.78±1.07 31 0 1 −1 0 0 68.07±1.52 23.98±0.94 32 0 0 1 0 −1 70.47±1.71 27.43±1.30 33 0 1 0 1 0 66.29±1.46 23.95±0.98 34 1 1 0 0 0 68.09±1.11 24.11±1.64 35 −1 0 −1 0 0 72.78±1.42 26.05±1.03 36 1 0 0 1 0 74.07±0.52 27.19±1.03 37 0 0 0 1 1 72.98±1.17 27.74±0.83 38 0 −1 0 1 0 70.25±1.20 26.03±1.19 39 1 0 −1 0 0 72.79±0.94 26.61±1.35 40 0 0 0 0 0 79.39±0.38 31.05±0.52 41 1 0 0 −1 0 69.92±1.72 23.82±1.58 42 1 −1 0 0 0 71.4±0.99 27.33±1.32 43 −1 −1 0 0 0 72.23±1.08 27.32±0.81 44 0 −1 0 0 1 71.29±0.81 28.31±1.06 45 −1 0 0 0 1 73.22±1.21 28.87±1.00 46 0 1 0 −1 0 64.88±164 21.73±0.49 2.3.1 ACE抑制率的回归模型建立与方差分析
通过表4试验数据,得到ACE抑制率(R1)的回归方程:
R1=79.15+0.40A−2.10B+0.37C+0.61D+1.64E+0.50AB+0.25AC+1.34AD+0.26AE−1.08BC+0.13BD+0.56BE−0.088CD+0.14CE+0.32DE−2.96A2−6.59B2−3.13C2−4.78D2−4.02E2,该回归方程的方差分析,结果见表5。
表 5 ACE抑制率(R1)回归模型方差分析Table 5. ACE inhibition rate (R1) regression model analysis of variance来源模型 平方和 自由度 均方 F值 P值 显著性 模型 628.59 20 31.43 336.24 <0.0001 极显著 A 2.62 1 2.62 28.08 <0.0001 极显著 B 70.39 1 70.39 753.06 <0.0001 极显著 C 2.15 1 2.15 22.96 <0.0001 极显著 D 5.95 1 5.95 63.69 <0.0001 极显著 E 42.77 1 42.77 457.57 <0.0001 极显著 AB 1.01 1 1.01 10.81 0.0030 极显著 AC 0.26 1 0.26 2.78 0.1078 不显著 AD 7.16 1 7.16 76.55 <0.0001 极显著 AE 0.28 1 0.28 3.01 0.0953 不显著 BC 4.69 1 4.69 50.14 < 0.0001 极显著 BD 0.065 1 0.065 0.70 0.4122 不显著 BE 1.24 1 1.24 13.30 0.0012 极显著 CD 0.031 1 0.031 0.33 0.5722 不显著 CE 0.078 1 0.078 0.84 0.3685 不显著 DE 0.40 1 0.40 4.31 0.0482 显著 A2 76.35 1 76.35 816.76 <0.0001 极显著 B2 378.75 1 378.75 4051.84 <0.0001 极显著 C2 85.28 1 85.28 912.37 <0.0001 极显著 D2 199.21 1 199.21 2131.19 <0.0001 极显著 E2 141.23 1 141.23 1510.85 <0.0001 极显著 残差 2.34 25 0.093 失拟 2.19 20 0.11 3.80 0.0720 不显著 误差 0.14 5 0.029 总和 630.93 45 注:极显著,P<0.01;显著,P<0.05;不显著,P>0.05;表6同。 该模型的F=628.59,P<0.0001差异极显著,且失拟项P=0.0720>0.05,不显著,决定系数为0.9963,拟合度程度较高。由表5回归模型系数的二次回归分析,剔除不显著项后得到的回归方程为:
R1=79.15+0.40A−2.10B+0.37C+0.61D+1.64E+0.50AB+1.34AD−1.08BC+0.56BE+0.32DE−2.96A2−6.59B2−3.13C2−4.78D2−4.02E2
分析对比一次项的F值,得出4个单因素对ACE抑制率影响大小顺序为:B>E>D>A>C,即酶解温度>酶解时间>pH>中性蛋白酶/碱性蛋白酶比例>底物浓度。在交互项中,AB、AD、BC、BE的交互作用对ACE抑制率的影响极显著(P<0.01),DE的交互作用对ACE抑制率的影响显著(P<0.05),AC、AE、BD、CD、CE的交互作用对ACE抑制率的影响不显著(P>0.05)。而对于模型的二次项来说均极显著(P<0.01)。
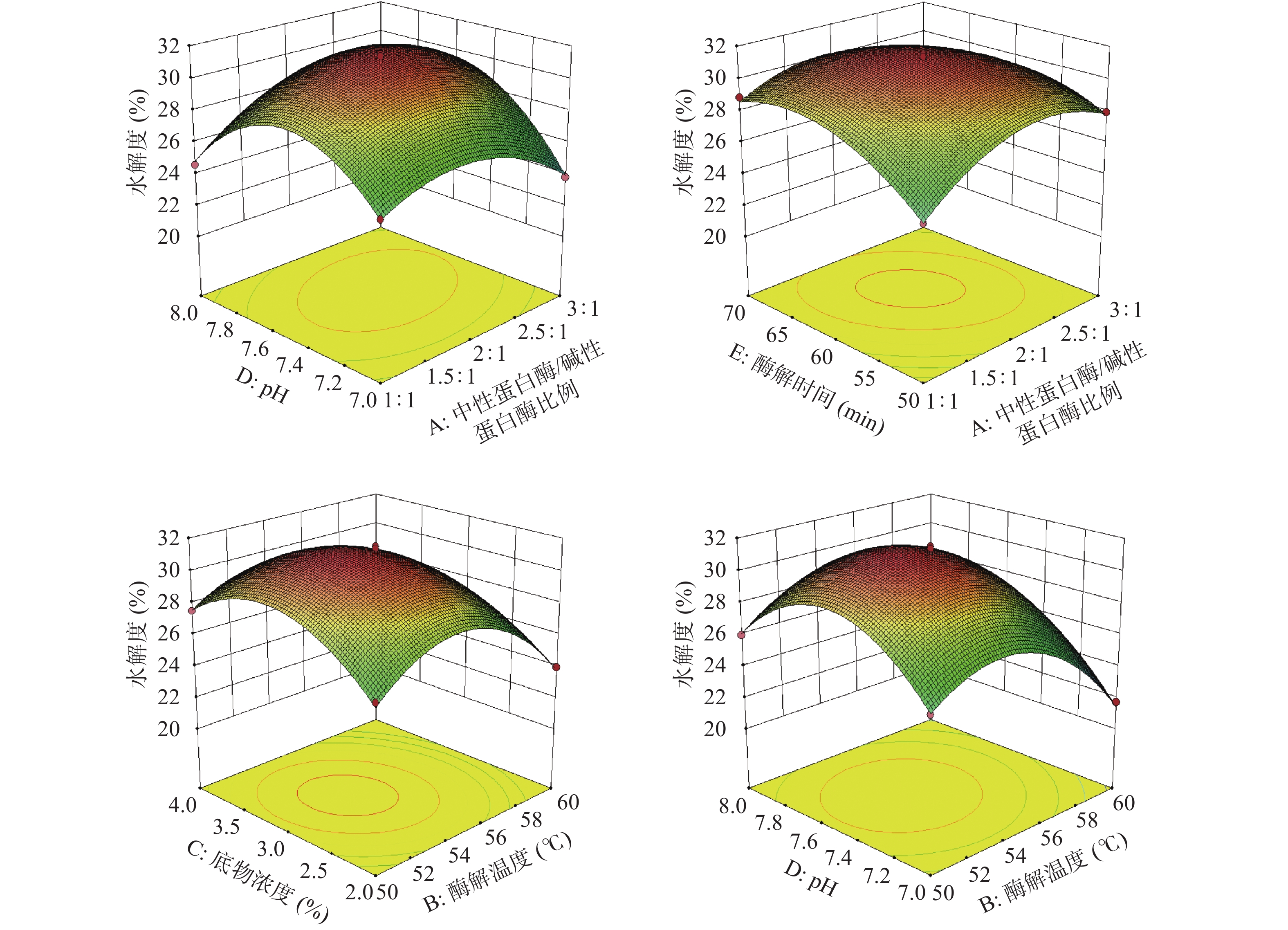
2.3.2 ACE抑制率响应面分析
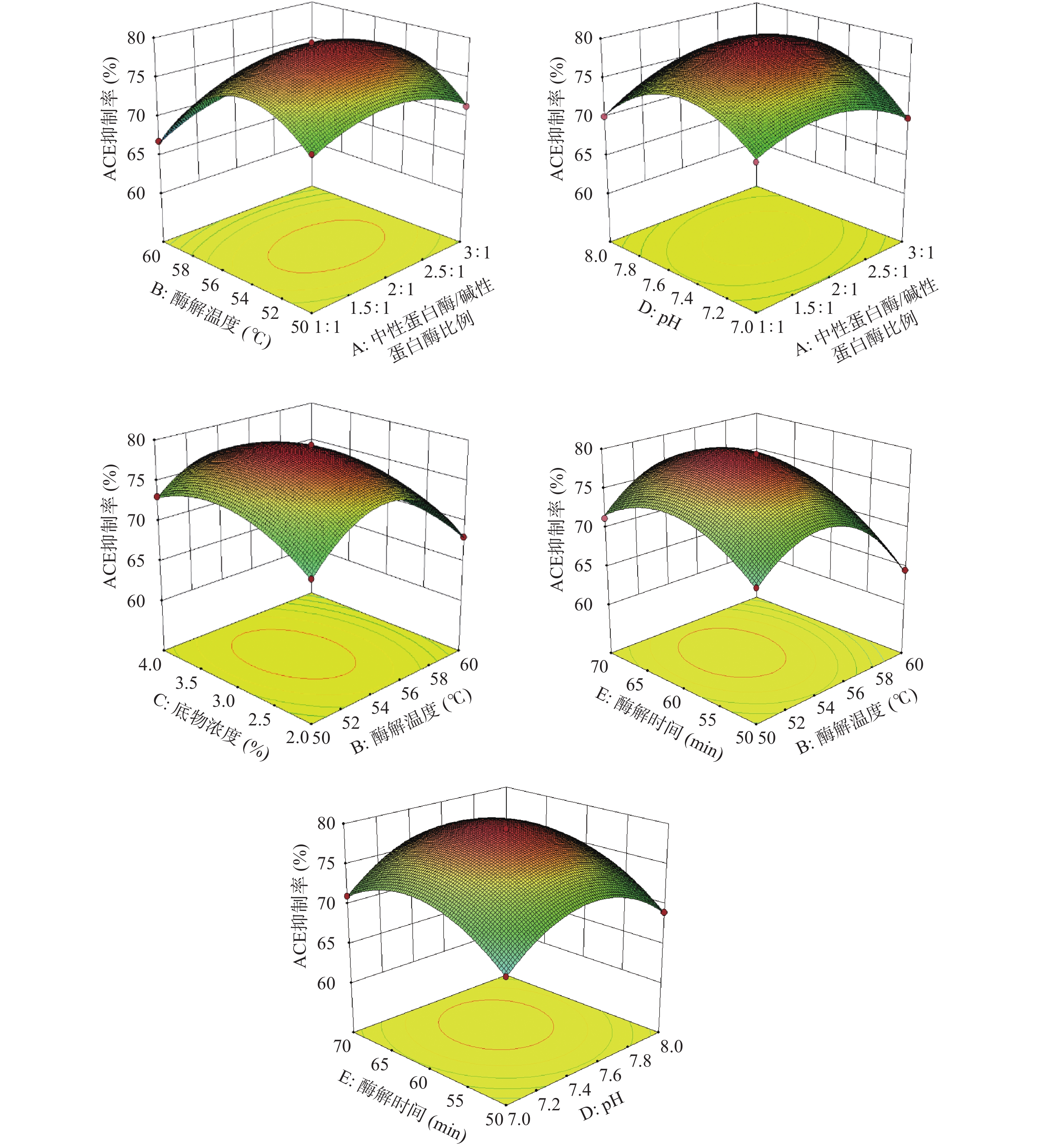
经Deign-Expert11软件处理,得到添加比例(A)、酶解温度(B)、底物浓度(C)、pH(D)和酶解时间(E)交互作用的响应面图。
由图11可知,ACE抑制率随着中性蛋白酶/碱性蛋白酶比例、酶解温度、底物浓度、pH、酶解时间的升高,ACE抑制率都出现先升高后减小的趋势,可以推断出获得较高ACE抑制率,中性蛋白酶/碱性蛋白酶比例应在2附近,酶解温度应在(54~56 ℃)之间,底物浓度应在3%附近,pH应在7.4~7.6之间,酶解时间应在60 min附近。
如图11所示,AB、AD、BC、BE交互作用下的等高线呈现曲线密集、较扁的椭圆形,且响应面的曲面降幅较大、走势陡峭,即表示AB、AD、BC、BE的交互作用对ACE抑制率影响为极显著(P<0.01);相较之下,DE交互作用下的等高线则出现较规则椭圆形且曲线较稀疏,响应面图伞形明显但降幅较小,表示DE的交互作用对ACE抑制率影响为显著(P<0.05),此都与方差分析结果吻合。
2.3.3 水解度的回归模型建立与方差分析
通过表4试验数据,得到水解度(R2)的回归方程:
R2=31.24+0.28A−1.63B+0.25C+0.72D+0.73E+0.14AB+0.14AC+1.09AD−0.92AE−0.61BC+0.41BD−0.31BE+0.78CD−1.14CE+0.16DE−2.13A2−3.39B2−2.72C2−3.63D2−1.76E2,该回归方程的方差分析,结果见表6。
表 6 水解度(R2)回归模型方差分析Table 6. Analysis of variance of degree of hydrolysis (R2) regression model来源模型 平方和 自由度 均方 F值 P值 显著性 模型 266.02 20 13.30 193.66 <0.0001 极显著 A 1.25 1 1.25 18.18 0.0003 极显著 B 42.45 1 42.45 618.01 <0.0001 极显著 C 1.04 1 1.04 15.15 0.0007 极显著 D 8.38 1 8.38 122.03 <0.0001 极显著 E 8.63 1 8.63 125.64 <0.0001 极显著 AB 0.078 1 0.078 1.14 0.2955 不显著 AC 0.078 1 0.078 1.14 0.2955 不显著 AD 4.75 1 4.75 69.20 <0.0001 极显著 AE 3.37 1 3.37 49.03 <0.0001 极显著 BC 1.49 1 1.49 21.67 <0.0001 极显著 BD 0.69 1 0.69 10.03 0.0040 极显著 BE 0.40 1 0.40 5.78 0.0240 显著 CD 2.42 1 2.42 35.21 <0.0001 极显著 CE 5.18 1 5.18 75.36 <0.0001 极显著 DE 0.099 1 0.099 1.44 0.2406 不显著 A2 40.45 1 40.45 588.98 <0.0001 极显著 B2 100.02 1 100.02 1456.37 <0.0001 极显著 C2 64.67 1 64.67 941.56 <0.0001 极显著 D2 115.02 1 115.02 1674.79 <0.0001 极显著 E2 27.07 1 27.07 394.18 <0.0001 极显著 残差 1.72 25 0.069 失拟 1.60 20 0.080 3.27 0.0964 不显著 误差 0.12 5 0.024 总和 267.73 45 该模型的F=266.02,P<0.0001差异极显著,且失拟项P=0.0964>0.05,不显著,决定系数为0.9936,拟合度程度较高。由表6回归模型系数的二次回归分析,剔除不显著项后得到的回归方程为:
R2=31.24+0.28A−1.63B+0.25C+0.72D+0.73E+1.09AD−0.92AE−0.61BC+0.41BD−0.31BE+0.78CD−1.14CE−2.15A2−3.39B2−2.72C2−3.63D2−1.76E2
分析对比一次项的F值,得出5个单因素对ACE抑制率影响大小顺序为:B>E>D>A>C,即酶解温度>酶解时间>pH>中性蛋白酶/碱性蛋白酶比例>底物浓度。在交互项中,AD、AE、BC、BD、CD、CE的交互作用对水解度的影响极显著(P<0.01),BE的交互作用对ACE抑制率的影响显著(P<0.05),AB、AC、DE的交互作用对ACE抑制率的影响不显著(P>0.05)。而对于模型的二次项来说均极显著(P<0.01)。
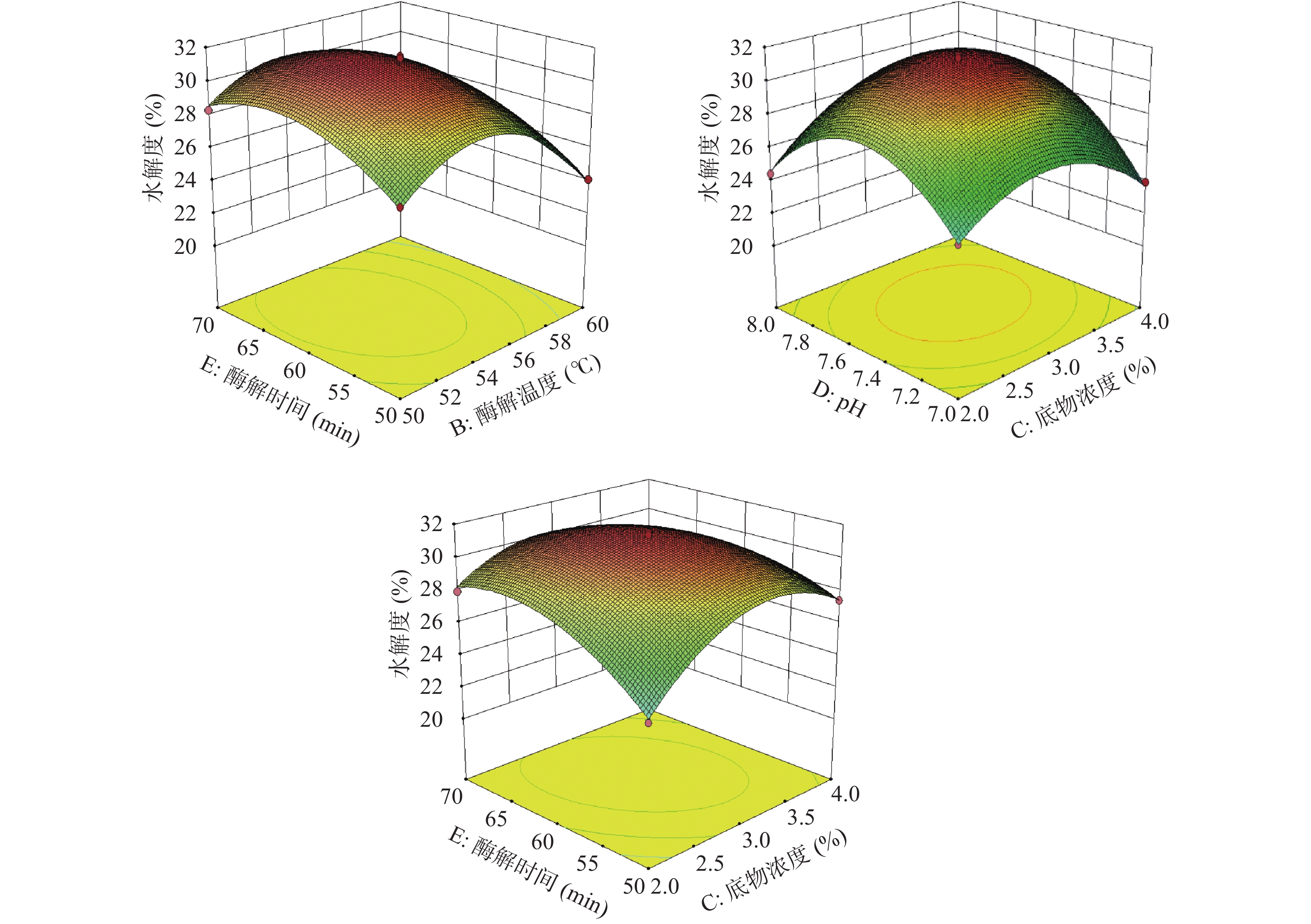
2.3.4 水解度抑制率响应面分析
经Deign-Expert11软件处理,得到添加比例(A)、酶解温度(B)、底物浓度(C)、pH(D)和酶解时间(E)交互作用的响应面及等高线图。
由图12可知,水解度随着中性蛋白酶/碱性蛋白酶比例、酶解温度、底物浓度、pH、酶解时间的升高,水解度都出现先升高后减小的趋势,可以推断出获得较高水解度,中性蛋白酶/碱性蛋白酶比例应在2附近,酶解温度应在(54~56 ℃)之间,底物浓度应在3%附近,pH应在7.4~7.6之间,酶解时间应在60 min附近。
如图12所示,AE、BC、BD、CD交互作用下的等高线呈较扁的椭圆形、曲线密集,AD、CE交互作用下的等高线的曲线中心较稀疏,但响应面降幅较大且走势陡峭,表示AE、BC、BD、CD、AD、CE的交互作用对水解度影响为极显著(P<0.01);相较之下,BE交互作用下的等高线的曲线中心较稀疏且响应面降幅较小,表示BE的交互作用对水解度影响为显著(P<0.05),此都与方差分析结果吻合。
由所得到的模型,经Design-Expert11软件处理得到ACE抑制率和水解度最高的相应各参数值为:中性蛋白酶/碱性蛋白酶比例为2.06:1,酶解温度为54.03 ℃,底物浓度为3.07%,pH为7.54,酶解时间为61.84 min,最大理论ACE抑制率为79.52%,最大理论水解度为31.54%。经过修正确定最终工艺参数为液料比中性蛋白酶/碱性蛋白酶比例为2.1:1、酶解温度为54 ℃,底物浓度为3.1%,pH为7.5,酶解时间为62 min。此条件下重复进行3次试验,ACE平均抑制率为(79.46%±0.49%),平均水解度为(31.45%±0.85%),两者与理论值接近,表明该回归模型对优化ACE抑制率和水解度的工艺可行,可用于指导实际生产。
2.4 ACE抑制作用实验结果
样品组在最优酶解条件下,ACE抑制率大小为(79.46%±0.49%),而阳性对照组卡托普利的ACE抑制率大小为(98.74%±0.61%),虽然样品组ACE抑制率低于阳性对照组,但证明酸枣仁ACE抑制肽具有显著降压效果(P<0.05)。由于本试验中酸枣仁蛋白酶解液中为杂蛋白,未进行分离纯化,所以不以多肽浓度定义,而是以酶解前底物浓度定义,同样,本试验对照卡托普利仅为定性试验,具体定量还需后续体外试验。
3. 结论
通过测定六种蛋白酶与复合蛋白酶(中性蛋白酶:碱性蛋白酶为1:1)分别酶解酸枣仁蛋白得到的酶解产物的ACE抑制率和水解度,结果表明复合蛋白酶酶解后酸枣仁蛋白酶解产物的ACE抑制率和水解度都显著高于其它组,故确定中性蛋白酶和碱性蛋白酶作为复合蛋白酶来优化酶解工艺。确定复合酶的酶添加量为6000 U/g。
经Design-Expert11软件分析得出5个因素对ACE抑制率和水解度影响由大到小的顺序为:酶解温度、酶解时间、pH、添加比例、底物浓度。由得到的回归模型对酸枣仁蛋白酶解工艺进行优化,得出最佳提取工艺条件为中性蛋白酶/碱性蛋白酶比例为2.1:1、酶解温度为54 ℃,底物浓度为3.1%,pH为7.5,酶解时间为62 min。此条件下进行3次验证试验,ACE平均抑制率为(79.46%±0.49%),平均水解度为(31.45%±0.85%),与理论值较为接近,表明该回归模型对优化酸枣仁蛋白酶解制备酸枣仁ACE抑制肽工艺可行,较前人的研究,补足了复合酶解酸枣仁蛋白制备ACE抑制肽的空白,为酸枣仁废物再利用提供新的研究思路。在与卡托普利进行对比实验中,侧面证明酸枣仁ACE抑制肽具有显著降压效果,由于此对比试验仅为定性试验,若证明实际降压效果,仍需开展后续动物试验。
-
表 1 6种蛋白酶酶解条件
Table 1 Conditions for enzymatic hydrolysis of six proteases
酶种类 加酶量(U/g) 酶解温度(℃) 底物浓度(%) pH 时间(min) 碱性蛋白酶 5000 55 3.0 7.0 60 中性蛋白酶 5000 55 3.0 7.0 60 胃蛋白酶 5000 37 3.0 4.5 60 胰蛋白酶 5000 37 3.0 8.0 60 木瓜蛋白酶 5000 55 3.0 7.0 60 α-糜蛋白酶 5000 37 3.0 7.5 60 表 2 因素水平表
Table 2 Factor level table
因素 水平 −1 0 1 A 中性蛋白酶/碱性蛋白酶比例 1:1 2:1 3:1 B 酶解温度(℃) 50 55 60 C 底物浓度(%) 2.0 3.0 4.0 D pH 7.0 7.5 8.0 E 时间(min) 50 60 70 表 3 ACE抑制率测定步骤
Table 3 Test procedure of ACE inhibition rate
试剂 (μL) 样品 A1 A2 A3 25 mU/mL ACE 0 0 10 1 mol/L HCl 0 0 50 5 mmol/L HHL 30 30 30 ACE抑制剂 10 0 10 0.1 mol/L硼酸盐缓冲液 0 10 0 37 ℃恒温水浴锅水浴5 min 25 mU/mL ACE 10 10 0 37 ℃恒温水浴锅水浴40 min 1 mol/L HCl 50 50 0 乙酸乙酯 900 900 900 表 4 响应面试验设计与结果
Table 4 Experimental design and results
实验号 A B C D E ACE抑制率(R1,%) 水解度(R2,%) 1 0 0 1 0 1 73.98±1.41 26.41±1.09 2 0 −1 0 0 −1 69.66±1.72 26.74±1.34 3 0 0 0 0 0 79.18±0.88 31.13±1.23 4 1 0 0 0 −1 70.73±1.25 27.94±1.49 5 −1 0 0 0 −1 69.94±0.97 25.39±1.05 6 0 −1 1 0 0 73.15±1.01 27.54±0.82 7 −1 1 0 0 0 66.91±1.95 23.54±1.39 8 0 0 0 0 0 79.04±1.02 31.28±0.99 9 0 0 0 −1 1 71.12±0.84 25.51±1.21 10 0 0 0 −1 −1 68.46±1.55 24.29±1.37 11 0 0 1 −1 0 71.47±1.26 23.93±0.54 12 0 1 0 0 −1 64.57±1.33 24.11±1.28 13 0 0 −1 0 1 73.11±0.41 27.94±1.05 14 0 0 −1 1 0 71.34±1.27 24.45±1.36 15 −1 0 0 1 0 70.17±0.89 24.62±0.74 16 1 0 1 0 0 73.68±1.31 27.21±0.96 17 −1 0 0 −1 0 71.37±1.43 25.61±1.10 18 0 0 0 0 0 78.91±1.07 31.36±0.97 19 0 0 −1 0 −1 70.16±1.38 24.41±0.90 20 0 0 0 0 0 79.11±0.91 31.47±0.84 21 1 0 0 0 1 75.07±0.85 27.75±0.67 22 0 1 1 0 0 66.71±1.94 22.96±1.02 23 0 1 0 0 1 68.43±1.27 24.42±1.49 24 −1 0 1 0 0 72.65±1.20 26.09±1.24 25 0 0 0 1 −1 69.05±0.97 25.89±0.77 26 0 0 0 0 0 79.27±0.74 31.17±1.16 27 0 −1 −1 0 0 70.18±1.54 26.12±1.12 28 0 0 −1 −1 0 70.14±1.31 24.71±0.86 29 0 −1 0 −1 0 69.35±0.91 25.47±1.23 30 0 0 1 1 0 72.32±1.33 26.78±1.07 31 0 1 −1 0 0 68.07±1.52 23.98±0.94 32 0 0 1 0 −1 70.47±1.71 27.43±1.30 33 0 1 0 1 0 66.29±1.46 23.95±0.98 34 1 1 0 0 0 68.09±1.11 24.11±1.64 35 −1 0 −1 0 0 72.78±1.42 26.05±1.03 36 1 0 0 1 0 74.07±0.52 27.19±1.03 37 0 0 0 1 1 72.98±1.17 27.74±0.83 38 0 −1 0 1 0 70.25±1.20 26.03±1.19 39 1 0 −1 0 0 72.79±0.94 26.61±1.35 40 0 0 0 0 0 79.39±0.38 31.05±0.52 41 1 0 0 −1 0 69.92±1.72 23.82±1.58 42 1 −1 0 0 0 71.4±0.99 27.33±1.32 43 −1 −1 0 0 0 72.23±1.08 27.32±0.81 44 0 −1 0 0 1 71.29±0.81 28.31±1.06 45 −1 0 0 0 1 73.22±1.21 28.87±1.00 46 0 1 0 −1 0 64.88±164 21.73±0.49 表 5 ACE抑制率(R1)回归模型方差分析
Table 5 ACE inhibition rate (R1) regression model analysis of variance
来源模型 平方和 自由度 均方 F值 P值 显著性 模型 628.59 20 31.43 336.24 <0.0001 极显著 A 2.62 1 2.62 28.08 <0.0001 极显著 B 70.39 1 70.39 753.06 <0.0001 极显著 C 2.15 1 2.15 22.96 <0.0001 极显著 D 5.95 1 5.95 63.69 <0.0001 极显著 E 42.77 1 42.77 457.57 <0.0001 极显著 AB 1.01 1 1.01 10.81 0.0030 极显著 AC 0.26 1 0.26 2.78 0.1078 不显著 AD 7.16 1 7.16 76.55 <0.0001 极显著 AE 0.28 1 0.28 3.01 0.0953 不显著 BC 4.69 1 4.69 50.14 < 0.0001 极显著 BD 0.065 1 0.065 0.70 0.4122 不显著 BE 1.24 1 1.24 13.30 0.0012 极显著 CD 0.031 1 0.031 0.33 0.5722 不显著 CE 0.078 1 0.078 0.84 0.3685 不显著 DE 0.40 1 0.40 4.31 0.0482 显著 A2 76.35 1 76.35 816.76 <0.0001 极显著 B2 378.75 1 378.75 4051.84 <0.0001 极显著 C2 85.28 1 85.28 912.37 <0.0001 极显著 D2 199.21 1 199.21 2131.19 <0.0001 极显著 E2 141.23 1 141.23 1510.85 <0.0001 极显著 残差 2.34 25 0.093 失拟 2.19 20 0.11 3.80 0.0720 不显著 误差 0.14 5 0.029 总和 630.93 45 注:极显著,P<0.01;显著,P<0.05;不显著,P>0.05;表6同。 表 6 水解度(R2)回归模型方差分析
Table 6 Analysis of variance of degree of hydrolysis (R2) regression model
来源模型 平方和 自由度 均方 F值 P值 显著性 模型 266.02 20 13.30 193.66 <0.0001 极显著 A 1.25 1 1.25 18.18 0.0003 极显著 B 42.45 1 42.45 618.01 <0.0001 极显著 C 1.04 1 1.04 15.15 0.0007 极显著 D 8.38 1 8.38 122.03 <0.0001 极显著 E 8.63 1 8.63 125.64 <0.0001 极显著 AB 0.078 1 0.078 1.14 0.2955 不显著 AC 0.078 1 0.078 1.14 0.2955 不显著 AD 4.75 1 4.75 69.20 <0.0001 极显著 AE 3.37 1 3.37 49.03 <0.0001 极显著 BC 1.49 1 1.49 21.67 <0.0001 极显著 BD 0.69 1 0.69 10.03 0.0040 极显著 BE 0.40 1 0.40 5.78 0.0240 显著 CD 2.42 1 2.42 35.21 <0.0001 极显著 CE 5.18 1 5.18 75.36 <0.0001 极显著 DE 0.099 1 0.099 1.44 0.2406 不显著 A2 40.45 1 40.45 588.98 <0.0001 极显著 B2 100.02 1 100.02 1456.37 <0.0001 极显著 C2 64.67 1 64.67 941.56 <0.0001 极显著 D2 115.02 1 115.02 1674.79 <0.0001 极显著 E2 27.07 1 27.07 394.18 <0.0001 极显著 残差 1.72 25 0.069 失拟 1.60 20 0.080 3.27 0.0964 不显著 误差 0.12 5 0.024 总和 267.73 45 -
[1] 李强. 酸枣仁潜在效应成分研究[D]. 太原: 山西大学, 2017. LI Q. Study on potential effective components of jujube seed[D]. Taiyuan: Shanxi University, 2017.
[2] 刘静, 李贞, 刘海英. 酸枣仁氨基酸组成分析及营养评价[J]. 食品研究与开发,2016,37(20):20−22. [LIU J, LI Z, LIU H Y. Analysis of amino acid composition and nutrition evaluation of jujube seed[J]. Food Research and Development,2016,37(20):20−22. doi: 10.3969/j.issn.1005-6521.2016.20.006 [3] 赵越, 张孚嘉, 吴楠, 等. ACE抑制肽的研究进展[J]. 中国酿造,2020,39(1):6−11. [ZHAO Y, ZHANG F J, WU N, et al. Research progress of ACE inhibitory peptide[J]. China Brewing,2020,39(1):6−11. doi: 10.11882/j.issn.0254-5071.2020.01.002 [4] 操德群, 何艳丽, 余虹, 等. 海洋生物ACE抑制肽研究进展[J]. 核农学报,2017,31(5):927−937. [CAO D Q, HE Y L, YU H, et al. Research progress of ACE inhibitory peptides in marine organisms[J]. Journal of Nuclear Agriculture,2017,31(5):927−937. doi: 10.11869/j.issn.100-8551.2017.05.0927 [5] 李景, 陈定刚. 大豆蛋白源ACE抑制肽研究进展[J]. 粮食与油脂,2018,31(9):7−9. [LI J, CHEN D G. Research progress of ACE inhibitory peptide from soybean protein[J]. Cereals and Oils,2018,31(9):7−9. doi: 10.3969/j.issn.1008-9578.2018.09.003 [6] 梁婷婷, 佟立涛, 蒲华寅, 等. 动植物源蛋白体外消化产物结构性质及ACE抑制活性[J]. 食品科学,2018,39(4):6−12. [LIANG T T, TONG L T, PU H Y, et al. Structural properties and ACE inhibitory activity of in vitro digestible products of animal and plant proteins[J]. Food Science,2018,39(4):6−12. doi: 10.7506/spkx1002-6630-201804002 [7] 刘志国, 陈江源, 王亚林, 等. 玉米醇溶蛋白酶解制备ACE抑制肽的研究[J]. 食品研究与开发,2006,27(2):138−141. [LIU Z G, CHEN J Y, WANG Y L, et al. Study on preparation of ACE inhibitory peptide by zein glycolysis[J]. Food Research and Development,2006,27(2):138−141. doi: 10.3969/j.issn.1005-6521.2006.02.048 [8] 毛跟年, 周亚丽, 贺磊, 等. 魔芋ACE抑制肽酶法制备工艺研究[J]. 食品工业,2017,38(1):99−102. [MAO G N, ZHOU Y L, HE L, et al. Study on preparation technology of konjac ACE inhibitory peptidase[J]. Food Industry,2017,38(1):99−102. [9] 贺磊. 魔芋ACE抑制肽制备技术及理化性质研究[D]. 西安: 陕西科技大学, 2017. HE L. Study on preparation technology and physicochemical properties of ACE inhibitory peptide from taro[D]. Xi’an: Shanxi University of Science and Technology, 2017.
[10] 裴璞花, 安传相, 刘晓燕, 等. 酶解核桃蛋白制备降血压肽的工艺优化[J]. 食品研究与开发,2018,39(14):69−75. [PEI P H, AN C X, LIU X Y, et al. Optimization of enzymatic hydrolysis of walnut protein to prepare antihypertensive peptides[J]. Food Research and Development,2018,39(14):69−75. doi: 10.3969/j.issn.1005-6521.2018.14.013 [11] 宋凯强, 刘鹏莉, 郑振佳, 等. 大蒜降压肽的制备及超滤分离[J]. 食品工业科技,2019,40(19):73−80. [SONG K Q, LIU P L, ZHENG Z J, et al. Preparation and ultrafiltration separation of antihypertensive peptides from garlic[J]. Science and Technology of Food Industry,2019,40(19):73−80. [12] PRIYANTO A D, DOERKSEN R J, CHANG C I, et al. Screening discovery and characterization of angiotensin-I converting enzyme inhibitory peptides derived from proteolytic hydrolysate of bitter melon seed proteins[J]. Journal of Proteomics,2015,14(10):424−435.
[13] 于志鹏, 武思佳, 赵文竹, 等. 蛋清中ACE抑制肽的筛选及其作用机制[J]. 食品科学,2019,40(22):126−133. [YU Z, WU S J, ZHAO W Z, et al. Screening and mechanism of ACE inhibitory peptides in egg white[J]. Food Science,2019,40(22):126−133. doi: 10.7506/spkx1002-6630-20181109-118 [14] 尹歆, 邓放明. 鲢鱼蛋白制备ACE抑制肽的工艺优化[J]. 食品与机械,2012,28(2):147−151. [YIN X, DENG F M. Process optimization of preparation of ACE inhibitory peptide from silver carp protein[J]. Food & Machinery,2012,28(2):147−151. [15] 郑炯, 邓惠玲, 阚建全. 响应面法优化猪血红蛋白制备ACE抑制肽的酶解工艺条件[J]. 食品科学,2012,33(23):209−214. [ZHENG J, DENG H L, KAN J Q. Optimization of enzymatic hydrolysis conditions for preparation of ACE inhibitory peptide from porcine hemoglobin by response surface methodology[J]. Food Science,2012,33(23):209−214. [16] 周亚丽. 魔芋ACE抑制肽分离纯化及体外降血压活性研究[D]. 西安: 陕西科技大学, 2017. ZHOU Y L. Isolation and purification of ACE inhibitory peptides from konjac and study on blood pressure reducing activity in vitro[D]. Xi’an: Shanxi University of Science and Technology, 2017.
[17] 赵爽, 刘昆仑, 陈复生. 食源性ACE抑制肽研究进展[J]. 粮食与油脂,2017,30(3):37−40. [ZHAO S, LIU K L, CHEN F S. Research progress of ACE inhibitory peptide in food[J]. Grain and Oil,2017,30(3):37−40. doi: 10.3969/j.issn.1008-9578.2017.03.010 [18] THEWISSEN B G, PAULY A, CELUS I, et al. Inhibition of angiotensin I-converting enzyme by wheat gliadin hydrolysates[J]. Food Chemistry,2011,127(4):1653−1658. doi: 10.1016/j.foodchem.2010.11.171
[19] 吴楠, 双全, 许伟瀚. ACE抑制肽的制备及其结构对活性的影响[J]. 中国酿造,2016,35(11):54−58. [WU N, SHUANG Q, XU W H. Preparation of ACE inhibitory peptides and the effect of structure on activity[J]. China Brewing,2016,35(11):54−58. doi: 10.11882/j.issn.0254-5071.2016.11.011 [20] 王琳琳, 陈立, 李建科. 食源血管紧张素转化酶抑制肽研究进展[J]. 中国果菜,2020,40(6):71−76. [WANG L L, CHEN L, LI J K. Angiotensin converting enzyme inhibitory peptides from food sources[J]. China Fruit and Vegetables,2020,40(6):71−76. [21] HE H L, LIU D, MA C B. Review on the angiotensin-i-converting enzyme (ACE) inhibitor peptides from marine proteins[J]. Applied Biochemistry & Biotechnology,2013,169(3):738−749.
[22] VEN C, GRUPPEN H, BONT D. Optimisation of the angiotensin converting enzyme inhibition by whey protein hydrolysates using response surface methodology[J]. International Dairy Journal,2002,12(10):813−820. doi: 10.1016/S0958-6946(02)00077-8
[23] SARI M, GERD E V, JUHA MATTI P, et al. Angiotensin I-converting enzyme inhibitory and antioxidant properties of rapeseed hydrolysates[J]. Journal of Functional Foods,2012,4(3):575−583. doi: 10.1016/j.jff.2012.03.003
[24] PIHLANTO A, AKKANEN S, J KORHONEN H. ACE-inhibitory and antioxidant properties of potato (Solanum tuberosum)[J]. Food Chemistry,2008,109(1):104−120. doi: 10.1016/j.foodchem.2007.12.023
[25] 徐敏, 武爱群. 超声波协同双酶复合酶解米渣蛋白制备ACE抑制肽工艺研究[J]. 粮食与饲料工业,2019,1(1):1−7. [XU M, WU A Q. Study on synthesis of ACE inhibitory peptide by enzymatic hydrolysis of rice residue protein with ultrasonic wave and double enzyme[J]. Food and Feed Industry,2019,1(1):1−7. [26] 黄之镨, 马伟光. 酸枣仁及活性物质的药理研究进展[J]. 中国民族民间医药,2018,27(3):57−60. [HUANG Z P, MA W G. Progress of pharmacological research on jujube seed and active substance[J]. Chinese National Folk Medicine,2018,27(3):57−60. [27] 赵节昌. 响应面法优化酸枣仁蛋白提取工艺[J]. 食品科学,2013,34(16):134−138. [ZHAO J C. Optimization of extraction process of jujube kernel protein by response surface methodology[J]. Food Science,2013,34(16):134−138. doi: 10.7506/spkx1002-6630-201316027 [28] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology,1971,20(7):1637−1648. doi: 10.1016/0006-2952(71)90292-9
[29] ADLERNISSEN NISSEN J. Enzymatic hydrolysis of food proteins[J]. Canadian Medical Association Journal,1986,172(8):1783−1785.
[30] 王升光, 于帅, 孟凡刚, 等. 酶法制备大豆肽的相对分子量分布及降压作用研究[J]. 食品工业科技,2018,39(1):46−51. [WANG S G, YU S, MENG F G, et al. Study on relative molecular weight distribution and antihypertensive effect of soybean peptide prepared by enzymatic method[J]. Science and Technology of Food Industry,2018,39(1):46−51. [31] LIU X, ZHANG M, SHI Y, et al. Production of the angiotensin I converting enzyme inhibitory peptides and isolation of four novel peptides from jellyfish (Rhopilema esculentum) protein hydrolysate[J]. J Sci Food Agric,2016,96(9):3240−3248. doi: 10.1002/jsfa.7507
[32] 朱俊向, 于丁一, 宋玉凤, 等. 动物蛋白水解酶法制备南极磷虾多肽及其抗氧化活性[J]. 中国调味品,2019,44(4):104−107. [ZHU J X, YU D Y, SONG Y F, et al. Preparation and antioxidant activity of krill polypeptides from animal proteolytic enzymes[J]. Chinese Seasoning,2019,44(4):104−107. doi: 10.3969/j.issn.1000-9973.2019.04.022 [33] PRIPP A H, ARDOE Y. Modelling relationship between angiotensin-(I)-converting enzyme inhibition and the bitter taste of peptides[J]. Food Chemistry,2007,102(3):880−888. doi: 10.1016/j.foodchem.2006.06.026
[34] GONZALEZ TELLO P, CAMACHO F, ALAMEDA J E, et al. Enzymatic hydrolysis of whey proteins: I. Kinetic models[J]. Biotechnology & Bioengineering,1994,44(4):523−528.
[35] GUAN X, YAO H Y, CHENG Z X, et al. Some functional properties of oat bran protein concentrate modified by trypsin[J]. Food Chemistry,2007,101(1):163−170. doi: 10.1016/j.foodchem.2006.01.011
[36] KIM J M, WHANG J H, KIM K M, et al. Preparation of corn gluten hydrolysate with angiotensin I converting enzyme inhibitory activity and its solubility and moisture sorption[J]. Process Biochemistry,2004,39(8):989−994. doi: 10.1016/S0032-9592(03)00205-X
[37] MEGÍAS C, YUST M, PEDROCHE J, et al. Purification of an ACE inhibitory peptide after hydrolysis of sunflower (Helianthus annuus L. ) protein isolates[J]. Journal of Agricultural & Food Chemistry,2004,52(7):1928−1932.
[38] KIM S K, BYUN H G, PARK P J, et al. Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural & Food Chemistry,2001,49(6):2992.





 下载:
下载:

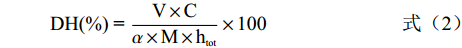
 下载:
下载:
