Effect of Combined Oyster Peptide and Ginseng Extracts on Improvement of Sexual Function and Anti-fatigue in Male Mice
-
摘要: 为初步探究牡蛎肽与人参提取物配伍对正常雄性小鼠性功能及运动疲劳的影响,本研究将ICR雄性小鼠随机分为6组,分别为空白组、牡蛎肽对照组(0.2 mg/g bw)、人参提取物对照组(0.2 mg/g bw)、3种剂量牡蛎肽与人参提取物配伍组(低、中、高剂量分别为0.1、0.2、0.6 mg/g bw),连续灌胃42 d,并在干预最后一天分别进行游泳和交配实验,测定抗疲劳及性功能相关生化指标。从性功能方面,与空白组相比,各处理组均不同程度增强小鼠交配能力(P<0.05);同等剂量配伍组小鼠交配能力较单组分对照组有所提升,但没有统计学差异(P>0.05);与空白组比较,中剂量配伍组使血清睾酮、促卵泡激素及阴茎海绵体中一氧化氮水平分别提高20.02%、19.92%和17.19%,显著降低海绵体中5型磷酸二酯酶含量(P<0.05),效果优于单组分对照组;免疫组化结果说明配伍组可不同程度上调睾丸组织中类固醇激素合成急性调节蛋白(StAR)和17β-羟类固醇脱氢酶(HSD17B3)的表达,但与空白组比较没有统计学差异(P>0.05)。从抗疲劳方面,中剂量配伍组显著降低乳酸(P<0.01)、尿素氮(P<0.05)和丙二醛含量(P<0.01),提高糖原含量(P<0.01),比单组分对照组的抗疲劳效果更明显。本研究发现牡蛎肽与人参提取物配伍在提高性功能及抗疲劳方面具有协同增效作用,有益于推动该领域功能食品产业发展。Abstract: This study aimed to explore the effects of the combination of oyster peptide and ginseng extracts (OPGE) on exercise fatigue and sexual function in normal male mice. In this experiment, ICR male mice were randomly divided into 6 groups, including control group, oyster peptide (0.2 mg/g bw, OP), ginseng extract (0.2 mg/g bw, GE), low dosage of OPGE (0.1 mg/g bw, OPGEL), medium dosage of OPGE (0.2 mg/gbw, OPGEM) and high dosage of OPGE (0.6 mg/g bw, OPGEH). All animals were treated continuously by oral gavage for 42 days, and then the swimming experiment and mating test were respectively performed on the last day of administration. Anti-fatigue and sexual function-related biochemical parameters were measured. The mating ability of mice was significantly enhanced in each treatment group compared with control group. The mating ability of OP and GE treated alone showed inferior to OPGEM administration, but without statistical difference. Compared with the control group, the serum levels of testosterone and follicle-stimulating hormone, the nitric oxide level in penis was increased by 20.02%, 19.92% and 17.19%, respectively, while the content of phosphodiesterases-5 in penis was decreased in OPGEM group. The results indicated that OPGEM administration presented the best effect on the promotion of sexual function among all groups
(P<0.05). Besides, the expressions of steroid hormone synthesis acute regulatory protein (StAR) and 17β-hydroxysteroid dehydrogenase (HSD17B3) in the testis were up-regulated by OPGE administration, but without a statistical difference compared with the control group (P>0.05). Furthermore, the levels of lactic acid (P<0.01), urea nitrogen (P<0.05) and malondialdehyde (P<0.01) were decreased by the administration of OPGEM, while the content of glycogen was increased (P<0.01). In conclusion, OPGE presented a synergistic effect on anti-fatigue and improvement of sexual ability in normal male mice. The results are beneficial to promote the development of the functional food industry in the related field. -
Keywords:
- oyster peptide /
- ginseng extracts /
- anti-fatigue /
- sexual function /
- synergistic effect
-
随着年龄的增长,下丘脑-垂体性腺轴功能逐步减退,促性腺激素释放激素分泌下降,造成性欲和勃起功能减弱以及肌力下降等症状。性功能降低对男性的健康、心理状态和人际关系产生严重的影响[1]。2015年,一项中老年男性生殖健康调查发现40~49岁、50~59岁和60~69岁的男性勃起功能障碍(Erectile dysfunction, ED)患病率分别为55.3%、88.2%和91.8%[2]。2017年,Zhang等[3]调查发现40岁以上男性ED总患病率约40.56%,其中抽烟(频率≥30根/d)和肥胖(BMI≥30 kg/m2)是增加患病概率的危险因素。此外,研究表明过度或高强度运动不仅引起运动损伤,还可能降低激素水平,引起机体疲劳、性功能障碍、肌肉运动力下降等症状[4]。市面上改善男性性功能的药物可能引起某些不良反应,如头痛、鼻塞、肌肉疼痛、视力模糊、面部潮红等,不能长期服用[5]。据报道,许多抗疲劳、补肾壮阳类保健食品为达到速效的目的,非法添加西地那非等处方药,危害消费者健康[6]。为减小药物带来的副作用,开发安全有效的食源性活性物质具有实际应用意义。
疲劳是一种精神或身体疲倦、耐力下降的复杂生理和心理现象[7],可分为中枢疲劳和外周疲劳[8-9],其产生与多种因素相关,包括组织中代谢物质的积累、能量供应不足、氧化应激、肌肉损伤等[10]。长期疲劳可能引发癌症、抑郁、多发性硬化等疾病的发生,同时也是机体“脆弱”反应的警示信号[11]。此外,肌肉疲劳产生时,机体感觉信息的输入和运动信息输出产生变化,肌肉力量和姿势控制能力下降[12],还可能对性活动能力产生一定影响[13]。改善或缓解疲劳症状可能需要较长时间,但长期服用化学药物可能会导致一些不良反应或毒性作用[14]。近年来,市场上多种抗疲劳营养饮料,通常包含咖啡因、牛磺酸、葡萄糖醛酸、L-酪氨酸、瓜拉那提取物及其他兴奋剂[15],不适用于所有群体。因此,无论是慢性疲劳还是性功能低下,均严重影响人们的生活质量和健康,开发具有明确活性功能的营养补充剂具有积极意义。
近年来,由于药用植物及天然来源的生物活性物质具有来源丰富、安全性高、生物活性广泛等特点,引起医疗和功能食品领域的极大兴趣。中医认为牡蛎具有滋阴补血、生精固肾、强身健体、恢复疲劳等功能。研究发现,牡蛎肉及其水解物可提高小鼠的交配能力及血清睾酮浓度、降低5型磷酸二酯酶水平,表现出明显改善男性性功能的生物活性[16-18]。刘瑜等[19]发现牡蛎低聚肽能够显著改善环磷酰胺引起的雄激素部分缺乏综合征,提高雄鼠捕捉和交配次数。人参,一种十分珍贵的药食兼用植物,其药理活性主要依赖于皂苷,具有补元气、抗疲劳、安神补脑等作用[20-21]。鲍雷等[22]表明人参低聚肽具有提高雄性激素水平、增加性腺指数和缩短交配潜伏期的能力。虽然牡蛎肽及人参提取物具有良好的生理功效,但两者复配对抗疲劳及提高男性性功能的效果是否具有协同作用鲜有报道,缺乏科学验证。此外,由于牡蛎肽口感较差且价格相对昂贵,为提高产品品质及降低成本投入,研究有效的替代配方对该领域产品开发与推广具有积极意义。综上,鉴于前人的研究基础,本实验初步探究牡蛎肽与人参提取物配伍对正常雄性小鼠性功能的影响及抗疲劳作用,为深入研究和开发具有缓解疲劳和改善性功能的产业化功能食品提供理论基础。
1. 材料与方法
1.1 材料与仪器
实验动物ICR雄性小鼠(5 w,(20±2)g) 由上海斯莱克实验动物有限责任公司提供,并饲养于浙江中医药大学动物中心;雌性ICR小鼠(9~10 周)用于性功能实验 由上海斯莱克实验动物有限责任公司提供。动物使用许可证编号为:SYXK(浙)2018-0012。所有动物实验操作均符合浙江中医药大学动物实验中心动物伦理要求,并严格按照实验动物福利原则与规范要求进行,动物伦理批准编号为:IACUC-20200518-12。所有动物自由进食标准颗粒饲料及饮水,保持环境温度(25±2)℃,于12 h光照与12 h黑暗条件下饲养;牡蛎肽(Oyster peptide, OP)、人参提取物(Ginseng extract, GE) 由宁波御坊堂生物科技有限公司提供,OP分子量在1000 Da以下占比97.96%、140~500 Da占比92.69%、总蛋白含量70.6%,GE总皂苷含量10.83%、水分含量4.0%、灰分1.2%;乳酸(LA)、乳酸脱氢酶(LDH)、血尿素氮(BUN)、丙二醛(MDA)、总抗氧化能力(T-AOC)、肝糖原(LG)及肌糖原(MG)试剂盒 南京建成生物工程研究所;BCA蛋白定量试剂盒 碧云天生物技术有限公司;睾酮(T)、黄体生成素(LH)、卵泡刺激素(FSH)酶联免疫吸附测定(ELISA)试剂盒 武汉基因美生物科技有限公司;一氧化氮(NO)及5型磷酸二酯酶(PDE-5)ELISA试剂盒 武汉酶免生物科技有限公司;类固醇激素合成快速调节蛋白(StAR)、17β-羟类固醇脱氢酶(HSD17B3)抗体 Proteintech公司。
SHJ-A6恒温水浴锅 江苏安普;Infinite M200 Pro酶标仪 瑞士TECAN公司;DM500光学显微镜 上海徕卡显微系统贸易有限公司;RM2016病理切片机 上海徕卡仪器有限公司。
1.2 实验方法
1.2.1 性功能评价
将48只小鼠随机分为6组,分别为空白组(同等体积蒸馏水)、牡蛎肽对照组(0.2 mg/g bw)、人参提取物对照组(0.2 mg/g bw)、配方低剂量组(0.1 mg/g bw)、配方中剂量组(0.2 mg/g bw)和配方高剂量组(0.6 mg/g bw),每组8只。配方组中,OP与GE配方按比例11:39配制(以国标用量,以及不同比例配方的体外抗氧化活性和消化稳定性确定最终配比)。以0.01 mL/g bw灌胃量给予小鼠相应剂量的受试物,连续给药42 d。48只雌性ICR小鼠于实验前48 h皮下注射5 μg苯甲酸雌二醇,于实验前5 h皮下注射5 μg孕酮诱发动情[23]。参考Xi等[13]的实验方法,灌胃42 d结束后,在昏暗安静、有红色灯光的房间进行(19:00~24:00),将雄性小鼠单独放在笼子里,使其适应15 min。雌性和雄性小鼠放在同一个笼子里,通过摄影机摄录25 min内小鼠交配行为。统计各组小鼠的性行为参数,包括捕捉次数(雄鼠捕捉雌鼠的次数);骑跨潜伏期(雄鼠出现第一次骑跨行为的时间间隔);骑跨次数(雄鼠发生骑跨行为的次数);插入潜伏期(雄鼠有第一次插入行为的时间);插入次数(雄鼠射精前插入行为的总次数);射精潜伏期(雄鼠第一次插入到射精的时间间隔);射精次数(雄鼠射精的总次数);射精后间隔期(雄鼠射精后到再次骑跨插入之间的时间间隔)。待交配实验结束后,从眼球后静脉收集雄性小鼠血液样本,3000 r/min离心10 min获得血清,测定睾酮(T)、促黄体生成素(LH)、促卵泡激素(FSH)和NO的浓度。称量附睾、精囊腺、睾丸、阴茎、肝脏、肾脏、胸腺和脾脏重量,计算脏体比。采用4%多聚甲醛固定肝脏,并通过HE染色法观察肝脏组织。
1.2.2 血清相关指标的检测
参照生化试剂盒说明书,测定小鼠血清中LDH活性、LA和BUN含量。按照ELISA测定试剂盒说明书操作,测定T、LH、FSH和NO的浓度。
1.2.3 组织中生化指标的测定
取保存好的肌肉和肝脏组织样本,用生理盐水漂洗后,滤纸吸干,精确称重,按照试剂盒说明测定肝糖原和肌糖原含量。另称取(0.1±0.05)g肌肉组织,参照试剂盒说明书测定肌肉中MDA含量和T-AOC。组织中总蛋白含量的测定参照BCA蛋白定量试剂盒说明书进行操作。取保存好的小鼠阴茎海绵体组织,称取(0.01±0.005)g组织,按照1:9(g:mL)料液比加入生理盐水,置于组织研磨器中研磨,得到匀浆后离心,取上清。按照ELISA试剂盒说明书操作,测定NO和PDE-5含量。
1.2.4 免疫组化测定
睾酮合成相关蛋白酶的表达参考Li等[24]的研究方法,睾丸组织切片常规脱蜡水化后,通过缓冲液EDTA修复切片,滴加山羊血清工作液进行封闭,室温孵育30 min。分别滴加一抗StAR(1:100)和HSD17B3(1:100),4 ℃冰箱过夜孵育。次日加入山羊抗兔IgG-HRP多聚体(二抗)于37 ℃孵育20 min,PBS轻轻冲洗数次,滴加稀释过的辣根过氧化物酶继续孵育30 min,滴加显色液DAB(1:20),小心冲洗,苏木素染色3 min后封片拍照。
1.2.5 抗疲劳功能评价
将48只小鼠随机分为6组,给药剂量与给药方式同1.2.1,给药42 d,所有动物休息30 min后,在泳池中进行无负荷游泳30 min[25]。游泳30 min后立即从眼球后静脉收集血液样本,3000 r/min离心10 min获得血清,测定小鼠血清中LDH活性、LA和BUN含量。取小鼠骨骼肌和肝脏组织样本用于糖原含量的测定。
1.3 数据处理
上述各项指标结果以平均值±标准差(
2. 结果与分析
2.1 牡蛎肽与人参提取物配伍对雄性小鼠性功能的影响
2.1.1 脏器指数与肝脏毒性分析
如表1所示,与空白组相比,牡蛎肽、人参提取物及其配方对小鼠脏器指数均没有显著影响(P>0.05)。肝脏是主要的代谢器官,在动物接触有害物质时最先遭受损伤的器官之一[26]。通过给予小鼠牡蛎肽、人参提取物及不同剂量的配方溶液42 d,未发生任何毒性发作及死亡现象。从肝脏HE切片结果可知(图1),各处理组没有造成肝细胞坏死、肝组织损伤等毒性作用。
表 1 雄性小鼠脏体比Table 1. Organ index of male mice组别 脏体比(%) 肝脏 肾脏 脾脏 胸腺 睾丸 精囊腺 附睾 阴茎 空白 5.21±0.27 1.43±0.11 0.31±0.02 0.12±0.05 0.67±0.08 0.59±0.07 0.27±0.08 0.14±0.02 牡蛎肽 5.15±0.30 1.35±0.28 0.32±0.04 0.15±0.05 0.70±0.04 0.72±0.15 0.27±0.06 0.15±0.01 人参提取物 4.73±0.44 1.43±0.09 0.34±0.03 0.13±0.05 0.70±0.04 0.73±0.08 0.28±0.07 0.15±0.01 配方低剂量 5.07±0.53 1.46±0.10 0.37±0.05 0.13±0.02 0.69±0.05 0.67±0.14 0.24±0.08 0.15±0.01 配方中剂量 4.85±0.29 1.45±0.10 0.34±0.02 0.11±0.01 0.64±0.06 0.70±0.15 0.27±0.05 0.16±0.02 配方高剂量 4.79±0.26 1.35±0.13 0.36±0.04 0.13±0.03 0.69±0.05 0.61±0.16 0.29±0.06 0.15±0.01 2.1.2 雄性小鼠性行为学实验结果
表2显示小鼠性行为实验结果,各处理组均显著提高小鼠捕捉次数和射精次数( P<0.05),其中高剂量配方组表现出极显著差异(P<0.01)。中剂量配方组的骑跨、插入和射精潜伏期均明显降低,效果优于其他处理组,但与空白组相比无统计学差异(P>0.05)。与空白组比较,人参提取物、低、中和高剂量配方组的射精后间隔期分别显著降低65.77%、60.24%、69.88%和78.20%(P<0.05)。从交配行为学可知,人参提取物效果较牡蛎肽强。因此,在配方产品中,人参提取物可能在性功能方面发挥主要作用。
表 2 牡蛎肽、人参提取物及其配方对小鼠交配行为的影响Table 2. Effect of oyster peptide (OP), ginseng extracts (GE) and combined OP and GE on sexual behavioral related indexes组别 捕捉次数 骑跨潜伏期(s) 骑跨次数 插入潜伏期(s) 插入次数 射精潜伏期(s) 射精次数 射精后间隔期(s) 空白 26.00±4.57 428.30±198.10 4.57±1.40 472.80±221.10 15.13±9.17 96.00±54.19 2.14±0.90 151.40±67.49 牡蛎肽 38.00±8.64* 567.70±273.30 11.17±2.71* 581.20±285.70 51.20±24.43 43.20±35.46 5.501.05* 70.20±69.98 人参提取物 41.67±6.80** 545.80±208.1 12.33±2.39** 577.20±220.00 61.40±36.07 86.17±67.83 6.00±2.83* 51.83±12.61** 配方低剂量 40.71±11.56** 484.70±153.2 11.17±4.79* 446.80±135.70 60.17±35.84 57.71±38.55 6.00±2.28* 60.20±22.17* 配方中剂量 39.17±3.76* 359.70±141.2 13.20±2.78** 386.00±171.50 60.60±29.62 28.20±9.65 6.20±2.77* 45.60±22.19** 配方高剂量 40.00±4.24** 377.20±209.7 12.71±3.50** 505.00±305.90 68.14±45.41* 69.17±57.32 6.29±1.60** 33.00±15.36** 注:与空白组比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01);图2、图4同。 2.1.3 小鼠性功能相关生化指标检测结果
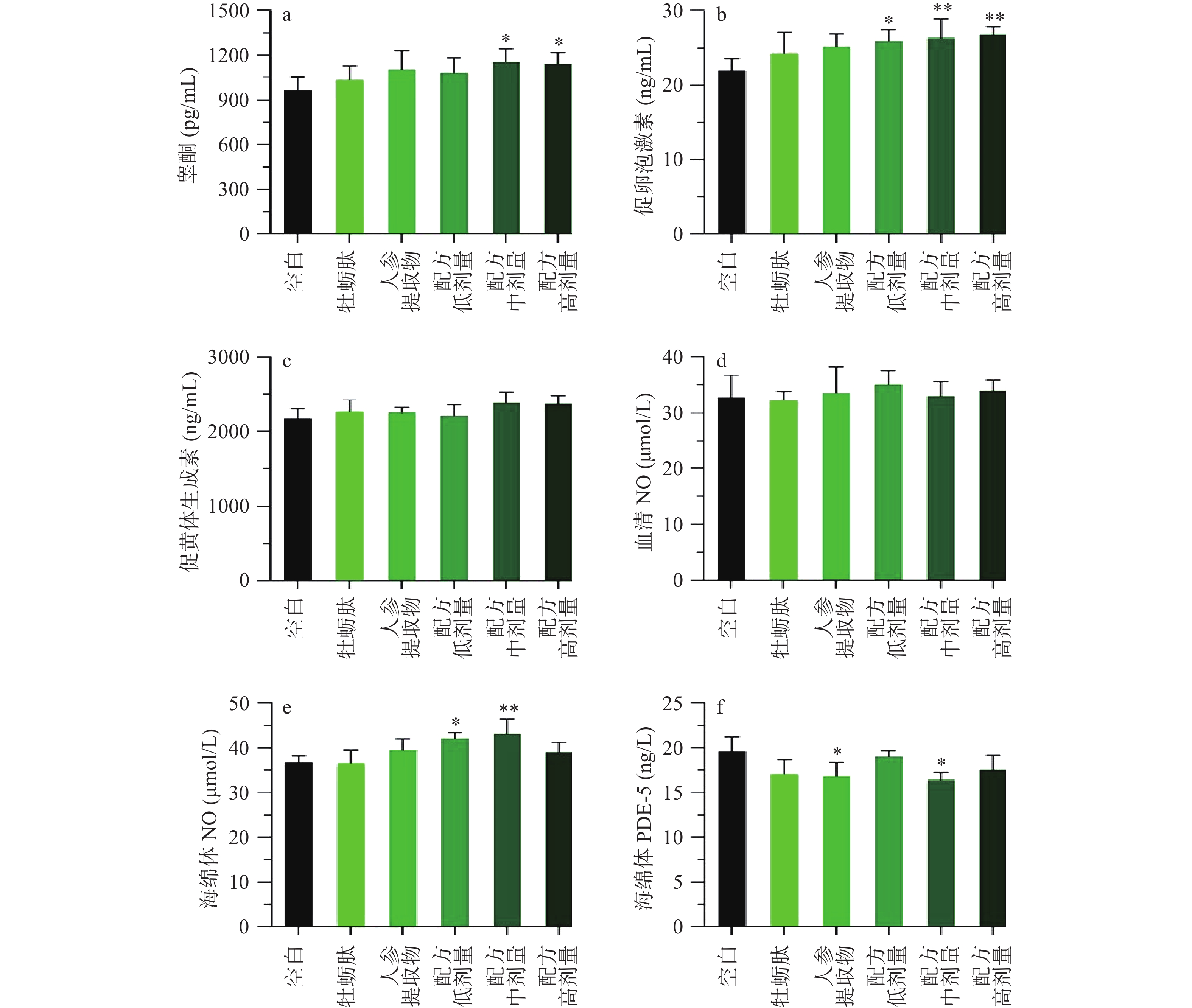
图2a~c显示雄性小鼠的激素水平。男性的生长发育、生育能力以及机体健康很大程度取决于雄性激素。特别是在中老年时期,伴随着睾酮水平的下降,可能会引起自主神经功能絮乱、性功能减退、心理和躯体障碍[27],低水平雄激素也是男性寿命缩短的危险因素[28]。各处理组均明显提高血清睾酮含量,其中中、高剂量配伍组与空白组相比有统计学差异(P<0.05),分别提高20.02%和18.77%。FSH可促使睾丸支持细胞分泌激素结合蛋白与睾酮结合,使生精小管内维持高浓度睾酮,促进精子生成[29]。低、中、高3种不同剂量配方干预后均显著提高小鼠促卵泡激素水平(P<0.05),分别提高17.74%、19.92%和22.07%,效果优于牡蛎肽与人参提取物单独处理。图2c表明各处理组的促黄体激素与空白组相比没有统计学差异(P>0.05)。因此,配伍组可能通过调控性腺轴功能,提高激素水平和生精能力,从而增强雄性小鼠性功能。
除了激素水平,eNOS/NO/cGMP信号通路对男性性功能同样起着不可或缺的作用。图2d和图2e分别显示血清与阴茎海绵体中NO含量,结果表明各处理组没有显著影响小鼠血清NO水平(P>0.05),但低、中剂量配方组使海绵体NO含量显著上升(P<0.05)。与空白组相比,各处理组海绵体中PDE-5水平均有明显下降趋势,但只有人参提取物和中剂量配方组具有统计学差异(P<0.05),分别下降14.34%和16.43%。
2.1.4 小鼠睾丸StAR和HSD17B3免疫组化结果
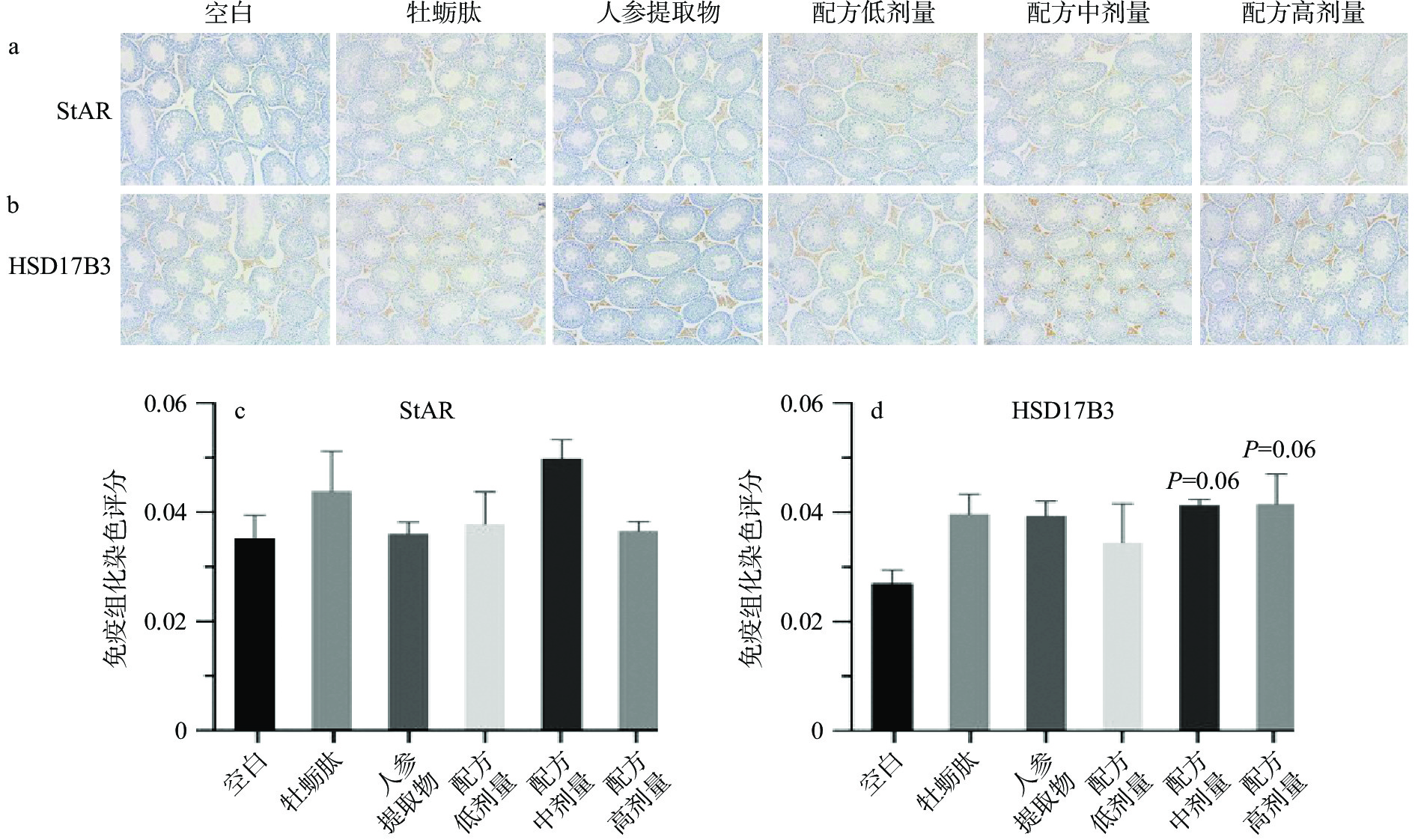
睾丸间质细胞为睾酮激素合成的主要场所,免疫组化结果显示StAR和HSD17B3主要分布于睾丸间质细胞中(阳性表达),见图3a~b。StAR主要负责将胆固醇转运至线粒体内膜,使得线粒体内膜上的细胞色素P450胆固醇侧链裂解酶(P450scc)能够进一步催化胆固醇裂解成孕烯醇酮[30]。与空白组相比,StAR蛋白的表达没有显著差异(P>0.05),说明处理组可能不是通过调节StAR蛋白来促进睾酮分泌。HSD17B3参与睾酮合成的最后一步,将雄烯二酮转化为睾酮,HSD17B3缺乏的临床诊断标志是血液中雄烯二酮与睾酮的比值增高[28]。中、高剂量配方处理组明显提高睾丸组织中HSD17B3的表达,但与空白组比较没有统计学差异(P>0.05)。
2.2 牡蛎肽与人参提取物配伍对小鼠抗疲劳相关指标的影响
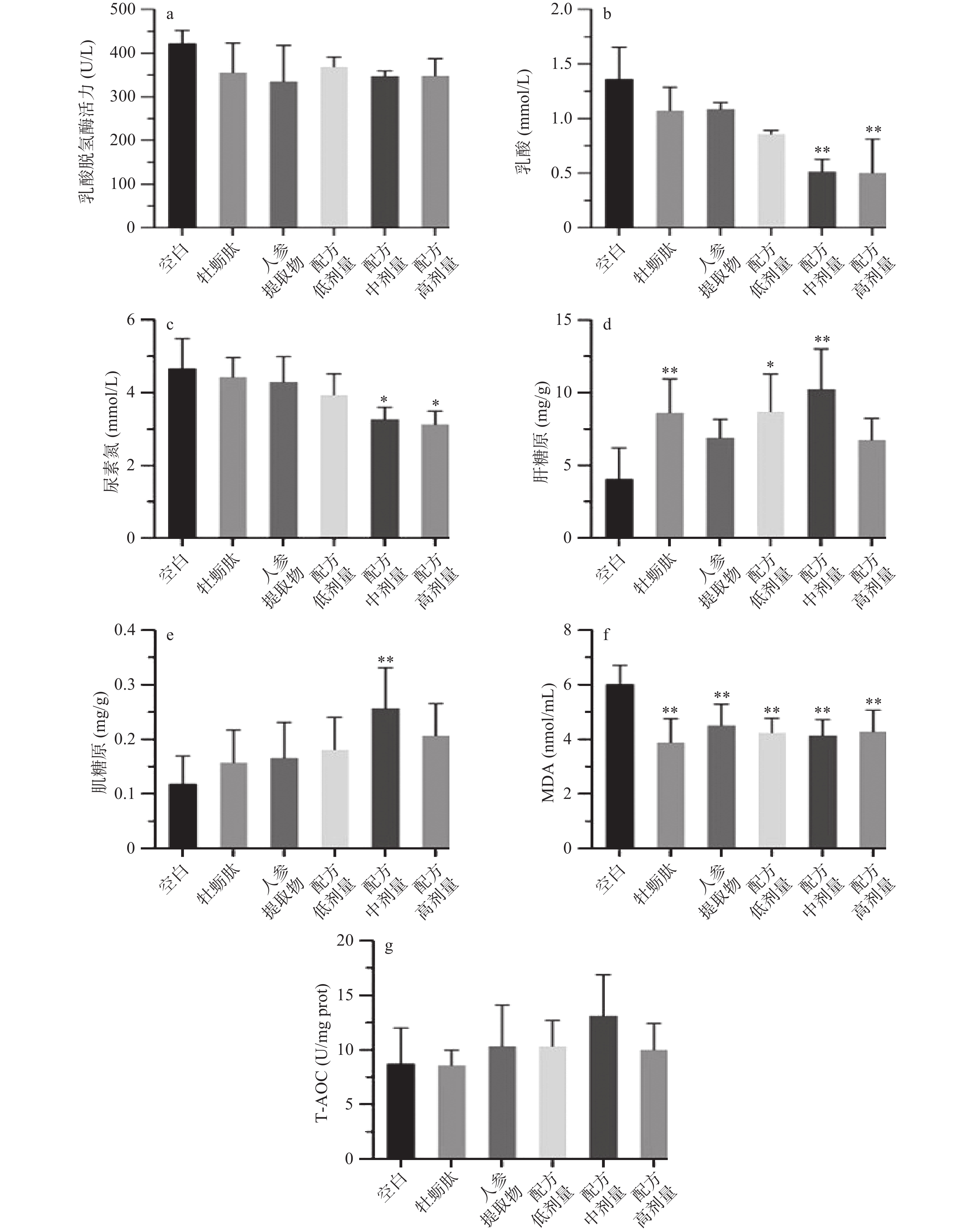
为探究不同处理对小鼠运动损伤和代谢产物水平的影响,每组小鼠游泳30 min后测定抗疲劳相关指标,结果如图4所示。当身体消耗糖原所获得的能量不足,机体开始分解蛋白以获得能量维持生理功能,但此时蛋白质和氨基酸的代谢产物BUN含量也增加。运动时,碳水化合物进行无氧糖酵解产生大量乳酸,引起生理性运动疲劳,测定血清LA含量是判断疲劳程度及有氧代谢能力的重要指标之一,降低LA含量是延缓疲劳产生或加快疲劳消除的有效手段[9]。图4b和图4c显示,与空白组相比,中、高剂量配方干预均显著降低小鼠血清乳酸及尿素氮水平(P<0.05),表明配伍组具有加快代谢物消除的作用。各处理组的乳酸脱氢酶活力虽有不同程度的下降,但没有统计学差异(P>0.05)。
肝糖原含量是反映小鼠疲劳程度的重要指标,其含量越高说明能给机体提供的能量越多[31]。牡蛎肽、低剂量以及中剂量配方处理显著提高小鼠肝糖原含量(P<0.05),分别提高112.62%、114.44%和152.15%,说明配伍组提高肝糖原的能力可能主要来源于牡蛎肽。与空白组比较,各处理组的肌糖原含量均有不同程度的提升,其中中剂量配方组具有统计学差异(P<0.01)。表明同等剂量下,配伍组增加机体能量储存的能力强于单组分对照组。
剧烈运动可能导致骨骼肌产生过多的活性氧簇(ROS),发生一系列氧化反应,引起外周性疲劳。测定肌肉中MDA含量和总抗氧化能力(图4f和图4g),发现各处理组的MDA水平与空白组相比均有显著性差异(P<0.01),但总抗氧化能力与空白组比较没有统计学差异(P>0.05)。说明牡蛎肽、人参提取物及其配伍组具有抑制脂质氧化的作用。
3. 讨论
从性功能方面,配伍组能有效提高小鼠的捕捉次数、插入次数及射精次数,且同等剂量配伍组效果优于单组分对照组。据报道,尽管短时间低强度运动可促使血清睾酮分泌增加(提高运动机能),但急性力竭或长期高负荷锻炼会降低下丘脑-垂体-性腺轴功能,引起雄激素水平下降[32]或精子畸形率上升[30],而雄性激素缺乏与机体疲劳、性功能障碍、肌肉运动力下降等症状密切相关。长期或不正确运动训练,不仅导致机体疲劳,也会引起睾丸激素水平显著下降,改变生理参数,如精子浓度和形态、精子DNA完整性、抗氧化能力等[32]。Lim[33]表明某些具有促进睾丸激素分泌功能的植物活性物质能够在一定程度上帮助疲劳和体质虚弱的男性恢复身体机能。人参及其有效成分能够改善机体荷尔蒙絮乱,皂苷分子结构与类固醇激素相似,对环孢素诱导的生精细胞凋亡和睾酮合成能力下降具有改善作用[34]。本研究中人参提取物的总皂苷含量为10.83%,可能发挥着重要作用。结果显示,单独人参提取物处理能明显提高小鼠血清睾酮和促卵泡激素水平,但与空白组比较没有统计学差异,而中、高剂量配方处理均能显著提高睾酮和促卵泡激素水平,说明牡蛎肽与人参提取物在维持睾酮水平和精子生成方面具有潜在的协同作用。同样,张亭等[16]研究表明牡蛎低聚肽配伍核桃肽和山药多糖能显著升高正常小鼠血清睾酮和降低PDE-5水平,有效增强性功能。此外,基于睾酮水平的升高,本研究测定两种睾酮合成关键蛋白StAR和HSD17B3的表达,发现牡蛎肽、人参提取物及配伍组对正常小鼠的StAR表达均没有显著影响(P>0.05);中、高剂量配伍组能够明显提升HSD17B3的表达,但与空白组比没有统计学差异,说明处理组可能不是通过调节StAR和HSD17B3来促进睾酮的合成,该作用机理有待进一步深入探究。
多项研究表明,性刺激时NO扩散到血管平滑肌细胞中并激活鸟苷酸环化酶,导致环状鸟苷酸(cGMP)依赖性蛋白激酶(PKG)信号传导途径激活,使血管快速舒张而勃起[35]。Gao等[35]发现人参皂甙Re(GS-Re)通过调节eNOS/NO/cGMP通路促使血小板源生长因子-BB(PDGF-BB)诱导血管平滑肌细胞增殖,显著增加NO和cGMP水平以及phos-eNOSSer1177/eNOS比值。同样,本研究表明中剂量配伍组可明显提高海绵体中NO水平,有利于提高雄性小鼠性功能,且效果优于单组分对照组。在NO-cGMP通路中,PDE-5酶促进cGMP水解,导致cGMP不能进一步激活PKG,造成勃起障碍。目前多数治疗勃起功能障碍的药物为PDE-5抑制剂,但此类药物价格昂贵,并且可能产生一些不良反应[36]。本实验发现配伍组能有效降低PDE-5水平,是一种潜在的PDE-5抑制剂。
从抗疲劳方面,本研究发现单组分牡蛎肽和中剂量配方均显著提高小鼠肝糖原含量,人参提取物组则没有显著变化,说明在能量储存方面,牡蛎肽在组分中起主要作用。同样,Zhang等[37]从海马中提取活性肽(SH200),发现SH200明显延长小鼠运动时间,提高肝糖原和ATP含量,并激活AMMPK/PGC-1α信号通路改善小鼠线粒体功能,增强骨骼肌代谢和保护肌纤维。陶雅浩等[38]研究表明,补充牡蛎肽能够提高无训练小鼠力竭运动时蛋白质/氨基酸分解供能的能力,降低肌糖原和肝糖原的消耗。运动不仅导致能量的消耗,同时也使代谢产物大量堆积,扰乱机体稳态。本研究发现与空白组相比,只有中、高剂量配方组使小鼠血清BUN和LA水平明显下降,说明配伍组比单组分处理的效果更佳。MDA是细胞膜多不饱和脂肪酸氧化反应的产物,能够反映运动后体内细胞氧化损伤程度[39]。Wang等[40]研究表明经过30 min游泳后,带鱼肽组的小鼠BUN和MDA含量均比空白组低,具有抗疲劳功效。同样,本研究各处理组均明显降低运动后小鼠骨骼肌中MDA水平,表明两种活性物质在减小细胞脂质氧化损伤方面具有潜在活性。
4. 结论
牡蛎肽与人参提取物复配具有缓解疲劳和提高雄性小鼠性功能的潜力,且效果优于单独的牡蛎肽和人参提取物组。结果表明,配伍组主要通过提高糖原含量,降低乳酸、尿素氮和MDA含量表现出抗疲劳作用。在性功能方面,配伍组显著提高小鼠交配行为学指标,并可能通过调节激素水平,改善eNOS/NO/cGMP信号通路中NO和PDE-5的表达,从而有效增强小鼠性功能。但两种活性物质配伍在不同模型或运动模式下是否还具有良好的功效,通过何种机制影响性功能仍需进一步深入探究。此外,本研究提示植物提取物与活性肽配伍具有潜在的增效作用,有利于降低成本和推动功能食品产业化发展。
-
表 1 雄性小鼠脏体比
Table 1 Organ index of male mice
组别 脏体比(%) 肝脏 肾脏 脾脏 胸腺 睾丸 精囊腺 附睾 阴茎 空白 5.21±0.27 1.43±0.11 0.31±0.02 0.12±0.05 0.67±0.08 0.59±0.07 0.27±0.08 0.14±0.02 牡蛎肽 5.15±0.30 1.35±0.28 0.32±0.04 0.15±0.05 0.70±0.04 0.72±0.15 0.27±0.06 0.15±0.01 人参提取物 4.73±0.44 1.43±0.09 0.34±0.03 0.13±0.05 0.70±0.04 0.73±0.08 0.28±0.07 0.15±0.01 配方低剂量 5.07±0.53 1.46±0.10 0.37±0.05 0.13±0.02 0.69±0.05 0.67±0.14 0.24±0.08 0.15±0.01 配方中剂量 4.85±0.29 1.45±0.10 0.34±0.02 0.11±0.01 0.64±0.06 0.70±0.15 0.27±0.05 0.16±0.02 配方高剂量 4.79±0.26 1.35±0.13 0.36±0.04 0.13±0.03 0.69±0.05 0.61±0.16 0.29±0.06 0.15±0.01 表 2 牡蛎肽、人参提取物及其配方对小鼠交配行为的影响
Table 2 Effect of oyster peptide (OP), ginseng extracts (GE) and combined OP and GE on sexual behavioral related indexes
组别 捕捉次数 骑跨潜伏期(s) 骑跨次数 插入潜伏期(s) 插入次数 射精潜伏期(s) 射精次数 射精后间隔期(s) 空白 26.00±4.57 428.30±198.10 4.57±1.40 472.80±221.10 15.13±9.17 96.00±54.19 2.14±0.90 151.40±67.49 牡蛎肽 38.00±8.64* 567.70±273.30 11.17±2.71* 581.20±285.70 51.20±24.43 43.20±35.46 5.501.05* 70.20±69.98 人参提取物 41.67±6.80** 545.80±208.1 12.33±2.39** 577.20±220.00 61.40±36.07 86.17±67.83 6.00±2.83* 51.83±12.61** 配方低剂量 40.71±11.56** 484.70±153.2 11.17±4.79* 446.80±135.70 60.17±35.84 57.71±38.55 6.00±2.28* 60.20±22.17* 配方中剂量 39.17±3.76* 359.70±141.2 13.20±2.78** 386.00±171.50 60.60±29.62 28.20±9.65 6.20±2.77* 45.60±22.19** 配方高剂量 40.00±4.24** 377.20±209.7 12.71±3.50** 505.00±305.90 68.14±45.41* 69.17±57.32 6.29±1.60** 33.00±15.36** 注:与空白组比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01);图2、图4同。 -
[1] KAYODE O T, YAKUBU M T. Parquetina nigrescens leaves: Chemical profile and influence on the physical and biochemical indices of sexual activity of male Wistar rats[J]. Journal of Integrative Medicine,2017,15(1):64−76. doi: 10.1016/S2095-4964(17)60318-2
[2] TANG W H, ZHUANG X J, SHU R M, et al. The prevalence of erectile dysfunction among subjects with late-onset hypogonadism: A population-based study in China[J]. International Journal of Clinical and Experimental Medicine,2015,8(8):13901−13910.
[3] ZHANG X, YANG B, LI N, et al. Prevalence and risk factors for erectile dysfunction in Chinese adult males[J]. Journal of Sexual Medicine,2017,14(10):1201−1208. doi: 10.1016/j.jsxm.2017.08.009
[4] 井宏颖, 吕克宁, 宋晓晨, 等. 地黄饮子对运动性疲劳小鼠运动能力的影响[J]. 湖南中医药大学学报,2021,41(1):34−38. [JING H Y, LV K, SONG X C, et al. Effect of radix rehmanniae decoction on exercise ability in exercise-induced fatigue mice[J]. Journal of Hunan University of Chinese Medicine,2021,41(1):34−38. doi: 10.3969/j.issn.1674-070X.2021.01.007 [5] TADAYON N, BORNA J, MORTEZA G, et al. Vitamin E and ginseng combined supplement for treatment of male erectile dysfunction: A double-blind, placebo-controlled, randomized, clinical trial[J]. Advances in Integrative Medicine,2021,8(1):44−49. doi: 10.1016/j.aimed.2019.12.001
[6] 谢柏艳, 李文博, 杨玉平. 液相色谱-串联质谱法测定抗疲劳类保健食品中非法添加的西地那非含量的不确定度评定[J]. 食品安全质量检测学报,2021,12(12):1113−1118. [XIE B Y, LI W B, YANG Y P. Uncertainty evaluation for the determination of sildenafil illegally added in anti-fatigue health food by liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality,2021,12(12):1113−1118. [7] YANG Q Y, LAI X D, OUYANG J, et al. Effects of Ginsenoside Rg3 on fatigue resistance and SIRT1 in aged rats[J]. Toxicology,2018,409:144−151. doi: 10.1016/j.tox.2018.08.010
[8] MA N, TAO H, DU H, et al. Antifatigue effect of functional cookies fortified with mushroom powder (Tricholoma matsutake) in mice[J]. Journal of Food Science,2020,85(12):4389−4395. doi: 10.1111/1750-3841.15510
[9] 孟超, 肖凯文, 郑双艳, 等. 蜂王浆主蛋白对小鼠的抗疲劳作用[J]. 中国食品学报,2017,10(7):23−29. [MENG C, XIAO K W, ZHENG S Y, et al. Anti-fatigue activity of MRJPs from fresh royal jelly in mice[J]. Journal of Chinese Institute of Food Science and Technology,2017,10(7):23−29. [10] COQUEIRO A Y, ROGERO M M, TIRAPEGUI J. Glutamine as an anti-fatigue amino acid in sports nutrition[J]. Nutrients,2019,11(4):1−19.
[11] ZHANG X, JING S, LIN H, et al. Anti-fatigue effect of anwulignan via the NRF2 and PGC-1alpha signaling pathway in mice[J]. Food & Function,2019,10(12):7755−7766.
[12] 李旭龙, 陈洪鑫. 运动疲劳对人体姿势控制功能影响的研究综述[J]. 湖北体育科技,2017,36(11):971−974. [LI X L, CHEN H X. Influence of exercise fatigue on postural control: A review of literature[J]. Hubei Sports Science,2017,36(11):971−974. doi: 10.3969/j.issn.1003-983X.2017.11.009 [13] XI X, GUO S, GUO H, et al. Anti-exercise-fatigue and promotion of sexual interest activity of total flavonoids from wasps drone-pupae in male mice[J]. Biomedicine & Pharmacotherapy,2018,107:254−261.
[14] LUO C, XU X, WEI X, et al. Natural medicines for the treatment of fatigue: Bioactive components, pharmacology, and mechanisms[J]. Pharmacological Research,2019,148:104409. doi: 10.1016/j.phrs.2019.104409
[15] CUI J, XIA P, ZHANG L, et al. A novel fermented soybean, inoculated with selected Bacillus, Lactobacillus and Hansenula strains, showed strong antioxidant and anti-fatigue potential activity[J]. Food Chemistry,2020,333:e127527. doi: 10.1016/j.foodchem.2020.127527
[16] 张亭, 李迪, 乌兰, 等. 牡蛎低聚肽配伍核桃低聚肽和山药多糖对雄性小鼠性功能的影响[J]. 现代预防医学,2018,45(12):2141−2153. [ZHANG T, LI D, WU L, et al. Effect of compatibilities of oyster oligopeptides, walnut oligopeptides and yam polysaccharide on sexual function in male mice[J]. Modern Preventive Medicine,2018,45(12):2141−2153. [17] ZHANG Z, SU G, ZHOU F, et al. Alcalase-hydrolyzed oyster (Crassostrea rivularis) meat enhances antioxidant and aphrodisiac activities in normal male mice[J]. Food Research International,2019,120:178−187. doi: 10.1016/j.foodres.2019.02.033
[18] RIDZWAN B H, HANANI M, SITI NORSHUHADAA M P, et al. Screening for aphrodisiac property in local oyster of Crassostrea iredalei[J]. World Applied Sciences Journal,2013,26(12):1546−1551.
[19] 刘瑜, 张海欣, 盛卓娴, 等. 牡蛎低聚肽对CTX诱导的PADAM大鼠性功能及生殖功能的干预作用[J]. 食品工业科技,2020,41(17):302−307. [LIU Y, ZHANG H X, SHENG Z X, et al. Intervention of oyster oligopeptides on sexual and reproductive functions in PADAM rats induced by CTX[J]. Science and Technology of Food Industry,2020,41(17):302−307. [20] 尹佳乐, 陈越, 张海悦. 蒲公英人参复合保健饮料研制及其抗疲劳功能研究[J]. 食品科技,2020,45(11):82−89. [YIN J L, CHEN Y, ZHANG H Y. Study on compound health beverage of dandelion ginseng and its anti-fatigue function[J]. Food Science and Technology,2020,45(11):82−89. [21] WANG C, LIU J, DENG J, et al. Advances in the chemistry, pharmacological diversity, and metabolism of 20(R)-ginseng saponins[J]. Journal of Ginseng Research,2020,44(1):14−23. doi: 10.1016/j.jgr.2019.01.005
[22] 鲍雷, 王军波, 张远, 等. 吉林人参低聚肽对雄性小鼠性功能影响的实验研究[J]. 中国预防医学杂志,2015,16(10):757−760. [BAO L, WANG J B, ZHANG Y, et al. Effects of Panax ginseng oligopeptide of Jilin on sexual function in male mice[J]. China Prevention medicine,2015,16(10):757−760. [23] SATTAYASAI J, SRISUWAN S, ARKARAVICHIEN T, et al. Effects of andrographolide on sexual functions, vascular reactivity and serum testosterone level in rodents[J]. Food Chemistry Toxicology,2010,48(7):1934−8. doi: 10.1016/j.fct.2010.04.037
[24] LI Z Q, YU Y G, LI Y, et al. Taxifolin attenuates the developmental testicular toxicity induced by di-n-butyl phthalate in fetal male rats[J]. Food Chemistry Toxicology,2020,142:111482. doi: 10.1016/j.fct.2020.111482
[25] 中华人民共和国卫生部. 保健食品检验与评价技术规范[S]. 2003: 87. Ministry of Health of the People’s Republic of China. Technical specifications for health food inspection and evaluation[S]. 2003: 87.
[26] CHINDE S, GROVER P. Toxicological assessment of nano and micron-sized tungsten oxide after 28 days repeated oral administration to Wistar rats[J]. Mutat Res Gen Tox En,2017,819:1−13. doi: 10.1016/j.mrgentox.2017.05.003
[27] 周兴, 李波男, 周海亮, 等. 雄蚕益肾方对LOH大鼠Leydig细胞胆固醇转运蛋白、睾酮合成酶和SF-1表达的影响[J]. 中华男科学杂志,2020,26(3):258−264. [ZHOU X, LI B N, ZHOU H L, et al. Xiongcan Yishen prescription up-regulates the expression of cholesterol transport proteins, steroidogenic enzymes and SF-1 in the Leydig cells of rats with late-onset hypogonadism[J]. National Journal of Andrology,2020,26(3):258−264. [28] REBOURCET D, MACKAY R, DARBEY A, et al. Ablation of the canonical testosterone production pathway via knockout of the steroidogenic enzyme HSD17B3, reveals a novel mechanism of testicular testosterone production[J]. The FASEB Journal,2020,34(8):10373−10386. doi: 10.1096/fj.202000361R
[29] LI Z M, LIU N, JIANG Y P, et al. Vitexin alleviates streptozotocin-induced sexual dysfunction and fertility impairments in male mice via modulating the hypothalamus-pituitary-gonadal axis[J]. Chemico-Biological Interactions,2019,297:119−129. doi: 10.1016/j.cbi.2018.10.013
[30] 张姹, 魏易焓, 卢静怡, 等. 不同运动方式和运动时间对小鼠睾酮分泌和精子生成的影响[J]. 中国畜牧杂志,2021,57(2):96−100. [ZHANG C, WEI Y H, LU J Y. Effects of different exercise modes and exercise time on testosterone secretion and sperm production in mice[J]. Chinese Journal of Animal Science,2021,57(2):96−100. [31] NAM S Y, KIM H M, JEONG H J. Anti-fatigue effect by active dipeptides of fermented porcine placenta through inhibiting the inflammatory and oxidative reactions[J]. Biomedicine Pharmacother,2016,84:51−59. doi: 10.1016/j.biopha.2016.09.012
[32] SGRÒ, PAOLO. Exercise, training, and the hypothalamic-pituitary-gonadal axis in men[J]. Current Opinion in Endocrine and Metabolic Research,2019,9:86−89. doi: 10.1016/j.coemr.2019.08.004
[33] LIM P H C. Asian herbals and aphrodisiacs used for managing ED[J]. Translation Andrology Urology,2017,6(2):167−175. doi: 10.21037/tau.2017.04.04
[34] CHEN J B, LI M J, CHEN L X, et al. Effects of Raphani Semen on anti-fatigue and pharmacokinetics of Panax ginseng[J]. Chinese Herbal Medicines,2019,11(3):308−313. doi: 10.1016/j.chmed.2019.05.001
[35] GAO Y, ZHU P, XU S F, et al. Ginsenoside Re inhibits PDGF-BB-induced VSMC proliferation via the eNOS/NO/cGMP pathway[J]. Biomedicine & Pharmacotherapy,2019,115:108934.
[36] ADEBAYO A A, OBOH G, ADEMOSUN A O. Almond-supplemented diet improves sexual functions beyond Phosphodiesterase-5 inhibition in diabetic male rats[J]. Heliyon,2019,5(12):e03035. doi: 10.1016/j.heliyon.2019.e03035
[37] ZHANG Y Y, RYU B, CUI Y H, et al. A peptide isolated from Hippocampus abdominalis improves exercise performance and exerts anti-fatigue effects via AMPK/PGC-1α pathway in mice[J]. Journal of Functional Foods,2019,61:103489. doi: 10.1016/j.jff.2019.103489
[38] 陶雅浩, 金其贯, 徐昊然. 牡蛎肽补充和运动训练对小鼠运动耐力的影响[J]. 食品科技,2020,45(3):57−63. [TAO Y H, JIN Q G, XU H R. Effects of oyster peptide supplementation and exercise training on exercise endurance in mice[J]. Food Science and Technology,2020,45(3):57−63. [39] HU M, DU J, DU L D, et al. Anti-fatigue activity of purified anthocyanins prepared from purple passion fruit (
P. edulis Sim) epicarp in mice[J]. Journal of Functional Foods,2020,65:103725. doi: 10.1016/j.jff.2019.103725 [40] WANG P X, ZENG H L, LIN S L, et al. Anti-fatigue activities of hairtail (Trichiurus lepturus) hydrolysate in an endurance swimming mice model[J]. Journal of Functional Foods,2020,74:104207. doi: 10.1016/j.jff.2020.104207
-
期刊类型引用(0)
其他类型引用(2)






 下载:
下载:
 下载:
下载:
