Review on the Effect of Non-thermal Processing Technologies on the Bioavailability of Carotenoids in Fruits and Vegetables
-
摘要: 类胡萝卜素是一类广泛存在于果蔬食品中的脂溶性天然色素,具有多种生理功能。通常果蔬中类胡萝卜素的生物利用度较低,不同加工方式对类胡萝素的释放和生物利用度会有不同的影响,通过科学的手段提高果蔬中类胡萝卜素的生物利用度成为果蔬加工领域研究的热点。本文简述了不同非热加工技术(高压均质技术,超高压技术,超声波技术,高压脉冲电场技术等)对果蔬类胡萝卜素生物利用度的影响,并简要总结了加工影响果蔬类胡萝卜素生物利用度的可能途径如破坏细胞壁等天然结构屏障,或促进果胶、脂质等物质的溶出,类胡萝卜素-蛋白质复合物结构破坏等,以期为不同非热加工技术用于提高果蔬类胡萝卜素生物利用度及营养品质精准调控提供参考。Abstract: Carotenoids are a kind of fat-soluble natural pigments widely found in fruits and vegetables, having a variety of functional properties. Generally, the bioavailability of carotenoids in fruits and vegetables is low, and different processing methods will have different effects on the release and bioavailability of carotenoids. So how to improve the bioavailability of carotenoids in fruits and vegetables through scientific means becomes a research hotspots in the fruit and vegetable processing field. This article briefly describes the effects of different non-thermal processing technologies on the bioavailability of fruits and vegetables’ carotenoids, and briefly summarizes the ways that processing affects the bio-availability of fruits and vegetables’ carotenoids, such as destroying natural structural barriers (cell walls), or promoting the dissolution of pectin, lipids and other substance, or damaging the structure of carotenoid-protein complex, etc. This study provides a reference for different non-thermal processing technologies for improving the bioavailability of fruits and vegetables’ carotenoids and precise regulation of nutritional quality.
-
随着人们对于食品的需求从基本的“保障供给”向“营养健康”转变,膳食成为仅次于遗传而影响人类健康的第二大因素,如何充分发挥食品的营养功能、实现精准营养成为当下研究的热点[1]。类胡萝卜素是一类重要的脂溶性天然活性成分,具有抗氧化、抗病毒、增强人体免疫力和防癌抗癌等多种生理功能[2-5]。人体自身不能合成类胡萝卜素,需从食物中获取[6]。消费者所喜爱的富含类胡萝卜素的果蔬及其加工制品是膳食营养中类胡萝卜素的主要来源[7]。类胡萝卜素的生理功能不仅与其在食品中的绝对含量相关,更在很大程度上取决于其生物利用度[8-10]。然而,由于类胡萝卜素特殊存在形式及其脂溶特性,其消化过程中存在难以从食物组织中释放[11]、溶解度低、稳定性差、易发生转化或降解等问题[6],通常果蔬中类胡萝卜素的生物利用度极低[7,12-15]。
适当的加工已被证实可有效提高果蔬中类胡萝卜素的生物利用度[7,14,16]。传统果蔬加工主要以热处理为主,但高温易引起果蔬中VC等热敏性营养成分的破坏、品质劣变等[17-19]。随着公众消费理念的转变和对“清洁标签”的重视,有着“最少加工”、“营养最大保留”等优势的非热加工技术成为国内外果蔬加工应用的新发展方向[20]。因此,本文结合近年来国内外相关研究进展,系统综述了典型非热加工技术(超高压、高压均质、超声波、高压脉冲电场等)对果蔬中类胡萝卜素生物利用度的影响和加工对果蔬类胡萝卜素生物利用度的影响途径,以期为非热加工用于提高果蔬类胡萝卜素生物利用度及营养品质精准调控提供参考。
1. 类胡萝卜素在果蔬中的存在形式及其生物利用度
类胡萝卜素是一类由8个类异戊二烯单位组成的C40类萜化合物及其衍生物,根据其结构和功能的不同分为含氧官能团的叶黄素类如叶黄素、玉米黄质、花青素等和以聚类异戊二烯为中心、两端环状结构或非环状结构且无任何官能团的胡萝卜素类如α-胡萝卜素、β-胡萝卜素和番茄红素等[7,21-22]。在植物组织中,类胡萝卜素合成后存在于不同的质体类型中,从而形成不同的细胞亚结构[23-24]。在可进行光合作用的组织中,如叶菜类,其位于叶绿体中,与类囊体膜中的捕光复合物蛋白密切相关[24]。在不可进行光合作用的组织中,类胡萝卜素主要以晶体形式或油滴形式沉积在有色体中[24-25],在有色体的发育过程中形成由类胡萝卜素、脂类和蛋白质组成的特殊亚结构单元。常见的有色体结构形态有晶体状、球状、纤维状、膜状或管束状等[8]。例如,在胡萝卜中,类胡萝卜素主要以大晶体形式积累[9,26-27];在番茄中,类胡萝卜素主要以膜状晶体的形式存在[9];而在南瓜中,类胡萝卜素则主要以油滴的形式存在[3]。
类胡萝卜素的生物利用度(bioavailability)是指从食物基质中释放,随后可被人体所吸收和利用的那部分类胡萝卜素,实现其前提条件是类胡萝卜素的生物可及性(bioaccessibility),即食物经胃肠道消化后释放出来的可被小肠吸收的类胡萝卜素[28-30]。果蔬中的类胡萝卜素在被人体肠道吸收之前需要经过几个复杂的过程:首先,类胡萝卜素必须从食物基质中释放出来[16,31-32];其次,释放的类胡萝卜素分散在消化道中与油脂结合形成乳状液[33];最后,形成的乳状液同肠道内存在的磷脂、胆盐、胆固醇等形成混合胶束,以此被小肠上皮细胞吸收[9,34-35],从而类胡萝卜素被人体所吸收。
2. 非热加工对果蔬类胡萝卜素生物利用度的影响
2.1 高压均质技术
高压均质(High pressure homogenization,HPH)是通过高剪切、空化和湍流等机械效应,使物料发生物理、化学、结构性质等一系列变化的非热加工处理技术[26,36],使得果蔬基质的微观结构破坏,产生尺寸更小更均匀的颗粒,从而改变果蔬样品的质地特征和物理稳定性。
HPH处理对果蔬中类胡萝卜素生物利用度的影响主要是对阻碍其释放的生物屏障进行破坏,从而提高其生物利用度,且会因类胡萝卜素的种类、添加的物质以及处理条件等不同而对类胡萝卜素产生不同的影响(表1)。Zhang等[37]研究表明,HPH(200 MPa/15 min/<35 ℃)处理后番茄汁中番茄红素和ζ-胡萝卜素的生物利用度分别提高了1.43和1.06倍,番茄红素生物利用率的提高主要是由于高压诱导细胞破碎以及全反式番茄红素的异构化,但在消化液中未检测到β-胡萝卜素,这是由于β-胡萝卜素生物利用度过低而无法被检测。Palmero等[31]通过构建不同生物结构屏障的番茄模型系统,研究HPH对类胡萝卜素生物利用度的影响,相关结果表明在含有类胡萝卜素富集油分的天然细胞结构屏障系统中,与可溶相相比,HPH处理不溶相使得天然结构屏障破坏从而显著提高β-胡萝卜素和番茄红素的生物利用度。Liu等[38]研究HPH(20~180 MPa/均质1~3次/入口温度25~70 ℃)处理胡萝卜汁,结果表明HPH处理可使得类胡萝卜素含量在20~150 MPa下保持一定水平,甚至在180 MPa下增加,同时在20~180 MPa下类胡萝卜素的生物利用度没有明显差异,但均质次数的增加会使得类胡萝卜素的生物利用度上升,这可能是由于不同处理条件对细胞壁破坏程度或粒径的不同而引起的。
表 1 HPH处理对果蔬类胡萝卜素含量和生物利用度的影响Table 1. Effects of HPH treatment on carotenoid content and bioavailability of fruits and vegetables研究对象 类胡萝卜素种类 处理条件 研究结论 参考文献 李子番茄、红
甜椒制备的乳剂番茄红素和
β-胡萝卜素100~1500 bar 在添加10%乳剂时,番茄红素和β-胡萝卜素的释放率显著增加 Kirkhus等[16] 胡萝卜 α-胡萝卜素、
β-胡萝卜素10~100 MPa 胡萝卜中随着压力的升高,其转向油脂的含量增加 Mutsokoti等[9] 番茄 β-胡萝卜素、
番茄红素10~100 MPa 随着压力的升高,番茄中α-胡萝卜素和β-胡萝卜素转向油脂的含量提升 Mutsokoti等[9] 橘汁 总类胡萝卜素 150 MPa/68 ℃/15 s 橘汁中总类胡萝卜素含量和生物利用度显著提高(利用度提高5倍) Sentandreu等[40] 胡萝卜汁 类胡萝卜素 20~180 MPa/25~70 ℃ 胡萝卜汁中类胡萝卜素含量和生物利用度显著提升 Liu等[38] 胡萝卜 类胡萝卜素 20~180 MPa/25 ℃ 胡萝卜组织中类胡萝卜素的生物利用度显著提升 Liu等[26] 番茄汁 番茄红素和
ζ-胡萝卜素200 MPa/15 min/<35 ℃ 番茄汁中番茄红素和ζ-胡萝卜素的生物利用度显
著提高(1.43/1.06倍)Zhang等[37] 番茄模型系统 类胡萝卜素 100 MPa处理包含可
溶相细胞族的系统番茄模型系统中类胡萝卜素生物利用度显著增加 Palmero等[31] 橘汁 总类胡萝卜素 150 MPa 橘汁中总类胡萝卜素含量下降,生物利用度显著提升(5倍) Stinco等[41] 番茄汁 番茄红素 100 bar/37 ℃ 番茄汁中番茄红素生物利用度未见显著变化,但加入油脂后
其生物利用度显著提升Colle等[39] 番茄果肉 番茄红素 84~1327 bar/14~34 ℃ 番茄果肉中番茄红素的含量未见显著变化,生物利用度降低 Colle等[36] 番茄模型系统 番茄红素、
β-胡萝卜素100 MPa处理含有色素
细胞和细胞族系统中番茄模型系统中番茄红素和β-胡萝卜素生物利用度无明显变化 Palmero等[31] 红番茄/黄番茄
橙番茄番茄红素、
ζ-胡萝卜素、
叶黄素20~100 MPa/4 ℃ 番茄中番茄红素、ζ-胡萝卜素和叶黄素含量无明显变化,
生物利用度降低(约1倍)Panozzo等[8] 也有研究表明,适当的HPH处理会促进类胡萝卜素的释放,但较高的均质压力反而会进一步造成番茄红素等类胡萝卜素的剧烈降解,或形成较强的纤维网状结构而降低类胡萝卜素的生物利用度。如Colle等[36]研究发现,HPH(84~479 bar/30 min/25 ℃)处理或HPH协同90 ℃热处理番茄浆后,其中番茄红素的生物利用度显著下降,主要是由于HPH处理导致粒径减小,诱导番茄果肉形成更强的纤维结构,导致类胡萝卜素的生物利用度降低。然而,Colle等[39]研究发现,HPH(100 bar/20 min/70~90 d)处理后番茄果肉中番茄红素的生物利用度未见显著变化。
HPH对果蔬类胡萝卜素生物利用度的影响依处理方式或条件、类胡萝卜素种类等不同。HPH可诱导植物细胞破裂,微生物失活,类胡萝卜素释放从而使得类胡萝卜素的生物利用度增加,但细胞的类型和强度又取决于果蔬的类型,压力诱导细胞破裂取决于压力水平,这可能是类胡萝卜素有不同生物利用度的原因[18]。
2.2 超高压技术
超高压技术(High hydrostatic pressure,HHP)是将样品置于传压介质中,经100~1000 MPa加压处理,以达到对食品进行杀菌、钝酶、改性等目的[43]。HHP能够很好地保留食品的功能性色素成分,又能在不降低色素含量的条件下产生更多的同分异构体,从而改变色素的功能性和理化特性[12,50,52-53]
HHP处理可显著影响果蔬中类胡萝卜素含量及生物利用度(如表2所示)。大量研究表明,HHP可诱导提高果蔬类胡萝卜素生物利用度的原因之一可能是HHP可显著提高果蔬类胡萝卜素的含量。如Ramos-Parra等[43]的研究表明,HHP(50~400 MPa/3~60 min/4 ℃下贮存)处理可显著提高类胡萝卜素含量(番茄红素含量提高11倍),这主要是由于HHP可诱导木瓜中类胡萝卜素前体物质如植物烯的浓度上升,促进了类胡萝卜素的合成。Jacobo-Velázquez等[42]研究表明,HHP(600 MPa/3 min)处理的鳄梨样品与未处理样品相比,类胡萝卜素浓度提高56%且其生物利用度也有提高,这可能是由于HHP处理诱导了蛋白质结构的改变,导致类胡萝卜素-蛋白质复合物破坏,促使类胡萝卜素释放从而提高其生物利用度。Huang等[44]研究发现HHP(500 MPa/20 min)下,杏蜜中总类胡萝卜素含量和β-胡萝卜素含量显著增加;另外,发现不同HHP处理条件下,类胡萝卜素的变化可能不同,如在较低压力和较短时间(400 MPa/5 min和300 MPa/5~20 min)条件下α-胡萝卜素含量显著增加,而在较高压力和较长时间(400 MPa/15~20 min和500 MPa/5~20 min)下α-胡萝卜素含量显著降低,从而对其生物利用度产生不同的影响,这可能是由于类胡萝卜素的异构化的结果。
表 2 HHP处理对果蔬类胡萝卜素含量和生物利用度的影响Table 2. Effects of HHP treatment on carotenoid content and bioavailability of fruits and vegetables研究对象 类胡萝卜素种类 处理条件 研究结论 参考文献 鳄梨 总类胡萝卜素 600 MPa/23 ℃/3 min 鳄梨中总类胡萝卜素含量增加(约56%) Jacobo-Velázquez等[42] 杏花蜜 总类胡萝卜素
和β-胡萝卜素500 MPa/40 ℃/20 min 杏花蜜中总类胡萝卜素和β-胡萝卜素含量显著增加 Huang等[44] 番木瓜 类胡萝卜素 50/100 MPa/23 ℃/
3 min/贮存2~4 d番木瓜中类胡萝卜素含量显著增加(1.7倍) Ramos-Parra等[43] 橘汁 总类胡萝卜素 400 MPa/40 ℃/1 min 橘汁胡萝卜素含量显著增加(45.19%) Plaza等[45] 花椰菜、菠菜 叶黄素和
β-胡萝卜素625 MPa/70 ℃/5 min 菠菜中β-胡萝卜素以及花椰菜和菠菜中叶黄素含量显著增加 Sanchez等[46] 胡萝卜 类胡萝卜素 300 MPa/23 ℃/5 min 胡萝卜中类胡萝卜素含量下降,但更有利于类胡萝卜素的提取 Stinco等[47] 番茄汁 番茄红素 700 MPa/30~50 ℃/5 min 番茄汁中番茄红素含量下降,但生物利用度上升 Gupta等[48] 柑橘汁 类胡萝卜素 400 MPa/40 ℃/1 min 柑橘汁中总类胡萝卜素含量下降,但类胡萝卜素生物利用度
显著增加Cilla等[49] 涩柿 总类胡萝卜素 200 MPa/25 ℃/6 min 涩柿中总类胡萝卜素含量下降(22%),但生物利用度提高
(全-E-β-隐黄素(54.2%))Cano等[50] 青豆 类胡萝卜素、
叶黄素400~600 MPa/25 ℃/2 min 青豆中类胡萝卜素含量无显著变化,但600 MPa下叶黄素生物
利用度增加McInerney等[12] 番茄汁 番茄红素 600 MPa/45 ℃/5 min 番茄汁中全反式番茄红素和顺式番茄红素含量无显著变化 Yan等[51] 胡萝卜、番
茄、红辣椒相对类胡萝
卜素含量625 MPa/20 ℃/5 min 胡萝卜、番茄和红辣椒中相对类胡萝卜素含量无显著变化 Sanchez等[46] 番茄汁 全反式
β-胡萝卜素700 MPa/30~50 ℃/5 min 番茄汁中全反式β-胡萝卜素的含量增加,生物利用度无显著变化 Gupta等[48] 胡萝卜 类胡萝卜素 400~600 MPa/25 ℃/2 min 胡萝卜中类胡萝卜素含量和生物利用度无显著变化 McInerney等[12] 花椰菜 叶黄素 400~600 MPa/25 ℃/2 min 花椰菜中叶黄素生物利用度降低 McInerney等[12] 也有研究表明,压力可通过对改变食物基质环境如果胶结构的改变、脂氧合酶活性等影响类胡萝卜素的生物利用度[42,50]。如Cano等[50]研究表明,HHP(200 MPa/25 °C/6 min)处理下,虽然柿子中总类胡萝卜素含量下降了22%,但其生物利用度显著提高,这主要是由于HHP处理会使果胶分子结构中的疏水基团暴露,从而改变了分子间的疏水效应和分子间的相互作用,HHP介导的果胶结构修饰以及与其他植物组织成分的相互作用会影响类胡萝卜素胶束化,从而提高类胡萝卜素的生物利用度。Jacobo-Velázquez等[42],HHP处理(600 MPa/3 min)鳄梨酱,类胡萝卜素含量增加,与对照组相比脂氧合酶的残留活性为43%,但随着储存时间的延长,类胡萝卜素含量下降,这是因为鳄梨中存在的脂氧合酶 II型同工酶能够通过共氧化机制催化类胡萝卜素的降解(O2存在下)[54],从而影响类胡萝卜素的含量和生物利用度。然而,Gupta等[48]研究表明HHP(500~700 MPa/30 ℃)及压力辅助热处理番茄汁可促进番茄红素的提取率提高12%,但其生物利用度在不同处理下(HHP/HHP-热/热)无显著变化,这主要是由于加工使得番茄红素晶体被基质物质包裹且不足以使其溶解并胶束化。
2.3 超声波技术
超声处理(Ultrasound processing,US)是使处理液体中产生微气泡,随后演变成介质,随着气泡的增大,在破碎时产生较大的冲击波,产生空化现象,破裂气泡内部产生具有相关局部极端温度和压力的冲击波,同时超声可诱导大分子(多糖和蛋白质等)结构和功能修饰[55],以此来影响细胞壁和细胞膜[18,56]。
超声可通过对果蔬细胞壁或细胞膜破坏使得类胡萝卜素释放或改变类胡萝卜素的结构进而影响类胡萝卜素的生物利用度[57]。Buniowska等[58]研究表明,与未处理组相比,超声处理(400 W/24 kHz/20~160 s)木瓜和芒果(50.75%/19.25%(v/v))果汁混合物后,混合果汁中类胡萝卜素生物利用度显著提高,Umair等[59]在胡萝卜汁中也获得了类似的结果,这主要是加工破坏细胞膜使得类胡萝卜素释放从而增加了其可接受性。Etzbach等[60]利用超声(160 W/13 kHz)处理橙汁,总类胡萝卜素含量虽然降低,但胶束中的类胡萝卜素含量上升了,这有助于提升类胡萝卜素的生物利用度。Zhang等[37]研究发现,超声处理(400 W)可使得番茄汁中的番茄红素和ζ-胡萝卜素的生物利用度分别提高1.76和0.95倍,这主要归因于超声降低了番茄汁的粒径,同时促进番茄红素全反式异构化,使得番茄红素生物利用度提高。
然而,Anese等[61]研究表明,超声处理(24 kHz/400 W/15~60 min/超声振幅100 mm/强度105 W/cm2)会导致番茄浆和果汁中的番茄红素的生物利用度降低,主要是由于超声处理使得番茄果肉低酯化果胶分子之间通过氢键和疏水相互作用形成网络结构,导致样品具有凝胶状的性质而影响番茄红素的消化过程。因此,超声处理会由于处理条件和基质的不同从而导致对类胡萝卜素生物利用度有不同的影响。
2.4 高压脉冲电场技术
高压脉冲电场(Pulsed electric fields,PEF)是通过诱导暴露在电压脉冲电场的植物组织的细胞膜形成空隙(即电穿孔现象),电场中相反的电荷离子在细胞膜两侧积累导致膜厚度减小,随着电场强度增强(达到0.5~5 kV/cm),会导致气孔形成以及细胞膜的半透性丧失,从而使细胞内容物释放[18,62]。
PEF处理下使得植物组织局部结构变化,细胞膜破裂,从而使得类胡萝卜素释放[63]。Buniowska等[58]发现等效能量输入下,PEF(40 kV/20 ℃/10 s)处理混合果汁甜叶菊后,总类胡萝卜素含量显著增加(18%)且生物利用度显著提升,这是由于PEF加工引起了细胞膜和细胞壁破坏,使得类胡萝卜素释放形成混合胶束从而提高其生物利用度。Jayathunge等[30]研究结果表明,在PEF(0~80次单极脉冲/4冲脉冲贮藏24 h)条件下处理番茄汁,其番茄红素的生物利用度均有提升,这可能是由于PEF处理对细胞膜通透性和番茄红素合成的响应促进了类胡萝卜素在处理后及24 h贮藏后含量提升,从而使得其生物利用度提高。
然而,Bot等[62]研究表明,在PEF(600个脉冲/0.33 Hz/40~45 E)、PEF+热处理条件下,番茄组织中全反式番茄红素生物利用度未见显著变化,但有色体中类胡萝卜素的生物利用度显著降低,全反式番茄红素和β化胡萝卜素含量也有一定的降低,这可能是由于PEF诱导细胞膜修饰和类胡萝卜素-蛋白质复合物诱导修饰,形成新的生物屏障,阻碍类胡萝卜素胶束化,降低类胡萝卜素的生物利用度。因此,PEF处理对果蔬类胡萝卜素的生物利用度的影响主要是改变阻碍其释放的生物屏障如细胞壁、细胞膜等环境的影响,从而改变类胡萝卜素所处的基质环境和可提取性。
2.5 其它
在果蔬加工中,紫外辐射(UV)、脉冲光(PL)、高密度二氧化碳(HPCD)、高压放电(HVED)以及高压等冷离子体(HVCP)等非热加工技术也得到较多的应用[45,58-59,64-68],不同的加工方法及条件可对类胡萝卜素及其生物利用度产生不同的影响。
紫外照射可通过改变类胡萝卜素的结构(顺式、反式)从而影响其生物利用度[69-70]。Bravo等[65]采用紫外(剂量1~12.2 kJ/m2/处理1~12 h/放置2 d)处理番茄,结果表明随着处理时间的延长,番茄红素总量(顺式和反式)逐步提升,且在处理12 h时,顺式番茄红素含量增加最多,从而利于提高番茄红素的生物利用度。Aguiló-Aguayo等[66]采用PL(2.5 kV/1~30 J/cm2)处理番茄组织,结果表明PL仅在通量为30 J/cm2时可提高番茄红素、α-胡萝卜素和β-萝胡萝卜素的含量,且在5.36 J/cm2下处理新鲜番茄制备的番茄汁中,贮藏15 d后番茄红素的生物利用度有所提高,PL处理可能作为对PL处理的光保护性抗氧化剂防御而刺激类胡萝卜素的生物合成路径,从而番茄红素含量上升,生物利用度提高,GuillermoValdivia等[70]通过PL处理鲜切番茄中也获得了相同的结果。Zhao等[68]研究发现,与对照组和热处理组相比,HPCD(20 MPa/20~60 min)处理后番茄汁中番茄红素的生物可及性显著提高,这可能是是归因于HPCD的均质和番茄红素顺式异构化作用[71-72]。Buniowska等[58]的研究表明,HVED(32~256 kJ/kg/0.5 Hz)处理使得混合果汁甜叶菊中类胡萝卜素生物利用度较未处理组显著提升,这主要是由于加工可以引起细胞膜破坏,导致生物活性化合物的释放,从而提高了其生物利用度。Umair等[59]利用HVCP(40 kV/等离子体放电4 min)处理胡萝卜汁,观察到总类胡萝卜素、番茄红素以及叶黄素含量显著增加,这主要归因于反式异构体向生物利用度更高的形式(顺式异构体)转化以及细胞结构破坏。
此外,果蔬加工过程中还常采用两种或两种以上非热或热加工技术协同处理[40,45,59-60,73-74]。如Jayathunge等[30]采用超声(20 kHz/7 min)协同脉冲电场(100 Hz,1500 μs)和漂烫对番茄汁进行处理,结果表明番茄红素的保留率较高,这是由于漂烫或PEF处理引起的热会增加类胡萝卜素的可提取水平,且该处理还显著提升了全反式番茄红素的生物利用度。Umair等[59]采用HVCP(70 kV/4 min/3次)和US(20 kHz/15 ℃/3 min)联用处理胡萝卜汁,结果显示该处理显著提高了总类胡萝卜素、番茄红素和叶黄素的含量,这进一步表明可以通过US-HVCP联用保留类胡萝卜素等营养成分提高其生物利用度从而提升加工果汁的品质。
3. 加工对果蔬中类胡萝卜素生物利用度影响的可能途径
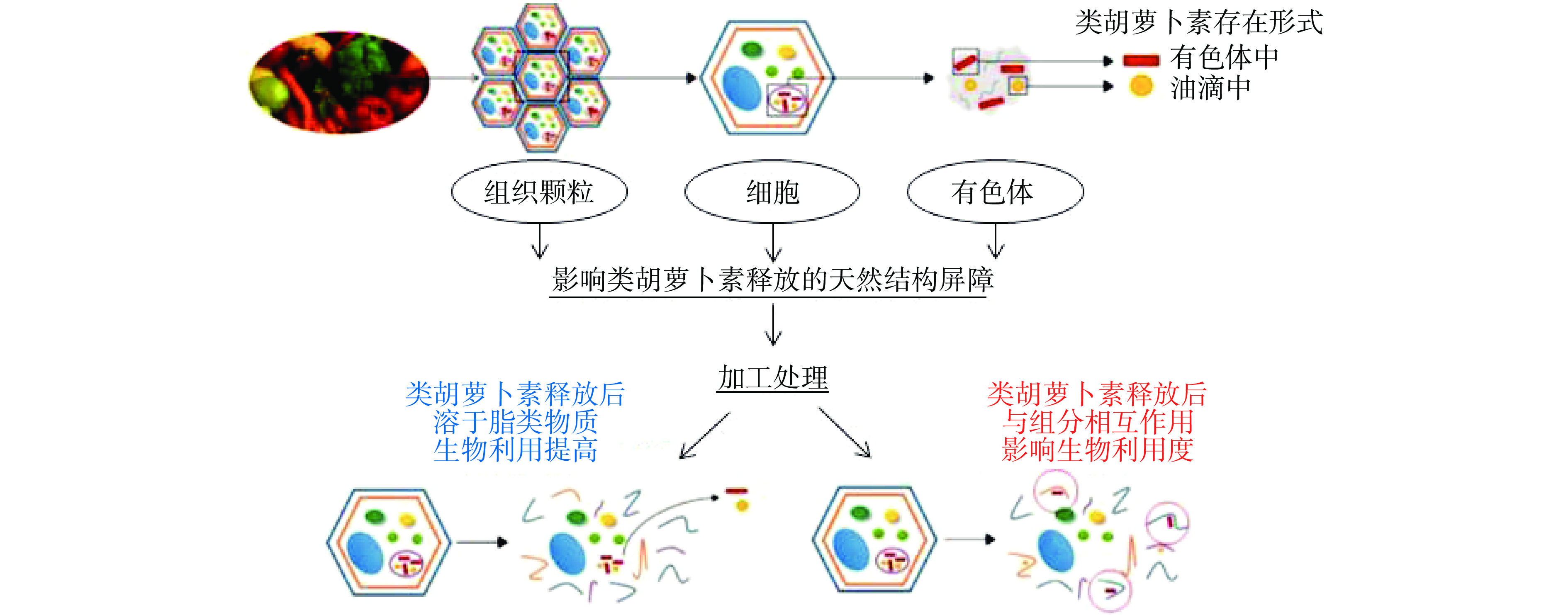
果蔬中类胡萝卜素的生物利用度主要取决于类胡萝卜素所在的食品质体类型(亚细胞定位)、类胡萝卜素种类与结构(即反式与顺式异构体)、所处基质环境是否存在促进或抑制其吸收的化合物(脂肪和膳食纤维等)[41,75]。食品加工可能通过调控果蔬食品中类胡萝卜素的释放及其基质环境,进而影响类胡萝卜素的生物利用度(图1)。一方面,加工可有效破坏阻止类胡萝卜素释放的天然结构屏障,同时引起类胡萝卜素组成和结构的变化,进而影响到类胡萝卜素的生物利用度[9,24,76-78];另一方面,加工介导下果蔬食品中释放的类胡萝卜素可与不同基质组分在均相或两相界面等多途径发生相互作用从而影响其生物利用度[18,79]。
3.1 加工对果蔬中类胡萝卜素的影响
3.1.1 加工对果蔬中类胡萝卜素释放的影响
果蔬原料的组织颗粒、细胞壁、有色体等天然细胞结构屏障的存在会影响类胡萝卜素的释放[23]。已有研究表明,类胡萝卜素的生物包封程度与其生物利用度呈负相关[31],即硬度较低、细胞壁较薄的果蔬原料中类胡萝卜素生物利用度较高,溶于油脂中的类胡萝卜素生物利用度最高。适度的加工处理可有效破坏果蔬天然结构屏障而促进类胡萝卜素的溶出[9,80]。常见的非热加工处理可使细胞壁破坏、类胡萝卜素与果胶等物质的结合[7,14]、类胡萝卜素-蛋白复合物变性等促进类胡萝卜素释放[24],但也有报道表明,加工也会造成类胡萝卜素部分降解、降低其胶束化水平[10]。非热加工中的高压均质作为典型的机械处理,对于胡萝卜等硬度较高的果蔬食品中类胡萝卜素释放效果显著[38],但对于番茄、芒果等硬度较低的食品影响较小[39],较高的均质压力还可能会造成番茄红素等类胡萝卜素的剧烈降解(48%)[37]或形成较强的纤维网状结构降低类胡萝卜素的生物利用度[8]。
3.1.2 加工对类胡萝卜素结构的影响
类胡萝卜素结构也是影响其生物利用度的重要因素之一[18],通常情况下,同种类胡萝卜素的顺式异构体较其反式异构体更容易形成胶束而被消化吸收[81]。果蔬中天然存在的类胡萝卜素多以全反式结构存在,加工可导致类胡萝卜素发生顺-反异构或降解[10,37,46,52,78,82]。如热处理会导致类胡萝卜素发生异构化,改变其溶解度,从而影响其生物利用度[14]。经过高压处理后,类胡萝卜素反式结构随着压力的增加而降低,顺式结构则相反[37]。Gupta等[48]研究发现,番茄原汁中反式-β-胡萝卜素含量高达16%,采用不同加工工艺(压力和其他加工方式结合以及单独超高压)处理后样品中全反式β-胡萝卜素含量发生显著增加(15%~30%)。
3.2 加工对果蔬类胡萝卜素基质环境的影响
3.2.1 果胶等膳食纤维
加工破坏了果蔬中包埋类胡萝卜素的天然结构屏障,使得细胞壁破碎[24]。膳食纤维是组成细胞壁结构的重要成分,加工过程中释放的可溶性膳食纤维在果蔬加工制品中可作为大分子连续相,类胡萝卜素以分散相分散在其中,分散相的生物利用率将显著受连续相组成、结构以及均一稳定性的影响[3,83]。果胶作为主要的可溶性膳食纤维,已被广泛证明可影响脂类和类胡萝卜素的消化吸收[7,84],其主要通过提高消化液黏度、与脂肪酶或胆盐结合、与钙结合或对脂滴包裹而影响类胡萝卜素生物利用度[7,15,29,50,83-84]。果胶链的螺旋结构无序性使得分子间相互作用可以改变消化介质中的微粘度[84](增加胃中消化液的粘度),从而影响对食糜的剪切力作用,延长食物在胃和小肠阶段的消化时间并降低基质与酶之间的运输效率[29]。在底物存在的情况下,果胶还会与脂肪酶优先形成复合物,从而抑制脂肪酶对底物作用,限制了油脂和类胡萝卜素形成混合胶束,降低了类胡萝卜素的生物利用度[29,84]。果胶与钙离子的结合会形成凝胶体系,从而影响类胡萝卜素的消化吸收过程;果胶与胆盐的结合影响了脂质消化和胶束化的形成;带负电荷的果胶由于表面活性和静电吸引力包裹在以二酰基甘油和三酰基甘油组成的脂滴表面形成保护膜,从而阻止了脂肪酶和脂滴的接触,影响类胡萝卜素的生物利用度[29,84]。
据报道,果胶对类胡萝卜素起物理屏障作用[50]。也有研究表明高浓度果胶显著降低类胡萝卜素胶束化,而低浓度却有利于提高类胡萝卜素的生物可利用性[32],这可能是由于高浓度的果胶会进一步包裹类胡萝卜素分子,形成新的生物屏障,从而降低其生物利用度[79]。另外,果胶的酯化度(DM)值对类胡萝卜素生物利用度影响较大[85]。通常情况下高DM果胶会导致与钙的结合减少,凝胶减少,同时高DM果胶的疏水特性使其具有较高的乳化能力,从而提高了脂质消化速率和胶束化速率[15]。加工可通过破坏细胞结构如细胞壁或者细胞器膜等,使得细胞中的果胶等物质释放[20,79]。如Al-Yafeai等[78]对玫瑰果的研究发现,与未加工的样品相比,其果胶含量较高。Cano等[50]研究表明,加工也会对果胶的结构产生影响,如超高压处理会使得果胶分子的疏水基团暴露,影响分子间的疏水效应和分子间的相互作用,从而影响类胡萝卜素的生物利用度。
3.2.2 脂类等其他基质组分
类胡萝卜素作为一种脂溶性物质,其更容易与脂类物质水解形成混合胶束被人体吸收[26]。脂类物质主要通过刺激胆盐分泌、为类胡萝卜素提供疏水环境以及促进胶束的形成影响类胡萝卜素的生物利用度[3]。果蔬中脂类物质含量极少,可通过一些加工促进油脂的溶出或添加油脂促进类胡萝卜素的溶出和吸收。Liu等[26]对比添加2%或10%的玉米油制备的胡萝卜汁混合乳液,经过HPH处理后,总类胡萝卜素、β-胡萝卜素和α-胡萝卜素的生物利用度显著提高。同时,油脂的饱和度也会影响类胡萝卜素的生物利用度,如Verkempinck等[85]研究橄榄油、大豆油、亚麻籽油和蔗糖酯(5% W/V)制备乳剂递送类胡萝卜素,发现橄榄油中存在的单不饱和脂肪酸更具有疏水性,从而导致胶束具有更大的溶解疏水类胡萝卜素的能力,结果表明油脂的不饱和度可能在胃肠道中调节脂解和类胡萝卜素的生物可及性。加工通过破坏果蔬细胞结构,使得类胡萝卜素释放,脂质等物质与其结合形成胶束[9];同时,胆汁中分泌的胆汁酸和磷脂胆碱也有助于膳食脂类和类胡萝卜素的分散[76],从而提高类胡萝卜素的生物利用度。
3.2.3 其他
果蔬中也含有少量蛋白质,Iddir等[86]研究表明蛋白质在消化过程中可通过肽类物质影响消化酶或脂滴进入从而改变类胡萝卜素的生物利用度,同时,通过添加不同浓度和种类的蛋白质如乳清分离蛋白、大豆分离蛋白等研究其对类胡萝卜素生物利用度的影响,结果表明蛋白质在消化过程中会根据类胡萝卜素和蛋白质种类的不同而不同程度地影响类胡萝卜素的生物可及性,同时会产生正向和负向相互作用。
另外,加工使得细胞破坏而释放的内源性物质如果胶或脂类等物质,可能进一步发生互作效应[16]。果胶通过改变油滴的表面性质和抑制脂肪酶的活性从而来抑制脂质消化影响类胡萝卜素的生物利用度[36,50]。果胶同时具有乳化特性,油脂存在的情况下可形成乳液,对类胡萝卜素有包封、增溶和稳定的作用[26]。Sotomayor-Gerding等[87]研究表明,水包油乳状液可以有效的包封和输送类胡萝卜素,以此方法输送的类胡萝卜素具有较高的生物利用度。
4. 结语
果蔬中类胡萝卜素的低生物利用度问题严重影响了其生物活性的有效发挥。加工可能会改变果蔬中类胡萝卜素的组成、结构和类胡萝卜素所处的基质环境,使其从有色体等组织中释放并与食物基质中的物质如脂肪、胆碱等相互作用,形成混合胶束被小肠上皮细胞吸收,以有效发挥其生物活性。
非热加工技术是目前重要的食品加工手段,已被广泛应用于果蔬加工行业,其对果蔬中类胡萝卜素生物利用度的影响研究具有重要意义。然而,目前非热加工对果蔬中类胡萝卜素生物利用度影响机制研究还不够深入,现有研究主要集中在不同非热加工处理破坏影响类胡萝卜素释放的组织或细胞等天然结构屏障以促进其从原料中释放及结构异构化。未来的研究应加强不同非热加工技术介导下果蔬内源基质组分变化及其与类胡萝卜素相互作用对类胡萝卜素生物利用度影响的研究,进一步完善真实食品体系中类胡萝卜素生物利用度调控机制与理论,为寻求科学有效的新型加工技术应用于果蔬营养品质精准调控、实现精准营养提供指导。
-
表 1 HPH处理对果蔬类胡萝卜素含量和生物利用度的影响
Table 1 Effects of HPH treatment on carotenoid content and bioavailability of fruits and vegetables
研究对象 类胡萝卜素种类 处理条件 研究结论 参考文献 李子番茄、红
甜椒制备的乳剂番茄红素和
β-胡萝卜素100~1500 bar 在添加10%乳剂时,番茄红素和β-胡萝卜素的释放率显著增加 Kirkhus等[16] 胡萝卜 α-胡萝卜素、
β-胡萝卜素10~100 MPa 胡萝卜中随着压力的升高,其转向油脂的含量增加 Mutsokoti等[9] 番茄 β-胡萝卜素、
番茄红素10~100 MPa 随着压力的升高,番茄中α-胡萝卜素和β-胡萝卜素转向油脂的含量提升 Mutsokoti等[9] 橘汁 总类胡萝卜素 150 MPa/68 ℃/15 s 橘汁中总类胡萝卜素含量和生物利用度显著提高(利用度提高5倍) Sentandreu等[40] 胡萝卜汁 类胡萝卜素 20~180 MPa/25~70 ℃ 胡萝卜汁中类胡萝卜素含量和生物利用度显著提升 Liu等[38] 胡萝卜 类胡萝卜素 20~180 MPa/25 ℃ 胡萝卜组织中类胡萝卜素的生物利用度显著提升 Liu等[26] 番茄汁 番茄红素和
ζ-胡萝卜素200 MPa/15 min/<35 ℃ 番茄汁中番茄红素和ζ-胡萝卜素的生物利用度显
著提高(1.43/1.06倍)Zhang等[37] 番茄模型系统 类胡萝卜素 100 MPa处理包含可
溶相细胞族的系统番茄模型系统中类胡萝卜素生物利用度显著增加 Palmero等[31] 橘汁 总类胡萝卜素 150 MPa 橘汁中总类胡萝卜素含量下降,生物利用度显著提升(5倍) Stinco等[41] 番茄汁 番茄红素 100 bar/37 ℃ 番茄汁中番茄红素生物利用度未见显著变化,但加入油脂后
其生物利用度显著提升Colle等[39] 番茄果肉 番茄红素 84~1327 bar/14~34 ℃ 番茄果肉中番茄红素的含量未见显著变化,生物利用度降低 Colle等[36] 番茄模型系统 番茄红素、
β-胡萝卜素100 MPa处理含有色素
细胞和细胞族系统中番茄模型系统中番茄红素和β-胡萝卜素生物利用度无明显变化 Palmero等[31] 红番茄/黄番茄
橙番茄番茄红素、
ζ-胡萝卜素、
叶黄素20~100 MPa/4 ℃ 番茄中番茄红素、ζ-胡萝卜素和叶黄素含量无明显变化,
生物利用度降低(约1倍)Panozzo等[8] 表 2 HHP处理对果蔬类胡萝卜素含量和生物利用度的影响
Table 2 Effects of HHP treatment on carotenoid content and bioavailability of fruits and vegetables
研究对象 类胡萝卜素种类 处理条件 研究结论 参考文献 鳄梨 总类胡萝卜素 600 MPa/23 ℃/3 min 鳄梨中总类胡萝卜素含量增加(约56%) Jacobo-Velázquez等[42] 杏花蜜 总类胡萝卜素
和β-胡萝卜素500 MPa/40 ℃/20 min 杏花蜜中总类胡萝卜素和β-胡萝卜素含量显著增加 Huang等[44] 番木瓜 类胡萝卜素 50/100 MPa/23 ℃/
3 min/贮存2~4 d番木瓜中类胡萝卜素含量显著增加(1.7倍) Ramos-Parra等[43] 橘汁 总类胡萝卜素 400 MPa/40 ℃/1 min 橘汁胡萝卜素含量显著增加(45.19%) Plaza等[45] 花椰菜、菠菜 叶黄素和
β-胡萝卜素625 MPa/70 ℃/5 min 菠菜中β-胡萝卜素以及花椰菜和菠菜中叶黄素含量显著增加 Sanchez等[46] 胡萝卜 类胡萝卜素 300 MPa/23 ℃/5 min 胡萝卜中类胡萝卜素含量下降,但更有利于类胡萝卜素的提取 Stinco等[47] 番茄汁 番茄红素 700 MPa/30~50 ℃/5 min 番茄汁中番茄红素含量下降,但生物利用度上升 Gupta等[48] 柑橘汁 类胡萝卜素 400 MPa/40 ℃/1 min 柑橘汁中总类胡萝卜素含量下降,但类胡萝卜素生物利用度
显著增加Cilla等[49] 涩柿 总类胡萝卜素 200 MPa/25 ℃/6 min 涩柿中总类胡萝卜素含量下降(22%),但生物利用度提高
(全-E-β-隐黄素(54.2%))Cano等[50] 青豆 类胡萝卜素、
叶黄素400~600 MPa/25 ℃/2 min 青豆中类胡萝卜素含量无显著变化,但600 MPa下叶黄素生物
利用度增加McInerney等[12] 番茄汁 番茄红素 600 MPa/45 ℃/5 min 番茄汁中全反式番茄红素和顺式番茄红素含量无显著变化 Yan等[51] 胡萝卜、番
茄、红辣椒相对类胡萝
卜素含量625 MPa/20 ℃/5 min 胡萝卜、番茄和红辣椒中相对类胡萝卜素含量无显著变化 Sanchez等[46] 番茄汁 全反式
β-胡萝卜素700 MPa/30~50 ℃/5 min 番茄汁中全反式β-胡萝卜素的含量增加,生物利用度无显著变化 Gupta等[48] 胡萝卜 类胡萝卜素 400~600 MPa/25 ℃/2 min 胡萝卜中类胡萝卜素含量和生物利用度无显著变化 McInerney等[12] 花椰菜 叶黄素 400~600 MPa/25 ℃/2 min 花椰菜中叶黄素生物利用度降低 McInerney等[12] -
[1] 陈坚. 中国食品科技: 从2020到2035[J]. 中国食品学报,2019,19(12):1−5. [CHEN J. China Food Science and Technology: From 2020 to 2035[J]. Chinese Journal of Food Science,2019,19(12):1−5. [2] BERNI P, CAMPOLI S S, NEGRI T C, et al. Non-conventional tropical fruits: Characterization, antioxidant potential and carotenoid bioaccessibility[J]. Plant Foods Hum Nutr,2019,74(1):141−148. doi: 10.1007/s11130-018-0710-1
[3] PRIYADARSHANI A M. A review on factors influencing bioaccessibility and bioefficacy of carotenoids[J]. Crit Rev Food Sci Nutr,2017,57(8):1710−1717. doi: 10.1080/10408398.2015.1023431
[4] 刘嘉宁, 刘璇, 毕金峰. 破碎和均细化处理方式对胡萝卜汁中类胡萝卜素释放的影响[J]. 农业工程学报,2017,33(14):307−314. [LIU J N, LIU X, BI J F. Effects of crushing and homogenizing treatment methods on the release of carotenoids in carrot juice[J]. Transactions of the Chinese Society of Agricultural Engineering,2017,33(14):307−314. doi: 10.11975/j.issn.1002-6819.2017.14.041 [5] ALAM M K, SAMS S, RANA Z H, et al. Minerals, vitamin C, and effect of thermal processing on carotenoids composition in nine varieties orange-fleshed sweet potato (Ipomoea batatas L. )[J]. Journal of Food Composition and Analysis,2020,92:103582. doi: 10.1016/j.jfca.2020.103582
[6] DE OLIVEIRA C L, BRYCHKOVA G, ESTEVES-FERREIRA A A, et al. Thermal disruption of the food matrix of biofortified lettuce varieties modifies absorption of carotenoids by Caco-2 cells[J]. Food Chem,2020,308:125443. doi: 10.1016/j.foodchem.2019.125443
[7] CHACON-ORDONEZ T, CARLE R, SCHWEIGGERT R. Bioaccessibility of carotenoids from plant and animal foods[J]. J Sci Food Agric,2019,99(7):3220−3239. doi: 10.1002/jsfa.9525
[8] PANOZZO A, LEMMENS L, VAN L A, et al. Microstructure and bioaccessibility of different carotenoid species as affected by high pressure homogenisation: A case study on differently coloured tomatoes[J]. Food Chem,2013,141(4):4094−100. doi: 10.1016/j.foodchem.2013.06.099
[9] MUTSOKOTI L, PANOZZO A, MUSABE E T, et al. Carotenoid transfer to oil upon high pressure homogenisation of tomato and carrot based matrices[J]. Journal of Functional Foods,2015,19:775−785. doi: 10.1016/j.jff.2015.10.017
[10] RODRIGUEZ-ROQUE M J, DE ANCOS B, SANCHEZ-VEGA R, et al. Food matrix and processing influence on carotenoid bioaccessibility and lipophilic antioxidant activity of fruit juice-based beverages[J]. Food Funct,2016,7(1):380−389. doi: 10.1039/C5FO01060H
[11] TAN Y, ZHANG Z, ZHOU H, et al. Factors impacting lipid digestion and beta-carotene bioaccessibility assessed by standardized gastrointestinal model (INFOGEST): Oil droplet concentration[J]. Food Funct,2020,11(8):7126−7137. doi: 10.1039/D0FO01506G
[12] MCINERNEY J K, SECCAFIEN C A, STEWART C M, et al. Effects of high pressure processing on antioxidant activity, and total carotenoid content and availability, in vegetables[J]. Innovative Food Science & Emerging Technologies,2007,8(4):543−548.
[13] 易建勇, 侯春辉, 毕金峰, 等. 果蔬食品中类胡萝卜素生物利用度研究进展[J]. 中国食品学报,2019,19(9):286−297. [YI J Y, HOU C H, BI J F, et al. Research progress on the bioavailability of carotenoids in fruit and vegetable foods[J]. Chinese Journal of Food Science,2019,19(9):286−297. [14] CILLA A, BOSCH L, BARBERÁ R, et al. Effect of processing on the bioaccessibility of bioactive compounds–A review focusing on carotenoids, minerals, ascorbic acid, tocopherols and polyphenols[J]. Journal of Food Composition and Analysis,2018,68:3−15. doi: 10.1016/j.jfca.2017.01.009
[15] WELLALA C K D, BI J, LIU X, et al. Juice related water-soluble pectin characteristics and bioaccessibility of bioactive compounds in oil and emulsion incorporated mixed juice processed by high pressure homogenization[J]. Food Hydrocolloids,2019,93:56−67. doi: 10.1016/j.foodhyd.2019.02.011
[16] KIRKHUS B, AFSETH N K, BORGE G I A, et al. Increased release of carotenoids and delayed in vitro lipid digestion of high pressure homogenized tomato and pepper emulsions[J]. Food Chem,2019,285:282−289. doi: 10.1016/j.foodchem.2019.01.124
[17] ZHANG Z, WANG X, LI Y, et al. Evaluation of the impact of food matrix change on the in vitro bioaccessibility of carotenoids in pumpkin (Cucurbita moschata) slices during two drying processes[J]. Food Funct,2017,8(12):4693−4702. doi: 10.1039/C7FO01382E
[18] BARBA F J, MARIUTTI L R B, BRAGAGNOLO N, et al. Bioaccessibility of bioactive compounds from fruits and vegetables after thermal and nonthermal processing[J]. Trends in Food Science & Technology,2017,67:195−206.
[19] 闫凤娇. 国内外食品非热加工技术发展状况[J]. 食品安全导刊,2020(18):178. [YAN F J. The development status of non-thermal food processing technology at home and abroad[J]. Food Safety Guide,2020(18):178. [20] LIU F, LIAO X, WANG Y. Effects of high-pressure processing with or without blanching on the antioxidant and physicochemical properties of mango pulp[J]. Food and Bioprocess Technology,2016,9(8):1306−1316. doi: 10.1007/s11947-016-1718-x
[21] 惠俊楠, 李若楠, 李玲茜, 等. 类胡萝卜素应用的研究进展[J]. 畜牧与兽医,2020,52(4):143−147. [HUI J N, LI R N, LI L Q, et al. Research progress in the application of carotenoids[J]. Animal Husbandry and Veterinary Medicine,2020,52(4):143−147. [22] OCHOA B M, MOJICA C L, HSIEH L M, et al. Lutein as a functional food ingredient: Stability and bioavailability[J]. Journal of Functional Foods,2020,66:103771. doi: 10.1016/j.jff.2019.103771
[23] YI J, ZHAO Y, BI J, et al. Evaluation of processing methods and oral mastication on the carotenoid bioaccessibility of restructured carrot chips[J]. J Sci Food Agric,2020,100(13):4858−4869. doi: 10.1002/jsfa.10546
[24] VERKEMPINCK S, PALLARES PALLARES A, HEN- DRICKX M, et al. Processing as a tool to manage digestive barriers in plant-based foods: Recent advances[J]. Current Opinion in Food Science,2020,35:1−9.
[25] KHOO H E, PRASAD K N, KONG K W, et al. Carotenoids and their isomers: Color pigments in fruits and vegetables[J]. Molecules,2011,16(2):1710−1738. doi: 10.3390/molecules16021710
[26] LIU J, BI J, LIU X, et al. Effects of high pressure homogenization and addition of oil on the carotenoid bioaccessibility of carrot juice[J]. Food Funct,2019,10(1):458−468. doi: 10.1039/C8FO01925H
[27] PHAN M A T, BUCKNALL M P, ARCOT J. Co-ingestion of red cabbage with cherry tomato enhances digestive bioaccessibility of anthocyanins but decreases carotenoid bioaccessibility after simulatedin vitro gastro-intestinal digestion[J]. Food Chem,2019,298:125040. doi: 10.1016/j.foodchem.2019.125040
[28] YAO K, MCCLEMENTS D J, XIANG J, et al. Improvement of carotenoid bioaccessibility from spinach by co-ingesting with excipient nanoemulsions: Impact of the oil phase composition[J]. Food Funct,2019,10(9):5302−5311. doi: 10.1039/C9FO01328H
[29] 刘璇, 刘嘉宁, 毕金峰, 等. 果胶对脂类和类胡萝卜素消化利用影响研究进展[J]. 农业工程学报,2018,34(13):311−318. [LIU X, LIU J N, BI J F, et al. Research progress in the effect of pectin on the digestion and utilization of lipids and carotenoids[J]. Transactions of the Chinese Society of Agricultural Engineering,2018,34(13):311−318. doi: 10.11975/j.issn.1002-6819.2018.13.038 [30] JAYATHUNGE K, STRATAKOS A C, CREGENZAN-ALBERTIA O, et al. Enhancing the lycopene in vitro bioaccessibility of tomato juice synergistically applying thermal and non-thermal processing technologies[J]. Food Chem,2017,221:698−705. doi: 10.1016/j.foodchem.2016.11.117
[31] PALMERO P, PANOZZO A, COLLE I, et al. Role of structural barriers for carotenoid bioaccessibility upon high pressure homogenization[J]. Food Chem,2016,199:423−432. doi: 10.1016/j.foodchem.2015.12.062
[32] XAVIER A A O, MERCADANTE A Z. The bioaccessibility of carotenoids impacts the design of functional foods[J]. Current Opinion in Food Science,2019,26:1−8.
[33] PETRY F C, MERCADANTE A Z. Impact of in vitro digestion phases on the stability and bioaccessibility of carotenoids and their esters in mandarin pulps[J]. Food Funct,2017,8(11):3951−3963. doi: 10.1039/C7FO01075C
[34] VERRIJSSEN T A, CHRISTIAENS S, VERKEMPINCK S H, et al. In vitro beta-Carotene bioaccessibility and lipid digestion in emulsions: Influence of pectin type and degree of methyl-esterification[J]. J Food Sci,2016,81(10):C2327−C2336. doi: 10.1111/1750-3841.13408
[35] PETRY F C, MERCADANTE A Z. Bile amount affects both the degree of micellarization and the hydrolysis extent of carotenoid esters during in vitro digestion[J]. Food Funct,2019,10(12):8250−8262. doi: 10.1039/C9FO01453E
[36] COLLE I, VAN BUGGENHOUT S, VAN LOEY A, et al. High pressure homogenization followed by thermal processing of tomato pulp: Influence on microstructure and lycopene in vitro bioaccessibility[J]. Food Research International,2010,43(8):2193−2200. doi: 10.1016/j.foodres.2010.07.029
[37] ZHANG W, YU Y, XIE F, et al. High pressure homogenization versus ultrasound treatment of tomato juice: Effects on stability and in vitro bioaccessibility of carotenoids[J]. LWT,2019,116:108597. doi: 10.1016/j.lwt.2019.108597
[38] LIU X, LIU J, BI J, et al. Effects of high pressure homogenization on pectin structural characteristics and carotenoid bioaccessibility of carrot juice[J]. Carbohydr Polym,2019,203:176−184. doi: 10.1016/j.carbpol.2018.09.055
[39] COLLE I J P, LEMMENS L, VAN BUGGENHOUT S, et al. Processing tomato pulp in the presence of lipids: The impact on lycopene bioaccessibility[J]. Food Research International,2013,51(1):32−38. doi: 10.1016/j.foodres.2012.11.024
[40] SENTANDREU E, STINCO C M, VICARIO I M, et al. High-pressure homogenization as compared to pasteurization as a sustainable approach to obtain mandarin juices with improved bioaccessibility of carotenoids and flavonoids[J]. Journal of Cleaner Production,2020,262:121325. doi: 10.1016/j.jclepro.2020.121325
[41] STINCO C M, SENTANDREU E, MAPELLI-BRAHM P, et al. Influence of high pressure homogenization and pasteurization on the in vitro bioaccessibility of carotenoids and flavonoids in orange juice[J]. Food Chem,2020,331:127259. doi: 10.1016/j.foodchem.2020.127259
[42] JACOBO-VELÁZQUEZ D A, HERNÁNDEZ-BRENES C. Stability of avocado paste carotenoids as affected by high hydrostatic pressure processing and storage[J]. Innovative Food Science & Emerging Technologies,2012,16:121−128.
[43] RAMOS-PARRA P A, GARCIA-SALINAS C, RODRIGUEZ-LOPEZ C E, et al. High hydrostatic pressure treatments trigger de novo carotenoid biosynthesis in papaya fruit (Carica papaya cv. Maradol)[J]. Food Chem,2019,277:362−372. doi: 10.1016/j.foodchem.2018.10.102
[44] HUANG W, BI X, ZHANG X, et al. Comparative study of enzymes, phenolics, carotenoids and color of apricot nectars treated by high hydrostatic pressure and high temperature short time[J]. Innovative Food Science & Emerging Technologies,2013,18:74−82.
[45] PLAZA L, SÁNCHEZ-MORENO C, DE ANCOS B, et al. Carotenoid and flavanone content during refrigerated storage of orange juice processed by high-pressure, pulsed electric fields and low pasteurization[J]. LWT-Food Science and Technology,2011,44(4):834−839. doi: 10.1016/j.lwt.2010.12.013
[46] SANCHEZ C, BARANDA A B, MARTINEZ DE MARANON I. The effect of high pressure and high temperature processing on carotenoids and chlorophylls content in some vegetables[J]. Food Chem,2014,163:37−45. doi: 10.1016/j.foodchem.2014.04.041
[47] STINCO C M, SZCZEPANSKA J, MARSZALEK K, et al. Effect of high-pressure processing on carotenoids profile, colour, microbial and enzymatic stability of cloudy carrot juice[J]. Food Chem,2019,299:125112. doi: 10.1016/j.foodchem.2019.125112
[48] GUPTA R, KOPEC R E, SCHWARTZ S J, et al. Combined pressure-temperature effects on carotenoid retention and bioaccessibility in tomato juice[J]. J Agric Food Chem,2011,59(14):7808−7817. doi: 10.1021/jf200575t
[49] CILLA A, RODRIGO M J, DE ANCOS B, et al. Impact of high-pressure processing on the stability and bioaccessibility of bioactive compounds in Clementine mandarin juice and its cytoprotective effect on Caco-2 cells[J]. Food Funct,2020:8951−8962.
[50] CANO M P, GOMEZ-MAQUEO A, FERNANDEZ-LOPEZ R, et al. Impact of high hydrostatic pressure and thermal treatment on the stability and bioaccessibility of carotenoid and carotenoid esters in astringent persimmon (Diospyros kaki Thunb, var. Rojo Brillante)[J]. Food Res Int,2019,123:538−549. doi: 10.1016/j.foodres.2019.05.017
[51] YAN B, MARTíNEZ-MONTEAGUDO S I, COOPERSTONE J L, et al. Impact of thermal and pressure-based technologies on carotenoid retention and quality attributes in tomato juice[J]. Food and Bioprocess Technology,2017,10(5):808−818. doi: 10.1007/s11947-016-1859-y
[52] 刘兰英, 李晓莺, 禄璐, 等. 超高压对果蔬类胡萝卜素及抗氧化活性影响的研究进展[J]. 宁夏农林科技,2019,60(8):56−59. [LIU L Y, LI X Y, LU L, et al. Research progress on the effects of ultra-high pressure on carotenoids and antioxidant activities of fruits and vegetables[J]. Ningxia Agriculture and Forestry Science and Technology,2019,60(8):56−59. doi: 10.3969/j.issn.1002-204x.2019.08.020 [53] ZHAO G, ZHANG R, ZHANG M. Effects of high hydrostatic pressure processing and subsequent storage on phenolic contents and antioxidant activity in fruit and vegetable products[J]. International Journal of Food Science & Technology,2017,52(1):3−12.
[54] JACOBO-VELáZQUEZ D A, HERNáNDEZ-BRENES C, CISNEROS-ZEVALLOS L, et al. Partial purification and enzymatic characterization of avocado (Persea americana Mill, cv. Hass) lipoxygenase[J]. Food Research International,2010,43(4):1079−1085. doi: 10.1016/j.foodres.2010.01.021
[55] ANESE M, BOT F, PANOZZO A, et al. Effect of ultrasound treatment, oil addition and storage time on lycopene stability and in vitrobioaccessibility of tomato pulp[J]. Food Chemistry,2015,172:685−691. doi: 10.1016/j.foodchem.2014.09.140
[56] KUMCUOGLU S, YILMAZ T, TAVMAN S. Ultrasound assisted extraction of lycopene from tomato processing wastes[J]. J Food Sci Technol,2014,51(12):4102−4107. doi: 10.1007/s13197-013-0926-x
[57] BUNIOWSKA M, ARRIGONI E, ZNAMIROWSKA A, et al. Liberation and micellarization of carotenoids from different smoothies after thermal and ultrasound treatments[J]. Foods,2019,8(10):492. doi: 10.3390/foods8100492
[58] BUNIOWSKA M, CARBONELL-CAPELLA J M, FRIGOLA A, et al. Bioaccessibility of bioactive compounds after non-thermal processing of an exotic fruit juice blend sweetened with Stevia rebaudiana[J]. Food Chem,2017,221:1834−1842. doi: 10.1016/j.foodchem.2016.10.093
[59] UMAIR M, JABBAR S, SENAN A M, et al. Influence of combined effect of ultra-sonication and high-voltage cold plasma treatment on quality parameters of carrot juice[J]. Foods,2019,8(11):593. doi: 10.3390/foods8110593
[60] ETZBACH L, STOLLE R, ANHEUSER K, et al. Impact of different pasteurization techniques and subsequent ultrasonication on the in vitro bioaccessibility of carotenoids in Valencia orange (Citrus sinensis (L.) Osbeck) juice[J]. Antioxidants (Basel), 2020, 9(6):534.
[61] ANESE M, MIROLO G, BERALDO P, et al. Effect of ultrasound treatments of tomato pulp on microstructure and lycopene in vitro bioaccessibility[J]. Food Chem,2013,136(2):458−463. doi: 10.1016/j.foodchem.2012.08.013
[62] BOT F, VERKERK R, MASTWIJK H, et al. The effect of pulsed electric fields on carotenoids bioaccessibility: The role of tomato matrix[J]. Food Chem,2018,240:415−421. doi: 10.1016/j.foodchem.2017.07.102
[63] GONZALEZ-CASADO S, MARTIN-BELLOSO O, ELEZ-MARTINEZ P, et al. Application of pulsed electric fields to tomato fruit for enhancing the bioaccessibility of carotenoids in derived products[J]. Food Funct,2018,9(4):2282−2289. doi: 10.1039/C7FO01857F
[64] AL-JUHAIMI F, GHAFOOR K, OZCAN M M, et al. Effect of various food processing and handling methods on preservation of natural antioxidants in fruits and vegetables[J]. J Food Sci Technol,2018,55(10):3872−3880. doi: 10.1007/s13197-018-3370-0
[65] BRAVO S, GARCíA-ALONSO J, MARTíN-POZUELO G, et al. Effects of postharvest UV-C treatment on carotenoids and phenolic compounds of vine-ripe tomatoes[J]. International Journal of Food Science & Technology,2013,48(8):1744−1749.
[66] AGUILÓ-AGUAYO I, CHARLES F, RENARD C M G C, et al. Pulsed light effects on surface decontamination, physical qualities and nutritional composition of tomato fruit[J]. Postharvest Biology and Technology,2013,86:29−36. doi: 10.1016/j.postharvbio.2013.06.011
[67] URBONAVIČIENĖ D, VIŠKELIS P, VIŠKELIS J, et al. Stability of tomato lycopene under thermal-and light-irradiation treatments in an oil-based model system[J]. Zemdirbyste-Agriculture,2015,102(2):185−192. doi: 10.13080/z-a.2015.102.024
[68] ZHAO W, SUN Y, MA Y, et al. Dense phase carbon dioxide treatment of tomato juice: Effect on physico-chemical properties, phenolic composition, lycopene isomerisation and in vitro bioaccessibility[J]. International Journal of Food Science & Technology,2018,54(5):1658−1669.
[69] PATARO G, SINIK M, CAPITOLI M M, et al. The influence of post-harvest UV-C and pulsed light treatments on quality and antioxidant properties of tomato fruits during storage[J]. Innovative Food Science & Emerging Technologies,2015,30:103−111.
[70] VALDIVIA-NÁJAR C G, MARTÍN-BELLOSO O, SOLIVA-FORTUNY R. Kinetics of the changes in the antioxidant potential of fresh-cut tomatoes as affected by pulsed light treatments and storage time[J]. Journal of Food Engineering,2018,237:146−153. doi: 10.1016/j.jfoodeng.2018.05.029
[71] CAPPELLETTI M, FERRENTINO G, ENDRIZZI I, et al. High pressure carbon dioxide pasteurization of coconut water: A sport drink with high nutritional and sensory quality[J]. Journal of Food Engineering,2015,145:73−81. doi: 10.1016/j.jfoodeng.2014.08.012
[72] BRIONGOS H, ILLERA A E, SANZ M T, et al. Effect of high pressure carbon dioxide processing on pectin methylesterase activity and other orange juice properties[J]. LWT,2016,74:411−419. doi: 10.1016/j.lwt.2016.07.069
[73] LINHARES M F D, ALVES FILHO E G, SILVA L M A, et al. Thermal and non-thermal processing effect on acai juice composition[J]. Food Res Int,2020,136:109506. doi: 10.1016/j.foodres.2020.109506
[74] MAPELLI-BRAHM P, STINCO C M, RODRIGO M J, et al. Impact of thermal treatments on the bioaccessibility of phytoene and phytofluene in relation to changes in the microstructure and size of orange juice particles[J]. Journal of Functional Foods,2018,46:38−47. doi: 10.1016/j.jff.2018.04.044
[75] STINCO C M, FERNANDEZ-VAZQUEZ R, ESCUDERO-GILETE M L, et al. Effect of orange juice's processing on the color, particle size, and bioaccessibility of carotenoids[J]. J Agric Food Chem,2012,60(6):1447−1455. doi: 10.1021/jf2043949
[76] NAGAO A, KOTAKE-NARA E, HASE M. Effects of fats and oils on the bioaccessibility of carotenoids and vitamin E in vegetables[J]. Biosci Biotechnol Biochem,2013,77(5):1055−1060. doi: 10.1271/bbb.130025
[77] PALMERO P, LEMMENS L, RIBAS-AGUSTI A, et al. Novel targeted approach to better understand how natural structural barriers govern carotenoid in vitro bioaccessibility in vegetable-based systems[J]. Food Chem,2013,141(3):2036−2043. doi: 10.1016/j.foodchem.2013.05.064
[78] AL-YAFEAI A, BOHM V. In vitro bioaccessibility of carotenoids and vitamin E in rosehip products and tomato paste as affected by pectin contents and food processing[J]. J Agric Food Chem,2018,66(15):3801−3809. doi: 10.1021/acs.jafc.7b05855
[79] KOPEC R E, FAILLA M L. Recent advances in the bioaccessibility and bioavailability of carotenoids and effects of other dietary lipophiles[J]. Journal of Food Composition and Analysis,2018,68:16−30. doi: 10.1016/j.jfca.2017.06.008
[80] DHUIQUE-MAYER C, SERVENT A, MESSAN C, et al. Bioaccessibility of biofortified sweet potato carotenoids in baby food: Impact of manufacturing process[J]. Front Nutr,2018,5:98. doi: 10.3389/fnut.2018.00098
[81] O’SULLIVAN L, GALVIN K, AISLING A S, et al. Effects of cooking on the profile and micellarization of 9-cis-, 13-cis- and all-trans-β-carotene in green vegetables[J]. Food Research International,2010,43(4):1130−1135. doi: 10.1016/j.foodres.2010.02.012
[82] 吴汝林, 王丽红. 加工处理对食品中类胡萝卜素顺反异构化作用的影响[J]. 食品科技,2006(11):126−129. [WU R L, WANG L H. The effect of processing on the cis-trans isomerization of carotenoids in food[J]. Food Science and Technology,2006(11):126−129. doi: 10.3969/j.issn.1005-9989.2006.11.035 [83] TOMAS M, SAGDIC O, CATALKAYA G, et al. Effect of dietary fibre addition in tomato sauce on the in vitro bioaccessibility of carotenoids[J]. Quality Assurance and Safety of Crops & Foods,2018,10(3):277−283.
[84] CERVANTES-PAZ B, ORNELAS-PAZ J J, RUIZ-CRUZ S, et al. Effects of pectin on lipid digestion and possible implications for carotenoid bioavailability during pre-absorptive stages: A review[J]. Food Res Int, 2017, 99(Pt 2): 917−927.
[85] VERKEMPINCK S H E, SALVIA-TRUJILLO L, DENIS S, et al. Pectin influences the kinetics of in vitro lipid digestion in oil-in-water emulsions[J]. Food Chem,2018,262:150−161. doi: 10.1016/j.foodchem.2018.04.082
[86] IDDIR M, DINGEO G, PORRAS YARURO J F, et al. Influence of soy and whey protein, gelatin and sodium caseinate on carotenoid bioaccessibility[J]. Food Funct,2020,11(6):5446−5459. doi: 10.1039/D0FO00888E
[87] SOTOMAYOR-GERDING D, OOMAH B D, ACEVEDO F, et al. High carotenoid bioaccessibility through linseed oil nanoemulsions with enhanced physical and oxidative stability[J]. Food Chem,2016,199:463−470. doi: 10.1016/j.foodchem.2015.12.004
-
期刊类型引用(3)
1. 路晓,李文钊,徐艳朋,李玉爽,王智珍,张亚旭,刘馨阳,阮美娟. 不同预处理对六种药食同源食材加工特性及其饼干品质影响研究. 食品与发酵工业. 2024(12): 258-265 .  百度学术
百度学术
2. 邱心茹,张源,蒋远帅,高文慧,刘友雪,衣春颖,李悦,孔峰. 鸡骨粉理化性质及其对全麦饼干品质的影响. 食品科技. 2024(06): 147-152 .  百度学术
百度学术
3. 傅新征,林思琦,罗培轩. 响应面法优化超声波辅助酸酶法制备荸荠抗性淀粉工艺. 湖北民族大学学报(自然科学版). 2024(04): 551-558 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:
