Research Progress on Preparation and Application of Hyaluronic Acid
-
摘要: 透明质酸(hyaluronic acid,HA)作为一种线性黏多糖,其在人体内分布广泛,发挥着重要的生理功能作用,由于其独特的理化性质和生理功能,在保健品、化妆品、医药等方面应用广泛。2021年我国批准HA作为新资源食品原料,了解其制备及分离纯化方法对推动其产业化发展很有必要,本文综述了HA的生理功能、不同来源HA的制备方法及近年来的制备热点、分离纯化方式对HA纯度的影响及HA在不同领域的应用,旨在为透明质酸的开发与综合利用提供思路。Abstract: Hyaluronic acid is a naturally occurring biopolymer possessing numerous functions within the body including wound repair, cell migration, and cell signaling. Due to its unique physical and chemical properties, it is widely used in health care products, cosmetics, and medicine.In 2021, hyaluronic acid is approved as a new resource food raw material in China, which has attracted widespread attention. Understanding its preparation, separation and purification methods is necessary to promote its industrial development.This article summarizes the physiological functions, preparation methods and preparation trends of HA from different sources, the effect of separation and purification method on HA purity, the application fields of hyaluronic acid, aiming to provide ideas for the development and comprehensive utilization of hyaluronic acid.
-
Keywords:
- hyaluronic acid /
- physiological function /
- preparation /
- separation and purification /
- application
-
透明质酸(hyaluronic acid,HA),俗称玻尿酸,是一种高分子量线性大分子酸性黏多糖,由D-葡萄糖醛酸和N-乙酰基氨基-D-葡萄糖的双糖单位重复交替连接组成[1]。1934年,人们最先从牛眼玻璃体中分离得到HA,并发现动物和人体结缔组织细胞间质中也广泛存在HA,其中,眼玻璃体、皮肤、脐带、软骨和关节滑液中HA含量较高。不同来源的HA其结构基本相同,但来源不同的HA其分子量大小有所不同[2]。HA作为机体内的多功能基质,具有调控细胞增殖,分化,迁移、润滑关节,保护软骨、促进创伤愈合、抗氧化、抗衰老等重要的生理功能。
HA具有极强的保水作用,保湿效果高于目前自然界发现的其它保湿物质,被誉为理想的天然保湿因子,已被广泛应用于临床医学和化妆品生产等领域。随着今年HA被批准为新资源食品原料,HA的应用领域不断扩大。同时消费者的健康意识不断提高,对HA原料的需求不断扩大,工业化制备高品质HA必不可少。本文通过对天然HA的生理功能,制备及分离纯化,应用领域展开综述,旨在为HA的开发与利用提供参考。
1. 透明质酸在机体内的分布及生理功能
1.1 透明质酸在机体内的分布
天然HA广泛存在于高等动物体内各种组织中,只是含量不同。其主要分布在细胞基质和润滑液中,包括人脐带、关节滑液、皮肤、胸淋巴液、玻璃体、鸡冠等。雄鸡冠是目前发现的HA含量最高的动物组织,各机体透明质酸含量见表1[3]。HA在人体各组织中广泛分布,不同生物体组织中的HA其分布位置基本相同,主要在分子量大小方面有差异,正常生物组织中HA分子量大约为1000~8000 kDa,分子量大小不同,三维结构刺激不同受体或通路,发挥不同作用[4]。
表 1 不同机体透明质酸含量Table 1. Hyaluronic acid content in different bodies组织或体液 透明质酸浓度(μg·mL-1) 公鸡冠 7500 人脐带 4100 人关节滑液 1400~3600 牛鼻软骨 1200 人眼玻璃体 140~340 人表皮 100 人真皮 200~500 兔脑 65 兔心 27 人胸淋巴液 0.2~50 人尿 0.1~0.3 人血清 0.01~0.1 1.2 透明质酸的生理功能
1.2.1 润滑关节,保护软骨
HA广泛分布在细胞间质和细胞基质中,是关节滑液的主要组成成分,分布于软骨和韧带表面,HA具有良好的粘弹性,在行走时,滑液呈粘性减少关节摩擦,在做跑步等高撞击频率动作时滑液呈弹性,缓冲应力对关节的损伤,当关节负重时滑液由流体变为弹性体保护关节软骨[5]。有大量证据表明老年患者骨关节炎是由氧化应激引起的,骨关节炎是关节软骨的磨损,当受到活性氧攻击时HA长链分解为HA片段,削弱了软骨的整体结构[6]。
1.2.2 促进创伤愈合
伤口愈合过程可以分为止血期、炎症期、增殖期、成熟期四个时期。损伤发生时HA在伤口处含量增加,由于其分子量大,用作早期的临时结构[7]。炎症期受损的细胞开始渗出含有盐、水、蛋白质的渗出物[8],此阶段的特征是受伤部位发红发热,疼痛、功能障碍[9]。HA与白细胞、内皮细胞表面受体CD44结合,导致较少的白细胞迁移到炎症部位减少伤口肿胀程度[10]。CD44受体在炎症反应中具有重要作用,其中高分子量HA刺激抗炎反应,低分子量HA诱导炎症反应。增殖期创面以新的胶原组织重建,细胞外基质分泌,在肌成纤维作用下伤口开始收缩[11]。成熟期无组织胶原蛋白形成交联,减少疤痕,增强伤口部分皮肤弹性。
1.2.3 调控细胞增殖、迁移、分化
HA是影响细胞增殖、迁移、分化过程的重要调节因子,HA的存在有助于局部组织水化,削弱细胞对胞外基质的固定,促进细胞分离从而迁移甚至分裂,细胞表面的HA受体也可以与一些与细胞运动相关的激酶相连接[12]。在有丝分裂早期阶段,HA含量增高,分裂进入G1期(前一次有丝分裂完成到合成期开始之间的时期)含量急剧下降,高水平HA引起生长因子释放,并通过形成细胞膜外膜影响细胞间相互作用加快细胞增殖[13],但目前尚未观察到HA有直接地促进有丝分裂活性的作用。HA的这种信号调控作用与其分子量有关,分子量不同触发的信号通路不同,低分子量HA诱导细胞增殖,此外低分子量HA可增强促炎基因的表达,高分子量HA作用则相反[14]。
1.2.4 血管生成作用
有报道称低分子量HA可刺激信号分子表达,刺激血管内皮细胞增殖和迁移,高分子量HA可抑制内皮细胞增殖与迁移,有抗血管生成作用[15],但是支持HA对细胞生长的影响大多数是使用肿瘤异种移植物产生的,某些数据显示注射低分子量HA会抑制肿瘤的生长[16],这与上述观念相冲突,表明可能存在更加复杂的路径和相互作用,需要进一步研究。
1.2.5 抗氧化活性
研究发现HA可消除自由基,具有一定的抗氧化活性。高分子量HA可保护细胞免受活性氧的影响,过量的活性氧会破坏蛋白质、脂质和DNA,HA的某些抗氧化特性包括其减少紫外线诱导的细胞凋亡,酸诱导的DNA损伤等能力[17]。冯宁等[18]研究了口服HA后血清的超氧化物歧化酶活性,发现HA具有体内抗氧化作用,于海慧等[19]研究发现大鲵黏液HA具有一定的体外抗氧化活性,能够清除 DPPH·、·OH、ABTS+·和还原 Fe3+。有学者推测HA的抗氧化性能是由于HA结构上的羟基官能团可以吸收活性氧[14]。
1.2.6 抗衰老作用
研究发现人体内透明质酸含量随年龄增加会有降低的现象,60岁与20岁时相比HA含量下降75%,年龄越大体内透明质酸含量越低,同年龄人群体内的HA含量也不同,体内HA含量高的人群看起来更加年轻,出现衰老症状的人群体内HA含量明显较低[20]。皮肤中HA含量降低,细胞间胶状基质所填充的空间减小,导致细胞排列紧密,胶原蛋白失水硬化,使皮肤粗糙,失去弹性。研究发现HA可治愈由紫外线照射引起的皮肤损害,高浓度HA可影响胶原蛋白的表达[21]。
综上,HA的生理功能与其分子量大小息息相关,不同分子量HA在创伤愈合,调控细胞增殖、迁移、分化,血管生成及抗氧化活性等生理功能中发挥着不同的作用,低分子量HA诱导炎症反应,诱导细胞增殖,刺激血管内皮细胞增殖和迁移,高分子量HA抗氧化活性优于低分子量HA。这种生理功能上的差异导致其最终在产品上的应用有所不同。
2. 透明质酸的结构与性质
2.1 透明质酸的结构
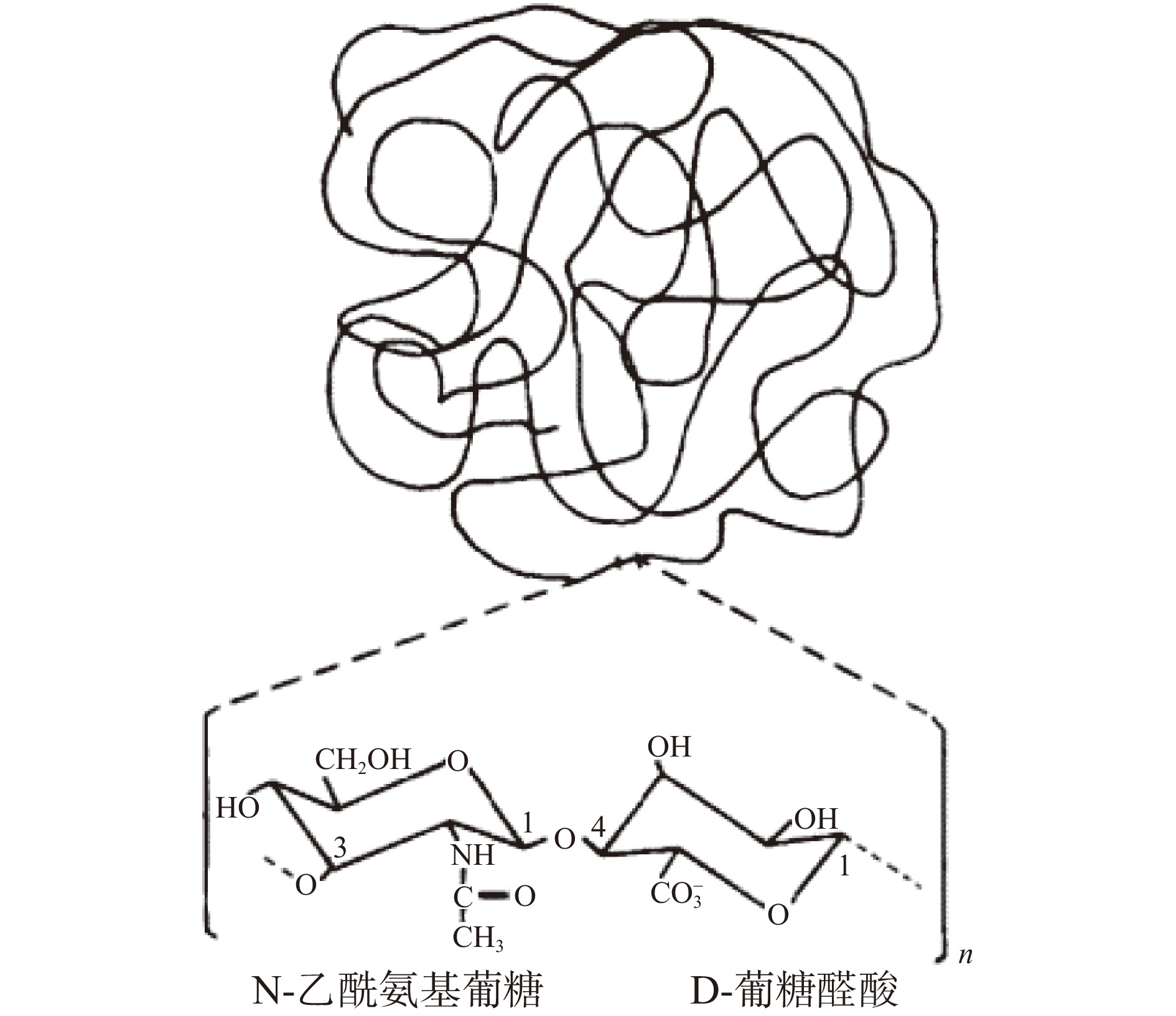
HA是由葡萄糖醛酸和乙酰氨基葡萄糖等摩尔重复交替连接组成的一种高分子量酸性黏多糖,两种单糖之间通过β-1,3-糖苷键相连,双糖单位通过β-1,4-糖苷键相连,HA的一级结构如图1所示[22]。HA作为目前发现的唯一不含硫的糖胺聚糖与普通糖胺聚糖的区别在于HA通过细胞膜表面膜蛋白合成而非由细胞高尔基体合成[23],不同来源HA结构无差异。
2.2 透明质酸的理化性质
HA为白色无定形固体,有酸性粘多糖的共同性质,溶于水不溶于乙醇等有机溶剂[24]。HA水溶液具有特异的流变学性质,拥有良好的粘弹性,低浓度或小分子量HA以单体状态存在,粘度变化小,高分子量高浓度HA粘弹性较好[25],呈非牛顿流体特性,非常适合模拟关节滑液,滑液的粘弹性与HA浓度有关[13],合理改变HA的分子量和溶液浓度均能获得较好的粘弹性。由于HA分子链单糖间氢键的存在,低浓度HA也能形成独特的蜂窝状网络结构使HA能吸附约自身1000倍的水分,具有很强的保湿性[26]。不同分子量HA具有不同理化性质,高分子量HA有更高的粘度,较长链HA随机卷曲结构更稳定,短链更容易膨胀[27]。细胞区分高分子量和低分子量HA的方法及生物学途径差异仍未知。
3. 透明质酸的制备及纯化
3.1 透明质酸来源途径
3.1.1 动物组织来源途径
动物组织来源可分为陆地生物来源和海洋生物来源,目前主要从鸡冠、人脐带、蛋壳膜、猪皮等陆地生物组织中提取HA。鸡冠作为HA含量较高的动物组织,广泛用于透明质酸的提取。陆生生物组织提取由于受到原料的限制,不能进行大批量生产,研究者在不断尝试从其他动物组织或其他原料来源中进行提取。海洋生物资源如动物残渣、废弃物、副产品等由于其长期的经济效益和环境效益,一直以来都得到了广泛的关注,作为HA等物质的提取来源具有重大潜力[28]。研究者们已从海洋生物眼玻璃体如金乌贼眼、鱿鱼眼、金枪鱼眼、蛙皮、鱼体粘液、淡水蚌肉汁水等生物组织中提取到HA[19,25,29]。易喻等[29]首次从金枪鱼眼玻璃体中提取HA,最终提取率为0.013%,于海慧等[19]从大鲵体表黏液中进行提取,在胰蛋白酶添加量1.5%时,HA得率为1.7041 mg/g ,提取到的HA结构与标准品相同,相比于鸡冠、脐带等陆地生物组织,提取率较低,但可作为HA提取的稳定来源。
3.1.2 微生物发酵来源途径
HA广泛分布在部分细菌的细胞夹膜中,能避免氧气对细胞产生伤害,前人对细菌中透明质酸的探究主要是为了探索荚膜的组成及功能。日本资生堂首先将发酵法制备HA应用于工业生产。HA在菌体中的合成复杂且连续,葡萄糖在葡萄糖激酶的作用下生成葡萄糖-6-磷酸,之后在异构酶、葡萄糖磷酸变异酶等多种酶的作用下生成前体物质尿苷二磷酸-N-酰基-氨基葡萄糖和尿苷二磷酸-葡萄糖醛酸,二者在HA合酶的作用下交替的添加到HA分子链中[30]。来自C群的兽疫链球菌是获取透明质酸的主要来源[31],由于其致病性和野生型菌株中的内毒素等原因,在实际生产中对野生型菌株进行改良,通过非致病菌株生产HA已成为普遍做法[32]。对菌种进行处理的手段主要有基因工程、诱变育种和原生质体育种,JIN等[33]通过整合水蛭来源的透明质酸水解酶LHyal基因,通过序列优化和N-端融合His标签策略调控LHAase的表达,改良构建枯草芽孢杆菌的HA合成途径,获得一株在3 L发酵罐发酵100 h时HA累积至19.38 g/L的高产菌株。韦朝宝等[34]在此基础上选择生产周期短、强度高的兽疫链球菌进行构建,获得了能缓解发酵过程中溶氧问题的高产菌株。目前,已在枯草芽孢杆菌[35]、乳酸菌[36]、谷氨酸棒杆菌[37]等不同宿主中通过异源表达HA合酶实现HA的合成。
3.2 透明质酸的制备
3.2.1 动物组织源透明质酸制备
对于动物组织来源HA的生产常采用组织提取法,完整的工艺流程包括预处理、提取、分离纯化、干燥等,加工工艺已较为成熟,提取法工艺简单,提取到的多为大分子量HA[38],粘度大,保湿性能好,主要用于医药和化妆品行业。提取方法主要有盐提和酶提,无机盐和酶的加入可以解除动物组织中透明质酸HA与蛋白质的络合,此外酶能水解蛋白质、核酸等杂质,利于HA的提取[39]。KALKANDELEN等[40]通过丙酮将组织匀浆脱脂、经醋酸钠溶液多次提取成功从鸡冠中提取到HA。但组织提取法程序复杂,提取率较低,酶法提取因其高效性成为研究热点,目前常用的提取的酶有中性蛋白酶、胃蛋白酶、胰蛋白酶和木瓜蛋白酶等。ÜRGEOVÁ等[41]比较了胃蛋白酶、胰蛋白酶和木瓜蛋白酶从蛋壳膜中提取HA的结果,结果表明胰蛋白酶比其他两种酶更有效,在pH为8、37 ℃、胰蛋白酶用量为50 U/g酶解蛋壳膜时,HA提取率为44.82 mg/g蛋壳膜。为了获得更好的提取效果,实验中常采用酶混合物或超声等手段辅助提取,陈胜军等[42]利用超声(200 W,30 kHz)辅助胰蛋白酶和复合蛋白酶从罗非鱼眼中提取、优化后HA得率为11.44%,与单纯酶解法相比得率约提高5%。
3.2.2 微生物源透明质酸的制备
微生物发酵法工艺流程主要包括菌种培养、发酵、分离纯化、干燥等。目前,提高微生物发酵法提取效果的研究主要集中在培育优良菌株、选择合适的培养基及优化发酵条件。通过对培养基条件和发酵工艺条件进行控制获得高产量HA的研究已有很多,相比于组织提取法制备HA,微生物发酵法的一个优势在于可以在发酵过程中调控HA的分子量,这也是目前关于HA发酵工艺研究的主要内容。HA分子量的调控受到HA合成酶及其与底物结合的相对强度、HA前体物质浓度与HA合酶浓度比例影响[43]。碳源产生的果糖-6-磷酸会被用来合成乳酸,抑制菌体生长和HA合成,可以通过抑制与HA竞争碳源的其他途径(糖酵解途径等),将更多碳源用于合成HA,增加HA产量和分子量[44]。代谢流的平衡可影响HA的分子量[45],对温度、通气量、pH、搅拌速度等影响HA产量及分子量的发酵条件进行了一定研究,如刘金龙等[46]研究了发酵条件对马链球菌合成HA分子量的影响,分批培养发酵模式比葡糖糖补料培养模式更利于高分子量HA生成;在0~45%溶氧浓度范围内,相对分子质量随溶氧水平的增加增长了109.4%;低温有利于HA的合成,低温下HA的产量和分子量都相对较高,在33 ℃时HA产量和分子量分别为4.41 g/L和2.54×106;pH对HA的产量和分子量具有不同的影响,pH为7时HA产量最高(3.72 g/L),pH为8时HA产量最低(3.01 g/L),但pH为8时取得了最大的分子量(2.38×106),说明可以在生产过程中通过控制发酵工艺条件实现HA的高质量生产。
动物组织提取法和微生物发酵法是生产HA最常用的两种方法,组织提取法用于动物组织中HA的提取,此法常在早期使用,提取过程复杂,HA产率较低,受到原料来源限制,随着科学技术的进步,发酵法因成本低、产率高,易规模化生产等优势成为工业生产HA的主流方法。随着制备方法的不断完善,人们对HA的生产需求逐渐从高产量转向高品质,目前的研究主要在于通过基因工程、诱变育种等方式生产特定分子量的HA以满足HA在不同应用中的需要,建立一种高效安全的HA制备方法以生产符合各种应用场景的特定分子量HA将成为研究热点。
3.3 透明质酸的分离纯化
无论组织提取法或发酵法,其提取的透明质酸粗品中都含有一些蛋白质、核酸及其他杂质,需要进行分离纯化得到HA纯品,按照分离纯化的原理可大体分为沉淀、过滤、吸附三种方式。
3.3.1 沉淀
沉淀方式主要有季铵盐沉淀和有机溶剂沉淀,季铵盐纯化法的原理是季铵盐与HA在水溶液中所带电荷不同,两者在低盐溶液中络合沉淀,在高盐溶液中解离溶解,从而达到除去不与HA络合沉淀的杂质的目的。常用的季铵盐有溴代十六烷基吡啶(CPB)、十六烷基三甲基溴化铵(CTAB)、氯代十六烷基三甲基吡啶(CPC)和其他长链季铵盐[47],该法提纯的HA纯度高,效果好,能除去不和季铵盐络合的杂质。有机溶剂沉淀法主要通过影响介质的介电常数,造成分子内和分子间聚集,从而达到去除蛋白质的目的[48],相比于氯仿、丙酮等限制级试剂,乙醇因其安全性和低成本应用较多,宋磊等[49]在乙醇粗提后对影响HA纯度的因素进行优化结合板框过滤法得到含量为93.71%的高纯度HA。CAVALCANTI等[50]探究了乙醇和发酵液比例对介电常数的影响,以及pH对HA纯化的影响,在pH为4,乙醇发酵液比例2:1时,HA纯度为55%,回收率为85%,有机溶剂沉淀用于HA初始纯化具有良好效果。
3.3.2 过滤
过滤法原理主要是根据颗粒大小将其保留在多孔膜上,过滤法相比于有机溶剂沉淀没有有机溶剂成本消耗,工艺简单,可以实现工业化,但单纯使用过滤法蛋白质去除效果不佳,随着纯化的进行会出现孔堵塞的现象,限制了其在HA纯化过程中的应用。切向过滤或使用助滤剂可以很大程度减轻孔堵塞现象[51],GÖZKE等[52]提出了一种膜过滤和电泳结合的电过滤技术,电场对HA的过滤有很强的促进作用,与常规过滤相比,相同实验时间内,基于样品渗透质量的浓缩因子提高了近4倍,并且这种过滤方法不会对HA的分子结构和平均分子量产生负面影响,为HA的下游纯化工艺提供了新的可能。
3.3.3 吸附
吸附是依据化合物在多孔固体表面选择性保留来进行HA纯化,常用的吸附剂有活性炭、树脂、硅胶等。活性炭由于其具有强烈吸附蛋白质核酸而对大分子量中性多糖吸附较弱的特点,是分离纯化HA的理想材料。魏琳娜等[53]在提取高原鼢鼠组织中HA的工艺中采用乙醇沉淀结合活性炭吸附方法,提取到的HA回收率可达72.73%。CAVALCANTI等[50]研究发现不同pH下的HA结构对沉淀性能具有重要影响,在pH为4时,HA的回收率为85%,pH为7时,HA的回收率为70%,在使用活性炭的过程中,调节合适的pH可使HA的回收率提高。电泳是一种广泛使用的蛋白质分离方法,其分离效率受到凝胶的影响,与其他操作相比,其HA纯化效率较低。离子交换层析法也是在生物大分子提纯中广泛应用的方法之一,该法纯化温和不引起分子结构变化,但成本较高,需选择合适的交换树脂和交换条件,操作复杂,主要用于医用级HA的生产。倪杭生等[54]采用强酸型阳离子交换树脂和经组氨酸基团修饰的强碱型阴离子树脂串联,HA粗品中的杂质蛋白质在偏酸性溶液中与强酸性阳离子交换剂发生交换吸附而被纯化,以氯化钠溶液洗脱,得到的HA精品的蛋白质含量低于0.075%,平均分子量大于9.41×105,纯化重量收率为58%~61%。
分离纯化是制备高纯度、高品质HA必不可少的步骤,目前关于HA的纯化方面的研究中,对于纯化过程中各种纯化操作对HA纯度变化的研究内容较少,CAVALCANTI等[51]以HA或蛋白质在溶液中的百分比表示纯化程度,总结了纯化过程中HA纯度的变化,来源于兽疫链球菌的HA发酵液首先经异丙醇沉淀操作后蛋白质含量为14.1%,经硅胶吸附操作后蛋白质含量为4.5%,经过滤与吸附作用相结合的木炭过滤器组件作用后蛋白质含量仅为0.6%,最后经透析过滤操作蛋白质含量可达0.06%。各种分离纯化方法都有其优势和劣势,在实际工业生产中常根据原料来源及终端产品的不同要求对几种分离纯化方法进行合理组合以达到分离纯化最大效果。
4. 透明质酸的应用
4.1 食品领域的应用
HA在日本食品市场应用广泛,除保健类食品外,在普通食品如饮料、软糖、果酱中也得到了广泛的应用。在美国食品市场,HA主要作为膳食补充剂使用[55]。目前,我国含HA的产品主要是保健食品,主要功效为改善皮肤水分,查圣华等[56]以透明质酸钠为主要原料研制了一种燕窝罐头可有效提高皮肤水分,并无其他不良反应,市面上类型主要有胶囊型,口服型,冲剂型等。HA经口服消化吸收后,体内HA合成的前体增加,使体内HA含量提高并集中定位于皮肤组织,进而增强皮肤的保水能力,软化皮肤角质层,进一步改善肌肤弹性和减少皱纹[57]。
4.2 化妆品及日用品中的应用
HA大量存在于人体及其它生物组织中,具有极强的保湿性能,在化妆品中主要作为保湿剂、增稠剂、乳化剂[58-59]使用。目前,市场上几乎全部种类的化妆品配方中都含有HA。HA易在皮肤上形成水化膜提升皮肤润滑感,可促进皮肤对活性物质的吸收,膜的形成在一定程度上有隔离细菌作用,利于皮肤消炎及修护,延缓皮肤老化[60]。HA为皮肤组织本身存在的成分有更高的安全性。此外,由于HA在口腔中具有抗炎修复作用,添加到牙膏中能起到一定的保湿和功效作用[61],HA在日用品中的应用在不断扩展与深入。
4.3 医学领域的应用
HA作为关节滑液的重要组分,在关节的保护方面发挥着重要的生理功能,HA在关节中的合成或代谢异常就可导致关节疾病的发生,此时可通过注射外源性HA对关节滑液进行补充,改善关节生理功能[62]。由于HA独特的理化性质和生物相容性,被广泛用于视网膜、白内障等相关眼科手术中。HA在医美整形中作为填充剂进行皮下注射以达到消除面部皱纹、疤痕,使面部饱满的效果[63]。HA喷雾可用于患者面部激光术后的修复治疗,能有效恢复皮肤屏障损伤[64]。HA衍生物在眼用制剂方面也得到广泛的应用,如HA钠可以代替泪液黏性蛋白的作用,用于干眼病的治疗缓解干眼不适症状[65]。研究发现很多疾病发生时体内HA含量会出现升高现象,所以临床上可通过检测HA在血清中的含量水平,来反映出各种疾病的变化,对辅助诊断等具有重要的意义。
HA在食品、化妆品、日用品及医学等领域应用广泛,其在功能性护肤品、眼科、骨科等方面的应用已比较成熟,在食品领域应用中还存在巨大潜力,口服HA相比于外敷注射更加温和,更能由内而外激发活力,2021年1月,国家卫生健康委员会批准透明质酸作为新资源食品原料在普通食品中添加,这表明HA在食品领域的应用将迎来大规模的增长。此外,HA分子存在很多修饰位点,对其活性基团进行修饰如交联、酯化、接枝等使其具有更好的理化性质和抗酶解能力[66],可使HA应用在更加复杂的环境中。随着技术的进步,HA在各领域中的应用将会越来越深入。
5. 结论与展望
HA具有重要的理化性质和生理功能,其覆盖领域广,市场需求量大,全球HA原料销量呈现增长趋势。目前,工业制备HA的方法主要是动物组织提取法和微生物发酵法,微生物发酵法具有成本低、易大批量生产等优点,但有些产品被检测出有毒性,目前微生物发酵法研究的重点在于通过基因工程或诱变育种培育优良菌株以及通过调控发酵工艺获得高品质HA。虽然组织提取法有原料来源受限以及生产成本高等不足,但近年来关于提取法的研究中用到的原料主要为鸡头、鱼头、鱼眼等副产物及加工产生的废弃物,这些废弃物组织中含有丰富的HA,利用这些废弃物为原料可避免资源浪费、保护环境、又可降低生产成本、满足市场需求,并能为一些低附加值的产业提供更多选择。随着HA应用场景的不断拓展,市场需求量的不断增长,建立一种高效安全的HA提取纯化工艺,对HA分子进行修饰以生产符合不同应用场景的特定分子量HA将成为研究热点。
-
表 1 不同机体透明质酸含量
Table 1 Hyaluronic acid content in different bodies
组织或体液 透明质酸浓度(μg·mL-1) 公鸡冠 7500 人脐带 4100 人关节滑液 1400~3600 牛鼻软骨 1200 人眼玻璃体 140~340 人表皮 100 人真皮 200~500 兔脑 65 兔心 27 人胸淋巴液 0.2~50 人尿 0.1~0.3 人血清 0.01~0.1 -
[1] 张堃, 简军, 张政朴. 透明质酸的结构、性能、改性和应用研究进展[J]. 高分子通报,2015,9:217−226. [ZHANG K, JIAN J, ZHANG Z P. Research progress on the structure, properties, modification and application of hyaluronic acid[J]. Polymer Bulletin,2015,9:217−226. [2] JEON O, SONG S J, LEE K, et al. Mechanical properties and degradation behaviors of hyaluronic acid hydrogels cross-linked at various cross-linking densities[J]. Carbohydrate Polymers,2007,70(3):251−257. doi: 10.1016/j.carbpol.2007.04.002
[3] KOGAN G, ŠOLTÉS L, STERN R, et al. Hyaluronic acid: A natural biopolymer with a broad range of biomedical and industrial applications[J]. Biotechnology Letters,2006,29(1):17−25. doi: 10.1007/s10529-006-9219-z
[4] COWMAN M K, LEE HG, SCHWERTFEGERK L, et al. The content and size of hyaluronan in biological fluids and tissues[J]. Frontiers in Immunology,2015(6):261.
[5] HLAVÁCEK M. The role of synovial fluid filtration by cartilage in lubrication of synovial joints-I. Mixture model of synovial fluid[J]. Journal of Biomechanics,1993,26(10):1145−1160. doi: 10.1016/0021-9290(93)90062-J
[6] MAREK P, MAłGORZATA K, JACEK K, et al. The oxidative stress in knee osteoarthritis patients an attempt of evaluation of possible compensatory effects occurring in the disease development[J]. Medicina,2019,55(5):150. doi: 10.3390/medicina55050150
[7] VOIGT J, VICKIE R. Hyaluronic acid derivatives and their healing effect on burns, epithelial surgical wounds, and chronic wounds: A systematic review and meta-analysis of randomized controlled trials[J]. Wound Repair and Regeneration,2012,20(3):317−331. doi: 10.1111/j.1524-475X.2012.00777.x
[8] HOTAMISLIGILG S. Inflammation, metaflammation and immunometabolic disorders[J]. Nature,2017,542(7640):177−185. doi: 10.1038/nature21363
[9] KOJOUHAROV H V, TREJO I, CHEN B M. Modeling the effects of inflammation in bone fracture healing[C]// American Institute of Physics Conference Series. American Institute of Physics Conference Series, 2017.
[10] GRISHMA S P, ROHAN B, CHARLES D E. Numerical investigation of leukocyte rolling, adhesion and bond formation on surface coated with varying p-selectin density[J]. Cell Press, 2019, 116(3): 18.
[11] LANDÉN N X, LI D Q, STÅHLE M. Transition from inflammation to proliferation: A critical step during wound healing[J]. Cellular and Molecular Life Sciences: Cmls,2016,73(20):3861−3885. doi: 10.1007/s00018-016-2268-0
[12] JOHN CH W Y, ABATANGELO G. Functions of hyaluronan in wound repair[J]. Wound Repair and Regeneration,1999,7(2):79−89. doi: 10.1046/j.1524-475X.1999.00079.x
[13] HUI E, GIMENO K I, GUAN G, et al. Spatiotemporal control of viscoelasticity in phototunable hyaluronic acid hydrogels[J]. Biomacromolecules,2019,20(11):4126−4134. doi: 10.1021/acs.biomac.9b00965
[14] DOVEDYTIS M, LIU Z J, BARTLETT S. Hyaluronic acid and its biomedical applications: A review[J]. Engineered Regeneration,2020,1:102−113. doi: 10.1016/j.engreg.2020.10.001
[15] SLEVIN M, KRUPINSKI J, GAFFNEY J, et al Hyaluronan-mediated angiogenesis in vascular disease: Uncovering RHAMM and CD44 receptor signaling pathways[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2007, 26(1): 58–68.
[16] ZHONG Y N, KATHARINA G, CHENG L, et al. Hyaluronic acid-shelled acid-activatable paclitaxel prodrug micelles effectively target and treat CD44-overexpressing human breast tumor xenografts in vivo[J]. Biomaterials,2016:84.250−261.
[17] MOSELEY R, LEAVER M, WALKER M, et al. Comparison of the antioxidant properties of HYAFF ® -11p75, AQUACEL ® and hyaluronan towards reactive oxygen species in vitro[J]. Biomaterials,2002,23(10):2255−2264. doi: 10.1016/S0142-9612(01)00360-X
[18] 冯宁, 石艳丽, 郭风仙, 等. 口服透明质酸对皮肤水分的改善作用及体内抗氧化作用研究[J]. 食品与药品,2016,18(6):386−390. [FENG N, SHI Y L, GUO F X, et al. Study on the effect of oral hyaluronic acid on skin moisture improvement and in vivo antioxidant effect[J]. Food and Drugs,2016,18(6):386−390. doi: 10.3969/j.issn.1672-979X.2016.06.003 [19] 于海慧, 李伟, 佟长青. 大鲵体表黏液透明质酸提取及其抗氧化活性的研究[J]. 农产品加工,2018,10:18−21. [YU H H, LI W, TONG C Q. Extraction of hyaluronic acid from body surface mucus of giant salamander and its antioxidant activity[J]. Agricultural Products Processing,2018,10:18−21. [20] 郭学平, 贺艳丽, 孙茂利, 等. 透明质酸在保健品中的应用[J]. 中国生化药物杂志,2002,23(1):49−51. [GUO X P, HE Y L, SUN M L, et al. Application of hyaluronic acid in health products[J]. Chinese Journal of Biochemical Pharmaceutics,2002,23(1):49−51. doi: 10.3969/j.issn.1005-1678.2002.01.024 [21] 吴斌杰, 倪海良, 朱敏良, 等. 透明质酸研究进展及应用[J]. 中国美容整形外科杂志,2018,29(4):252−254. [WU B J, NI H L, ZHU M L, et al. Research progress and application of hyaluronic acid[J]. Chinese Journal of Aesthetic Plastic Surgery,2018,29(4):252−254. doi: 10.3969/j.issn.1673-7040.2018.04.018 [22] LAURENT T C. Biochemistry of hyaluronan[J]. Acta Oto-laryngologica Supplementum,1987,442:7−24.
[23] 陈建澍, 王婧茜, 易喻, 等. 透明质酸及其衍生物研究进展[J]. 中国生物工程杂志,2015,35(2):111−118. [CHEN J S, WANG J Q, YI Y, et al. Research progress of hyaluronic acid and its derivatives[J]. Chinese Journal of Bioengineering,2015,35(2):111−118. [24] 王翠凤. 透明质酸的应用现状[J]. 中国医疗器械杂志,2018,42(1):74−76,78. [WANG C F. The application status of hyaluronic acid[J]. Chinese Journal of Medical Devices,2018,42(1):74−76,78. doi: 10.3969/j.issn.1671-7104.2018.01.021 [25] 沙坤. 中国林蛙皮透明质酸提取技术的研究[D]. 长春: 吉林农业大学, 2004. SHA K. Research on the extraction technology of hyaluronic acid from the skin of Chinese forest frog[D]. Changchun: Jilin Agricultural University, 2004.
[26] 江珊, 梁虹. 玻尿酸——备受追捧的美容利器[J]. 健康世界,2020(2):25−27. [JIANG S, LIANG H. Hyaluronic acid-a highly sought after beauty tool[J]. Healthy World,2020(2):25−27. [27] MARY K. C, SHIRO M. Experimental approaches to hyaluronan structure[J]. Carbohydrate Research,2005,340(5):791−809. doi: 10.1016/j.carres.2005.01.022
[28] TRIVEDI N, BAGHEL R S, BOTHWELL J, et al. An integrated process for the extraction of fuel and chemicals from marine macroalgal biomass[J]. Scientific Reports,2016,6(1):30728. doi: 10.1038/srep30728
[29] 易喻, 徐骏, 梅建凤, 等. 金枪鱼眼透明质酸的提取工艺研究[J]. 浙江工业大学学报,2018,46(3):276−281. [YI Y, XU J, MEI J F, et al. Study on the extraction process of hyaluronic acid from tuna eyes[J]. Journal of Zhejiang University of Technology,2018,46(3):276−281. doi: 10.3969/j.issn.1006-4303.2018.03.007 [30] ARINOBU Y, ATAMAS S P, OTSUKA T, et al. Molecular cloning and characterization of a putative mouse hyaluronan synthase[J]. Biological Chemistry,1996,271(38):23400−23406. doi: 10.1074/jbc.271.38.23400
[31] DONATELLA C, ILEANA D I, ELISABETTA C, et al. Engineering S. equi subsp. zooepidemicus towards concurrenttion of hyaluronic acid and chondroitin biopolymers of biomedical interest[J]. AMB Express,2017,7(1):61. doi: 10.1186/s13568-017-0364-7
[32] PAN N C, PEREIRA H C B, SILVA M L C, et al. Improvement production of hyaluronicacid by Streptococcus zooepidemicus in sugarcane molassesugarcane molasses[J]. Biotechnology and Applied Chemistry,2017,182(1):276−293.
[33] JIN P, KANG Z, YUAN P H, et al. Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168[J]. Metabolic Engineering 2016, 35: 21–30.
[34] 韦朝宝, 堵国成, 陈坚, 等. 发酵透明质酸寡糖兽疫链球菌工程菌株的构建[J]. 生物工程学报,2019,35(5):805−815. [WEI C B, DU G C, CHEN J, et al. Construction of an engineered strain of fermenting hyaluronic acid oligosaccharide Streptococcus zooepidemicus[J]. Chinese Journal of Biological Engineering,2019,35(5):805−815. [35] ADAM W, WESTBROO K, XIANG R, et al. Metabolic engineering to enhance heterologous production of hyaluronic acid in Bacillus subtilis[J]. Metabolic Engineering,2018,47:401−413. doi: 10.1016/j.ymben.2018.04.016
[36] SUNGUROğLU C, SEZGIN D E, AYTAR Ç P, et al. Higher titer hyaluronic acid production in recombinant Lactococcus lactis[J]. Preparative Biochemistry & Biotechnology,2018,48(8):734−742.
[37] CHENG F, YU H, STEPHANOPOULO G, et al. Engineering Corynebacterium glutamicum for high titer biosynthesis of hyaluronic acid[J]. Metabolic Engineering,2019,55:276−289. doi: 10.1016/j.ymben.2019.07.003
[38] YAMADA T, KAWASAKI T. Microbial synthesis of hyaluronan and chitin: New approaches[J]. Biosci Bioeng, 2005, 99(6): 521–528.
[39] SADHASIVAM G, MUTHUVEL A. Isolation and characterization of hyaluronic acid from marine organisms[J]. Advances in Food and Nutrition Research,2014,72:61−77.
[40] KALKANDELEN C, SU S, SAATCIOGLU E, et al. Hyaluronic acid production and analysis from rooster comb[C]// 2020 Medical Technologies Congress (TIPTEKNO). Antalya, 2020: 1−4.
[41] ÜRGEOVÁ E, VULGANOVÁ K. Comparison of enzymatic hydrolysis of polysaccharides from eggshells membranes[J]. NovaBiotechnologica et Chimica,2016,15(2):133−141. doi: 10.1515/nbec-2016-0014
[42] 陈胜军, 陈辉, 高瑞昌, 等. 超声波辅助酶解法提取罗非鱼眼透明质酸工艺条件[J]. 核农学报,2014,28(8):1446−1452. [CHEN S J, CHEN H, GAO R C, et al. Technology conditions for the extraction of hyaluronic acid from tilapia eyes by ultrasonic-assisted enzymatic hydrolysis[J]. Journal of Nuclear Agriculture,2014,28(8):1446−1452. [43] 郜娇娇, 杨树林. 微生物发酵法生产高分子量透明质酸的研究进展[J]. 中国生物工程杂志,2017,37(5):118−125. [GAO J J, YANG S L. Research progress on the production of high molecular weight hyaluronic acid by microbial fermentation[J]. Chinese Journal of Bioengineering,2017,37(5):118−125. [44] 董志红. 发酵法生产透明质酸的诱变育种及分子量可控工艺研究[D]. 杭州: 浙江工业大学, 2017. DONG Z H. Research on mutation breeding and molecular weight controllable technology of hyaluronic acid production by fermentation[D]. Hangzhou: Zhejiang University of Technology, 2017.
[45] KARAMI M, SHAHRAKY M K, RANJBAR M, et al. Preparation, purification, and characterization of low-molecular-weight hyaluronic acid[J]. Biotechnology Letters,2021,43(1):133−142.
[46] 刘金龙, 赵国群, 李志敏, 等. 培养条件对Streptococcus equisimilis合成透明质酸相对分子质量的影响[J]. 食品与生物技术学报,2015,34(2):209−214. [LIU J L, ZHAO G Q, Li Z M, et al. Effect of culture condition on the molecular weight of hyaluronic acid synthesized by Streptococcus equisimilis[J]. Journal of Food Science and Biotechnology,2015,34(2):209−214. [47] AMAGAI I, TASHIRO Y, OGAWA H. Improvement of the extraction procedure for hyaluronan from fish eyeball ansd the molecular characterization[J]. Fisheries Science,2009,75(3):805−810. doi: 10.1007/s12562-009-0092-2
[48] LI Y, SHI S, YANG X, et al. The deproteinization, antioxidant acticities and inhibitory effect on a-amylase of polysaccharides from corn silk[J]. Biochem Biotechnol, 2019, 15(2): 83–90.
[49] 宋磊, 孟国庆, 郭燕风, 等. 发酵液中透明质酸提取纯化工艺的研究[J]. 山东农业科学,2017,49(3):134−139. [SONG L, MENG G Q, GUO Y F, et al. Study on the extraction and purification process of hyaluronic acid in fermentation broth[J]. Shandong Agricultural Sciences,2017,49(3):134−139. [50] CAVALCANTI A D D, MELO B A G, OLIVEIRA R C, et al. Recovery and purity of high molar mass bio-hyaluronic acid via precipitation strategies modulated by pH and sodium chloride[J]. Biochem Biotechnol, 2019, 188: 527–539.
[51] CAVALCANTI A, MELO B, FERREIRA B, et al. Performance of the main downstream operations on hyaluronic acid purification[J]. Process Biochemistry,2020,99:160−170. doi: 10.1016/j.procbio.2020.08.020
[52] GÖZKE G, KIRSCHHÖFER F, PRECHTL C, et al. Electrofiltration improves dead-end filtration of hyaluronic acid and presents an alternative downstream processing step that overcomes technological challenges of conventional methods[J]. Engineering in Life Science,2017,17(9):970−975.
[53] 魏琳娜, 汪洋, 魏登邦, 等. 高原鼢鼠组织中透明质酸提取工艺及分子表征[J]. 生物技术通报,2017,33(3):151−161. [WEI L N, WANG Y, WEI D B, et al. Extraction technology and molecular characterization of hyaluronic acid from plateau zokor tissues[J]. Biotechnology Bulletin,2017,33(3):151−161. [54] 倪杭生, 李润, 贺艳丽, 等. 透明质酸的离子交换层析纯化[J]. 中国医药工业杂志,2001,11:5−8. [NI H S, LI R, HE Y L, et al. Purification of hyaluronic acid by ion exchange chromatography[J]. Chinese Journal of Pharmaceuticals,2001,11:5−8. doi: 10.3969/j.issn.1001-8255.2001.01.004 [55] 刘硕, 王景召. 透明质酸的特性及其在食品中的应用[J]. 化工设计通讯,2018,44(8):62. [LIU S, WANG J Z. The characteristics of hyaluronic acid and its application in food[J]. Chemical Engineering Design Communications,2018,44(8):62. doi: 10.3969/j.issn.1003-6490.2018.08.058 [56] 查圣华, 王俊亮, 廉翠翠, 等. 透明质酸胶原蛋白冰糖燕窝研制及其改善皮肤水分功效[J]. 食品工业,2020,41(2):129−134. [CHA S H, WANG J L, LIAN C C, et al. Development of hyaluronic acid collagen rock sugar bird's nest and its effect on improving skin moisture[J]. Food Industry,2020,41(2):129−134. [57] 蒋秋燕, 凌沛学, 程艳娜, 等. 口服透明质酸在动物体内的分布[J]. 中国生化药物杂志,2008,29(2):73−76. [JIANG Q Y, LING P X, CHENG Y N, et al. Distribution of oral hyaluronic acid in animals[J]. Chinese Journal of Biochemical Pharmaceutics,2008,29(2):73−76. [58] 诸超, 朱叶, 魏玮, 等. 香豆素改性透明质酸颗粒乳化剂的制备及应用[J]. 功能高分子学报,2016,29(4):388−396. [ZHU C, ZHU Y, WEI W, et al. Preparation and application of coumarin-modified hyaluronic acid granular emulsifier[J]. Journal of Functional Polymers,2016,29(4):388−396. [59] 付思娅, 李娟. 面膜研究进展探析[J]. 化工管理,2017,26:117−119. [FU S Y, LI J. Research on the progress of facial mask[J]. Chemical Management,2017,26:117−119. doi: 10.3969/j.issn.1008-4800.2017.25.092 [60] 蒙亮亮, 杜桐, 王欣欣,等. 透明质酸在化妆品中的应用研究进展[J]. 山东化工,2018,47(18):52−54,56. [MENG L L, DU T, WANG X X, et al. Research progress in the application of hyaluronic acid in cosmetics[J]. Shandong Chemical Industry,2018,47(18):52−54,56. doi: 10.3969/j.issn.1008-021X.2018.18.023 [61] 许海燕, 王海英, 肖小红, 等. 透明质酸在牙膏中的应用[J]. 口腔护理用品工业,2020,30(6):13−17. [XU H Y, WANG H Y, XIAO X H, et al. Application of hyaluronic acid in toothpaste[J]. Oral Care Products Industry,2020,30(6):13−17. doi: 10.3969/j.issn.2095-3607.2020.06.002 [62] 杨威, 陈泽华, 易志勇, 等. 关节腔内注射透明质酸与安慰剂治疗早中期膝骨关节炎的疗效差异: 基于随机、双盲、对照、临床试验的Meta分析[J]. 中国组织工程研究,2021,25(23):3760−3766. [YANG W, CHEN Z H, YI Z Y, et al. The effect of intra-articular injection of hyaluronic acid and placebo in the treatment of early and mid-stage knee osteoarthritis: A meta-analysis based on randomized, double-blind, controlled, and clinical trials[J]. Chinese Tissue Engineering Research,2021,25(23):3760−3766. doi: 10.12307/2021.051 [63] 刘兰婷, 吴琳, 曾戴琳, 等. 注射用透明质酸的应用进展[J]. 实用皮肤病学杂志,2020,13(6):352−355. [LIU L T, WU L, ZENG D L, et al. The application progress of hyaluronic acid for injection[J]. Journal of Practical Dermatology,2020,13(6):352−355. [64] 马瑛, 彭湃, 赵茜. 透明质酸喷雾在面部激光术后患者皮肤修护中的应用效果及安全性[J]. 临床医学研究与实践,2020,5(36):175−177. [MA Y, PENG P, ZHAO Q. Application effect and safety of hyaluronic acid spray in skin repair of patients after facial laser surgery[J]. Clinical Medical Research and Practice,2020,5(36):175−177. [65] 俞惠玲. 0.3%透明质酸钠联合普拉洛芬治疗干眼症的临床观察[J]. 临床医药文献电子杂志,2019,6(60):71. [YU H L. Clinical observation of 0.3% sodium hyaluronate combined with Pranoprofen in the treatment of dry eye[J]. Electronic Journal of Clinical Medicine,2019,6(60):71. [66] 胡乐坚, 刘富垒, 李凌超,等. 两亲性透明质酸衍生物的合成及其在抗肿瘤纳米药物递送系统中的应用[J]. 药学进展,2017,41(11):804−811. [HU L J, LIU F L, LI L C, et al. Synthesis of amphiphilic hyaluronic acid derivatives and their application in anti-tumor nano-drug delivery systems[J]. Progress in Pharmaceutical Sciences,2017,41(11):804−811. -
期刊类型引用(7)
1. 刘冀黔,旦正杰,韩丽娟,桂林生,侯生珍,王志有,杨葆春. 不同月龄黑藏羊肉品质及风味评价分析. 饲料研究. 2024(13): 105-111 .  百度学术
百度学术
2. 宁舒娴,曾金秀,沙小梅,丁红秀. 不同生境来源的鳙鱼肉挥发性物质组成比较分析. 食品工业科技. 2024(18): 265-272 .  本站查看
本站查看
3. 董平,范文教,朱开宪,吴华昌,邓静. 不同复热方式对咸烧白风味的影响. 食品科技. 2023(02): 122-129 .  百度学术
百度学术
4. 陈方雪,邓祎,谌玲薇,李冬生,乔宇,吴文锦,熊光权,汪兰,李新,石柳,丁安子. 预制冷风风干武昌鱼干制过程中的品质变化及香气形成. 现代食品科技. 2023(02): 9-17 .  百度学术
百度学术
5. 张蓝月,孙万成,罗毅皓. 基于气相色谱-离子迁移谱分析不同地区羊肉的挥发性风味化合物. 食品与发酵工业. 2023(10): 265-272 .  百度学术
百度学术
6. 火玉明,柯汉杰,吴晨昕,姜红贺,梁鹏,汪晴,陈小辉. 海鲈鱼鱼松加工工艺研究. 食品安全质量检测学报. 2022(10): 3367-3374 .  百度学术
百度学术
7. 戴振庭,周惠敏,殷泽生,周瑜,陈舜胜. 添加植物油对鲣鱼鱼松滋味的影响. 甘肃农业大学学报. 2022(06): 227-234 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



