Optimization of Extraction Process and Antioxidant Activity of Ligusticum chuanxiong Protein by Response Surface Methodology
-
摘要: 为优化川芎蛋白(Ligusticum chuanxiong protein,LCP)的提取工艺,并考察其抗氧化活性。基于单因素实验,采用Box-Behnken响应面法,以料液比、提取时间、提取溶剂pH为考察因素,LCP得率为指标,优化LCP提取工艺;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定LCP的分子量范围;测定LCP的等电点(pI)及溶解度,并考察LCP的抗氧化活性。结果表明:最佳提取条件为料液比1:15 (g/mL)、提取时间1.5 h、pH6,在优化条件下LCP得率为(2.36%±0.13%),实测值与理论值较为接近,表明该数学模型可用于优化LCP提取工艺。最优条件下提取的LCP分子量在17~48 kDa,等电点为3.88,pH8时溶解度为96%,羟自由基清除能力IC50为1.18 mg/mL、超氧阴离子自由基清除能力IC50为0.57 mg/mL、1,1-二苯基-2-苦基肼基(DPPH)自由基清除能力IC50为1.31 mg/mL。该法提取的LCP具有较好的抗氧化活性,可为LCP抗氧化活性的进一步研发提供实验思路。
-
关键词:
- 川芎蛋白 /
- 提取工艺 /
- 抗氧化 /
- 等电点 /
- SDS-PAGE凝胶电泳
Abstract: The aim of this study was to optimize the extraction process of Ligusticum chuanxiong protein (LCP) and to investigate its antioxidant activity. Based on single factor experiment, Box-Behnken response surface methodology was used to optimize the extraction process of LCP, with solid-liquid ratio, extraction time, extraction solvent pH as the factors, and extraction rate of LCP as the index. The molecular weight range of LCP was determined by sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE). The isoelectric point (pI) and solubility of LCP were determined, and the antioxidant activity of LCP was investigated. The results showed that the optimal extraction conditions were solid-liquid ratio of 1:15 (g/mL), extraction time of 1.5 h and pH of 6. Under the optimized conditions, the extraction yield of LCP was (2.36%±0.13%), and the measured value was close to the theoretical value, indicating that the mathematical model could be used to optimize the extraction process of LCP. Under the optimal conditions, the molecular weight of the extracted LCP was 17~48 kDa, the isoelectric point was 3.88, the solubility was 96% at pH8. The IC50 of hydroxyl radical scavenging activity was 1.18 mg/mL, the IC50 of superoxide anion radical scavenging activity was 0.57 mg/mL, and the IC50 of 1, 1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity was 1.31 mg/mL. LCP extracted by this method has good antioxidant activity, which can provide experimental ideas for further research and development of LCP antioxidant activity. -
川芎(Ligusticum chuanxiong Hort.)为伞形科植物川芎的干燥根茎,性味辛温,归肝、胆、心包经,具活血行气、祛风止痛的功效[1]。首载于《神农本草经》,为著名的川产道地药材。目前对川芎所含成分的研究,主要集中于小分子成分,对川芎大分子成分的研究甚少[2]。前期研究初步表明[3],川芎中含有丰富的蛋白质,且具有较好的抗氧化能力。天然蛋白质因其来源丰富、可生物降解、环境友好性和高生物活性等特点,近年来成为天然抗氧化剂的研究热点。
氧自由基对生物大分子、氨基酸、DNA、脂类和蛋白质等造成氧化损伤且与癌症、动脉粥样硬化、冠心病、糖尿病、神经功能障碍和免疫系统减弱等慢性疾病的发生有关[4]。经研究发现,植物源蛋白质具有抗凝血、抗肿瘤、抗氧化和抗真菌等生物活性,如石斛蛋白提取液、葛根蛋白、豌豆蛋白、黑豆蛋白等均具有较好的抗氧化活性[5-8],对羟基自由基和DPPH自由基有良好的清除效果,大豆蛋白具有较强的DPPH自由基清除能力[9]。目前,川芎蛋白(LCP)抗氧化能力的相关研究未见报道,本研究旨在通过 Box-Behnken响应面法确定其最佳提取条件;以DPPH自由基清除、羟自由基清除和超氧阴离子自由基清除率为指标,以抗坏血酸为阳性对照进行分析,考察LCP的抗氧化活性,同时为LCP的开发提供可靠的数据资料。
1. 材料与方法
1.1 材料与仪器
川芎 贵阳济仁堂药业有限公司;BCA蛋白浓度测定试剂盒、考马斯亮蓝R250、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Maker、抗坏血酸标准品(VC) 北京索莱宝科技有限公司;DPPH自由基清除能力试剂盒、羟自由基清除能力试剂盒、超氧阴离子清除能力试剂盒 苏州格锐思生物科技有限公司。
PHS-3C pH计 上海仪电科学仪器股份有限公司;TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;AL204电子天平 美国梅特勒托利多公司;FD冷冻干燥机 上海拓纷机械设备有限公司;Multiskan FC酶标仪 赛默飞(上海)世尔仪器有限公司。
1.2 实验方法
1.2.1 蛋白浓度测定
分别吸取5 mg/mL的标准溶液 4、6、8、10、12、14、16、18、20 μL于96孔板中,并用蒸馏水补足至 20 μL。分别加入 200 μL BCA工作液(BCA试剂与铜试液50:1)混匀,室温静置l0 min,于650 nm下检测不同浓度牛血清蛋白溶液的吸光值A,以蛋白质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,回归方程为:y=2.2706x+0.0402(R2=0.9993)。川芎提取物中LCP浓度根据上述回归方程求得。
1.2.2 单因素实验
基于前期研究[10-11],以LCP得率为检测指标,分别以pH、提取时间、料液比为影响因素以设计单因素实验。
1.2.2.1 川芎药材前处理
取干燥洁净的川芎药材,粉碎,过3号筛(50目)。称取适量过筛后的川芎药材粉末置于圆底烧瓶中,加4倍量沸程为30~60 ℃ 石油醚水浴回流脱脂1 h,静置后过滤,将川芎药材粉末于通风橱自然晾干,备用。
1.2.2.2 LCP的提取
精密称取川芎药材粉末3 g,平行三份,加入Tris-HCl(68 mmol/L,0.5% SDS,5%甘油,10% β-巯基乙醇)溶液,置于4 ℃ 冰箱浸提1.5 h。5000 r/min离心10 min,收集上清,加入3倍量10%TCA-丙酮,置−20 ℃冰箱沉淀1.5 h,5000 r/min离心10 min,收集沉淀,分别用丙酮及80%丙酮洗涤3次,5000 r/min离心10 min,收集沉淀,冷冻干燥即得LCP,按公式(1)计算得率。
蛋白得率(%)=M2M1×100 (1) 式中:M1表示川芎蛋白冻干粉的质量,g;M2表示川芎药材的质量,g。
1.2.2.3 不同pH对LCP得率的影响
按“1.2.2.2”项下操作,固定提取时间为1.5 h,料液比为1:15 g/mL,研究提取液pH(3、4、5、6、7、8、9)对LCP得率的影响。
1.2.2.4 料液比对LCP得率的影响
按“1.2.2.2”项下操作,固定提取时间为1.5 h,提取液pH为6,研究料液比(1:10、1:15、1:20、1:25、1:30 g/mL)对LCP得率的影响。
1.2.2.5 提取时间对LCP得率的影响
按“1.2.2.2”项下操作,固定料液比为1:20 g/mL,提取液pH为6,研究提取时间(0.5、1、1.5、2、2.5 h)对LCP得率的影响。
1.2.3 LCP提取条件的响应面试验设计
为选择最佳实验条件,以提取时间 、B料液比 、C提取溶剂pH为独立变量,蛋白得率为响应变量,采用Design Export 8.0.6的Box-Behnken响应面方法(RSM) [12]优化过程。各组平行3次,响应面试验因素和水平见表1。
表 1 响应面优化试验因素水平表Table 1. Factors and levels table of response surface optimization水平 因素 A提取时间(h) B料液比(g/mL) C pH −1 1 1:10 5 0 1.5 1:15 6 1 2 1:20 7 1.2.4 SDS-PAGE凝胶电泳
采用贺小燕等[13]试验方法,以4.5%的浓缩胶和12.5%的分离凝胶进行SDS-PAGE电泳,浓缩胶电压80 V电泳20 min,分离胶电泳120 V电泳80 min,指示剂到达分离胶底部约1 cm处停止电泳,考马斯亮蓝R250染色,脱色液脱色至条带清晰。
1.2.5 LCP等电点测定
取10支洁净离心管,称重。根据表2,分别加入不同体积LCP溶液(50 mg/mL),再分别加入不同浓度、不同体积的乙酸溶液或去离子水,混合,测定pH。于4 ℃静置1 h 后,5000 r/min离心15 min。完全除去上清液后,将带有沉淀物的离心管称重,通过减重法计算沉淀质量。由于蛋白质在pI处沉淀最多,即可测定川芎的pI[14-15]。
表 2 等电点测定Table 2. Isoelectric point measurement试剂 编号 1 2 3 4 5 6 7 8 9 10 去离子水(mL) 5 5.5 3 4 5 5.5 4 5 5.5 6 1.00 mol·L−1 乙酸(mL) 1 0.5 − − − − − − − − 0.10 mol·L−1 乙酸(mL) − − 3 2 1 0.5 − − − − 0.01 mol·L−1 乙酸(mL) − − − − − − 2 1 0.5 − 蛋白提取液(mL) 1 1 1 1 1 1 1 1 1 1 pH 3.47 3.78 3.88 4.16 4.6 5.53 7.68 7.96 8.13 8.34 1.2.6 LCP溶解度的测定
将50 mg样品悬浮在10 mL蒸馏水中,并使用1 mol/mL的 HCl或NaOH溶液将悬浮液的pH调节至2~12。将悬浮液在22 ℃下连续搅拌1 h,并在5000 r/min离心15 min,BCA试剂盒测定上清液中蛋白质的量。溶解度按公式(2)计算。
蛋白溶解度(%)=M2M1×100 (2) 式中:M1:悬浮液中加入的蛋白总量,mg,M2:离心后上清液蛋白的量,mg。
1.2.7 LCP抗氧化能力的测定
1.2.7.1 羟自由基清除能力的测定
取不同浓度的LCP溶液各0.125 mL,按试剂盒加入反应试剂一、试剂二、试剂三各0.125 mL和0.5 mL的蒸馏水,混匀,即为测定组。取等体积蒸馏水,依法制备空白组。取不同浓度的LCP溶液液各0.125 mL,加入反应试剂一、试剂二各0.125 mL和0.625 mL的蒸馏水,混匀,即为对照组。于37 ℃反应20 min,转移至玻璃比色皿中,蒸馏水调零,510 nm读取各组吸光度值A,平行测定3次,以VC为阳性对照组,公式(3)计算清除率。
羟自由基清除率(%)=A1−(A2−A3)A1×100 (3) 式中:A1:空白组吸光度值,A2:测定组吸光度值,A3:对照组吸光度值。
1.2.7.2 超氧阴离子自由基清除能力的测定
取不同浓度的LCP溶液液各0.04 mL,按试剂盒加入反应试剂一0.26 mL、试剂二0.32 mL、试剂三0.04 mL、试剂四0.06 mL,混匀,即为测定组。取等体积蒸馏水,同法制备对照组。依上述方法,不加试剂三,加蒸馏水补足体积,混匀,即为空白组。于37 ℃反应10 min,转移至玻璃比色皿中,蒸馏水调零,570 nm读取各组吸光度值A,平行测定3次,以VC为阳性对照组,如下公式(4)计算清除率。
超氧阴离子自由基清除率(%)=A1−A2A1−A3×100 (4) 式中:A1:对照组吸光度值,A2:测定组吸光度值,A3:空白组吸光度值。
1.2.7.3 DPPH自由基清除能力的测定
分别吸取1.47 mg/mL的 LCP溶液0.2、0.4、0.6、0.8、1 mL,加80%甲醇补足至1 mL,备用。取上述不同浓度的LCP溶液0.4 mL,按试剂盒加入0.6 mL工作液制,混匀,即得测定组。取0.4 mL不同浓度的LCP溶液与0.6 mL 80% 甲醇溶液为对照组。取0.4 mL 80% 甲醇溶液与0.6 mL工作液,充分混匀,即得空白组。室温避光静置30 min使之充分反应,无水乙醇调零,于517 nm读取吸光度值A,每个浓度的样品重复测定3次,取均值,以VC为阳性对照组,按公式(5)计算清除率[16]。
DPPH自由基清除率(%)=(1−A1−A2A3)×100 (5) 式中:A1:测定组吸光度值,A2:对照组吸光度值,A3:空白组吸光度值。
1.3 数据处理
实验结果用平均值±标准差表示,采用 Design Expert 8.0.6 进行响应面实验数据优化,用SPSS 26.0软件进行方差分析,以P<0.05 表示有统计学意义。
2. 结果与分析
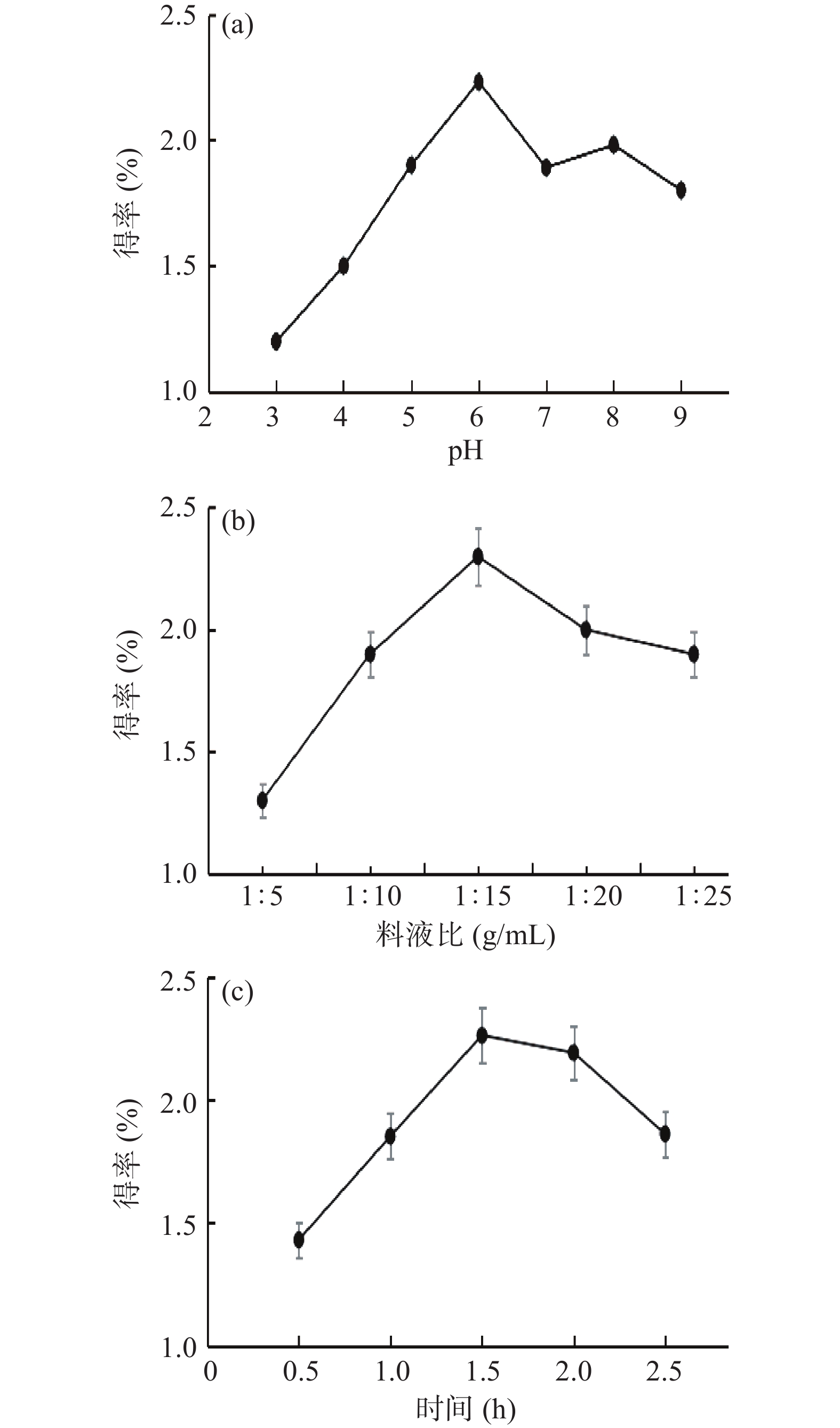
2.1 单因素实验
实验结果见图1(a),LCP得率先随pH的增大而增大。推测在一定范围内,增大pH,因形成羧基离子和去质子胺,蛋白质分子中含有更高的负电荷排斥力,使蛋白质和水分子之间的相互作用增加[17-18],而增加LCP的溶解度;亦可能是因偏离LCP的等电点,而增加LCP的溶解度,最终使LCP得率增大。pH6时LCP的得率为(2.23%±0.05%),而后LCP得率随pH增大而减小。推测较高pH水平下提取样品时,因增加淀粉及其他杂质物质的溶出[15,19],而稀释LCP的浓度。且在碱性条件下,酚类化合物易从药材中释放并与蛋白质共价结合而后快速氧化,导致提取物的颜色呈褐色[20]。经方差分析,P=0.002<0.01,表明pH对LCP得率的影响有极显著性。综合考虑,选取提取液pH5~7进行响应面法优化试验。
从图1(b)可发现,蛋白质得率因料液比的不同而差异明显。料液比在1:5~1:15(g/mL)范围内,蛋白质得率逐渐增加,这是由于随着料液比的增大,溶液中分子扩散和碰撞速率加快,促进蛋白质分子的溶解。当料液比在1:15~1:25(g/mL)范围内,得率逐渐下降,推测是由于料液比增大而致蛋白质分子分散性加大,不易酸沉获得蛋白质,同时一些可溶性杂质溶解阻碍蛋白质溶出,且不利于获得纯度较好的蛋白质[21]。经方差分析,P=0.032<0.05,表明料液比对LCP得率的影响具有显著性。综合考虑,选取料液比1:10~1:20(g/mL)进行响应面法优化试验。
在特定条件下,蛋白质浸出需要一定时间达到平衡状态;时间较短,分子扩散效率一定,蛋白质溶出量有限;延长浸提时间蛋白质得率呈下降趋势,可能是由于蛋白质长时间在碱性环境中会发生轻微水解和变性,而且时间延长也会增加非蛋白物质浸出,影响蛋白质进一步沉淀和蛋白制品的纯度[22],且与同类豆类如豌豆、大豆和蚕豆相比,川芎富含不同的多糖,多糖与蛋白质的相互作用可能导致川芎中提取蛋白的价值降低[23-24]。经方差分析,P=0.023<0.05,表明提取时间对LCP得率的影响具有显著性。综合考虑,选取提取时间1~2 h进行响应面法优化试验。
2.2 响应面分析LCP提取工艺试验结果
2.2.1 响应面法优化实验设计及结果
每组样品平行测定3次,取平均值,并进行数据散点图和统计分析。Design Expert 8.0.6软件进行响应面设计及结果分析。结果如表3 所示,得拟合方程为:y=2.28+0.18A+0.21B+0.19C−0.055AB+0.078AC+0.13BC−0.47A2−0.34B2−0.54C2。
表 3 响应面试验方案与结果Table 3. Response surface test scheme and results试验号 A提取时间 B料液比 C pH Y蛋白得率(%) 1 −1 −1 0 0.98 2 1 −1 0 1.43 3 −1 1 0 1.62 4 1 1 0 1.85 5 −1 0 −1 0.96 6 1 0 −1 1.18 7 −1 0 1 1.2 8 1 0 1 1.73 9 0 −1 −1 1.21 10 0 1 −1 1.24 11 0 −1 1 1.3 12 0 1 1 1.85 13 0 0 0 2.35 14 0 0 0 2.11 15 0 0 0 2.24 16 0 0 0 2.34 17 0 0 0 2.36 2.2.2 方差分析结果
如表4所示,模型F=40.23,Pr>F<0.01,说明此回归模型是极显著的。方程失拟项F=0.89,Pr>F>0.05,失拟项相对于纯误差影响不显著,说明回归模型与实测值拟合度较好,适用性高,可以使用该回归方程代替试验真实点分析试验结果。各因素的影响大小为:提取时间<提取溶剂pH<料液比。通过F检验来判定,概率P(F>Fα)的值越小,则相应变量的显著程度越高,对试验指标的影响越大,PA、PB、PC均小于0.01,说明提取时间、料液比、提取溶剂pH对LCP得率的影响极显著。R2=0.9810,R2Adj=0.9566,表示所建立的模型能够很好地反映独立变量和响应变量之间的关系。
表 4 响应面试验方差分析Table 4. Response surface test variance analysis方差来源 平方和 自由度 均方 F 值 Pr>F 显著性 模型 3.92 9 0.44 40.23 <0.0001 ** A 提取时间 0.26 1 0.26 23.6 0.0018 ** B 料液比 0.34 1 0.34 31.04 0.0008 ** C pH 0.28 1 0.28 25.62 0.0015 ** AB 0.012 1 0.012 1.12 0.3257 AC 0.024 1 0.024 2.22 0.18 BC 0.068 1 0.068 6.24 0.0411 ** A2 0.94 1 0.94 86.32 <0.0001 ** B2 0.48 1 0.48 44.6 0.0003 ** C2 1.23 1 1.23 113.87 <0.0001 ** 残差 0.076 7 0.011 失拟项 0.03 3 0.01 0.89 0.5176 纯误差 0.045 4 0.011 总和 4 16 R2=0.9810 R2Adj=0.9566 注: **:表示数值具有极显著差异,即P<0.01。 2.2.3 因素交互作用
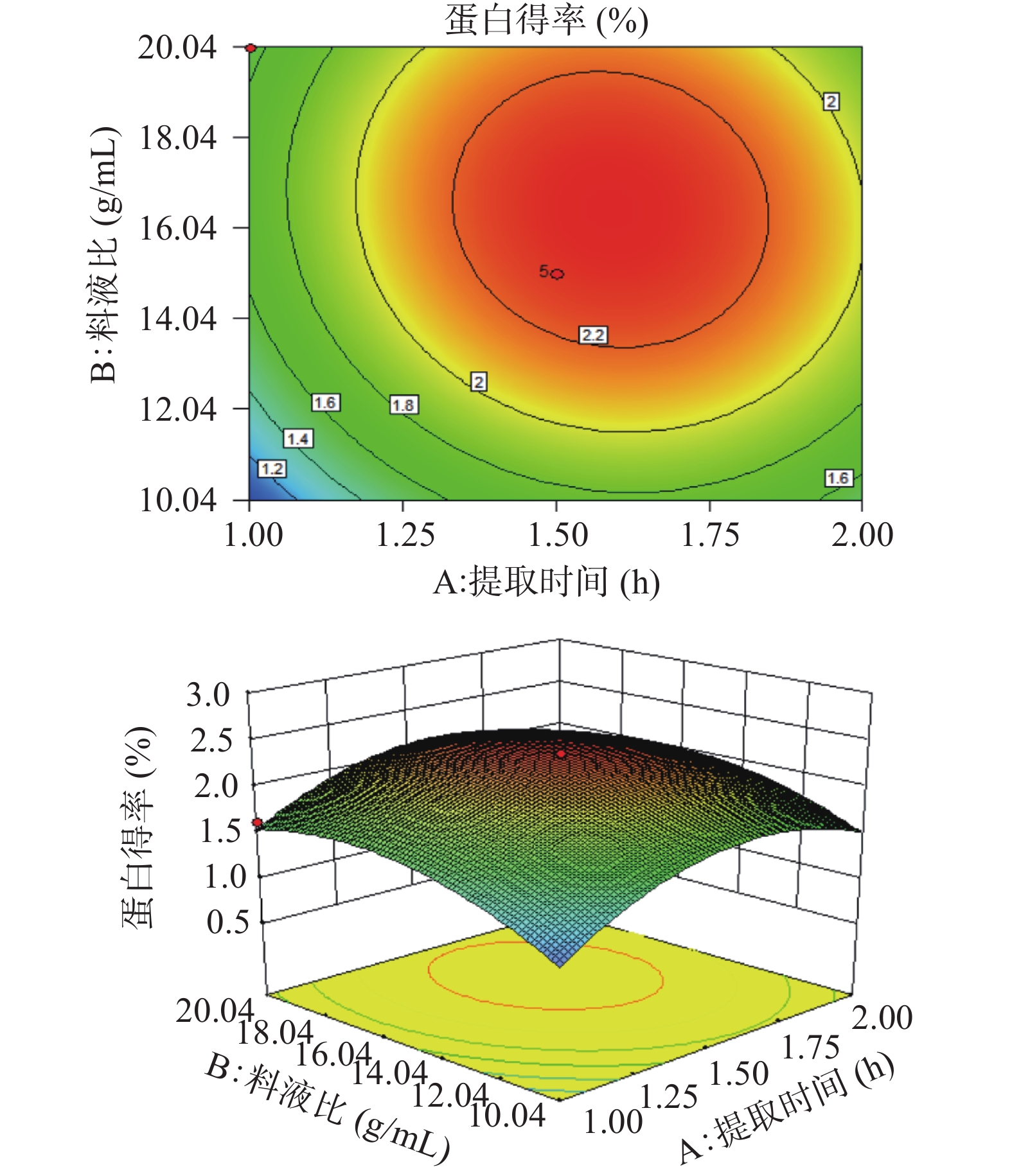
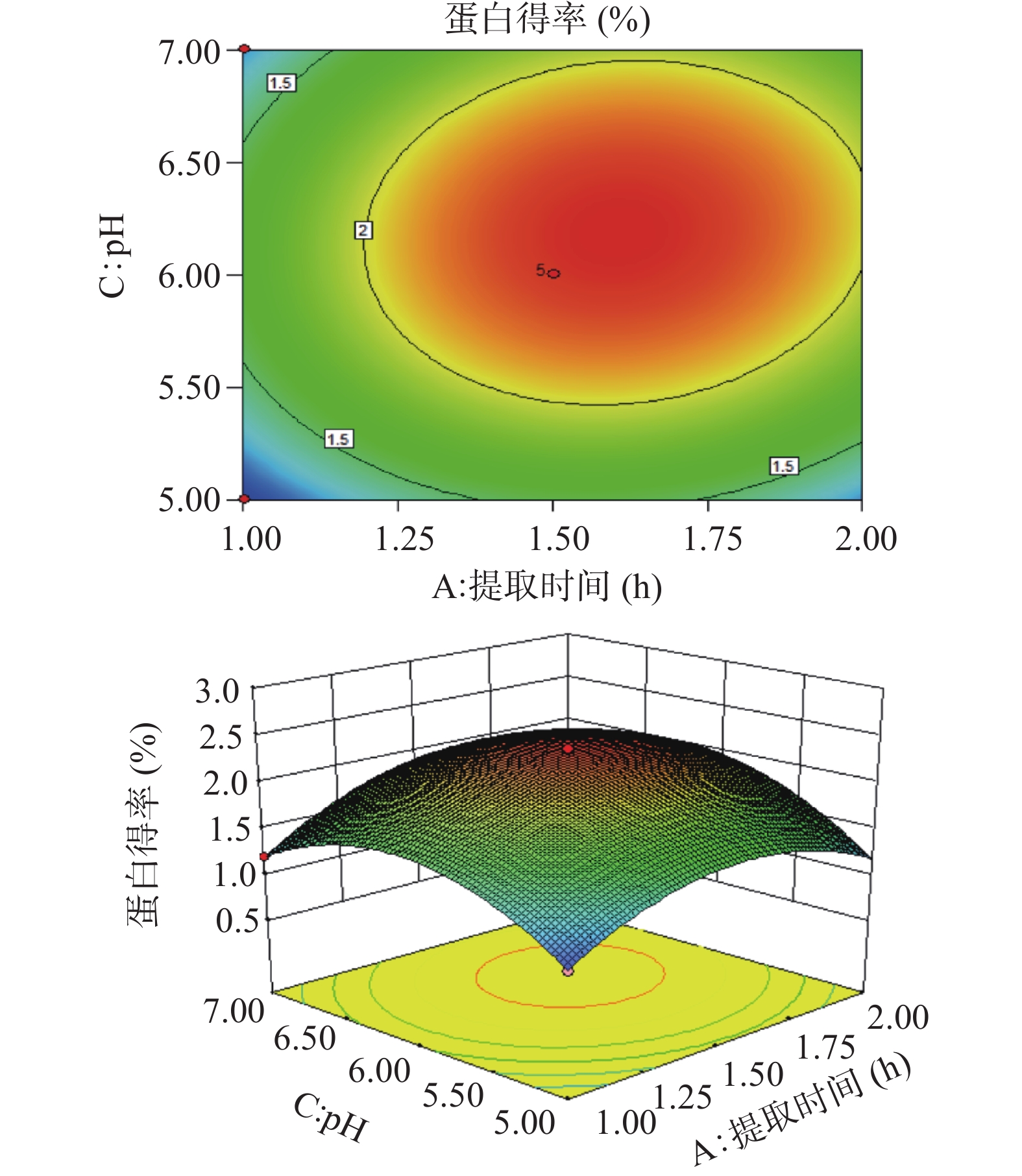
利用Design Expert 8.0.6,根据回归方程,生成等高线和响应面图,并考察拟合响应曲面的形状,分析pH、料液比、提取时间对LCP得率的影响。在响应面图中,曲线变化越陡峭,说明交互影响越显著。从图2~图4可见,三个因素在所选范围内存在极值,即等高线中最小椭圆的中心点。结果表明,BC交互作用显著,与F值结果一致。
2.2.4 验证试验
经软件分析,该模型得到的最优条件为:料液比1:15.65(g/mL)、提取时间1.58 h、pH6.23。且预测LCP得率理论值为2.35%。考虑到实际操作的可能性,将试验条件修正为:料液比为1:15(g/mL)、提取时间1.5 h、pH6。在该修正条件下进行3次提取试验,平均蛋白质得率为(2.36%±0.13%),接近理论值。表明该数学模型可用于优化LCP质提取过程。
2.3 SDS-PAGE凝胶电泳
实验结果如图5所示,Tris-HCl所提LCP的分子量分布在17~48 kDa之间,较之月见草蛋白[21](16~200 kDa)、榴莲蛋白[25](20~100 kDa)、向日葵蛋白[26](300~350 kDa)、扁豆蛋白[19](50~80 kDa),LCP分子量较小。有研究提取不同蘑菇中的蛋白质并进行抗氧化研究,结果表明分子量较小的蛋白质抗氧化能力较强[27]。活性氧自由基可以诱导蛋白质[28]发生过氧化反应,因其易与蛋白质或蛋白质衍生化合物相关的反应可能发生在含有组氨酸的侧链上,使蛋白质分子具有抗氧化活性。
2.4 等电点测定
在等电pH条件下,蛋白质分子上的电荷缺失降低了蛋白质分子之间的排斥力,从而促进了蛋白质与蛋白质之间的相互作用,蛋白质沉淀,溶解性降低,最终降低其他功能特性。试验中制备的LCP提取物在pH为3.88时沉淀最多,如图6所示,pH3.88与其余pH的蛋白沉淀量之间存在显著差异(P<0.05),因此pH3.88可能是LCP的pI,这可以为分离和纯化中选择离子交换剂或凝胶色谱试剂及后续研究提供基础[29],因等电点附近加热可以更好地控制蛋白质的溶解度,可通过加热控制蛋白质变性和聚集的程度来增强蛋白质的功能。
2.5 溶解度
蛋白质溶解度是蛋白质变性和结构改变程度的指标,也是蛋白质功能的良好指标。pH为8(图7)时,LCP的溶解度为96%。LCP在pH 3~4之间溶解度最小,当pH偏离pI时,蛋白溶解度增大。在pH8下观察到较高的溶解度,可能是由于高pH条件下LCP部分水解导致末端残基增多[30],这些残基有利于蛋白质分子与水的亲水性相互作用,如氢键和静电相互作用[19]。
2.6 LCP 体外抗氧化试验
由图8(a)可知,在0.3~1.5 mg/mL范围内,LCP的羟自由基清除能力随着浓度的增大而增强,当其浓度达到1.5 mg/mL 时,羟自由基清除率为60%。阳性对照组 VC的IC50值为0.72 mg/mL,计算得到LCP清除羟自由基的IC50值为1.18 mg/mL,由此可知,虽清除效果弱于阳性对照组,LCP具有一定的羟自由基清除能力。
由图8(b)可知,LCP对超氧阴离子自由基的清除能力在0.3~1.5 mg/mL 的浓度范围内随着浓度的增大而增强,呈现较为明显的量效关系,当其浓度达到1.5 mg/mL 时,超氧阴离子自由基清除率达到78%,清除能力与1.5 mg/mL VC相当。通过计算可知LCP清除超氧阴离子自由基的IC50值为 0.57 mg/mL,VC的IC50值0.26 mg/mL。由实验结果可知,LCP具有良好的超氧阴离子清除能力,并呈剂量依赖性,活性随蛋白质浓度的增加而增加,但不呈线性关系,推测是蛋白质不完全溶解所致。而超氧自由基能间接诱导脂质氧化而促进动脉粥样硬化斑块的发展和生长[31]。推测LCP可作为一种潜在的预防心血管疾病的天然抗氧化剂进一步研究。
由图8(c)可知,随着浓度的增加,LCP的DPPH自由基清除率逐渐增大,二者呈正相关性,当浓度为1.5 mg/mL时,DPPH自由基清除率达到最大值58.3%。但与阳性对照组VC(IC50值为0.16 mg/mL)相比,LCP(IC50值为 1.31 mg/mL)清除羟自由基的能力较弱,推测LCP可能含有较高疏水氨基酸所致[32-33]。
LCP显示出良好的抗氧化活性,可能是由于LCP 中含的氨基酸部分水解,能够向自由基提供质子,从而显示出抗氧化能力[30];在适当的pH条件下提取的LCP,属小分子量的蛋白质,亦可能是增强抗氧化活性的一个原因[34]。
3. 结论
蛋白来源丰富,种类繁多,在食品及医疗行业的应用广泛。天然蛋白质是动植物体内的重要大分子物质,具有维持细胞表面或细胞内识别、细胞粘附、蛋白质的加工和转移等生物活性功能和生物活性[35]。本研究首次从中药川芎中分离蛋白质,单因素结合响应面法优化LCP提取工艺结果表明,在pH6、料液比1:15、提取1.5 h条件下提取LCP,得率为(2.36%±0.13%),Tris-HCl法可以用于LCP提取。同时对其理化特性进行了研究,SDS-PAGE电泳表明,LCP的分子量分布在17~48 kDa之间。LCP的pI约为pH3.88;pH为8时,LCP的溶解度为96%。通过探索的LCP的分子量、等电点、溶解度等功能特性,可为其进一步研究提供一定的研究基础,为其在食品工业等领域的应用提供理论依据。
机体细胞的癌变,衰老及其它疾病都与机体内自由基的过量产生有直接的密切联系[36]。本研究结果显示,LCP具有良好的抗氧化活性,羟自由基清除能力IC50为1.18 mg/mL、超氧阴离子自由基清除能力IC50为0.57 mg/mL、1,1-二苯基-2-苦基肼基(DPPH)自由基清除能力IC50为1.31 mg/mL。且属于天然产物,具有比较高的安全性,可作为一种潜在的天然抗氧化剂源。本研究为川芎合理开发和应用提供了一些基础资料,也为开发植物源的天然抗氧剂奠定了良好的基础。
-
表 1 响应面优化试验因素水平表
Table 1 Factors and levels table of response surface optimization
水平 因素 A提取时间(h) B料液比(g/mL) C pH −1 1 1:10 5 0 1.5 1:15 6 1 2 1:20 7 表 2 等电点测定
Table 2 Isoelectric point measurement
试剂 编号 1 2 3 4 5 6 7 8 9 10 去离子水(mL) 5 5.5 3 4 5 5.5 4 5 5.5 6 1.00 mol·L−1 乙酸(mL) 1 0.5 − − − − − − − − 0.10 mol·L−1 乙酸(mL) − − 3 2 1 0.5 − − − − 0.01 mol·L−1 乙酸(mL) − − − − − − 2 1 0.5 − 蛋白提取液(mL) 1 1 1 1 1 1 1 1 1 1 pH 3.47 3.78 3.88 4.16 4.6 5.53 7.68 7.96 8.13 8.34 表 3 响应面试验方案与结果
Table 3 Response surface test scheme and results
试验号 A提取时间 B料液比 C pH Y蛋白得率(%) 1 −1 −1 0 0.98 2 1 −1 0 1.43 3 −1 1 0 1.62 4 1 1 0 1.85 5 −1 0 −1 0.96 6 1 0 −1 1.18 7 −1 0 1 1.2 8 1 0 1 1.73 9 0 −1 −1 1.21 10 0 1 −1 1.24 11 0 −1 1 1.3 12 0 1 1 1.85 13 0 0 0 2.35 14 0 0 0 2.11 15 0 0 0 2.24 16 0 0 0 2.34 17 0 0 0 2.36 表 4 响应面试验方差分析
Table 4 Response surface test variance analysis
方差来源 平方和 自由度 均方 F 值 Pr>F 显著性 模型 3.92 9 0.44 40.23 <0.0001 ** A 提取时间 0.26 1 0.26 23.6 0.0018 ** B 料液比 0.34 1 0.34 31.04 0.0008 ** C pH 0.28 1 0.28 25.62 0.0015 ** AB 0.012 1 0.012 1.12 0.3257 AC 0.024 1 0.024 2.22 0.18 BC 0.068 1 0.068 6.24 0.0411 ** A2 0.94 1 0.94 86.32 <0.0001 ** B2 0.48 1 0.48 44.6 0.0003 ** C2 1.23 1 1.23 113.87 <0.0001 ** 残差 0.076 7 0.011 失拟项 0.03 3 0.01 0.89 0.5176 纯误差 0.045 4 0.011 总和 4 16 R2=0.9810 R2Adj=0.9566 注: **:表示数值具有极显著差异,即P<0.01。 -
[1] 国家药典委员会.中华人民共和国药典.一部[S].北京: 中国医药科技出版社, 2020: 42. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. One[S]. Beijing: China Medical Science and Technology Press, 2020: 42.
[2] Chen Z J, Zhang C, Gao F, et al. A systematic review on the rhizome of Ligusticum chuanxiong Hort. (Chuanxiong)[J]. Food & Chemical Toxicology,2018:S0278691518301248.
[3] 冯帅, 李峰, 王心. 50种中药总蛋白含量与寒热药性的相关性研究[J]. 辽宁中医杂志,2010,37(8):1412−1414. [Feng S, Li F, Wang X. Correlation between total protein content of 50 kinds of Chinese herbs and cold and heat properties[J]. Liaoning Journal of Traditional Chinese Medicine,2010,37(8):1412−1414. [4] Aya U, Vasudevanpillai B, Yasukazu Y. In vivo ROS production and use of oxidative stress-derived biomarkers to detect the onset of diseases such as Alzheimer’s disease, Parkinson’s disease, and diabetes[J]. Free Radical Research,2017,51(4):413−427. doi: 10.1080/10715762.2017.1315114
[5] Feng Wang, Yizhong Zhang, Ling Xu, et al. An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J]. LWT,2020:127.
[6] 懿化, 王星滟, 张武霞, 等.黑豆糖蛋白的结构分析及抗氧化和免疫活性[J/OL].食品科学: 1−13[2021-05-05]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201229.1000.050.html. Yi Hua, Wang Xingyan, Zhang Wuxia, et al. Structural analysis of black bean glycoprotein and its antioxidant and immune activities [J/OL]. Food Science: 1−13 [2021-05-05]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201229.1000.050.html.
[7] 邓辉, 崔绍进, 朱富成, 等. 霍山石斛糖蛋白的提取方法优选及抗氧化活性分析[J]. 生物学杂志,2019,36(2):111−115. [Deng H, Cui S J, Zhu F C, et al. Optimization of extraction methods and antioxidant activity analysis of glycoproteins from Dendrobium huoshenii[J]. Chinese Journal of Biology,2019,36(2):111−115. [8] 王苗, 张红印, 范琳, 等. 葛根蛋白提取工艺及其体外抗氧化性研究[J]. 食品研究与开发,2021,42(1):73−79. [Wang M, Zhang H Y, Fan L, et al. Study on extraction technology and antioxidant activity of pueraria protein in vitro[J]. Food Research and Development,2021,42(1):73−79. [9] Ycza B, Clw A, Cfm C, et al. Interactions of grape seed procyanidins with soy protein isolate: Contributing antioxidant and stability properties[J]. LWT,2019,115:108465. doi: 10.1016/j.lwt.2019.108465
[10] 赵营莉, 李娟, 方兴, 等. 蒙古黄芪和膜荚黄芪水溶性蛋白表达[J]. 中国实验方剂学杂志,2020,26(5):145−152. [Zhao Y L, LI J, Fang X, et al. Expression of water-soluble proteins in Astragalus mongolicus and Astragalus membranaceus[J]. Chinese Journal of Experimental Formulae,2020,26(5):145−152. [11] Hejazi T H, Bashiri M. Optimization of probabilistic multiple response surfaces[J]. Applied Mathematical Modelling,2012,36(3):1275−1285. doi: 10.1016/j.apm.2011.07.067
[12] Ratanasumarn N, Chitprasert P. Cosmetic potential of lignin extracts from alkaline-treated sugarcane bagasse: Optimization of extraction conditions using response surface methodology[J]. International Journal of Biological Macromolecules,2020,153:138−145. doi: 10.1016/j.ijbiomac.2020.02.328
[13] 贺小燕. 甘草蛋白自组装行为研究[D].福州: 福州大学, 2013. He X Y. Study on self-assembly behavior of glycyrrhiza protein [D]. Fuzhou: Fuzhou University, 2013.
[14] JianTing Y, CaiE W, YingYing L, et al. Identification and purification of an allergic glycoprotein from Ginkgo biloba Kernel[J]. 中国农业科学: 英文版,2011,10(4):631−641. [15] Sethi Swati, Yadav D N, Snigdha Sneha, et al. Optimization of process parameters for extraction of protein isolates from Khesari dhal (Lathyrus sativus L)[J]. LWT,2021:137.
[16] 张蜀艳, 蒲建萍, 李政. 白花蛇舌草和半枝莲总黄酮提取工艺优化及抗氧化性研究[J]. 食品研究与开发,2019,40(4):91−96. [Zhang S Y, Pu J P, Li Z. Study on the extraction process and antioxidant activity of total flavonoids from Hedyotis variegata and Scutellaria chinensis[J]. Food Research and Development,2019,40(4):91−96. doi: 10.3969/j.issn.1005-6521.2019.04.018 [17] Deepanshu, Garg, Snehasis, et al. Optimizing the extraction of protein from Prosopis cineraria seeds using response surface methodology and characterization of seed protein concentrate[J]. LWT,2019,117:108630−108630.
[18] Dipak Das, Nisar A. Mir, Narender Kumar Chandla, Sukhcharn Singh, Combined effect of pH treatment and the extraction pH on the physicochemical, functional and rheological characteristics of amaranth (Amaranthus hypochondriacus) seed protein isolates[J].Food Chemistry, 2021, 353, 129466.
[19] Jarpa-Parra M, Bamdad F, Wang Y, et al. Optimization of lentil protein extraction and the influence of process ph on protein structure and functionality[J]. LWT - Food Science and Technology,2014,57(2):461−469. doi: 10.1016/j.lwt.2014.02.035
[20] Feng Y N, Zhang X F. Polysaccharide extracted from Huperzia serrata using response surface methodology and its biological activity[J]. International Journal of Biological Macromolecules,2020:157.
[21] Mh A, Ai A, Sp B. Optimization of extraction and deamidation of edible protein from evening primrose (Oenothera biennis L.) oil processing by-products and its effect on structural and techno-functional properties[J]. Food Chemistry,2020:334.
[22] Bedin S, Netto F M, Bragagnolo N, et al. Reduction of the process time in the achieve of rice bran protein through ultrasound-assisted extraction and microwave-assisted extraction[J]. Separation Science,2020,55(2):1577449.
[23] Aya A, Ersus S. Optimization of enzyme assisted extraction of protein from the sugar beet (Beta vulgaris L.) leaves for alternative plant protein concentrate production[J]. Food Chemistry,2020:335.
[24] Butt M S , Batool R. Nutritional and functional properties of some promising legumes protein isolates[J]. Pakistan Journal of Nutrition,2010,9(4).
[25] Xue Y T, Misran A , Daim L, et al. Optimization of protein extraction for proteomic analyses of fresh and frozen “Musang King” durian pulps[J]. Food Chemistry,2021,343:128471. doi: 10.1016/j.foodchem.2020.128471
[26] Slabi S A , Mathe C , Basselin M , et al. Multi-objective optimization of solid/liquid extraction of total sunflower proteins from cold press meal[J]. Food Chemistry,2020,317:126423. doi: 10.1016/j.foodchem.2020.126423
[27] Cheung Y C, Siu K C, Liu Y S, et al. Molecular properties and antioxidant activities of polysaccharide–protein complexes from selected mushrooms by ultrasound-assisted extraction[J]. Process Biochemistry,2012,47(5):892−895. doi: 10.1016/j.procbio.2012.02.004
[28] Chen C , Sun-Waterhouse D , Y Zhang, et al. The chemistry behind the antioxidant actions of soy protein isolate hydrolysates in a liposomal system: Their performance in aqueous solutions and liposomes[J]. Food Chemistry,2020:323.
[29] Raikos V. Effect of heat treatment on milk protein functionality at emulsion interfaces: A review[J]. Food Hydrocolloids,2010,24(4):259−265. doi: 10.1016/j.foodhyd.2009.10.014
[30] Sf A , Em B , Qag B . Ali Golimovahhed. Grass pea (Lathyrus sativus L.) protein isolate: The effect of extraction optimization and drying methods on the structure and functional properties[J]. Food Hydrocolloids,2018:74.
[31] Umeno A, Biju V, Yoshida Y. In vivo ROS production and use of oxidative stress-derived biomarkers to detect the onset of diseases such as Alzheimer's disease, Parkinson's disease, and diabetes[J]. Free Radical Research,2017:413.
[32] He Z, Zhang D, Olanya O M. Antioxidant activities of the water-soluble fractions of glandless and glanded cottonseed protein[J]. Food Chemistry,2020,325:126907. doi: 10.1016/j.foodchem.2020.126907
[33] Rd A , Lz B , Gr B , et al. Elderberry (Sambucus nigra L.) as potential source of antioxidants. Characterization, optimization of extraction parameters and bioactive properties[J]. Food Chemistry,2020:330.
[34] Wang Y Y, Wang C Y, Wang S T, et al. Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J]. Food Chemistry,2021:345.
[35] Li Z, Wang B, Chi C, et al. Purification and characterization of an antioxidant glycoprotein from the hydrolysate of Mustelus griseus[J]. International Journal of Biological Macromolecules,2013,52:267−274. doi: 10.1016/j.ijbiomac.2012.10.025
[36] Zhang W X , Song D, Xu D, et al. Characterization of polysaccharides with antioxidant and immunological activities from Rhizoma Acori Tatarinowii[J]. Carbohydrate Polymers,2015:133.
-
期刊类型引用(3)
1. 陆义涛,田翠芳,吴倩,刘佳文,刘静,段为旦,徐欢,周立法,潘迎捷,赵勇,张昭寰. 新型功能性冰在食品杀菌保鲜中的应用与展望. 食品科学. 2024(14): 267-276 .  百度学术
百度学术
2. 郭树欣,梁惜雯,姜爱丽,熊思国,蒋旭. 高原夏菜贮运保鲜技术研究进展. 食品安全质量检测学报. 2023(18): 10-16 .  百度学术
百度学术
3. 姜旭阳,姚琳琳,赵晓霞,张璐. 养殖工船大黄鱼冰浆保鲜方法研究. 渔业现代化. 2022(05): 81-88 .  百度学术
百度学术
其他类型引用(1)






 下载:
下载:









 下载:
下载:



