Effects of Simulated Gastrointestinal Digestion on Active Components and Antioxidant Activity of Fermented Tea (Camellia sinensis) Jiaosu in Vitro
-
摘要: 为探究古茶树叶酵素经模拟胃、肠消化后活性成分和抗氧化活性的变化,该研究采用体外模拟胃、肠消化的方法,检测古茶树叶酵素模拟胃肠消化过程中总酚、黄酮、原花青素含量的释放规律,同时对模拟胃肠消化前后茶叶酵素中的5种儿茶素类物质含量变化进行了分析,并对其体外抗氧化活性的变化规律进行了进一步研究。结果表明:古茶树叶酵素在模拟胃消化中,总酚、总黄酮含量和ABTS阳离子自由基清除能力、还原力均显著提高(P<0.05),原花青素含量、DPPH自由基清除能力无显著变化(P>0.05);在模拟肠消化中,总酚含量、ABTS阳离子自由基清除能力显著提高(P<0.05),总黄酮含量、DPPH自由基清除能力、还原力无显著变化(P>0.05),原花青素含量显著降低(P<0.05)。5种儿茶素类物质中在胃消化过程中无显著性变化(P>0.05),而在肠消化过程中均显著下降(P<0.05),儿茶素、表没食子儿茶素、表儿茶素、表儿茶素没食子酸酯含量在模拟肠消化2 h后分别下降了74.58%、64.40%、86.95%、48.21%。这表明,古茶树叶酵素在模拟胃肠消化过程中,胃蛋白酶、胃酸可促进抗氧化活性物质释放,有较好的抗氧化活性,有望应用于抗氧化产品的开发。Abstract: In order to explore the changes of active components and antioxidant activities of ancient fermented tea (Camellia sinensis) Jiaosu after simulated gastric and intestinal digestion, the contents of total phenols, flavones and procyanidins in ancient fermented tea (Camellia sinensis) Jiaosu were determined by the method of in vitro simulated gastric and intestinal digestion. Meanwhile, the changes in the contents of five catechins in tea Jiaosu was investigated before and after gastric and intestinal digestion, and the changes of antioxidant activity in vitro were further studied. The results showed that the contents of total phenols, total flavonoids, ABTS cationic free radical scavenging ability and reducing power were significantly increased (P<0.05), while the content of procyanidins and DPPH free radical scavenging ability had no significant change (P>0.05). In the simulated intestinal digestion, the total phenol content and ABTS cationic free radical scavenging ability increased significantly (P<0.05), while the total flavone content, DPPH free radical scavenging ability and reducing power had no significant change (P>0.05), while the procyanidin content decreased significantly (P<0.05). The contents of catechins, epigallocatechin, epicatechin and epicatechin gallate decreased by 74.58%, 64.40%, 86.95% and 48.21%, respectively. These results indicated that pepsin and gastric acid could promote the release of antioxidant active substances in the simulated gastrointestinal digestion process of ancient tea leaf enzyme, which had good antioxidant activity and was expected to be applied in the development of antioxidant products.
-
食用酵素是以一种或几种新鲜的果蔬、谷豆类和食药两用草本类等食材为原料,经多种微生物长时间发酵而生产的功能性产品[1],含有丰富的次级代谢物、益生菌和原料本身的维生素、矿物质等营养成分等[2],具有清除自由基、抗氧化[3]、降血脂、提高免疫力等[4]生理功能。
茶树(Camellia sinensis L.)是属于山茶科(Theaceae)、山茶属(Camellia)的植物[5],树龄达百年以上可称作古茶树。茶树叶是茶树的叶子和芽,对人体具有减脂[6]、抗氧化[7]等保健功能。目前,以茶树叶为原料加工制作的保健品较少,通过微生物发酵制备古茶树叶酵素,可以在保留茶叶本身活性成分的基础上,进一步增强其营养价值及和保健功能,实现其高价值利用的目的。
茶叶中的主要生物活性成分有多酚、类黄酮、花青素等物质,类黄酮物质是茶叶中普遍存在的次生代谢产物,类黄酮途径包括花青素、原花青素、黄酮醇等多个途径。其中花青素在花青素还原酶的作用下生产表儿茶素,无色花青素在五色花青素还原酶作用下生成儿茶素,儿茶素、表儿茶素等类黄酮途径产物可聚合成原花青素。其中,多酚类、黄酮类物质、花青素类以及儿茶素类物质有着密不可分的关系[8]。研究表明,茶叶中的多酚类物质被吸收之前,易在胃肠道中发生降解或结构变化,导致其生物活性随之改变,尤其是抗氧化活性在消化前后差异巨大[9-10]。茶叶酵素作为即食食品,其生物活性成分在消化过程中也会发生变化,但体内研究天然产物的生物活性较为复杂且昂贵,采用体外模拟胃肠消化则是一种低成本且较接近真实体内消化的方法。国内外许多学者已经对蓝莓、山楂、柑橘等多种食品进行了体外消化模拟实验,研究其在消化模拟过程中酚类物质的变化规律[11-13]。
目前尚未有探究茶树叶酵素在消化过程中活性成分含量及抗氧化活性变化规律的相关研究报道,故本试验采用体外模拟胃肠消化法,探讨消化过程中茶树叶酵素总酚、黄酮、原花青素含量的变化规律,同时对模拟胃肠消化前后茶叶酵素中的5种儿茶素类物质含量变化进行了研究,通过DPPH自由基清除能力、ABTS阳离子自由基清除能力和还原力考察茶树叶酵素抗氧化能力的变化,以期正确评价茶树叶酵素的营养价值和抗氧化活性。
1. 材料与方法
1.1 材料与仪器
古茶树叶酵素(古茶树树叶与发酵液和糖液按一定比例加入高压蒸汽灭菌过的20 L不锈钢发酵罐中,于20 ℃下发酵70 d制成) 由浙江省农产品化学与生物加工技术重点实验室提供;1,1-二苯基-2-三硝基苯肼(DPPH) 日本TCI公司;2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、磷酸(色谱纯)、儿茶素(C)、表没食子儿茶素(EGC)、表儿茶素(EC)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG) 上海阿拉丁化学试剂有限公司;胃蛋白酶、胰蛋白酶、福林酚试剂、猪胆盐 国药集团化学试剂有限公司;乙腈(色谱纯) 美国Thermo Fisher Scientific公司。
PHS-3C精密酸度计 杭州齐威仪器有限公司;XMTD-204数显式电热恒温水浴锅 常州诺基仪器有限公司;TS-110X50水浴摇床 上海天呈实验仪器制造有限公司;Waters e2695高效液相色谱(配Waters 2998二极管阵列检测器和SunFire C18(5 μm,250 mm×4.6 mm)色谱柱) 美国Waters公司;SpectraMax iD5多功能酶标仪 美国Molecular Devices公司。
1.2 实验方法
1.2.1 体外模拟胃肠消化
酵素稀释液的制备:取4 mL酵素样品与16 mL 9 mg/mL NaCl溶液混合均匀,设立三个平行实验组。
模拟胃液消化组:取20 mL上述稀释液,HCl溶液(1 mol/L)调节pH至2.0±0.1,加入4 mL模拟胃液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L的HCl溶液);胃酸对照组:20 mL稀释液加入4 mL 0.01 mol/L 的HCl溶液,调节pH至2.0±0.1;空白对照组:20 mL稀释液加入等体积生理盐水代替胃液。于37 ℃,100 r/min水浴振荡2 h,分别在消化的0.0、0.5、1.0、2.0 h取样,并于4 ℃、8000 r/min条件下离心10 min,取上清液,待测。
模拟肠液消化:取模拟胃消化2 h的样品,用1 mol/L NaHCO3调节pH至7.0±0.1。模拟肠液消化组:加入4 mL模拟肠液(0.4 g胰蛋白酶、2.5 g猪胆盐溶于100 mL 0.1 mol/L pH 7.0的NaHCO3-Na2CO3缓冲液,即0.4 mg/mL胰蛋白酶溶液和25 mg/mL胆汁提取物);肠空白对照组:加入等体积0.1 mol/L NaHCO3-Na2CO3缓冲液代替肠液。
将上述各组于37 ℃,100 r/min水浴振荡2 h。于消化的0.0、0.5、1.0、2.0 h取样,并于4 ℃、8000 r/min条件下离心10 min,取上清液,待测。
1.2.2 总酚含量测定
采用福林酚法[16]测定总酚,取样品各阶段消化液1 mL,分别加入5 mL体积分数为10%的福林酚溶液,避光常温放置反应3 min后加入75 g/L Na2CO3溶液4 mL,混匀。于25 ℃反应1 h,以水为空白对照,在波长765 nm处测定吸光度值,以没食子酸为标样制作标准曲线,结果以没食子酸当量(mg GAE/mL)表示。
1.2.3 总黄酮含量测定
根据硝酸铝比色法[17]测定总黄酮,取样品各阶段消化液5 μL,分别加入7.5 μL 5%的NaNO2,静置6 min后加入7.5 μL 10%的Al(NO3)3静置6 min,再加入50 μL 4%氢氧化钠溶液,用水补至250 μL,静置15 min,在波长510 nm处测定吸光度值,以芦丁为标样制作标准曲线,结果以芦丁当量(mg RE/mL)表示。
1.2.4 原花青素含量测定
采用香草醛-甲醇-盐酸显色法[18]测定原花青素,取样品各阶段消化液20 μL,分别加入120 μL 4%香草醛-甲醇溶液和60 μL浓HCl,于25 ℃避光孵育15 min,在波长500 nm处测定吸光度值,以儿茶素为标样制作标准曲线,结果以儿茶素当量(mg CE/mL)表示。
1.2.5 儿茶素类物质含量测定
1.2.5.1 HPLC条件
将样品各阶段消化液用0.22 μm滤膜过滤,待测。色谱柱:SunFire C18(5 μm,250 mm×4.6 mm);流动相:乙腈(A)和0.2%磷酸溶液(B);梯度洗脱(0 min,5%A;0~15 min,5%~15%A;15~40 min,15%~25%A;40~45 min,25%~5%A);流速:1 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:280 nm[19]。
1.2.5.2 标准溶液制备
称取C 5 mg、EC 5 mg、EGC 10 mg、EGCG 10 mg、ECG 10 mg分别于5 mL容量瓶中,用稳定溶液(移取25 mL 10 mg/mL EDTA-2Na、25 mL 10 mg/mL抗坏血酸和50 mL乙腈,并用超纯水定容至500 mL)定容至5 mL。4 ℃保存备用。
1.2.5.3 标准曲线的绘制
取1.2.5.2节中的标准溶液过0.22 μm的滤膜,按1.2.5.1节中色谱条件进行分析。以样品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,以峰面积外标法进行定量。
1.2.6 抗氧化能力测定
1.2.6.1 DPPH自由基清除能力测定
取5 μL样品,加水至50 μL,加入到100 μL 0.1 mmol/L DPPH-甲醇溶液中,再加入11.3 μL 50 mmol/L Tris-HCl缓冲溶液(pH7.4),25 ℃下恒温反应30 min。以去离子水为对照,在517 nm下测定吸光度。按式(1)计算样品的DPPH自由基清除能力[20]。
DPPH自由基清除率(%)=[A0−(A1−A2)]A0×100 (1) 式中:A0为空白对照液的吸光度;A1为样品测定管的吸光度;A2为样品本底管的吸光度。
1.2.6.2 ABTS阳离子自由基清除能力测定
用7 mmol/L ABTS(用5 mmol/L PBS,pH7.4配制),加入过硫酸钾最终浓度为2.45 mmol/L,在室温下黑暗放置12~16 h。使用前把ABTS+溶液用PBS稀释成在734 nm下吸光度为0.70±0.02。取8 μL样品,用磷酸缓冲液(5 mmol/L,pH7.4)补至12 μL,再加入200 μL ABTS溶液,在30 ℃下,反应1 h。以去离子水为对照,在734 nm下测定吸光度。按式(2)计算样品的ABTS阳离子自由基清除能力[21]。
ABTS自由基清除率(%)=[A0−(A1−A2)]A0×100 (2) 式中:A0为空白对照液的吸光度;A1为样品测定管的吸光度;A2为样品本底管的吸光度。
1.2.6.3 还原力测定
取3 μL样品,用磷酸缓冲液(0.2 mol/L,pH6.6)至250 μL,然后加入250 μL 1%铁氰化钾(w/v),混合均匀,50 ℃,反应30 min,再加入10%三氯乙酸(w/v)250 μL,混合均匀,静止10 min,立即取100 μL上清液,加入100 μL去离子水和20 μL 0.1%三氯化铁(w/v),混合均匀,以去离子水为对照,在700 nm下测定[22]。
1.3 数据处理
以上实验均平行3次,得到数据经过SPSS软件分析实验数据,平均值的差异性采用单因素分析(one-way analysis of variance,ANOVA)中的最小显著差异法(least significant difference,LSD)检验,以P<0.05为差异显著。
2. 结果与分析
2.1 体外模拟消化过程中活性成分含量的变化
2.1.1 体外模拟消化过程中总酚含量的变化
如图1所示,胃液消化组的总酚含量在0.5~1 h显著上升(P<0.05),1 h后显著下降(P<0.05);胃酸对照组和胃空白对照组的总酚含量在消化0.5~1 h内有所下降后趋于稳定,且胃酸对照组的总酚含量显著高于胃空白对照组(P<0.05)。在模拟胃液消化过程中,消化0~2.0 h内,总酚含量依次为胃液消化组>胃酸对照组>胃空白对照组,这说明模拟胃消化过程中的胃蛋白酶和胃酸均有利于古茶树叶酵素中多酚释放量的增加,其中胃蛋白酶起主要作用,这可能是某些与蛋白质以氢键等非共价结合的多酚物质,在蛋白质被胃蛋白酶水解后释放[13];而胃液消化组1 h后总酚含量的降低可能是由多酚类物质降解量大于释放量引起的。
在模拟肠消化过程中,与模拟肠消化0 h比较,总酚含量在0.5 h内显著下降(P<0.05),而肠消化1 h后又显著上升(P<0.05)。肠消化前期多酚含量显著下降的原因可能是部分酸性酚类化合物在中性环境下发生降解降解生成其他物质[12];后期显著上升则可能是由于与多糖以酯键形式结合形成糖苷的多酚分子在酶的作用下水解释放,导致整体酚羟基含量有所上升所致[23-24]。
2.1.2 体外模拟消化过程中总黄酮含量的变化
如图2所示,胃液消化组和胃酸对照组的黄酮含量在0.5 h内显著提高(P<0.05),0.5~1 h内胃酸对照组趋于稳定,胃液消化组仍显著升高(P<0.05),而空白对照组的总黄酮含量在胃消化过程中的无显著变化。在模拟胃液消化2 h过程中,黄酮含量的最大值(6.258±0.122 mg RE/mL)为胃消化0 h(4.745±0.018 mg RE/mL)的1.32倍。胃酸对照组的黄酮含量最大值(5.458±0.138 mg RE/mL)为胃消化0 h的1.15倍。在胃消化阶段,黄酮含量依次为模拟胃液消化组>胃酸对照组>胃空白对照组,这表明胃蛋白酶和胃酸能够对黄酮的释放共同起促进作用。在模拟胃消化阶段,黄酮和总酚含量变化规律较为相似,胃液消化均可促进两者含量增加直至稳定;而与总酚含量变化规律不同的是,胃酸对照组的黄酮含量同样显著提高(P<0.05),说明较低pH可以促进黄酮类物质的释放[9,14-15]。
在模拟肠消化过程中,肠液消化组与肠空白对照组的总黄酮含量均呈现先上升后下降又上升的趋势,且两组之间无显著性差异,说明胰酶对黄酮释放量影响较小。肠液消化1 h内,黄酮含量有所降低可能是因为儿茶素、表儿茶素等黄烷-3-醇类物质在环境变化的情况下不稳定所致[25],后期黄酮含量出现上升趋势可能是酶水解蛋白质,将一些与蛋白质复合的黄酮类化合物水解出来。
2.1.3 体外模拟消化过程中原花青素含量的变化
如图3所示,胃液消化组的原花青素含量在0.5~2 h显著上升(P<0.05);胃酸对照组和胃空白对照组的原花青素含量在消化过程中均无显著差异,这表明胃蛋白酶可以促进原花青素的释放。
在模拟肠消化过程中,与模拟肠消化0 h相比,模拟肠液组的原花青素含量在1 h时显著下降(P<0.05);而空白对照组在肠消化过程中原花青素含量无显著差异,说明胰蛋白酶和胆汁对原花青素含量有显著影响,可能是在肠环境下原花青素单体降解引起的[25]。刘静敏等[10]研究发现紫娟等四种茶叶在模拟肠消化阶段中原花青素含量均显著下降,与本文结论一致。本文的古茶树叶酵素经模拟肠消化2 h后,原花青素含量与空白对照组相比未发生显著的变化。
2.1.4 体外模拟消化过程中儿茶素类物质含量的变化
为进一步探究和明确在胃肠环境下儿茶素类物质具体变化,本研究选取了儿茶素、表没食子儿茶素、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯等5种儿茶素单体作为代表,研究其在胃肠消化过程中的变化情况。图4为混合标准品的HPLC图。
如表1所示,5种儿茶素标准品质量浓度与峰面积呈现良好的线性关系,R2值均在0.9978以上。
表 1 儿茶素类物质的标准曲线回归方程Table 1. Linear regresslon equations for five catechins standards儿茶素类物质 回归方程 R2 C y=61421x−2721 0.9999 EC y=35414x−21146 0.9999 EGC y=32652x−685.2 0.9999 EGCG y=117837x−1198176.4 0.9978 ECG y=16677x−8106 0.9999 如表2所示,模拟胃消化对C、EGC和ECG无显著影响(P>0.05),但胃液消化0 h与2 h相比,EC含量显著上升(P<0.05)。儿茶素在体外模拟胃消化过程中的降解不显著,说明胃液中的强酸环境和胃蛋白酶对儿茶素类物质影响较小,这可能是因为儿茶素类物质在酸性条件下较为稳定[26]。
表 2 古茶树茶叶酵素模拟胃消化过程中儿茶素类物质含量的变化Table 2. Changes of catechins in fermented tea Jiaosu during simulated gastric digestion儿茶素类物质(μg·mL−1) 胃空白对照组(h) 胃酸对照组(h) 胃液消化组(h) 0 0.5 1 2 0 0.5 1 2 0 0.5 1 2 EGC 76.53±4.00abcd 78.41±3.69abcd 73.39±0.78d 77.71±6.76abcd 81.76±0.30a 79.65±2.36ab 78.79±1.46abc 78.94±0.89abc 75.57±1.29bcd 76.73±2.35abcd 73.90±0.81cd 77.18±1.04abcd C 42.90±1.72bcd 44.28±2.33abcd 41.82±0.08d 44.48±3.75abcd 47.65±2.48a 46.38±2.48ab 47.27±0.85a 43.58±1.87cd 45.64±1.02abc 46.13±1.53ab 44.45±0.58abcd 46.31±0.74ab EC 439.15±4.49bc 446.33±5.20a 435.08±0.96c 442.19±10.27ab 445.67±1.31a 442.90±0.10ab 434.30±1.05c 441.82±1.68ab 414.34±1.40e 420.15±2.14d 409.59±0.63e 425.45±0.85d EGCG ND ND ND ND 0.53 ND ND ND ND ND ND ND ECG 16.63±0.35c 18.40±0.53abc 18.09±2.41bc 19.32±0.56abc 22.41±3.43a 21.61±0.89ab 21.82±0.21ab 20.45±0.61abc 21.85±2.05ab 18.32±3.70bc 19.32±0.30abc 19.97±0.62abc 注:同行小写英文字母不同表示差异显著(P<0.05);表3同。 如表3所示,模拟肠消化2 h后,EGC、C、EC、ECG含量从21.83±1.88、18.25±0.09、83.67±7.50、16.76±0.42 µg/mL降低至10.51±2.18、6.24±0.46、14.20±1.33、3.92±1.33 µg/mL,均显著下降(P<0.05),分别下降了64.40%、74.58%、86.95%、48.21%;肠空白对照组的EGC、C、EC、ECG含量同样显著降低(P<0.05),分别下降了51.86%、65.81%、83.03%、76.61%。结果表明,儿茶素类物质的降解大多发生在肠消化阶段,其在模拟肠液中的不稳定性主要是酸碱环境变化引起的,与消化酶作用无关。Tenore等[27]研究表明,儿茶素经过胃、肠消化含量有所降低,这是由于儿茶素对胃肠道的pH敏感引起的,添加消化酶并不能显著影响儿茶素含量。小肠环境中pH、残留溶解氧和来自正常消化功能的活性氧都可能促进肠道内儿茶素的环聚和自氧化等反应,如EGC的B环上相邻的3’,4’和5’羟基具有不稳定性,易导致B环去质子化以及半醌自由基的形成,而中性条件附近会进一步使得稳定的儿茶素半醌中间体发生自氧化反应,生成二聚体等最终产物。此外,B环结构的差异也决定了不同儿茶素类物质的稳定性[28-29]。
表 3 古茶树茶叶酵素模拟肠消化过程中儿茶素类物质含量的变化Table 3. Changes of catechins in fermented tea Jiaosu during simulated intestinal digestion儿茶素类物质(μg·mL−1) 肠空白对照组(h) 肠液消化组(h) 0 0.5 1 2 0 0.5 1 2 EGC 21.83±1.88c 14.83±0.71d 27.44±0.39b 10.51±2.18d 36.71±3.65a 32.34±4.89a 21.26±1.26c 13.07±1.38d C 18.25±0.09bc 12.63±1.58d 15.65±0.46cd 6.24±0.46e 24.27±2.28a 21.32±3.96ab 14.53±0.06d 6.17±0.75e EC 83.67±7.50b 45.91±0.59e 58.80±0.42d 14.20±1.33f 123.65±6.63a 73.40±6.02e 56.86±0.51d 16.14±0.44f EGCG ND ND ND ND ND ND ND ND ECG 16.76±0.42a 11.91±3.71bc 9.70±0.33bc 3.92±1.33e 8.11±0.18d 10.39±1.01b 8.89±0.39cd 4.20±0.21e 2.2 体外模拟消化过程中抗氧化活性的变化
2.2.1 体外模拟消化过程中DPPH自由基清除率的变化
如图5所示,胃液消化组在消化过程中DPPH自由基清除率与0 h相比无显著变化(P>0.05);胃酸对照组在消化0.5~1 h内显著下降(P<0.05)后上升至与0 h无显著差异(P>0.05);空白对照组在消化0.5 h内显著下降(P<0.05)后缓慢上升至与0 h无显著差异(P>0.05)。上述结果表明,胃消化对DPPH自由基清除能力无显著影响。
肠消化组中DPPH自由基清除率的变化趋势表现为先下降再上升,但肠液消化组和肠空白对照组之间无显著差异(P>0.05),这说明胰酶对DPPH自由基清除能力无显著影响。模拟肠道环境中,古茶树叶酵素的DPPH自由基清除能力随着总酚含量的下降而降低。
2.2.2 体外模拟消化过程中ABTS阳离子自由基清除率的变化
如图6所示,与模拟胃消化0 h相比,胃液消化组在消化过程中1 h内显著上升(P<0.05),1 h后显著下降(P<0.05),但清除率仍然高于模拟胃消化0 h;胃酸消化组在消化过程中1 h内显著上升(P<0.05),1 h后显著下降(P<0.05)至与模拟胃消化0 h相同;空白对照组整体呈现上升趋势,这表明胃蛋白酶和胃酸均会引起ABTS阳离子自由基清除率的变化。
模拟肠消化过程,与模拟肠消化0 h相比,肠液消化组在0.5 h内显著上升(P<0.05)后趋于稳定;空白对照组在0.5~1 h内显著下降(P<0.05)后趋于稳定,这表明胰蛋白酶和胆汁可以促进ABTS阳离子自由基清除能力的增强。
2.2.3 体外模拟消化过程中还原力的变化
如图7所示,与模拟胃消化0 h相比,胃液消化组在消化过程中还原力无显著变化(P>0.05);胃酸对照组还原力在1 h内有所下降,消化2 h又回升至与模拟胃消化0 h无显著差异(P>0.05);胃空白对照组在1 h内显著(P<0.05)下降后有所回升,还原力依次为模拟胃液消化组>胃酸对照组>胃空白对照组,这表明胃蛋白酶和胃酸是引起还原力的变化的主要原因。
模拟肠消化阶段,肠液消化组和空白对照组均在1 h内显著下降(P<0.05)后回升至与模拟肠消化0 h无显著差异(P>0.05)。此外,肠液消化组的还原力略高于肠空白对照组,这表明胰蛋白酶和胆汁可以在一定程度上增强还原力。
结合图1和图2可知,在胃、肠消化阶段古茶树茶叶酵素的DPPH自由基清除能力和还原力与总酚、黄酮含量的变化规律相似,进一步表明多酚类化合物是其抗氧化能力的基础。在胃肠消化过程中,抗氧化活性物质会因为pH、消化酶等环境因素发生解离、转化、降解等[23]。随着消化过程的进行,酚类等抗氧化活性物质可能降解为其他小分子酚类物质,使酚羟基数目在单位体积中有所增加[30]。酚羟基具有供氢体活性,在氧化过程中,酚羟基作为主要的还原部位可以与氧化过程中生成的多种自由基反应,分子内氢键等形式可以使其自身形成的自由基得以稳定,从而阻断自由基链的反应[11,30-31],这可能是引起体外抗氧化能力增强的原因之一。此外,抗氧化活性综合了体系中所有抗氧化物质协同或拮抗的作用,抗氧化活性的变化可能是由于胃肠环境的变化影响了抗氧化物质的相互作用引起的[32]。
3. 结论
本文通过体外模拟胃、肠消化法,评价了古茶树叶酵素在模拟胃肠消化过程中进一步探究了主要酚类物质的释放规律和体外抗氧化活性的变化。结果表明:不同酚类化合物在模拟胃肠消化过程中稳定性不同。体外模拟胃消化能够促进总酚、黄酮和原花青素的释放;体外模拟肠消化后,总酚含量、黄酮含量和原花青素含量总体水平有所下降,这与C、EGC、ECG、EC含量在模拟肠液消化后显著降低(P<0.05)一致;古茶树叶酵素经过体外模拟胃肠消化后,其DPPH自由基清除能力无显著变化,ABTS自由基清除能力、还原力有所增强。体外消化过程中酚类物质变化原因有待进一步实验验证。
-
表 1 儿茶素类物质的标准曲线回归方程
Table 1 Linear regresslon equations for five catechins standards
儿茶素类物质 回归方程 R2 C y=61421x−2721 0.9999 EC y=35414x−21146 0.9999 EGC y=32652x−685.2 0.9999 EGCG y=117837x−1198176.4 0.9978 ECG y=16677x−8106 0.9999 表 2 古茶树茶叶酵素模拟胃消化过程中儿茶素类物质含量的变化
Table 2 Changes of catechins in fermented tea Jiaosu during simulated gastric digestion
儿茶素类物质(μg·mL−1) 胃空白对照组(h) 胃酸对照组(h) 胃液消化组(h) 0 0.5 1 2 0 0.5 1 2 0 0.5 1 2 EGC 76.53±4.00abcd 78.41±3.69abcd 73.39±0.78d 77.71±6.76abcd 81.76±0.30a 79.65±2.36ab 78.79±1.46abc 78.94±0.89abc 75.57±1.29bcd 76.73±2.35abcd 73.90±0.81cd 77.18±1.04abcd C 42.90±1.72bcd 44.28±2.33abcd 41.82±0.08d 44.48±3.75abcd 47.65±2.48a 46.38±2.48ab 47.27±0.85a 43.58±1.87cd 45.64±1.02abc 46.13±1.53ab 44.45±0.58abcd 46.31±0.74ab EC 439.15±4.49bc 446.33±5.20a 435.08±0.96c 442.19±10.27ab 445.67±1.31a 442.90±0.10ab 434.30±1.05c 441.82±1.68ab 414.34±1.40e 420.15±2.14d 409.59±0.63e 425.45±0.85d EGCG ND ND ND ND 0.53 ND ND ND ND ND ND ND ECG 16.63±0.35c 18.40±0.53abc 18.09±2.41bc 19.32±0.56abc 22.41±3.43a 21.61±0.89ab 21.82±0.21ab 20.45±0.61abc 21.85±2.05ab 18.32±3.70bc 19.32±0.30abc 19.97±0.62abc 注:同行小写英文字母不同表示差异显著(P<0.05);表3同。 表 3 古茶树茶叶酵素模拟肠消化过程中儿茶素类物质含量的变化
Table 3 Changes of catechins in fermented tea Jiaosu during simulated intestinal digestion
儿茶素类物质(μg·mL−1) 肠空白对照组(h) 肠液消化组(h) 0 0.5 1 2 0 0.5 1 2 EGC 21.83±1.88c 14.83±0.71d 27.44±0.39b 10.51±2.18d 36.71±3.65a 32.34±4.89a 21.26±1.26c 13.07±1.38d C 18.25±0.09bc 12.63±1.58d 15.65±0.46cd 6.24±0.46e 24.27±2.28a 21.32±3.96ab 14.53±0.06d 6.17±0.75e EC 83.67±7.50b 45.91±0.59e 58.80±0.42d 14.20±1.33f 123.65±6.63a 73.40±6.02e 56.86±0.51d 16.14±0.44f EGCG ND ND ND ND ND ND ND ND ECG 16.76±0.42a 11.91±3.71bc 9.70±0.33bc 3.92±1.33e 8.11±0.18d 10.39±1.01b 8.89±0.39cd 4.20±0.21e -
[1] 刘加友, 王振斌. 微生物酵素食品研究进展[J]. 食品与发酵工业,2017,42(1):273−276. [Liu Jiayou, Wang Zhenbin. Research progress on microbial ferment food[J]. Food and Fermentation Industries,2017,42(1):273−276. [2] 毛建卫, 吴元锋, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯,2010,39(3):42−44. [Mao Jianwei, Wu Yuanfeng, Fang Sheng. Research progress on microbial ferment[J]. Bulletin of Fermentation Science and Technology,2010,39(3):42−44. doi: 10.3969/j.issn.1674-2214.2010.03.018 [3] 范昊安, 沙如意, 方晟, 等. 苹果梨酵素发酵过程中的褐变与抗氧化活性[J]. 食品科学,2020,41(14):116−123. [Fan Haoan, Sha Ruyi, Fang Sheng, et al. Browning and antioxidant activity of apple-pear jiaosu during fermentation[J]. Food Science,2020,41(14):116−123. doi: 10.7506/spkx1002-6630-20190515-151 [4] 赵芳芳, 莫雅雯, 蒋增良, 等. 功能性微生物酵素产品的研究进展[J]. 食品与发酵工业,2017,42(7):283−287. [Zhao Fangfang, Mo Yawen, Jiang Zengliang, et al. Research progress of functional microbial enzyme products[J]. Food and Fermentation Industries,2017,42(7):283−287. [5] 李艳春, 陈志鹏, 林伟伟, 等. 茶树连作障碍形成机制及调控措施研究进展[J]. 生态科学,2019,38(5):225−232. [Li Yanchun, Chen Zhipeng, Lin Weiwei, et al. Research progress on the formation mechanism and regulation measures of continuous cropping obstacle of tea plant[J]. Ecological Science,2019,38(5):225−232. [6] Wu T, Guo Y, Liu R, et al. Black tea polyphenols and polysaccharides improve body composition, increase fecal fatty acid, and regulate fat metabolism in high-fat diet-induced obese rats[J]. Food & Function,2016:2469.
[7] 周金伟, 陈雪, 易有金, 等. 不同类型茶叶体外抗氧化能力的比较分析[J]. 中国食品学报,2014,14(8):262−269. [Zhou Jinwei, Chen Xue, Yi Youjin, et al. Comparative analysis on antioxidant capacities of different types of fermented teas in vitro[J]. Journal of Chinese Institute of Food Science and Technology,2014,14(8):262−269. [8] 徐歆. 紫娟茶原花青素分离提纯、组分鉴定及肠胃稳定性研究[D]. 武汉: 湖北工业大学, 2019. Xu X. Study on separation, purification, component identification and gastrointestinal stability of proanthocyanidins from Zijuan tea[D]. Wuhan: Hubei University of Technology, 2019.
[9] 金亮, 李小白, 丁华侨, 等. 不同种类茶叶抗氧化活性及茶汤颜色参数比较[J]. 中国食品学报,2016,16(2):242−250. [Jin Liang, Li Xiaobai, Ding Huaqiao, et al. Comparison on antioxidant activity and color parameters for different types of tea[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(2):242−250. [10] 刘静敏, 史静兰, 鲁江, 等. 体外模拟胃肠消化过程中四种茶叶活性成分及抗氧化性变化规律[J]. 食品工业科技,2020,41(1):301−306. [Liu Jingmin, Shi Jinglan, Lu Jiang, et al. Changes of active constituents and antioxidant properties of four kinds of tea during gastrointestinal digestion in vitro[J]. Science and Technology of Food Industry,2020,41(1):301−306. [11] 薛宏坤, 谭佳琪, 王瑜, 等. 体外消化对蓝莓提取物抗氧化、抗癌及组分的影响[J]. 精细化工,2019,36(3):461−468. [Xue Hongkun, Tan Jiaqi, Wang Yu, et al. Effects of in vitro digestion on antioxidant activity, anti-cancer activity and composition of blueberry extracts[J]. Fine Chemicals,2019,36(3):461−468. [12] 陈希苗, 李美英, 许秋莉, 等. 体外模拟胃肠消化中山楂多酚及抗氧化活性的变化[J]. 食品科学,2019,40(5):31−37. [Chen Ximiao, Li Meiying, Xu Qiuli, et al. Changes in polyphenol contents and antioxidant activity in hawthorn (Crataegus pinnatifida Bunge) during simulated gastrointestinal digestion[J]. Food Science,2019,40(5):31−37. doi: 10.7506/spkx1002-6630-20170930-447 [13] 从彦丽, 彭梦雪, 刘冬, 等. 柑橘在体外模拟胃肠消化过程中总多酚、总黄酮及总抗氧化活性的变化规律[J]. 食品科学,2016,37(17):96−103. [Cong Yanli, Peng Mengxue, Liu Dong, et al. Changes in total polyphenols, total flavonoids and antioxidant activity of citrus during in vitro gastrointestinal digestion process[J]. Food Science,2016,37(17):96−103. doi: 10.7506/spkx1002-6630-201617016 [14] Tagliazucchi D, Verzelloni E, Bertolini D, et al. In vitro bio-accessibility and antioxidant activity of grape polyphenols[J]. Food Chemistry,2010,120(2):599−606. doi: 10.1016/j.foodchem.2009.10.030
[15] 王谢祎, 翟宇鑫, 李倩, 等. 南酸枣在模拟消化过程中抗氧化活性及多酚含量分析[J]. 食品科学,2016,37(11):7−11. [Wang Xieyi, Zhai Yuxin, Li Qian, et al. Changes in antioxidant activity and phenol content in Choerospondias axillaris fruits during simulated gastrointestinal digestion[J]. Food science,2016,37(11):7−11. doi: 10.7506/spkx1002-6630-201611002 [16] 徐洪宇, 蒯宜蕴, 詹壮壮, 等. 果皮中酚类物质含量、抗氧化活性及在体外消化过程中成分的变化[J]. 食品科学,2019,40(15):23−30. [Xu Hongyu, Kuai Yiyun, Zhan Zhuangzhuang, et al. Phenolic contents and antioxidant activity of fruit peels and changes in phenolic composition during in vitro simulated digestion[J]. Food Science,2019,40(15):23−30. doi: 10.7506/spkx1002-6630-20180806-046 [17] 黎海彬. 山楂中有效成分含量测定的研究[J]. 食品科学,2008,29(8):475−477. [LI Haibin. Study on determination of effective Ingredients in crataegus pinatigide bge[J]. Food Science,2008,29(8):475−477. doi: 10.3321/j.issn:1002-6630.2008.08.110 [18] 赵平, 刘俊英, 张月萍. 香草醛法测定原花青素物质的量浓度[J]. 中国食品添加剂,2011(3):219−224. [Zhao Ping, Liu Junying, Zhang Yueping. Determination of proanthocyanidins molar concentration using vanillin[J]. China Food Additives,2011(3):219−224. doi: 10.3969/j.issn.1006-2513.2011.03.038 [19] 梁冬松, 王芳, 韦炎冶, 等. 高效液相色谱法同时测定发酵前后白参菌茶中六种活性成分[J]. 食品与发酵工业,2020,46(8):234−238. [Liang Dongsong, Wang Fang, Wei Yanye, et al. Simultaneous determination of changes in six active ingredients in Schizophyllum communeh fermented tea by HPLC[J]. Food and Fermentation Industries,2020,46(8):234−238. [20] Pinteus S, Silva J, Alves C, et al. Cytoprotective effect of seaweeds with high antioxidant activity from the peniche coast (Portugal)[J]. Food Chemistry,2017,218:591−599. doi: 10.1016/j.foodchem.2016.09.067
[21] Arnao M B, Cano A, Acosta M. The hydrophilic and lipophilic contribution to total antioxidant activity[J]. Food Chemistry,2001,73(2):239−244. doi: 10.1016/S0308-8146(00)00324-1
[22] Tohidi B, Rahimmalek M, Arzani A. Essential oil composition, total phenolic, flavonoid contents, and antioxidant activity of thymus species collected from different regions of Iran[J]. Food Chemistry,2017,220:153−161. doi: 10.1016/j.foodchem.2016.09.203
[23] 李茹, 朱毅. 体外模拟胃、肠消化对萝卜苗中活性物质、抗氧化功能及代谢差异物的影响[J]. 中国食品学报,2019,19(4):61−71. [Li Ru, Zhu Yi. Effect of simulated gastrointestinal digestion in vitro on active substances, antioxidant function and differential metabolites of radish sprouts[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(4):61−71. [24] 李俶, 王谢祎, 翟宇鑫, 等. 多酚化合物体外模拟消化的稳定性分析[J]. 食品科学,2016,37(13):1−5. [Li Shu, Wang Xieyi, Zhai Yuxin, et al. Stability of polyphenols during in vitro digestion[J]. Food Science,2016,37(13):1−5. doi: 10.7506/spkx1002-6630-201613001 [25] 谭和平, 邹燕, 叶善蓉, 等. 茶叶中的多酚类物质及其分析方法综述[J]. 中国测试技术,2008(4):4−11. [Tan Heping, Zou Yan, Ye Shanrong, et al. Review of tea polyphenols analyses for tea[J]. China Measurement & Testing Technology,2008(4):4−11. [26] Record I R, Lane J M. Simulated intestinal digestion of green and black teas[J]. Food Chemistry,2001,73(4):481−486. doi: 10.1016/S0308-8146(01)00131-5
[27] Tenore G C, Campiglia P, Giannetti D, et al. Simulated gastrointestinal digestion, intestinal permeation and plasma protein interaction of white, green, and black tea polyphenols[J]. Food Chemistry,2015,169(feb. 15):320−326.
[28] Green R J, Murphy A S, Schulz B, et al. Common tea formulations modulatein vitro digestive recovery of green tea catechins[J]. Molecular Nutrition & Food Research,2007,51(9):1152−1162. doi: 10.1002/mnfr.200700086
[29] Mochizuki M, Yamazaki S I, Kano K, et al. Kinetic analysis and mechanistic aspects of autoxidation of catechins[J]. Biochim Biophys Acta,2002,1569(1-3):35−44. doi: 10.1016/S0304-4165(01)00230-6
[30] 葛艳琳. 山葡萄皮花青素超声波辅助提取及抗氧化活性研究[J]. 食品研究与开发,2018,39(10):48−55. [Ge Yanlin. Ultrasonic assisted extraction technology and its antioxidant activity of Vitis amurensis Rupr skin anthocyanin[J]. Food Research and Development,2018,39(10):48−55. doi: 10.3969/j.issn.1005-6521.2018.10.010 [31] 万红霞, 孙海燕, 熊云霞, 等. 体外模拟胃肠消化过程中苹果和梨的抗氧化活性变化[J]. 广州城市职业学院学报,2019,13(3):68−73. [Wan Hongxia, Sun Haiyan, Xiong Yunxia, et al. Changes in antioxidant activity of apples and pears during in vitro simulated digestion process[J]. Journal of Guangzhou City Polytechnic,2019,13(3):68−73. doi: 10.3969/j.issn.1674-0408.2019.03.013 [32] 王振帅, 陈善敏, 信思悦, 等. 朝鲜蓟花苞汁总酚、总黄酮、抗氧化性比较及体外模拟胃肠消化特性[J]. 食品科学,2019,40(19):136−142. [Wang Zhenshuai, Chen Shanmin, Xin Siyue, et al. Total phenols and flavonoids and antioxidant activity of artichoke (Cynara scolymus L.) bud juices before and after gastrointestinal digestion in vitro[J]. Food Science,2019,40(19):136−142. doi: 10.7506/spkx1002-6630-20181015-147





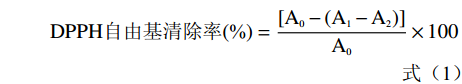
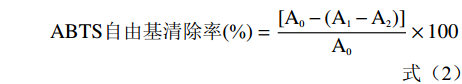

 下载:
下载:






 下载:
下载:
