Research Progress of Soybean Protein Hydrogels
-
摘要: 大豆蛋白是一种优质的植物蛋白资源,具有良好的凝胶性、生物相容性和安全性,是制备蛋白基水凝胶材料的主要来源之一。本文概述了基于大豆蛋白的水凝胶最新研究进展;简单介绍了大豆蛋白及其结构后,讨论了当前大豆蛋白水凝胶主要的制备方法以及凝胶机制;总结了大豆蛋白水凝胶在食品领域的应用情况,并提出大豆蛋白水凝胶如今存在的问题及今后的研究方向,为制备具有更高性能的大豆蛋白基水凝胶及推动其在食品领域中的广泛应用提供理论依据。Abstract: Soybean protein is a kind of high quality plant protein resource which has great gelatability, biocompatibility and safety. It is also one of the main sources for preparing protein-based hydrogel materials. The latest research progress of hydrogels based on soybean protein is summarized in this paper. After a brief introduction of soybean protein and its structure, the main preparation methods and gel mechanism of soybean protein hydrogels are discussed. The application of soybean protein hydrogels in food industry is summarized, the existing problems and future research directions of soybean protein hydrogels are put forward to provide theoretical basis for preparing higher performance soybean protein hydrogels and promoting its wide application in the food field.
-
Keywords:
- soy protein /
- hydrogel /
- preparation method /
- gel mechanism /
- application
-
水凝胶由亲水性聚合物链的三维网络组成,其中水是分散相并且至少占凝胶重量的70%[1]。水凝胶的形态介于固体和液体之间,并具有固态和液态的双重性质[2],其本身不溶于水,但由于存在亲水性部分,因而具有吸收大量水的能力,它能在水中明显吸水溶胀,并且具有很强的保持水分的能力[3]。此外,它还具有其他特性,如柔韧性、刺激响应性及与活组织的相似性,物理化学特性十分接近生物体内的软组织[4]。水凝胶是通过合成、天然或杂化聚合物的物理或化学交联形成的[5]。合成聚合物水凝胶虽然具有优异的机械性能,但其生物相容性和可调性较差,且存在一定的细胞毒性和食品不安全性。因此,目前的相关研究正在向天然聚合物材料水凝胶转变[3,5-6]。
天然聚合物材料水凝胶通常来自多糖或蛋白质。在水凝胶开发过程中,蛋白质比多糖具有固有优势,蛋白质包含多种不同的氨基酸,其含有的众多反应基团可用作化学修饰和交联以形成聚合物结构的位点[7],在已报道的各种水凝胶中,蛋白质基水凝胶也由于其优异的特性,如高营养价值、生物相容性、生物降解性、可调机械特性以及与合成聚合物相比的低毒性等而被科研人员广泛开发和研究[8]。目前,常见的蛋白水凝胶原料包括胶原、丝素蛋白、明胶等,但这些蛋白大多属于动物蛋白,应用成本较高,且由于其复杂的结构和微妙的性质,它们的精细结构改变也常常受到限制[9]。此外,与动物源性蛋白质相比,植物源性蛋白质(如大豆蛋白)可能更加安全,因为其传播人畜共患病的可能性较小[10]。
大豆蛋白作为植物蛋白中来源最为丰富的蛋白之一,其具有营养价值高、环境友好以及来源广泛等特点,在食品工业中已得到广泛应用。大豆蛋白中含有极性官能团的氨基酸,例如羧基、氨基和羟基等,它们能够进行化学反应并使大豆蛋白易于修饰[11]。迄今为止,国内外对大豆蛋白基水凝胶的研究已取得一定成果,并已在食品领域得到了一定的应用。因此,本文主要针对大豆蛋白基水凝胶的制备方法、凝胶机理及应用研究进展进行综述,以期为大豆蛋白基水凝胶的制备及其在食品行业的发展提供一定的参考。
1. 大豆蛋白的组成及结构
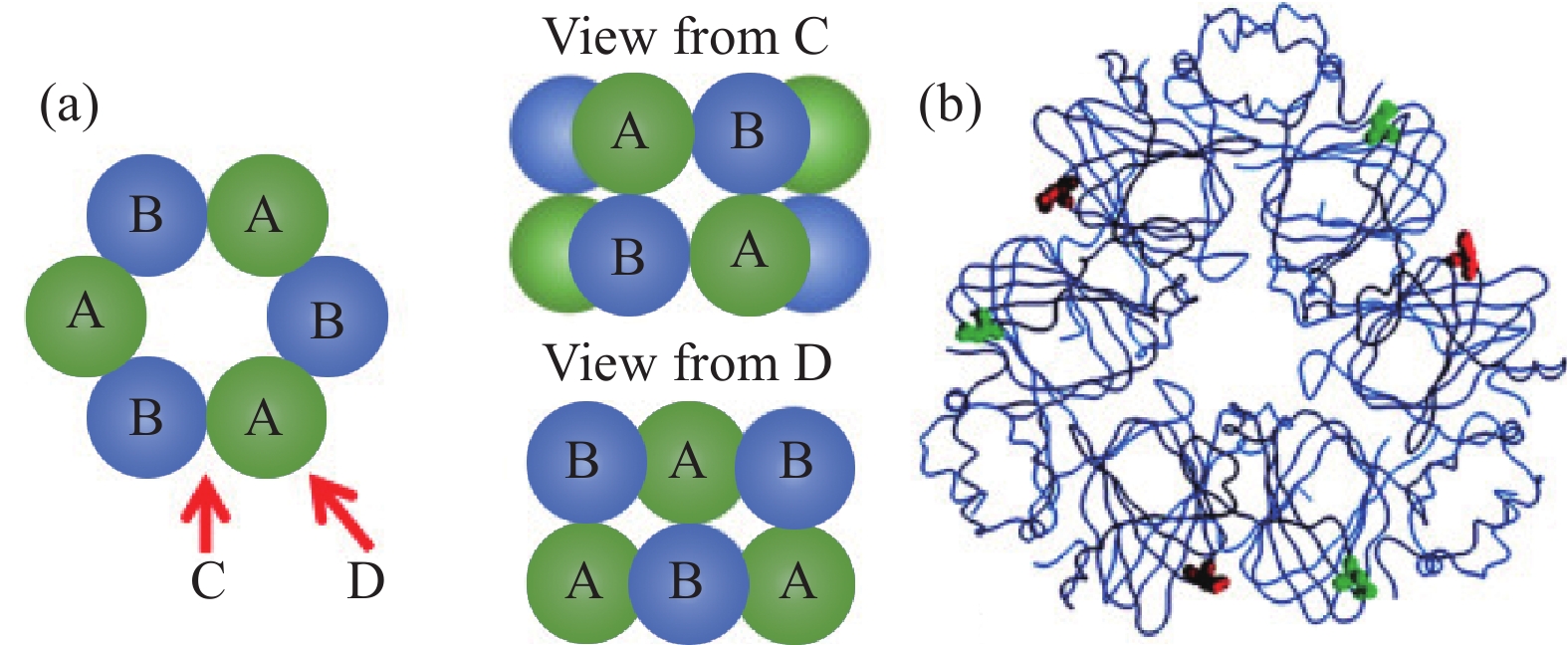
大豆是众所周知的食物来源,约含有40%的蛋白质。通过在较低温度下除油可获得大豆分离蛋白(soy protein isolate,SPI),大豆水提蛋白经酸化至pH4.5~4.8,可分为贮藏球蛋白和乳清组分[12],大豆贮藏蛋白主要由白蛋白和球蛋白组成,后者占种子蛋白总量的50%~90%[13]。根据它们的沉降系数,大豆蛋白可分为2S、7S、11S甚至15S组分。大豆蛋白中的白蛋白主要以2S形式存在,而7S,11S或15S组分通常对应于球蛋白。大豆球蛋白(SG)和-伴大豆球蛋白(SC)是两个主要的球蛋白,有文献中分别称为11S和7S[12-13]。
11S形式的天然SG是一种分子量为300~380 kDa的六聚体,通常由六个亚基组成。每个亚基由酸性多肽(A)和碱性多肽(B)组成,通过二硫键连接在一起。单个六边形的A或B多肽被认为通过静电和氢键结合在一起(图1),11S球蛋白的整个结构主要是通过疏水相互作用保持[13]。SG的四级结构易受到环境条件(如pH和离子强度)以及加工和存储应力(如冷冻、干燥和加热)变化的影响,SG由于其较高的巯基和二硫键含量而易于聚集[14]。SC是一种三聚体糖蛋白,由三个主要亚基(α',α和β)组成,占种子蛋白质总量的30%~50%[13]。这种7S球蛋白通常缺乏残基,因此,没有二硫键,蛋白结构主要通过亚基间疏水相互作用来维持,易受pH和离子强度变化的影响。与天然SG相似,SC还具有低水平的α-螺旋和非常高的二级结构[13],而天然SC比天然SG更容易变性[15]。
SPI是重要的大豆蛋白产品之一,通常含有85%~90%的蛋白质(以干基计)。SPI具有优异的乳化性、凝胶性、发泡性和成膜性能,这使其成为一种极具吸引力的食品原料。然而由于生产的复杂性,SPI的结构和功能特性随原材料、加工变量及生产商的不同而有很大差异[16]。SPI在食品加工过程中的功能特性受到可用加工方法的限制,其中,pH对大豆蛋白结构的影响较为显著,pH相关的结构修饰通常发生在第四级和第三级[14]。商业SPI中的大多数蛋白质都被部分或完全变性,并以聚集甚至不溶的状态存在[17],pH或温度的极值都会降低其溶解度,SG变性后,其溶解性就会丧失,故商用SPI通常在水中较难溶解[15]。
2. 大豆蛋白水凝胶的制备方法
基于大豆蛋白水凝胶常用的制备方法来分类,主要可以分为物理交联、化学交联以及酶促交联三类。
2.1 物理交联制备大豆蛋白水凝胶
物理交联是一种比较温和的交联方法,主要是通过冷冻、加热、高压和冻融等方法来制备水凝胶,使得聚合物中的分子链通过物理作用力如电荷作用、氢键、范德华力等弱力交联构成三维网络结构[18]。
2.1.1 大豆蛋白的热致凝胶
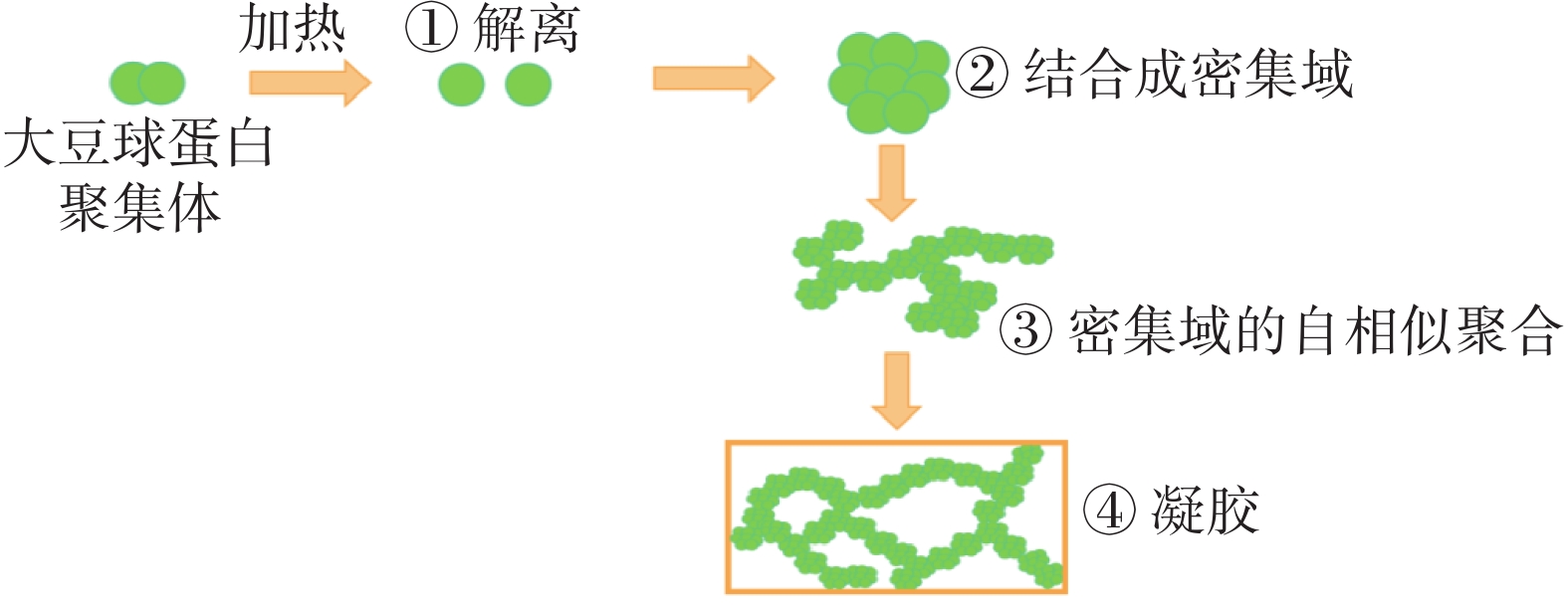
在大豆蛋白基水凝胶中,研究最多且最深入的一类是热凝胶[19],通常球状蛋白凝胶的制备由三个不同的步骤组成:变性、聚集和凝胶,而在典型的热凝胶中,这些过程在热处理中同时发生[20]。大豆蛋白的热变性被认为是形成凝胶的先决条件,其在高于65 ℃的温度下加热可形成三维网络结构[19,21]。大豆分离蛋白受热的凝胶化过程如图2所示,可以分为四个步骤:第一步中,天然球蛋白的小聚集体在加热过程中离解;第二步中,蛋白质再次结合成密集的近似球形颗粒,半径在30~50 nm之间;第三步中,这些颗粒随机粘在一起形成自相似聚集体,这些聚集体中蛋白质之间的键足够强,可以抵抗冷却和稀释;第四步中,聚集体渗透并形成一个系统跨越网络[22]。
大豆蛋白的热诱导胶凝行为可以通过改变加热温度、加热时间、离子强度、pH和蛋白质组合物等热处理条件来改变[21,23-25]。加热会导致蛋白质分子变性和展开,活性位点暴露,从而触发蛋白质之间通过共价键(二硫键)和非共价键(例如疏水性相互作用,静电相互作用和氢键)之间的相互作用形成大分子的聚集体,当大豆蛋白浓度足够高时,可以形成具有三维网络的凝胶[26]。CHIEN等[27]仅在热处理的情况下,制备了不同重量百分比(15、18和20 wt.%)的坚固的大豆蛋白水凝胶,该水凝胶系统能够通过改变大豆蛋白的浓度来控制水凝胶的性能。蛋白质浓度的增加使水凝胶的结构变得更光滑、更具粘性和更少的颗粒状。此外,在菊粉水凝胶中添加大豆蛋白(1、 3、6 g/100 g)可以得到结构更为致密和均匀的凝胶网络,获得更高的屈服应力、质地(硬度、粘附性)和铺展性参数[28]。KANGII等[29]发现在较高的加热温度和蛋白质浓度下形成了牢固坚韧且不易破碎的大豆蛋白凝胶,凝胶的弹性在所有蛋白质浓度下均相似,但在较高温度下加热时较低。因此,为了形成硬质凝胶,必须加热至93 ℃以上。CAMPBELL等[30]通过酸化和热处理共同作用制备了高强度大豆蛋白水凝胶,发现相比未加热酸诱导的大豆蛋白凝胶,加热后的凝胶强度显著增加,这是由于热处理导致蛋白的溶解性降低并产生了大量的二硫键,并在分子间β折叠结构的参与下,未折叠的蛋白质部分聚集形成热凝胶。
2.1.2 大豆蛋白的冷致凝胶
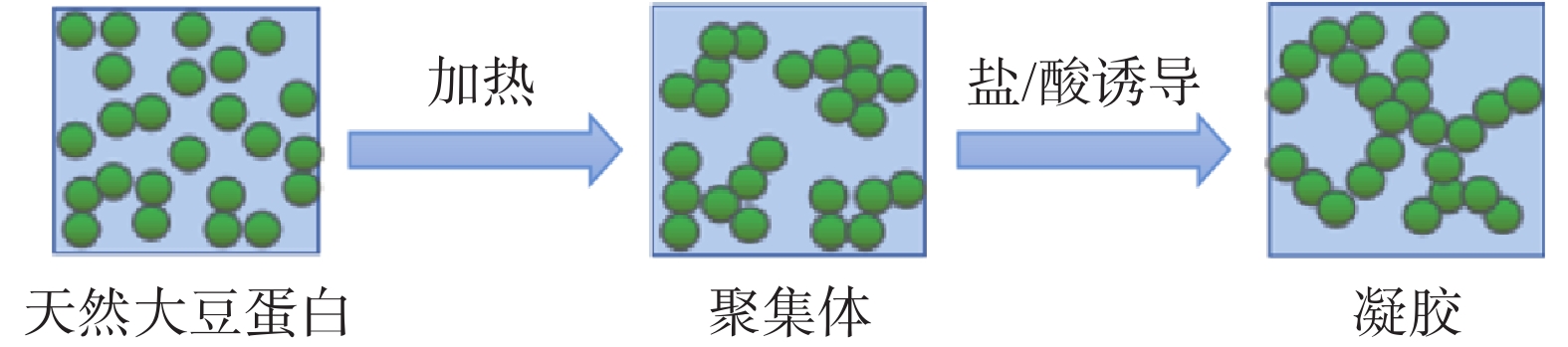
相比于大豆蛋白热凝胶,冷凝胶的制备条件相对温和,弥补了大豆蛋白热凝胶方法由于高温处理而导致其在热敏性相关应用中存在的不足[19]。大豆蛋白冷凝胶的制备过程较为复杂,首先,必须要将蛋白溶液加热至变性温度之上,以使蛋白分子暴露出可反应的官能团,并且为了避免大豆蛋白形成热凝胶,需要将体系的蛋白浓度控制在临界凝胶浓度以下;同时,体系中的离子强度也必须足够低,否则蛋白分子可能会发生聚集;第二步是在冷却之后加入钙盐,以减少静电排斥作用,并使得蛋白聚集物间形成盐桥,促进了体系的凝胶化[31-32](如图3所示)。大豆蛋白冷凝胶的凝胶强度与所使用的凝固剂有关,不同种类和浓度的凝固剂诱导的大豆蛋白冷凝胶的凝胶强度不同。倪俊杰等[33]发现大豆蛋白冷凝胶的凝胶强度随凝固剂质量分数增加而增加,在1%~4%的质量分数范围内,酸诱导冷凝胶的凝胶强度高于盐诱导冷凝胶,并且相较于盐诱导来说,通过酸诱导的大豆蛋白冷凝胶热稳定性也更高。
2.1.3 其他物理方法
此外,经高压、超声等物理方法处理也会对大豆蛋白水凝胶产生影响,经这些方法处理后的大豆蛋白水凝胶的凝胶能力得到了一定程度的改善。高压处理可通过疏水键和静电键的断裂来影响蛋白质的构象,从而导致蛋白质变性、聚集、凝胶化。MOLINA等[35]在研究高压对大豆分离蛋白及其组成成分(包括7S和11S球蛋白)的影响时,发现在20%的蛋白溶液上施加300~700 MPa的压力可形成大豆蛋白凝胶。通过超高压处理后获得的大豆分离蛋白凝胶的凝胶强度随着大豆分离蛋白质量分数、温度和处理压力的增加而增加,并且超高压处理后凝胶外观会更加的平滑和细致[36]。目前,超声作为一种极具潜力的绿色加工技术也越来越受到人们的关注。超声处理产生的空化和高剪切能量波会导致蛋白质分子的去折叠和部分变性,使得表面活性位点暴露,从而增强了大豆蛋白随后的热诱导聚集和凝胶行为[37]。朱建华等[38]发现经超声处理的大豆蛋白凝胶的凝胶强度值比未超声处理高,且随处理时间的增加而进一步增强,这是由超声处理后蛋白质体系的均匀分散和大豆蛋白质亚基的扩展而形成了致密的凝胶网络所致。而WANG等[26]在不同蛋白浓度(1%,2%和4% w/v)下通过超声预处理的样品在加热后同样显示出了比未超声处理的大豆蛋白对照样品更高的凝胶能力。
2.2 化学交联制备大豆蛋白水凝胶
化学交联是将交联剂添加到聚合物溶液中以共价键形式交联分子链以形成网络结构的过程。 蛋白质的化学交联所使用的交联剂一般是包含双官能团的化学试剂,可以与大豆蛋白的分子链上的羟基、羧基、氨基等官能团发生席夫碱、加成、缩合等反应[39],利用这些特性,使得具有不同结构与性能的大豆蛋白水凝胶被设计与合成。目前用于蛋白质的典型化学交联剂包括戊二醛、聚乙二醇、京尼平等。
2.2.1 美拉德型交联剂
含有醛基的化学交联剂如戊二醛,甲醛和乙二醛等已被广泛用于交联蛋白质[40-41],这类反应被称为“美拉德型”交联[42-43],因为在两个单独的蛋白质分子上的两个赖氨酸残基与交联剂上的醛基之间形成了共价酰胺键[44]。CAILLARD等[45]将甘油醛与戊二醛进行了比较,发现甘油醛虽然较戊二醛更为安全,但甘油醛对蛋白交联的影响程度较弱,而大豆蛋白水凝胶的凝胶性能主要取决于交联剂的浓度和交联程度,相比于甘油醛,戊二醛能更好地改善水凝胶的流变性能和溶胀性。
2.2.2 京尼平
京尼平(Genipin,GP)是一种从栀子果实栀子中提取的天然交联剂,具有1/10000的细胞毒性和良好的生物相容性,被认为是戊二醛的潜在替代品[46]。该分子具有独特的结构,能迅速与伯氨基反应,形成分子间和分子内共价键,形成蓝色水凝胶[47]。SONG等[48]使用京尼平作为交联剂研究了对大豆分离蛋白凝胶的影响,发现随着京尼平含量的增加,初始凝胶时间缩短,凝胶的稳定性得到改善。此外,发现适当提高反应温度有利于大豆分离蛋白在京尼平的存在下凝胶化。金蓓等[49]利用京尼平作为交联剂交联大豆蛋白和壳聚糖制备复合水凝胶作为茶碱控释载体,结果发现京尼平的添加量不仅可以增强复合水凝胶的网络结构稳定性,而且随着含量的增加,复合水凝胶在模拟肠胃液中的溶胀度和控释速率随之降低。
2.2.3 乙二胺四乙酸二酐
氨基酸残基与酸酐的酰化是蛋白质最常见的化学修饰之一,使用乙二胺四乙酸二酐(EDTAD)对赖氨酰残基进行改性能够将大量羧酸盐阴离子(COO-)并入大豆蛋白质分子中,产生许多水结合位点,从而增加其亲水性[50]。CUADRI等[7]研究了使用EDTAD将大豆蛋白功能化获得水凝胶的可行性,发现EDTAD修饰后大豆蛋白的亲水性特征显著增加,随着功能化程度的提高,水的吸收量增加更大,水凝胶中含有较大的多孔区域。
2.2.4 聚乙二醇
聚乙二醇也是一种用来制备大豆蛋白水凝胶的较为常见的化学交联剂。刘杰等[51]使用Tempo-BAIB催化体系将聚乙二醇单甲醚中的羟基氧化成醛基,通过席夫碱及还原反应将聚乙二醇片段接枝到大豆分离蛋白的分子链上,大豆分离蛋白经聚乙二醇改性后可以在37 ℃自发形成凝胶,并随着聚乙二醇接枝率的增加,凝胶化时间可以小于30 min。SNYDERS等[8]发现由含水量为96%的聚乙二醇和大豆蛋白制成的杂化水凝胶的弹性模量可以随原料比例组成的改变而发生变化,因此,可通过改变其组分来调节其机械性能。
2.2.5 其他化学交联方法
迄今为止,除上述常见的交联剂外,还出现了一些新的交联剂被用于与大豆蛋白合成水凝胶。例如,卢新生等[52]提供了一种新的改性方法,即采用甲基丙烯酸单体(PMAA)接枝改性大豆分离蛋白,通过接枝聚合的方法制备了具有天然高分子和合成高分子的双重优异性能的SPI-PMAA水凝胶。此外,在碱性条件下,通过自由基聚合可以诱导蛋白质与多酚交联。GUO等[19]通过大豆分离蛋白和多酚类物质坦尼酸 (TA) 共价反应制备了SPI-TA水凝胶,结果表明在pH为11时,大豆分离蛋白和坦尼酸可形成保水性为95.5%±0.052%的水凝胶,当坦尼酸的浓度为88~117 μmol/g时凝胶硬度最佳,其具有典型的凝胶行为,这也为蛋白质与多酚共价结合制备凝胶剂提供了参考。
2.3 酶促交联制备大豆蛋白水凝胶
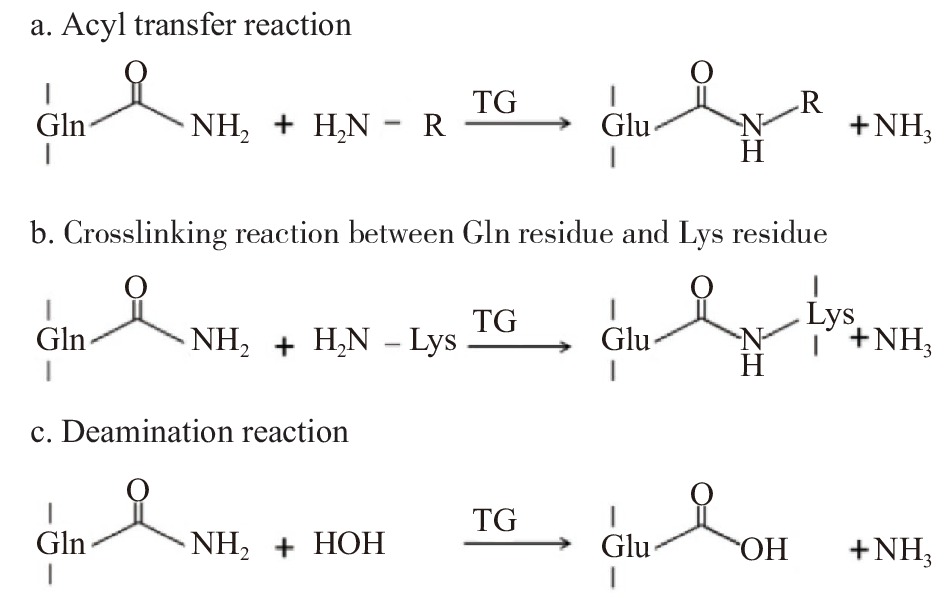
另一种用于制备大豆蛋白水凝胶的常用方法是生物酶交联,这是一种无毒、可行且有效的交联方法。转谷氨酰胺酶 (Transglutaminase,TGase) 可以催化谷氨酰胺残基(Gln)的γ-羟胺基和赖氨酸残基(Lys)的ε-氨基之间的酰基转移反应,导致分子间或分子内交联[53]。转谷氨酰胺酶共可催化三个反应:酰基转移反应、谷氨酰胺(Gln)与赖氨酸(Lys)残基的交联反应以及脱酰胺基反应(如图4所示)[54]。因此TGase被广泛用于食品加工业中以改善食品蛋白质的胶凝特性[55-56]。例如,β-伴大豆球蛋白的大部分亚基和大豆球蛋白SPI的酸性亚基可以通过TGase聚合,并且可以使用TGase作为凝结使豆浆形成冷凝胶[57-58]。SONG等[59]使用微生物转谷氨酰胺酶与大豆分离蛋白制备了具有可调凝胶时间和机械强度特性的蛋白质基水凝胶,并研究了其作为载体控制5-氨基水杨酸释放的可能性,证实了药物的控制释放行为,表明所形成的SPI水凝胶具有控制药物释放的潜在应用。为了得到性能更好的大豆蛋白水凝胶,陆续出现许多新的水凝胶制备方法,以满足不同产品的需要。GAN等[60]通过将化学交联和酶促交联共同作用,经研究发现此方法得到的凝胶比单交联所得凝胶网络结构更加致密,凝胶强度和粘弹性也明显增强。
综上所述,对物理交联、化学交联及酶促交联制备大豆蛋白水凝胶的优缺点进行了总结(如表1所示)。基于物理交联的大豆蛋白水凝胶制备方法无需加入任何交联剂和催化剂,较为安全,但该方法制备的水凝胶结构稳定性差,力学性能较差[61]。基于化学交联形成大豆蛋白水凝胶机械强度高,稳定性好,但其中大多数的交联剂都不安全且不具有成本效益[62]。而通过酶交联制备的大豆蛋白水凝胶绿色安全,结构稳定且生物相容性好,由于物理交联和化学交联方法制备的水凝胶均存在一定的不足,为了扩展大豆蛋白水凝胶的应用,目前,越来越多的研究开始尝试酶催化交联的方法来制备水凝胶。
表 1 不同水凝胶的制备方法的优缺点对比Table 1. Comparison of the advantages and disadvantages of different hydrogel preparation methods水凝胶 交联手段 优点 缺点 物理交联水凝胶 冷冻、加热或高压等作用下发生交联 无需加入任何化学催化剂、
引发剂,较为安全凝胶结构不稳定,机械性能差 化学交联水凝胶 交联剂(如戊二醛、环氧丙烷、京尼平、
聚乙二醇等)水凝胶机械性能稳定,
稳定性好化学交联剂难以去除,水凝胶生物
相容性低,弹性较低酶促交联水凝胶 辣根过氧化酶、谷氨酰胺转移酶、络氨酸酶、
赖氨酸氧化酶等反应条件温和,可原位形成
水凝胶,生物相容性好凝胶强度较差,酶价格较高 3. 大豆蛋白基互穿网络水凝胶
互穿网络水凝胶 (Interpenetrating polymer network hydrogels,IPN) 是由两种或两种以上的聚合物组成,一般通过物理或化学方法合成和相互连接[63]。其中,双网络水凝胶是互穿网络水凝胶的一种特殊形式,它由两个具有独特特性的渗透聚合物网络组成,其中刚性的网络作为第一网络,而柔性的网络作为第二个网络。互穿聚合物网络的形成可以保留每个网络结构的特性,并由于交联网络中的互锁结构而提高材料的稳定性[64],目前大豆蛋白互穿网络水凝胶的相关研究正逐渐增多,根据原料来源可将其分为大豆蛋白/天然聚合物互穿网络水凝胶和大豆蛋白/合成聚合物互穿网络水凝胶。
3.1 大豆蛋白/天然聚合物互穿网络水凝胶
天然聚合物一般具有优异的生物降解性、可再生性和良好的生物相容性,是用于制备水凝胶的首选材料。目前,已有研究将甜菜果胶、玉米纤维胶、壳聚糖等天然聚合物与大豆蛋白构建互穿网络水凝胶用以改善大豆蛋白水凝胶的功能特性。例如,有学者们以甜菜果胶和大豆蛋白为原料,通过漆酶和谷氨酰胺转氨酶两步酶诱导交联制备了甜菜果胶/大豆蛋白双网络水凝胶,提高了水凝胶的机械性能、质构特性和韧性[65-66];还有通过热处理和漆酶两步凝胶法制备了大豆蛋白/甜菜果胶双网络水凝胶,发现与单网络水凝胶相比,双网络水凝胶具有优异的力学性能、保水性和微观结构[67]。DENG等[68]以玉米纤维胶和大豆分离蛋白为原料,在漆酶诱导和热处理作用下制备了双网络水凝胶,发现该水凝胶的硬度和变形能力均优于单网络水凝胶,并且双网络水凝胶具有更密集的孔隙结构和平滑的表面。然而,由于加热过程不适合封装热敏性活性物质,因此,YAN等[69]通过漆酶和葡萄糖酸δ-内酯诱导开发一种新型玉米纤维胶和大豆分离蛋白双网络水凝胶,该双网络水凝胶具有pH响应,递送释放效率高,可作为热敏生物活性化合物的口服输送工具。
3.2 大豆蛋白/合成聚合物互穿网络水凝胶
与天然聚合物水凝胶相比,化学合成聚合物水凝胶的来源种类更加丰富,其在力学性能上也更具优势。目前,已有研究将大豆蛋白与化学合成的高分子聚合物,如聚丙烯酰胺、聚氨酯、聚丙烯酸等为原料制备互穿网络水凝胶。LIU等[70-71]制备了大豆蛋白和聚(N-异丙基丙烯酰胺)组成的热敏互穿聚合物网络水凝胶,发现水凝胶具有良好的可混溶性、高孔隙率和温敏性,并且可以通过调节大豆蛋白或交联剂的含量来控制活性物质的释放比。李榕[72]通过同步互穿网络方法制备了大豆分离蛋白/聚甲基丙烯酸-β-羟乙酯(SPI/PHEMA)水凝胶和大豆分离蛋白/聚甲基丙烯酸互穿网络(SPI/PMAA)水凝胶,发现SPI/PHEMA水凝胶具有清晰的网络结构,孔壁厚度相差甚微,网孔尺寸大小不均一,水凝胶的热稳定性随着HEMA的加入而增加;SPI/PMAA水凝胶具有多孔网状结构,热稳定性和pH敏感性,并且具有良好的缓释性能,其缓释效果较好。
综上所述,由大豆蛋白与天然聚合物制备或合成聚合物制备的互穿网络水凝胶都可以改善单一大豆蛋白基水凝胶性能较差的不足。因此,大豆蛋白互穿网络水凝胶因其具有的诸多优势,已逐步成为大豆蛋白基水凝胶研究的热点。
4. 大豆蛋白水凝胶的应用
大豆蛋白基水凝胶具有低成本、无毒性、高营养价值和较好的的生物相容性等优点,这为其在食品领域中的应用提供了更多的可能性。迄今为止,基于大豆蛋白的水凝胶在食品系统中的应用研究已取得了一定的进展,而文献表明,大豆蛋白基水凝胶具有包埋递送生物活性物质的能力,因此,目前将其应用于输送系统方面的研究相对较为深入[73-74]。
大豆蛋白基水凝胶可以运送一些风味不佳或者稳定性较弱的营养物质(如核黄素、多酚等)。其中,核黄素作为一种水溶性维生素,涉及到人体内许多代谢反应,而人体并不能合成核黄素,必须通过肠道吸收获得作为营养素[75]。因此,核黄素常被选为输送系统研究的生物活性化合物/营养化合物模型[76]。MALTAIS等[77]研究了大豆蛋白冷固水凝胶作为核黄素递送装置的应用,发现在胃蛋白酶存在下,凝胶至少可保护核黄素6 h,当pH为7.5时,凝胶网络结构消失,结果表明大豆蛋白冷固水凝胶有助于通过胃肠道输送生物活性分子并在小肠中输送。HU等[76]用高强度超声处理负载核黄素的TGase诱导的大豆蛋白水凝胶,并发现经超声处理可以提高胶凝收率和包封效率,降低胃肠道降解,因此获得了核黄素的长期释放,这些证明了大豆蛋白凝胶作为生物活性化合物/营养载体的潜力。此外,为了扩大这些输送设备的潜在用途范围,MALTAIS等[78]利用冷冻干燥的冷固型大豆蛋白凝胶制作片剂研究了核黄素的释放,在模拟胃液中用胃蛋白酶消化水凝胶和片剂6 h,核黄素的零级释放较低,片剂和水凝胶的释放分别达到23%和13%,这些低释放值归因于大豆蛋白基质对胃蛋白酶水解的抵抗行为,因为大豆蛋白中存在较少量的疏水性芳香族氨基酸,这些氨基酸是胃蛋白酶的优先裂解位点,6 h胰酶消化导致载药水凝胶和片剂的彻底降解。因此,由大豆蛋白水凝胶制成的片剂是结肠给药的理想选择。
基于大豆蛋白的水凝胶在作为益生菌的输送系统上也有了一定的研究。LEW等[79]和YEW等[80]利用酶交联大豆分离蛋白与香蕉皮、香蕉果肉、芝麻皮和可可皮等农业废弃物混合,开发益生菌保护载体,发现该水凝胶负载益生菌在胃条件下释放率低,但在肠道条件下释放率高,可用作新的益生菌载体,用于增强胃肠道的转运和储存。YAN等[81]研究大豆蛋白分离物/甜菜果胶的互穿网络冷集水凝胶输送益生菌,发现该水凝胶具有高封装效率(超过 88.9%),并保持了更好的存储稳定性,作为食品载体用于口服益生菌具有巨大潜力。
此外,DING等[82]通过将叶酸、大豆蛋白和大豆多糖自组装制备了负载叶酸大豆蛋白/大豆多糖水凝胶,研究发现蛋白和多糖可以抑制紫外线照射期间溶解氧和叶酸之间的反应,在酸性条件下,在热量、氧气和光的存在下制备和储存纳米凝胶后,纳米凝胶中的大多数叶酸分子仍保留在其自然结构中,并且可以在中性pH(即肠道中)快速释放。由于大多数的食品和饮料都是酸性的,因此大豆蛋白纳米凝胶是食品和饮料中叶酸的合适输送系统。
5. 结论与展望
大豆蛋白基水凝胶可以通过不同的制备方法以及构建互穿聚合物网络等技术来调整所需特性,包括凝胶刚度、机械强度、降解性等。然而,大豆蛋白水凝胶的发展还有很大的空间,许多问题尚未解决。如发现新的绿色安全交联方法,改善现有大豆蛋白水凝胶存在的不足;或通过一些新技术来增强蛋白质水凝胶机械性能而不损害其生物相容性等等。并且,通过不同方法获得的大豆蛋白基水凝胶在食品系统中的实际应用也还有待证实。目前,大豆蛋白基水凝胶在食品领域应用还较为单一,应加大大豆蛋白水凝胶的开发力度,拓展其在食品领域更多的应用研究,如脂肪替代品、食品包装材料等,也是当前大豆蛋白水凝胶研究的重要方向。随着对大豆蛋白基水凝胶的材料和制备方法的探索不断深入,其在食品领域的发展也将会越来越广。
-
表 1 不同水凝胶的制备方法的优缺点对比
Table 1 Comparison of the advantages and disadvantages of different hydrogel preparation methods
水凝胶 交联手段 优点 缺点 物理交联水凝胶 冷冻、加热或高压等作用下发生交联 无需加入任何化学催化剂、
引发剂,较为安全凝胶结构不稳定,机械性能差 化学交联水凝胶 交联剂(如戊二醛、环氧丙烷、京尼平、
聚乙二醇等)水凝胶机械性能稳定,
稳定性好化学交联剂难以去除,水凝胶生物
相容性低,弹性较低酶促交联水凝胶 辣根过氧化酶、谷氨酰胺转移酶、络氨酸酶、
赖氨酸氧化酶等反应条件温和,可原位形成
水凝胶,生物相容性好凝胶强度较差,酶价格较高 -
[1] TAN J, JOYNER H S. Characterizing wear behaviors of edible hydrogels by kernel-based statistical modeling[J]. Journal of Food Engineering,2020,275:109850. doi: 10.1016/j.jfoodeng.2019.109850
[2] KOPEEK J, YANG J. Hydrogels as smart biomaterials[J]. Polymer International,2007,56(9):1078−1098. doi: 10.1002/pi.2253
[3] KATYAL P, MAHMOUDINOBAR F, MONTCLARE J K. Recent trends in peptide and protein-based hydrogels[J]. Current Opinion in Structural Biology,2020,63:97−105. doi: 10.1016/j.sbi.2020.04.007
[4] BAHRAM M, MOHSENI N, MOGHTADER M. An introduction to hydrogels and some recent applications[M]//Emerging concepts in analysis and applications of hydrogels. IntechOpen, 2016.
[5] JONKER A M, LÖWIK D W P M, VAN HEST J C M. Peptide-and protein-based hydrogels[J]. Chemistry of Materials,2012,24(5):759−773. doi: 10.1021/cm202640w
[6] BRINDHA J, CHANDA K, BALAMURALI M M. Revisiting the insights and applications of protein engineered hydrogels[J]. Materials Science and Engineering: C,2019,95:312−327. doi: 10.1016/j.msec.2018.11.002
[7] CUADRI A A, BENGOECHEA C, ROMERO A, et al. A natural-based polymeric hydrogel based on functionalized soy protein[J]. European Polymer Journal,2016,85:164−174. doi: 10.1016/j.eurpolymj.2016.10.026
[8] SNYDERS R, SHINGEL K I, ZABEIDA O, et al. Mechanical and microstructural properties of hybrid poly (ethylene glycol)–soy protein hydrogels for wound dressing applications[J]. Journal of Biomedical Materials Research Part A,2007,83(1):88−97.
[9] PANAHI R, BAGHBAN-SALEHI M. Protein-based hydrogels[M]//Mondal M I H. Cellulose-based superabsorbent hydrogels. Cham: Springer International Publishing, 2018: 1−40.
[10] XU H, SHEN L, XU L, et al. Controlled delivery of hollow corn protein nanoparticles via non-toxic crosslinking: In vivo and drug loading study[J]. Biomedical Microdevices,2015,17(1):1−8. doi: 10.1007/s10544-014-9904-y
[11] TIAN H, GUO G, FU X, et al. Fabrication, properties and applications of soy-protein-based materials: A review[J]. International Journal of Biological Macromolecules,2018,120:475−490. doi: 10.1016/j.ijbiomac.2018.08.110
[12] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: A review on composition, aggregation and emulsification[J]. Food Hydrocolloids,2014,39(2):301−318.
[13] TANG C H. Nanostructured soy proteins: Fabrication and applications as delivery systems for bioactives (a review)[J]. Food Hydrocolloids,2019,91:92−116. doi: 10.1016/j.foodhyd.2019.01.012
[14] TANG C H. Emulsifying properties of soy proteins: A critical review with emphasis on the role of conformational flexibility[J]. CRC Critical Reviews in Food Technology,2017,57(12):2636−2679. doi: 10.1080/10408398.2015.1067594
[15] TANG C. Nanostructures of soy proteins for encapsulation of food bioactive ingredients[M]//Biopolymer nanostructures for food encapsulation purposes. Academic Press, 2019: 247−285.
[16] MOURE A, SINEIRO J, DOMÍNGUEZ H, et al. Functionality of oilseed protein products: A review[J]. Food Research International,2006,39(9):945−963. doi: 10.1016/j.foodres.2006.07.002
[17] LEE K H, RYU H S, RHEE K C. Protein solubility characteristics of commercial soy protein products[J]. Journal of the American Oil Chemists' Society,2003,80(1):85−90. doi: 10.1007/s11746-003-0656-6
[18] 赵群. 丝素蛋白水凝胶的研究进展[J]. 轻工科技,2016,32(8):29−32. [ZHAO Q. Research progress of silk fibroin hydrogel[J]. Light Industry Science and Technology,2016,32(8):29−32. [19] GUO Y, BAO Y, SUN K, et al. Effects of covalent interactions and gel characteristics on soy protein-tannic acid conjugates prepared under alkaline conditions[J]. Food Hydrocolloids,2021,112:106293. doi: 10.1016/j.foodhyd.2020.106293
[20] VILELA J A P, CAVALLIERI Â L F, DA CUNHA R L. The influence of gelation rate on the physical properties/structure of salt-induced gels of soy protein isolate–gellan gum[J]. Food Hydrocolloids,2011,25(7):1710−1718. doi: 10.1016/j.foodhyd.2011.03.012
[21] WU C, HUA Y, CHEN Y, et al. Effect of temperature, ionic strength and 11S ratio on the rheological properties of heat-induced soy protein gels in relation to network proteins content and aggregates size[J]. Food Hydrocolloids,2017,66:389−395. doi: 10.1016/j.foodhyd.2016.12.007
[22] NICOLAI T, CHASSENIEUX C. Heat-induced gelation of plant globulins[J]. Current Opinion in Food Science,2019,27:18−22. doi: 10.1016/j.cofs.2019.04.005
[23] JIAN H, XIONG Y L, GUO F, et al. Gelation enhancement of soy protein isolate by sequential low-and ultrahigh-temperature two-stage preheating treatments[J]. International Journal of Food Science & Technology,2014,49(12):2529−2537.
[24] LU X, LU Z, YIN L, et al. Effect of preheating temperature and calcium ions on the properties of cold-set soybean protein gel[J]. Food Research International,2010,43(6):1673−1683. doi: 10.1016/j.foodres.2010.05.011
[25] LAKEMOND C M M, DE JONGH H H J, PAQUES M, et al. Gelation of soy glycinin; influence of pH and ionic strength on network structure in relation to protein conformation[J]. Food Hydrocolloids,2003,17(3):365−377. doi: 10.1016/S0268-005X(02)00100-5
[26] WANG J, NA X, NAVICHA W B, et al. Concentration-dependent improvement of gelling ability of soy proteins by preheating or ultrasound treatment[J]. LWT,2020,134:110170. doi: 10.1016/j.lwt.2020.110170
[27] CHIEN K B, CHUNG E J, SHAH R N. Investigation of soy protein hydrogels for biomedical applications: materials characterization, drug release, and biocompatibility[J]. Journal of Biomaterials Applications,2014,28(7):1085−1096. doi: 10.1177/0885328213497413
[28] FLOROWSKA A, HILAL A, FLOROWSKI T, et al. Addition of selected plant-derived proteins as modifiers of inulin hydrogels properties[J]. Foods,2020,9(7):845. doi: 10.3390/foods9070845
[29] KANGII J, MATSUMURA Y, MORI T. Characterization of texture and mechanical properties of heat-induced soy protein gels[J]. Journal of the American Oil Chemists' Society,1991,68(5):339−345. doi: 10.1007/BF02657690
[30] CAMPBELL L J, GU X, DEWAR S J, et al. Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J]. Food Hydrocolloids,2009,23(2):344−351. doi: 10.1016/j.foodhyd.2008.03.004
[31] BRYANT C M, MCCLEMENTS D J. Molecular basis of protein functionality with special consideration of cold-set gels derived from heat-denatured whey[J]. Trends in Food Science & Technology,1998,9(4):143−151.
[32] MARANGONI A G, BARBUT S, MCGAULEY S E, et al. On the structure of particulate gels—the case of salt-induced cold gelation of heat-denatured whey protein isolate[J]. Food Hydrocolloids,2000,14(1):61−74. doi: 10.1016/S0268-005X(99)00046-6
[33] 倪俊杰, 傅玉颖, 李可馨, 等. 不同凝固剂诱导大豆蛋白冷凝胶的流变特性及分形结构分析[J]. 中国食品学报,2018,18(7):295−305. [NI J J, FU Y Y, LI K X, et al. Fractal structure and rheological properties analysis of cold-set soy protein gel induced by different coagulants[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(7):295−305. [34] CHEN N, CHASSENIEUX C, NICOLAI T. Kinetics of NaCl induced gelation of soy protein aggregates: Effects of temperature, aggregate size, and protein concentration[J]. Food Hydrocolloids,2018,77:66−74. doi: 10.1016/j.foodhyd.2017.09.021
[35] MOLINA E, DEFAYE A B, LEDWARD D A. Soy protein pressure-induced gels[J]. Food Hydrocolloids,2002,16(6):625−632. doi: 10.1016/S0268-005X(02)00028-0
[36] 张宏康, 李里特, 辰巳英三. 超高压对大豆分离蛋白凝胶的影响[J]. 中国农业大学学报,2001(2):87−91. [ZHANG H K, LI L T, TATSUMI E. Studies on high pressure induced gelation of isolated soybean protein[J]. Journal of China Agricultural University,2001(2):87−91. doi: 10.3321/j.issn:1007-4333.2001.02.019 [37] HU H, WU J, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids,2013,30(2):647−655. doi: 10.1016/j.foodhyd.2012.08.001
[38] 朱建华, 杨晓泉. 超声物理改性对SPI功能特性的影响[J]. 中国油脂,2006(1):42−44. [ZHU J H, YANG X Q. Effects of ultrasonic physical modification technology on the functional properties of soybean protein isolate[J]. China Oils and Fats,2006(1):42−44. doi: 10.3321/j.issn:1003-7969.2006.01.013 [39] 沈睦贤. 聚合物水凝胶的制备及粘接性能研究[D]. 上海: 华东理工大学, 2014 SHEN M X. Synthesis and adhesion of polymeric hydrogels[D]. Shanghai: East China University of Science and Technology, 2014.
[40] GERRARD J A, BROWN P K, FAYLE S E. Maillard crosslinking of food proteins I: The reaction of glutaraldehyde, formaldehyde and glyceraldehyde with ribonuclease[J]. Food Chemistry,2002,79(3):343−349. doi: 10.1016/S0308-8146(02)00174-7
[41] GERRARD J A, MEADE S J, MILLER A G, et al. Protein cross-linking in food[J]. Annals of the New York Academy of Sciences,2010,1043:97−103.
[42] CAILLARD R, REMONDETTO G E, SUBIRADE M. Physicochemical properties and microstructure of soy protein hydrogels co-induced by Maillard type cross-linking and salts[J]. Food Research International,2009,42(1):98−106. doi: 10.1016/j.foodres.2008.10.004
[43] CAILLARD R, REMONDETTO G E, SUBIRADE M. Rheological investigation of soy protein hydrogels induced by Maillard-type reaction[J]. Food hydrocolloids,2010,24(1):81−87. doi: 10.1016/j.foodhyd.2009.08.009
[44] GERRARD J A, BROWN P K, FAYLE S E. Maillard crosslinking of food proteins II: The reactions of glutaraldehyde, formaldehyde and glyceraldehyde with wheat proteins in vitro and in situ[J]. Food Chemistry,2003,80(1):35−43. doi: 10.1016/S0308-8146(02)00232-7
[45] CAILLARD R, REMONDETTO G E, MATEESCU M A, et al. Characterization of amino cross-linked soy protein hydrogels[J]. Journal of Food Science,2008,73(5):C283−C291. doi: 10.1111/j.1750-3841.2008.00780.x
[46] LIN J, GUO X, AI C, et al. Genipin crosslinked sugar beet pectin-whey protein isolate/bovine serum albumin conjugates with enhanced emulsifying properties[J]. Food Hydrocolloids,2020,105:105802. doi: 10.1016/j.foodhyd.2020.105802
[47] TEIMOURI S, DEKIWADIA C, KASAPIS S. Decoupling diffusion and macromolecular relaxation in the release of vitamin B6 from genipin-crosslinked whey protein networks[J]. Food Chemistry,2021,346:128886. doi: 10.1016/j.foodchem.2020.128886
[48] SONG F, ZHANG L M. Gelation modification of soy protein isolate by a naturally occurring cross-linking agent and its potential biomedical application[J]. Industrial & Engineering Chemistry Research,2009,48(15):7077−7083.
[49] 金蓓, 冯宗财, 陈小娣, 等. 大豆蛋白基复合水凝胶的制备及其体外释放[J]. 食品工业科技,2012,33(13):84−87,91. [JIN B, FENG Z C, CHEN X D, et al. Study on preparation of soybean protein based composite hydrogel and itsin vitro releasel[J]. Science and Technology of Food Industry,2012,33(13):84−87,91. [50] HWANG D C, DAMODARAN S. Equilibrium swelling properties of a novel ethylenediaminetetraacetic dianhydride (EDTAD)-modified soy protein hydrogel[J]. Journal of Applied Polymer Science,1996,62(8):1285−1293. doi: 10.1002/(SICI)1097-4628(19961121)62:8<1285::AID-APP19>3.0.CO;2-6
[51] 刘杰, 周浩, 黄郁芳, 等. 聚乙二醇化学改性的大豆分离蛋白凝胶[J]. 高等学校化学学报,2018,39(2):390−396. [LIU J, ZHOU H, HUANG Y F, et al. Polyethylene glycol chemically modified soy protein isolate hydrogel[J]. Chemical Journal of Chinese Universities,2018,39(2):390−396. [52] 卢新生, 李榕, 李娜, 等. 甲基丙烯酸接枝改性大豆分离蛋白制备水凝胶及其性能研究[J]. 甘肃高师学报,2017,22(12):34−37. [LU X S, LI R, LI N, et al. Study on the preparation of hydrogel and its properties by the grafting of methacrylic acid graft modified soy protein isolate[J]. Journal of Gansu Normal Colleges,2017,22(12):34−37. doi: 10.3969/j.issn.1008-9020.2017.12.009 [53] ZHANG M, YANG Y, ACEVEDO N C. Effects of pre-heating soybean protein isolate and transglutaminase treatments on the properties of egg-soybean protein isolate composite gels[J]. Food Chemistry,2020,318:126421. doi: 10.1016/j.foodchem.2020.126421
[54] ZINK J, WYROBNIK T, PRINZ T, et al. Physical, chemical and biochemical modifications of protein-based films and coatings: An extensive review[J]. International Journal of Molecular Sciences,2016,17(9):1376. doi: 10.3390/ijms17091376
[55] HERNÀNDEZ-BALADA E, TAYLOR M M, PHILLIPS J G, et al. Properties of biopolymers produced by transglutaminase treatment of whey protein isolate and gelatin[J]. Bioresource Technology,2009,100(14):3638−3643. doi: 10.1016/j.biortech.2009.02.039
[56] YOKOYAMA K, NIO N, KIKUCHI Y. Properties and applications of microbial transglutaminase[J]. Applied Microbiology and Biotechnology,2004,64(4):447−454. doi: 10.1007/s00253-003-1539-5
[57] TANG C H, WU H, YU H P, et al. Coagulation and gelation of soy protein isolates induced by microbial transglutaminase[J]. Journal of Food Biochemistry,2006,30(1):35−55. doi: 10.1111/j.1745-4514.2005.00049.x
[58] TANG C H, LI L, WANG J L, et al. Formation and rheological properties of ‘cold-set’ tofu induced by microbial transglutaminase[J]. LWT-Food Science and Technology,2007,40(4):579−586. doi: 10.1016/j.lwt.2006.03.001
[59] SONG F, ZHANG L M. Enzyme-catalyzed formation and structure characteristics of a protein-based hydrogel[J]. The Journal of Physical Chemistry B,2008,112(44):13749−13755. doi: 10.1021/jp8041389
[60] GAN C Y, CHENG L H, EASA A M. Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard cross-linking[J]. Food Research International,2008,41(6):600−605. doi: 10.1016/j.foodres.2008.03.015
[61] TANG S, YANG J, LIN L, et al. Construction of physically crosslinked chitosan/sodium alginate/calcium ion double-network hydrogel and its application to heavy metal ions removal[J]. Chemical Engineering Journal,2020,393:124728. doi: 10.1016/j.cej.2020.124728
[62] XU H, SHEN L, XU L, et al. Low-temperature crosslinking of proteins using non-toxic citric acid in neutral aqueous medium: Mechanism and kinetic study[J]. Industrial Crops and Products,2015,74:234−240. doi: 10.1016/j.indcrop.2015.05.010
[63] WANG J, WEI J. Interpenetrating network hydrogels with high strength and transparency for potential use as external dressings[J]. Materials Science and Engineering: C,2017,80:460−467. doi: 10.1016/j.msec.2017.06.018
[64] ZHAO S P, MA D, ZHANG L M. New semi-interpenetrating network hydrogels: Synthesis, characterization and properties[J]. Macromolecular Bioscience,2006,6(6):445−451. doi: 10.1002/mabi.200600011
[65] HOU J J, GUO J, WANG J M, et al. Edible double-network gels based on soy protein and sugar beet pectin with hierarchical microstructure[J]. Food Hydrocolloids,2015,50:94−101. doi: 10.1016/j.foodhyd.2015.04.012
[66] HOU J J, YANG X Q, FU S R, et al. Preparation of double-network tofu with mechanical and sensory toughness[J]. International Journal of Food Science & Technology,2016,51(4):962−969.
[67] CHEN H, GAN J, JI A, et al. Development of double network gels based on soy protein isolate and sugar beet pectin induced by thermal treatment and laccase catalysis[J]. Food Chemistry,2019,292:188−196. doi: 10.1016/j.foodchem.2019.04.059
[68] DENG C, LIU Y, LI J, et al. Diverse rheological properties, mechanical characteristics and microstructures of corn fiber gum/soy protein isolate hydrogels prepared by laccase and heat treatment[J]. Food Hydrocolloids,2018,76:113−122. doi: 10.1016/j.foodhyd.2017.01.012
[69] YAN W, ZHANG B, YADAV M P, et al. Corn fiber gum-soybean protein isolate double network hydrogel as oral delivery vehicles for thermosensitive bioactive compounds[J]. Food Hydrocolloids,2020,107:105865. doi: 10.1016/j.foodhyd.2020.105865
[70] LIU Y, CUI Y. Thermosensitive soy protein/poly (n-isopropylacrylamide) interpenetrating polymer network hydrogels for drug controlled release[J]. Journal of Applied Polymer Science,2011,120(6):3613−3620. doi: 10.1002/app.33535
[71] LIU Y, CUI Y. Preparation and properties of temperature-sensitive soy protein/poly (N-isopropylacrylamide) interpenetrating polymer network hydrogels[J]. Polymer International,2011,60(7):1117−1122. doi: 10.1002/pi.3050
[72] 李榕. 大豆分离蛋白基互穿网络水凝胶的制备及其性能[D]. 兰州: 西北师范大学, 2014 LI R. Preparation and properties of soybean protein isolate based interpenetration network hydrogels [D]. Lanzhou: Northwest Normal University, 2014.
[73] ABAEE A, MOHAMMADIAN M, JAFARI S M. Whey and soy protein-based hydrogels and nano-hydrogels as bioactive delivery systems[J]. Trends in Food Science & Technology,2017,70:69−81.
[74] KHALESI H, LU W, NISHINARI K, et al. New insights into food hydrogels with reinforced mechanical properties: A review on innovative strategies[J]. Advances in Colloid and Interface Science,2020:102278.
[75] YOSHIMATSU H, YONEZAWA A, YAO Y, et al. Functional involvement of RFVT3/SLC52A3 in intestinal riboflavin absorption[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2014,306(2):G102−G110. doi: 10.1152/ajpgi.00349.2013
[76] HU H, ZHU X, HU T, et al. Effect of ultrasound pre-treatment on formation of transglutaminase-catalysed soy protein hydrogel as a riboflavin vehicle for functional foods[J]. Journal of Functional Foods,2015,19:182−193. doi: 10.1016/j.jff.2015.09.023
[77] MALTAIS A, REMONDETTO G E, SUBIRADE M. Soy protein cold-set hydrogels as controlled delivery devices for nutraceutical compounds[J]. Food Hydrocolloids,2009,23(7):1647−1653. doi: 10.1016/j.foodhyd.2008.12.006
[78] MALTAIS A, REMONDETTO G E, SUBIRADE M. Tabletted soy protein cold-set hydrogels as carriers of nutraceutical substances[J]. Food Hydrocolloids,2010,24(5):518−524. doi: 10.1016/j.foodhyd.2009.11.016
[79] LEW L C, BHAT R, EASA A M, et al. Development of probiotic carriers using microbial transglutaminase-crosslinked soy protein isolate incorporated with agrowastes[J]. Journal of the Science of Food and Agriculture,2011,91(8):1406−1415. doi: 10.1002/jsfa.4325
[80] YEW S E, LIM T J, LEW L C, et al. Development of a probiotic delivery system from agrowastes, soy protein isolate, and microbial transglutaminase[J]. Journal of Food Science,2011,76(3):H108−H115. doi: 10.1111/j.1750-3841.2011.02107.x
[81] YAN W, JIA X, ZHANG Q, et al. Interpenetrating polymer network hydrogels of soy protein isolate and sugar beet pectin as a potential carrier for probiotics[J]. Food Hydrocolloids,2020:106453.
[82] DING X, YAO P. Soy protein/soy polysaccharide complex nanogels: Folic acid loading, protection, and controlled delivery[J]. Langmuir,2013,29(27):8636−8644. doi: 10.1021/la401664y
-
期刊类型引用(1)
1. 李诗. 柚子副产物主要活性成分及综合利用的研究进展. 现代食品. 2024(01): 24-26 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



