Research Progress in the Extraction and Rapid Determination of Inorganic Arsenic in Food
-
摘要: 砷元素广泛存在于自然界中,砷及其化合物被广泛应用于农药、涂料、医药等领域,世界范围内由砷引起的食品安全问题时有发生。在诸多砷及其化合物中以无机砷的毒性最大,被国际癌症研究机构确认为I类致癌物。在食品安全监管方面,快速准确的测定食品中无机砷的含量是控制其危害人体健康的首要举措,也是开展相关研究的技术基础。近年来,液相色谱原子荧光光谱法和液相色谱等离子质谱法是无机砷检测的主流方法,然而常规的检测方法存在前处理工序复杂、检测耗时长等问题,所以开发快速前处理技术和快速检测技术对提高食品中无机砷的快速筛查和风险评估具有重要意义。国内外学者对食品中无机砷的前处理与快速检测进行了诸多拓展与研究,本文结合近年来的研究,综述了无机砷的前处理技术和快速检测方法在食品监测中的应用和进展,以期为相关研究提供参考。Abstract: Arsenic is a common toxic element, and has been widely found in nature environment. Arsenic and its compounds are also widely used in pesticides, coating materials, medicine and other fields. Food safety problems caused by arsenic are frequently taken place in the world. Among them, inorganic arsenic is the most toxic and has been recognized as the I class of carcinogens by the International Agency for Research on Cancer. In terms of food safety supervision, the rapid and accurate determination of inorganic arsenic in food will be the primary measure to control its harm to human health, and it also will be the basis technique for related researches. In recent years, the combination of Atomic fluorescence spectroscopy with chromatography and the combination of inductively coupled plasma mass spectrometry (ICP-MS) with chromatography have been the main methods for the detection of inorganic arsenic. However, the conventional detection methods have some problems such as complicated pretreatment procedure and long detection time. Therefore, it is of great significance to develop rapid pretreatment and rapid detection technology for improving the ability of rapid screening and risk assessment of inorganic arsenic in food. At present, many of new research methods on the rapid extraction and detection of arsenic in food are studied by domestic and foreign scholars. In this paper, some extraction and rapid detection methods of inorganic arsenic in food are reviewed to provide reference for related research.
-
Keywords:
- food /
- inorganic arsenic /
- extraction procedure /
- rapid detection
-
砷(Arsenic, As)是一种广泛存在于自然界的非金属元素,环境中的砷主要来源于矿石中金、银、铜等金属的冶炼,在土壤、水和空气中都有分布,主要以无机三价砷、五价砷、甲基砷酸、二甲基砷酸的形式存在,而在一些动植物中,还会以砷甜菜碱、砷糖、砷胆碱等复杂砷化合物的形式存在[1]。不同形态的砷都有一定的毒性,人类长期暴露于砷环境中,会增加肺病、心脏病、癌症的患病风险。一般来说,无机砷的毒性大于有机砷,而无机砷中以三价砷毒性最大,在人体内三价砷很容易与巯基结合形成稳定的化合物,阻碍细胞正常的呼吸和代谢,抑制酶的活性,从而引起病变[2]。使用含砷农药、在富含砷的土壤中种植或用砷污染的地下水灌溉生产的稻米会受到砷的污染,受污染的稻米中三价砷的含量较高,约占无机砷含量的90%[3],因此以大米为主食的地区将更易遭受健康威胁。鉴于此,我国对不同食品中无机砷的限量制定了严格的规定[4],同时也规定了相应的检测方法(表1)。然而目前国标和文献报道的方法中,仍然存在前处理过程繁琐、分析时间较长等问题,严重影响了检测的时效性。而发展快速前处理方法和快速检测方法在一定程度上能弥补该缺陷,提高分析效率。本文综述了近年来关于食品中无机砷元素的前处理方法和快速检测方法,并对发展方向进行展望,为实现砷污染物的快速筛查和快速检测新方法的开发提供参考。
表 1 我国部分食品中无机砷的限量和国标检测方法Table 1. Maximum levels of inorganic arsenic and determinations in some foods in China食品名称 无机砷限量(mg/kg) 国家标准检测方法[5] 大米、糙米、稻谷(以糙米计) 0.2 第一法 液相色谱-原子荧光光谱法
第二法 液相色谱-电感耦合等离子质谱法婴幼儿谷类辅助食品(添加藻类的产品除外) 0.2 添加藻类的产品 0.3 水产动物及其制品(鱼类及其制品除外) 0.5 鱼类及其制品 0.1 水产调味品(鱼类调味品除外) 0.5 鱼类调味品 0.1 1. 无机砷的前处理技术
食品中无机砷的检测一般包括无机砷总量检测和无机砷形态检测。合理有效的前处理技术能够减少基体干扰对检测结果的影响,保证检测的精准度。常用的无机砷前处理方法主要有稀酸提取法、酶解萃取法、材料吸附法等。
1.1 稀酸提取法
利用砷元素在稀酸溶液中易溶解的特点,对样品中的无机砷进行提取。该方法温和方便,提取率高,适用于不同基体中元素的提取。常用的稀酸有硝酸、硫酸、盐酸、磷酸、三氟乙酸等,具体见表2。从表2中可以看到,使用稀酸的提取效率整体较高,即便酸浓度很低也有很好的效果,提取率基本大于76%。而对于稀酸提取条件的选择,超声和微波辅助的方式较普通的振荡方式效率更高,如文献[11]所示,借助于超声和微波辅助形式,提取效率明显提高;前期本实验室发现使用稀酸与单模微波消解技术配合提取复杂基体中的无机砷,前处理时间仅需30 min即可达到84%~104%的提取率,大大提高了处理效率[13]。这可能是因为超声波形成的空化效应[15]以及微波产生的电磁场[16]能够加速破坏植物细胞壁,从而能够加快有效物质的溶出速率,使得微波方式和超声方式逐渐成为一种稀酸提取必不可少的辅助方式。
表 2 无机砷的稀酸提取方法Table 2. The extraction methods of inorganic arsenic by dilute acid样品 提取剂 提取条件 提取效率(%) 参考文献 蚕豆 1% HNO3 微波辅助,95 ℃,50 min 85~108 [6] 蔬菜 1% HNO3 微波辅助,95 ℃,50 min 95~104 [7] 洋葱 1% HNO3 微波辅助,90 ℃,90 min 94 [8] 鲜花粉 0.2 mol/L H2SO4 超声,室温,75 min 81~88 [9] 海藻 1.5 mol/L磷酸 振荡,室温,14 h 76 [10] 大米 0.25 mol/L HNO3 水浴超声,室温,136 min 91~113 [11] 大米 0.25 mol/L HNO3 加热80 ℃,120 min 82~106 [12] 稻米 0.15 mol/L HNO3 微波辅助,70~110 ℃,30 min 84~104 [13] 蔬菜 2% HNO3 微波辅助,90 ℃,17 min 91~106 [14] 1.2 酶解萃取法
酶解萃取法是利用酶的催化作用破坏样品中的大分子结构,如蛋白质、甘油三酯、淀粉等,从而使砷释放出来。酶解萃取的条件温和,近年来,在砷形态分析研究中使用较多,是一种环境友好型的前处理技术。常用的酶有胃蛋白酶、胰蛋白酶、纤维素酶、α-淀粉酶以及几种酶的组合等。
酶萃取法的提取效率与酶种类的选择关系密切,因酶本身具有选择性,在使用时应充分考虑对酶种类的选择问题。LIU等[17]利用木瓜蛋白酶萃取鸡胸肉中的砷,提取并检测出10种砷形态,但使用胃蛋白酶、胰蛋白酶和菠萝蛋白酶提取时效率明显不如木瓜蛋白酶。ERKAN[18]则用α-淀粉酶成功从大米粉中提取了无机砷用于ICP-MS分析。CARLOS等[19]利用传统的酶水解程序提取检测海藻中的多种元素,选择了胰蛋白酶、α-淀粉酶、胃蛋白酶作比较,分别在37 ℃条件下振荡6 h,其中胃蛋白酶对海藻中砷的提取效果最好,提取率约75%。从上述文献中可以看出每种酶适用的底物类型有所区别,在不同基体中,砷的提取率会因使用酶的种类不同而有所差异。
超声辅助酶解萃取法即在使用酶温和处理样品过程中加以超声手段辅助,利用超声波的作用加速酶分散和酶解作用。借助超声手段辅助酶解萃取,能明显减少提取时间、提高提取效率。王继霞等[20]将超声辅助-胃蛋白酶萃取相结合来萃取贝壳类海产品中的砷化合物,仅在35 ℃下超声5 min,即可有效分析样品中的5种砷形态,平均加标回收率为89%~107%,大大缩短了提取时间。SANZ等[21]利用超声探头,先将0.3 g大米粉与10 mg淀粉酶和3 mL水一起超声60 s,然后加入30 mg蛋白酶,再次超声波处理120 s,仅用3 min便完成了无机砷的提取。使用酶萃取的方法往往需要控制反应温度和酶解时间,相比于单一的酶温和处理手段,超声辅助酶解萃取法能明显缩短提取时间、提高效率,在砷形态分析上具有很好的优势和发展前景,使砷的提取变得绿色温和、操作简便,为以后发展快速、温和的有效提取方式提供了新思路。
1.3 材料吸附法
吸附法主要利用了吸附-分离原理将目标物质通过一定方式吸附在具有特定功能基团的材料表面再通过适当条件将其分离的技术。目前已有很多文献对该方法进行了研究,许多研究者根据目标物质的性质自由设计或改造材料的功能基团,有针对性的吸附目标物质。该方法具有适用范围广、可重复使用、效果好等优点,在无机砷提取和前处理富集中有广阔的应用前景。常用的吸附材料包括:传统吸附材料、纳米吸附材料等。
1.3.1 传统吸附材料
传统吸附材料是利用物理或化学方法吸附在固体表面富集周围介质中的分子或离子从而达到吸附的目的,一般来说,具有大比表面积的多孔材料往往具有较强的吸附能力。传统吸附材料包括:氧化铝、聚合物吸附剂、金属配合物吸附剂、离子交换树脂等。SHAHED等[22]用含硅醇基团的铵盐改性氧化铝合成新型吸附剂来吸附水、大米、鸡肉、牛奶中的无机砷等,pH为1.5时超声10 min,吸附容量为287 μg/g,并将此吸附剂用于环境、食品和生物样品中无机砷的含量测定和形态分析。MARYAM等[23]用吡咯烷二硫代氨基甲酸铵和少量六氟磷酸钠作为离子对剂,在超声作用下分散到样品溶液中对砷进行加速吸附萃取脱附,方法检出限为7 ng/L,富集系数为100,可用于食品中砷的测定。总的来说,传统吸附材料价格低廉,容易被改造,但其吸附能力有限,循环使用率偏低[24],因此如何通过简单制备和改性的方式来提高传统吸附材料的使用性能是当前研究的重点方向。
1.3.2 纳米吸附材料
纳米材料是指在三维空间中至少有一维处于纳米尺度范围或由它们作为基本单元构成的材料,具有体积效应和量子效应等独特理化性质,因其具有较大的比表面积而表现出优良的吸附性能,在样品预处理方面具有很大的应用价值[25]。AHMED等[26]采用锆基金属有机骨架(UiO-66)作为载体,通过阳离子表面活性剂和钼酸铵的改性,开发了配体功能化纳米复合材料,对砷(Ⅴ)的最大吸附量为82 mg/g,可以选择性地吸附无机砷。WU等[27]通过桉树叶提取物与硝酸铁反应合成一种绿色纳米铁离子用于砷(V)的吸附,最大吸附容量为21 mg/g,并证明了砷(V)在纳米铁表面主要通过Fe-O-As键均匀吸附,最初与纳米铁键合形成一个单齿螯合配体,随后形成一个双齿双核配合物,属于一种化学吸附行为。
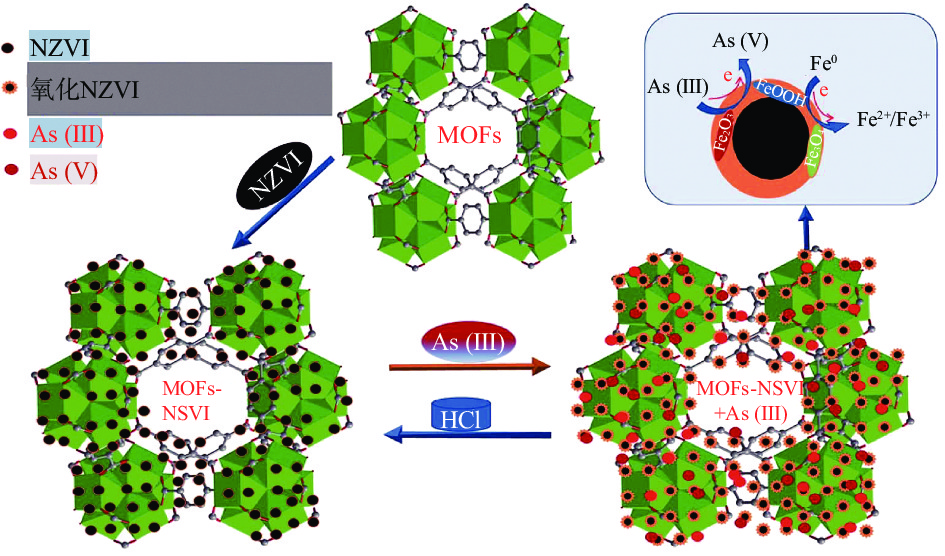
纳米零价铁(NZVI)因具有表面能高、吸附和反应活性较好以及还原能力强、可催化和降解污染物等特点,逐渐被应用于重金属吸附领域。但其易被氧化和团聚的缺点也限制了它的实际应用,许多研究者将如何防止团聚作为了研究重点[28]。LIU等[29]以棉纤维为载体,纳米零价铁为除砷活性成分,二氧化硅为保护层,采用水热还原法制备了NZVI@SiO2@celluoses(FSC)复合材料。直径为50~80 nm的棒状纳米零价铁均匀分布在棉纤维表面,二氧化硅涂层能有效防止表面氧化。在pH为2.8~4.0的酸性条件下,对砷有较好的吸附能力,最大吸附量为70 mg/g。LIU等[30]以1,4-二羧基苯锆金属有机骨架(UiO-66MOF)为模板,成功地提高了NZVI的分布和活性,其原理如图1所示,MOFs与NZVI修饰后快速捕获砷(III),并且促进了NZVI与砷(III)的反应,砷(III)被氧化为砷(V),通过化学氧化和物理吸附,吸附容量可达361 mg/g。
磁性纳米吸附材料是近年来发展的热点之一,既保留了纳米材料的吸附性能,又可以利用磁力作用分离、回收、循环利用使用后的材料,简化了操作步骤。常见的磁性材料多以铁化合物为磁核,在表面进行不同基团的包裹和修饰。磁性纳米材料的使用在一定程度上能减少离心步骤的使用、简化操作、节省时间。RAHIL等[31]将磁性纳米离子、离子印迹技术以及超声辅助手段融为一体,建立了一种新型磁性离子印迹聚合物对超痕量砷的超声辅助微固相萃取法,最大吸附量为37 mg/g,与非磁性聚合物纳米粒子相比,最大吸附量增加了30倍,且磁性分离技术取代了离心分离技术,后处理简单,节省了大量的时间。近几年随着技术的发展,磁性纳米吸附材料能与越来越多的功能材料相互修饰使用,离子液体[32]、深共晶溶剂[33]等都是绿色萃取领域非常具有潜力的吸附材料,具有高效提取、操作简单、成本低廉等优势[34-35]。由上述文献可以发现,材料吸附法通常需要特定的pH环境,一般在偏酸性时吸附砷的效率高,而且对砷的吸附价态具有强特异性,适用于分析单一形态的砷元素而不适用于同时分析多种无机砷,这与稀酸提取法和酶解萃取法具有很大的不同,研究者可根据目的的不同来选择合适的前处理方法。
2. 无机砷的快速检测方法
快速检测方法具有检测速度快、操作方便、成本低廉等特点,适用于现场快速检测和初步筛查。目前应用于食品中无机砷的快速检测方法主要有比色法、电化学分析法、荧光光谱传感器法、表面增强拉曼光谱法等。
2.1 比色法
比色法又叫分光光度法,基于反应的原理可划分为二乙氨基二硫代甲酸银分光光度法、银盐法、砷斑法、硼氢化物还原比色法等。市面上常用的是砷斑法,主要开发成试剂盒的形式使用,它的检测和定量主要取决于无机砷还原形成的砷化氢气体与溴化汞反应生成的色斑情况,随着砷浓度的增加,色斑颜色从浅黄色变成深褐色,可通过肉眼进行定性判定,也可与预先设定的颜色对比卡或以能够识别颜色信号的光谱仪进行定量判定。EDI等[36]用研制的比色法试剂盒对13个海藻样品和34个海带样品中的无机砷进行了测定,采用稀酸加热煮沸的方式提取,砷回收率为80%~94%,且二甲基亚砷酸形式的有机砷对无机砷的检测没有基质效应;该方法的重现性好,平均误差为±19%,检测限约0.05 mg/kg。EDI等[37]使用比色法试剂盒筛选方法在现场对30种大米进行了无机砷的检测,1%稀硝酸加热煮沸15~45 min,基本实现了在1 h内完成检测的目标,对现场测试结果的准确性进行统计,只有不到10%的假阳性和假阴性,筛查结果的准确性令人满意。总之,比色法试剂盒法虽然在准确度上没有原子荧光光谱法和电感耦合等离子质谱法准确,但它使用方便、操作简单、快速、实验条件易于满足,检测结果具有一定的参考价值,适合于现场快筛、定性或半定量分析。
2.2 电化学分析法
电化学分析法是根据不同物质的电化学特性及电流电位等参数来判断被测组分及含量的方法。电化学分析法测定砷元素多数是测砷(Ⅲ),因为砷(Ⅴ)基本没有电活性,研究者通常会将砷(Ⅴ)还原为砷(Ⅲ)间接测定总无机砷的含量,但在测定过程中容易受到其他离子和基体的干扰,尤其容易受到铜离子的影响[38]。PIPAT等[39]用悬汞滴电极,采用阴极溶出伏安法测定样品中的无机砷。当盐酸介质中存在铜时,只有砷(Ⅲ)沉积在汞电极上,用硫代硫酸钠将砷(Ⅴ)还原为砷(Ⅲ)即可测定总无机砷的含量,砷(Ⅲ)的检测限为0.02 μg/L,总无机砷的检测限为0.03 μg/L。然而,镀汞的电极虽然性能比较稳定,但考虑到汞的毒性及其在使用时造成的人身威胁和环境污染,许多研究者倾向于研究更加绿色友好型的电极,比如金电极、铋电极等。BABAR等[40]用金纳米电极测试超低水平砷(Ⅲ),检测限为0.1 μg/L,金表面的纳米结果增强了电化学比表面积,生成更多表面活性中心,有利于砷在电极上的吸附,从而实现高灵敏度的检测。MEFA等[41]用方波溶出伏安法研究了铋修饰脱落石墨电极对水样中砷、汞、铅等重金属离子的共检测,其中砷的检测限为0.014 μg/L。
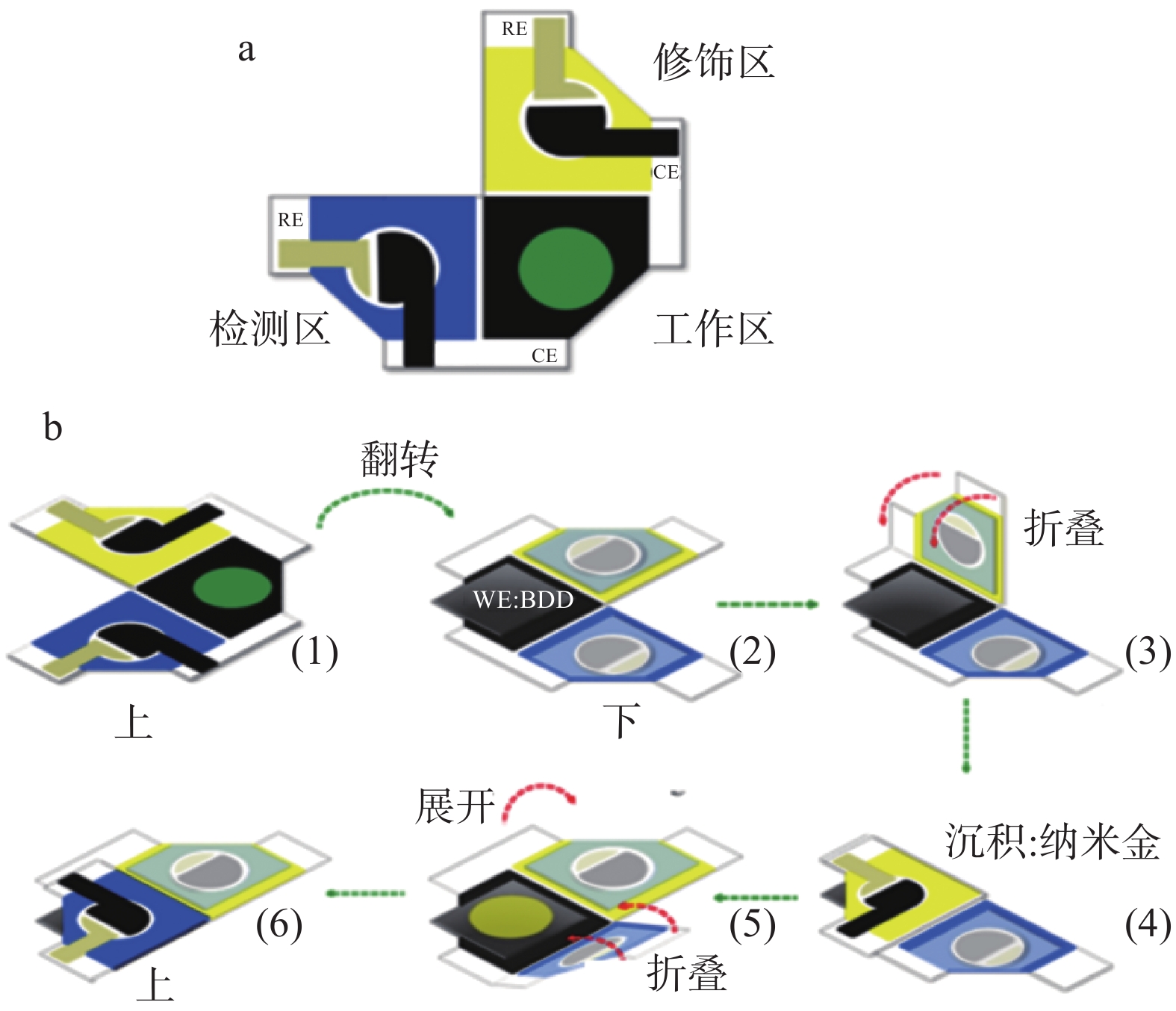
电化学方法在环境尤其是水环境领域较为成熟,但在食品重金属检测方面应用较少,主要还是受限于食品复杂的样品基质。GAMBOA等[42]组装碳纳米管-金纳米粒子修饰振动筛印刷电极,采用线性扫描阳极溶出伏安法测定无机砷,并在丝网印刷电极上安装了振动马达,以创建一个具有增强的质量传递的便携式自主系统,方法线性范围为10~550 μg/L,偏差为2.4%。PUNGJUNUN等[43]设计了一种多步纸基分析装置即配有金纳米粒子修饰的硼掺杂金刚石电极,主要分为检测区、电极工作区和修饰区三部分(图2a),并将其应用于总无机砷的阳极溶出伏安法测定,图2b为分析流程,首先将修饰区与电极工作区对折,将纳米金粒子修饰到硼掺杂金刚石电极上,展开后再将检测区域与工作电极对折,使检测区域的待测物在工作电极上完成对砷(Ⅲ)的检测,砷(Ⅲ)的检测限为20 ng/mL,精密度高、重现性好,利用该方法对大米样品中总无机砷的测定结果与电感耦合等离子体发射光谱法(ICP-OES)一致。相比于其他快检方法,电化学分析法具有仪器体积小、成本低、灵敏度高、准确性好、检测速度快的优势,在离子快速检测方向发挥着重要作用。其局限性在于电化学分析方法只能检测特定形态的砷元素,不能识别所有形态的无机砷。
2.3 荧光光谱传感器法
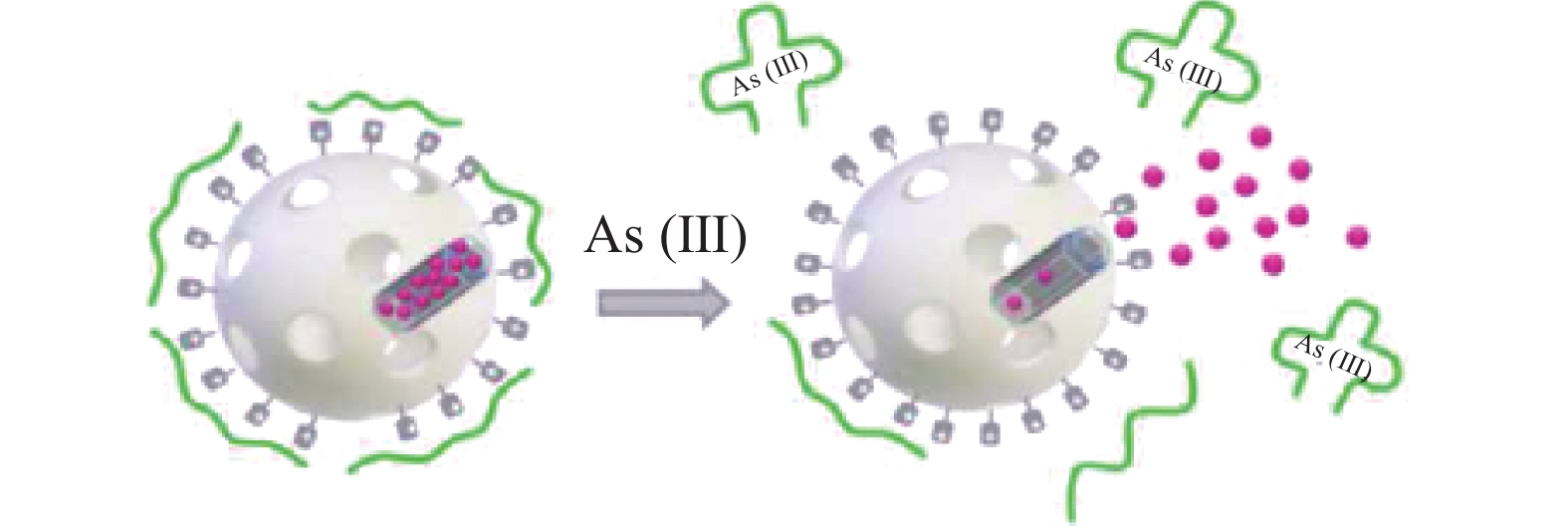
荧光光谱传感器法主要是指利用某些具有荧光特性物质或连接有荧光标记物的物质根据其荧光谱线及强度进行含量测定的方法。OROVAL等[44]设计了一种介孔二氧化硅纳米颗粒与适配体结合的新型荧光传感器,在53.2~798 nm动态范围内测定砷(Ⅲ),检测限为11.97 nmoL,其主要原理是利用罗丹明B修饰无机载体孔,氨丙基将其外表面官能化后引入适体剂制成的固体封顶,当溶液中存在砷(Ⅲ)时介孔二氧化硅纳米粒子表面的适配体置换和随后的传递将导致孔打开,荧光信号释放(如图3所示),介孔二氧化硅纳米粒子具有内表面积大、表面改性灵活、易于团簇等优点,提高了荧光光谱传感器检测的灵敏度和专一性。荧光光谱传感器法的检测一般会依赖荧光探针对目标物的识别性能,因此对荧光探针设计及合成的研究是发展荧光传感器的热点之一。
2.4 表面增强拉曼光谱法
表面增强拉曼光谱法作为一种新型的分析技术,也有部分研究者将其应用于砷元素的检测。SONG等[45]将4-巯基苯甲酸和砷(Ⅲ)适体吸附在Au@Ag上,随砷(Ⅲ)的加入信号增强,该生物传感器的线性范围为0.5~10 μg/L,检测限为0.1 μg/L。然而,表面增强拉曼光谱在实际应用中还有很多挑战,比如基底的纳米结构特征、表面化学性质、纳米粒子的聚集程度、样品的基体效应、分析条件等重要影响因素限制了它的推广。
3. 总结与展望
砷元素的形态种类繁多且在不同基体中含量差异较大,在检测过程中易受干扰因素的影响,因此,对其进行提取和准确检测具有一定的难度。近几年食品样品前处理技术的发展和对快速检测方法研究的深入,为无机砷元素的定性和定量分析提供了方法和依据。然而,复杂多样的食品基质中砷的快速提取方法和快速检测技术的相互融合仍存在不成熟不完善的地方,在现有研究的基础上开发更为轻便、可靠、成本低廉、抗基体干扰能力强的前处理技术和检测方法,使快速前处理与快速检测融为一体真正满足现场使用,这将会成为食品安全检测技术未来重要的研究方向和发展趋势。
-
表 1 我国部分食品中无机砷的限量和国标检测方法
Table 1 Maximum levels of inorganic arsenic and determinations in some foods in China
食品名称 无机砷限量(mg/kg) 国家标准检测方法[5] 大米、糙米、稻谷(以糙米计) 0.2 第一法 液相色谱-原子荧光光谱法
第二法 液相色谱-电感耦合等离子质谱法婴幼儿谷类辅助食品(添加藻类的产品除外) 0.2 添加藻类的产品 0.3 水产动物及其制品(鱼类及其制品除外) 0.5 鱼类及其制品 0.1 水产调味品(鱼类调味品除外) 0.5 鱼类调味品 0.1 表 2 无机砷的稀酸提取方法
Table 2 The extraction methods of inorganic arsenic by dilute acid
样品 提取剂 提取条件 提取效率(%) 参考文献 蚕豆 1% HNO3 微波辅助,95 ℃,50 min 85~108 [6] 蔬菜 1% HNO3 微波辅助,95 ℃,50 min 95~104 [7] 洋葱 1% HNO3 微波辅助,90 ℃,90 min 94 [8] 鲜花粉 0.2 mol/L H2SO4 超声,室温,75 min 81~88 [9] 海藻 1.5 mol/L磷酸 振荡,室温,14 h 76 [10] 大米 0.25 mol/L HNO3 水浴超声,室温,136 min 91~113 [11] 大米 0.25 mol/L HNO3 加热80 ℃,120 min 82~106 [12] 稻米 0.15 mol/L HNO3 微波辅助,70~110 ℃,30 min 84~104 [13] 蔬菜 2% HNO3 微波辅助,90 ℃,17 min 91~106 [14] -
[1] AHMAD H, ZHAO L H, LIU C K, et al. Ultrasound assisted dispersive solid phase microextraction of inorganic arsenic from food and water samples using CdS nanoflowers combined with ICP-OES determination[J]. Food Chemistry,2021,338:128028. doi: 10.1016/j.foodchem.2020.128028
[2] PRABHAT K R, SANG S L, ZHANG M, et al. Heavy metals in food crops: Health risks, fate, mechanisms, and management[J]. Environment International,2019,125:365−385. doi: 10.1016/j.envint.2019.01.067
[3] 董晓丽, 王步军. 江西省稻米中总砷和无机砷含量的测定与分析[J]. 食品科学技术学报,2019,37(6):124−128. [DONG X L, WANG B J. Determination and analysis on total arsenic and inorganic arsenic in rice of Jiangxi province[J]. Journal of Food Science and Technology,2019,37(6):124−128. doi: 10.3969/j.issn.2095-6002.2019.06.017 [4] 国标: 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 2762-2017食品中污染物限量[S]. 2017, GB: National Health Commission of the People’s Republic of China, China Food and Drug Administration. GB 2762-2017 National food safety standard-maximum levels of contaminants in food[S]. 2017.
[5] 国标: 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.11-2014 食品中总砷及无机砷的测定[S]. 2014. GB: National Health Commission of the People’s Republic of China, China Food and Drug Administration. GB 5009.11-2014 National standard for food safety-determination of total arsenic and inorganic arsenic in foods[S]. 2014.
[6] SADEE B A, FOULKES M E, HILL S J. A study of arsenic speciation in soil, irrigation water and plant tissue: A case study of the broad bean plant, Vicia faba[J]. Food Chemistry,2016,210:362−370. doi: 10.1016/j.foodchem.2016.04.066
[7] REHMAN Z U, KHAN S, QIN K, et al. Quantification of inorganic arsenic exposure and cancer risk via consumption of vegetables in southern selected districts of Pakistan[J]. Science of the Total Environment,2016,550:321−329. doi: 10.1016/j.scitotenv.2016.01.094
[8] MA L, YANG Z G, KONG Q, et al. Extraction and determination of arsenic species in leafy vegetables: Method development and application[J]. Food Chemistry,2016,217:524−530.
[9] 王素芬, 陈芳, 王鹏, 等. HPLC-HG-AFS联用技术检测蜂花粉中砷形态[J]. 食品科学,2013,34(12):189−193. [WANG S F, CHEN F, WANG P, et al. Determination of four arsenic species in bee pollen by high performance liquid chromatography-hydride generation-atomic fluorescence spectrometry[J]. Food Science,2013,34(12):189−193. [10] RICHARD S, CSILLA S, ILDIKO I, et al. Determination of arsenic species in seafood samples from the Aegean Sea by liquid chromatography-(photo-oxidation)-hydride generation–atomic fluorescence spectrometry[J]. Analytica Chimica Acta,2005,547(1):109−118. doi: 10.1016/j.aca.2005.01.032
[11] BRUNO E S, NÍVIA M M, LUCIANA M C. Determination of arsenic species in rice samples using CPE and ETAAS[J]. Food Chemistry,2015,178:89−95. doi: 10.1016/j.foodchem.2015.01.014
[12] MEGUMI H N, TSUTOMU N, RIEKO M, et al. Evaluation of a nitric acid-based partial-digestion method for selective determination of inorganic arsenic in rice[J]. Shokuhinseigaku Zasshi Journal of the Food Hygienic Society of Japan,2008,49(2):95−99. doi: 10.3358/shokueishi.49.95
[13] 周明慧, 陈曦, 张洁琼, 等. 稻米中无机砷检测关键因素研究及方法建立[J]. 中国粮油学报,2019,34(9):112−117. [ZHOU M H, CHEN X, ZHANG J Q, et al. Key factors and establishment of detection methods of inorganic arsenic in rice[J]. Journal of the Chinese Cereals and Oils Association,2019,34(9):112−117. doi: 10.3969/j.issn.1003-0174.2019.09.019 [14] JIA X T, YANG X Y, ZHAO W, et al. A method for rapid determination of arsenic species in vegetables using microwave-assisted extraction followed by detection with HPLC hyphenated to inductively coupled plasma-mass spectrometry[J]. Journal of Separation Science,2019,42(18):1−11.
[15] 吴昊, 宗志敏, 石金龙. 超声波协同酶法提取银杏黄酮的工艺研究[J]. 中国资源综合利用,2012,30(11):26−29. [WU H, ZONG Z M, SHI J L. Study on the extraction of total flavonoids from ginkgo biloba by ultrasonic wave and enzymatic[J]. China Resources Comprehensive Utilization,2012,30(11):26−29. doi: 10.3969/j.issn.1008-9500.2012.11.013 [16] 徐晨, 范云场. 微波辅助萃取在色谱分析样品前处理中的应用[J]. 应用化工,2018,47(2):343−346. [XU C, FAN Y C. Application of microwave-assisted extraction in sample pretreatment of chromatographic analysis[J]. Applied Chemical Industry,2018,47(2):343−346. doi: 10.3969/j.issn.1671-3206.2018.02.034 [17] LIU Q Q, PENG H Y, LU X F, et al. Enzyme-assisted extraction and liquid chromatography mass spectrometry for the determination of arsenic species in chicken meat[J]. Analytica Chimica Acta,2015,888:1−9. doi: 10.1016/j.aca.2015.05.001
[18] ERKAN Y. Use of hydrolytic enzymes as green and effective extraction agents for ultrasound assisted-enzyme based hydrolytic water phase microextraction of arsenic in food samples[J]. Talanta,2018,189:302−307. doi: 10.1016/j.talanta.2018.07.006
[19] CARLOS P F, ANTONIO M P, ADELA B B, et al. Speeding up enzymatic hydrolysis procedures for the multi-element determination in edible seaweed[J]. Analytica Chimica Acta,2005,548(1-2):183−191. doi: 10.1016/j.aca.2005.06.004
[20] 王继霞, 张颜, 叶明德, 等. 超声辅助酶水解-高效液相色谱-氢化物发生-原子荧光光谱测定贝壳类海产品中砷形态[J]. 分析科学学报,2018,34(1):145−148. [WANG J X, ZHANG Y, YE M D, et al. Speciation of arsenic in shell samples with ultrasound- assisted enzymatic hydrolysis extraction combined with high performance liquid chromatograohy-hydride genetation-atomic fluorescence spectrometry determination[J]. Journal of Analytical Science,2018,34(1):145−148. [21] SANZ E, OLIVAS R M, CÁMARA C. A rapid and novel alternative to conventional sample treatment for arsenic speciation in rice using enzymatic ultrasonic probe[J]. Analytica Chimica Acta,2005,535:227−235. doi: 10.1016/j.aca.2004.12.021
[22] SHAHED H, GHOLAMREZA K, AMIR R J A. Ultra-trace determination of arsenic species in environmental waters, food and biological samples using a modified aluminum oxide nanoparticle sorbent and AAS detection after multivariate optimization[J]. Microchimica Acta,2015,182(11-12):1957−1965. doi: 10.1007/s00604-015-1532-6
[23] MARYAM E, BEHROOZ M, KHOSROU A. Evaluation of ultrasound-assisted in situ sorbent formation solid-phase extraction method for determination of arsenic in water, food and biological samples[J]. Environmental Technology,2015,36(11):1381−1388. doi: 10.1080/09593330.2014.990933
[24] KAMAL K J, ELENA P V, PILAR B B, et al. Ionic imprinted polymer-vortex-assisted dispersive micro-solid phase extraction for inorganic arsenic speciation in rice by HPLC-ICP-MS[J]. Talanta,2020,220:121418−121427. doi: 10.1016/j.talanta.2020.121418
[25] 苏祖俭, 黄伟雄, 蔡文华, 等. 食品中无机砷分析技术进展[J]. 食品安全质量检测学报,2018,9(14):38−47. [SU Z J, HUANG W X, CAI W H, et al. Advances in analysis of inorganic arsenic in food[J]. Journal of Food Safety and Quality,2018,9(14):38−47. [26] AHMED S, HASSAN H M A, AZZAZY H M E, et al. Novel nano-conjugate materials for effective arsenic(V) and phosphate capturing in aqueous media[J]. Chemical Engineering Journal,2018,331:54−63. doi: 10.1016/j.cej.2017.08.037
[27] WU Z C, SU X B, LIN Z, et al. Mechanism of As(V) removal by green synthesized iron nanoparticles[J]. Journal of Hazardous Materials,2019,379:120811. doi: 10.1016/j.jhazmat.2019.120811
[28] 阚连宝, 刘泽. 纳米零价铁制备与应用的研究进展[J]. 环境科学与技术,2019,42(6):215−223. [KAN L B, LIU Z. Research progress in preparation and application of nano-zero-valent iron[J]. Environmental Science and Technology,2019,42(6):215−223. [29] LIU H, LI P P, YU H Q, et al. Controlled fabrication of functionalized nanoscalezero-valent iron/celluloses composite with siliconas protective layer for arsenic removal[J]. Chemical Engineering Research and Design,2019,151:242−251. doi: 10.1016/j.cherd.2019.09.020
[30] LIU T Y, ZHANG Z C, WANG Z H, et al. Highly efficient and rapid removal of arsenic (iii) from aqueous solutions by nanoscale zero-valent iron supported on a zirconium 1, 4-dicarboxybenzene metal–organic framework (UiO-66 MOF)[J]. RSC Advances,2019,9(67):39475−39487. doi: 10.1039/C9RA08595E
[31] RAHIL J, MAHTAB S, ALIREZA T, et al. Ultrasonic-assisted micro solid phase extraction of arsenic on a new ion-imprinted polymer synthesized from chitosan-stabilized pickering emulsion in water, rice and vegetable samples[J]. Ultrasonics Sonochemistry,2020,61:104802. doi: 10.1016/j.ultsonch.2019.104802
[32] ZHANG M Y, MA X G, LI J, et al. Enhanced removal of As (III) and As (Ⅴ) from aqueous solution using ionic liquid-modified magnetic graphene oxide[J]. Chemosphere,2019,234:196−203. doi: 10.1016/j.chemosphere.2019.06.057
[33] MAHBOUBE S, SAEED H, ALI A. Centrifuge-less deep eutectic solvent based magnetic nanofluid-linked airagitated liquid-liquid microextraction coupled with electrothermal atomic absorption spectrometry for simultaneous determination of cadmium, lead, copper, and arsenic in food samples and non-alcoholic beverages[J]. Food Chemistry,2019,281:304−311. doi: 10.1016/j.foodchem.2018.12.110
[34] ALTUNAY N, ELIK A, DEMIRBAS A. Developing a new and simple natural deep eutectic solvent based ultrasonic-assisted microextraction procedure for determination and preconcentration of As and Se from rice samples[J]. Analytical Methods,2019,11:3429−3438. doi: 10.1039/C9AY00916G
[35] ZOUNR R A, TUZEN M, KHUHAWAR M Y. Ultrasound assisted deep eutectic solvent based on dispersive liquid liquid microextraction of arsenic speciation in water and environmental samples by electrothermal atomic absorption spectrometry[J]. Journal of Molecular Liquids,2017,242:441−446. doi: 10.1016/j.molliq.2017.07.053
[36] EDI B, KAROLINA N, JENNY R, et al. A field deployable method for a rapid screening analysis of inorganic arsenic in seaweed[J]. Microchimica Acta,2017,184(6):1701−1709. doi: 10.1007/s00604-017-2151-1
[37] EDI B, SEVERINE L, EVA M K, et al. Detection of inorganic arsenic in rice using a field test kit: A screening method[J]. Analytical Chemistry,2015,87(22):11271−11276. doi: 10.1021/acs.analchem.5b02386
[38] XUAN D, RICHARD C. Detection of As (Ⅲ) via oxidation to As (Ⅴ) using platinum nanoparticle modified glassy carbon electrodes: Arsenic detection without interference from copper[J]. The Analyst,2006,131:516−521. doi: 10.1039/b513686e
[39] PIPAT C, PUCHONG W, TAWATCHAI K, et al. Determination of inorganic arsenic species by hydride generation atomic absorption spectrophotometry and cathodic stripping voltammetry[J]. Science Asia,2015,41:187−197. doi: 10.2306/scienceasia1513-1874.2015.41.187
[40] BABAR N, JOYA K S, TAYYAB M A, et al. Highly sensitive and selective detection of arsenic using electrogenerated nanotextured gold assemblage[J]. ACS Omega,2019,4(9):13645−13657. doi: 10.1021/acsomega.9b00807
[41] MAFA P J, IDRIS A O, MABUBA N, et al. Electrochemical co-detection of As (III), Hg (II) and Pb (II) on a bismuth modified exfoliated graphite electrode[J]. Talanta,2016,153:99−106. doi: 10.1016/j.talanta.2016.03.003
[42] GAMBOA J C M, CORNEJO L, SQUELLA J A. Vibrating screen printed electrode of gold nanoparticle-modified carbon nanotubes for the determination of arsenic (III)[J]. Journal of Applied Electrochemistry,2014,44(12):1255−1260. doi: 10.1007/s10800-014-0727-6
[43] PUNGJUNUN K, CHAIYO S, JANTRAHONG I, et al. Anodic stripping voltammetric determination of total arsenic using a gold nanoparticle-modified boron-doped diamond electrode on a paper-based device[J]. Microchimica Acta,2018,185(7):324−331. doi: 10.1007/s00604-018-2821-7
[44] OROVAL M, COLL C, BERNARDOS A, et al. Selective fluorogenic sensing of As (III) using aptamer-capped nanomaterials[J]. ACS Applied Materials and Interfaces,2017,9(13):11332−11336. doi: 10.1021/acsami.6b15164
[45] SONG L L, MAO K, ZHOU X D, et al. A novel biosensor based on Au@Ag core-shell nanoparticles for SERS detection of arsenic (III)[J]. Talanta,2016,146:285−290. doi: 10.1016/j.talanta.2015.08.052
-
期刊类型引用(0)
其他类型引用(2)





 下载:
下载:
 下载:
下载:



