Process Optimization and Performance Analysis of Modified Zein Film by High Pressure Heat-Moisture (HPHM) Treatment
-
摘要: 本研究采用高压湿热法对玉米醇溶蛋白膜进行改性处理,通过单因素实验和L9(34)正交试验优化了高压湿热处理的工艺,并进行了性能研究。结果表明,最佳高压湿热处理条件为:成膜液体积9 mL、处理温度121 ℃、处理时间40 min。在此条件下玉米醇溶蛋白膜的吸水率低至11.35%±0.74%,浸水后透明度为181.30±3.29,相比未处理有显著改善(P<0.05)。同时,经过高压湿热改性后玉米醇溶蛋白膜的体外酶解抗性(14.92%±0.58%)和抗拉强度(16.51±2.13 MPa)明显增强。傅里叶红外光谱(FT-IR)分析表明,高压湿热改性导致玉米醇溶蛋白中β-转角结构向结构更加有序的无规则卷曲、β-折叠和α-螺旋结构转变。本文为高压湿热法辅助制备蛋白基高耐水性材料的开发提供理论基础。Abstract: In this study, zein films were modified by high pressure heat-moisture (HPHM) method and the technology of HPHM modification was optimized through single experiments and L9(34) orthogonal tests, and the properties of zein film were studied. The optimal technology was as follows: Film-formation solution volume of 9 mL, treatment temperature of 112 ℃ and treatment time of 40 min. Under the optimal technology, the water absorption rate (WAR) and transparency of modified zein film was 11.35%±0.74% and 181.30±3.29, respectively, greatly improved than raw film (P<0.05). Meanwhile, the HPHM zein film exhibited obvious improved in vitro enzymatic hydrolysis resistance (14.92%±0.58%) and tensile strength (16.51±2.13 MPa). FTIR results also showed that the β-bend of zein molecule was converted to more ordered-arranged random coli, β-sheet and α-helix after HPHM modification. This study could provide essential foundations for manufacturing high-hydrophobic protein-based films assisted by HPHM modification.
-
Keywords:
- zein /
- film /
- high pressure heat-moisture /
- functional properties /
- structure
-
玉米醇溶蛋白(zein)作为工业上生产玉米淀粉的主要副产物,其含量约占玉米总蛋白的50~60%[1-3]。玉米醇溶蛋白含有较多非极性氨基酸,具有较强的疏水作用力[4]。此外,分子结构中含硫氨基酸比重较大,分子间及分子内通过二硫键紧密相连[5]。玉米醇溶蛋白在醇水溶液中以无规则线团形式存在[6],当溶剂蒸发后,蛋白质分子间通过疏水作用力、二硫键和氢键自组装形成网络状结构,即玉米醇溶蛋白膜[7]。玉米醇溶蛋白膜透明,有光泽,且具有安全无毒、隔氧、阻油、抗紫外线、防静电、可降解等特性[8-9],在包装材料、药物递送、细胞组织支架材料、果蔬保鲜等领域有着较大的应用潜力[10-12]。
针对玉米醇溶蛋白的研究多集中在提高其机械性能[13]、抗菌性[14]以及溶解性[15]。Dong等[16]分别通过自组装单分子层法(SAM)和蒸发诱导自组装法(EISA)诱导制备高疏水性玉米醇溶蛋白膜。研究证明通过调节玉米醇溶蛋白浓度和蒸发时间可以控制蛋白胶束粒径。通过提高膜表面粗糙度,接触角最高可达126°。徐慧等[17]通过电场对玉米醇溶蛋白进行诱导成膜,研究发现乙醇体积分数90%时膜静态接触角可达到最大值为62.46°,通过调节溶剂浓度可获得具有一定疏水特性和机械强度的薄膜。虽然对于提高玉米醇溶蛋白膜疏水性的研究较为广泛,但这些研究多集中于膜表面疏水特性的改善,提高玉米醇溶蛋白膜整体耐水性方面的研究较少。与其他两亲性蛋白质类似,未经改性的玉米醇溶蛋白膜耐水性较差[18],在水相环境中易吸水溶胀,进而引起透明度的下降。这些不足限制了玉米醇溶蛋白在作为食品包装材料或作为基材进行细胞培养观察时的实际应用性,亟需找到合适的改性方法以提高其功能特性。
前期实验研究发现,通过对玉米醇溶蛋白膜进行高压湿热改性处理后,其阻水能力有明显改善。高压湿热法无有毒试剂残留,清洁环保,操作简单,在蛋白基食品包装材料领域相比于其他化学改性法、物化改性方法具有较好的应用潜力。
本文通过单因素实验考察成膜液体积、处理温度和处理时间对玉米醇溶蛋白膜吸水率和透明度的影响,通过正交试验优化确定最佳改性条件。在此基础上,对改性前后玉米醇溶蛋白膜的机械性能、抗酶解性以及红外二级结构进行综合表征。本研究为高耐水性蛋白基材料的开发提供数据基础,有助于拓展玉米淀粉副产物的开发与利用。
1. 材料与方法
1.1 材料与仪器
玉米醇溶蛋白 高邮市日星药用辅料有限公司;无水乙醇 天津市致远化学试剂有限公司;丙三醇(甘油) 天津市致远化学试剂有限公司;胰蛋白酶(≥2500 U/mg) 杭州联科生物科技有限公司。
LDZX-50FBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;756PC紫外-可见分光光度计 中国普锐斯仪器有限公司;TA.XT-plus质构分析仪 英国Stable Micro Systems公司;Nicolet5700傅里叶变换红外光谱仪 美国热电尼高力仪器公司。
1.2 实验方法
1.2.1 玉米醇溶蛋白膜的制备
称量一定量的玉米醇溶蛋白粉末溶解于80%(v/v)乙醇溶液,配制成浓度为15%(w/v)的蛋白溶液,向溶液中加入蛋白质量20%(w/w)的甘油作为增塑剂,磁力搅拌(转速为300 r/min)30 min直至完全溶解。随后,在60 ℃水浴中加热10 min,趁热倒入模具,于室温(25±0.5 ℃)下自然干燥48 h后揭膜。将制得的玉米醇溶蛋白膜样品存放于温度25±0.5 ℃,相对湿度50%±2%环境中平衡一周待用[19]。
1.2.2 高压湿热改性处理
采用高压蒸汽灭菌锅作为高压湿热环境发生器(相对湿度100%),将样品膜置于玻璃平皿中,按照1.2.3中的处理条件对玉米醇溶蛋白膜进行高压湿热改性。待样品处理后恢复室温,放置于相对湿度50%±2%环境中平衡一周待测。
1.2.3 单因素实验
固定高压湿热改性处理的基本条件为玉米醇溶蛋白成膜液体积7 mL,处理温度为121 ℃,处理时间为30 min。在基本参数下分别考察玉米醇溶蛋白成膜液体积(3、5、7、9、11 mL)、高压湿热处理温度(105、115、121、126 ℃)、高压湿热处理时间(10、20、30、40、50 min)对膜吸水率和浸水后透明度两个指标的影响。
1.2.4 正交优化试验
根据单因素实验结果,以综合得分(S)为评价指标,选择适宜的水平进行L9(34)正交优化试验并确定高压湿热处理的最佳工艺条件。按如下公式计算样品膜的综合得分:
S=(100%−S1)×100+S2 式中,S为样品的综合得分,S1为样品的吸水率,%;S2为样品的透明度。
正交试验因素与水平如表1所示。
表 1 正交试验因素水平设计Table 1. Factors and levels of orthogonal experiments水平 A成膜液体积(mL) B处理温度(℃) C处理时间(min) 1 7 115 20 2 9 121 30 3 11 126 40 1.2.5 吸水率
将样品裁切成10 mm×25 mm矩形条,50 ℃烘干至恒重,精确称量其质量,记为W1;称重后放入玻璃平皿中,加入40 mL去离子水,室温下浸泡24 h。随后取出用滤纸吸附薄膜表面水分,精确称量此时膜的质量,记为W2;再次将薄膜烘干到恒重,精确称量其质量,记为W3。通过如下公式计算吸水率(%)[20]:
吸水率(%)=W2−W3W1×100 1.2.6 厚度和透明度
参考Ramos等[21]的方法但有所修改,用电子数显卡尺精准测量玉米醇溶蛋白膜的厚度,精确度为0.01 μm。每个样品随机选取三个位置进行测量,取平均值用于透明度的计算。将薄膜裁剪成1.0 cm×2.5 cm的矩形条,将样品置于石英比色皿中测定波长600 nm处的吸光度,按如下公式计算薄膜的透明度:
透明度=薄膜厚度A600nm 1.2.7 力学特性
采用质构仪测定薄膜的抗拉强度(MPa)和断裂伸长率(%),将样品裁切成1 cm×6 cm矩形条,初始夹具间距为30 mm,机械十字头初始间隙为50 mm,探针测试速度为50 mm/min。
1.2.8 体外酶解率
将样品裁切成2 cm×4 cm的矩形条并放入玻璃平皿中,置于50 ℃烘箱中干燥至恒重,取出后称量其质量,记为W1;量取10 mL 0.25%胰蛋白酶的PBS缓冲溶液(pH7.4)加入样品中,保证样品完全浸泡,置于37 ℃生化培养箱中酶解4 h。随后取出,用滤纸除滤干表面液体,50 ℃烘箱中干燥至恒重,精确称量其质量,记为W2。按如下公式计算膜体外酶解率[22]:
体外酶解率(%)=W1−W2W1×100 1.2.9 傅里叶变换红外光谱(FT-IR)
扫描采用傅里叶变换衰减全反射红外光谱(ATR-FTIR)对玉米醇溶蛋白膜的特征峰和二级结构进行表征,以空气为空白背景,扫描次数为32,透射模式下对波数4000~675 cm−1进行光谱扫描。采用OMNIC 8.2软件对酰胺I区(1700~1600 cm−1)光谱进行基线校正、傅里叶自去卷积(FSD)和二阶求导等数据处理,计算出蛋白质中各二级结构单元的相对含量(%)[23]。
1.3 数据统计分析
采用正交试验助手IIV3.1和SPSS19.0软件进行正交试验设计以及数据的统计分析。使用Origin 9.0软件进行绘图。
2. 结果与分析
2.1 单因素实验
2.1.1 成膜液体积
图1为成膜液体积对高压湿热改性玉米醇溶蛋白膜吸水率和浸水后透明度的影响。由结果可知,随着成膜液体积的增加,玉米醇溶蛋白膜吸水率整体呈现先降低后升高趋势,当成膜液体积为9 mL时吸水率达到最低值13.62%±2.04%,同时,浸水后透明度达到最大值168.67±6.54。由图1可知,透明度的变化与吸水率呈现相反趋势,吸水率越高表明玉米醇溶蛋白膜的溶胀越严重,透明度受其影响也相应下降[24]。
在薄膜制备过程中,成膜液体积与膜厚度理论上呈正相关关系。实验测得成膜液体积为3、5、7、9、11 mL时薄膜厚度分别为91.68±4.64、151.33±5.34、198.57±5.41、235.25±16.58、269.17±18.98 μm。成膜液体积较小时制成的玉米醇溶蛋白膜相对较薄。在玉米醇溶蛋白膜干燥过程中,随着成膜液体积的增加,有更多的玉米醇溶蛋白分子参与到极性自组装过程[25],形成了牢固的蛋白网络结构,其耐水性能相应较强。但当成膜液体积达到11 mL时,吸水率反而有所提高,透明度也相应下降。其原因包括两个方面:一是实验中薄膜制备模具尺寸固定,过量的成膜液会影响乙醇-水溶剂的挥发速率,进而降低薄膜的均匀性,导致吸水率小幅度上升。11 mL样品较大的厚度标准偏差值(18.98 μm)可以反映出薄膜的均匀性差。二是玉米醇溶蛋白膜的厚度对力学性质影响显著,郭兴凤等[25]研究发现在一定厚度范围内,玉米醇溶蛋白膜越厚,抗拉强度越小。因此,成膜液体积通过厚度间接影响薄膜力学强度以及在高压湿热处理环境中的耐受度,进而造成吸水率不降反升。结合上述结果,选择7、9、11 mL作为正交试验的优化水平。
2.1.2 高压湿热处理温度
图2为高压湿热处理温度对玉米醇溶蛋白膜吸水率和浸水后透明度的影响。由结果可知,吸水率呈现先降低后升高的趋势,透明度相应地呈现相反趋势。处理温度为121℃时,吸水率达到最低值16.67%±1.68%,此时透明度为最大值112.56±5.35,显著高于其他处理温度样品(P<0.05)。在固定其他条件不变的前提下,随着高压湿热处理温度的增加,反应腔内的压力随之增加。处理温度为121 ℃时,反应腔内压力可达到103.4 kPa。高压湿热环境诱导玉米醇溶蛋白膜旧化学键断裂,生成新键。蛋白膜分子间形成了新的二硫键使蛋白网络结构更紧密[24-25],有利于限制水分子浸润。然而,当进一步提高处理温度,较高的温度加剧了分子热运动[26],使蛋白质与水之间亲和力增强,导致吸水率不降反升。结合上述结果,选择115、121、126℃作为正交试验的优化水平。
2.1.3 高压湿热处理时间
图3为高压湿热处理时间对玉米醇溶蛋白膜吸水率和浸水后透明度的影响。由结果可知,随着高压湿热处理时间的延长,玉米醇溶蛋白膜的吸水率和透明度变化相对较小。虽然在30 min处理时的吸水率达到最低值,但在统计分析上并没有显著差异(P>0.05)。可见相比于另外两个因素,高压湿热处理时间对玉米醇溶蛋白膜的吸水率和透明度影响较小。结合图3结果,选择20、30、40 min作为正交试验的优化水平。
2.2 正交试验
在单因素实验基础上,以综合得分(S)为优化指标进行L9(34)正交试验,进一步优化玉米醇溶蛋白膜的高压湿热法改性工艺,正交试验设计及结果如表2所示。由表2中极差值R可知,各因素对玉米醇溶蛋白膜吸水率和透明度影响的主次顺序为A(成膜液体积)>B(处理温度)>C(处理时间)。
表 2 正交试验方案及结果Table 2. Orthogonal experimental scheme and results序号 A B C D S1吸水率
(%)S2透明度 S综合
得分空列 1 1 1 1 1 22.97 110.13 187.16 2 1 2 2 2 18.03 142.64 224.61 3 1 3 3 3 17.81 144.91 227.10 4 2 1 2 3 13.69 154.27 240.58 5 2 2 3 1 11.47 178.80 267.33 6 2 3 1 2 12.78 169.14 256.36 7 3 1 3 2 16.67 143.55 226.88 8 3 2 1 3 15.46 154.08 238.62 9 3 3 2 1 16.11 150.34 234.23 K1 212.957 218.207 227.380 229.573 K2 254.757 243.520 233.140 235.950 K3 233.243 239.230 240.437 235.433 R 41.800 25.313 13.057 6.377 对正交试验结果进行方差分析,结果如表3所示。由结果可知,成膜液体积对高压湿热改性玉米醇溶蛋白膜的影响最大,达到显著水平(P<0.05),与极差分析结果一致。
表 3 正交试验方差分析Table 3. Analysis of variance of orthogonal experiment方差来源 偏差平方和 df F值 F临界值 显著性 A 2621.612 2 34.830 19.000 * B 1101.149 2 14.630 19.000 C 256.895 2 3.413 19.000 D 75.268 2 1.000 19.000 误差 75.27 2 注:*表示差异显著(P<0.05)。 结合正交试验和方差分析结果可知,最优组合为A2B2C3,即玉米醇溶蛋白成膜液体积9 mL、处理温度121℃、处理时间40 min。在此条件下进行三次验证试验,测得改性玉米醇溶蛋白膜的吸水率为11.35%±0.74%,透明度为181.30±3.29。而未处理的玉米醇溶蛋白膜吸水率为148.23%±2.56%,透明度为47.51±1.30。为了直观反映高压湿热处理对玉米醇溶蛋白膜浸水后透明度的影响,对未处理和最佳改性处理条件下的玉米醇溶蛋白膜进行拍照观察,结果如图4所示。由图4可以看出,高压湿热改性前后玉米醇溶蛋白膜的透明度有较大差异。未处理的膜样品下图片较为模糊,而经过改性处理后的蛋白膜下方图像仍清晰可辨。上述结果证明,高压湿热处理能够有效降低玉米醇溶蛋白膜的吸水率,提高浸水后的透明度。
2.3 高压湿热改性玉米醇溶蛋白膜的机械特性和抗酶解性
以未处理的玉米醇溶蛋白膜作为对照,对高压湿热改性玉米醇溶蛋白膜的机械特性和抗酶解性进行表征,结果如表4所示。由机械特性结果可知,高压湿热改性后玉米醇溶蛋白膜的抗拉强度有所提高,由未处理14.82±1.57 MPa提高至16.51±2.13 MPa,这表明改性后玉米醇溶蛋白膜的力学强度有所增强。改性后断裂伸长率值由3.61%±0.46%降低至3.20%±0.18%,这可能是由于高压高温环境致使作为增塑剂的甘油部分析出所导致的。
表 4 高压湿热改性对玉米醇溶蛋白膜机械特性和抗酶解性的影响Table 4. Effect of HPHM modification on mechanical and enzymatic resistant properties of zein film功能特性与结构 未处理 高压湿热处理 机械特性 抗拉强度(MPa) 14.82±1.57 16.51±2.13 断裂伸长率(%) 3.61±0.46 3.20±0.18 抗酶解性 体外酶解率(%) 17.15±0.27 14.92±0.58 理想的细胞培养基材应具有较高的抗酶解特性以抵抗胰蛋白酶的消化作用[27]。由结果可知,改性前后玉米醇溶蛋白膜的体外酶解率由17.15%±0.27%降低至14.92%±0.58%。这表明高压湿热改性可提高玉米醇溶蛋白膜的抗酶解特性。
2.4 FT-IR光谱
通过FT-IR光谱分析高压湿热改性前后玉米醇溶蛋白膜的特征峰和二级结构的变化,结果如图5所示。由图5(a)可知,未处理的玉米醇溶蛋白膜与最佳改性条件下的膜样品FT-IR谱图整体上无较大差异。由局部放大图5(b)可知,玉米醇溶蛋白膜经过高压湿热改性后在3300 cm−1处的吸收峰有明显增强,该处对应着O-H的伸缩振动结构,这是由于高压湿热处理中的样品处于高湿度环境,膜样品自身极性增强所导致的。图5(c)中1480~1200 cm−1区间对应C-H及N-H振动以及酰胺结构的异构体,是蛋白质的指纹区[28],由结果可以看出,改性后的图谱在1437 cm−1和1238 cm−1处的峰值强度都略高于未处理。这说明高压湿热能诱导玉米醇溶蛋白氢键作用增强,部分分子发生重排,蛋白质多肽链进一步折叠和卷曲,形成更紧密的空间结构。酰胺I区(1700~1660 cm−1)主要是由于C=O伸缩振动产生,归属于N-H弯曲和C-H伸缩振动。图5(d)中改性后的玉米醇溶蛋白峰位和峰高均无明显差异,仅峰面积略有增加。这表明高压湿热改性处理对玉米醇溶蛋白的主体结构没有显著影响。
根据谱峰归属[29]将酰胺I区中复杂的重叠谱带区分为四种二级结构单元:β-折叠1640~1610 cm−1、无规卷曲1638~1640 cm−1、α-螺旋1648~1659 cm−1、β-转角1660~1697 cm−1,对峰面积进行Gaussian-Lorentzian函数拟合,并计算出各二级结构单元的相对百分含量[30],结果如表5所示。与未处理相比,改性后玉米醇溶蛋白中的β-转角的相对含量由47.45%下降至45.64%。无规则卷曲、β-折叠和α-螺旋相对含量略有增加。这表明高压湿热改性导致玉米醇溶蛋白中β-转角结构向无规则卷曲、β-折叠和α-螺旋结构转变。蛋白膜结构中β-折叠和α-螺旋含量的增加反映了膜有序结构的增强,这与吸水率和抗拉强度的结果一致,进一步证明高压湿热改性能够促使玉米醇溶蛋白网络结构更为紧密,膜结构强度也会有所增加。此外,紧密的蛋白质网络结构使酶的作用位点内嵌,提高了玉米醇溶蛋白的抗酶解性,与2.3结果一致。
表 5 高压湿热改性对玉米醇溶蛋白膜二级结构相对百分含量的影响Table 5. Effect of HPHM modification on relative percentage of secondary structure of zein film二级结构 未处理 高压湿热处理 β-折叠(%) 26.12 26.47 无规则卷曲(%) 17.07 18.33 α-螺旋(%) 9.36 9.55 β-转角(%) 47.45 45.64 3. 结论
通过单因素和正交试验确定了最佳高压湿热处理条件为:玉米醇溶蛋白成膜液体积9 mL,处理温度121 ℃,处理时间40 min。在此条件下玉米醇溶蛋白膜吸水率低至11.35%±0.74%,浸水后透明度为181.30±3.29,高压湿热改性处理能有效改善玉米醇溶蛋白膜的耐水性。各因素影响的显著程度从大到小依次为成膜液体积、处理温度、处理时间。
高压湿热改性后玉米醇溶蛋白膜的抗拉强度和抗酶解性均有提高。红外分析表明,高压湿热改性导致玉米醇溶蛋白中β-转角结构向无规则卷曲、β-折叠和α-螺旋结构转变。经过高压湿热改性后的玉米醇溶蛋白膜网络结构更紧密,耐水性有显著改善,有利于提高其在食品包装材料等领域的应用价值。
-
表 1 正交试验因素水平设计
Table 1 Factors and levels of orthogonal experiments
水平 A成膜液体积(mL) B处理温度(℃) C处理时间(min) 1 7 115 20 2 9 121 30 3 11 126 40 表 2 正交试验方案及结果
Table 2 Orthogonal experimental scheme and results
序号 A B C D S1吸水率
(%)S2透明度 S综合
得分空列 1 1 1 1 1 22.97 110.13 187.16 2 1 2 2 2 18.03 142.64 224.61 3 1 3 3 3 17.81 144.91 227.10 4 2 1 2 3 13.69 154.27 240.58 5 2 2 3 1 11.47 178.80 267.33 6 2 3 1 2 12.78 169.14 256.36 7 3 1 3 2 16.67 143.55 226.88 8 3 2 1 3 15.46 154.08 238.62 9 3 3 2 1 16.11 150.34 234.23 K1 212.957 218.207 227.380 229.573 K2 254.757 243.520 233.140 235.950 K3 233.243 239.230 240.437 235.433 R 41.800 25.313 13.057 6.377 表 3 正交试验方差分析
Table 3 Analysis of variance of orthogonal experiment
方差来源 偏差平方和 df F值 F临界值 显著性 A 2621.612 2 34.830 19.000 * B 1101.149 2 14.630 19.000 C 256.895 2 3.413 19.000 D 75.268 2 1.000 19.000 误差 75.27 2 注:*表示差异显著(P<0.05)。 表 4 高压湿热改性对玉米醇溶蛋白膜机械特性和抗酶解性的影响
Table 4 Effect of HPHM modification on mechanical and enzymatic resistant properties of zein film
功能特性与结构 未处理 高压湿热处理 机械特性 抗拉强度(MPa) 14.82±1.57 16.51±2.13 断裂伸长率(%) 3.61±0.46 3.20±0.18 抗酶解性 体外酶解率(%) 17.15±0.27 14.92±0.58 表 5 高压湿热改性对玉米醇溶蛋白膜二级结构相对百分含量的影响
Table 5 Effect of HPHM modification on relative percentage of secondary structure of zein film
二级结构 未处理 高压湿热处理 β-折叠(%) 26.12 26.47 无规则卷曲(%) 17.07 18.33 α-螺旋(%) 9.36 9.55 β-转角(%) 47.45 45.64 -
[1] 赵妍, 田晓花. 玉米醇溶蛋白研究进展[J]. 粮食与油脂,2015,28(1):11−15. doi: 10.3969/j.issn.1008-9578.2015.01.003 [2] Reza K M. Zein and zein-based nano-materials for food and nutrition applications: A review[J]. Trends in Food Science & Technology,2018,79:184−197.
[3] Lena V, Liliana L, Judith R, et al. Electrospunzein fibers incorporating poly(glycerolsebacate) for soft tissue engineering[J]. Nanomaterials,2018,8(3):150. doi: 10.3390/nano8030150
[4] Sutthasupa S, Sanda F. Macroporous scaffolds: Molecular brushes based on oligo(lactic acid)-amino acid-indomethacin conjugated poly(norbornene)s[J]. European Polymer Journal,2017:S0014305717316713.
[5] Guo Y, Liu Z, An H, et al. Nano-structure and properties of maize zein studied by atomic force microscopy[J]. Journal of Cereal Science,2005,41(3):277−281. doi: 10.1016/j.jcs.2004.12.005
[6] Momany F A, Sessa D J, Lawton J W, et al. Structural characterization of α-zein[J]. Journal of Agricultural & Food Chemistry,2006,54(2):543−7.
[7] Kim S, Xu J. Aggregate formation of zein and its structural inversion in aqueous ethanol[J]. Journal of Cereal Science,2008,47(1):1−5. doi: 10.1016/j.jcs.2007.08.004
[8] Serna C P, Filho J F. Biodegradable zein-based blend films: Structural, mechanical and barrier properties.[J]. Food Technology and Biotechnology,2015,53(3):348−353.
[9] 姚晓敏, 孙向军, 卢杰. 可食性玉米醇溶蛋白成膜工艺的研究[J]. 食品工业科技,2002(1):20−23. doi: 10.3969/j.issn.1002-0306.2002.01.006 [10] Paliwal R, Palakurthi S. Zein in controlled drug delivery and tissue engineering[J]. Journal of Controlled Release,2014:108−122.
[11] Zhang Y, Cui L, Che X, et al. Zein-based films and their usage for controlled delivery: Origin, classes and current landscape[J]. Journal of Controlled Release,2015:206−219.
[12] 李敏, 王瑶, 王双双, 等. 玉米醇溶蛋白支架生物相容性及在牙周缺损修复中的应用[J]. 中国组织工程研究,2016,20(25):3726−3731. doi: 10.3969/j.issn.2095-4344.2016.25.012 [13] 王键, 何余堂, 尹天罡, 等. 有机酸改性对玉米醇溶蛋白膜机械性能的影响[J]. 中国食品学报,2020,20(4):18−24. [14] 董爽, 宋昱珠, 吕莹, 等. 玉米醇溶蛋白/纳米TiO2抗菌复合膜的制备及性质研究[J]. 食品科技,2020,45(6):25−30. [15] 董辉. 亲水性玉米醇溶蛋白的改性研究进展[J]. 胶体与聚合物,2019,37(04):184−187. [16] Dong F, Padua G W, Wang Y. Controlled formation of hydrophobic surfaces by self-assembly of an amphiphilic natural protein from aqueous solutions[J]. Soft Matter,2013,9(25):5933−5941. doi: 10.1039/c3sm50667c
[17] 徐慧, 陈野. 电场下乙醇对玉米醇溶蛋白膜性质的影响[J]. 农业机械学报,2015,46(10):298−303. doi: 10.6041/j.issn.1000-1298.2015.10.040 [18] 徐慧, 陈野. 电场处理改善玉米醇溶蛋白膜理化性质[J]. 农业工程学报,2015,31(8):272−276. [19] Dong Shuang, Peng Guo, Chen Guiyun, et al. Study on the atmospheric cold plasma (ACP) treatment of zein film: Surface properties and cytocompatibility[J]. International Journal of Biological Macromolecules,2020,153:1319−1327. doi: 10.1016/j.ijbiomac.2019.10.268
[20] 赵宇. 低温等离子体处理zein膜及接枝PLA性质研究[D]. 天津: 天津科技大学, 2017. [21] Óscar L. Ramos, Isabel Reinas, Sara I. Silva, et al. Effect of whey protein purity and glycerol content upon physical properties of edible films manufactured therefrom[J]. Food Hydrocolloids,2013,30(1):110−122.
[22] Spasojevic L, Katona J, Bucko S, et al. Edible water barrier films prepared from aqueous dispersions of zein nanoparticles[J]. LWT-Food Science and Technology,2019:350−358.
[23] Dong Shuang, Guo Peng, Chen Ye, et al. Surface modification via atmospheric cold plasma (ACP): Improved functional properties and characterization of zein film[J]. Industrial Crops and Products,2018:124−133.
[24] 王丽娟. 玉米醇溶蛋白胶体颗粒的制备及应用研究[D]. 广州: 华南理工大学, 2014. [25] 郭兴凤, 崔和平. 玉米醇溶蛋白膜的机械性能与膜厚度的相关性研究[J]. 河南工业大学学报(自然科学版),2015(4):49−52. [26] 孙宏霞, 杨春华, 刘琳琳, 等. 红外加热对大豆蛋白质湿热变性的影响[J]. 食品工业科技,2017,38(5):196−198. [27] Garland Shaun P, McKee Clayton T, Chang Yow-Ren, et al. A cell culture substrate with biologically relevant size-scale topography and compliance of the basement membrane[J]. Langmuir,2014,30(8):2101−2108. doi: 10.1021/la403590v
[28] Zhang B, Luo Y, Wang Q. Effect of acid and base treatments on structural, rheological, and antioxidant properties of α-zein[J]. Food Chemistry,2011,124(1):210−220. doi: 10.1016/j.foodchem.2010.06.019
[29] 刘明. FTIR对丝素蛋白构象的研究[D]. 杭州: 浙江大学, 2006. [30] Yang H, Yang S, Kong J, et al. Obtaining information about protein secondary structures in aqueous solution using Fourier transform IR spectroscopy[J]. Nature Protocols,2015,10(3):382−396. doi: 10.1038/nprot.2015.024
-
期刊类型引用(3)
1. 王滋,雷桥,张文惠. 两段阶梯加热成膜工艺对蛋白基复合材料疏水性和阻隔性能的影响. 食品与机械. 2024(01): 3-10 .  百度学术
百度学术
2. 黄燃,鲍士宝. 亚硫酸钠-壳聚糖微粒对明胶膜结构和性能的影响. 食品工业科技. 2024(13): 9-16 .  本站查看
本站查看
3. 杨天学,杨哲,张军平,王铭,龚天成,张婷,侯佳奇,席北斗. 国内外可降解膜研究热点及趋势对比分析. 中国塑料. 2023(01): 119-132 .  百度学术
百度学术
其他类型引用(3)





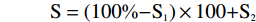
 下载:
下载:
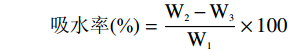
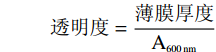
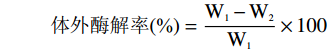





 下载:
下载:



