Ultrasound-assisted Sulfuric Acid Hydrolysis Method for Preparation and Characterization of Nanocellulose from Ginkgo Nut Shell
-
摘要: 为充分利用银杏的工业生产副产物,以银杏果壳为原料,采用超声辅助硫酸水解法制备银杏果壳纳米纤维素(nanocrystalline cellulose isolated from ginkgo nut shell,NCC-GNS)。通过单因素实验研究了硫酸质量分数、反应温度和反应时间3个因素对NCC-GNS得率的影响,并应用正交试验进行优化,获得NCC-GNS的最佳制备条件。以常规硫酸水解法(未加超声辅助)制备的纳米纤维素(nanocrystalline cellulose,NCC)为对照,通过扫描电镜(scanning electron microscopy,SEM)、透射电镜(transmission electron microscopy,TEM)、Zeta电位和动态光散射(dynamic light scattering,DLS)、X-射线衍射(x-ray diffraction,XRD)、傅里叶变换红外光谱(fourier transform infrared spectroscopy,FT-IR)、热重(thermogravimetric analysis,TGA)等分析超声辅助处理对NCC-GNS的影响。结果表明:超声功率120 W时,制备NCC-GNS的最佳条件为硫酸质量分数48%、反应温度60 ℃、反应时间25 min,最优条件下NCC-GNS得率为37.01%;超声辅助和常规硫酸水解法制备的NCC-GNS均为长棒型,尺寸无明显差异,超声辅助制备的NCC-GNS长度和直径的分布范围相对集中,长度80~180 nm、直径3.5~5.5 nm;超声辅助制备的NCC-GNS结晶度为88%,高于常规硫酸水解的75%;两种方法制备的NCC-GNS均具有较低的Zeta电位和有良好的热稳定性。综上,超声辅助硫酸水解法制备的NCC-GNS得率较高,获得的NCC-GNS结晶度高、热稳定性好,在生物质复合材料领域表现出良好的应用前景。Abstract: In order to make full use of the by-products of industrial production of ginkgo, this study used ginkgo nut shell as raw materials and adopt ultrasonic-assisted sulfuric acid hydrolysis to prepare ginkgo nut shell nanocrystalline cellulose (nanocrystalline cellulose isolated from ginkgo nut shell, NCC-GNS). The effects of three factors (e.g. sulfuric acid mass fraction, reaction temperature, reaction time) on nanocellulose yield were investigated by single-factor tests, and orthogonal experiments were used to optimize them to obtain the best preparation conditions for NCC-GNS. Taking nanocrystalline cellulose (nanocrystalline cellulose, NCC) prepared by conventional sulfuric acid hydrolysis (without ultrasound assistance) as a control, analyzed the impact of ultrasound-assisted processing on NCC-GNS through scanning electron microscopy (SEM), transmission electron microscopy (TEM), Zeta potential and dynamic light scattering (DLS), X-ray diffraction (x-ray diffraction, XRD), Fourier transform infrared spectroscopy (FT-IR), thermogravimetric analysis (TGA), etc. The results showed that the optimal conditions for preparing NCC-GNS were sulfuric acid mass fraction of 48%, reaction temperature of 60 °C, reaction time of 25 min under the condition of ultrasonic power of 120 W. The NCC-GNS yield under optimal conditions was 37.01%. The NCC-GNS prepared by ultrasonic-assisted and conventional sulfuric acid hydrolysis methods were long rods with no significant difference in size. The length and diameter of the NCC-GNS prepared by ultrasonic-assisted were relatively concentrated with a length of 80~180 nm and a diameter of 3.5~5.5 nm. The crystallinity of NCC-GNS prepared by ultrasound was 88%, which was higher than 75% of conventional sulfuric acid hydrolysis. The NCC-GNS prepared by the two methods had lower Zeta potential and good thermal stability. In summary, the yield of NCC-GNS prepared by ultrasonic-assisted sulfuric acid hydrolysis was high, and the obtained NCC-GNS had high crystallinity and good thermal stability, which was expected to have better applications in the field of biomass composite materials.
-
Keywords:
- optimization /
- ginkgo nut shell /
- nanocrystalline cellulose /
- ultrasound-assisted /
- preparation /
- characterization
-
纳米纤维素是纤维素通过酸水解或机械处理等去除无规区而获得的直径1~100 nm的超微细纤维素[1]。NCC具有比表面积大、生物相容性好、高结晶度、高杨氏模量[2-4]等特性,在医药[5-6]、复合材料[7]、食品工业[8]等邻域均有广阔的潜在应用前景。农业废物中含有大量的纤维素,来源广泛且经济是制备NCC的重要原料。但纤维素来源和制备工艺的差异对NCC产率、形态尺寸、结晶度等有一定影响,可改变其作为增强材料的性能和应用范围[9]。因此,有关不同原料和制备工艺对NCC结构影响的研究引起越来越多的关注[10-14]。
我国是银杏的发源地,现有广东南雄、江苏泰兴、江苏邳州、山东郯城、湖北安陆、浙江长兴六大银杏产业基地。2015年,我国银杏果产量1.8亿吨,约占世界总量的70%[15]。果壳作为农业废弃物通常直接燃烧或掩埋在土壤中,不仅破坏环境而且浪费资源[16]。银杏果壳约含44.34%纤维素,是良好的纤维素源,可用于NCC的制备[15]。近些年来,为了进一步提高NCC的产率,有关更加绿色高效制备前处理的研究越来越多,包括有机酸水解前处理、低共熔溶剂前处理、离子液体前处理和溶剂辅助前处理等,更多的是将几种方法结合。最近,Yang等[15,17]以银杏果壳为原料,通过酸水解结合高压均质法处理制得不同长度的NCC,并比较不同长度的NCC对Pickering乳液稳定性的影响,结果表明,小尺寸和高疏水性的NCC具有更低的界面张力,NCC可充当Pickering稳定剂并形成界面膜。而以银杏果壳为原料制备NCC的条件优化及表征鲜有报道。
本实验以银杏果壳为原料,采用超声辅助硫酸水解法制备银杏果壳NCC,以单因素为基础进行正交试验来优化其制备条件,并比较超声辅助和常规硫酸水解处理对银杏果壳NCC形态、粒径、晶体结构、红外光谱特性、热稳定性等特性的影响,以期高效地获得银杏果壳NCC,为银杏果壳废弃物的再利用和NCC的制备研究提供参考。
1. 材料与方法
1.1 材料与仪器
银杏果 2019年9月采自浙江农林大学东湖校区(剥壳,脱去内皮,洗净,果壳60 ℃烘干,粉碎后过80目筛,正己烷脱脂,4 ℃冰箱保存备用);亚氯酸钠、硫酸、氢氧化钠、冰醋酸、乙二胺四乙酸二钠、硼酸钠、十二烷基硫酸钠、乙二醇乙醚、无水磷酸氢二钠、十六烷三甲基溴化铵、十氢化萘、无水亚硫酸钠、丙酮等其他试剂 分析纯,国药集团化学试剂有限公司。
KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;TGL-20B-C高速离心机 上海安亭科学仪器厂;ZetaPALS电位及粒径分析仪 美国Brookhaven公司;Quanta 650扫描电子显微镜 美国FEI公司;JEM-1400EX透射电子显微镜 日本JEOL公司;XRD 6000 X-射线衍射、IR Prestige-21傅立叶变换红外光谱仪 日本岛津有限公司;STA 409C综合热分析仪 德国Netzsch公司;Freezone冷冻速干机 美国Labconco公司。
1.2 实验方法
1.2.1 银杏果壳纤维素提取
银杏果壳木质素和半纤维素的去除按照参考文献[10]进行。木质素去除:取银杏果壳粉,按料液比1:10加1.5%(w/v)的亚氯酸钠溶液(pH=3~4),70 ℃水浴中持续搅拌2 h,抽滤,水洗滤渣至中性,重复漂白过程5~6次,直到获得白色产物。半纤维素去除:去除木质素的银杏壳用1 mol/L NaOH溶液处理2 h(65 ℃),抽滤去除溶解的半纤维素,水洗滤渣至中性,得到化学纯化的银杏果壳纤维素(chemically purified cellulose from ginkgo nut shell, CPC-GNS),60 ℃干燥,粉碎备用。
1.2.2 主要化学成分测定
银杏果壳和银杏果壳纤维素中纤维素、木质素和半纤维素含量的采用范氏(Van Soest)法[18]测定。
1.2.3 银杏果壳纳米纤维素的制备
称取上述银杏果壳纤维素,按1:20的料液比分散于指定浓度(按质量分数计)的硫酸水溶液中,室温润胀10 min。将混合液置于恒定功率(120 W)的超声波清洗器中,不断搅拌,恒定温度下反应一定时间后,加入约20倍的4 ℃预冷去离子水终止反应。对反应产物进行高速离心(10000 r/min,10 min),弃取上清液,沉淀物用去离子水洗涤,重复3~4次离心(溶液呈弱酸性)至上层液体为乳白色的纳米纤维素悬浮液,将此悬浮液装入透析袋中,用去离子水透析至pH呈中性。透析好的NCC悬浮液经真空冷冻干燥得到银杏果壳纳米纤维素粉末。
1.2.4 NCC-GNS得率的测定
取20 mL透析至中性的NCC-GNS悬浮液于称量瓶中,105 ℃烘干至恒重,取出至干燥器内冷却30 min,称重,按下面的公式计算得率。
Y(%)=(m1−m2)V1m3V2×100 式中:Y—纳米纤维素得率,%;m1—干燥后称量瓶和样品的总质量,g;m2—称量瓶的质量,g;m3—纤维素原料的质量,g;V1—纳米纤维素悬浮液的总体积,mL;V2—量取的纳米纤维素悬浮液的体积,mL。
1.2.5 单因素实验
取一定量的银杏果壳纤维素,按方法1.2.3制备NCC。以NCC得率为指标,选取硫酸质量分数(44%、46%、48%、50%、52%)、反应温度(50、55、60、65、70 ℃)、反应时间(15、20、25、30、35 min)作为单因素条件进行实验分析,选取某一因素进行实验时,其他因素均选取固定水平(硫酸质量分数48%、反应温度60 ℃、反应时间25 min)对应的参数。
1.2.6 正交试验
为了优化实验参数,根据单因素实验的结果,以NCC得率为考核目标,采用正交试验来研究硫酸质量分数、反应温度和反应时间对NCC得率的影响,以确定最佳的制备条件,正交试验设计见表1。
表 1 正交试验因素水平表Table 1. Factors and levels of orthogonal experiment水平 因素 A硫酸质量分数(%) B反应温度(℃) C反应时间(min) 1 46 55 20 2 48 60 25 3 50 65 30 1.2.7 NCC形貌表征
1.2.7.1 SEM分析
用扫描电子显微镜进行形貌观察。取干燥备用NCC,通过导电胶沾在干净的样品台上,并进行喷金处理,设置电压为1 kV。
1.2.7.2 TEM分析
用透射电子显微镜观察NCC的形态和粒径分布情况。将镀碳支持膜铜网放置封口膜上,取一滴NCC悬浮液(1wt%)到支持膜表面,停留10 min,去除多余溶液。再将干燥后的支持膜放置封口膜上,加1滴醋酸双氧铀染液,染色约90 s,吸去多余染液,干燥3 h后进行观察。
1.2.7.3 粒径分析
从透射电镜照片中选取100个单独NCC,利用Gatan Digital Micrograph image J软件进行标记,用图片尺寸测量NCC的长度和直径,通过Origin软件来完成数据统计分析制图。
1.2.7.4 Zeta电位和DLS测定
用ZetaPALS测定NCC悬浮液的Zeta电位和颗粒尺寸,测试条件为25 ℃,测试3次,取平均值。
1.2.7.5 XRD测定
用X-射线衍射仪进行测定,Cu 靶,电压40 kV,电流30 mA,扫描范围为5°~40°,连续扫描,扫描速度2°/min,间距0.02°。用分峰法将无定型区散射与各晶面的衍射峰分开,根据各峰的面积计算结晶度Xc[19]。
1.2.7.6 FT-IR测定
用傅立叶变换红外光谱仪(KBr压片法)记录样品的红外光谱,扫描范围400~4000 cm−1。
1.2.7.7 TGA测定
用综合热分析仪分析样品的热力特性,温度范围为30~600℃,升温速率为10 ℃/min。
1.3 数据处理
实验采用 SPSS 25.0、Jade 5、Origin 2017等软件进行数据处理与统计分析。
2. 结果与分析
2.1 银杏果壳及银杏果壳纤维素主要化学成分分析
本实验使用的银杏果壳主要化学成分为:木质素(52.12 ±0.89)wt%、纤维素(36.26±1.03)wt%、半纤维素(4.52±0.91)wt%(见表2),主要化学成分与Yang等[15]报道的数据基本一致。通过亚氯酸钠和NaOH处理去除木质素和半纤维素,得到银杏果壳纤维素,其纤维素含量提高至(83.22±1.18)wt%,木质素和半纤维素的含量分别降至(5.05±0.81)wt%和(0.53±0.17)wt%,表明化学纯化得到的银杏果壳纤维素可用于NCC的制备。
表 2 银杏果壳和银杏果壳纤维素化学成分Table 2. Chemical composition of GNS and CPC-GNS成分 银杏果壳 银杏果壳纤维素 纤维素(wt%) 36.26±1.03 83.22±1.18 木质素(wt%) 52.12±0.89 5.05±0.81 半纤维素(wt%) 4.52±0.91 0.53±0.17 2.2 单因素和正交实验分析
2.2.1 硫酸质量分数对NCC-GNS得率的影响
由图1可知,随着硫酸质量分数的不断提高,NCC-GNS的得率呈先增大后减小的趋势,当硫酸的质量分数为48%时NCC-GNS的得率最高,为37.01%。硫酸浓度是NCC-GNS制备的关键因素,不同来源的纤维素结构存在差异,制备NCC-GNS所需硫酸的浓度也不尽相同。硫酸浓度较低时体系中的氢离子浓度较小水解程度较低,难将纤维水解到纳米级别,NCC-GNS得率低;随着硫酸浓度的升高,更多纤维素分子之间的糖苷键发生断裂,产生更多的纳米级纤维素,NCC-GNS得率增加。但过高的硫酸浓度又会导致纤维素的进一步水解,降解为葡萄糖,使得NCC-GNS得率降低[13]。
2.2.2 反应温度对NCC-GNS得率的影响
由图2可知,随着反应温度增加,NCC-GNS的得率先增大后减小,当反应温度为60 ℃时NCC-GNS的得率最高,为37.06%。这是因为反应温度会影响硫酸水解纤维素的效率,温度较低时酸水解反应不充分,NCC-GNS得率较低,随着反应温度的升高,促进了更多纤维素分子链上糖苷键的断裂,纤维素被水解细化到纳米级别。但过高的反应温度也降低NCC-GNS得率,甚至还会导致纤维素的炭化[20]。
2.2.3 反应时间对NCC-GNS得率的影响
由图3可知,随着反应时间的增加,NCC-GNS的得率先增大后减小,当反应时间为25 min时NCC-GNS的得率最高,为36.58%。这是因为酸解时间较短时纤维素与硫酸接触不充分,反应不完全,随着反应时间的增加,水解反应进行程度不断增大。但是过长的反应时间,纤维素在硫酸溶液中发生均相水解反应,纤维素进一步降解为葡萄糖,使得NCC-GNS得率降低。
2.2.4 正交试验结果
根据单因素实验的结果,以NCC-GNS得率为指标,采用正交试验来研究硫酸质量分数、反应温度和反应时间对NCC-GNS得率的影响,以确定最佳的制备条件。正交试验结果及直观分析见表3。
表 3 正交试验结果及直观分析Table 3. Orthogonal test results and visual analysis实验号 A硫酸质量分数(%) B反应温度(℃) C反应时间(min) 空白列 得率(%) 1 46 55 20 1 10.48 2 46 60 25 2 16.29 3 46 65 30 3 11.7 4 48 65 25 1 29.15 5 48 55 30 2 32.10 6 48 60 20 3 31.37 7 50 60 30 1 30.11 8 50 65 20 2 21.77 9 50 55 25 3 29.10 K1 12.82 23.89 21.21 23.25 K2 30.87 25.92 24.85 23.39 K3 26.99 20.87 24.64 24.06 R 18.05 5.05 3.64 0.81 由表3极差分析结果可以得出,A、B、C三个因素影响得率的主次顺序为硫酸质量分数>反应温度>反应时间,最佳条件组合为 A2B2C2,即硫酸质量分数48%、反应温度60 ℃、反应时间25 min。进一步检验3个因素的显著性程度,对实验结果进行方差分析,分析结果见表4。
表 4 方差分析表Table 4. Variance analysis table因素 Ⅲ类平方和 自由度 F值 显著性 A 541.646 2 481.634 * B 38.744 2 34.451 * C 25.059 2 22.282 * 误差 1.125 2 注:*代表差异性显著;给定显著水平α=0.05,F0.05 (2,2)=19.0,P<0.05。 由表4可知因素A、B、C对实验结果都有显著的影响。实验指标是NCC-GNS的得率,在不考虑交互作用的情况下,最优方案应取各因素最大K值所对应的水平,为A2B2C2,即硫酸质量分数48%、反应温度60 ℃、反应时间25 min。与单因素实验结果相符。在最优条件下进行验证实验,得到NCC-GNS的得率为36.89%±1.2%。
本实验采用超声辅助硫酸水解法制备NCC-GNS,主要利用超声波的空化作用提高反应效率,较高于常规硫酸水解(未加超声辅助,硫酸质量分数48%、反应温度为60 ℃、反应时间为25 min,制备NCC-GNS的得率30.16%±0.91%)。
2.3 NCC-GNS表征
为分析NCC-GNS的结构特征,在最优制备条件下,对超声辅助硫酸水解法制备的NCC-GNS和常规硫酸水解法制备的NCC就形态、粒径、Zeta电位、结晶度、红外光谱及热力学特性进行表征。
2.3.1 形貌观察
NCC-GNS和NCC的扫描电镜如图4所示,NCC-GNS呈棒状结构,纳米棒紧密的缠结在一起,形成了类似“薄膜”一样的结构。
NCC-GNS和NCC的透射电镜结果如图5所示,与扫描电镜结果一致,NCC-GNS呈棒状结构,棒状细长,纳米棒之间有粘连和堆叠的现象。但NCC-GNS较NCC分布均匀,这可能是因为超声辅助处理促进了纳米棒的分布。但NCC粒径很小,比表面积巨大,使得纳米棒之间受范德华力的影响较为明显,导致团聚和堆叠现象的发生[21]。
2.3.2 粒径分析
根据透射电镜的结果,进一步用软件Gatan Digital Micrograph image J分析NCC-GNS的长度和直径分布。由图6可知,NCC-GNS-Y长度集中在80~180 nm,直径集中在3.5~5.5 nm,而NCC-GNS-N长度和直径范围更宽,长度在40~220 nm,直径在3.5~7.5 nm。说明超声辅助处理制备的NCC-GNS尺寸更加均匀,与透射电镜观察的结果相符。NCC-GNS-Y长径比为27±3,大于以开心果壳和菠萝叶等废弃物为来源制备的NCC[11,22]。高长径比会增加界面面积,从而提高复合材料的机械性能[12]。NCC-GNS-Y直径小、长径比较高,在复合材料中有较好的应用前景。
2.3.3 Zeta电位和DLS分析
超声辅助和常规硫酸水解制备NCC-GNS悬浮液的Zeta电位和DLS分析如表5所示。NCC-GNS和NCC悬浮液Zeta电位绝对值均大于30.00 mV,表明体系比较稳定;NCC-GNS经DLS测得长度尺寸略小于NCC;经DLS测得两种方法制备的NCC-GNS长度尺寸略小于TEM的观察结果,其悬浮液的Zeta电位和粒径大小无明显差异。
表 5 Zeta电位和DLSTable 5. Zeta potential and DLSZeta电位(mV) DLS(nm) NCC-GNS −39.6±1.5 105.7±5.2 NCC −35.3±3.6 110.3±4.6 2.3.4 X-射线衍射分析
银杏果壳、银杏果壳纤维素、NCC-GNS和NCC的X-射线衍射如图7所示,样品均都在2θ=14.7°、16.4°、22.4°处出现了较强的衍射峰,分别对应的是1-10、110和200晶面,与天然纤维素Ⅰβ的特征衍射峰一致[23],表明酸水解和超声处理均未改变主晶体结构。但NCC-GNS和NCC出现了两个小峰(图7,虚线圆圈标记为1和2),可能是由于少量的纤维素II存在造成的。样品结晶度从原料GNS的52%分别提高至NCC的75%和NCC-GNS的88%。与陆红佳等[24]超声波辅助酸法制备纳米薯渣纤维素的结果相似,超声处理提高了NCC的结晶度。说明超声处理通过空化作用促进了NCC的水解分离,对NCC-GNS的结晶度产生积极的影响。
2.3.5 红外光谱分析
银杏果壳、银杏果壳纤维素、NCC和NCC-GNS的FT-IR光谱如图8所示。不同样品的特征峰没有发生明显变化,说明超声辅助硫酸水解制备NCC过程中未破坏和改变纤维素分子的主要化学结构。纯化和提取纤维素的过程,1730、1510和1270 cm−1处的光谱峰逐渐消失,表明大部分木质素和其他多糖已被去除[10],这些谱峰与酯基(C=O)的特征拉伸频率和木质素、半纤维素以及其他组分中的芳环拉伸振动有关[2]。
由图7可知,两种方法制备的NCC-GNS与NCC均存在纤维素Ⅰ的特征吸收谱带:1435、1061和895 cm−1处的吸收峰分别对应-CH2-(C6)-弯曲、吡喃糖环C-O拉伸和β-糖苷键的弯曲振动吸收峰。在1636、3420和2900 cm-1处的吸收峰分别对应吸附水中H-O-H的弯曲振动、纤维素分子中羟基的O-H的伸缩振动和亚甲基的C-H对称伸缩振动吸收峰[25]。NCC-GNS和NCC在1200 cm−1出现的小峰是硫酸基团S=O振动的结果,酸水解后NCC-GNS表面引入的带负电荷的硫酸基团[26]。
2.3.6 热重分析
银杏果壳、银杏果壳纤维素、NCC和NCC-GNS热重分析如表6和图9所示。根据以前的研究[27],第一阶段出现的热失重现象,温度低于100℃,主要与吸收水的蒸发有关;第二阶段,温度大于170℃时开始纤维素热分解过程,包括解聚、脱水和糖苷单元的分解;第三阶段热分解过程温度大于270℃,主要是纤维素分解的残余烧焦物。由DTG曲线可以看出,NCC-GNS、NCC和银杏果壳纤维素最大失重速率时的温度分别为254、309、331 ℃,NCC-GNS最大失重速率时的温度明显小于NCC和银杏果壳纤维素。原因是经硫酸水解制备的NCC-GNS表面接枝了带负电荷的磺酸基,超声辅助使得NCC-GNS的表面热暴露增大从而接入了更多的磺酸基团[28],从而降低了NCC-GNS的热解温度。由于磺酸基团的阻燃行为和NCC-GNS的高结晶度[29],在600 ℃时,NCC-GNS的残余率为24.38%,高于银杏果壳纤维素。
表 6 综合热分析结果Table 6. Result of comprehensive thermal analysis样品 第一阶段 第二阶段 第三阶段 600 ℃时的残余率(%) 起始温度(℃) 最大失重时的降解温(℃) 起始温度(℃) 最大失重时的降解温(℃) 起始温度(℃) 最大失重时的降解温(℃) 银杏果壳 30 96 178 357 386 438 25.65 银杏果壳纤维素 30 89 179 331 352 418 20.90 NCC 30 71 178 309 332 351 24.35 NCC-GNS 30 81 177 254 274 353 24.38 两种方法制备的银杏果壳纳米纤维素,它们的TG和DTG曲线变化趋势极为相似,制备的银杏果壳纳米纤维素具有良好的热稳定性,在耐热性复合材料中应用表现出一定潜能[30]。
3. 结论
本实验探究了超声辅助硫酸水解法对制备NCC-GNS的影响,并通过单因素实验和正交试验获得最优制备条件。超声辅助和常规硫酸水解法制备的银杏果壳纳米纤维素均为长棒型,尺寸无明显差异,其中超声辅助制备的银杏果壳纳米纤维素长度和直径范围相对集中。两种方法制备的银杏果壳纳米纤维素均具有较低的Zeta电位。超声辅助硫酸水解制备的银杏果壳纳米纤维素结晶度为88%,高于常规硫酸水解的75%,仍属纤维素Ⅰβ型。此制备过程中未发生化学结构的破坏和改变,纤维素分子的化学结构保持不变。超声辅助硫酸水解制备的NCC-GNS在600 ℃时仍有较高的残余率(24.38%),有良好的热稳定性。采用超声辅助硫酸水解法制备出的高得率、高长径比、高结晶度、良好热稳定性的纳米纤维素有望在食品包装、复合材料等领域中得到进一步应用。
-
表 1 正交试验因素水平表
Table 1 Factors and levels of orthogonal experiment
水平 因素 A硫酸质量分数(%) B反应温度(℃) C反应时间(min) 1 46 55 20 2 48 60 25 3 50 65 30 表 2 银杏果壳和银杏果壳纤维素化学成分
Table 2 Chemical composition of GNS and CPC-GNS
成分 银杏果壳 银杏果壳纤维素 纤维素(wt%) 36.26±1.03 83.22±1.18 木质素(wt%) 52.12±0.89 5.05±0.81 半纤维素(wt%) 4.52±0.91 0.53±0.17 表 3 正交试验结果及直观分析
Table 3 Orthogonal test results and visual analysis
实验号 A硫酸质量分数(%) B反应温度(℃) C反应时间(min) 空白列 得率(%) 1 46 55 20 1 10.48 2 46 60 25 2 16.29 3 46 65 30 3 11.7 4 48 65 25 1 29.15 5 48 55 30 2 32.10 6 48 60 20 3 31.37 7 50 60 30 1 30.11 8 50 65 20 2 21.77 9 50 55 25 3 29.10 K1 12.82 23.89 21.21 23.25 K2 30.87 25.92 24.85 23.39 K3 26.99 20.87 24.64 24.06 R 18.05 5.05 3.64 0.81 表 4 方差分析表
Table 4 Variance analysis table
因素 Ⅲ类平方和 自由度 F值 显著性 A 541.646 2 481.634 * B 38.744 2 34.451 * C 25.059 2 22.282 * 误差 1.125 2 注:*代表差异性显著;给定显著水平α=0.05,F0.05 (2,2)=19.0,P<0.05。 表 5 Zeta电位和DLS
Table 5 Zeta potential and DLS
Zeta电位(mV) DLS(nm) NCC-GNS −39.6±1.5 105.7±5.2 NCC −35.3±3.6 110.3±4.6 表 6 综合热分析结果
Table 6 Result of comprehensive thermal analysis
样品 第一阶段 第二阶段 第三阶段 600 ℃时的残余率(%) 起始温度(℃) 最大失重时的降解温(℃) 起始温度(℃) 最大失重时的降解温(℃) 起始温度(℃) 最大失重时的降解温(℃) 银杏果壳 30 96 178 357 386 438 25.65 银杏果壳纤维素 30 89 179 331 352 418 20.90 NCC 30 71 178 309 332 351 24.35 NCC-GNS 30 81 177 254 274 353 24.38 -
[1] Costa L A, Fonseca A F, Pereira F V, et al. Extraction and characterization of cellulose nanocrystals from corn stover[J]. Cellulose Chemistry Technology,2015,49(2):127−133.
[2] Rosa M F, Medeiros E S, Maimonge J A, et al. Cellulose nanowhiskers from coconut husk fibers: Effect of preparation conditions on their thermal and morphological behavior[J]. Carbohydrate Polymers,2010,81(1):83−92. doi: 10.1016/j.carbpol.2010.01.059
[3] Lou Zaixiang, Wang Hongxin, Li Jing, et al. Effect of simultaneous ultrasonic/microwave assisted extraction on the antioxidant and antibacterial activities of burdock leaves[J]. Journal of Medicinal Plants Research,2011,5(22):5370−5377.
[4] Saha M, Eskicioglu C, Marin J. Microwave ultrasonic and chemo-mechanical pretreatments for enhancing methne potential of pulp mill wastewater treatment sludge[J]. Bioresource Technology,2011,102(17):7815−1826. doi: 10.1016/j.biortech.2011.06.053
[5] Kolakovic R, Peltonen L, Laukkanen A, et al. Nanofibrillar cellulose films for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2012,82(2):308−315. doi: 10.1016/j.ejpb.2012.06.011
[6] Thennakoon M Udeni Gunathilake, Yern Chee Ching, Cheng Hock Chuah. Enhancement of curcumin bioavailability using nanocellulose reinforced chitosan hydrogel[J]. Polymers,2017,9(2):64.
[7] 郭婷, 刘雄. 纳米纤维素的改性及其在复合材料中的应用进展[J]. 食品科学,2014,35(3):285−289. doi: 10.7506/spkx1002-6630-201403056 [8] 张秀伶, 王稳航. 纳米纤维素研究及在食品工业中的应用前景[J]. 食品工业科技, 2016, 37(21): 377−382. [9] Wilson Pires Flauzino Neto, Hudson Alves Silvério, Noélio Oliveira Dantas, et al. Extraction and characterization of cellulose nanocrystals from agro-industrial residue-Soy hulls[J]. Industrial Crops and Products,2013,42:480−488. doi: 10.1016/j.indcrop.2012.06.041
[10] Saleheen Bano, Yuvraj Singh Negi. Studies on cellulose nanocrystals isolated from groundnut shells[J]. Carbohydrate Polymers,2017,157:1041−1049. doi: 10.1016/j.carbpol.2016.10.069
[11] Josh Marett, Alex Aning E, Johan Foster. The isolation of cellulose nanocrystals from pistachio shells via acid hydrolysis[J]. Industrial Crops & Products,2017,109:869−874.
[12] 刘潇, 董海洲, 侯汉学. 花生壳纳米纤维素的制备及其对淀粉膜性能的影响[J]. 中国粮油学报,2015,30(1):112−116. [13] 陈珊珊, 陶宏江, 王亚静, 等. 葵花籽壳纳米纤维素制备工艺优化及其表征[J]. 农业工程学报,2015,31(15):302−308. doi: 10.11975/j.issn.1002-6819.2015.15.041 [14] 宋孝周, 吴清林, 傅峰, 等. 农作物与其剩余物制备纳米纤维素研究进展[J]. 农业机械学报,2011,42(11):106−112. [15] Yang Ni, Li Jinwei, Fan Liuping. Production of nanocellulose with different length from ginkgo seed shells and applications for oil in water Pickering emulsions[J]. International Journal of Biological Macromolecules,2020,149:617−626. doi: 10.1016/j.ijbiomac.2020.01.263
[16] Mehdi Jonoobi, Reza Oladi, Yalda Davoudpour, et al. Different preparation methods and properties of nanostructured cellulose from various natural resources and residues: A review[J]. Cellulose,2015,22(2):935−969. doi: 10.1007/s10570-015-0551-0
[17] Yang Ni, Fan Liuping, Yong Sun. Interfacial properties of cellulose nanoparticles with different lengths from ginkgo seed shells[J]. Food Hydrocolloids,2020,109:106−121.
[18] 李华, 孔新刚, 王俊. 秸秆饲料中纤维素、半纤维素和木质素的定量分析研究[J]. 新疆农业大学学报,2007(3):65−68. doi: 10.3969/j.issn.1007-8614.2007.03.015 [19] Alfred D French, Michael Santiago Cintrón. Cellulose polymorphy, crystallite size, and the Segal Crystallinity Index[J]. Cellulose,2013,20(1):583−588. doi: 10.1007/s10570-012-9833-y
[20] Chen Wenshuai, Yu Haipeng, Liu Yixing, et al. Individualization of cellulose nanofibers from wood using high-intensity ultrasonication combined with chemical pretreatments[J]. Carbohydrate Polymers,2010,83(4):1804−1811.
[21] Liu Haiyun, Liu Dagang, Yao Fei, et al. Fabrication and properties of transparent polymethy/methacrylate/cellulose nanocrystals composites[J]. Bioresource Technology,2010,101(14):5685−5692. doi: 10.1016/j.biortech.2010.02.045
[22] Roni Marcos Dos Santos, Wilson Pires Flauzino Neto, Hudson Alves Silvério, et al. Cellulose nanocrystals from pineapple leaf, a new approach for the reuse of this agro-waste[J]. Industrial Crops and Products,2013,50:707−714. doi: 10.1016/j.indcrop.2013.08.049
[23] Hanieh Kargarzadeh, Ishak Ahmad, Ibrahim Abdullah, et al. Effects of hydrolysis conditions on the morphology, crystallinity, and thermal stability of cellulose nanocrystals extracted from kenaf bast fibers[J]. Cellulose,2012,19(3):855−866. doi: 10.1007/s10570-012-9684-6
[24] 陆红佳, 文红丽, 刘雄. 超声波辅助酸法制备纳米薯渣纤维素的工艺研究[J]. 中国粮油学报,2012,27(4):96−100. doi: 10.3969/j.issn.1003-0174.2012.04.020 [25] Ping Lu, You-Lo Hsieh. Cellulose isolation and core-shell nanostructures of cellulose nanocrystals from chardonnay grape skins[J]. Carbohydrate Polymers,2012,87(4):2546−2553. doi: 10.1016/j.carbpol.2011.11.023
[26] Ping Lu, You-Lo Hsieh. Preparation and properties of cellulose nanocrystals: Rods, spheres, and network[J]. Carbohydrate Polymers,2010,82(2):329−336. doi: 10.1016/j.carbpol.2010.04.073
[27] Araki J, Wada M, Kuga S, et al. Flow properties of microcrystalline cellulose suspension prepared by acid treatment of native cellulose[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,1998,142(1):75−82.
[28] Eliangela Morais Teixeira, Ana Carolina Corrêa, Alexandra Manzoli, et al. Cellulose nanofibers from white and naturally colored cotton fibers[J]. Cellulose,2010,17(3):595−606. doi: 10.1007/s10570-010-9403-0
[29] George Johnsy, Ramana K V, Bawa A S, et al. Bacterial cellulose nanocrystals exhibiting high thermal stability and their polymer nanocomposites[J]. International Journal of Biological Macromolecules,2011,48(1):50−57. doi: 10.1016/j.ijbiomac.2010.09.013
[30] Agustin M B, Nakatsubo F, Yano H. The thermal stability of nanocellulose and its acetates with different degree of polymerization[J]. Cellulose,2016,23(1):451−464. doi: 10.1007/s10570-015-0813-x
-
期刊类型引用(11)
1. 苏敏,李红丽,白亚敏,黄大亮,刘元,吴彦蕾. 基于液相色谱-串联高分辨质谱技术的食品中污染物检测技术研究进展. 食品安全质量检测学报. 2025(04): 44-52 .  百度学术
百度学术
2. 张君. 我国南方部分地区蓝莓种植过程中农药残留检测结果分析. 河北农机. 2024(03): 136-138 .  百度学术
百度学术
3. 张申平,秦宇,顾颖娟. QuEChERS-超高效液相色谱-四极杆/静电场轨道阱质谱法测定牛羊乳及其乳粉中21种兽药. 乳业科学与技术. 2024(02): 24-29 .  百度学术
百度学术
4. 李红洲,国果,李博岩,梁桂娟,李志远. 超高效液相色谱-四极杆-飞行时间-高分辨质谱法分析6种李果实中的代谢物差异性. 食品安全质量检测学报. 2024(11): 63-73 .  百度学术
百度学术
5. 刘宇航,于寒冰,杨红菊,马啸,温雅君,孙志伟,习佳林,熊慧勤,肖志勇. 高效液相色谱-四极杆-飞行时间质谱法快速筛查蔬菜中124种药物与个人护理品残留量. 食品安全质量检测学报. 2024(16): 175-184 .  百度学术
百度学术
6. 朱春雨,吴移山,郑景娇. 高效液相色谱-串联质谱法测定鸡蛋中地克珠利、妥曲珠利及其代谢物残留量. 食品安全质量检测学报. 2024(16): 211-218 .  百度学术
百度学术
7. 肖泳,曾小明,李政,袁列江,邓航,王淑霞,潘照. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定鸡蛋中94种农药残留. 食品与发酵工业. 2024(21): 333-340 .  百度学术
百度学术
8. 王颖怡,吴玉田,孟春杨,周贻兵,刘利亚. HPLC-MS/MS技术同时测定鸡蛋中5种抗球虫药. 食品工业. 2023(06): 291-294 .  百度学术
百度学术
9. 李晓慧,李建洪,王洪萍,金芬. 植物源性食品中化学性危害物质的色谱-质谱检测技术研究进展. 分析测试学报. 2023(10): 1357-1369 .  百度学术
百度学术
10. 周雪莼,胡婷婷,王佳慧,白静,杨颖,侯宇,张哲,张勋. 高效液相色谱-高分辨质谱法快速筛查动物源性药食同源产品中32种抗生素兽药残留. 吉林中医药. 2023(12): 1469-1474 .  百度学术
百度学术
11. 范轶欧,迟英欣,杨路平,焦燕妮. 高分辨质谱技术在环境和食品风险物质非靶向筛查检测中应用的研究进展. 预防医学论坛. 2023(12): 955-960 .  百度学术
百度学术
其他类型引用(0)





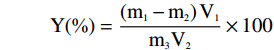
 下载:
下载:









 下载:
下载:



