Determination of 6 Kinds of Veterinary Drug Residues in Milk by Ultra Performance Liquid Chromatography-tandem Mass Spectrometry
-
摘要: 目的:建立高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)测定牛奶样品中6种兽药残留(硝碘酚腈、碘醚柳胺、氯氰碘柳胺、托曲珠利、三氯苯达唑、水杨酸钠)的检测方法。方法:样品经过乙腈溶液提取,以MAX固相萃取柱净化,采用Waters X Bridge BEH-C18色谱柱分离,流动相以乙腈和0.1%甲酸水溶液梯度洗脱,并使用电喷雾离子源,正负离子切换扫描模式进行检测,外标法定量。结果:6种兽药在0~10 ng/mL范围内呈现良好的线性关系,决定系数(R2)均大于0.995。6种兽药方法的检出限为0.06~0.18 μg/kg,方法的定量限为0.5~2.0 μg/kg。在添加量为0.5~8.0 μg/kg的加标回收实验下,6种兽药加标回收率为67.1%~105.5%,相对标准偏差均小于10%。结论:该方法前处理操作简便,分析速度快,灵敏度高,可用于牛奶样品中的兽药残留测定。
-
关键词:
- 高效液相色谱-串联质谱法 /
- 兽药残留 /
- 固相萃取 /
- 牛乳
Abstract: Objective: To establish a high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) method for the determination of six veterinary drug residues in milk samples. Methods: The sample was extracted with acetonitrile solution, purified with MAX solid phase extraction column, and separated by Waters X Bridge BEH-C18 chromatographic column. The mobile phase was eluted with a gradient of acetonitrile and 0.1% formic acid aqueous solution, and electrospray ion source was used, positive and negative ion switching scanning mode for detection, external standard method for quantification. Results: The 6 veterinary drugs showed a good linear relationship in the range of 0~10 ng/mL, and the coefficient of determination (R2) was greater than 0.995. The detection limit of the 6 veterinary drugs was 0.06~0.18 μg/kg. The limit of quantification of the method was 0.5~2.0 μg/kg. With the addition of 0.5~8.0 μg/kg in the standard recovery experiment, the recovery rates of the 6 veterinary drugs were 67.1%~105.5%, and the relative standard deviations were all less than 10%. Conclusion: This method is easy to operate, fast in analysis, and high in sensitivity. It can be used for the determination of veterinary drug residues in milk samples. -
牛奶作为天然存在的营养物质,因其丰富的营养价值,深受广大消费者的喜爱,因此牛奶的质量问题也成为全世界关注的食品安全问题。兽药在奶牛管理中的广泛使用,一方面对于防治动物疾病、改善产品质量起着重要作用,但另一方面也给牛奶带来了潜在的有害物质。兽药残留对牛奶质量和人体健康有不良影响。
肝片吸虫是一种人畜共患的食源性寄生虫[1],主要寄生于哺乳动物的胆道内。人感染后可引起肝脏损害和出血,可造成胆管阻塞、肝实质变性、黄疸等[2]。分泌毒素具有溶血作用,且肝片吸虫病的诊断较困难,往往在作出诊断之前已经造成巨大的经济损失,对社会、畜牧业和人类健康带来巨大威胁。对于此病的防治,目前主要靠抗肝片吸虫药物进行治疗,常见的包括:硝碘酚腈、碘醚柳胺、氯氰碘柳胺、三氯苯达唑等[3-4]。为了确保消费者健康和牛奶质量,欧盟以及瑞士监管当局已经制定了最大残留量(MRLs)以及设定牛奶中药物残留允许最高水平[3]。我国对于兽药残留管控也很严格,2019年相继发布GB 31650-2019《食品安全国家标准 食品中兽药最大残留量》和农业农村部公告第250号等。其中,GB 31650-2019 《食品安全国家标准 食品中兽药最大残留量》规定了硝碘酚腈、碘醚柳胺、氯氰碘柳胺、三氯苯达唑在牛奶中的限量分别为20、10、45、10 μg/kg,托曲珠利和水杨酸钠为泌乳期禁用兽残药品。因此,为加强国内乳制品中抗肝片吸虫药残留量的监管力度,建立快速、准确、灵敏、高效的抗肝片虫药多残留检测方法十分有必要,能够为监管提供有力的技术支撑,保证乳制品质量安全。
牛奶通常基质复杂,在对其检测和分析之前需要对样品进行前处理,以消除其他成分的干扰。目前国内关于乳制品抗吸虫和抗球虫药物的检测还未建立完善的方法,对于硝碘酚腈、碘醚柳胺、氯氰碘柳胺、托曲珠利、三氯苯达唑和水杨酸钠,国内尚无相关的食品检测标准。但若能从代表样品中一次获得更多的检测数据,将是未来牛奶预处理技术和检测的一个重要发展方向。
目前,国内关于乳制品中抗吸虫和抗球虫药物的检测还未建立完善的方法,对于硝碘酚腈、碘醚柳胺、氯氰碘柳胺、托曲珠利、三氯苯达唑和水杨酸钠,国内尚无相关的食品检测标准。在乳制品中兽药残留常用分析方法有以下几种:微生物法(纸片法[4-5]、四平皿法[6]、氯化三苯基四氮唑法[7]、微生物受体检测[8-9]),免疫学法(酶联免疫法[10-12]、胶体金检测技术[13-15]、荧光定量检测[16-17]、化学发光免疫检测[18-19]、放射免疫分析[20]、生物芯片检测技术[21]),胶体金免疫层析法[22],生物传感器法[23],物理化学方法(薄层色谱法[24]、液相色谱法[25-26]、气相色谱法[27-28]、液相色谱串联质谱法[29-30])。但微生物法和免疫法检测针对性差,假阳性高,液相色谱法溶剂消耗量大,对环境不友好,气相色谱法所检测物质需要易挥发,有一定局限性,目前的主流设备仍为液相色谱串联质谱。
因此,本文采用高效液相色谱-三重四极杆质谱(HPLC-MS/MS)为检测手段,对牛奶中6种兽药(硝碘酚腈、碘醚柳胺、氯氰碘柳胺、托曲珠利、三氯苯达唑和水杨酸钠)定量分析方法进行研究及确证,比较不同的前处理方法,优化色谱条件和质谱条件,本实验目的旨在建立一种操作简单、快速、准确,能够满足牛奶中6种兽药残留的同时测定的方法,为动物源食品中兽药残留的监测提供有效的方法支撑。
1. 材料与方法
1.1 材料与仪器
生牛乳 市售;氯氰碘柳胺标准品(纯度98.18%)、碘醚柳胺标准品(纯度99.10%)、三氯苯达唑标准品(纯度98.65%)、水杨酸钠标准品(纯度99.97%)、硝碘酚腈标准品(纯度98.85%)、托曲珠利标准品(纯度99.7%) Dr·Ehrenstorfer;甲醇、乙腈、甲酸、丙酮、乙酸乙酯(色谱纯) 赛默飞世尔科技有限公司;氨水 国药集团化学试剂有限公司;Oasis MAX固相萃取柱(60 mg/3 mL)、Oasis HLB(150 mg/3 mL)、Oasis Prime HLB(150 mg/3 mL)、Waters XBridge BEH-C18色谱柱(50 mm×2.1 mm, 1.7 µm) 美国Waters公司;0.22 μm滤膜(有机系) 北京百奥莱博科技有限公司;实验用水 均为超纯水(18.0 MΩ·cm)。
TQ-XS高效液相色谱-三重四极杆串联质谱仪 美国Waters公司;Milli-Q ZMQS50001超纯水机 美国密理博公司;LYNX4000高速落地离心机 中国赛默飞世尔科技有限公司;ME203E/02电子分析天平 瑞士梅特勒-托利多公司;涡旋混合器 德国IKA公司;CP2600 超声仪 美国CREST公司;N-EVAP112氮吹仪 美国Organamation Assiciates Jnc公司;Visiprep™ SPE固相萃取装置 德国SUPELCO公司。
1.2 实验方法
1.2.1 标准溶液配制
分别称取适量的硝碘酚腈、碘醚柳胺、氯氰碘柳胺、托曲珠利、三氯苯达唑和水杨酸钠标准品于10 mL容量瓶中,用甲醇稀释定容至刻度,分别配制成浓度为1 mg/mL的标准储备溶液,−20 ℃保存备用。
分别准确移取每种兽药标准储备液1 mL于10 mL容量瓶中,用甲醇稀释定容至刻度,配制成浓度为100 μg/mL的标准中间液。
1.2.2 样品制备
取经混匀的生乳1.00 g(精确至0.01 g)于50 mL离心管中,加入5 mL乙腈溶液[31],涡旋振荡10 min,10000 r/min条件下离心5 min,取上清液至另一离心管,并加入1 mL 5%氨水,涡旋混匀得到待净化液。
1.2.3 样品前处理过程
分别用3 mL乙腈和3 mL 5%氨水溶液对Oasis MAX 3 mL柱进行活化,将待净化液(1.2.2制备溶液)上样至固相萃取柱中,分别用3 mL水和3 mL甲醇对固相萃取柱进行淋洗,弃去全部淋出液。然后用4 mL洗脱液进行洗脱,收集全部洗脱液于干净的离心管中。
将洗脱液在40 ℃下氮吹至近干,加入乙腈水溶液稀释并定容至1 mL。再将其置于涡旋混合器上,涡旋混合1 min,取上清液经0.22 μm有机系滤膜过滤,待HPLC-MS/MS检测分析。
1.2.4 液相条件
色谱柱:Waters XBridge BEH-C18(1.7 μm,2.1 mm×50 mm)或具有同等性能的色谱柱;柱温:30 ℃;流速:0.3 mL/min;进样量:2 μL;流动相A:0.1% 甲酸水,B:乙腈,流动相梯度洗脱程序见表1。
表 1 梯度洗脱程序Table 1. Gradient elution condition时间(min) 流速(mL/min) 0.1%甲酸水(%) 乙腈(%) 0.0 0.3 70 30 6.0 0.3 0 100 8.00 0.3 0 100 8.01 0.3 70 30 10.0 0.3 70 30 1.2.5 质谱条件
离子源为电喷雾离子源(ESI);检测方式为多离子反应监测(MRM);毛细管电压为2.00 kV;锥孔反吹气为150 L/h;脱溶剂气温度为450 ℃、流量为900 L/h。不同兽药对应的离子选择参数见表2。
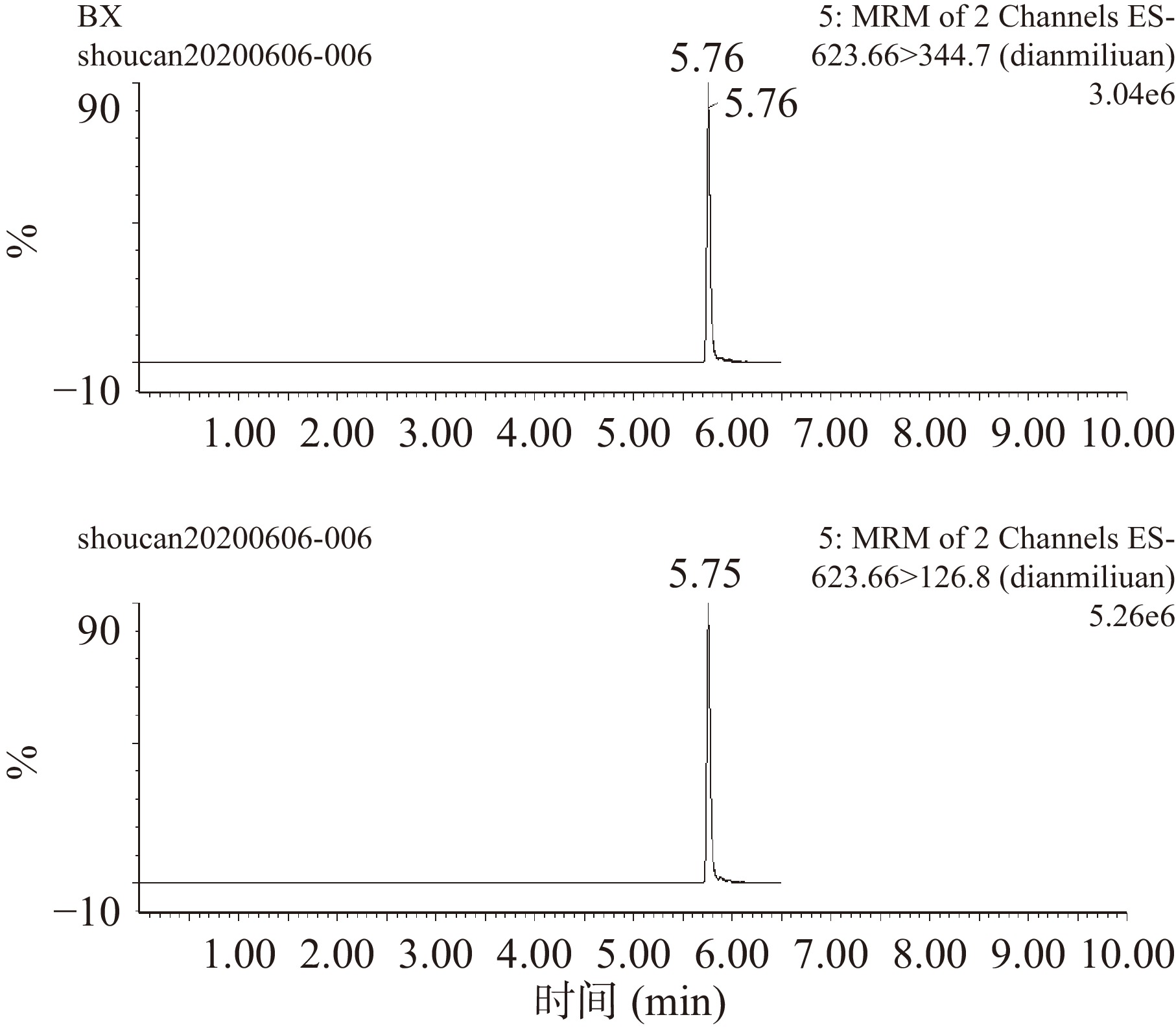
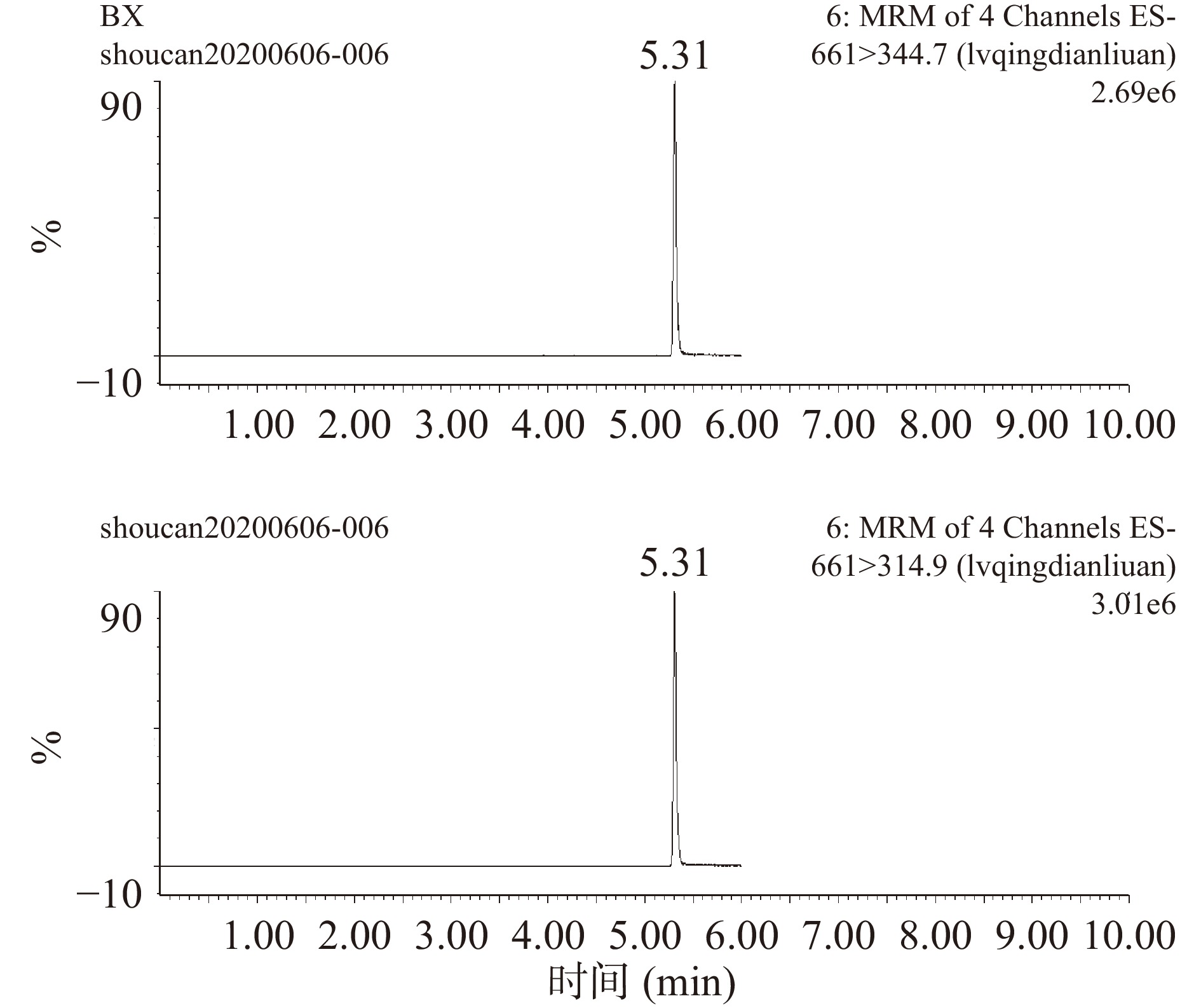
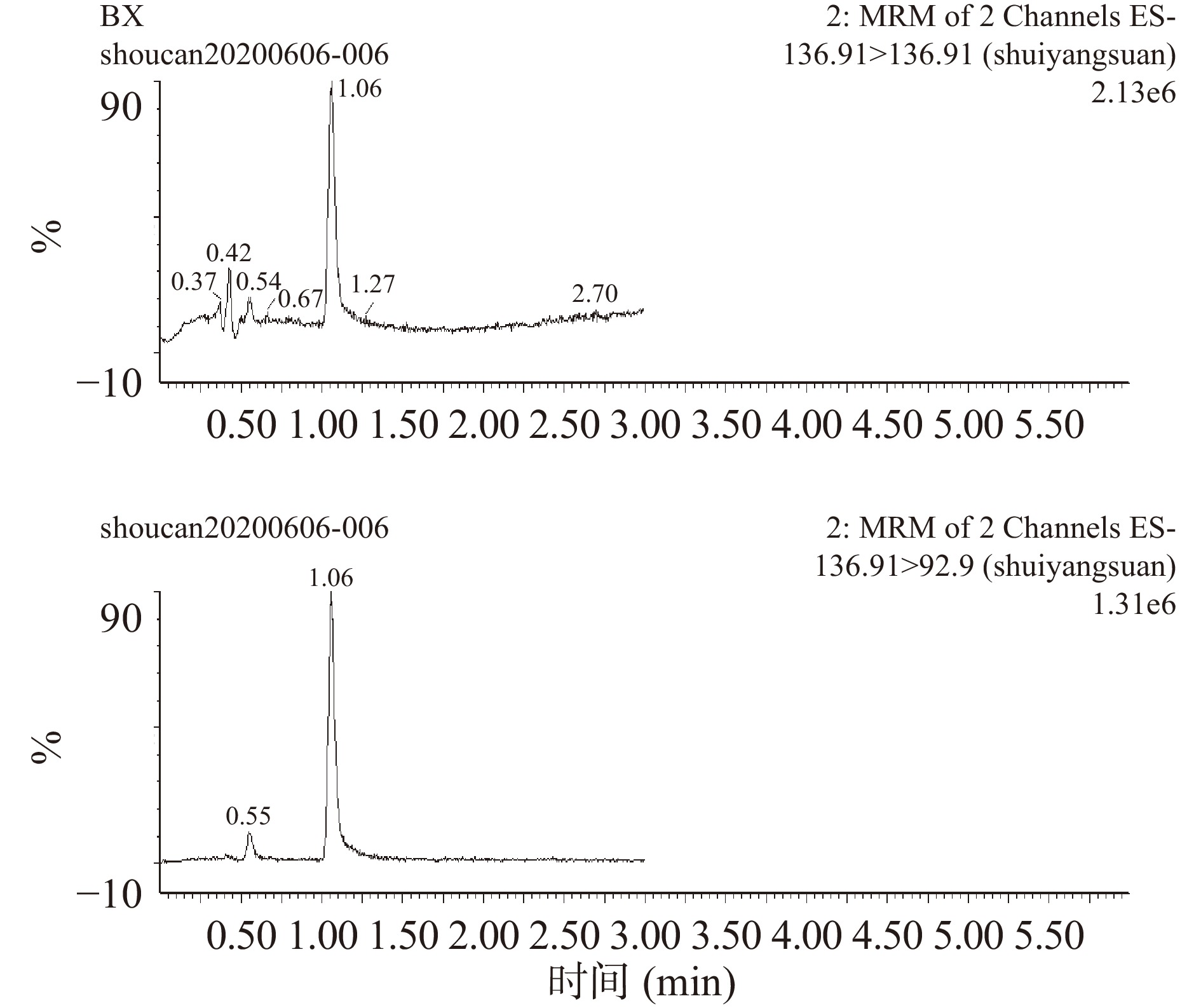
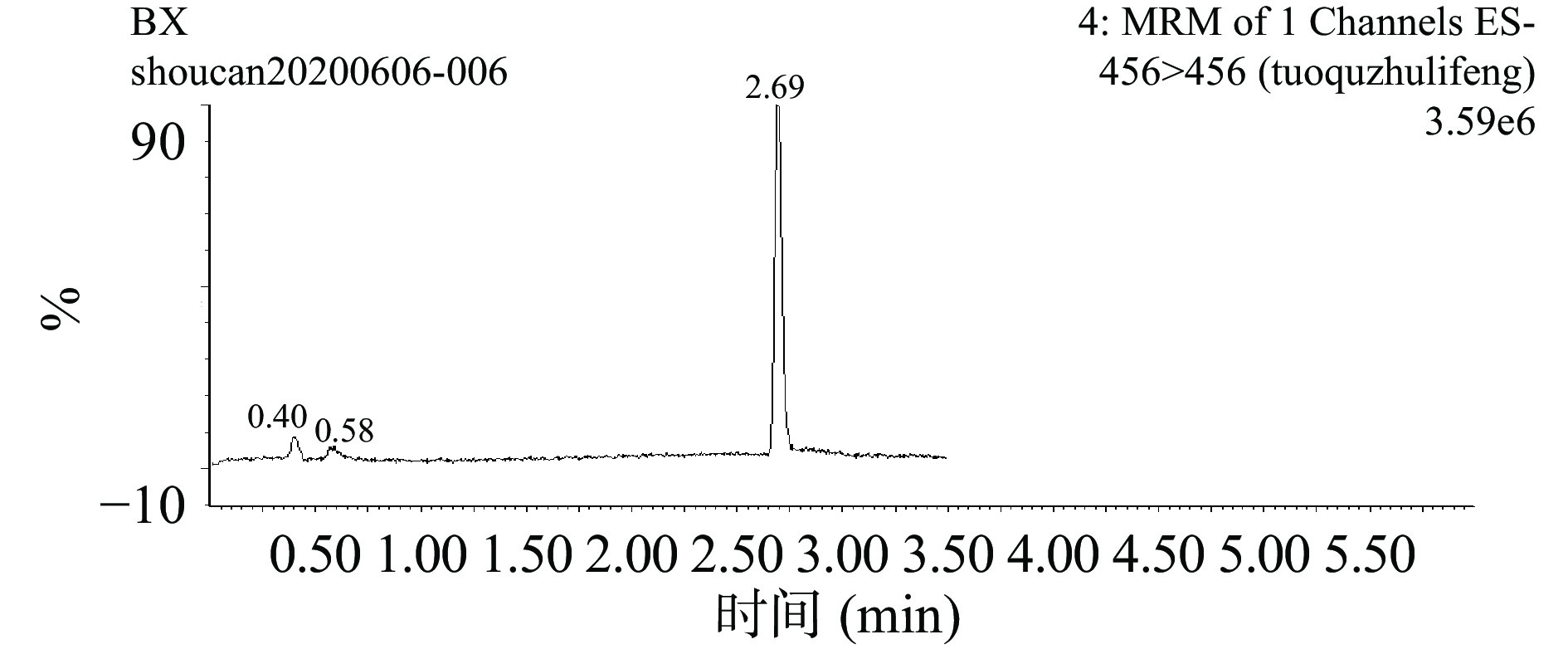
表 2 不同兽药对应的离子选择参数Table 2. Ion selection parameters corresponding of different veterinary drugs兽药组分 保留时间(min) 母离子(m/z) 子离子(m/z) 锥孔电压(V) 去簇电压(V) 电离模式 三氯苯达唑 3.21 358.96 344.07* 35 25 ES+ 358.96 274.06 35 35 硝碘酚腈 1.80 288.8 161.8* 55 33 ES− 288.8 126.7 50 20 碘醚柳胺 5.76 623.66 344.7* 70 43 ES− 623.66 126.8 70 33 氯氰碘柳胺 5.31 661.0 344.7* 40 35 ES− 661.0 314.9 40 35 水杨酸钠 1.06 136.91 161.98* 20 15 ES− 136.91 187.97 20 15 托曲珠利 2.69 456 456* 25 15 ES− 注:*表示该物质的定量离子。 1.3 数据处理
利用Origin 9.0软件进行实验数据处理。
2. 结果与分析
2.1 样品前处理方法的优化
2.1.1 提取溶剂的选择
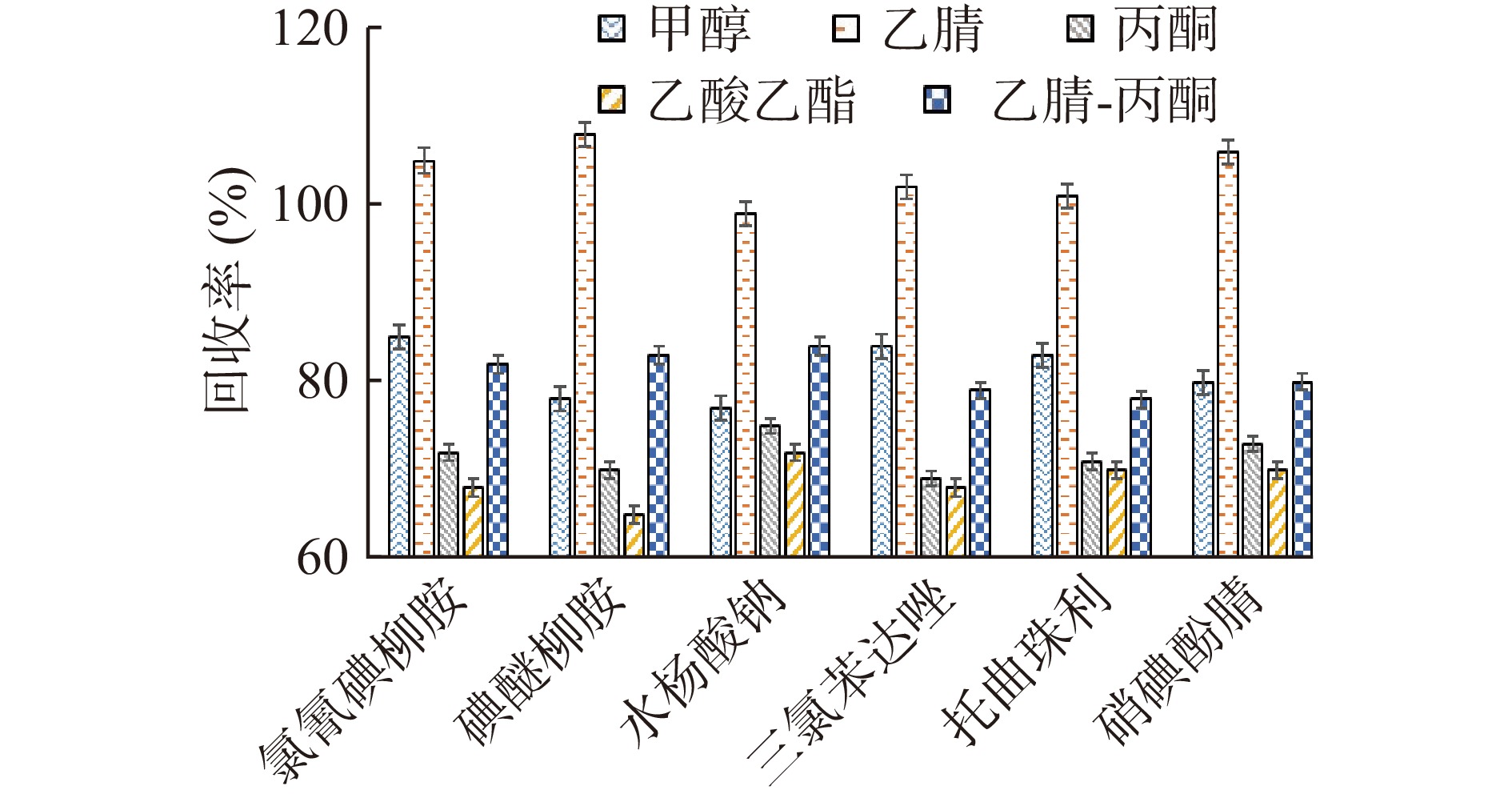
根据6种兽药的结构特性和化学性质,分别加入5 mL甲醇、乙腈、丙酮、乙酸乙酯和乙腈-丙酮(65:35),(除乙腈-丙酮为复合溶液提取外,其余为纯溶液提取,所用均为色谱纯)对牛奶进行提取,随后将提取液进行过柱净化,氮吹至近干,用乙腈溶液溶解定容后过仪器进行分析,考察不同提取溶剂对牛奶中兽药提取效率的影响。
不同提取溶剂对6种兽药提取效果分析如图1所示。结果表明,采用丙酮、乙酸乙酯和乙腈-丙酮提取时,目标分析物的回收率为68%~84%,采用甲醇提取时,回收率为78%~85%,但提取液经离心后仍浑浊,基质效应明显,采用乙腈提取时,回收率为99%~108%,且杂质含量较少,因此,最终选择乙腈溶液作为提取溶剂。
2.1.2 净化柱的选择
实验选取MAX柱、Waters Prime HLB 柱和HLB柱三种固相萃取柱,分别采用上述净化方法,对加标的牛奶样品,经乙腈萃取后,进行净化,考察不同净化方法对6种目标物的影响。结果表明(表3),MAX柱对6种兽药保留较好,回收率为92.4%~108.9%,而采用Waters Prime HLB柱和HLB柱进行净化,对6种兽药目标物不能很好地保留,加标回收率分别为78.6%~84.6%和75.9%~89.4%,因此最终选择MAX柱作为净化柱。
2.1.3 洗脱溶剂的选择
洗脱液分别用5%-甲酸乙腈溶液和5%甲酸-甲醇溶液进行洗脱,以对6种兽药残留药物的回收率影响为评判标准。试验结果表明(表4),5%甲酸-甲醇溶液作为洗脱液时,目标物不能完全洗脱下来,回收率为64.3%~82.7%,当洗脱液为5%-甲酸乙腈时,目标物可以被完全洗脱,回收率为94.8%~109.3%。因此,最终选择5%-甲酸乙腈溶液作为洗脱液。
表 4 不同洗脱溶剂的回收率Table 4. Recovery rate of different elution solvents洗脱液 项目类别 回收率(%) 5%甲酸-甲醇溶液 碘醚柳胺 67.8 氯氰碘柳胺 76.3 水杨酸钠 65.6 托曲珠利 64.3 硝碘酚腈 82.7 三氯苯达唑 77.6 5%-甲酸乙腈 碘醚柳胺 99.1 氯氰碘柳胺 98.6 水杨酸钠 102.5 托曲珠利 94.8 硝碘酚腈 109.3 三氯苯达唑 99.2 2.2 色谱条件的优化
2.2.1 流动相的选择
本实验采用乙腈、甲醇作为有机相,以纯水、5 mmol/L乙酸铵、0.1%甲酸水、0.1%氨水分别作为水相进行试验,考察对6种目标物色谱分离效果和质谱响应强度的影响。结果表明,选用甲醇作为有机相,质谱响应强度比乙腈低,且有基质效应,因此选择乙腈作为有机相。当选用纯水或5 mmol/L乙酸铵作为水相时,目标物的峰型较差,基质噪音也较大;选用0.1%氨水时,目标物峰有拖尾现象;选用0.1%甲酸水时,目标物质谱响应强度高,且峰型较好,分离度效果佳。故本实验最终采用乙腈-0.1%甲酸水溶液作为流动相。
在上述色谱分离条件和质谱测定条件下,6种兽药混合标准品标准液中碘醚柳胺、氯氰碘柳胺、水杨酸钠、托曲珠利、硝碘酚腈和三氯苯达唑的MRM色谱图见图2~图7。
2.3 方法学验证
2.3.1 基质效应分析
本文通过提取空白样品后在基质中加标,定量测定空白基质提取液与纯溶剂中同浓度兽药的离子响应强度,通过比值来评价基质效应(ME:ME=B/A),A表示纯溶剂中分析物的峰面积,B表示基质溶液中分析物的峰面积。若ME<1,则表明基质对分析物产生的响应是抑制作用;若ME>1,表明基质可以增强分析物的响应值。经过试验,结果如表5所示,ME结果范围是0.27~0.65,表明牛奶基质对6种兽药均为抑制作用,故采用基质加标曲线校正回收率,以降低基质效应的影响。
表 5 不同物质的基质效应Table 5. Matrix effect of different substances项目类别 ME 碘醚柳胺 0.34 氯氰碘柳胺 0.27 水杨酸钠 0.50 托曲珠利 0.65 硝碘酚腈 0.48 三氯苯达唑 0.59 2.3.2 标准曲线与线性范围
配制混合标准溶液,对质量浓度0.0、0.5、1.0、2.0、5.0、10.0 ng/mL的混标标准工作液,在优化的分析条件下进行上机检测,以目标物的峰面积为纵坐标,以混标标准工作溶液质量浓度为横坐标,建立标准曲线方程。结果表明,6种兽药在浓度0.0~10.0 ng/mL范围内,均呈现良好的线性关系(R2>0.995)。各个物质兽药线性回归方程和相关系数见表6。
表 6 6种兽药的回归方程、决定系数Table 6. Regression equation and determination coefficient of 6 kinds of veterinary drugs序号 化合物 回归方程 决定系数(R2) 1 三氯苯达唑 Y=68101.5X−7364.99 0.997051 2 碘醚柳胺 Y=5810.77X−408.196 0.996118 3 硝碘酚腈 Y=3197.98X−372.555 0.997051 4 氯氰碘柳胺 Y=4564.52X−212.032 0.997202 5 水杨酸钠 Y=4597.82X−115.005 0.997213 6 托曲珠利 Y=6719.78X−156.499 0.996632 2.3.3 检测限与定量限
采用空白样品中添加目标化合物的方法,当加标浓度为0.5 μg/kg时,三氯苯达唑、硝碘酚腈、碘醚柳胺、氯氰碘柳胺的信号与噪声比值分别为146.962、36.761、170.411、170.411;当加标浓度为2 μg/kg时,水杨酸钠、托曲珠利的信号与噪声比值分别为12.625、16.991,S/N>10,加标回收率符合要求(如表3所示),满足定量要求;经不断梯度稀释标准工作液进行加标,通过前处理上机检测,当S/N>3时,满足定性要求;由此确定各物质的检出限与定量限,具体结果见表7。
表 3 不同净化柱的回收率Table 3. Recovery rates of different purification columns净化柱 项目类别 回收率(%) MAX柱 碘醚柳胺 92.4 氯氰碘柳胺 96.3 水杨酸钠 95.8 托曲珠利 99.2 硝碘酚腈 108.9 三氯苯达唑 97.6 Waters Prime
HLB柱碘醚柳胺 79.2 氯氰碘柳胺 80.7 水杨酸钠 80.5 托曲珠利 78.6 硝碘酚腈 84.6 三氯苯达唑 80.2 HLB柱 碘醚柳胺 78.9 氯氰碘柳胺 85.8 水杨酸钠 89.4 托曲珠利 75.9 硝碘酚腈 88.4 三氯苯达唑 80.3 表 7 6种兽药的检出限、定量限Table 7. Limits of detection and limits of quantitation of 6 kinds of veterinary drugs化合物 定量限(μg/kg) 检出限(μg/kg) 三氯苯达唑 0.5 0.09 水杨酸钠 2.0 0.18 硝碘酚腈 0.5 0.06 托曲珠利 2.0 0.16 碘醚柳胺 0.5 0.06 氯氰碘柳胺 0.5 0.06 2.3.4 精密度与回收率
在牛奶空白样品中进行低、中、高3个水平的加标回收实验,每个水平进行6次平行试验,三氯苯达唑、硝碘酚腈、碘醚柳胺、氯氰碘柳胺添加水平分别为0.5、1.0、2.0 μg/kg,水杨酸钠和托曲珠利添加水平分别为2.0、4.0、8.0 μg/kg。结果表明(表8),6种兽药在牛奶基质中的平均回收率为67.1%~105.5%,相对标准偏差(RSD)均小于10%。
表 8 6种兽残物质的加标回收率和精密度Table 8. Recovery and precision of 6 kinds of veterinary drugs项目类别 加标水平(μg/kg) 1 2 3 4 5 6 平均值 RSD(%) 回收率(%) 三氯苯达唑 0.5 0.415 0.417 0.420 0.497 0.478 0.482 0.452 8.4 90.3 1.0 0.901 0.878 0.886 0.852 0.984 0.968 0.912 5.8 91.0 2.0 1.45 1.47 1.47 1.47 1.58 1.60 1.51 4.3 75.3 硝碘酚腈 0.5 0.400 0.371 0.463 0.477 0.444 0.452 0.43 9.3 86.9 1.0 0.828 0.826 0.822 0.750 0.839 0.825 0.82 4.0 81.5 2.0 1.27 1.42 1.19 1.40 1.36 1.43 1.34 7.2 67.1 水杨酸钠 2.0 1.58 1.89 1.84 1.92 1.70 1.70 1.77 7.6 88.5 4.0 3.07 3.03 3.08 3.02 3.25 3.26 3.12 3.5 77.9 8.0 6.83 6.67 6.66 6.67 6.68 6.74 6.71 1.0 83.8 碘醚柳胺 0.5 0.493 0.428 0.457 0.473 0.499 0.497 0.47 5.9 94.9 1.0 0.825 0.818 0.827 0.986 0.916 0.815 0.86 8.2 86.4 2.0 2.09 2.05 2.06 2.09 2.04 2.03 2.06 1.3 102.8 氯氰碘柳胺 0.5 0.459 0.458 0.469 0.451 0.405 0.410 0.44 6.2 88.4 1.0 0.867 0.837 0.898 0.802 0.847 0.872 0.85 3.9 85.3 2.13 2.12 2.07 2.09 2.08 2.17 2.11 1.8 2.13 105.5 托曲珠利 2.0 1.40 1.26 1.38 1.41 1.26 1.40 1.35 5.4 67.6 4.0 3.13 3.07 2.85 2.89 2.85 2.94 2.96 4.0 73.9 8.0 7.73 7.43 7.68 7.86 7.42 7.24 7.56 3.1 94.5 3. 结论
本文利用超高效液相色谱-质谱法结合固相萃取法,通过优化前处理实验条件、液相条件和质谱条件,建立了同时测定牛奶基质中6种兽药残留物质检测方法。其中,三氯苯达唑、水杨酸钠、硝碘酚腈、托曲珠利、碘醚柳胺、氯氰碘柳胺的检出限分别为0.09、0.18、0.06、0.16、0.06、0.06 μg/kg,定量限为0.5、2.0、0.5、2.0、0.5、0.5 μg/kg。该方法前处理过程简单、灵敏度高、检测效率高,可满足牛奶基质中对目标化合物进行准确定性和定量分析的要求,为动物源性食品中兽药残留的监管提供了有效的方法支撑。
-
表 1 梯度洗脱程序
Table 1 Gradient elution condition
时间(min) 流速(mL/min) 0.1%甲酸水(%) 乙腈(%) 0.0 0.3 70 30 6.0 0.3 0 100 8.00 0.3 0 100 8.01 0.3 70 30 10.0 0.3 70 30 表 2 不同兽药对应的离子选择参数
Table 2 Ion selection parameters corresponding of different veterinary drugs
兽药组分 保留时间(min) 母离子(m/z) 子离子(m/z) 锥孔电压(V) 去簇电压(V) 电离模式 三氯苯达唑 3.21 358.96 344.07* 35 25 ES+ 358.96 274.06 35 35 硝碘酚腈 1.80 288.8 161.8* 55 33 ES− 288.8 126.7 50 20 碘醚柳胺 5.76 623.66 344.7* 70 43 ES− 623.66 126.8 70 33 氯氰碘柳胺 5.31 661.0 344.7* 40 35 ES− 661.0 314.9 40 35 水杨酸钠 1.06 136.91 161.98* 20 15 ES− 136.91 187.97 20 15 托曲珠利 2.69 456 456* 25 15 ES− 注:*表示该物质的定量离子。 表 4 不同洗脱溶剂的回收率
Table 4 Recovery rate of different elution solvents
洗脱液 项目类别 回收率(%) 5%甲酸-甲醇溶液 碘醚柳胺 67.8 氯氰碘柳胺 76.3 水杨酸钠 65.6 托曲珠利 64.3 硝碘酚腈 82.7 三氯苯达唑 77.6 5%-甲酸乙腈 碘醚柳胺 99.1 氯氰碘柳胺 98.6 水杨酸钠 102.5 托曲珠利 94.8 硝碘酚腈 109.3 三氯苯达唑 99.2 表 5 不同物质的基质效应
Table 5 Matrix effect of different substances
项目类别 ME 碘醚柳胺 0.34 氯氰碘柳胺 0.27 水杨酸钠 0.50 托曲珠利 0.65 硝碘酚腈 0.48 三氯苯达唑 0.59 表 6 6种兽药的回归方程、决定系数
Table 6 Regression equation and determination coefficient of 6 kinds of veterinary drugs
序号 化合物 回归方程 决定系数(R2) 1 三氯苯达唑 Y=68101.5X−7364.99 0.997051 2 碘醚柳胺 Y=5810.77X−408.196 0.996118 3 硝碘酚腈 Y=3197.98X−372.555 0.997051 4 氯氰碘柳胺 Y=4564.52X−212.032 0.997202 5 水杨酸钠 Y=4597.82X−115.005 0.997213 6 托曲珠利 Y=6719.78X−156.499 0.996632 表 3 不同净化柱的回收率
Table 3 Recovery rates of different purification columns
净化柱 项目类别 回收率(%) MAX柱 碘醚柳胺 92.4 氯氰碘柳胺 96.3 水杨酸钠 95.8 托曲珠利 99.2 硝碘酚腈 108.9 三氯苯达唑 97.6 Waters Prime
HLB柱碘醚柳胺 79.2 氯氰碘柳胺 80.7 水杨酸钠 80.5 托曲珠利 78.6 硝碘酚腈 84.6 三氯苯达唑 80.2 HLB柱 碘醚柳胺 78.9 氯氰碘柳胺 85.8 水杨酸钠 89.4 托曲珠利 75.9 硝碘酚腈 88.4 三氯苯达唑 80.3 表 7 6种兽药的检出限、定量限
Table 7 Limits of detection and limits of quantitation of 6 kinds of veterinary drugs
化合物 定量限(μg/kg) 检出限(μg/kg) 三氯苯达唑 0.5 0.09 水杨酸钠 2.0 0.18 硝碘酚腈 0.5 0.06 托曲珠利 2.0 0.16 碘醚柳胺 0.5 0.06 氯氰碘柳胺 0.5 0.06 表 8 6种兽残物质的加标回收率和精密度
Table 8 Recovery and precision of 6 kinds of veterinary drugs
项目类别 加标水平(μg/kg) 1 2 3 4 5 6 平均值 RSD(%) 回收率(%) 三氯苯达唑 0.5 0.415 0.417 0.420 0.497 0.478 0.482 0.452 8.4 90.3 1.0 0.901 0.878 0.886 0.852 0.984 0.968 0.912 5.8 91.0 2.0 1.45 1.47 1.47 1.47 1.58 1.60 1.51 4.3 75.3 硝碘酚腈 0.5 0.400 0.371 0.463 0.477 0.444 0.452 0.43 9.3 86.9 1.0 0.828 0.826 0.822 0.750 0.839 0.825 0.82 4.0 81.5 2.0 1.27 1.42 1.19 1.40 1.36 1.43 1.34 7.2 67.1 水杨酸钠 2.0 1.58 1.89 1.84 1.92 1.70 1.70 1.77 7.6 88.5 4.0 3.07 3.03 3.08 3.02 3.25 3.26 3.12 3.5 77.9 8.0 6.83 6.67 6.66 6.67 6.68 6.74 6.71 1.0 83.8 碘醚柳胺 0.5 0.493 0.428 0.457 0.473 0.499 0.497 0.47 5.9 94.9 1.0 0.825 0.818 0.827 0.986 0.916 0.815 0.86 8.2 86.4 2.0 2.09 2.05 2.06 2.09 2.04 2.03 2.06 1.3 102.8 氯氰碘柳胺 0.5 0.459 0.458 0.469 0.451 0.405 0.410 0.44 6.2 88.4 1.0 0.867 0.837 0.898 0.802 0.847 0.872 0.85 3.9 85.3 2.13 2.12 2.07 2.09 2.08 2.17 2.11 1.8 2.13 105.5 托曲珠利 2.0 1.40 1.26 1.38 1.41 1.26 1.40 1.35 5.4 67.6 4.0 3.13 3.07 2.85 2.89 2.85 2.94 2.96 4.0 73.9 8.0 7.73 7.43 7.68 7.86 7.42 7.24 7.56 3.1 94.5 -
[1] 杨柱昌. 绵羊肝片吸虫病的诊断与治疗[J]. 中国畜牧兽医文摘,2017,33(11):185. [YANG Z C. Diagnosis and treatment of sheep liver fascioniasis[J]. Chinese Animal Husbandry and Veterinary Digest,2017,33(11):185. [2] 杨维维, 田志娟, 张月娟, 等. 羊肝片吸虫病的防治[J]. 中国畜牧兽医文摘,2018,34(4):138. [YANG W W, TIAN Z J, ZHANG Y J, et al. Prevention and treatment of sheep liver fascioniasis[J]. Chinese Animal Husbandry and Veterinary Digest,2018,34(4):138. [3] 张吉丽, 朱阵, 李冰, 等. 肝片吸虫病的研究进展[J]. 黑龙江畜牧兽医,2016(11):58−61,65. [ZHANG J L, ZHU Z, LI B, et al. Advances in the study of hepatic fascioniasis[J]. Heilongjiang Animal Husbandry and Veterinary Medicine,2016(11):58−61,65. [4] 石润佳, 韩荣伟, 王军, 等. 华北地区乳房炎奶样中大肠杆菌的耐药性研究[J]. 现代食品科技,2019(5):274−280. [SHI R J, HAN R W, WANG J, et al. Antimicrobial resistance of Escherichia coli in milk samples of mastitis in North China[J]. Modern Food Technology,2019(5):274−280. [5] 林修光, 寇运同, 贾臻, 等. 用标准纸片法快速测定鸡肉中四环素族残留量[J]. 口岸卫生控制,2001,6(3):19−20. [LIN X G, KOU Y T, JIA Z, et al. Rapid determination of tetracycline residues in chicken by standard disk method[J]. Port Health Control,2001,6(3):19−20. doi: 10.3969/j.issn.1008-5777.2001.03.008 [6] CURRIE D, LYNAS L, KENNEDY D G, et al. Evaluation of a modified EC four plate method to detect antimicrobial drugs[J]. Food Additives and Contaminants,1998,15(6):651−660. doi: 10.1080/02652039809374694
[7] TUMINI M, NAGEL O G, ALTHAUS R L. Microbiological bioassay using Bacillus pumilus to detect tetracycline in milk[J]. The Journal of Dairy Research,2015,82(2):248−255. doi: 10.1017/S0022029915000138
[8] 顾欣. 牛奶中青霉素残留的微生物学检测方法研究进展[J]. 中国兽药杂志,2007,41(1):40−45. [GU X. Research progress of microbial detection methods for penicillin residue in milk[J]. Chinese Journal of Veterinary Drugs,2007,41(1):40−45. doi: 10.3969/j.issn.1002-1280.2007.01.013 [9] 舒黛廉, 王珏. 乳及乳制品中抗生素残留微生物检测法研究进展及其控制措施[J]. 中国畜牧兽医,2008,35(1):74−77. [SHU D L, WANG J. Research progress and control measures of microbial detection of antibiotic residues in milk and dairy products[J]. China Animal Husbandry and Veterinary Science,2008,35(1):74−77. [10] 郑晶, 黄晓蓉, 郑俊超, 等. 微生物抑制法与酶联免疫法检测鳗鱼中喹诺酮类药物残留的比较研究[J]. 中国卫生检验杂志,2006,16(1):79−81. [ZHENG J, HUANG X R, ZHENG J C, et al. Comparative study on the determination of quinolone residues in eel by microbial inhibition method and enzyme-linked immunoassay[J]. Chinese Journal of Health Laboratory,2006,16(1):79−81. doi: 10.3969/j.issn.1004-8685.2006.01.039 [11] 郭建巍, 沈倍奋, 冯健男, 等. 蓖麻毒素快速ELISA检测法的建立[J]. 细胞与分子免疫学杂志,2006,22(4):536−538. [GUO J W, SHEN B F, FENG J N, et al. Development of rapid ELISA method for detection of ricin[J]. Journal of Cell and Molecular Immunology,2006,22(4):536−538. doi: 10.3321/j.issn:1007-8738.2006.04.042 [12] 梁迪思, 李建生. 酶联免疫法(ELISA)测定婴幼儿配方奶粉中的黄曲霉毒素M1方法改进[J]. 现代食品科技,2010,26(12):1421−1423. [LIANG D S, LI J S. Improvement of enzyme-linked immunosorption (ELISA) method for determination of aflatoxin M1 in infant formula[J]. Modern Food Technology,2010,26(12):1421−1423. [13] 张明, 吴国娟, 沈红, 等. 免疫胶体金法检测磺胺甲噁唑残留的研究[J]. 中国兽药杂志,2006(4):17−19. [ZHANG M, WU G J, SHEN H, et al. Determination of sulfamethoxazole residues by immunocolloidal gold method[J]. Chinese Journal of Veterinary Drugs,2006(4):17−19. doi: 10.3969/j.issn.1002-1280.2006.04.005 [14] 栗慧, 金艳丹, 张岩蔚. 四环素胶体金免疫检测技术的研究[J]. 食品研究与开发,2018,39(3):146−150. [LI H, JIN Y D, ZHANG Y W. Study on immunoassay technology of tetracycline colloidal gold[J]. Food Research and Development,2018,39(3):146−150. doi: 10.3969/j.issn.1005-6521.2018.03.026 [15] 姜艳彬, 孙冠如, 王海, 等. 盐酸克伦特罗胶体金快速检测试纸条的研制[C]//第五次全国免疫诊断暨疫苗学术研讨会论文汇编. 中华医学会, 中国医药生物技术协会, 2011. JIANG Y B, SUN G R, WANG H, et al. Development of test strip for rapid detection of clenbuterol hydrochloride colloidal gold[C]//Proceedings of the Fifth National Symposium on Immunological Diagnosis and Vaccines. Chinese Medical Association, China Medical Biotechnology Association, 2011.
[16] 齐刚, 陈静, 詹晓霞, 等. 荧光定量快检法与胶体金技术检测兽药残留优势对比[J]. 养殖技术顾问,2017(9):27,65. [QI G, CHEN J, ZHAN X X, et al. Determination of veterinary drug residues by fluorescence quantitative rapid detection and Colloidal gold technology[J]. Aquaculture Technical Consultant,2017(9):27,65. [17] 董浩, 徐楠楠. 鹅细小病毒荧光定量PCR检测方法的建立及应用[J]. 中国兽药杂志,2011,45(9):12−14. [DONG H, XU N N. Establishment and application of fluorescence quantitative PCR method for detection of goose parvovirus[J]. Chinese Journal of Veterinary Medicine,2011,45(9):12−14. doi: 10.3969/j.issn.1002-1280.2011.09.006 [18] 肖勤, 林金明. 化学发光免疫分析方法的应用研究进展[J]. 分析化学,2015,43(6):929−938. [XIAO Q, LIN J M. Research progress in the application of chemiluminescence immunoassay[J]. Analytical Chemistry,2015,43(6):929−938. [19] 王武康, 王文卓. 化学发光免疫检测试剂条及其检测农药兽药残留的应用: CN106568939A[P]. 2017. WANG W K, WANG W Z. Chemiluminescence immunoassay reagent strip and its application in detection of pesticide and veterinary drug residues: CN106568939A[P]. 2017.
[20] 黄杏杏. 化学发光免疫法与放射免疫法检测血浆醛固酮, 肾素对原发性醛固酮增多症筛查效率的对比分析[D]. 大连: 大连医科大学, 2017. HUANG X X. Comparative analysis of screening efficiency of plasma aldosterone and renin in primary aldosteronism by chemiluminescence immunoassay and radioimmunoassay[D]. Dalian: Dalian Medical University, 2017.
[21] 杜永杰. 浅析蛋白芯片在兽药残留中的应用[J]. 畜禽业,2018,29(5):59. [DU Y J. Analysis on the application of protein chip in veterinary drug residue[J]. Livestock and Poultry Industry,2018,29(5):59. [22] 冯月君, 张瑜, 万宇平, 等. 一种异丙威胶体金免疫快速检测试纸条的研制[J]. 中国酿造,2020,335(1):199−202. [FENG Y J, ZHANG Y, WAN Y P, et al. Development of an immunorapid test strip for isoprovir colloidal gold[J]. China Brewing,2020,335(1):199−202. [23] 周从燕, 李丽蓉, 刘入源. 纳米基电分析生物传感器在食品兽药残留检测中的研究与应用进展[J]. 食品安全质量检测学报,2020,335(1):199−202. [ZHOU C Y, LI L R, LIU R Y. Research and application progress of nano-electroanalytical biosensor in the detection of veterinary drug residues in food[J]. Journal of Food Safety and Quality Testing,2020,335(1):199−202. [24] 梁勇, 黄陈, 金礼琴. 薄层色谱法和高效液相色谱法在中兽药质量控制中的应用[J]. 畜牧与饲料科学,2020,41(4):97−100. [LIANG Y, HUANG C, JIN L Q. Application of thin layer chromatography and high performance liquid chromatography in quality control of Chinese veterinary drugs[J]. Animal Husbandry and Feed Science,2020,41(4):97−100. doi: 10.12160/j.issn.1672-5190.2020.04.019 [25] 王亮. 高效液相色谱法检测兽药中青霉素残留[J]. 中国化工贸易,2017,9(3):199,201. [WANG L. Determination of penicillin residues in veterinary drugs by high performance liquid chromatography[J]. China Chemical Trade,2017,9(3):199,201. [26] 李娜, 张玉婷, 刘磊, 等. QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中4类29种禁限用兽药残留[J]. 色谱,2014(12):1313−1319. [LI N, ZHANG Y T, LIU L, et al. Determination of veterinary drug residues in food of animal origin by Quechers-ultra performance liquid chromatography-tandem mass spectrometry[J]. Chromatographic,2014(12):1313−1319. [27] 田苗. 猪组织中10种β-兴奋剂类兽药残留量的气相色谱-质谱法检测[J]. 分析测试学报,2010,29(7):712−716. [TIAN M. Determination of 10 β-stimulant veterinary drugs residues in pig tissues by gas chromatography-mass spectrometry[J]. Journal of Analytical Testing,2010,29(7):712−716. doi: 10.3969/j.issn.1004-4957.2010.07.013 [28] 林维宣, 田苗, 董伟峰. 固相萃取-气相色谱/质谱法同时检测动物组织中多种β-兴奋剂残留量的研究[J]. 动物医学进展,2010,31(z1):1−4. [LIN W X, TIAN M, DONG W F. Simultaneous determination of β-stimulant residues in animal tissues by solid phase extraction and gas chromatography/mass spectrometry[J]. Advances in Veterinary Medicine,2010,31(z1):1−4. doi: 10.3969/j.issn.1007-5038.2010.z1.001 [29] 刘洪斌, 于洪侠, 刘佳佳, 等. 高效液相色谱-串联质谱法检测牛奶中多种苯并咪唑兽药残留[J]. 分析试验室,2011,30(3):13−17. [LIU H B, YU H X, LIU J J, et al. Determination of benzimidazole residues in milk by high performance liquid chromatography-tandem mass spectrometry[J]. Analysis Laboratory,2011,30(3):13−17. [30] 李照, 常建军, 喻东威, 等. 高效液相色谱串联质谱法检测液体乳中四环素类和喹诺酮类兽药残留量[J]. 食品安全质量检测学报,2019,10(3):688−692. [LI Z, CHANG J J, YU D W, et al. Determination of tetracycline and quinolone residues in liquid milk by high performance liquid chromatography/tandem mass spectrometry[J]. Journal of Food Safety and Quality Testing,2019,10(3):688−692. [31] 李帅鹏, 黄显会, 王伟, 等. 高效液相色谱-串联质谱法测定牛羊组织中苯酚类和水杨酸苯胺类抗蠕虫药多残留[J]. 分析化学,2014,42(3):423−428. [LI S P, HUANG X J, WANG W, et al. Determination of phenol and aniline salicylate residues in bovine and sheep tissues by high performance liquid chromatography-tandem mass spectrometry[J]. In Analytical Chemistry,2014,42(3):423−428.





 下载:
下载:


 下载:
下载:



