Effects of Cysteine Treatment on the Quality and Antioxidant Activity in Postharvest Flammulina velutipes
-
摘要: 为了研究半胱氨酸处理对金针菇低温贮藏品质和抗氧化活性变化的影响,将新鲜金针菇分别采用15 mmol/L半胱氨酸和清水浸泡处理20 min后于2~3 ℃贮藏12 d,并定期检测相关理化指标。结果表明,15 mmol/L半胱氨酸处理能够抑制新鲜金针菇的呼吸强度和褐变度;延缓可溶性固形物和可溶性蛋白含量下降,并保持较低相对电导率;抑制了多酚氧化酶(polyphenol oxidase,PPO)活性和过氧化物酶(peroxidase,POD)活性,并保持较高的总酚和抗坏血酸含量,贮藏结束时,半胱氨酸处理组的PPO和POD活性比对照组分别降低了13.78%和26.49%,总酚和抗坏血酸含量分别为对照组的1.12和1.37倍;处理组提高了超氧化物歧化酶(superoxide dismutase,SOD)活性、谷胱甘肽还原酶活性以及1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除率,对失重率无显著影响;相关性分析发现,处理组的呼吸强度与SOD活性、DPPH自由基清除率相关系数分别为−0.951和−0.903,呈显著(P<0.05)负相关。由此得出,低温贮藏期间,半胱氨酸处理能够降低金针菇内部物质的代谢速率,维持较高抗氧化能力和感官品质。Abstract: In order to investigate the effects of cysteine (Cys) treatment in preserving quality and antioxidant activities of Flammulina velutipes during low temperature storage, fresh Flammulina velutipes were pretreated with 15 mmol/L cysteine and clear water at 25 ℃ for 20 min before storage for 12 d at 2~3 ℃, and The physical and chemical indexes were tested regularly. The results showed that 15 mmol/L cysteine treatment could restrain the respiration intensity and delay browning degree of fresh mushroom. At the same time, cysteine treatment could reduce the rate of decline of soluble solids and soluble protein. And the relative conductivity could be kept at low state in cysteine treated mushroom. And cysteine treatment significantly controlled the activity of the polyphenol oxidase (PPO) and could down-regulate the activity of peroxidase (POD). In addition, cysteine treatment had reserved thephenolic compound and ascorbic acid content. At 12 days of shelf-life, the activities of PPO and POD in cysteine treatment group decreased 13.78% and 26.49% compared with the control group, respectively, and the contents of total phenol and ascorbic acid by cysteine treated were 1.12 and 1.37 times of those in control group. Moreover, it could maintain higher levels of superoxide dismutase (SOD) and glutathione reductase (GR) activity along with superior 1,1-diphenyl-2-picrylhydrazyl (DPPH) scavenging capacity. However, it had no significant difference on the weight loss rate between the two treatment groups. The correlation analysis showed that the correlation coefficients between respiratory intensity and SOD activity and DPPH scavenging rate in the treatment group were −0.951 and −0.903, respectively, and showed a significant negative correlation. In conclusion, cysteine treatment could reduce the metabolic rate of internal substances of Flammulina velutipes, maintain higher antioxidant capacity and sensory quality during preserved period.
-
Keywords:
- Flammulina velutipes /
- cysteine /
- antioxidant activity /
- preservation /
- browning
-
金针菇(Flammulina velutipes)是一种组织脆嫩、味道鲜美的真菌[1],而其贮藏特点是需氧代谢旺盛,采后衰老迅速,容易出现褐变现象。研究表明[2]当金针菇遭受胁迫条件或处于衰老过程中,内源性抗氧化物质含量不断降低,活性氧在细胞各处的含量不断增加,会造成内部自由基代谢失调,从而恶性循环,造成不可逆的伤害,如细胞膜的完整性受损、物质消耗过快、组织褐变、菌柄软化、加速品质衰老[3]。因此,低温贮藏期间氧化还原状态的调控对金针菇的贮藏保鲜起着不可忽视的作用[4]。目前应用性研究中,低温结合气调保鲜[5]、低温结合化学保鲜[6]以及低温结合聚乙烯膜包装[7]是采后金针菇常用的保鲜方法,但影响因素较为复杂、较难调控。近年国内外研究都在探索其他绿色、高效的保鲜方法来提高金针菇内部抗氧化能力。例如,较多学者研究发现3 μmol/L油菜素内酯[4]、250 μmol/L水杨酸浸泡处理[8]和100 μmol/L外源茉莉酸甲酯熏蒸处理[9]都能够通过提高食用菇内部抗氧化物质的含量,保持食用菇较高的感官品质。
半胱氨酸(cysteine,Cys)是一种公认安全、无毒的天然抗褐变剂[10],已广泛应用于不同的鲜切果蔬。果蔬中酶的活性对于pH和抗褐变物质有高度敏感性,如半胱氨酸、植酸等,并且这些褐变抑制剂结合冷库贮藏的应用还能有效抑制衰老过程中的组织代谢紊乱,并保持产品较好的感官和生化品质[11]。例如配制抗褐变溶液时添加2%的半胱氨酸,浸泡鲜切苹果片30 s,可以抑制其品质恶化[12];1%的半胱氨酸溶液能够抑制鲜切马铃薯[13]和莴苣[14]的酶促褐变,保持较好的外观品质。所以适当浓度的半胱氨酸处理能够减少果蔬切割面以及内部的褐变和物质流失,并且有抑菌、维持果蔬营养和风味的效果[15-16]。然而,目前鲜有研究报道半胱氨酸处理对采后金针菇品质和抗氧化水平的影响。为此,本实验以15 mmol/L半胱氨酸处理采后新鲜金针菇,研究在2~3 ℃贮藏12 d中金针菇的品质和内部抗氧化能力的变化,并且对各指标进行相关性分析,为半胱氨酸在食用菌低温贮藏的研究提供科学参考。
1. 材料与方法
1.1 材料与仪器
白色金针菇 自山东省邹城市现代农业产业园挑选新鲜、无表观损伤的金针菇;L-半胱氨酸(纯度>99%) 国药集团化学试剂公司;多酚氧化酶测定试剂盒、过氧化物酶测定试剂盒、超氧化物歧化酶测定试剂盒、谷胱甘肽还原酶测定试剂盒 南京建成生物工程研究所。
3-30K高速离心机 德国SIGMA公司;UV-1800紫外可见分光光度计 日本岛津公司;DDSJ-308A电导率仪 上海精密科学仪器有限公司;WYA-2S阿贝折射仪 上海彼爱姆光学仪器有限公司;Infinite F50酶标仪 瑞士TECAN 公司。
1.2 实验方法
1.2.1 处理方法
通过前期预实验发现,15 mmol/L半胱氨酸浸泡20 min的感官品质最佳。因此,将挑选好的金针菇随机分成两组,分别为15 mmol/L半胱氨酸的处理组和对照组。用对应溶液将金针菇完全浸没,20 min后取出,在20~25 ℃的阴凉处风干。2 h之后进行装筐,每3株一筐,并套上0.5 mm厚度的PE袋。在恒定条件(温度2~3 ℃、空气湿度90%~95%)的环境中存放12 d,定期进行查看、取样和测定相关指标。保存新鲜样品时,需将金针菇快速切块,用液氮速冻,存放于−80 ℃的冰箱。后期实验进行之前,称取适量块状样品,在液氮中研磨成粉,随即进行指标测定。
1.2.2 指标测定
1.2.2.1 呼吸强度、失重率、褐变度的测定
呼吸强度测定参考碱液吸收法[17],单位为mg/(kg·h)。
失重率测定参考Wang等[18]的方法,并略作修改。每组固定6 株金针菇测定失重率,其计算见公式(1)。
(1) 褐变度的测定参考郎艳[19]的方法,并根据实际实验稍有改动。称取3 g样品,再加入5 mL磷酸钠缓冲液(pH=6.5,0.2 mol/L),放置10 min后离心(4 ℃、10000×g、15 min),最后取上清液在450 nm处测定,并表示为OD450×2。
1.2.2.2 可溶性固形物、可溶性蛋白含量的测定
可溶性固形物测定:金针菇研磨、过滤,将获取的汁液覆盖阿贝折射仪测定窗口,记录数值(%)。
可溶性蛋白测定:在5 mL的蒸馏水,混入2 g样品,离心(4 ℃、12000×g、20 min)。将上清液稀释10倍后再进行测定,参考考马斯亮蓝染色法[17],并略作改动。
1.2.2.3 相对电导率的测定
参考姚亚明等[1]的方法,并略作修改。称取5 g新鲜金针菇组织置于内壁干燥的比色管中,再加入30 mL超纯水,在静置浸泡1 h,测定电导率,用锡箔纸包裹锥形瓶瓶口,在沸水中沸腾30 min,快速冷却后测定电导率,相对电导率的计算见公式(2)。
(2) 式中:P1为静置1 h后的电导率,µS/cm;P2为煮沸冷却后的电导率,µS/cm。
1.2.2.4 多酚氧化酶和过氧化物酶活性的测定
多酚氧化酶(polyphenol oxidase,PPO)活性测定参考试剂盒的操作步骤。在1 mL酶提取液加入0.4 g样品,在低温下离心(4 ℃、10000×g、10 min),获得粗酶提取液。各150 μL的粗酶提取液和煮沸的酶液分别与缓冲液和基质液组成反应体系,之后进行孵育、离心、测定吸光值。以鲜质量计,单位为U/g。
过氧化物酶(peroxidase,POD)活性测定参考试剂盒的操作步骤。在3 mL的磷酸缓冲液(pH=7.0,0.1 mol/L)中加入2 g样品,离心(4 ℃、10000×g、10 min),获得酶提取液并加入到应用液中,最后于420 nm下测定吸光值。以鲜质量计,单位为U/g。
1.2.2.5 总酚含量、抗坏血酸含量的测定
总酚含量的测定参考福林酚法[20]。样品测定:取6 mL提前预冷的60%乙醇,加入1 g样品,两者在涡旋仪上混匀,低温离心(4 ℃、10000×g、30 min)。取3.0 mL福林酚,加入0.7 mL上清液,暗处放置1 min,再加入2 mL的碳酸钠溶液(20 g/mL),最后于40 ℃的水浴锅中保温2 h,取出冷却,测定混合溶液吸光度。以鲜质量计,单位为mg/100g。
抗坏血酸含量的测定参考刘萍等[21]的方法,以鲜质量计,单位为mg/100 g。
1.2.2.6 抗氧化酶活性和自由基清除率的测定
超氧化物歧化酶(superoxide dismutase,SOD)活性按照SOD试剂盒里的羟胺法测定。
谷胱甘肽还原酶(glutathione reductase,GR)活性按照GR试剂盒里紫外比色法进行测定。以上单位都为U/g,以鲜质量计。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率测定方法[22]如下。将无水乙醇提前进行预冷,取5 mL加入2 g样品,低温离心(4 ℃、10000×g、20 min)获得提取液,取0.3 mL,加入9.0 mL蒸馏水,涡旋混匀用于DPPH清除活性的测定。测定方法:配制好0.1 mmol/L DPPH乙醇溶液,吸取2 mL并与同体积样品稀释液进行混合,在20~25 ℃的环境中放置30 min后测定。相关计算见公式(3)
(3) 式中:A0表示对照组在517 nm处的吸光值;A1表示样品在517 nm吸光值。
1.3 数据处理
以上实验均重复三次。采用 Excel 2010对所有原始数据进行整理和计算;同时结合SPSS18.0对数据进行显著性分析;所有图片的绘制都采用Origin 2018软件。
2. 结果与分析
2.1 半胱氨酸处理对金针菇呼吸强度、失重率、褐变度的影响
金针菇在贮藏期间仍在呼吸代谢。如图1A所示,在前6 d内,两组处理的样品的呼吸强度变化都较为平缓,6 d之后呼吸强度持续升高。说明在低温贮藏的开始阶段,金针菇的呼吸代谢受到抑制,后期呼吸强度升高,原因可能是内部代谢逐渐紊乱,而半胱氨酸处理组的呼吸强度上升速率较对照组显著减缓(P<0.05)。贮藏结束时,对照组的呼吸强度显著高于半胱氨酸处理组(20.10%)。Fang等[23]研究发现降低呼吸强度是延缓金针菇采后生长和衰老的一种有效的途径。由此可见,在贮藏的后期,半胱氨酸处理能够通过抑制新鲜金针菇的呼吸强度,从而进一步减缓代谢速率,延缓品质劣变。
如图1B所示,在整个贮藏期间,金针菇的失重率持续升高,两组之间没有显著差异(P>0.05)。说明施加外源半胱氨酸对失重率没有显著影响。研究表明,当果蔬失重率达到5%~6%之间时,可认为已经开始丧失商品价值[24]。在本研究中的贮藏末期,对照组和半胱氨酸组的失重率分别为4.29%、4.22%,均低于5%,说明12 d后两组样品仍有一定的商品价值。
褐变是造成蘑菇质量损失和产品商业价值降低的主要原因[25]。图1C为不同处理组中褐变度的变化,褐变度在前9 d都呈现升高的趋势,而对照组在第9 d的褐变度最高。在第3、6、9 d,对照组的褐变度显著高于处理组(P<0.05),褐变度分别是处理组的1.29、1.28、1.15倍。由此说明半胱氨酸对于金针菇颜色变化的控制效果较为显著。
2.2 半胱氨酸处理对金针菇可溶性固形物、可溶性蛋白含量的影响
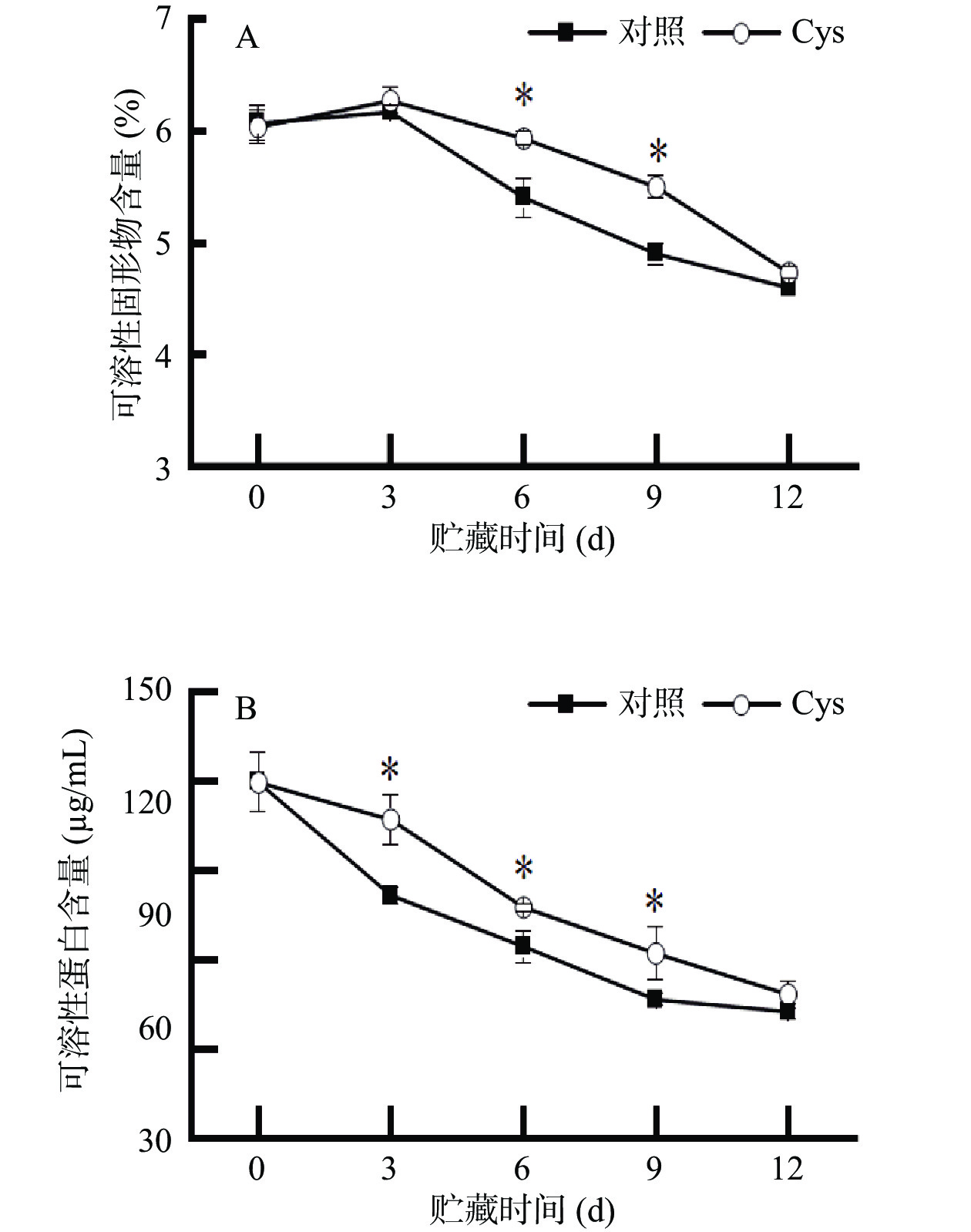
可溶性固形物在没有从外界吸收补充的状态下,其含量的降低和货架期呈正比[26]。图2A表示,第3 d之后,两组处理可溶性固形物含量都逐渐下降,然而半胱氨酸处理的可溶性固形物下降速率较为缓慢,第6 d和第9 d时,其可溶性固形物的含量分别是对照组的1.10、1.12倍。由此说明,对金针菇进行半胱氨酸浸泡处理,可以减轻可溶性固形物的消耗。
可溶性蛋白是食用菌含有的重要的营养物质,采后其含量会因为呼吸代谢逐渐下降,也有调节和维持细胞内外渗透压的作用。如图2B所示,两组可溶性蛋白的含量持续下降,然而半胱氨酸显著抑制可溶性蛋白水解(P<0.05)。在贮藏的第3、6、9 d,半胱氨酸处理组的可溶性蛋白质含量分别是对照组的1.31、1.21、1.33倍。由此说明,半胱氨酸处理抑制了金针菇中可溶性蛋白下降,从而维持细胞膜渗透压。Liu等[27]发现长根菇水溶性多糖对平菇进行浸泡处理,处理组的相对电导率、可溶性蛋白的水解速率显著降低,保持了平菇较高的感官品质。
2.3 半胱氨酸处理对金针菇相对电导率的影响
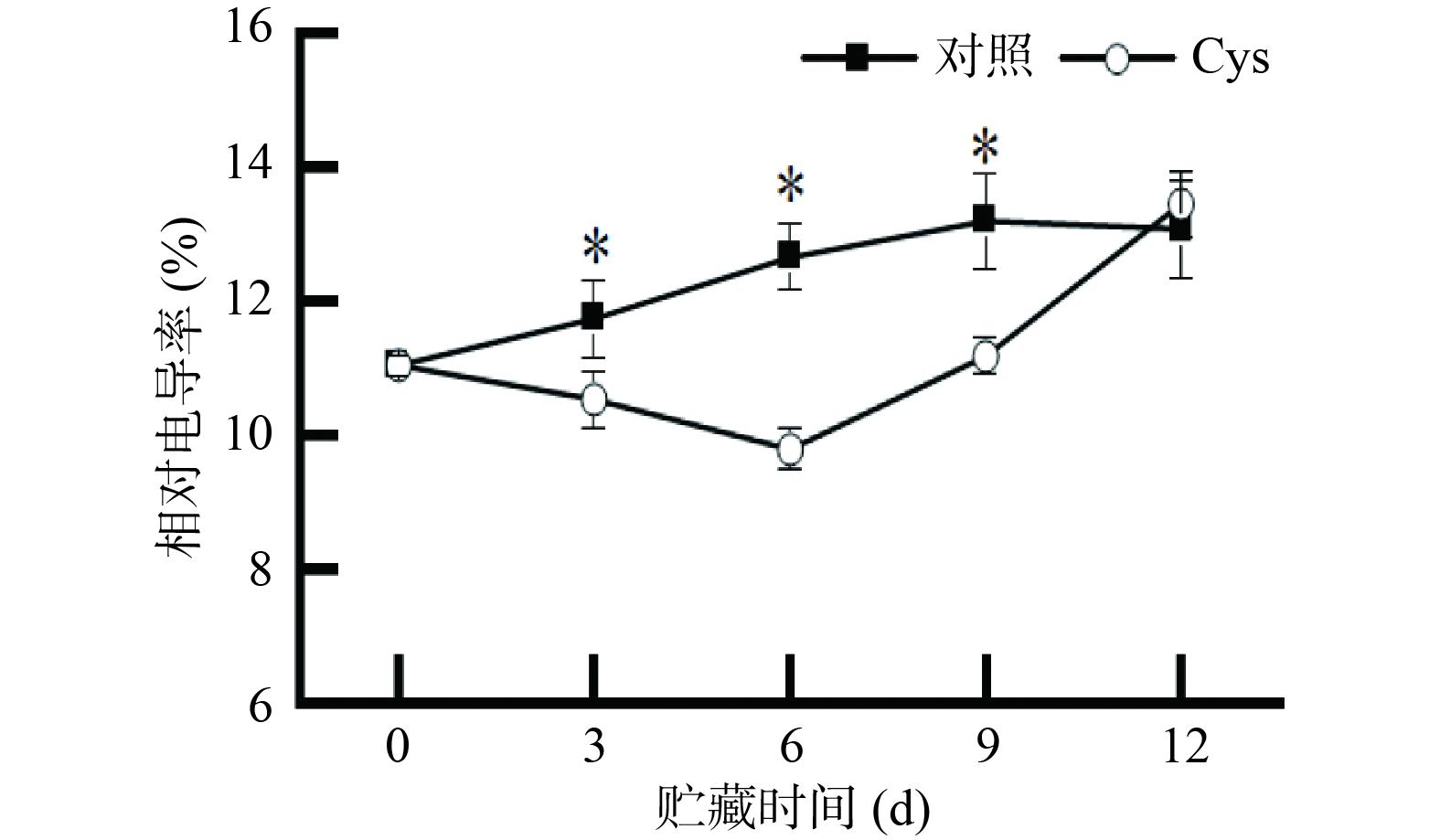
完整的细胞膜系统是生物体正常生理活动的基本保证。膜的完整性体现在膜的透气性上,而透气性可以通过电解质泄漏的变化来衡量[28]。如图3所示,对照组金针菇的相对电导率从第0 d开始一直在升高。半胱氨酸组于第6 d开始升高。贮藏的第6和9 d,处理组的相对电导率较对照组降低22.53%和15.24%。由此说明,在贮藏期间半胱氨酸处理能降低物质代谢速率,维持细胞内外的渗透压稳定,保护膜结构。
2.4 半胱氨酸处理对金针菇多酚氧化酶和过氧化物酶活性的影响
引起组织褐变常见的原因有果蔬内部相关酶活性及含量异常升高,如POD和PPO等[29-30]。如图4A、图4B,PPO和POD活性都是不断升高的。相比对照组,半胱氨酸组显著控制了两种酶活性的上升(P<0.05)。在贮藏的最后一天,相比对照组,半胱氨酸处理组的PPO活性降低了13.78%,并且伴随着POD活性降低了26.49%。推测半胱氨酸处理能够通过调控PPO和POD活性,进一步维持金针菇较好的感官品质。并且本实验得出的结果与靳祯亮[31]得出的结论相符合,即麦角硫因处理可以有效降低PPO活性,对食用菇有较好的护色效果。
2.5 半胱氨酸处理对金针菇总酚和抗坏血酸含量的影响
金针菇中自身含有一些保护细胞内重要分子免受氧化的自由基清除剂,常见有总酚、抗坏血酸等[32],因此需要减少这些抗氧化物质的过度消耗。图5A显示,对照组的总酚在贮藏的前9 d 变化并不明显,在贮藏的第9 d其含量略低。而半胱氨酸组总酚含量在第6 d最高,并且保持较稳定的水平。在贮藏结束时,半胱氨酸处理金针菇的总酚含量要比对照组高12.31%。图5B显示,抗坏血酸始终在消耗,而半胱氨酸处理的金针菇的抗坏血酸降低速度始终低于对照组。在贮藏最后一天,半胱氨酸组与对照组的抗坏血酸含量分别达到21.66和15.85 mg/100 g。由此发现,半胱氨酸处理的金针菇总酚和抗坏血酸的含量都维持较高的水平。
2.6 半胱氨酸处理对金针菇抗氧化酶活性和自由基清除率的影响
与组织抗氧化能力有关的指标还有SOD、GR、DPPH清除活性等。吴媛媛等[33]探讨受灰霉菌侵染的蓝莓果实体在贮藏期间自由基和抗氧化物质含量的变化时,发现在贮藏前期,自由基含量、SOD和GR的活性同时上升,果实外观并无明显变化;在贮藏后期,抗氧化物质含量下降,由于无法及时处理过量的自由基,组织开始软化、腐烂。在本实验中,金针菇的SOD活性如图6A显示从货架期第6 d开始下降,在贮藏的最后一天,两组的SOD活性都最低,但半胱氨酸处理的金针菇所含SOD活性显著高于另外一组(P<0.05),是另外一组的1.48倍。如图6B所示,对照组的GR活性从第3 d开始下降。而半胱氨酸组的GR活性在前6 d都是增加的,第6 d时,其GR的活性是对照组的1.56倍(P<0.05)。由此可见,半胱氨酸处理组可以维持较高的SOD和GR活性。
由图6C显示,对照组的DPPH自由基清除活性始终处于较低的水平。第3 d以后,半胱氨酸组的样品始终保持较高的清除活性,在贮藏的第12 d,半胱氨酸组的DPPH自由基清除率是对照组的1.33倍。因此,半胱氨酸处理能使金针菇组织内维持较高的DPPH自由基清除率。这个结果与Wu等[25]的结果相似,即短波紫外照射增强了贮藏期间蘑菇内盖、茎柄和整个菌体的抗氧化活性,其中茎柄中DPPH自由基清除活性最高。半胱氨酸维持较高DPPH自由基清除活性可能与其组织中较高的总酚和抗坏血酸等抗氧化物质含量有关[34]。
2.7 主要指标相关性分析
通过表1可知半胱氨酸组的呼吸强度与褐变度、可溶性固形物、DPPH自由基清除率的相关系数分别是0.909、−0.932、−0.903,呈显著或极显著相关(P<0.05或P<0.01),而处理组呼吸强度与褐变度、可溶性固形物、DPPH自由基清除率之间并没有显著相关(P>0.05),表明半胱氨酸组的呼吸代谢与内部物质含量以及品质变化的关系密切相关。并且相比于对照组,半胱氨酸组的褐变度和PPO活性、POD活性、可溶性固形物、SOD活性、抗坏血酸含量相关系数分别为0.967、0.898、−0.894、−0.924、−0.912,均呈显著或极显著相关(P<0.05或P<0.01),表明半胱氨酸组金针菇的色泽变化依赖于酶活性和抗氧化物质含量的高低,并且说明褐变度的抑制程度可以作为评价半胱氨酸处理效果的重要指标。
表 1 Pearson’s 相关系数Table 1. Pearson’s correlation coefficients指标 呼吸强度 褐变度 可溶性固形物 PPO活性 POD活性 抗坏血酸 SOD活性 DPPH自由基清除率 对照组 呼吸强度 1 0.341 −0.850 0.890* 0.991** −0.967** −0.980** −0.752 褐变度 1 −0.549 0.729 0.270 −0.532 −0.290 −0.824 可溶性固形物 1 −0.857 −0.841 0.930* 0.903* 0.712 PPO活性 1 0.849 −0.950* −0.840 −0.951* POD活性 1 −0.938* −0.977** −0.677 抗坏血酸 1 0.962** 0.848 SOD活性 1 0.679 DPPH自由基清除率 1 半胱氨酸处理组 呼吸强度 1 0.909* −0.932* 0.910* 0.867 −0.980** −0.951* −0.903* 褐变度 1 −0.894* 0.967** 0.898* −0.912* −0.924* −0.648 可溶性固形物 1 −0.954* −0.983** 0.978** 0.988** 0.820 PPO活性 1 0.963** −0.930* −0.979** −0.708 POD活性 1 −0.934* −0.970** −0.706 抗坏血酸 1 0.971** 0.867 SOD活性 1 0.826 DPPH自由基清除率 1 注:“*”表示0.05水平线显著相关(双尾);“**”表示0.05水平线显著相关(双尾)。 3. 结 论
本文研究了半胱氨酸处理对低温贮藏条件(2~3 ℃)下新鲜金针菇品质指标以及理化指标的影响。结果发现15 mmol/L的半胱氨酸处理通过延缓代谢速率和渗透调节物质的分解,从而保持膜内外渗透压的稳定性。与此同时,半胱氨酸能够显著降低金针菇组织内酶促褐变机率,从而有效延缓组织褐变。并且处理组与对照组相比,能保持较高内源性抗氧化剂含量,提高SOD、GR活性和DPPH清除活性。由此说明,15 mmol/L的半胱氨酸处理能够维持新鲜金针菇内部氧化体系的稳定性,从而延缓低温条件下金针菇的衰老和品质变化。
本研究通过相关性分析发现,相比对照组,处理组的品质指标(呼吸强度、褐变度)与内源的抗氧化指标(抗坏血酸、SOD等)呈显著负相关(P<0.05),也间接的验证新鲜金针菇采后感官品质与抗氧化物质变化密切相关。本实验从品质指标、褐变相关酶活力以及抗氧化能力等多方面探讨了半胱氨酸在食用菌低温贮藏中应用的科学性,但本实验也存在不足:在冷藏条件下,单纯的半胱氨酸浸泡处理对于保存新鲜食用菇是远远不够的,之后将会进一步探索如何将半胱氨酸以适当的比例添加在可食用涂膜中,结合冷库气调贮藏,尽可能降低食用菇物质损耗,延长其鲜食寿命。
-
表 1 Pearson’s 相关系数
Table 1 Pearson’s correlation coefficients
指标 呼吸强度 褐变度 可溶性固形物 PPO活性 POD活性 抗坏血酸 SOD活性 DPPH自由基清除率 对照组 呼吸强度 1 0.341 −0.850 0.890* 0.991** −0.967** −0.980** −0.752 褐变度 1 −0.549 0.729 0.270 −0.532 −0.290 −0.824 可溶性固形物 1 −0.857 −0.841 0.930* 0.903* 0.712 PPO活性 1 0.849 −0.950* −0.840 −0.951* POD活性 1 −0.938* −0.977** −0.677 抗坏血酸 1 0.962** 0.848 SOD活性 1 0.679 DPPH自由基清除率 1 半胱氨酸处理组 呼吸强度 1 0.909* −0.932* 0.910* 0.867 −0.980** −0.951* −0.903* 褐变度 1 −0.894* 0.967** 0.898* −0.912* −0.924* −0.648 可溶性固形物 1 −0.954* −0.983** 0.978** 0.988** 0.820 PPO活性 1 0.963** −0.930* −0.979** −0.708 POD活性 1 −0.934* −0.970** −0.706 抗坏血酸 1 0.971** 0.867 SOD活性 1 0.826 DPPH自由基清除率 1 注:“*”表示0.05水平线显著相关(双尾);“**”表示0.05水平线显著相关(双尾)。 -
[1] 姚亚明, 任月月, 刘芮瑜, 等. 1-MCP处理结合纳米包装对金针菇贮藏品质的影响[J]. 食品科学,2016,37(22):295−300. doi: 10.7506/spkx1002-6630-201622045 [2] Tian S P, Qin G Z, Li B Q. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant Molecular Biology,2013,82(6):593−602. doi: 10.1007/s11103-013-0035-2
[3] Li P X, Zhang X, Hu H L, et al. High carbon dioxide and low oxygen storage effects on reactive oxygen species metabolism in Pleurotus eryngii[J]. Postharvest Biology and Technology,2013,85:141−146. doi: 10.1016/j.postharvbio.2013.05.006
[4] Ding Y, Zhu Z, Zhao J H, et al. Effects of postharvest brassinolide treatment on the metabolism of white button mushroom (Agaricus bisporus) in relation to development of browning during storage[J]. Food and Bioprocess Technology,2016,9(8):1327−1334. doi: 10.1007/s11947-016-1722-1
[5] Li L, Sun H, Kitazawa H, et al. Effects of a high O2 dynamic-controlled atmosphere technology on the browning of postharvest white mushroom (Agaricus bisporus) in relation to energy metabolism[J]. Food Science and Technology International,2017,23(5):385−395. doi: 10.1177/1082013217695146
[6] Jafri M, Jha A, Bunkar D S, et al. Quality retention of oyster mushrooms (Pleurotus florida) by a combination of chemical treatments and modified atmosphere packaging[J]. Postharvest Biology and Technology,2013,76:112−118. doi: 10.1016/j.postharvbio.2012.10.002
[7] Li D Q, Qin X Y, Tian P P, et al. Toughening and its association with the postharvest quality of king oyster mushroom (Pleurotus eryngii) stored at low temperature[J]. Food Chemistry,2016,196:1092−100. doi: 10.1016/j.foodchem.2015.10.060
[8] Dokhanieh A Y, Aghdam M S. Postharvest browning alleviation of Agaricus bisporus using salicylic acid treatment[J]. Scientia Horticulturae,2016,207:146−151. doi: 10.1016/j.scienta.2016.05.025
[9] Meng D M, Zhang Y X, Yang R, et al. Arginase participates in the methyl jasmonate-regulated quality maintenance of postharvest Agaricus bisporus fruit bodies[J]. Postharvest Biology and Technology,2017,132:7−14. doi: 10.1016/j.postharvbio.2017.05.018
[10] Ali S, Khan A S, Malik A U. Postharvest l-cysteine application delayed pericarp browning, suppressed lipid peroxidation and maintained antioxidative activities of litchi fruit[J]. Postharvest Biology and Technology,2016,121:135−142. doi: 10.1016/j.postharvbio.2016.07.015
[11] Ali S, Khan A S, Malik A U, et al. Postharvest application of antibrowning chemicals modulates oxidative stress and delays pericarp browning of controlled atmosphere stored litchi fruit[J]. Journal of Food Biochemistry, 2019, 43(3): e12746.
[12] Jin T Z, Chen W, Gurtler J B, et al. Effectiveness of edible coatings to inhibit browning and inactivate foodborne pathogens on fresh-cut apples[J]. Journal of Food Safety,2020,40(4):e12802.
[13] Cerit İ, Pfaff A, Ercal N, et al. Postharvest application of thiol compounds affects surface browning and antioxidant activity of fresh-cut potatoes[J]. Journal of Food Biochemistry,2020,44(10):e13378.
[14] Pace B, Capotorto I, Ventura M, et al. Evaluation of l-cysteine as anti-browning agent in fresh-cut lettuce processing[J]. Journal of Food Processing and Preservation,2014,39(6):985−993.
[15] Li T T, Wu Q X, Zhou Y J, et al. L-cysteine hydrochloride delays senescence of harvested longan fruit in relation to modification of redox status[J]. Postharvest Biology and Technology,2018,143:35−42. doi: 10.1016/j.postharvbio.2018.04.011
[16] Zhu D, Guo R, Li W X, et al. Improved postharvest preservation effects of Pholiota nameko mushroom by sodium alginate–based edible composite coating[J]. Food and Bioprocess Technology,2019,12(4):587−598. doi: 10.1007/s11947-019-2235-5
[17] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 46−70. [18] Wang Z G, Chen L J, Yang H, et al. Effect of exogenous glycine betaine on qualities of button mushrooms (Agaricus bisporus) during postharvest storage[J]. European Food Research and Technology,2015,240(1):41−48. doi: 10.1007/s00217-014-2305-x
[19] 郎艳. 白色金针菇褐变的相关生理生化变化及酶褐变机理的研究[D]. 晋中: 山西农业大学, 2014: 20−21. [20] 李巨秀, 王柏玉. 福林-酚比色法测定桑椹中总多酚[J]. 食品科学,2009,30(18):292−295. doi: 10.3321/j.issn:1002-6630.2009.18.066 [21] 刘萍, 李明军, 丁义峰. 植物生理学实验[M]. 北京: 科学出版社, 2016: 54−57. [22] Brand-Williams W, Cuvelier M E, Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25−30. doi: 10.1016/S0023-6438(95)80008-5
[23] Fang D L, Yang W J, Kimatu B M, et al. Effect of nanocomposite packaging on postharvest quality and reactive oxygen species metabolism of mushrooms (Flammulina velutipes)[J]. Postharvest Biology and Technology,2016,119:49−57. doi: 10.1016/j.postharvbio.2016.04.012
[24] Jiang T J, Feng L F, Zheng X L. Effect of chitosan coating enriched with thyme oil on postharvest quality and shelf life of shiitake mushroom (Lentinus edodes)[J]. Journal of Agricultural and Food Chemistry,2012,60(1):188−196. doi: 10.1021/jf202638u
[25] Wu X L, Guan W Q, Yan R X, et al. Effects of UV-C on antioxidant activity, total phenolics and main phenolic compounds of the melanin biosynthesis pathway in different tissues of button mushroom[J]. Postharvest Biology and Technology,2016,118:51−58. doi: 10.1016/j.postharvbio.2016.03.017
[26] 季悦, 李静, 王雷, 等. 茉莉酸甲酯处理对鲜切菠萝品质及抗氧化活性的影响[J]. 食品科学,2018,39(1):258−263. [27] Liu Q, Kong W L, Hu S J, et al. Effects of Oudemansiella radicata polysaccharide on postharvest quality of oyster mushroom (Pleurotus ostreatus) and its antifungal activity against Penicillium digitatum[J]. Postharvest Biology and Technology,2020,166:111207. doi: 10.1016/j.postharvbio.2020.111207
[28] Wang T, Hu M J, Yuan D B, et al. Melatonin alleviates pericarp browning in litchi fruit by regulating membrane lipid and energy metabolisms[J]. Postharvest Biology and Technology,2020,160:111066. doi: 10.1016/j.postharvbio.2019.111066
[29] Zhan L J, Hu J Q, Lim L-T, et al. Light exposure inhibiting tissue browning and improving antioxidant capacity of fresh-cut celery (Apium graveolens var. dulce)[J]. Food Chemistry,2013,141(3):2473−2478. doi: 10.1016/j.foodchem.2013.05.035
[30] Preczenhak A P, Orsi B, Lima G P, et al. Cysteine enhances the content of betalains and polyphenols in fresh-cut red beet[J]. Food Chemistry,2019,286:600−607. doi: 10.1016/j.foodchem.2019.02.040
[31] 靳祯亮, 黄琦辉, 周巧丽, 等. 麦角硫因处理对采后双孢蘑菇品质的影响[J]. 中国食品学报,2017,17(3):194−200. [32] Orsavová J, Hlaváčová I, Mlček J, et al. Contribution of phenolic compounds, ascorbic acid and vitamin E to antioxidant activity of currant (Ribes L.) and gooseberry (Ribes uva-crispa L.) fruits[J]. Food Chemistry,2019,284:323−333. doi: 10.1016/j.foodchem.2019.01.072
[33] 吴媛媛, 刘瑞玲, 郜海燕, 等. 灰霉菌侵染对蓝莓采后品质变化及抗氧化性的影响[J]. 中国食品学报,2019,19(1):148−155. [34] Zhang Y, Gong Y, Chen L, et al. Hypotaurine delays senescence of peach fruit by regulating reactive oxygen species metabolism[J]. Scientia Horticulturae,2019,253:295−302. doi: 10.1016/j.scienta.2019.04.019
-
期刊类型引用(2)
1. 杨戬,刘伯扬,王丹慧,高永亮,赵三军,赵凯,李慧,仪虹伯. 基于中红外光谱的牛乳中A 2β-酪蛋白检测方法研究. 中国乳业. 2024(11): 144-148+156 .  百度学术
百度学术
2. 张立佳,莫楠,刘丽君,韩晓旭,赖世云,任一平,尹睿杰,李翠枝. 羊乳婴幼儿配方粉中牛乳成分鉴别与测定模型的建立. 食品安全质量检测学报. 2023(08): 195-203 .  百度学术
百度学术
其他类型引用(1)









 下载:
下载:



 下载:
下载:



