Physicochemical Properties, Antioxidant Activity and Protective Effect on Oxidative Stress Cells of Vernonia amygdalina Delile Leaf Jiaosu during Fermentation
-
摘要: 以扁桃斑鸠菊叶为原料制备酵素,监测发酵过程中理化指标的变化,通过ABTS+自由基、羟基自由基清除能力考察其发酵过程中抗氧化能力变化,并利用人正常肝细胞(WRL-68)模型考察其对氧化应激的保护作用。结果表明:对比酵素第2和第55 d,pH从4.24±0.01降至3.46±0.07,可溶性蛋白质、总糖、总酚、总黄酮含量呈下降趋势,分别从0.95±0.02、244.94±4.89、6.05±0.03、0.37±0.01 mg/mL降至0.71±0.02、34.26±0.57、3.42±0.21、0.08±0.01 mg/mL。总酸含量呈上升趋势,从0.15±0.01提高至0.95±0.01 mg/mL。在第2~28 d,抗坏血酸含量从25.36±0.52提高至28.44±0.01 µg/mL,随后呈下降趋势;ABTS+自由基清除能力在第18 d最强,为73.72%±0.86%,第28 d羟基自由基清除能力最高,为54.14%±0.43%,且ABTS+自由基、羟基自由基清除能力和总酸含量呈显著正相关性(P<0.01);WRL-68细胞经H2O2处理造模后,酵素处理组的胞内ROS显著降低(P<0.05),胞内抗氧化系酶SOD、CAT、GSH-Px活提高。综上,扁桃斑鸠菊叶酵素在发酵中期具有较强的清除自由基能力,且经酵素预处理后WRL-68细胞抵御氧化应激的能力提高。Abstract: Vernonia amygdalina Delile leaf was used as raw material to prepare Jiaosu. The change of basic physicochemical indexes were monitored during fermentation, and the antioxidant capacity was determined by the scavenging ability against ABTS+ radical and hydroxyl radical, and its protective effect to human normal hepatocytes (WRL-68) on oxidative stress was investigated by cell experiment. Results: Compared with the jiaosu on day 2 and day 55, the pH decreased from 4.24±0.01 to 3.46±0.07, and the content of soluble protein, total sugar, total phenol and total flavonoids decreased from 0.95±0.02, 244.94±4.89, 6.05±0.03, 0.37±0.01 mg/mL to 0.71±0.02, 34.26±0.57, 3.42±0.21 and 0.08±0.01 mg/mL, respectively. The total acid content increased from 0.15±0.01 to 0.95±0.01 mg/mL. The content of ascorbic acid increased from 25.36±0.52 to 28.44±0.01 μg/mL from 2 to 28 days, and then decreased. The ABTS+ radical scavenging ability was the strongest on the 18th day 73.72%±0.86%, and the hydroxyl radical scavenging capacity was the highest on the 28th day 54.14%±0.43%. There was a significant positive correlation between ABTS+ radical, hydroxyl radical scavenging ability and total acid content (P<0.01). After H2O2-injured WRL-68 cell, in cellular ROS significantly decreased, and the activities of antioxidant enzymes SOD, CAT and GSH-Px increased in the Jiaosu treated group. In summary, the Jiaosu of Vernonia amygdalina Delile leaf had strong ability to scavenge free radicals in the middle stage of fermentation, and the ability of WRL-68 cells to resist oxidative stress was improved after pretreatment with it.
-
扁桃斑鸠菊(Vernonia amygdalina Del.),菊科斑鸠菊属,称非洲树,又因其味苦,还被称为苦叶,是一种生长在非洲等热带地区及湿度较大地区的小乔木[1],最早在非洲发现,在潮湿环境生长旺盛,能耐高温天气,四季可种植,在非洲民间被视为一种药用植物,后从国外移植到我国。扁桃斑鸠菊气味苦涩,性凉,具有抗氧化[2-4]、抑菌[4-5]、抗肿瘤[5]、治溃疡[6]、调节血糖、降血脂、抗炎[7]、杀虫[8]、抗疟[9]等活性。目前,扁桃斑鸠菊的研究主要以提取工艺优化及功能评价为主,测定提取物功能成分含量及其功效研究。而扁桃斑鸠菊的酵素产品尚且不多,其功能成分检测及功效评价的关注度也很低。但酵素产业的迅速发展,为扁桃斑鸠菊的合理开发利用提供了新的途径与前景。
食用植物酵素(Edible plant Jiaosu)是以可食用果蔬等植物为原料,适当添加辅料,经微生物在一定条件下发酵制得的一种富含小分子活性物质的酵素产品,能极大的富集原料内的活性成分,并通过微生物作用生成一系列代谢产物[10-11]。扁桃斑鸠菊作为一种可食用植物,本文以其叶为原料,添加白砂糖为碳源制备扁桃斑鸠菊叶植物酵素,置于(25±2.5) ℃条件下避光发酵,监测发酵过程中总酸、pH、可溶性蛋白质、总糖、总黄酮、总酚、抗坏血酸等理化指标和抗氧化能力的变化,并评价其对肝细胞氧化应激保护作用,以期建立一种扁桃斑鸠菊叶酵素评价方法,为其工业化发酵和在食品及药品工业行的应用开发提供一定的数据支撑。
1. 材料与方法
1.1 材料与仪器
扁桃斑鸠菊叶 叶龄2个月,2020年6月采自浙江省农产品化学与生物加工技术重点实验室植物园;考马斯亮蓝-G250、牛血清白蛋白、10%福林酚(v/v)、碳酸钠、硫酸、硝酸铝、亚硝酸钠、氢氧化钠、盐酸硫酸亚铁、水杨酸钠 国药集团化学试剂有限公司;没食子酸、抗坏血酸 上海阿拉丁化学试剂有限公司;WRL-68人正常肝细胞 由浙江大学医学院附属第一医院提供;DMEM高糖培养基、青霉素-链霉素(100×)、磷酸缓冲液(PBS)、特级胎牛血清(FBS)、0.25%胰蛋白酶溶液 武汉普诺赛生命科技有限公司;T25培养瓶 美国康宁公司(Corning);总超氧化物歧化酶(SOD)测定试剂盒 南京建成生物工程研究所;3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝(MTT)及其他试剂盒 碧云天生物技术有限公司。
SpectraMax iD5多功能微孔读板酶标仪 美国Molecular Devices公司;Allegra X-12R离心机 贝克曼库尔特有限公司;PB-10酸度计 德国赛多利斯科学仪器(北京)有限公司;生物安全柜 美国Thermo Scientific。
1.2 实验方法
1.2.1 扁桃斑鸠菊叶含水量测定及水提物、酵素的制备
用灭菌水洗净新鲜扁桃斑鸠菊叶,晾干表面水分,切成片状(约1 cm×1 cm),按扁桃斑鸠菊叶:糖:无菌水=1:1:3(w:w:w)比例加至10 L发酵罐中,在(25±2.5)℃条下进行暗发酵。定期取样(2、4、6、8、10、12、14、16、18、20、24、28、34、44、54 d),10000 r/min离心20 min,取上清液备用;取50 g洗净、晾干后叶片,称重后置于水分测定仪内,测定水分含量,重复测定三次;取洗净、晾干后叶片,在105 ℃烘至恒重,粉碎过筛(60目),按新鲜扁桃斑鸠菊叶质量:水=1:3(w:w),功率100%、40 ℃提取2 h,得到水提物。
1.2.2 理化指标的测定
1.2.2.1 pH测定
依据GB 10468-1989《水果和蔬菜产品pH值的测定方法》测定pH[12]。
1.2.2.2 总酸含量测定
依据GB/T 12456-2008《食品中总酸的测定》测定可滴定酸的含量,测定结果以乳酸(g/100 mL)计[13-14]。
1.2.2.3 总糖含量测定
采用苯酚-硫酸法[15],样品稀释10倍,取1.0 mL,加入0.5 mL 6%苯酚溶液,混匀,加入2.5 mL浓硫酸,混匀,沸水浴反应15 min,待冷却至室温后于波长490 nm处测定吸光度。用葡萄糖标准品溶液绘制标准曲线,得到回归方程后计算葡萄糖含量及相对标准偏差。
1.2.2.4 可溶性蛋白质含量测定
采用考马斯亮蓝法[16],取适量样品,补去离子水至1 mL,加0.1 mg/mL考马斯亮蓝-G250溶液5 mL,室温反应10 min,在595 nm测吸光度。以牛血清白蛋白标准品绘制标准曲线,得到回归方程后计算可溶性蛋白质含量及相对标准偏差。
1.2.2.5 总酚含量测定
采用福林酚法[17],将不同发酵时间的酵素稀释10倍,分别取0.5 mL,加入2.5 mL 10%(v/v)福林酚溶液,避光反应3 min,加入2 mL 7.5%(w/v)Na2CO3水溶液,避光反应1 h,去离子水做空白调零,在波长765 nm处测定吸光度值。以没食子酸标准品溶液绘制标准曲线,得到回归方程后计算总酚含量及相对标准偏差。
1.2.2.6 总黄酮含量测定
采用氯化铝法[18],取不同发酵时间的酵素样品400 µL,加入0.15 mL质量分数为5%的亚硝酸钠溶液,混匀,静置6 min,加入0.15 mL质量分数10%的氯化铝溶液,混匀,静置6 min,加入1.0 mL质量分数4%的氢氧化钠溶液,补去离子水至总体积为5 mL,混匀后室温静置15 min,于波长510 nm处测定吸光度值。以芦丁标准品溶液绘制标准曲线,得到回归方程,计算总酚含量及相对标准偏差。
1.2.2.7 抗坏血酸含量测定
抗坏血酸标准曲线的绘制:分别取0.1 mg/mL抗坏血酸标准液0、50、100、150、200、250、300、400、500 µL,用0.1%盐酸溶液定溶至5 mL,于243 nm测吸光值,以标准液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。酵素样品处理:a.酸处理:取100 µL酵素,加入200 µL 10%盐酸溶液,去离子水定容至5 mL,243 nm测吸光值;b.碱处理:取100 µL酵素,加400 µL 1 mol/L 氢氧化钠溶液,加入1 mL去离子水,静置20 min,加入400 µL 10%盐酸溶液,定容至5 mL,243 nm测吸光值;酸、碱处的吸光度差值即为酵素样品的吸光度值,代入标准曲线,计算VC含量[19]。
1.2.3 抗氧化能力
羟基自由基清除能力:取不同发酵时间且稀释10倍的酵素样品各200 μL,加入140 μL 6 mmol/L H2O2,60 μL 20 mmol/L水杨酸钠及200 μL 1.5 mmol/L硫酸亚铁,震荡混匀,37 ℃反应1 h,于波长510 nm处测定吸光度值。ABTS+自由基清除能力:用5 mmol/L的pH7.4的PBS缓冲液配制7 mmol/L的ABTS溶液,再加入过硫酸钾使其终浓度为2.455 mmol/L,避光放置12 h,制成ABTS储备液。临用前,用PBS缓冲液稀释将其稀释至734 nm处吸光度值为(0.70±0.02),制成ABTS工作液。取不同发酵时间且稀释10倍的酵素样品各100 μL,加PBS缓冲液200 μL,加5 mL ABTS工作液,30 ℃反应1 h,于波长734 nm处测定吸光度值[20]。
羟基自由基清除能力(%)=A0−(A1−A2)A0×100 式中:A0为去离子水参比管吸光度值;A1为样品管吸光度值;A2为样品本底管吸光度值。
ABTS+自由基清除能力(%)=A0−(A1−A2)A0×100 式中:A0为去离子水参比管吸光度值;A1为样品管吸光度值;A2为样品本底管吸光度值。
1.2.4 氧化应激保护作用
1.2.4.1 细胞培养
WRL-68细胞用含1%青霉素-链霉素、10% FBS的DMEM高糖培养基培养于T25培养瓶,当细胞铺满培养瓶底层70%~80%进行传代,稳定传代3次后进行实验。
1.2.4.2 细胞毒性测定
取WRL-68细胞(细胞密度为1×105 cells/mL)于96孔培养板,每孔接种100 µL,37 ℃、5% CO2的饱和湿度培养箱中培养48 h,加入不同稀释倍数的扁桃斑鸠菊叶酵素样品(稀释10、20、40、60、80倍,过0.22 µm滤膜)及VC(0.25、0.5、1、1.5、2 mg/mL)100 µL,孵育24 h。通过MTT法测定存活率[21]。
1.2.4.3 氧化应激模型建立
取WRL-68细胞(细胞密度为1×105 cells/mL)于96孔培养板,每孔接种100 µL,37 ℃、5% CO2的饱和湿度培养箱中培养48 h,每孔加入不同浓度的H2O2(400、600、800、1000、1200 µmol/L)100 µL,孵育8 h,建立氧化损伤型WRL-68细胞模型。
1.2.4.4 扁桃斑鸠菊叶酵素对H2O2诱导的WRL-68细胞存活率影响
取WRL-68细胞(细胞密度为1×105 cells/mL)置于96孔板,每孔100 µL。培养24 h后去除培养基,样品组每孔加入样品(稀释20、40、60、80倍,过0.22 µm滤膜)100 µL,阳性对照组加入0.25 mg/mL VC 100 µL,处理24 h,再利用800 µmol/L的H2O2处理8 h,通过MTT法测定存活率。
1.2.4.5 扁桃斑鸠菊叶酵素对H2O2诱导的WRL-68细胞内ROS水平及抗氧化酶系影响
参照Huang等[22]的测定方法,并略作修改。取WRL-68细胞(细胞密度为1×105 cells/mL)于24孔板中,每孔1 mL,培养24 h。每孔加入样品(稀释20、40、60、80倍,过0.22 µm滤膜)1 mL处理24 h,再利用800 µmol/L的H2O2处理8 h,每孔加入1 mL 10 µmol/L 2',7'-二氯荧光黄双乙酸盐活性氧探针(DCFH-DA),37 ℃避光孵育30 min,用无血清细胞培养基洗三次,加1 mL PBS缓冲液,用荧光酶标仪测定细胞内ROS水平;每孔加入样品(稀释20、40、60、80倍,过0.22 µm滤膜)1 mL处理24 h,再利用800 µmol/L的H2O2处理8 h,收集细胞上清液,用试剂盒测定SOD、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH)酶活力,并根据BCA检测试剂盒测定胞内蛋白质含量。
1.3 数据处理
所有试验均进行3次重复,结果表示为平均值±标准偏差(Mean±SD),采用Origin Pro 8.6对结果进行统计学分析。
2. 结果与分析
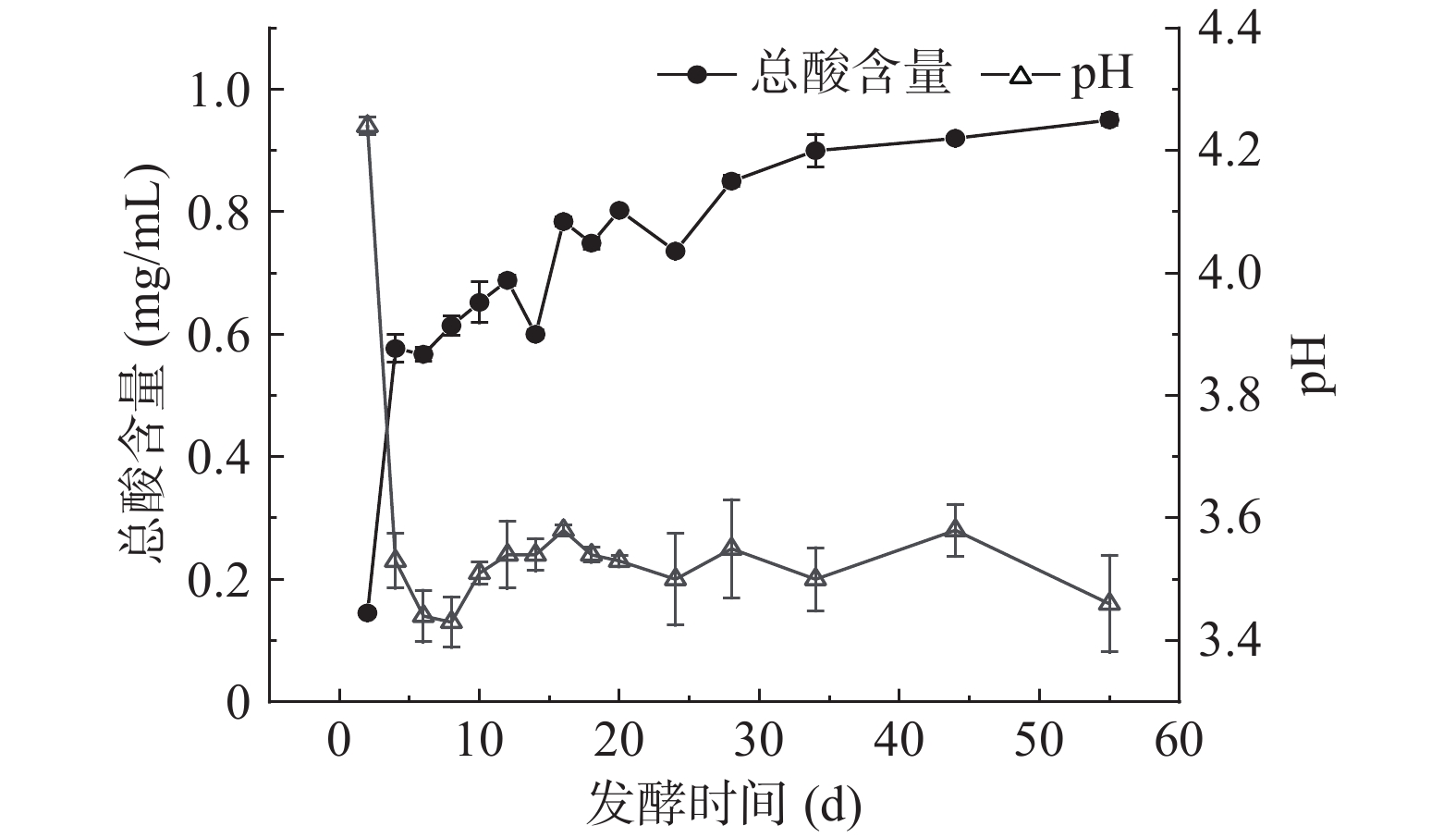
2.1 扁桃斑鸠菊叶水分含量及酵素发酵过程中总酸含量和pH变化
经测得叶中水分含量为78.72%±0.29%,水提物的pH为5.84,总酸含量为31.25±0.33 µg/mL。发酵过程中总酸及pH变化见图1,由图1可知,发酵过程中总酸含量先从0.14±0.01 mg/mL急剧增加至0.58±0.02 mg/mL,再缓慢增加至趋于稳定。pH呈先快速降低,然后缓慢波动的趋势。发酵4 d,总酸含量急剧增加,pH极显著下降至3.5(P<0.01),可能因发酵过程中乳酸菌为优势微生物群,在发酵初期快速生长,苹果酸、柠檬酸进一步代谢产生乙酸、乳酸等有机酸,使整个发酵环境条件的pH下降[23-24];还可能因为发酵初期,扁桃斑鸠菊叶细胞在高渗透压情况下,细胞破裂,胞内有机酸渗出[25],且复杂的微生物系统,加速了酸性物质的代谢产生。发酵至第10 d,pH呈现出上下波动状态,基本趋于稳定。总酸含量在第4~28 d呈波动上升趋势,后趋于稳定,发酵第55 d总酸含量达到最大值,为0.95±0.01 mg/mL。
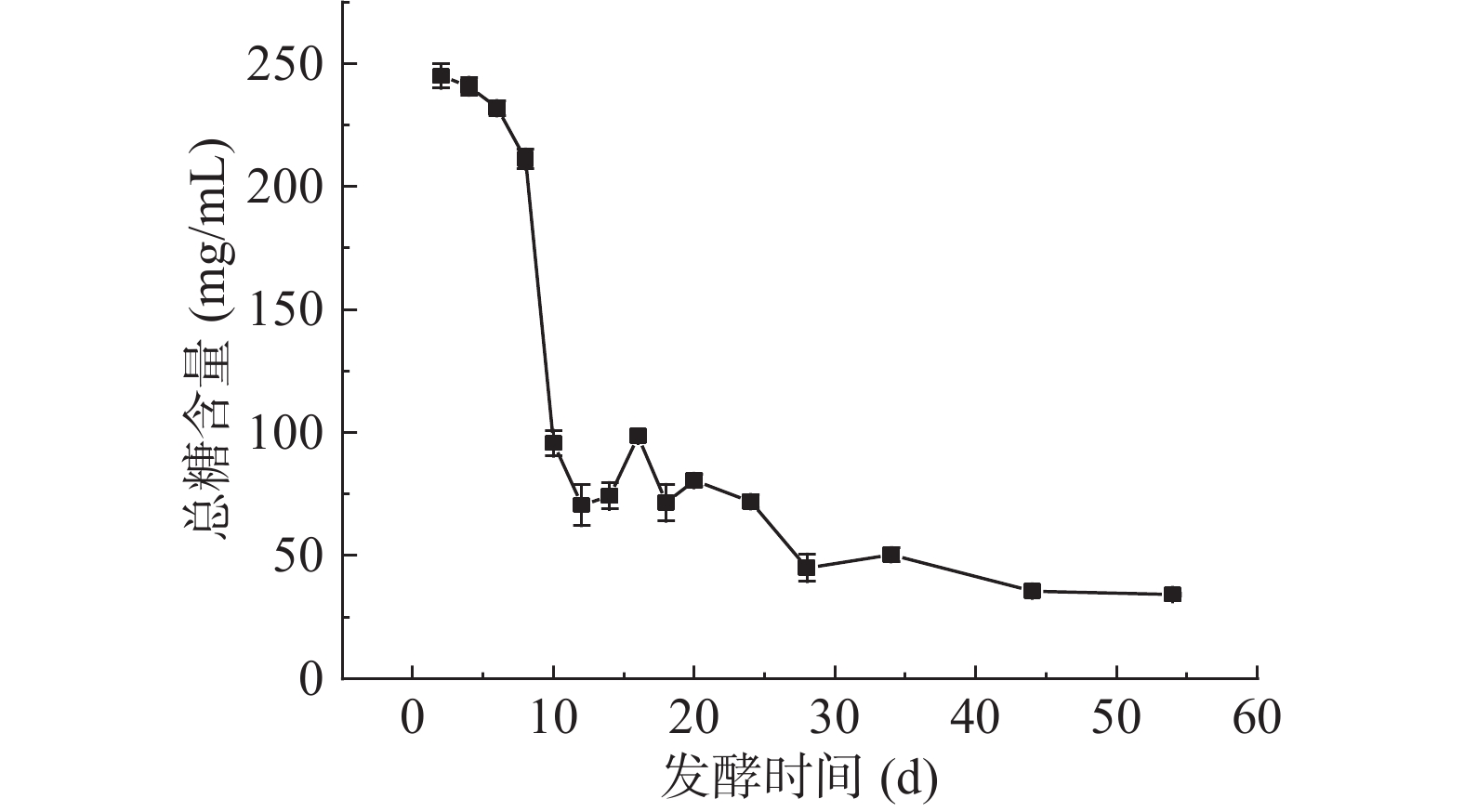
2.2 扁桃斑鸠菊叶酵素发酵过程中总糖含量的变化
总糖包含还原性糖及可水解为还原性单糖的总量,其含量决定着酵素的组织、质量形态及营养价值。葡萄糖回归方程为y=4.3014x+0.0165,R2=0.9998。总糖含量变化如图2所示,发酵第2~8 d总糖含量逐渐下降,最大值在第2 d,为244.95±4.89 mg/mL,第8~10 d含量急剧下降。Yang[18]与Otegbayo[26]等研究结果与本文一致,随着发酵时间的延长,总糖含量总体呈现下降趋势,扁桃斑鸠菊叶酵素发酵第8~10 d时,pH低至3.43,此时总糖含量的急速下降,可能因乳酸菌的大量增殖导致蔗糖的利用率增加,而乳酸菌的剧增会进一步代谢酸性有机酸的生成,特别是乳酸,会影响发酵液的酸碱度,较酸环境则又会抑制乳酸菌的生长,导致蔗糖利用量降低,表现为发酵整体过程中总糖含量呈现缓慢下降趋势。叶水提物总糖含量测定为50.69±0.42 mg/mL,酵素发酵过程添加了糖,所以发酵初期酵素总糖含量较高,发酵时间的延长总糖含量降低,最终含量略低于水提物。
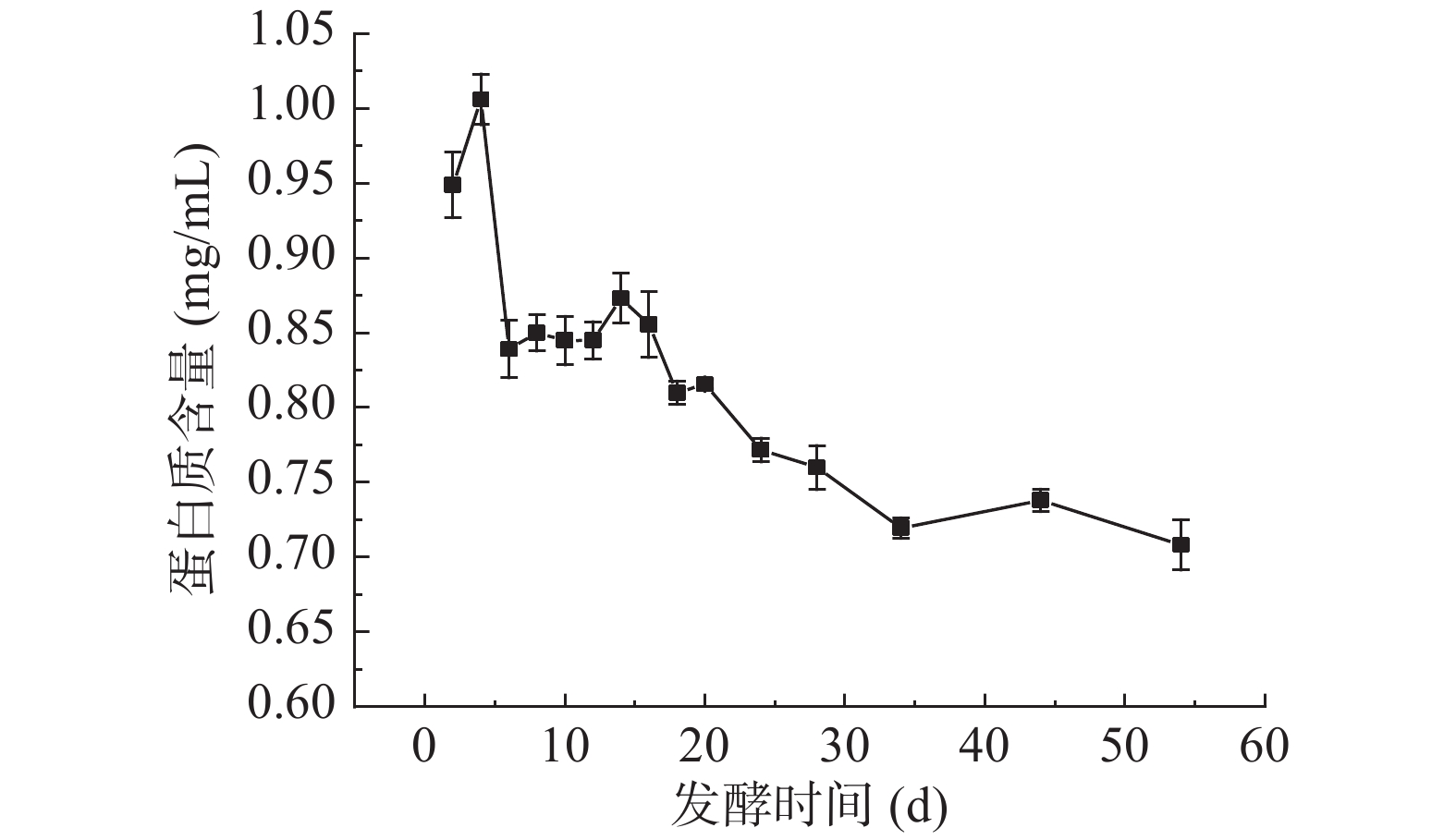
2.3 扁桃斑鸠菊叶酵素发酵过程中可溶性蛋白质含量的变化
蛋白质是人体组成成分的基础物质,评价食物中蛋白质营养价值是食物营养学最基本的内容。由图3可知,发酵初期,可溶性蛋白质含量上升,第4 d达到最大值,为1.01±0.02 mg/mL,而叶水提物蛋白质含量测得为0.24±0.02 mg/mL,经发酵蛋白含量提高了320.83%。陈燕飞[27]指出,微生物在低渗透压食品中容易生长,在高渗透压下易于脱水死亡,只有少数微生物可耐受高渗透压环境。发酵前期,高渗透压抑制大多数菌种生长和代谢,原料本身含有的蛋白质可能经过扩散作用释放到发酵液中,使得可溶性蛋白质含量略微上升。4~6 d可溶性蛋白质含量快速下降至0.84±0.02 mg/mL,可能是被酵母代谢形成氨基酸或脂肪酸,或发酵过程中pH的改变会促进蛋白质的降解[28]。发酵6~12 d开始,可溶性蛋白质含量动态稳定。此时发酵液中碳源充足且原料本身含营养物质,微生物适应环境,蛋白质的生成与代谢处于一个平衡时期,表现为稳定的蛋白质含量。随着发酵时间的延长,总糖含量趋于稳定,微生物生长繁殖速率降低,体系蛋白质趋于稳定[29]。
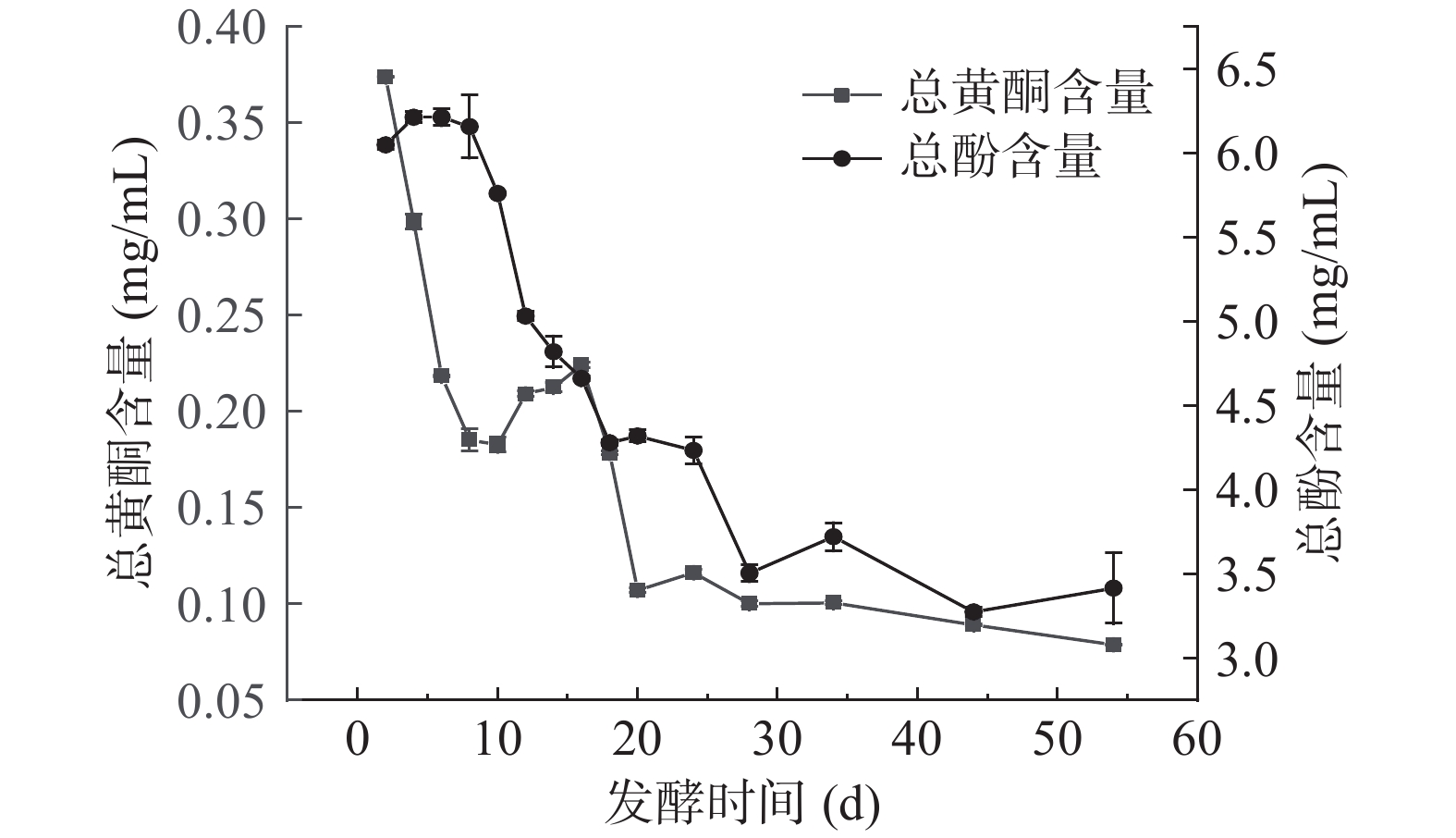
2.4 扁桃斑鸠菊叶酵素发酵过程中总酚及总黄酮含量的变化
实验测得扁桃斑鸠菊叶水提物中总酚及总黄酮含量分别为1.14±0.02和0.70±0.02 mg/mL,与水提物相比,适当时间的发酵可以提高总酚含量,但是总黄酮含量降低。酵素发酵过程中总酚和总黄酮含量变换见图4,发酵至第6 d,总酚含量达到最大,为6.21±0.05 mg/mL,随后开始下降。发酵后期的总酚含量下降,可能因为可水解的单宁在水解过程中分解为没食子酸和葡萄糖或鞣花酸和葡萄糖,随着发酵的进行,微生物代谢和酶活性的增强,部分酚类代谢物最终被分解为酸[30]。发酵第2 d,总黄酮的含量为0.37±0.04 mg/mL,随着发酵时间的延长,总黄酮含量呈先下降后趋于稳定的趋势。发酵过程中总酚和总黄酮含量的降低与植物细胞内的多酚氧化酶密切相关,如酪氨酸酶、儿茶酚氧化酶、漆酶,能够特异性催化多种酚类物质氧化,从而使发酵过程中总酚和总黄酮的含量降低[31]。原料特性差异,总酚、总黄酮含量随发酵含量变化也有差异,比如红豆越橘发酵过程中,二者含量同呈下降趋势[32],蓝莓酒发酵过程中,都呈现先上升后下降的趋势[33]。
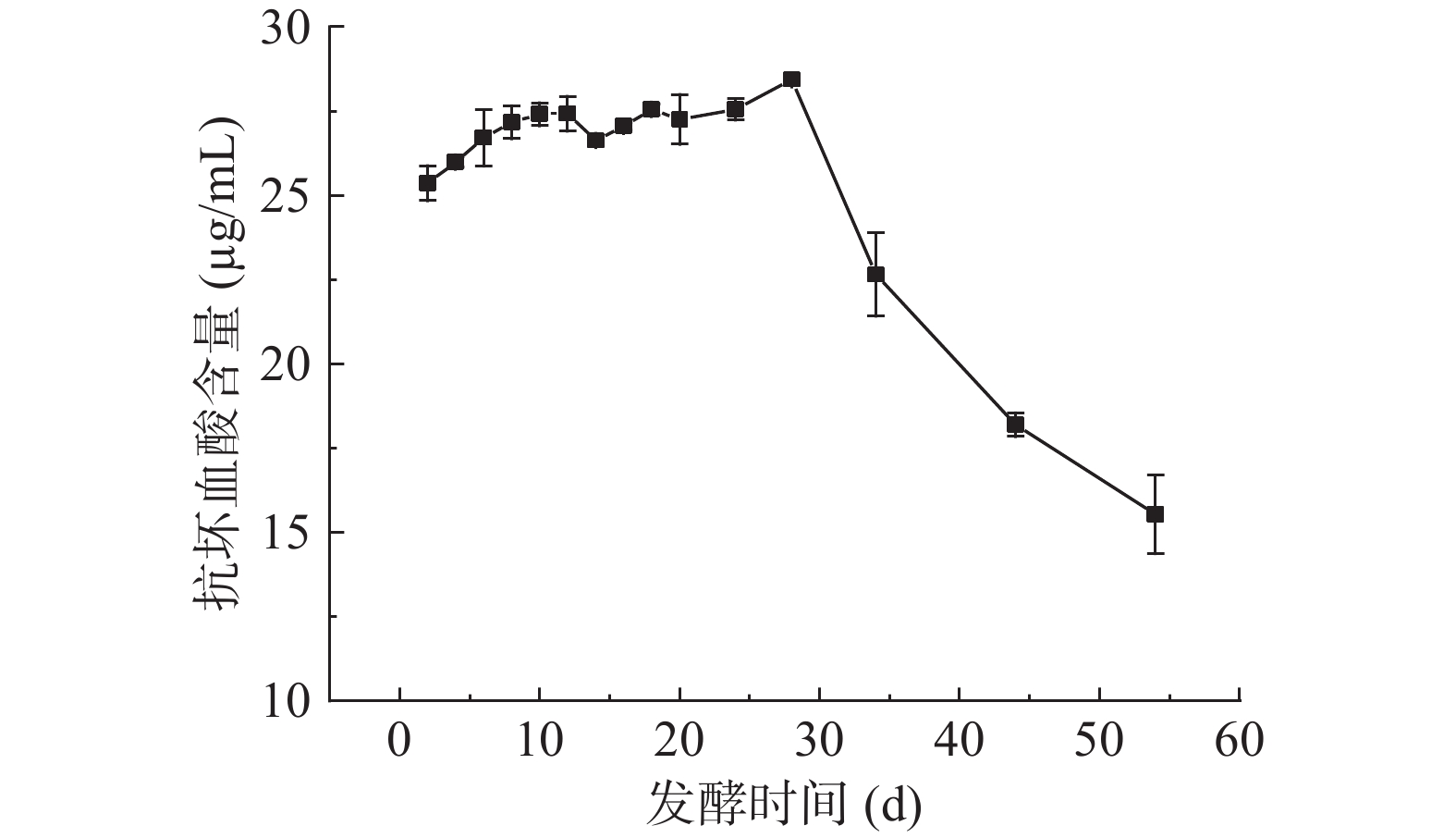
2.5 扁桃斑鸠菊叶酵素发酵过程中抗坏血酸含量的变化
抗坏血酸又称VC,富集于新鲜果蔬中,具有重要的抗氧化作用,是免疫系统重要的功能物质,也是营养学指标之一[34]。测得水提物中VC含量为2.00±0.01 μg/mL,酵素中VC含量如图5所示。酵素发酵前28 d VC含量缓慢增加,第28 d达到最大值,含量为28.44±0.31 μg/mL,随着发酵的继续,VC含量下降。田木星等[35]在发酵慕萨莱思酒过程中,同样发现VC含量先上升后下降。VC含量的上升可能与细胞内容物的溶出及微生物代谢有关。VC含量下降,可能与酵素制备、储存过程中温度、氧气、发酵时间等因素有关[26,35]。
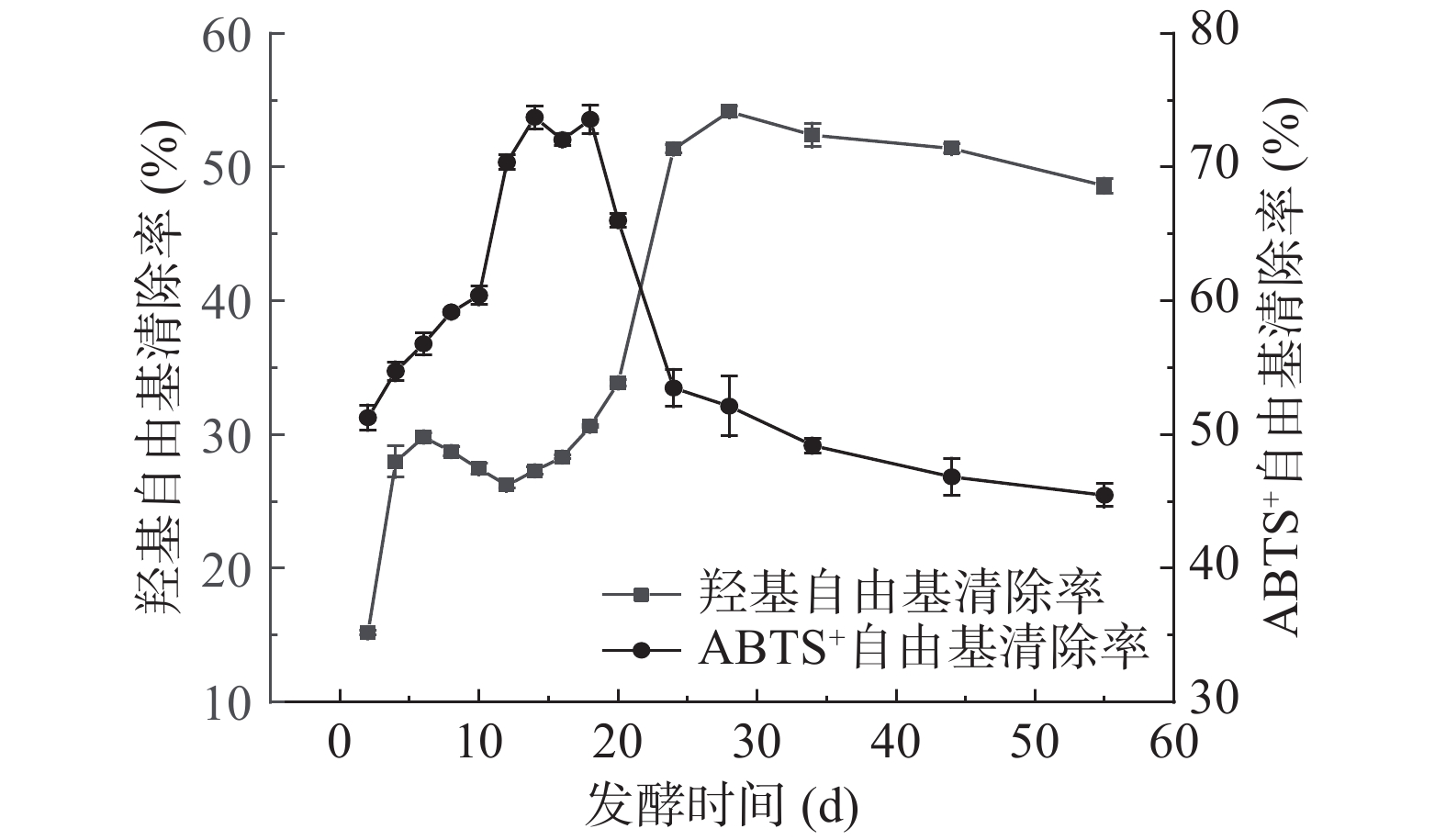
2.6 扁桃斑鸠菊叶酵素发酵过程抗氧化能力变化
自由基的存在可能会破坏细胞膜,损伤基因致使细胞变异,导致机体产生各种不适症状和疾病。而抗氧化剂具有清除自由基作用,是对人体有益的物质。叶水提物在相同取样量下,对于羟基自由基和ABTS+自由基清除能力分别为28.97%±1.31%和82.55%±1.77%。扁桃斑鸠菊叶酵素样品在发酵过程中抗氧化能力变化如图6所示,随着发酵时间的延长,羟基自由基清除能力总体呈上升趋势,第28 d清除能力达到最大,为54.14%±0.43%。发酵第2~28 d,酵素对ABTS+自由基清除能力总体呈现上升趋势,在2 d时清除能力最低,为51.26%±0.94%。第14 d时最高,为73.72%±0.86%。从18 d开始,清除ABTS+自由基的能力逐步下降,最低达45.46%±0.86%。研究表明:适当时间的发酵,不仅会产生乳酸影响食品的味道和风味,而且还可能将植物胞内水溶性的生物活性化合物释放到发酵液中,增强原料的抗氧化活性[36]。此外也有研究表明抗氧化能力的强弱往往与生物活性物质之间存在浓度依赖关系[37]。
2.7 发酵过程中抗氧化能力与代谢产物相关性分析
在发酵制备扁桃斑鸠菊酵素的过程中,发酵液具有较高的羟基自由基及ABTS+自由基清除能力,这可能与酵素中的总酸、总酚、总黄酮、抗坏血酸等代谢产物共同作用有关。扁桃斑鸠菊叶酵素发酵过程中理化指标经标准化处理后,利用Pearson法进行相关性分析,结果如表1所示,从表1中可以看出,总酸与羟基自由基清除能力呈极显著正相关性(P<0.01),而总酚和总黄酮含量与羟基自由基清除能力呈极显著负相关性(P<0.01),VC含量与ABTS+自由基清除能力呈显著负相关性(P<0.05);与寇婷婷等[38]研究发现相似,土豆提取物中总酚含量与羟基自由基清除能力呈负相关性,总黄酮与羟基自由基清除能力呈非常显著负相关性(P<0.01)。抗氧化能力强弱,可能是由总酸、总黄酮、总酚、VC等物质含量的相互影响共同决定。
表 1 经标准化处理后各参数的相关性分析Table 1. Correlation analysis of parameters after normalization组别 ZpH ZTA ZTP ZTF ZVc ZHR ZABTS ZpH 1 −0.711** 0.224 0.635* 0.019 -0.432 −0.120 ZTA / 1 −0.805* −0.906** −0.408 0.791** −1.22 ZTP / / 1 0.805** 0.490 −0.815** 0.221 ZTF / / / 1 0.377 −0.859** 0.291 ZVc / / / / 1 −0.451 0.610* ZHR / / / / / 1 −0.566* ZABTS 1 注:ZpH、ZTA、ZTP、ZTF、ZVc、ZHR、ZABTS分别代表标准化的pH、总酸、总酚、总黄酮、抗坏血酸、羟基自由基清除能力、ABTS+自由基清除能力;*表示P<0.05;**表示P<0.01。 2.8 氧化应激防护作用
从2.6可知,发酵至第28 d,样品的羟基自由基清除能力最强,ABTS+自由基清除能力也略高于50%,选取发酵28 d的样品,通过细胞实验,考察其氧化应激防护作用。
2.8.1 毒性试验结果
本研究选取扁桃斑鸠菊叶酵素及VC不同浓度检测器其对WRL-68细胞存活率的影响,结果如表2所示。酵素组相比空白对照组,仅VAJ10存在极显著性差异(P<0.001),其他浓度下细胞存活率无显著性差异,所以选择VAJ20、VAJ40、VAJ60、VAJ80浓度测定其对细胞氧化应激保护作用。VC组相比空白对照组,仅0.25 mg/mL浓度作用下无显著性差异,故选择此浓度VC做阳性对照。
表 2 不同浓度VAJ及VC对WRL-68细胞存活率的影响Table 2. Effects of different concentrations of VAJ and VC on the survival rate of WRL-68 cells组别 存活率(%) 组别 存活率(%) 空白对照组 100.00±2.72 对照组 100±2.79 VAJ10 30.00±1.74*** VC-0.25 96.18±2.76 VAJ20 97.29±1.67 VC-0.50 113.98±1.27** VAJ40 98.26±4.90 VC-1.00 116.16±1.94*** VAJ60 101.77±2.52 VC-1.50 80.48±2.61*** VAJ80 100.66±2.78 VC-2.00 50.15±3.50*** 注:VAJ10、VAJ20、VAJ40、VAJ60、VAJ80分别代表标扁桃斑鸠菊叶酵素稀释10、20、40、60、80倍;VC-0.25、VC-0.50、VC-1.00、VC-1.50、VC-2.00分别代表VC 0.25、0.50、1.00、1.50、2.00 mg/mL;与空白对照组比较,**,差异非常显著(P<0.01);***,差异极显著(P<0.001)。 2.8.2 氧化应激模型建立
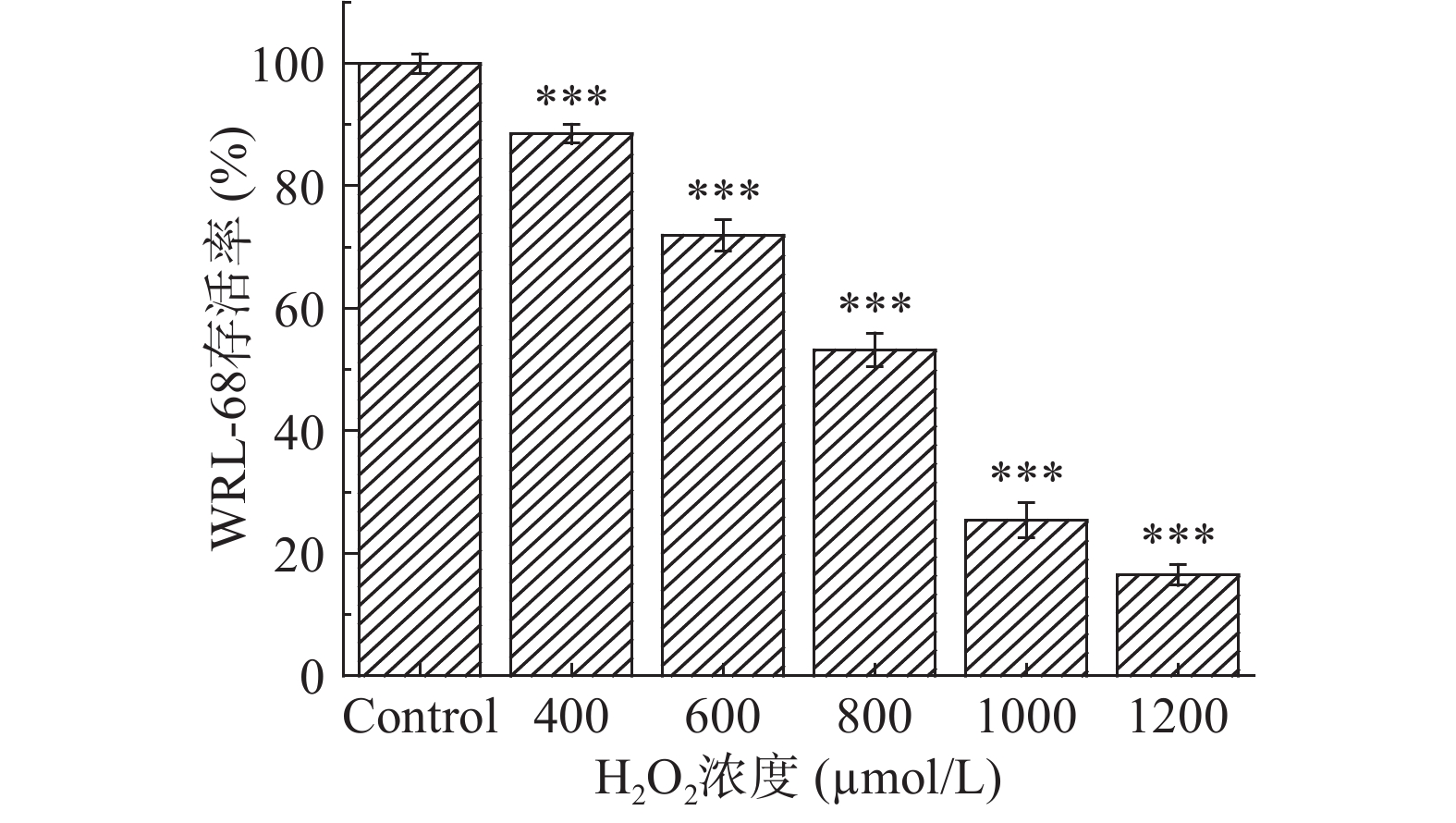
用不同浓度H2O2进行造模,作用于WRL-68细胞,构建氧化应激损伤模型。选取400~1200 µmol/L的H2O2,处理8 h,对细胞存活率的影响如图7所示,WRL-68细胞的存活率随着H2O2浓度的增加呈逐渐降低趋势。与空白对照组相比,400~1200 µmol/L H2O2能极显著抑制细胞增殖(P<0.001),且呈明显的剂量依赖性。当H2O2浓度为800 µmol/L时,对WRL-68细胞的抑制率为53.21%±2.80%,接近半数抑制浓度,选取此浓度用于建立氧化应激损伤模型。
2.8.3 扁桃斑鸠菊叶酵素对WRL-68细胞氧化应激损伤的存活率影响
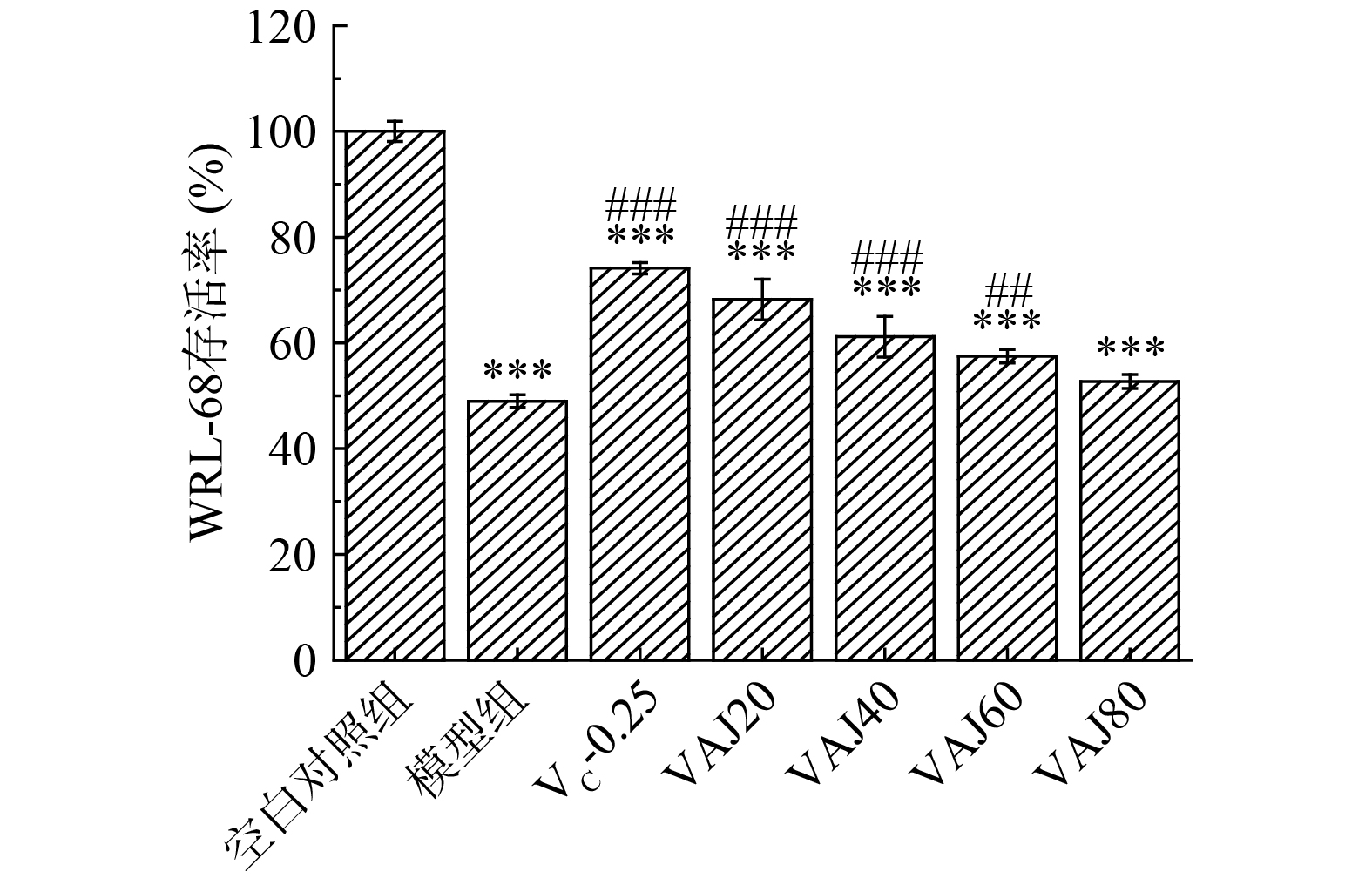
扁桃斑鸠菊叶酵素及H2O2作用WRL-68细胞后细胞存活率如图8所示,模型组细胞存活率降至48.98%±1.20%。VC-0.25、VAJ20、VAJ40、VAJ60、VAJ80细胞存活率较模型组分别提高至74.14%±1.07%、68.22%±3.82%、61.18%±3.86%、57.50%±1.29%及52.58%±0.09%。表明不同浓度扁桃斑鸠菊叶酵素样品均可减缓因H2O2诱导而引起的氧化损伤,且存在浓度依赖性,原因可能是样品内VC、总酚等成分清除活性氧达到保护细胞免受氧化损伤。
2.8.4 扁桃斑鸠菊叶酵素对H2O2诱导的WRL-68细胞内ROS水平及抗氧化酶系影响
H2O2等外界氧化物质的刺激,会使线粒体内产生的ROS含量上升,而SOD、CAT、GSH-Px等酶是生物自带的抗氧化剂[39]。由表3可知,与对照组相比,模型组ROS含量显著增加(P<0.01),胞内SOD、CAT、GSH-Px等酶活显著下降(P<0.001)。说明H2O2诱导的WRL-68细胞氧化损伤模型造模成功。和模型组相比较,各组扁桃斑鸠菊叶酵素样品都能极显著降低ROS的量(P<0.001)。
表 3 不同浓度VAJ对H2O2作用WRL-68细胞后胞内ROS、SOD、CAT、GSH-Px的影响Table 3. Effect of VAJ on intracellular ROS、SOD、CAT、GSH-Px in H2O2-induced WRL-68 cells组别 ROS(% of control) SOD(U/mg prot) CAT(units/mg prot) GSH-Px(mU/mg prot) 空白对照组 100±5.64 57.74±1.76 71.01±2.73 230.92±1.22 模型组 236.93±20.42*** 38.44±0.99*** 39.54±0.06*** 53.11±0.99*** VC 112.00±0.51### 54.86±0.65### 89.84±4.79***### 158.86±0.75***### VAJ20 122.94±2.87*### 54.08±5.24*### 68.86±4.11### 173.91±2.08***### VAJ40 141.34±6.47***### 45.08±1.61***# 65.51±4.39### 274.95±18.51***### VAJ60 159.91±2.03***### 41.96±1.41***# 64.75±2.21### 145.74±5.43***### VAJ80 186.54±11.87***### 42.92±3.60***# 42.67±1.15***### 132.86±13.07***### 注:与空白对照组比较,*,差异显著(P<0.05);***,差异极显著(P<0.001);与模型组比较,#,差异显著(P<0.05);###,差异极显著(P<0.001)。 WRL-68细胞经800 µmol/L H2O2作用8 h,细胞因氧化损伤造成半数抑制。经酵素样品预处理再用H2O2诱导氧化应激损伤,与模型组相比,不同浓度的扁桃斑鸠菊叶酵素VAJ20、VAJ40、VAJ60、VAJ80可显著提高H2O2诱导的WRL-68细胞内SOD活力(P<0.05、P<0.001、P<0.001、P<0.001),且VAJ20组效果接近VC组;各组胞内CAT活力都有所提高,尤其是VAJ20组,较模型组提高了29.32%,有效减缓因H2O2引起的CAT活力下降,VAJ40、VAJ60、VAJ80胞内CAT活力相比模型组也都有所提高(P<0.001),酵素在稀释20~60倍情况下对于CAT活力影响差异较小;经酵素样品预处理后,GSH-Px活力都显著提升,和模型组相比较存在极显著差异(P<0.001),其中VAJ40组GSH-Px活力比模型组提高了417.70%,有效减缓了因H2O2引起的GSH-Px活力下降。实验中各组抗氧化酶系活力的提高,可能是在扁桃斑鸠菊叶酵素发酵过程,生成某些具有抗氧化活性的小分子物质,提高抗氧化酶系到正常水平,起到抗氧化应激保护的作用[40]。
3. 结论
本研究以扁桃斑鸠菊叶为原料,通过自然发酵制备酵素,监测发酵过程中各理化指标及体外抗氧化能力的变化,并进行相关性分析。酵素各指标与叶水提物对比,发酵后可以提高扁桃斑鸠菊叶蛋白质、总酚与VC含量,而总酚与VC在抗氧化方面具有重要的作用。抗氧化实验方面,酵素相比水提物表现出更强的羟基自由基清除能力。在细胞氧化应激方面,可能因代谢生成某些小分子功能成分,酵素能够通过提高胞内抗氧化酶系SOD、CAT、GSH-Px的酶活力,起到氧化应激损伤的防护作用。通过以上实验,能较好地评价扁桃斑鸠菊叶酵素的抗氧化能力,且发酵后相比较水提物能提高蛋白质、总酚与VC含量,证明了发酵扁桃斑鸠菊叶具有一定的优势,以此为扁桃斑鸠菊叶酵素产业的应用开发提供一定的数据支撑。
-
表 1 经标准化处理后各参数的相关性分析
Table 1 Correlation analysis of parameters after normalization
组别 ZpH ZTA ZTP ZTF ZVc ZHR ZABTS ZpH 1 −0.711** 0.224 0.635* 0.019 -0.432 −0.120 ZTA / 1 −0.805* −0.906** −0.408 0.791** −1.22 ZTP / / 1 0.805** 0.490 −0.815** 0.221 ZTF / / / 1 0.377 −0.859** 0.291 ZVc / / / / 1 −0.451 0.610* ZHR / / / / / 1 −0.566* ZABTS 1 注:ZpH、ZTA、ZTP、ZTF、ZVc、ZHR、ZABTS分别代表标准化的pH、总酸、总酚、总黄酮、抗坏血酸、羟基自由基清除能力、ABTS+自由基清除能力;*表示P<0.05;**表示P<0.01。 表 2 不同浓度VAJ及VC对WRL-68细胞存活率的影响
Table 2 Effects of different concentrations of VAJ and VC on the survival rate of WRL-68 cells
组别 存活率(%) 组别 存活率(%) 空白对照组 100.00±2.72 对照组 100±2.79 VAJ10 30.00±1.74*** VC-0.25 96.18±2.76 VAJ20 97.29±1.67 VC-0.50 113.98±1.27** VAJ40 98.26±4.90 VC-1.00 116.16±1.94*** VAJ60 101.77±2.52 VC-1.50 80.48±2.61*** VAJ80 100.66±2.78 VC-2.00 50.15±3.50*** 注:VAJ10、VAJ20、VAJ40、VAJ60、VAJ80分别代表标扁桃斑鸠菊叶酵素稀释10、20、40、60、80倍;VC-0.25、VC-0.50、VC-1.00、VC-1.50、VC-2.00分别代表VC 0.25、0.50、1.00、1.50、2.00 mg/mL;与空白对照组比较,**,差异非常显著(P<0.01);***,差异极显著(P<0.001)。 表 3 不同浓度VAJ对H2O2作用WRL-68细胞后胞内ROS、SOD、CAT、GSH-Px的影响
Table 3 Effect of VAJ on intracellular ROS、SOD、CAT、GSH-Px in H2O2-induced WRL-68 cells
组别 ROS(% of control) SOD(U/mg prot) CAT(units/mg prot) GSH-Px(mU/mg prot) 空白对照组 100±5.64 57.74±1.76 71.01±2.73 230.92±1.22 模型组 236.93±20.42*** 38.44±0.99*** 39.54±0.06*** 53.11±0.99*** VC 112.00±0.51### 54.86±0.65### 89.84±4.79***### 158.86±0.75***### VAJ20 122.94±2.87*### 54.08±5.24*### 68.86±4.11### 173.91±2.08***### VAJ40 141.34±6.47***### 45.08±1.61***# 65.51±4.39### 274.95±18.51***### VAJ60 159.91±2.03***### 41.96±1.41***# 64.75±2.21### 145.74±5.43***### VAJ80 186.54±11.87***### 42.92±3.60***# 42.67±1.15***### 132.86±13.07***### 注:与空白对照组比较,*,差异显著(P<0.05);***,差异极显著(P<0.001);与模型组比较,#,差异显著(P<0.05);###,差异极显著(P<0.001)。 -
[1] Oyeyemi I T, Akinlabi A A, Adewumi A, et al. Vernonia amygdalina: A folkloric herb with anthelminthic properties[J]. Beni-Suef University Journal of Basic & Applied Sciences,2018,7(1):43−49.
[2] Alara O R, Abdurahman N H, Olalere O A. Ethanolic extraction of flavonoids, phenolics and antioxidants from Vernonia amygdalina leaf using two-level factorial design[J]. Journal of King Saud University-Science,2020,32(1):7−16. doi: 10.1016/j.jksus.2017.08.001
[3] Ketharin T, Nagaraja S, Thevanayagy A. Screening of Vernonia amygdalina leaf extracts for antioxidant and antimicrobial activity[J]. Materials Today: Proceedings,2019,16(4):1809−1818.
[4] Abere H, Yadessa M. Antibacterial and antioxidant compounds from the flower extracts of Vernonia amygdalina[J]. Advances in Pharmacological Sciences,2018,2018(4):1−6.
[5] Fachrunisa D, Hasibuan P A Z, Harahap U. Cell cycle inhibition and apoptotic induction of Vernonia amygdalina Del. leaves extract on mcf-7 cell line[J]. Open access Macedonian Journal of Medical Sciences,2019,7(22):3807−3810. doi: 10.3889/oamjms.2019.509
[6] Adefisayo M A, Akomolafe R O, Akinsomisoye S O, et al. Gastro-protective effect of methanol extract of Vernonia amygdalina (Del.) leaf on aspirin-induced gastric ulcer in Wistar rats[J]. Toxicology Reports,2017,4:625−633. doi: 10.1016/j.toxrep.2017.11.004
[7] Madzuki I N, Lau S F, Abdullah R, et al. Vernonia amygdalina inhibited osteoarthritis development by anti-inflammatory and anticollagenase pathways in cartilage explant and osteoarthritis-induced rat model[J]. Phytotherapy Research. 2019, 33(7): 1784-1793.
[8] Green P W C, Belmain S R, Ndakidemi P A, et al. Insecticidal activity of Tithonia diversifolia and Vernonia amygdalina[J]. Industrial Crops and Products,2017,110:15−21. doi: 10.1016/j.indcrop.2017.08.021
[9] Sultan S, Takele B T, Dereje K, et al. Treatment of malaria and related symptoms using traditional herbal medicine in Ethiopia[J]. Journal of Ethnopharmacology,2018,213:262−279. doi: 10.1016/j.jep.2017.10.034
[10] 范昊安, 沙如意, 方晟, 等. 苹果梨酵素发酵过程中的褐变与抗氧化活性[J]. 食品科学,2020,41(14):116−123. [Fan H A, Sha R Y, Fang S, et al. Browning and antioxidant activity of apple-pear Jiaosu during fermentation[J]. Food Science,2020,41(14):116−123. doi: 10.7506/spkx1002-6630-20190515-151 [11] 陈小伟, 程勇杰, 蒋立新, 等. 草莓酵素发酵过程中代谢产物及抗氧化性的变化研究[J]. 中国食品学报,2020,20(5):157−165. [Chen X W, Cheng Y J, Jiang L X, et al. Studies on the changes of metabolites and antioxidant activity during the fermentation process of strawberry Jiaosu[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(5):157−165. [12] 全国食品工业标准化技术委员会. GB 10468-1989水果和蔬菜产品pH值的测定方法[S]. 北京: 中国标准出版社, 1989. National Technical Committee on Food Industry of Standardization Administration of China. GB 10468-1989 Fruit and vegetable products-determination of pH[S]. Beijing: Standards Press of China, 1989.
[13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12456-2008食品中总酸的测定[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, Standardization Administration of the People’s Republic of China. GB/T 12456-2008 Determination of total acids in food[S]. Beijing: Standards Press of China, 2015.
[14] 中华人民共和国工业和信息化部. QB/T 5323-2018植物酵素[S]. 北京: 中国轻工业出版社, 2018. Ministry of Industry and Information Technology of the People’s Republic of China. QB/T 5323-2018 Plant Jiaosu[S]. Beijing: China Light Industry Press, 2018.
[15] 姚妞妞, 常春晖, 于宏伟, 等. 适合奶醋发酵的酵母菌发酵动力学研究[J]. 食品与发酵工业,2020,46(22):106−112. [Yao N N, Chang C H, Yu H W, et al. Study on yeast fermentation kinetics suitable for milk vinegar fermentation[J]. Food and Fermentation Industries,2020,46(22):106−112. [16] 吴永祥, 吴丽萍, 朴银美, 等. 药(食)真菌发酵豆渣的主要功能物质及生物活性变化[J]. 食品与发酵工业,2020,46(15):100−106. [Wu Y X, Wu L P, Park E M. Changes in main functional substances and biological activities of Okara fermented with medicinal and edible fungi[J]. Food and Fermentation Industries,2020,46(15):100−106. [17] 李华, 马丹妮, 吴莹晗, 等. 五种黑小麦的营养价值、抗氧化活性和淀粉消化性[J]. 食品与发酵工业,2020,46(12):80−86. [Li H, Ma D N, Wu Y H, et al. Nutritional value, antioxidant activity and starch digestibility of five Triticale varieties[J]. Food and Fermentation Industries,2020,46(12):80−86. [18] Yang X, Zhou J, Fan L, et al. Antioxidant properties of a vegetable-fruit beverage fermented with two Lactobacillus plantarum strains[J]. Food Science and Biotechnology,2018,27(6):1719−1726. doi: 10.1007/s10068-018-0411-4
[19] 周玉洁. 丹东蒲公英酵素功能性成分初步研究[D]. 沈阳: 沈阳农业大学, 2019. Zhou Y J. Preliminary study on functional components of dandelion(Taraxacum antungense Kitag.) enzyme[D]. Shenyang: Shenyang Agricultural University, 2019.
[20] 崔佳韵, 梁建芬. 不同年份新会陈皮挥发油的抗氧化活性评价[J]. 食品科技,2019,44(1):98−102. [Cui J Y, Liang J F. Antioxidant capacities of essential oils in Xinhui pericarpium citri reticulatae at different storage period[J]. Food Science and Technology,2019,44(1):98−102. [21] Shahzad M, Small D M, Morais C, et al. Protection against oxidative stress-induced apoptosis in kidney epithelium by Angelica and Astragalus[J]. Journal of Ethnopharmacology,2016,179(2):412−419.
[22] Huang D, Yin L, Liu X, et al. Geraniin protects bone marrowderived mesenchymal stem cells against hydrogen peroxideinduced cellular oxidative stress in vitro[J]. International Journal of Molecular Medicine,2018,41(2):739−748.
[23] Jimenez-Lopez J, Ruiz-Medina A, Ortega-Barrales P, et al. Phytochemical profile and antioxidant activity of caper berries (Capparis spinosa L.): Evaluation of the influence of the fermentation process[J]. Food Chemistry,2018,250:54−59. doi: 10.1016/j.foodchem.2018.01.010
[24] Wei M, Wang S, Gu P, et al. Comparison of physicochemical indexes, amino acids, phenolic compounds and volatile compounds in bog bilberry juice fermented by Lactobacillus plantarum under different pH conditions[J]. Journal of Food Science & Technology,2018,55(6):2240−2250.
[25] 张浩然, 范昊安, 顾逸菲, 等. 沙棘酵素发酵过程中代谢产物及抗氧化活性研究[J]. 食品工业科技,2020,41(11):125−133. [Zhang H R, Fan H A, Gu Y F, et al. Study on metabolites and antioxidant activity of Seabuckthorn Jiaosu during fermentation[J]. Science and Technology of Food Industry,2020,41(11):125−133. [26] Otegbayo B O, Akwa I M, Tanimola A R. Physico-chemical properties of beetroot (Beta vulgaris L.) wine produced at varying fermentation days[J]. Scientific African,2020,8:e00420. doi: 10.1016/j.sciaf.2020.e00420
[27] 陈燕飞. 渗透压对细菌的影响[J]. 太原师范学院学报(自然科学版),2012,11(1):136−139. [Chen Y F. Effect of osmotic pressure on bacteria[J]. Journal of Taiyuan Normal University (Natural Science Edition),2012,11(1):136−139. doi: 10.3969/j.issn.1672-2027.2012.01.038 [28] Karthikeyan V, Chukwan T, Suraphon T. Impact of the ripening stage of wax apples on chemical profiles of juice and cider[J]. Acs Omega,2018,3(6):6710−6718. doi: 10.1021/acsomega.8b00680
[29] 陈小伟, 范昊安, 张婷, 等. 咖啡果皮酵素发酵过程中代谢产物与抗氧化功能评价[J]. 食品研究与开发,2019,40(9):18−25, 50. [Chen X W, Fan H A, Zhang T, et al. Study on the evaluations of metabolites and antioxidant activity during the fermentation process of coffee peel jiaosu[J]. Food Research and Development,2019,40(9):18−25, 50. doi: 10.3969/j.issn.1005-6521.2019.09.004 [30] Lasinskas M, Jariene E, Vaitkeviciene N, et al. Effect of different durations of solid-phase fermentation for fireweed (Chamerion angustifolium (L.) Holub) leaves on the content of polyphenols and antioxidant activity in vitro[J]. Molecules,2020,25(4):1011. doi: 10.3390/molecules25041011
[31] Kim D H, Kim M J, Kim D W, et al. Changes of phytochemical components (urushiols, polyphenols, gallotannins) and antioxidant capacity during Fomitella fraxinea–mediated fermentation of Toxicodendron vernicifluum bark[J]. Molecules,2019,24(4):683−700. doi: 10.3390/molecules24040683
[32] 杨华, 刘亚娜, 郭德军. 红豆越橘果酒发酵过程总酚及总黄酮含量的变化[J]. 酿酒科技,2015(11):22−25. [Yang H, Liu Y N, Guo D J. The change in polyphenols content and flavonoids content during the fermentation of Vaccinium vitis-idaea wine[J]. Liquor-Making Science & Technology,2015(11):22−25. [33] 王行, 张海宁, 马永昆, 等. 蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J]. 现代食品科技,2015,31(1):90−95. [Wang X, Zhang H N, Ma Y K, et al. Dynamic changes in phenolics and their antioxidant activities during the fermentation of blueberry wine[J]. Modern Food Science and Technology,2015,31(1):90−95. [34] Richardson D P, Ansell J, Drummond L N. The nutritional and health attributes of kiwifruit: A review[J]. European Journal of Nutrition,2018,57(8):2659−2676. doi: 10.1007/s00394-018-1627-z
[35] 田木星, 王伟华, 苑贝贝, 等. 慕萨莱思酒发酵过程中主要成分变化规律研究[J]. 中国食品添加剂,2017(3):61−67. [Tian M X, Wang W H, Wan B B, et al. The research on the change pattern of main components in the fermentation process of Musalais[J]. China Food Additives,2017(3):61−67. doi: 10.3969/j.issn.1006-2513.2017.03.002 [36] Pu J, Li-Hua S, Shan-Qi S, et al. Characterization of phytochemicals and antioxidant activities of red radish brines during lactic acid fermentation[J]. Molecules,2014,19(7):9675−9688. doi: 10.3390/molecules19079675
[37] Ezekiel, D R Adewole. Antioxidant activities and nutritional compositions of Vernonia amygdalina[J]. International Journal of Basic and Applied Science,2015,4(1):9−16.
[38] 寇婷婷, 陈瑾, 范艳丽, 等. 马铃薯抗氧化活性成分研究[J]. 食品与机械,2019,35(12):158−162. [Kou T T, Chen J, Fan Y L, et al. Study on antioxidant active components of potatoes[J]. Food & Machinery,2019,35(12):158−162. [39] Xing X, Jiang Z, Tang X, et al. Sodium butyrate protects against oxidative stress in HepG2 cells through modulating Nrf2 pathway and mitochondrial function[J]. Journal of Physiology & Biochemistry,2016,73(3):405−414.
[40] Yeap S K, Beh B K, Ali N M, et al. In vivo antistress and antioxidant effects of fermented and germinated mung bean[J]. Biomed Research International,2014(1):1−6.
-
期刊类型引用(3)
1. 汤坤鹏,刘盛荣,余明明,叶丽云,王圣铕,吴小平. 扁桃斑鸠菊叶促进灵芝胞外多糖高产条件优化及抗氧化活性研究. 食品工业科技. 2024(15): 180-186 .  本站查看
本站查看
2. 李江,顾逸菲,王珍珍,蒋增良,沙如意,毛建卫. 霍山石斛酵素发酵过程中抗氧化性能的变化. 中国食品学报. 2023(03): 80-89 .  百度学术
百度学术
3. 刘敏杰,邱婷,陈琼,汪金萍. 不同发酵菌种处理对中草药酵素品质及抑菌效果的影响. 中国兽医杂志. 2022(02): 107-112 .  百度学术
百度学术
其他类型引用(3)







 下载:
下载:
 下载:
下载:



