HPLC Fingerprints of White Tea Based on Cluster Analysis
-
摘要: 采用高效液相色谱法对白茶样品中儿茶素类和生物碱类成分进行分析,建立白茶的特征性指纹图谱,为白茶的质量评价提供参考依据。以福鼎、政和等地的多种类白茶为样品,经提取溶剂、流动相、波长、流速、柱温等条件筛选,确定白茶指纹图谱高效液相色谱条件为:用70%甲醇在70 ℃条件下进行提取,色谱柱为Agilent Eclipse Plus C18(4.6 mm×250 mm,5 μm),以乙腈-0.5%乙酸为流动相进行梯度洗脱,检测波长258 nm,柱温35 ℃,进样量为10 μL;咖啡碱作为参照峰,计算共有峰相对保留时间和相对峰面积;选取中药色谱指纹图谱相似度评价系统(2012版)进行相似度评价;采用系统聚类分析法(Hierarchical cluster analysis,HCA)对其进行聚类分析。建立了白茶高效液相色谱法的指纹图谱,确认了28个共有峰;相似度评价结果显示,12批不同品种白茶相似度在0.98以上,表明不同年份不同产地的白茶样品成分组成一致;对没食子酸(Gallic acid,GA)、咖啡因(Caffeine,CAF)、表儿茶素(Epicatechin,EC)、表儿茶素没食子酸酯(Epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)、表没食子儿茶素(Epigallocatechin,EGC)六个成分进行了峰指认;系统聚类分析结果表明,存放时间对白茶成分的组成及含量有一定的影响,聚类分析将测定的白茶样品分为两类,2013、2014年为一类,2017~2020年为一类。该方法方便、快捷、简单、准确可靠,可为白茶的质量控制提供参考依据。Abstract: The catechins and alkaloids in white tea samples were analyzed by high performance liquid chromatography (HPLC), and the characteristic fingerprint of white tea was established to provide reference for the quality evaluation of white tea. Taking many kinds of white tea from Fuding, Zhenghe and other places as samples, through the selection of extraction solvent, mobile phase, wavelength, flow rate and column temperature, the HPLC conditions of white tea fingerprint were determined as follows: 70% methanol, extracted at 70 ℃, the chromatographic column was Agilent Eclipse Plus C18 (4.6 mm×250 mm, 5 μm), the gradient elution was carried out with acetonitrile −0.5% acetic acid as the mobile phase, the detection wavelength was 258 nm, the column temperature was 35 ℃, and the injection volume was 10 μL. Caffeine as a reference peak, the relative retention time and relative peak area of the common peak were calculated. The similarity evaluation system of chromatographic fingerprint of traditional Chinese medicine(version 2012) was selected to evaluate the similarity, and the systematic cluster analysis method (HCA) was used for cluster analysis.The fingerprint of white tea was established, and 28 common peaks were identified in the fingerprint. The similarity evaluation results showed that the similarity of 12 different varieties of white tea was above 0.98, which indicated that the composition of white tea samples from different years and different habitats were consistent. Gallic acid (GA), caffeine (CAF), epicatechin (EC), epigallocatechin gallate (ECG), epigallocatechin gallate (EGCG) and epigallocatechin (EGC) were identified by peak identification. The results of hierarchical cluster analysis showed that the storage time had a certain effect on the composition and content of white tea, and these white tea samples were divided into two categories: 2013, 2014 and 2017~2020. The method was convenient, fast, simple, accurate and reliable. It could provide a reliable evaluation method for quality control of white tea.
-
Keywords:
- white tea /
- HPLC /
- fingerprint /
- similarity assessment /
- hierarchical cluster analysis
-
白茶为我国六大茶类之一,属于微发酵茶,主要产地为福鼎、政和、建阳和松溪,以福鼎白茶品质最佳[1-2]。白茶为我国特有品种,其制备工艺简单,有效地保留了茶叶中的营养成分,富含维生素,氨基酸、茶多糖、茶多酚、茶色素、黄酮、生物碱等,具有极高的营养价值[3-5]。现代研究表明白茶有很好的三降三抗(降血压、降血脂[6]、降血糖[7]、抗氧化[8-10]、抗肿瘤[11]、抗辐射[12-13])的作用,还可以抗真菌[14]、解酒[15]、清除自由基[4]、调节神经紊乱[16]和延缓衰老[17]。
近年来白茶相关研究不断增加[5],目前的研究主要有:白茶制备工艺[18-19],化学成分组成与鉴定,白茶药理作用和衍生产品研究、开发[20-22]等。白茶质量控制和鉴别以感官评判为主,缺乏客观性。有学者将白茶作为组合研究对象,进行了香气成分鉴别[23]及指纹图谱初探[24-26]。关于白茶HPLC指纹图谱的系统研究尚不完善,其鉴别方法亟待提高。
本文采用中药指纹图谱与现代技术相结合的方法,对白茶多组分复杂体系进行质量评价[27],可以提供丰富的鉴别信息,便于白茶及其衍生产品的开发与研究。试验主要收集12批不同品种、年份的白茶进行研究,建立白茶的高效液相的指纹图谱,对12批白茶进行成分分析和聚类分析,为白茶的质量控制提供一定的参考。
1. 材料与方法
1.1 材料与仪器
12批白茶样品 按照GB/T30766-2014《茶叶分类》[28]标准进行处理,分别研磨过40目筛,放置于密封、干燥、温度20 ℃条件下储藏备用,样品的种类属性见表1;乙腈、甲醇 色谱纯,天津康科德公司;乙酸 色谱纯,天津市风船化学试剂科技有限公司;表儿茶素没食子酸酯(ECG) 批号:111987-201501,中国食品药品检定研究所;表儿茶素(EC) 批号:110878-200102,中国药品生物制品检定所;表没食子儿茶素(EGC) 批号:DST190703-038,乐美天医药德思特生物;表没食子儿茶素没食子酸酯(EGCG) 批号:DST191107-036,乐美天医药德思特生物;没食子酸(GA) 批号:SDT190715-008,纯度≥98.0%,乐美天医药德思特生物;咖啡碱(CAF) 批号:C11693000,纯度≥98.0%,Ehrenstorfer,德国。
表 1 茶叶样品生产信息Table 1. Tea sample production information样品编号 样品名称 产地 批号 生产日期 G1 牡丹王 福鼎 W2013001 2013 G2 白牡丹 福鼎 B2014001 2014 G3 贡眉 福鼎 G2017001 2017 G4 牡丹王 福鼎 W2018001 2018 G5 白毫银针 福鼎 H2019001 2019 G6 白牡丹 福鼎 B2019001 2019 G7 炭烤贡眉 福鼎 TG2019001 2019 G8 白毫银针 福鼎 H2020001 2020 G9 白牡丹 福鼎 B2019002 2019 G10 白牡丹 福鼎 B2020001 2020 G11 白牡丹 政和 B2020002 2020 G12 白牡丹 福鼎 B2020003 2020 Waters 2695-2998高效液相色谱仪-二极管阵列检测器、Empower 3数据工作站 美国Waters公司;KQ2200E超声波清洗器 昆山市超声仪器有限公司;SQP十万分之一天平 赛多利斯;AX124ZH万分之一天平 奥豪斯;纯水机 密理博;TD-5M低速离心机 四川蜀科仪器有限公司;HH-ZK-4智能数显恒温水浴锅 巩义市予华仪器有限责任公司;万能粉碎机 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 样品制备
对照品溶液:称取咖啡碱20 mg,EC、GA、EGC、ECG、EGCG各10 mg置于10 mL容量瓶中,加入70%甲醇超声溶解并稀释至刻度,摇匀,作为对照品储备液。量取上述标准品储备液各1.0 mL于10 mL容量瓶,用70%甲醇定容至刻度,摇匀,经0.45 μm滤膜滤过,作为对照品溶液,备用。
供试样品溶液:称取茶叶样品0.2000 g置于10 mL离心管中,加入经70 ℃预热过的70%的甲醇5 mL,并于70 ℃水浴中浸提10 min,隔5 min搅拌一次,转移上清液于离心管中,残渣用5 mL的70%甲醇溶液提取,合并两次提取液放至室温,于3500 r/min条件离心10 min,取上清液置10 mL量瓶中,加入70%甲醇定容,摇匀。取上述溶液2.0 mL置于10 mL量瓶,用70%甲醇定容,摇匀,经0.45 μm滤膜滤过,作为对照品溶液,备用[29]。
1.2.2 白茶指纹图谱建立
取12批白茶样品在“1.2.1”条件制备成供试样品溶液,进行高效液相色谱指纹图谱的分析。色谱条件:色谱柱:Agilent Eclipse Plus C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.5%乙酸;检测波长258 nm;柱温35 ℃;进样量10 µL;检测时长60 min。洗脱程序见表2。以咖啡碱的色谱峰为参照峰计算相对保留时间和相对峰面积比值。保存样品液相色谱图,并将数据导入到“中药色谱指纹图谱相似度评价系统2012版”软件进行处理,生成相应的白茶高效液相色谱指纹图谱。
表 2 高效液相色谱梯度洗脱程序Table 2. Program of HPLC gradient elution时间(min) 乙腈(%) 0.5%乙酸(%) 流速(mL/min) 0 6 94 1.0 15 10 90 0.8 30 20 80 0.8 45 30 70 0.8 60 40 60 0.8 1.2.3 指纹图谱方法学考察
1.2.3.1 咖啡碱线性关系考察
精密称取咖啡碱20 mg于10 mL容量瓶用70%甲醇定容,作为咖啡碱储备液。吸取咖啡碱250、500、750、1000、1250 μL于10 mL容量瓶用70%甲醇定容至刻度,摇匀,制得含量为0.05、0.1、0.15、0.2、0.25 g·L−1浓度的咖啡碱标准溶液,按“1.2.2”项条件下测定。
1.2.3.2 仪器精密度
称取白茶样品G9白牡丹,在“1.2.1”项下制备供试品溶液,按“1.2.2”项条件下测定,连续进样6针,选取其中峰面积大的10个峰作为共有峰(下同),记录10个共有峰的保留时间和峰面积,以咖啡碱为参照峰,计算相对保留时间和相对峰面积。
1.2.3.3 稳定性考察
称取白茶样品G9白牡丹,在“1.2.1”项下制备供试品溶液,分别于0、4、8、12、18、24 h按“1.2.2”项条件下测定,记录10个共有峰的保留时间和峰面积,以咖啡碱为参照峰,计算相对保留时间和相对峰面积。
1.2.3.4 重复性考察
称取白茶样品G9白牡丹6份,在“1.2.1”项下制备供试品溶液,按“1.2.2”项条件下测定,记录10个共有峰的保留时间和峰面积,以咖啡因为参照峰,计算相对保留时间和相对峰面积。
1.2.3.5 高效液相色谱法的白茶指纹图谱相似度的计算
12批白茶的样品在“1.2.1”项下制备供试品溶液,按“1.2.2”项条件下测定,记录茶叶样品在258 nm条件下的色谱图,并将数据导入到“中药色谱指纹图谱相似度评价系统2012版”进行色谱峰匹配,色谱峰匹配条件设置为平均数法,时间窗宽度为0.5,通过多点校正进行峰匹配,并计算样品之间的相似度。
1.2.3.6 聚类分析
为进一步考察不同批次间的差异,采用系统聚类分析(Hierarchical cluster analysis,HCA)对12批次白茶的数据进行分析,观察不同批次白茶间的差异。在SPSS18.0软件中导入12批样品相对峰面积,聚类法采用组间均联法,选用夹角余弦为刻度距离作为分类依据[30],分析不同白茶样品之间的亲疏程度。
2. 结果与分析
2.1 提取方法与色谱条件选择分析
2.1.1 提取溶剂的选择
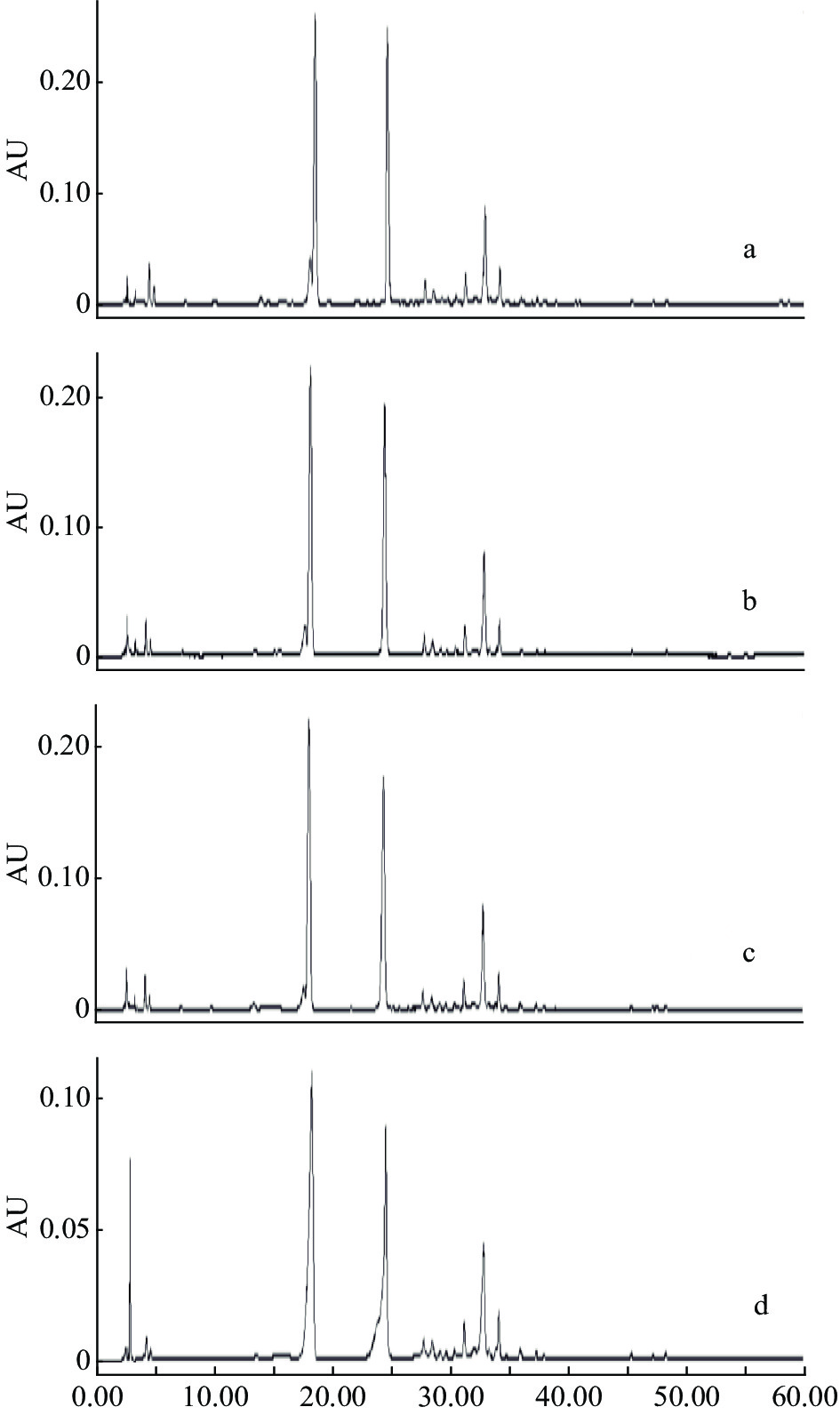
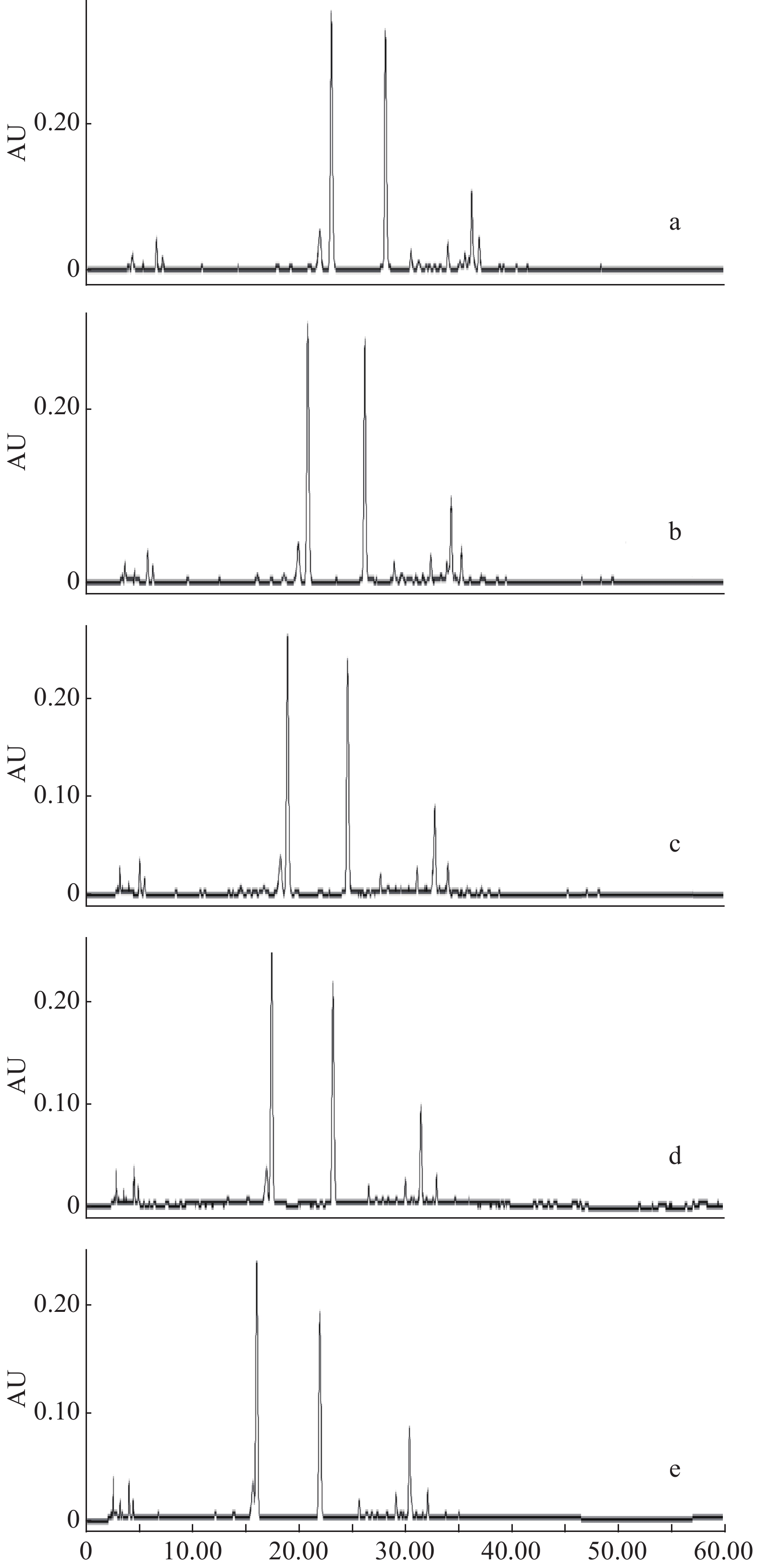
分别选择50%、60%、70%、80%、90%甲醇和50%、70%乙醇进行提取溶剂筛选,考察过程中发现采用50%、60%甲醇和50%乙醇时,白茶易漂浮于液面,浸提效果较差,故对70%、80%、90%甲醇和70%乙醇提取的样品进行液相色谱分析,结果如图1所示,提取溶剂选用70%乙醇时,色谱分离度和峰形欠佳,选用70%、80%、90%甲醇作为提取溶剂,其色谱图分离度和峰形俱佳,无明显差异,从提取成本和环保的角度考虑,未选用80%甲醇与90%甲醇,最终选用70%甲醇作为本方法的提取溶剂。
2.1.2 流动相的选择
理想的流动相可以更好地分离化合物,首先对比甲醇-水和乙腈-水两种流动相,如图2所示,可以看出乙腈-水作为流动相时色谱峰多,分离度好,进而在乙腈-水体系的基础上进行调整优化,采用乙腈−0.5%乙酸作为流动相进行考察,该条件峰形得到了进一步改善,最终确定本法流动相为乙腈−0.5%乙酸体系。
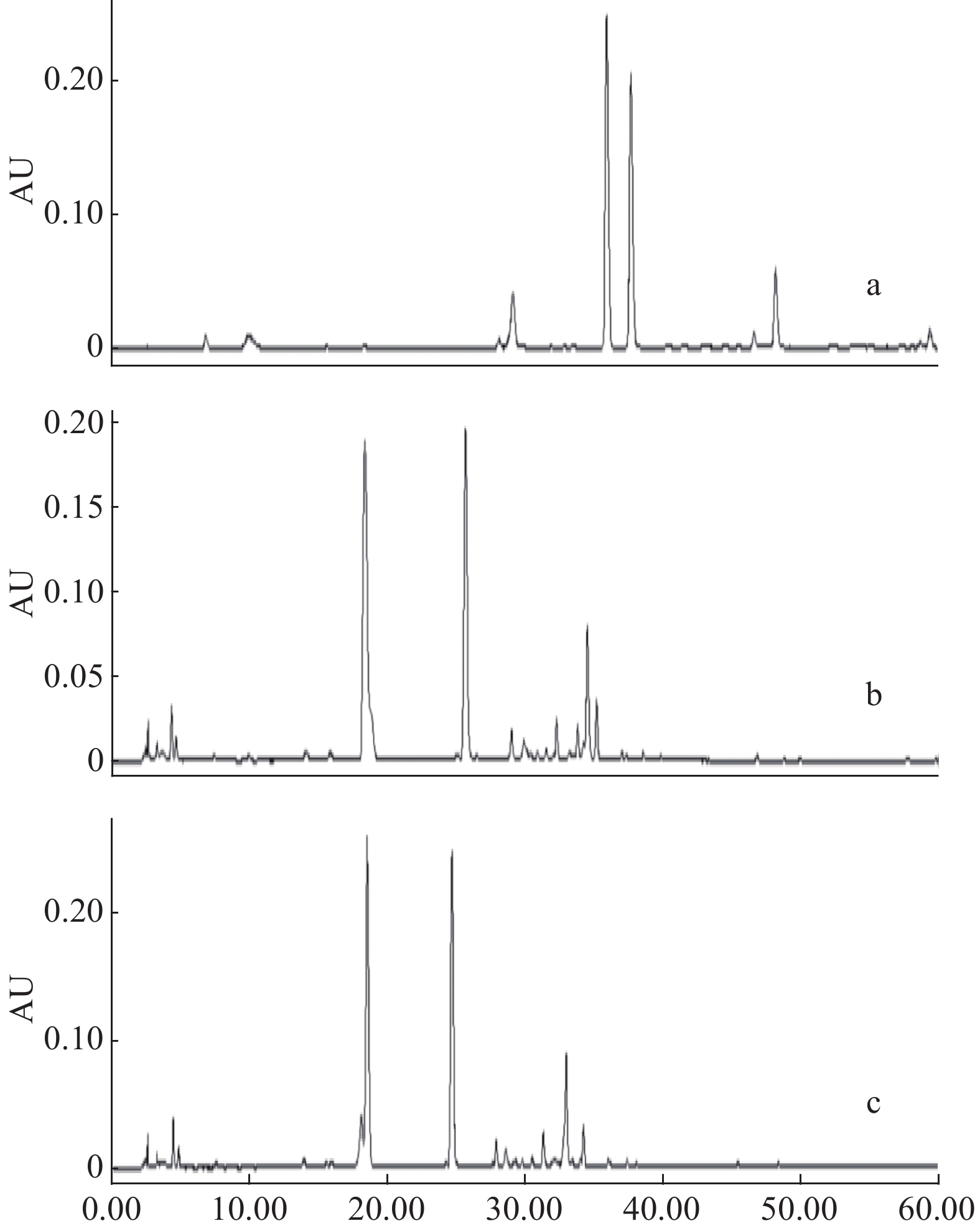
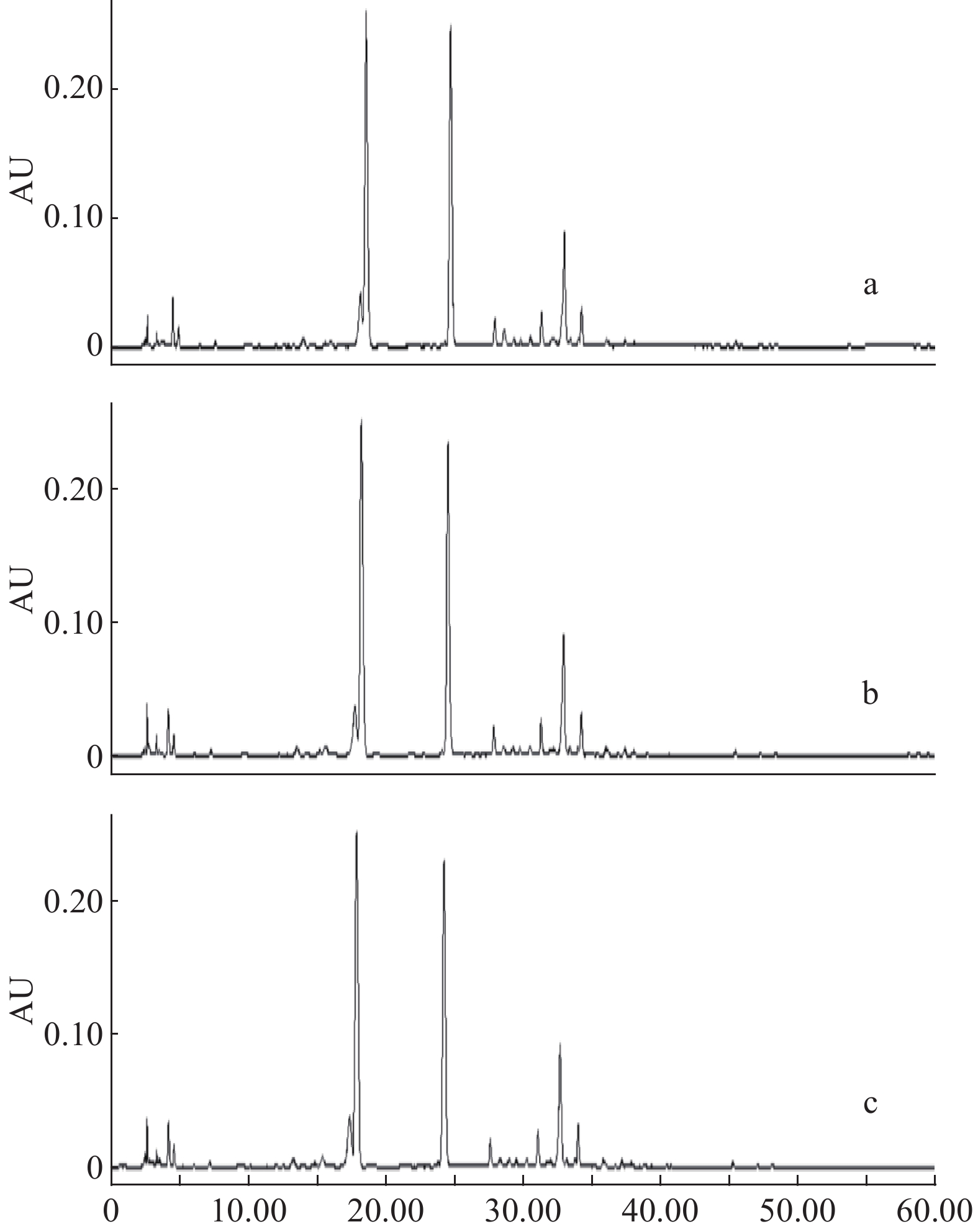
2.1.3 流动相梯度考察
由于白茶提取成分多且复杂,性质差别较大,因此,实验选用梯度作为流动相的洗脱方式。对比了下述几种梯度条件,梯度条件见表3,结果如图3所示,可以看到图3d的色谱图中的色谱峰较多,峰形较佳,确定为本实验的梯度条件。
表 3 高效液相色谱梯度考察Table 3. Program of HPLC gradient study方法1 方法2 方法3 方法4 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 0 0 1.0 0 3 0.8 0 6 1.0 0 6 1.0 60 100 1.0 15 17 0.8 5 6 1.0 15 10 0.8 30 25 0.8 8 15 0.7 30 20 0.8 35 35 0.8 25 25 0.7 45 30 0.8 40 70 0.8 35 40 0.7 50 90 1.0 60 90 1.0 2.1.4 波长的选择
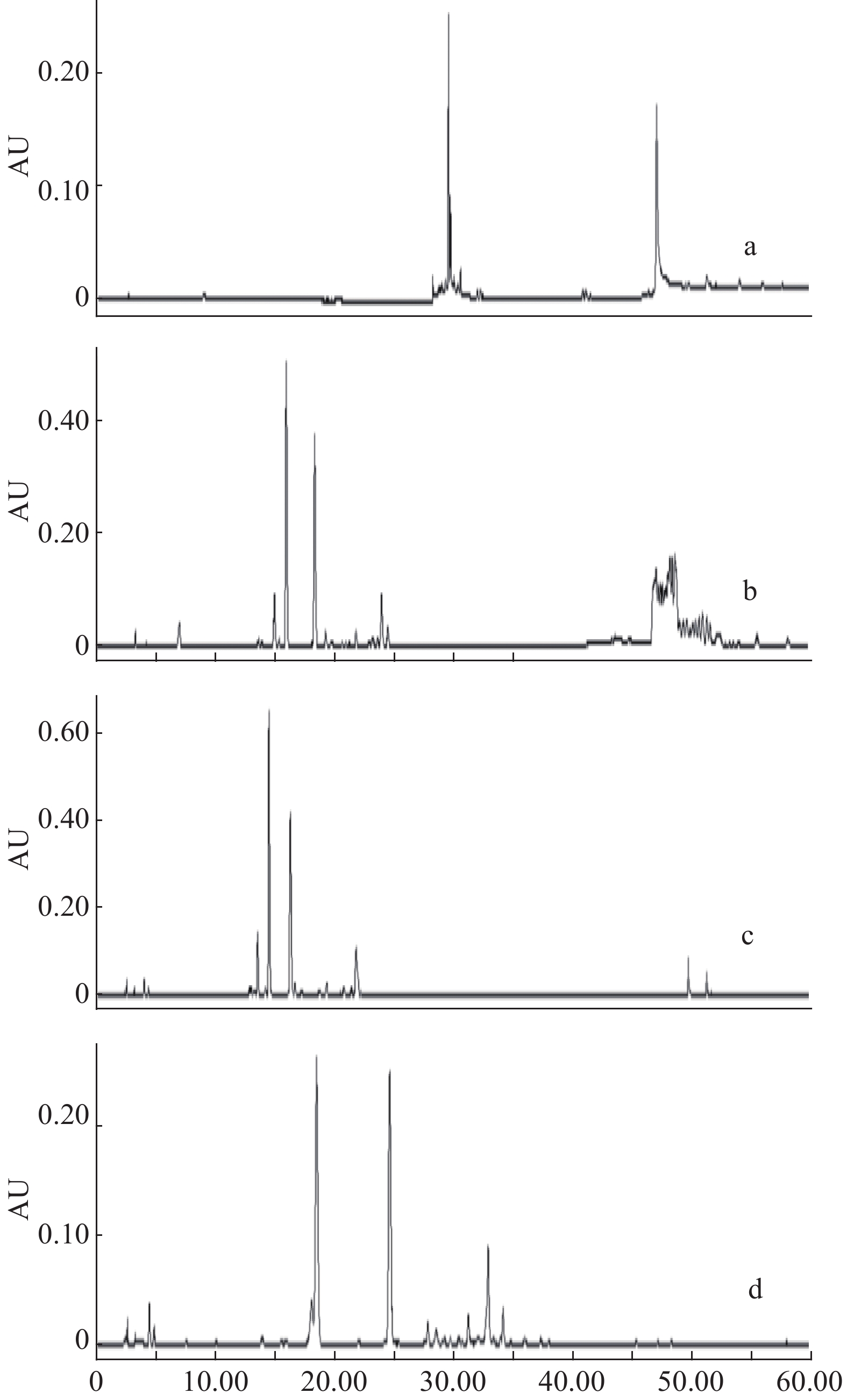
白茶中多酚类和生物碱类成分液相色谱的最大吸收波长多集中在270~280 nm之间,以270~280 nm为轴,选取240、258、270、280、300 nm几个波长,结果如图4所示,258 nm时基线平稳,色谱峰较多,容易分辨。经综合考虑确定以258 nm作为本方法的检测波长。
2.1.5 不同流速的考察
选取0.6、0.7、0.8、0.9、1.0 mL/min,考察了不同流速对分析方法的影响,结果如图5所示,随着流速升高,出峰时间整体前移,流速在0.8 mL/min时出峰早,峰分离度较好。因此,本实验的液相方法中主体流速选择0.8 mL/min。
2.1.6 柱温的确定
经考察柱温为25、30、35 ℃时,色谱图如图6所示,色谱图未见明显差异,考虑到环境温度的变化等因素,最终确定柱温为35 ℃。
2.1.7 参比对照峰的选择
参比对照峰的选择通常以保留时间和峰面积为指标,在指纹图谱的测定过程中发现咖啡碱保留时间居中,且峰面积较大,故选取咖啡碱作为参比对照峰。
2.2 指纹图谱方法学考察结果
2.2.1 咖啡碱线性关系
以峰面积为y轴,质量浓度为x轴求得回归方程为y=21031x+77833,r=0.9999,线性关系良好。
2.2.2 仪器精密度
精密称取样品G9,在“1.2.1”项下制备供试品溶液,按“1.2.2”项条件下测定,记录10个共有峰的保留时间和峰面积,并以咖啡碱为参照峰计算相对保留时间和相对峰面积。结果表明,选取的10个共有峰相对保留时间和相对峰面积RSD值均小于3%,色谱图在“中药色谱指纹图谱相似度评价系统2012版”对主要色谱峰进行匹配,相似度在0.999以上,表明仪器精密度良好。
2.2.3 稳定性考察
精密称取样品G9,在“1.2.1”项下制备供试品溶液,分别于0、4、8、12、18、24 h按“1.2.2”项条件下测定,记录10个共有峰的保留时间和峰面积,并以咖啡碱为参照峰计算相对保留时间和相对峰面积。结果表明选取的10个主要共有峰相对保留时间和相对峰面积RSD均小于5%,色谱图在“中药色谱指纹图谱相似度评价系统2012版”对主要色谱峰进行匹配,相似度在0.999以上,表示稳定性较好。
2.2.4 重复性考察
白茶样品G9经粉碎后精密称取6份,在“1.2.1”项下制备供试品溶液,按“1.2.2”项条件下测定,记录10个共有峰的保留时间和峰面积,并以咖啡碱为参照峰计算相对保留时间和相对峰面积。结果表明白茶色谱图中选取的10个共有峰相对保留时间和相对峰面积RSD值均小于3%,色谱图在“中药色谱指纹图谱相似度评价系统2012版”对主要色谱峰进行匹配,相似度在0.999以上,表明重复性良好。
2.3 指纹图谱的建立
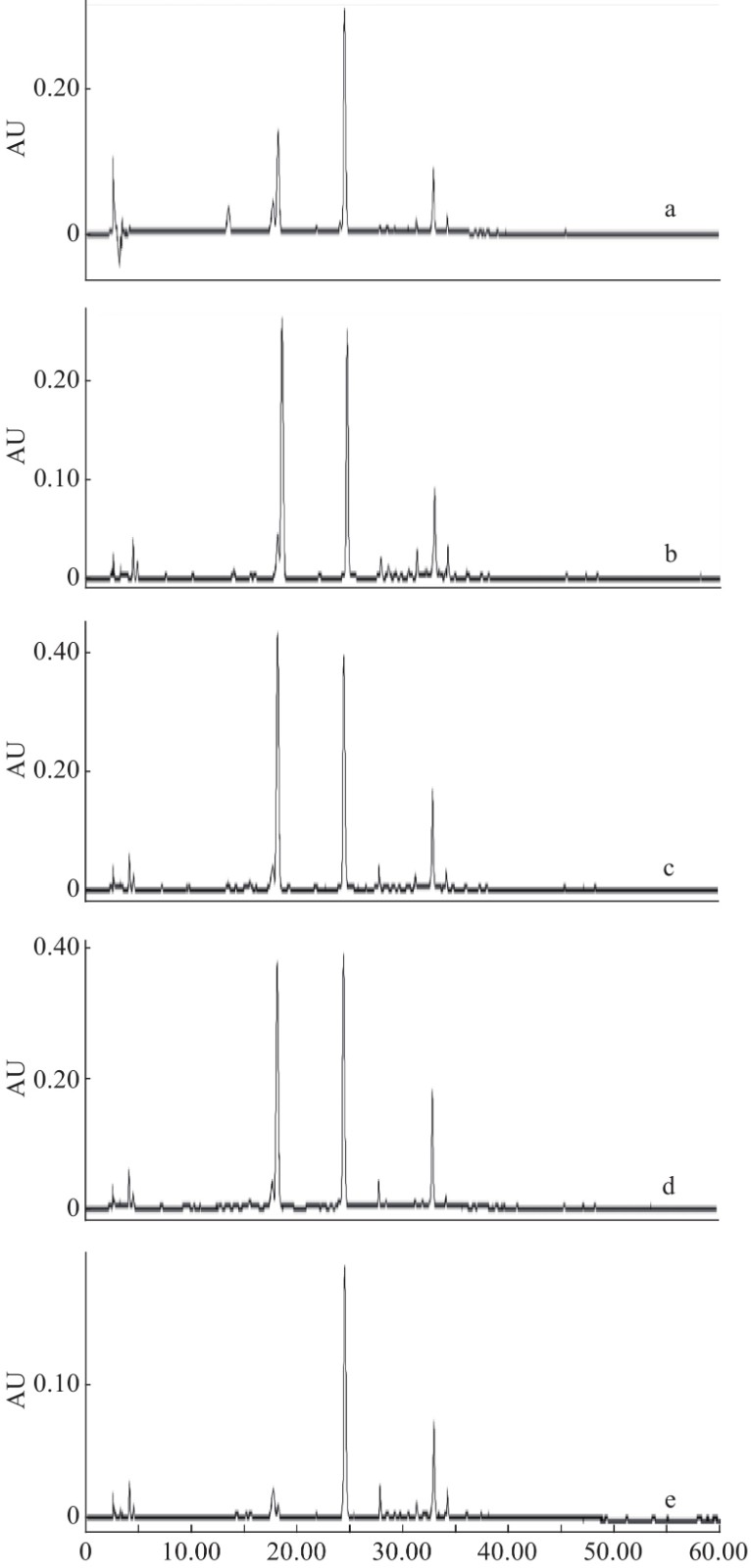
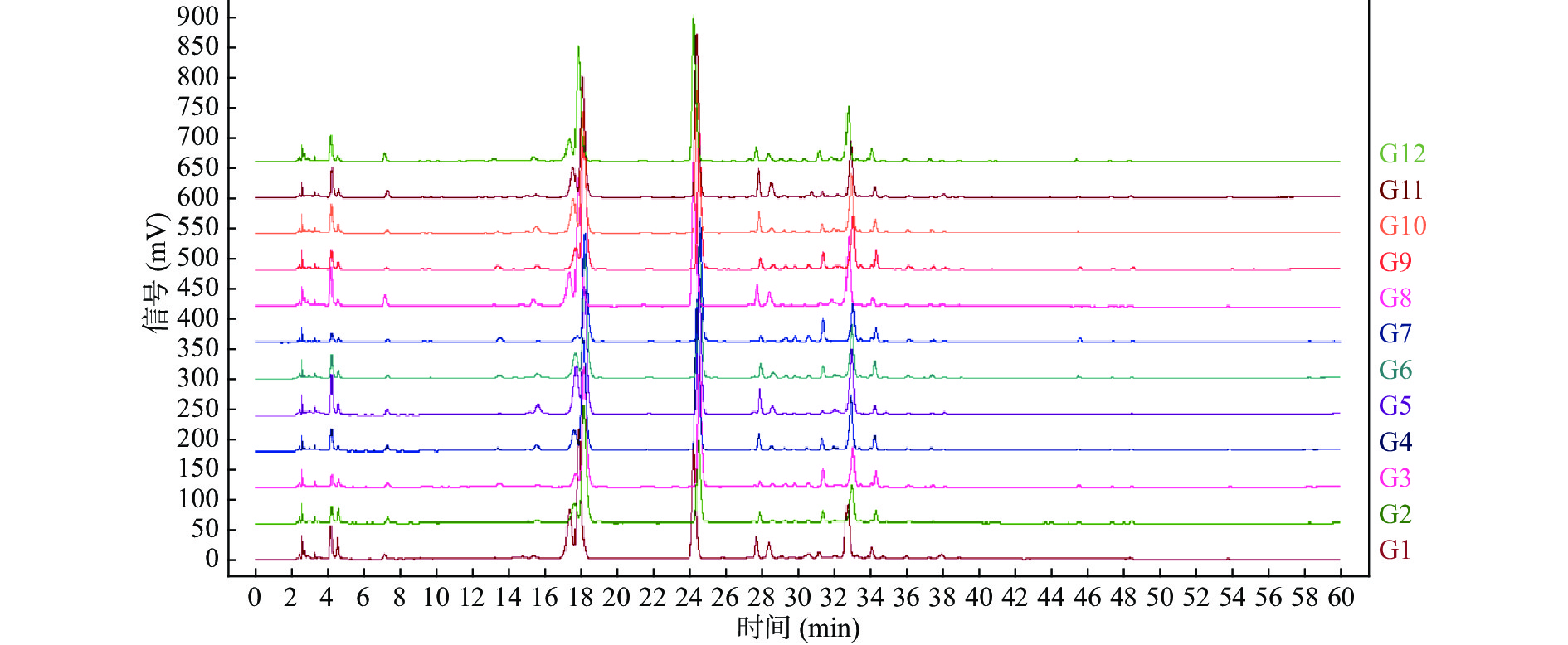
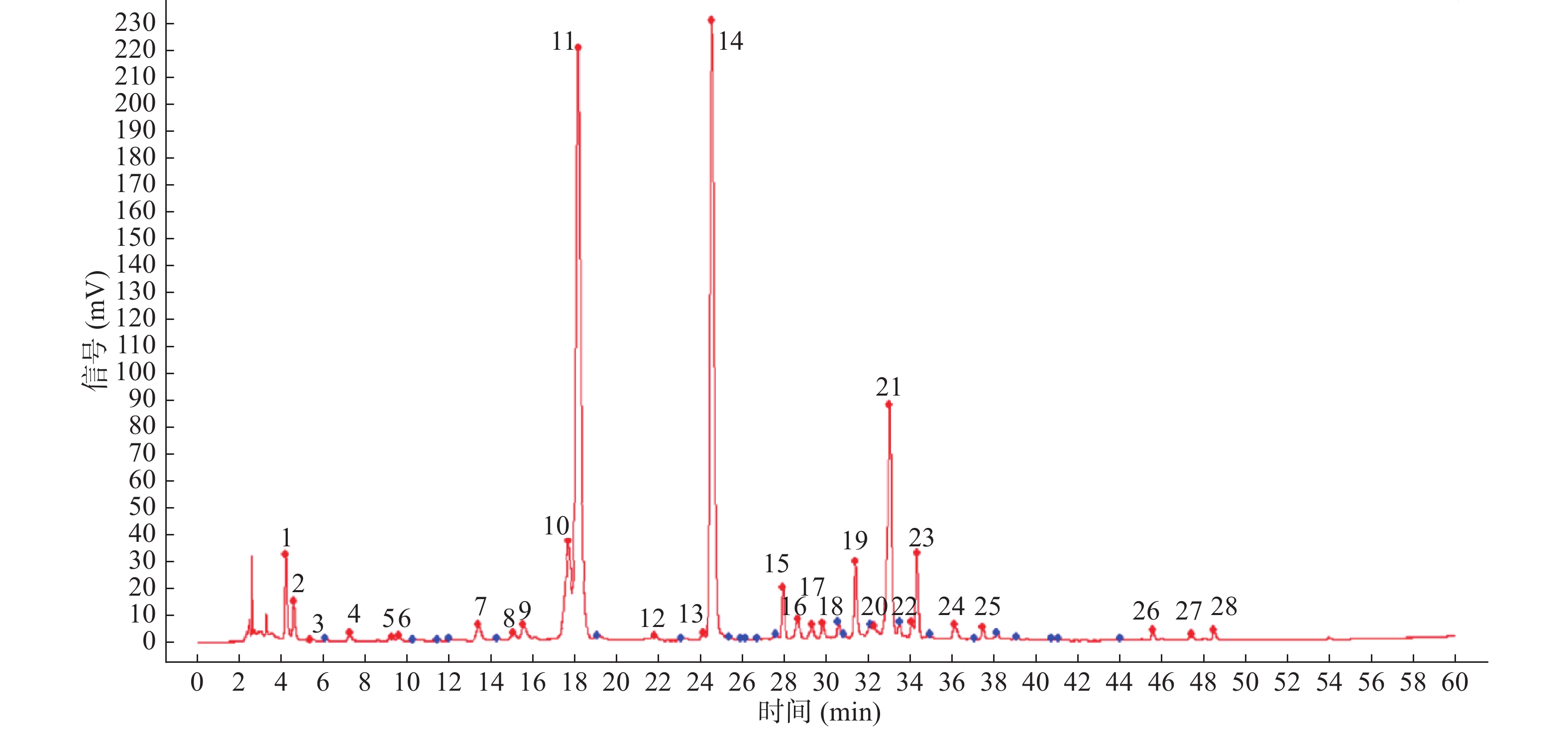
将白茶样品所得的色谱图以AIA的格式依次导入“中药色谱指纹图谱相似度评价系统2012版”,以G9为参照峰,进行色谱图叠加(图7),选择90%以上样本中的共有峰为样本的共有峰,在实验中以保留时间为18.23 min的11号峰(咖啡碱)为参照峰确立了28个共有峰(图8),各共有峰相对保留时间的RSD均小于2%,但各共有峰相对峰面积的值较大,说明不同品种、年份的白茶之间的差异较大(表4)。与对照品色谱图对比,指认出6个峰分别是峰2:GA;峰7:EGC;峰11:CAF;峰13:EC;峰14:EGCG;峰21:ECG(图8)。
表 4 12批茶共有峰的相对峰面积Table 4. Relative area of common peaks in 12 batches of tea编号 峰1 峰2 峰3 峰4 峰5 峰6 峰7 峰8 峰9 峰10 峰11 峰12 峰13 峰14 G1 0.1107 0.0728 0.0007 0.0206 0.0077 0.0040 0.0059 0.0144 0.0148 0.4182 1.0000 0.0077 0.0015 0.7548 G2 0.0622 0.0634 0.0009 0.0254 0.0074 0.0058 0.0049 0.0068 0.0253 0.1958 1.0000 0.0038 0.0039 0.6203 G3 0.0459 0.0326 0.0018 0.0188 0.0051 0.0069 0.0282 0.0029 0.0143 0.1257 1.0000 0.0055 0.0057 0.9296 G4 0.0909 0.0250 0.0018 0.0261 0.0043 0.0056 0.0195 0.0093 0.0433 0.2062 1.0000 0.0178 0.0058 1.1651 G5 0.1375 0.0456 0.0010 0.0246 0.0051 0.0052 0.0060 0.0119 0.0677 0.4390 1.0000 0.0102 0.0021 0.8967 G6 0.0819 0.0347 0.0007 0.0139 0.0054 0.0057 0.0190 0.0094 0.0296 0.2348 1.0000 0.0075 0.0042 1.0123 G7 0.0384 0.0241 0.0025 0.0165 0.0074 0.0071 0.0425 0.0036 0.0071 0.0553 1.0000 0.0060 0.0086 0.9768 G8 0.1308 0.0271 0.0007 0.0495 0.0016 0.0043 0.0060 0.0096 0.0541 0.2941 1.0000 0.0119 0.0026 0.9702 G9 0.0633 0.0305 0.0022 0.0080 0.0055 0.0066 0.0257 0.0092 0.0227 0.1860 1.0000 0.0055 0.0074 0.8889 G10 0.1062 0.0398 0.0007 0.0149 0.0056 0.0063 0.0125 0.0110 0.0523 0.3413 1.0000 0.0153 0.0036 1.0142 G11 0.1154 0.0354 0.0010 0.0328 0.0043 0.0039 0.0128 0.0165 0.0210 0.2941 1.0000 0.0109 0.0031 1.1773 G12 0.0977 0.0238 0.0009 0.0367 0.0028 0.0051 0.0169 0.0070 0.0337 0.2142 1.0000 0.0198 0.0050 1.0878 编号 峰15 峰16 峰17 峰18 峰19 峰20 峰21 峰22 峰23 峰24 峰25 峰26 峰27 峰28 G1 0.0957 0.1028 0.0119 0.0014 0.0043 0.0131 0.3878 0.0074 0.0423 0.0135 0.0329 0.0031 0.0027 0.0058 G2 0.0501 0.0225 0.0151 0.0151 0.0579 0.0029 0.2848 0.0119 0.0584 0.0111 0.0095 0.0061 0.0064 0.0145 G3 0.0255 0.0200 0.0223 0.0207 0.0955 0.0145 0.2715 0.0152 0.0704 0.0151 0.0109 0.0137 0.0061 0.0078 G4 0.0902 0.0281 0.0144 0.0137 0.0653 0.0138 0.3831 0.0136 0.0690 0.0167 0.0133 0.0085 0.0046 0.0079 G5 0.1091 0.0571 0.0077 0.0053 0.0167 0.0516 0.4530 0.0042 0.0341 0.0091 0.0064 0.0023 0.0014 0.0047 G6 0.0678 0.0419 0.0155 0.0144 0.0570 0.0144 0.3480 0.0105 0.0703 0.0165 0.0120 0.0098 0.0056 0.0093 G7 0.0303 0.0072 0.0365 0.0320 0.1251 0.0013 0.2799 0.0206 0.0717 0.0162 0.0082 0.0216 0.0090 0.0107 G8 0.0913 0.0937 0.0068 0.0022 0.0186 0.0104 0.4427 0.0045 0.0346 0.0052 0.0056 0.0031 0.0017 0.0052 G9 0.0478 0.0292 0.0170 0.0145 0.0777 0.0153 0.3281 0.0135 0.0753 0.0195 0.0119 0.0089 0.0053 0.0097 G10 0.0970 0.0379 0.0158 0.0137 0.0396 0.0132 0.4109 0.0100 0.0579 0.0172 0.0131 0.0062 0.0040 0.0057 G11 0.1336 0.1077 0.0123 0.0009 0.0277 0.0167 0.3723 0.0070 0.0444 0.0110 0.0065 0.0066 0.0048 0.0104 G12 0.0696 0.0550 0.0149 0.0153 0.0502 0.0105 0.3859 0.0138 0.0590 0.0150 0.0126 0.0097 0.0043 0.0075 2.4 相似度分析
将12批白茶样品色谱图导入“中药色谱指纹图谱相似度评价系统2012版”相似度软件,均值法生成指纹图谱的对照图谱。12批白茶样品与对照图谱的相似度在0.980~0.999之间,如表5,表明不同批次白茶成分组成一致,无显著性差异。
表 5 茶叶样品的相似度Table 5. Similarity of tea samples编号 样品名称批次 相似度 编号 样品名称批次 相似度 G1 牡丹王W2013001 0.983 G7 炭烤贡眉TG2019001 0.985 G2 白牡丹B2014001 0.980 G8 白毫银针H2020001 0.997 G3 贡眉G2017001 0.992 G9 白牡丹B2019002 0.998 G4 牡丹王W2018001 0.994 G10 白牡丹B2020001 0.998 G5 白毫银针H2019001 0.988 G11 白牡丹B2020002 0.994 G6 白牡丹B2019001 0.999 G12 炭烤贡眉TG2019001 0.997 2.5 基于样品28共有峰相对面积的聚类分析
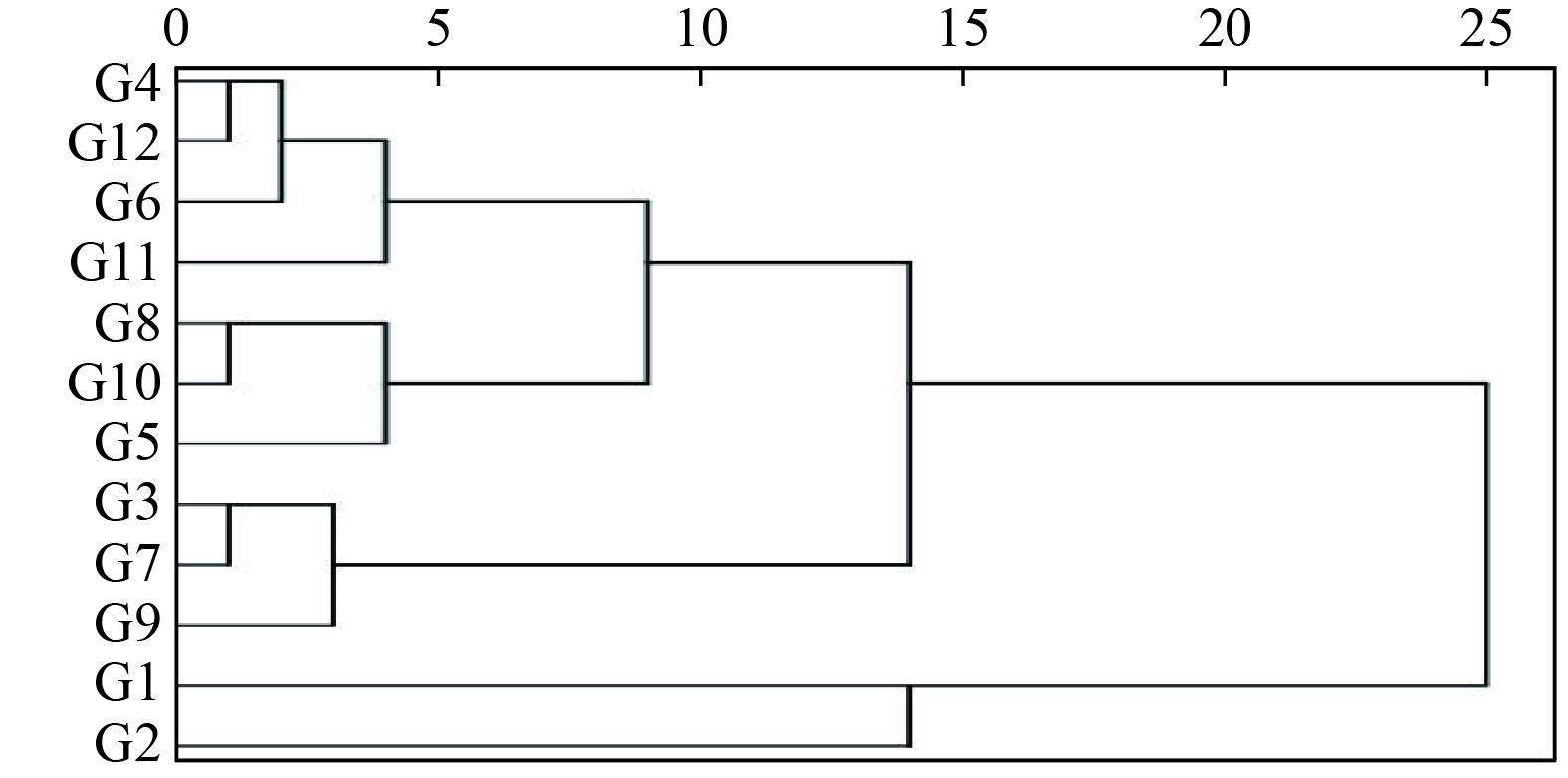
如图9所示,采用系统聚类分析法(HCA)对12批次白茶的数据进行分析,以峰11为参照峰计算28个峰的相对峰面积(见表4),将28个共有峰相对峰面积导入SPSS18.0软件,观察不同批次的白茶间的差异。聚类分析法采用组件均联法,选用夹角余弦为刻度。结果表明,聚类分析将12个样品分成了两类,其中G1和G2为一类,其他10个样品聚为一类。聚类分析表明各批次总体差异性较小,不同批次茶叶成分相对一致,差异较小,为白茶的研究奠定质量控制的基础,便于白茶及白茶相关产品的研究。
3. 结论与讨论
本文建立了白茶HPLC指纹图谱检测方法,经对12批不同品种、不同年份白茶进行HPLC指纹图谱研究,12批白茶样品与对照指纹图谱之间的相似度在0.98以上,说明12批白茶组成及含量基本一致,对图谱中GA、CAF、EC、ECG、EGCG、EGC六个峰进行成分确认。该方法准确、可靠,可为白茶的质量控制和深度开发提供参考依据。研究之初,同时考察了寿眉的指纹图谱,发现寿眉的某些儿茶素类成分如EGCG含量明显低于其他三种白茶。故本指纹图谱方法不适用于寿眉的鉴别。同时,本方法中共有峰多为茶多酚类物质,今后的研究中应关注到成分的广谱性加以进一步的考察。
通过对12批白茶样品相对峰面积的聚类分析中发现G1和G2在检测中被分为一类,分别为2013年的牡丹王和2014年的白牡丹,其他10种被分为一类。同时观察不同批次、种类白茶外观的差异,年份越久远白茶颜色越深,近几年的白茶多为青绿色,陈年白茶多为棕褐色,与聚类分析的结果具有一定的相关性。笔者推测,茶叶中的茶多酚在存放过程中逐渐被氧化,使其中一些儿茶素类成分含量降低,生成茶黄素,故外观相应发生变化。
-
表 1 茶叶样品生产信息
Table 1 Tea sample production information
样品编号 样品名称 产地 批号 生产日期 G1 牡丹王 福鼎 W2013001 2013 G2 白牡丹 福鼎 B2014001 2014 G3 贡眉 福鼎 G2017001 2017 G4 牡丹王 福鼎 W2018001 2018 G5 白毫银针 福鼎 H2019001 2019 G6 白牡丹 福鼎 B2019001 2019 G7 炭烤贡眉 福鼎 TG2019001 2019 G8 白毫银针 福鼎 H2020001 2020 G9 白牡丹 福鼎 B2019002 2019 G10 白牡丹 福鼎 B2020001 2020 G11 白牡丹 政和 B2020002 2020 G12 白牡丹 福鼎 B2020003 2020 表 2 高效液相色谱梯度洗脱程序
Table 2 Program of HPLC gradient elution
时间(min) 乙腈(%) 0.5%乙酸(%) 流速(mL/min) 0 6 94 1.0 15 10 90 0.8 30 20 80 0.8 45 30 70 0.8 60 40 60 0.8 表 3 高效液相色谱梯度考察
Table 3 Program of HPLC gradient study
方法1 方法2 方法3 方法4 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 时间(min) 乙腈(%) 流速(mL/min) 0 0 1.0 0 3 0.8 0 6 1.0 0 6 1.0 60 100 1.0 15 17 0.8 5 6 1.0 15 10 0.8 30 25 0.8 8 15 0.7 30 20 0.8 35 35 0.8 25 25 0.7 45 30 0.8 40 70 0.8 35 40 0.7 50 90 1.0 60 90 1.0 表 4 12批茶共有峰的相对峰面积
Table 4 Relative area of common peaks in 12 batches of tea
编号 峰1 峰2 峰3 峰4 峰5 峰6 峰7 峰8 峰9 峰10 峰11 峰12 峰13 峰14 G1 0.1107 0.0728 0.0007 0.0206 0.0077 0.0040 0.0059 0.0144 0.0148 0.4182 1.0000 0.0077 0.0015 0.7548 G2 0.0622 0.0634 0.0009 0.0254 0.0074 0.0058 0.0049 0.0068 0.0253 0.1958 1.0000 0.0038 0.0039 0.6203 G3 0.0459 0.0326 0.0018 0.0188 0.0051 0.0069 0.0282 0.0029 0.0143 0.1257 1.0000 0.0055 0.0057 0.9296 G4 0.0909 0.0250 0.0018 0.0261 0.0043 0.0056 0.0195 0.0093 0.0433 0.2062 1.0000 0.0178 0.0058 1.1651 G5 0.1375 0.0456 0.0010 0.0246 0.0051 0.0052 0.0060 0.0119 0.0677 0.4390 1.0000 0.0102 0.0021 0.8967 G6 0.0819 0.0347 0.0007 0.0139 0.0054 0.0057 0.0190 0.0094 0.0296 0.2348 1.0000 0.0075 0.0042 1.0123 G7 0.0384 0.0241 0.0025 0.0165 0.0074 0.0071 0.0425 0.0036 0.0071 0.0553 1.0000 0.0060 0.0086 0.9768 G8 0.1308 0.0271 0.0007 0.0495 0.0016 0.0043 0.0060 0.0096 0.0541 0.2941 1.0000 0.0119 0.0026 0.9702 G9 0.0633 0.0305 0.0022 0.0080 0.0055 0.0066 0.0257 0.0092 0.0227 0.1860 1.0000 0.0055 0.0074 0.8889 G10 0.1062 0.0398 0.0007 0.0149 0.0056 0.0063 0.0125 0.0110 0.0523 0.3413 1.0000 0.0153 0.0036 1.0142 G11 0.1154 0.0354 0.0010 0.0328 0.0043 0.0039 0.0128 0.0165 0.0210 0.2941 1.0000 0.0109 0.0031 1.1773 G12 0.0977 0.0238 0.0009 0.0367 0.0028 0.0051 0.0169 0.0070 0.0337 0.2142 1.0000 0.0198 0.0050 1.0878 编号 峰15 峰16 峰17 峰18 峰19 峰20 峰21 峰22 峰23 峰24 峰25 峰26 峰27 峰28 G1 0.0957 0.1028 0.0119 0.0014 0.0043 0.0131 0.3878 0.0074 0.0423 0.0135 0.0329 0.0031 0.0027 0.0058 G2 0.0501 0.0225 0.0151 0.0151 0.0579 0.0029 0.2848 0.0119 0.0584 0.0111 0.0095 0.0061 0.0064 0.0145 G3 0.0255 0.0200 0.0223 0.0207 0.0955 0.0145 0.2715 0.0152 0.0704 0.0151 0.0109 0.0137 0.0061 0.0078 G4 0.0902 0.0281 0.0144 0.0137 0.0653 0.0138 0.3831 0.0136 0.0690 0.0167 0.0133 0.0085 0.0046 0.0079 G5 0.1091 0.0571 0.0077 0.0053 0.0167 0.0516 0.4530 0.0042 0.0341 0.0091 0.0064 0.0023 0.0014 0.0047 G6 0.0678 0.0419 0.0155 0.0144 0.0570 0.0144 0.3480 0.0105 0.0703 0.0165 0.0120 0.0098 0.0056 0.0093 G7 0.0303 0.0072 0.0365 0.0320 0.1251 0.0013 0.2799 0.0206 0.0717 0.0162 0.0082 0.0216 0.0090 0.0107 G8 0.0913 0.0937 0.0068 0.0022 0.0186 0.0104 0.4427 0.0045 0.0346 0.0052 0.0056 0.0031 0.0017 0.0052 G9 0.0478 0.0292 0.0170 0.0145 0.0777 0.0153 0.3281 0.0135 0.0753 0.0195 0.0119 0.0089 0.0053 0.0097 G10 0.0970 0.0379 0.0158 0.0137 0.0396 0.0132 0.4109 0.0100 0.0579 0.0172 0.0131 0.0062 0.0040 0.0057 G11 0.1336 0.1077 0.0123 0.0009 0.0277 0.0167 0.3723 0.0070 0.0444 0.0110 0.0065 0.0066 0.0048 0.0104 G12 0.0696 0.0550 0.0149 0.0153 0.0502 0.0105 0.3859 0.0138 0.0590 0.0150 0.0126 0.0097 0.0043 0.0075 表 5 茶叶样品的相似度
Table 5 Similarity of tea samples
编号 样品名称批次 相似度 编号 样品名称批次 相似度 G1 牡丹王W2013001 0.983 G7 炭烤贡眉TG2019001 0.985 G2 白牡丹B2014001 0.980 G8 白毫银针H2020001 0.997 G3 贡眉G2017001 0.992 G9 白牡丹B2019002 0.998 G4 牡丹王W2018001 0.994 G10 白牡丹B2020001 0.998 G5 白毫银针H2019001 0.988 G11 白牡丹B2020002 0.994 G6 白牡丹B2019001 0.999 G12 炭烤贡眉TG2019001 0.997 -
[1] 吴传惠. 福鼎白茶标准化生产加工技术探讨[J]. 福建茶叶,2020,42(4):16. doi: 10.3969/j.issn.1005-2291.2020.04.013 [2] 谢中银. 福鼎白茶传统制作工艺研究[J]. 福建茶叶,2020,42(5):20−21. doi: 10.3969/j.issn.1005-2291.2020.05.012 [3] 林燕萍, 张见明, 陈泉宾, 等. 有机白茶和常规白茶品质差异分析[J]. 食品研究与开发,2020,41(19):151−156. doi: 10.12161/j.issn.1005-6521.2020.19.026 [4] 郑思梦, 赵峥山, 武慧慧, 等. 白茶药理作用及保健功效研究进展[J]. 粮食与油脂,2020,33(3):16−18. doi: 10.3969/j.issn.1008-9578.2020.03.006 [5] Tang G Y, Meng X, Gan R Y, et al. Health functions and related molecular mechanisms of tea components: An update review[J]. International Journal of Molecular Sciences,2019,Dec 8; 20(24):6196.
[6] Luo K, Ma C M, Xing S F, et al. White tea and its active polyphenols lower cholesterol through reduction of very-low-density lipoprotein production and induction of LDLR expression[J]. Biomedicine & Pharmacotherapy,2020,127(7):110146.
[7] 刘犀灵, 任发政, 雷新根, 等. 白茶对糖尿病模型小鼠降血糖作用的研究[J]. 中国食物与营养,2018,24(4):56−61. doi: 10.3969/j.issn.1006-9577.2018.04.013 [8] Amandeep K, Sumaya F, Amit S. A comparative study of antioxidant potential and phenolic content in white (silver needle), green and black tea[J]. Current Nutrition & Food Science, 2019, 15(4): 415−420.
[9] Rohadi D I, Lelita A S, Putri. Antioxidant capacity of white tea (Camelia sinensis) extract: compared to green, oolong and black tea[J]. Earth and Environmental Science, 2019, 292(1): 012018.
[10] Unachukwu U J, Ahmed S, Kavalier A, et al. White and green teas (Camellia sinensis var.sinensis): Variation in phenolic, methylxanthine, and antioxidant profiles[J]. Journal of Food Science,2010,75(6):C541−C548. doi: 10.1111/j.1750-3841.2010.01705.x
[11] Liu L, Liu B, Li J, et al. Responses of different cancer cells to white tea aqueous extract[J]. Journal of Food Science,2018,83(10):2593−2601. doi: 10.1111/1750-3841.14351
[12] 夏林涛, 林乃设. 福鼎白茶“防辐射”健康功效受到专家肯定[J]. 中国茶叶,2011,33(4):28. [13] Melissa M C, Domingo D S, Swain F R, et al. Topical application of green and white tea extracts provides protection from solar-simulated ultraviolet light in human skin[J]. Experimental Dermatology,2009,18(6):522−526. doi: 10.1111/j.1600-0625.2008.00818.x
[14] Huang J J, Yu H, Hong G, et al. Antifungal effect of tea extracts on candida albicans[J]. Dental Materials Journal,2020,39(4):664−669. doi: 10.4012/dmj.2019-014
[15] Zhou Y L, Tan F, Li C, et al. White peony (fermented Camellia sinensis) polyphenols help prevent alcoholic liver injury via antioxidation[J]. Antioxidants,2019,Oct 31; 8(11):524.
[16] Li X L, Smid S D, Lin J, et al. Neuroprotective and anti-amyloid β effect and main chemical profiles of white tea: Comparison against green, oolong and black tea[J]. Molecules,2019,May 19; 24(10):1926.
[17] Lee K O, Kim S N, Kim Y C. Anti-wrinkle effects of water extracts of teas in hairless mouse[J]. Toxicological Research,2014,30(4):283−289. doi: 10.5487/TR.2014.30.4.283
[18] Ni H, Jiang Q X, Lin Q, et al. Enzymatic hydrolysis and auto-isomerization during β-glucosidase treatment improve the aroma of instant white tea infusion[J]. Food Chemistry,2020:128565−128565.
[19] 邓仕彬, 林国荣, 周凤超. 制茶工艺对白茶品质影响研究进展[J]. 食品工业科技,2021,42(2):333−337, 344. [20] 王圣开. 气相色谱-质谱法测定白茶挥发成分[J]. 现代食品,2020(12):194−197. [21] 胡金祥. 白茶理化成分的分析与花色苷的结构鉴定[D]. 杭州: 浙江大学, 2020. [22] Xu L J, Xia G B, Luo Z S, et al. UHPLC analysis of major functional components in six types of Chinese teas: Constituent profile and origin consideration[J]. LWT,2019,102(3):52−57.
[23] 陈志达, 温欣黎, 陈兴华, 等. 不同等级福鼎白茶香气成分研究[J]. 浙江大学学报(农业与生命科学版),2019,45(6):715−722. [24] Long L M, Song S S, Cao X L. Discriminant analysis and similarity evaluation of gas chromatography-mass spectrometry fingerprints of aroma components in green tea grading[J]. Chinese Journal of Chromatography,2019,37(3):325−330. doi: 10.3724/SP.J.1123.2018.10017
[25] 王丽, 林昕, 邵金良, 等. 不同茶类的高效液相色谱特征指纹图谱研究[J]. 食品安全质量检测学报,2020,11(11):3586−3592. [26] 张玲玲, 孔娟, 李小芬, 等. 不同品种茶叶指纹图谱的建立及其相似度评价[J]. 食品工业科技,2020,41(8):242−249. [27] 赵娟, 谢世静, 赵兴华等. 中药指纹图谱质控方法研究进展[J]. 云南中医中药杂志,2020,41(1):82−86. doi: 10.3969/j.issn.1007-2349.2020.01.027 [28] 翁昆, 张亚丽. GB/T 30766-2014《茶叶分类》简介[J]. 中国标准导报,2015(1):34−35. [29] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 8313-2008 茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 标准物质出版社, 2008. [30] 韩忠耀, 余跃生, 魏学军, 等. 苗药水冬瓜根皮药材高效液相色谱指纹图谱研究[J]. 中国医院药学杂志,2017,37(2):126−129. -
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



