Optimization of Ultrasonic-assisted Enzymatic Extraction of ACE Inhibitory Peptides from Cyperus esculentus by Response Surface Method
-
摘要: 本文在单因素实验的基础上用响应面法优化了超声辅助酶提取油莎豆ACE(angiotensin converting enzyme)抑制肽工艺,并通过对血管紧张素转化酶的抑制实验选取了最佳辅助酶。结果表明,底物浓度3%、超声处理20 min、酶解温度45 ℃、加酶量5000 U/g、超声功率180 W、酶解3 h是超声波辅助酶法提取油莎豆ACE抑制肽的最佳工艺条件,最佳辅助酶-碱性蛋白酶,在此条件下ACE抑制率为74.16%。本研究为提取油莎豆ACE抑制肽提取了一定理论依据,为进一步研究油莎豆ACE抑制肽奠定了基础。Abstract: In this paper, based on the single-factor experiment, the response surface method was used to optimize the ultrasonic-assisted enzyme extraction process of Cyperus esculentus ACE inhibitory peptide, and the best auxiliary enzyme was selected through the inhibition experiment of angiotensin converting enzyme. The results showed that the optimal process conditions for the ultrasonic-assisted enzymatic extraction of Cyperus esculentus ACE inhibitory peptides were: Substrate concentration 3%, ultrasonic treatment time 20 min, enzymolysis temperature 45 ℃, enzyme addition 5000 U/g, ultrasonic power 180 W, enzymolysis time 3 h, the best auxiliary enzyme-alkaline protease, under this condition, the ACE inhibition rate was 74.16%. This study would provide a theoretical basis for the extraction of Cyperus esculentus ACE inhibitory peptides, which laid a foundation for further research on Cyperus esculentus ACE inhibitory peptide.
-
Keywords:
- Cyperus esculentus /
- ultrasound /
- enzymatic hydrolysis /
- ACE inhibitory peptide /
- response surface
-
油莎豆(Cyperus esculentus)因细长的根系顶端长有形状似豆的块茎而得名,属禾本科一年生植物,原产于非洲及地中海沿岸国家。油莎豆拥有极强的适应生存能力,于1960年被我国引进并大面积种植,主要分布于黑龙江、北京、河北、湖南、山东、四川等地[1-2]。油莎豆的主要成分是油脂及淀粉,占比达55%,此外还含有约10%的蛋白质。油莎豆蛋白中含17种氨基酸,营养极为丰富且消化率极高,其中70.59%的蛋白可被胃蛋白酶直接消化吸收,是一种利用价值超过小麦、玉米的高价值粮食作物[3-6]。
血管紧张素转化酶(ACE)是一种对血压有升高作用的酶,主要存在于动物肺部组织。ACE可通过催化血管紧张素I转化为血管紧张素II,促进血管收缩引起血压升高[7-8],还可使人体内舒缓肌肽失活,阻碍血管舒张,从而使血压升高。而ACE抑制肽是一种可以有效抑制ACE生理活动、降低血压的多肽物质,它与ACE间存在极强的相互作用,可以限制血管紧张素I向血管紧张素II转化[9-12]。近年来有很多研究者从核桃、绿豆等植物中提取ACE抑制肽并用于治疗高血压,都表现出明显的效果[13-15]。
我国对油莎豆ACE抑制肽的制备和研究处于起步阶段,主要集中在研究油莎豆的种植和成分分析。利用超声波辅酶法提取油莎豆ACE抑制肽未见报道,对油莎豆的利用和开发有重要意义[16]。本研究利用响应面法优化超声波辅助酶法提取油莎豆ACE抑制肽工艺,以期为油莎豆ACE抑制肽进一步研究提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
油莎豆 吉林农大外农贸市场售;碱性蛋白酶(100 U/mg)、中性蛋白酶(200 U/mg)、胃蛋白酶(200 U/mg)、木瓜蛋白酶(100 U/mg) 北京奥博星生物技术有限公司;血管紧张素转化酶、马尿酰组氨酰亮氨酸(HHL) Sigma公司。
JY99-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;LG0.2真空冷冻干燥机 沈阳航天新阳速冻设备制造有限公司;LXJ-ⅡB离心机 上海安亭科学仪器厂;SHA-B水浴恒温振荡器 金坛市医疗仪器厂;SPD-20A UVmini-1240紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 油莎豆蛋白等电点的测定
将霉变和有虫洞的油莎豆筛除后粉碎、用石油醚浸泡脱脂、干燥过80目筛。称取油莎豆粉20 g,按1:15(g/mL)加入蒸馏水混合,45 ℃水浴。用1 mol/L NaOH调pH为9.0,搅拌1 h,5000 r/min离心10 min后,将上清液均分成6组。用1 mol/L HCl溶液将上述6组上清液pH分别调为3.8、4.0、4.2、4.4、4.6、4.8,静置30 min后5000 r/min离心10 min,取沉淀物称重,以沉淀质量最大值时的pH为油莎豆蛋白等电点[17]。
蛋白质得率(%)=提取蛋白质量油莎豆粉质量×100 1.2.2 ACE抑制率测定
采用Cushman检测方法[18],在4 mL EP管中先加入200 μL马尿酰-组氨酰-亮氨酸(HHL)溶液,再加入50 μL ACE抑制剂,混合后置于37 ℃恒温水浴锅中水浴5 min,然后再加入50 μLACE溶液。37 ℃水浴条件下保持40 min,将1 moL/LHCl溶液作为终止剂,向上述溶液中加入200 μL HCl溶液迅速降低pH终止反应。再向试管中加入1.2 mL乙酸乙酯摇匀混合约15 s,5000 r/min离心10 min吸取0.8 mL脂层溶液,120 ℃烘干30 min。烘干后白色晶体加入3 mL的去离子水溶解,用紫外分光光度计测定波长为228 nm处吸光值。
ACE抑制率测定步骤见表1,计算公式如下:
ACE抑制率(%)=A2−A1A2−A3×100 式中:A1:ACE抑制肽和ACE都存在的溶液吸光度值;A2:不加ACE抑制肽的溶液吸光度值;A3:ACE与HHL存在的空白溶液吸光度值。
表 1 ACE 抑制率的测定步骤Table 1. Determination of ACE inhibition rate试剂 样品 A1(μL) A2(μL) A3(μL) HCl溶液 0 0 200 HHL溶液 200 200 200 ACE抑制剂 50 0 0 硼酸盐缓冲液 0 50 50 ACE溶液 50 50 50 HCl溶液 200 200 0 1.2.3 油莎豆蛋白质提取
将霉变和有虫洞的油莎豆筛除后粉碎、用石油醚浸泡脱脂、干燥过80目筛。按1:15 (g/mL)加入蒸馏水混合均匀,用0.5 mol/L NaOH将pH调至9.0搅拌提取1 h,5000 r/min离心10 min,取上清液。再将上清液用0.5 mol/L HCl滴定至等电点(pH4.2),静置30 min后5000 r/min离心10 min,沉淀用蒸馏水反复洗至中性,冷冻干燥48 h。密封在−20 ℃冰箱中保存[19]。
1.2.4 超声波辅助酶法制备油莎豆ACE抑制肽工艺
取5 g油莎豆粗蛋白,按料液比1:10加入蒸馏水。180 W超声处理20 min,用0.5 mol/L NaOH调节pH到9,水浴至恒温45 ℃后加入5000 U/g的蛋白酶,酶解3 h。将温度提升至90 ℃维持15 min灭酶,冷却至室温再将酶解液pH调至等电点(4.2),5000 r/min离心20 min,取上清液冷冻干燥[20]。
1.2.5 蛋白酶的筛选
油莎豆粗蛋白为底物,选取中性蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶4种酶在最适条件下对油莎豆粗蛋白进行酶解[21]。底物浓度3%,加酶量5000 U/g,酶解时间3 h。将温度提升至90 ℃维持15 min灭酶,冷却至室温再将酶解液pH调至等电点(4.2),5000 r/min离心20 min,收集上清液,测其ACE抑制率。
1.2.6 单因素实验
1.2.6.1 底物浓度对油莎豆ACE肽抑制率的影响
制备底物浓度为1%、2%、3%、4%、5%(m/v)的油莎豆粗蛋白溶液。180 W超声处理20 min,将pH调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定底物浓度对酶解液ACE抑制率的影响。
1.2.6.2 超声处理时间对油莎豆ACE肽抑制率的影响
配制底物浓度为3%(m/v)的蛋白质溶液,超声功率180 W,将超声处理时间设定为10、15、20、25、30 min。将pH调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定超声处理时间对油莎豆ACE肽抑制率的影响。
1.2.6.3 超声功率对油莎豆ACE肽抑制率的影响
配制底物浓度为3%(m/v)的蛋白质溶液,分别在超声功率为0、60、120、180、240 W,超声处理20 min。将pH调至9,水浴温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定超声功率对油莎豆ACE肽抑制率的影响。
1.2.6.4 酶解温度对油莎豆ACE肽抑制率的影响
配制底物浓度为3%(m/v)的蛋白质溶液,180 W超声处理20 min。将pH调至9,分别设定酶解温度为40、45、50、55、60 ℃,加酶量5000 U/g,酶解时间3 h。测定酶解温度对油莎豆ACE肽抑制率的影响。
1.2.6.5 酶解时间对油莎豆ACE肽抑制率的影响
配制底物浓度为3%(m/v)的蛋白质溶液,180 W超声处理20 min。将pH调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间分别选取为1、2、3、4、5 h。测定酶解时间对油莎豆ACE肽抑制率的影响。
1.2.6.6 加酶量对油莎豆ACE肽抑制率的影响
配制底物浓度为3%(m/v)的蛋白质溶液,180 W超声处理20 min。将pH调至9,酶解温度45 ℃,加酶量分别选取为3000、4000、5000、6000、7000 U/g,酶解时间3 h。测定加酶量对油莎豆ACE肽抑制率的影响。
1.3 响应面优化试验
根据Box-Benhnken试验设计原理,以油莎豆ACE抑制率为响应变量,从单因素实验结果中选取3个对油莎豆ACE抑制率影响最大的因素,见表2。以ACE抑制率为指标优化酶解温度、超声功率、酶解时间。
表 2 响应面分析因素及水平Table 2. Response surface analysis factors and levels水平 因素 A酶解时间(h) B酶解温度(℃) C超声功率(W) −1 2 40 120 0 3 45 180 1 4 50 240 1.4 数据处理
所有试验均重复三次,取平均值。单因素实验采用Origin2018软件绘图,数据以“平均值±标准差”来表示;采用Design Expert8.0.6软件进行响应面试验设计与分析。
2. 结果与分析
2.1 油莎豆蛋白等电点的确定
油莎豆等电点测定结果如图1所示,在pH3.8~4.2时,蛋白质得率增加;在pH4.2~4.8时,蛋白质得率降低,因此提取油莎豆蛋白最佳pH为4.2。
2.2 蛋白酶的选择
选用4种蛋白酶对油莎豆蛋白进行酶解,测定其抑制率,结果如表3所示。其中碱性蛋白酶的ACE抑制率最高,为74.45%,因此碱性蛋白酶为油莎豆粗蛋白最适酶解用酶。
表 3 四种蛋白酶对油莎豆ACE抑制肽的抑制率的影响Table 3. Influence of four proteases on the inhibition rate of Cyperus esculentus ACE inhibitor peptide酶 ACE抑制率(%) 胃蛋白酶 62.32±0.53 中性蛋白酶 69.15±0.87 碱性蛋白酶 74.45±0.69 木瓜蛋白酶 67.67±0.48 2.3 单因素实验结果
2.3.1 底物浓度对油莎豆ACE肽抑制率的影响
由图2可知,当蛋白质浓度为1%~3%时,ACE抑制率随着底物浓度的增加而增加;底物浓度为3%时ACE抑制率达到最大值74.29%;底物浓度超过3%时,ACE抑制率开始降低。底物浓度的多少直接决定了ACE抑制肽的含量,从而影响了ACE与ACE抑制肽间相互作用机率的大小及传质速度。底物浓度较小即ACE抑制肽含量较少时,溶液浓度较低二者相互接触更加容易,所以ACE抑制率随底物浓度的增加而增大。但底物浓度过高时ACE 抑制肽浓度也随之增大,此时ACE抑制肽之间可能会出现团聚现象,减小了其与ACE间可接触作用的表面积。此时表现为ACE抑制率随底物浓度增加而减小[22-23]。因此,选择底物浓度为3%。
2.3.2 超声处理时间对油莎豆ACE肽抑制率的影响
由图3可知,随超声时间增长,ACE抑制率先增加后降低。超声时间为20 min时,ACE抑制率达到最大值74.03%。适当时间的超声处理可破坏细胞壁释放胞内物质给蛋白酶提供更多的酶切位点,超声时间过长有可能将蛋白质结构破坏,影响ACE抑制肽的提取,降低其抑制率。因此,选择超声时间为20 min。
2.3.3 超声功率对油莎豆ACE肽抑制率的影响
由图4可知,随着超声功率的增加,ACE抑制率先增加后降低,超声功率为180 W时,ACE抑制率达到最大值74.52%。适当的超声功率能够破坏细胞壁,为蛋白酶提供更多的酶切位点。因此,选择超声功率为180 W。
2.3.4 酶解温度对油莎豆ACE肽抑制率的影响
由图5可知,随着酶解温度的升高,ACE抑制率先增加后降低,酶解温度为45 ℃时,ACE抑制率达到最大值74.60%。当温度继续升高时,会导致蛋白质变性蛋白酶失活,酶解度下降,ACE抑制肽含量降低,ACE抑制率减少[24]。因此,选择酶解温度为45 ℃。
2.3.5 酶解时间对油莎豆ACE肽抑制率的影响
由图6可知,前3 h随酶解时间的增加,ACE抑制率逐渐增加。3 h后,ACE抑制率趋于平缓,这可能是时间过长导致蛋白酶活性降低或底物量不足导致反应终止。酶解时间3 h时,ACE抑制率为最大值74.48%。因此,选择酶解时间为3 h。
2.3.6 加酶量对油莎豆ACE肽抑制率的影响
由图7可知,随加酶量的增加,ACE抑制率逐渐增加后平稳,加酶量5000 U/g时,ACE抑制率达到最大值74.13%。因此ACE抑制率并不会随着加酶量增高而不断变高,而是达到峰值后趋于稳定。为了节约生产成本,选择加酶量为5000 U/g。
2.4 响应面优化试验
根据单因素实验结果,影响油莎豆ACE抑制率最大的主要因素有:酶解时间(A)、酶解温度(B)、超声功率(C),利用Box-Behnken中心组合试验进行三因素三水平试验,对酶解条件进行优化。响应面试验结果见表4,方差分析结果见表5。
表 4 Box-Behnken试验设计及其结果Table 4. Box-Behnken experimental design and results实验号 A B C ACE抑制率(%) 1 3.00 40.00 240.00 71.82 2 2.00 40.00 180.00 69.91 3 3.00 45.00 180.00 74.13 4 3.00 50.00 120.00 70.34 5 2.00 45.00 120.00 71.24 6 3.00 40.00 120.00 70.46 7 4.00 50.00 180.00 69.35 8 3.00 45.00 180.00 74.51 9 3.00 45.00 180.00 73.92 10 3.00 45.00 180.00 74.38 11 3.00 50.00 240.00 69.97 12 2.00 45.00 240.00 70.75 13 4.00 40.00 180.00 70.89 14 4.00 45.00 120.00 72.25 15 4.00 45.00 240.00 72.14 16 2.00 50.00 180.00 69.43 17 3.00 45.00 180.00 74.53 表 5 响应面方差分析结果Table 5. Response surface analysis of variance results方差来源 平方和 自由度 均方 F P 显著性 模型 55.51 9 6.17 49.40 < 0.0001 *** A 1.36 1 1.36 10.90 0.0131 * B 1.99 1 1.99 15.94 0.0052 ** C 0.019 1 0.019 0.15 0.7080 AB 0.28 1 0.28 2.25 0.1773 AC 0.036 1 0.036 0.29 0.6075 BC 0.75 1 0.75 5.99 0.0442 * A2 12.54 1 12.54 100.42 < 0.0001 *** B2 30.09 1 30.09 240.97 < 0.0001 *** C2 3.99 1 3.99 31.94 0.0008 *** 残差 0.87 7 0.12 失拟项 0.60 3 0.20 2.88 0.1665 不显著 纯误差 0.28 4 0.069 总和 56.39 16 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05)。 2.4.1 回归方程的建立与检验
利用Design Expert8.0.6软件对表4中的实验数据进行多元回归拟合,得到二次多项回归程:Y=+74.29+0.41A−0.50B+0.049C−0.27AB+0.095AC−0.43BC−1.73A2−2.67B2−0.97C2。
由表5可知,模型P<0.0001,模型的决定系数R2=0.9646,调整系数R2adj=0.9845,说明该模型的拟合度很好。三个因素的显著性影响大小依次为:酶解温度>酶解时间>超声功率。
2.4.2 双因素的交互作用
等高线图可以直观地反映两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形表示交互作用显著。
如图8所示,酶解时间与温度的交互作用三维立体图的等高线图为圆形,所以酶解时间与温度的交互作用不显著。
如图9所示,超声功率与酶解时间的交互作用三维立体图的等高线图为圆形,所以超声功率与酶解时间的交互作用不显著。
如图10所示,超声功率与温度的交互作用三维立体图的等高线图为椭圆,所以超声功率与温度的交互作用显著。
2.4.3 最佳制备参数的确认及验证
通过Design Expert8.0.6软件进行工艺参数的优化组合,得到碱性蛋白酶酶解油莎豆蛋白制备ACE抑制肽的最佳工艺条件为:底物浓度3%、超声功率180 W、超声处理时间20 min、加酶量5000 U/g、酶解温度45 ℃、酶解时间3 h,预测此条件下ACE抑制率为74.45%。按照上述最佳条件进行三次验证试验,得到ACE抑制率的平均值为74.16%。基本接近试验所获得的理论值,表明预测值和真实值之间有很好的拟合性,因此本研究中利用响应面法获得的优化工艺参数准确可靠。
3. 结论
本实验在单因素实验的基础上用响应面法优化了油莎豆ACE抑制肽的提取工艺,确定了超声辅助碱性蛋白酶法提取ACE抑制肽的最佳条件:超声处理时间20 min、温度45 ℃、超声功率180 W、底物浓度3%、加酶量5000 U/g、酶解时间3 h,此条件下油莎豆ACE抑制肽的抑制率为74.16%。其中对最终提取效果影响较大的因素是酶解时间、超声功率、温度,因此提取过程本质上的影响因素可以归结为酶活性的高低以及酶活性位点与蛋白结合的难易程度。本研究对酶法提取ACE抑制肽工艺具有一定的参考价值,但是ACE抑制实验中的抑制率还存在较大的上升空间仍需继续探索。
-
表 1 ACE 抑制率的测定步骤
Table 1 Determination of ACE inhibition rate
试剂 样品 A1(μL) A2(μL) A3(μL) HCl溶液 0 0 200 HHL溶液 200 200 200 ACE抑制剂 50 0 0 硼酸盐缓冲液 0 50 50 ACE溶液 50 50 50 HCl溶液 200 200 0 表 2 响应面分析因素及水平
Table 2 Response surface analysis factors and levels
水平 因素 A酶解时间(h) B酶解温度(℃) C超声功率(W) −1 2 40 120 0 3 45 180 1 4 50 240 表 3 四种蛋白酶对油莎豆ACE抑制肽的抑制率的影响
Table 3 Influence of four proteases on the inhibition rate of Cyperus esculentus ACE inhibitor peptide
酶 ACE抑制率(%) 胃蛋白酶 62.32±0.53 中性蛋白酶 69.15±0.87 碱性蛋白酶 74.45±0.69 木瓜蛋白酶 67.67±0.48 表 4 Box-Behnken试验设计及其结果
Table 4 Box-Behnken experimental design and results
实验号 A B C ACE抑制率(%) 1 3.00 40.00 240.00 71.82 2 2.00 40.00 180.00 69.91 3 3.00 45.00 180.00 74.13 4 3.00 50.00 120.00 70.34 5 2.00 45.00 120.00 71.24 6 3.00 40.00 120.00 70.46 7 4.00 50.00 180.00 69.35 8 3.00 45.00 180.00 74.51 9 3.00 45.00 180.00 73.92 10 3.00 45.00 180.00 74.38 11 3.00 50.00 240.00 69.97 12 2.00 45.00 240.00 70.75 13 4.00 40.00 180.00 70.89 14 4.00 45.00 120.00 72.25 15 4.00 45.00 240.00 72.14 16 2.00 50.00 180.00 69.43 17 3.00 45.00 180.00 74.53 表 5 响应面方差分析结果
Table 5 Response surface analysis of variance results
方差来源 平方和 自由度 均方 F P 显著性 模型 55.51 9 6.17 49.40 < 0.0001 *** A 1.36 1 1.36 10.90 0.0131 * B 1.99 1 1.99 15.94 0.0052 ** C 0.019 1 0.019 0.15 0.7080 AB 0.28 1 0.28 2.25 0.1773 AC 0.036 1 0.036 0.29 0.6075 BC 0.75 1 0.75 5.99 0.0442 * A2 12.54 1 12.54 100.42 < 0.0001 *** B2 30.09 1 30.09 240.97 < 0.0001 *** C2 3.99 1 3.99 31.94 0.0008 *** 残差 0.87 7 0.12 失拟项 0.60 3 0.20 2.88 0.1665 不显著 纯误差 0.28 4 0.069 总和 56.39 16 注:***差异高度显著(P<0.001);**差异极显著(P<0.01);*差异显著(P<0.05)。 -
[1] 于红, 敬思群. 油莎豆化学成分及应用研究进展[J]. 食品工业,2015,36(6):242−245. [2] 阳振乐. 油莎豆的特性及其研究进展[J]. 北方园艺,2017,17(392):199−208. [3] Rahul V Manek, Philip F Builders, William M Kolling, et al. Physicochemical and binder properties of starch obtained from Cyperus esculentus[J]. AAPS Pharm Sci Tech,2012,13(2):379−388. doi: 10.1208/s12249-012-9761-z
[4] Moonjung Kim, Siwon No, Suk Hoo Yoon. Stereospecific analysis of fatty acid composition of Chufa (Cyperus esculentus L.) tuber oil[J]. Journal of the American Oil Chemists' Society,2007,84(11):1079−1080. doi: 10.1007/s11746-007-1131-8
[5] 陈星, 陈滴, 刘蕾. 油莎豆全成分分析[J]. 食品科技,2009,34(3):165−168. [6] 杨帆, 朱文学. 油莎豆研究现状及展望[J]. 粮食与油脂,2020,33(7):4−6. [7] Hankins C N, Shannon L M. Physical and enzymatic properties of a phytohemagglutinin from mung beans[J]. Journal of Biological Chemistry,1978,253(21):7791−7797. doi: 10.1016/S0021-9258(17)34439-3
[8] Wei-Liang W, Guo-Jie W, Dao-Shuang L, et al. The physiological function and research progress of angiotensin-i-converting enzyme inhibitory petides[J]. Modern Food Science and Technology,2006,22(3):251−254.
[9] 孙宁玲. 高血压领域的热点及思考[J]. 中华高血压杂志,2015,23(3):203−205. [10] 罗鹏. 葵花籽ACE抑制肽的分离纯化、结构分析与稳态化研究[D]. 武汉: 华中农业大学, 2018. [11] Martin M, Deussen A. Effects of natural peptides from food proteins on angiotensin converting enzyme activity and hypertension[J]. Critical Reviews in Food Science and Nutrition,2019,59(8):1264−1283. doi: 10.1080/10408398.2017.1402750
[12] Fagyas M, Úri K, Siket I M, et al. New perspectives in the renin-angiotensin-aldosterone system (RAAS) I: Endogenous angiotensin converting enzyme (ACE) inhibition[J]. PLoS One, 2014, 9(4): e87843.
[13] Ceren D D, Aysun Y, Funda K G, et al. Angiotensin-i-converting enzyme (ACE)-inhibitory peptides from plants[J]. Nutrients,2017,9(4):316. doi: 10.3390/nu9040316
[14] Wei L W, Guo J W, Dao S L, et al. The physiological function and research progress of angiotensin-i-converting enzyme inhibitory petides[J]. Modern Food Science and Technology,2006(3):251−254.
[15] 韩飞, 于婷婷, 周孟良, 等. 酶法生产大豆蛋ACE抑制肽的研究[J]. 食品科学,2008,29(11):369−374. doi: 10.3321/j.issn:1002-6630.2008.11.084 [16] 胡炜东, 蔡永敏, 鲁富宽. 响应面法优化油莎豆粕蛋白抗氧化肽制备工艺[J]. 食品工业,2014,35(2):105−108. [17] 胡炜东, 蔡永敏, 鲁富宽, 等. 响应面分析法优化油莎豆粕蛋白提取工艺[J]. 食品科技,2013,38(6):171−175, 184. [18] Cushman D W, Cheung H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Elsevier,1971,20(7):1637−1648.
[19] 杨叶波, 蔡培培, 何文森. 大豆蛋白质的提取技术的研究进展[J]. 广州化工,2015,43(9):26−27. doi: 10.3969/j.issn.1001-9677.2015.09.011 [20] 安传相. 核桃源蛋白ACE抑制肽制备及分离纯化的研究[D]. 贵阳: 贵州大学, 2018. [21] 胡庆娟, 吴光杰, 牛庆川, 等. 响应面试验优化木瓜蛋白酶法脱马齿苋多糖蛋白工艺[J]. 食品科学,2018,39(20):246−252. doi: 10.7506/spkx1002-6630-201820036 [22] 周洁静, 侯银臣, 刘旺旺, 等. 羊胎盘提取残余物免疫肽制备工艺的优化[J]. 食品与发酵工业,2015,41(3):129−134. [23] 韩扬. 超声辅助酶法制备燕麦ACE抑制肽的研究[D]. 北京: 北京工商大学, 2010. [24] 麻成金, 黄伟, 黄群, 等. 复合酶法提取仿栗籽蛋白的工艺优化[J]. 食品科学,2012,33(20):27−32. -
期刊类型引用(11)
1. 苏敏,李红丽,白亚敏,黄大亮,刘元,吴彦蕾. 基于液相色谱-串联高分辨质谱技术的食品中污染物检测技术研究进展. 食品安全质量检测学报. 2025(04): 44-52 .  百度学术
百度学术
2. 张君. 我国南方部分地区蓝莓种植过程中农药残留检测结果分析. 河北农机. 2024(03): 136-138 .  百度学术
百度学术
3. 张申平,秦宇,顾颖娟. QuEChERS-超高效液相色谱-四极杆/静电场轨道阱质谱法测定牛羊乳及其乳粉中21种兽药. 乳业科学与技术. 2024(02): 24-29 .  百度学术
百度学术
4. 李红洲,国果,李博岩,梁桂娟,李志远. 超高效液相色谱-四极杆-飞行时间-高分辨质谱法分析6种李果实中的代谢物差异性. 食品安全质量检测学报. 2024(11): 63-73 .  百度学术
百度学术
5. 刘宇航,于寒冰,杨红菊,马啸,温雅君,孙志伟,习佳林,熊慧勤,肖志勇. 高效液相色谱-四极杆-飞行时间质谱法快速筛查蔬菜中124种药物与个人护理品残留量. 食品安全质量检测学报. 2024(16): 175-184 .  百度学术
百度学术
6. 朱春雨,吴移山,郑景娇. 高效液相色谱-串联质谱法测定鸡蛋中地克珠利、妥曲珠利及其代谢物残留量. 食品安全质量检测学报. 2024(16): 211-218 .  百度学术
百度学术
7. 肖泳,曾小明,李政,袁列江,邓航,王淑霞,潘照. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定鸡蛋中94种农药残留. 食品与发酵工业. 2024(21): 333-340 .  百度学术
百度学术
8. 王颖怡,吴玉田,孟春杨,周贻兵,刘利亚. HPLC-MS/MS技术同时测定鸡蛋中5种抗球虫药. 食品工业. 2023(06): 291-294 .  百度学术
百度学术
9. 李晓慧,李建洪,王洪萍,金芬. 植物源性食品中化学性危害物质的色谱-质谱检测技术研究进展. 分析测试学报. 2023(10): 1357-1369 .  百度学术
百度学术
10. 周雪莼,胡婷婷,王佳慧,白静,杨颖,侯宇,张哲,张勋. 高效液相色谱-高分辨质谱法快速筛查动物源性药食同源产品中32种抗生素兽药残留. 吉林中医药. 2023(12): 1469-1474 .  百度学术
百度学术
11. 范轶欧,迟英欣,杨路平,焦燕妮. 高分辨质谱技术在环境和食品风险物质非靶向筛查检测中应用的研究进展. 预防医学论坛. 2023(12): 955-960 .  百度学术
百度学术
其他类型引用(0)





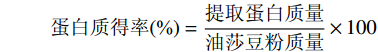
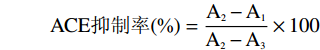
 下载:
下载:










 下载:
下载:



