Effects of Exogenous Inhibitors on the Microbial Community Composition Changes of Air-Dried Sausage
-
摘要: 为了解外源抑制物对风干肠微生物群落组成的影响,本研究将风干肠设置为6组,对照组(Control check,CK),CA组(复合抗氧化剂,Compound antioxidants),CS组(复合香辛料Compound spice,CS),CSA组(CA与CS复配),FBF组(发酵牛骨调味基料,Fermented beef flavorings),FBFA组(FBF与CA复配),在风干的第1、3、6、9、12 d测定菌落总数、乳酸菌数和肠杆菌科数,取各组风干终点(12 d)的风干肠样品进行16S rDNA高通量测序分析。结果表明,随着风干时间的延长,6组样品的乳酸菌数、菌落总数和肠杆菌科数均在风干前6 d呈升高趋势随后缓慢下降。风干第12 d的5组试验组样品中各种菌数均显著低于CK组,尤其FBF的添加可显著抑制肠杆菌科的生长,FBFA可以明显减少风干肠中的菌落总数。风干肠中主要的细菌群落是变形杆菌属、乳球菌属、葡萄球菌属、乳酸杆菌属和肠球菌属,CSA组、FBF组、FBFA组的优势菌群为乳球菌属。由此说明,外源抑制物对风干肠的细菌菌群丰度有重要的影响,结合微生物数量变化情况,FBF和FBFA对有害微生物有较好的抑制作用。
-
关键词:
- 外源抑制物 /
- 风干肠 /
- 细菌分布 /
- 16S rDNA测序
Abstract: To understand the effects of exogenous inhibitors on the microbial community composition, in this study, air-dried sausage was divided into six groups, including control group (CK), CA(Compound antioxidants) group, CS (Compound spice) group, CSA (CA combined with CS) group, FBF (Fermented beef Flavorings)group, FBFA (FBF combined with CA)group. The total number of bacterial colonies, Lactobacilli and Enterobacteriaceae were determined on the 1st, 3rd, 6th, 9th and 12th day of air drying. The samples of air-dried sausage at the end of air drying (12d) were analyzed by the high-throughput sequencing based on 16S rDNA. The results showed that with the prolongation of air drying time, the number of Lactobacilli, the total number of colonies and the number of Enterobacteriaceae in the samples of the six groups all increased at the time point of six days before air drying, and then decreased slowly. The number of bacteria in the five groups was significantly lower than that in the CK group, especially, the addition of FBF could significantly inhibit the growth of Enterobacteriaceae, FBFA could significantly reduce the total number of colonies in air-dried sausage. The main microbial community in the air-dried sausage were Proteus, Lactococcus, Staphylococcus, Lactobacillus and Enterococcus. The dominant bacterial community in the CSA, FBF and FBFA groups were Lactobacillus. These results showed that exogenous inhibitors had an important effect on the bacterial flora abundance, combined with the change of the number of microorganisms, FBF and FBFA have better inhibitory effect on harmful microorganisms. -
风干肠是在适宜的条件下进行风干成熟而制成的一类自然发酵肉制品,因为在风干过程中水分活度和pH逐渐降低,加之优势微生物的竞争作用,所以能抑制产品中有害微生物的生长繁殖,使产品具有营养丰富、色泽美观、风味独特、保质期长等特点,深受北方消费者的青睐[1-3]。
目前,我国风干肠的生产仍然存在一些不容小觑的问题,如传统风干肠的加工是采用自然发酵方式,生产周期长,微生物来源复杂,易受微生物污染而腐败变质,使产品质量不能得到很好的控制,而工业化生产为了提高风干肠的生产效率,使用快速风干成熟法,使风干肠失去了原有的独特发酵风味[4-5]。因此使用天然抑菌剂,研究风干肠在自然发酵过程中微生物数量动态变化及微生物群落结构组成对于实现风干肠发酵过程的人工控制和工业化生产,提高其安全品质具有重要意义[6-8]。风干肠中的主要微生物有细菌、霉菌和酵母[9]。Hu等[10]采用高通量测序技术对东北5个不同地区的风干香肠的细菌群落结构进行了测定,结果表明:硬壁菌和蛋白菌是优势菌门,乳酸杆菌、葡萄球菌、明串珠菌、乳球菌和魏氏菌是优势菌属,木糖葡萄球菌、清酒乳酸杆菌、希腊魏氏菌、柠檬明串珠菌、棉子糖乳球菌和植物乳杆菌为主要优势菌种。Chen等[11]研究表明乳酸杆菌和葡萄球菌是影响哈尔滨干香肠品质的优势菌。本实验室前期将已优选的复合抗氧化剂(Compound antioxidants, CA)、复合香辛料(Compound spice,CS)、发酵牛骨调味基料(Fermented beef flavorings,FBF)及其组合应用到风干肠的加工中,研究了其对产品的风味、生物胺、N-亚硝胺以及脂肪氧化等相关理化指标的影响,发现这些外源抑制物有一定的提高产品风味和安全品质的作用[12-14]。本研究在此基础上,进一步研究这些外源抑制物对风干肠在风干过程中的细菌总数、乳酸菌数、肠杆菌科菌数的变化,并通过16S rDNA高通量测序分析等仪器手段,分析风干终点(12 d)产品的微生物群落组成变化,比较几种外源抑制物对风干肠微生物安全性的影响,以期为风干肠的加工工艺提供理论指导。
1. 材料与方法
1.1 材料与仪器
猪后腿肉(冷却肉)、猪肥膘 天津市康宁肉制品有限公司;食盐、白沙糖、曲酒、味精、酱油、葡萄糖、木糖 天津市红旗农贸批发市场;冷冻牛骨肉末(骨肉比为3:7) 天津挂月食品有限公司;胡椒精油、姜油、花椒精油、八角精油、丁香精油 顶兴(天津)食品科技发展有限公司;茶多酚、迷迭香 豫中生物科技有限公司;VE、Vc、VB1 苏州佰亿鑫生物科技有限公司;VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌) 意大利萨科公司;风味蛋白酶(酶活力500 LAPU/g)、复合蛋白酶(酶活力1.5 AU/g) 丹麦诺维信公司;L-半胱氨酸、丙氨酸、甘氨酸 冀州市华阳化工有限责任公司;人工胶原蛋白肠衣(牛二层皮提取、孔径30 mm) 神冠控股(集团)有限公司(以上材料均为食品级);MRS培养基、营养琼脂、结晶紫中性红胆盐葡萄糖琼脂 青岛高科技工业园海博生物科技有限公司。
SX-500高压蒸汽灭菌锅 日本TOMY有限公司;CLIMACELL恒温恒湿箱、Friocell 22恒温恒湿培养箱 艾力特国际贸易有限公司;BVBJ-30F真空搅拌机 浙江嘉兴艾博实业有限公司;XZ-5L灌肠机 广州旭众食品机械有限公司;CLASSⅡ生物安全柜 天美(中国)科学仪器有限公司。
1.2 实验方法
1.2.1 风干肠的制作
参照李木子等[15]的方法。
1.2.2 几组外源抑制物的配制方法
1.2.2.1 CA的配比
按照熊凤娇等[12]的研究结果,以每组的总肉量计,依次添加茶多酚60.14 mg/kg、迷迭香60.11 mg/kg、VE60.00 mg/kg和抗坏血酸钠60.00 mg/kg。
1.2.2.2 CS的配比
按照陈文静等[16]的研究结果,以每组的总肉量计,依次添加胡椒精油、姜油、花椒精油、八角精油、丁香精油的含量分别为2.08、3.12、3.69、2.83、0.22 mL/kg。
1.2.2.3 FBF的制备
参照樊晓盼等[17]的方法。
1.2.3 试验设计方案
按照1.2.1风干肠的制作方法制作出6组风干肠,CK(Control group,CK)组作为空白对照组,风干肠的原辅料配比同1.2.1,其它5组风干肠均是在CK组的基础上添加不同种类的外源抑制物,其中CA和CS分别按照1.2.2.1和1.2.2.2的比例添加,FBF按照原料肉重的2%比例添加。具体试验设计方案见表1所示。各组分别在风干成熟过程的第1、3、6、9、12 d取样,进行菌落总数、乳酸菌数、肠杆菌科菌数的测定;取6组风干肠成品(风干成熟第12 d)进行微生物多样性分析。
表 1 试验设计方案Table 1. Scheme of experiment design组别 外源抑制物种类 CA CS 2% FBF(以原料肉重计) CK − − − CA √ − − CS − √ − CSA √ √ − FBF − − √ FBFA √ − √ 1.3 指标测定方法
1.3.1 乳酸菌总数
按GB 4789.35-2016《食品安全国家标准食品微生物学检验乳酸菌检验》[18]6.2.3.4乳杆菌计数方法执行。
1.3.2 菌落总数
按GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》[19]方法进行检测。
1.3.3 肠杆菌科总数
按GB 4789.41-2016《食品安全国家标准食品微生物学检验肠杆菌科检验》[20]执行。
1.3.4 微生物多样性分析
将6组风干肠成品送到北京奥维森基因科技有限公司,采用扩增子测序方法分析样品16S rDNA的V3-4区段、细菌群落结构等,对样品进行细菌多样性分析[21],扩增区段引物序列为:GTACTCCTACGGGAGGCAGCA,GTGGACTACHVGGGTWTCTAAT。
1.4 数据处理
采用Microsoft Excel 2010软件计算平均值和标准差,用SPSS软件进行显著性分析,Origin 10.0软件作图。
2. 结果与分析
2.1 6组风干肠在风干过程中乳酸菌数、菌落总数和肠杆菌科菌数的变化
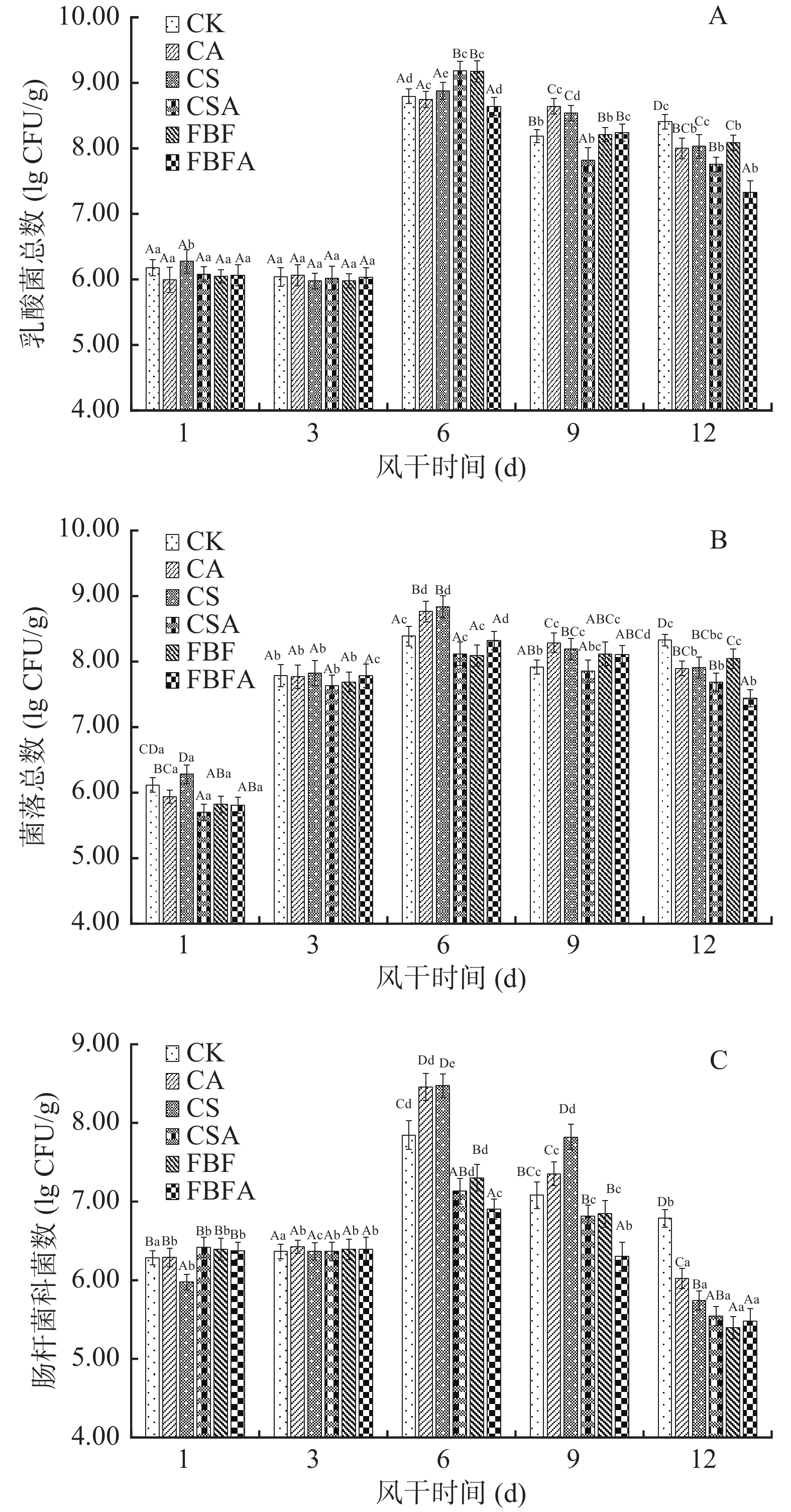
6组风干肠在风干过程中乳酸菌数、菌落总数和肠杆菌科菌数的变化见图1所示。由图1可以看出,各组样品的乳酸菌数、菌落总数和肠杆菌科菌数变化趋势基本一致,在风干前6 d呈升高趋势随后缓慢下降,此变化与韦友兵[22]研究萨拉米发酵成熟过程中微生物菌群变化趋势基本一致。各组的乳酸菌数由风干第1 d的6.00~6.28 lg CFU/g升高到第6 d的8.64~9.18 lg CFU/g再到第12 d的7.33~8.41 lg CFU/g(见图1A)。菌落总数的变化趋势,风干第1 d为5.70~6.12 lg CFU/g,风干第6 d达到最大值8.09~8.84 lg CFU/g,然后缓慢降低到风干12 d为7.44~8.33 lg CFU/g(见图1B),肠杆菌科菌数在风干第6 d达到最大6.90~8.47 lg CFU/g,风干结束时降低到5.40~6.79 lg CFU/g(见图1C)。各组风干肠之间在风干过程中的菌数未呈现规律性变化,比较6组风干肠之间在风干第12 d的菌数变化,乳酸菌数从高到低依次为:CK>FBF≈CS≈CA>CSA>FBFA,菌落总数从高到低依次为:CK>FBF>CS>CA>CSA>FBFA,肠杆菌科菌数从高到低依次为:CK>CA>CS>CSA>FBFA>FBF。由此可以看出,添加了外源抑制物的5组试验组的各种菌数均显著低于CK组(P<0.05),特别是FBF组的肠杆菌科数明显降低,FBFA组的菌落总数为组内最低,说明添加FBF和FBFA对有害微生物有较好的抑制作用。吴晨燕等[23]研究FBF对大肠杆菌的抑菌作用及机理,通过扫描电镜观察菌体形态,测定相对电导率了解胞膜通透性时发现,FBF会破坏细胞的正常形态,使菌体表面出现褶皱、孔洞,影响菌体营养物质的正常传递和运输,从而抑制大肠杆菌生长,这对于控制风干肠的安全性有利,因为肠杆菌科细菌属于条件致病菌[24]。但是,仔细观察FBF组、FBFA组和CSA组的肠杆菌科数仍高达5.40~5.54 lgCFU/g,瑞士对发酵成熟的生香肠中的肠杆菌科限量值为100 CFU/g[25]。虽然目前我国对发酵成熟的生香肠中的肠杆菌科数没有限量标准,但为了提高风干肠的品质和安全性,考虑在后期研究中应采用人工接种乳酸菌和天然抗氧化剂,利用优势菌群等温和的栅栏技术来控制杂菌的繁殖。
![]() 图 1 不同外源抑制物组风干肠在风干过程中乳酸菌总数、菌落总数和肠杆科菌数的变化注:A:乳酸菌总数,B:菌落总数,C:肠杆菌科菌数;大写字母不同代表不同处理组间差异显著(P<0.05);小写字母不同代表同一处理组在不同风干时间内差异显著(P<0.05)。Figure 1. Changes of total number of lactic acid bacteria, total number of colonies and the number of Enterobacteriaceae in air-dried sausages with different exogenous inhibitors
图 1 不同外源抑制物组风干肠在风干过程中乳酸菌总数、菌落总数和肠杆科菌数的变化注:A:乳酸菌总数,B:菌落总数,C:肠杆菌科菌数;大写字母不同代表不同处理组间差异显著(P<0.05);小写字母不同代表同一处理组在不同风干时间内差异显著(P<0.05)。Figure 1. Changes of total number of lactic acid bacteria, total number of colonies and the number of Enterobacteriaceae in air-dried sausages with different exogenous inhibitors2.2 6组风干肠成品的微生物多样性指数分析
利用Alpha多样性指数goods_coverage、chao1、observed species及shannon可进行样品微生物物种丰富度和多样性评估[26]。6组风干肠成品的Alpha多样性指数分析结果见表2所示。由表2可知,6组风干肠成品的测序覆盖率goods_coverage在99%以上,说明风干肠中未被测到的序列概率很低。CK组的chao1和observed_species指数高于5个试验组,因为外源抑制物的抑菌成分能够起到一定的抑菌作用,所以添加了外源抑制物的CA、CS、FBF、FBFA、CSA组的菌群丰度均低于CK组。另外,FBFA组的chao1和observed_species指数达到了组内最低,且shannon指数低于FBF组,说明物种多样性最低,且FBF与CA复配的抑菌效果优于FBF单独使用。
表 2 6组风干肠成品的Alpha多样性指数Table 2. Alpha diversity index of 6 groups of air-dried sausages products指数 goods_coverage(%) chao1 observed_species shannon CK 99.85 175.4884 154.0000 2.8976 CA 99.84 159.0000 129.0000 2.5770 CS 99.86 149.7126 123.0000 2.4969 CSA 99.86 158.8087 137.0000 3.2227 FBF 99.84 175.2727 145.0000 3.1430 FBFA 99.86 147.1765 118.0000 3.0426 注:goods_coverage:样本中序列被测出的概率,其值越大被测出的概率越高;chao1:即菌种丰富度指数,用以估计群落中的OTU数目;observed_species:随测序深度的增加,实际观测到OTU的个数;shannon指数衡量物种的均匀度(evenness)即多样性,shannon越大,evenness越高。 2.3 基于门水平的微生物群落结构分析
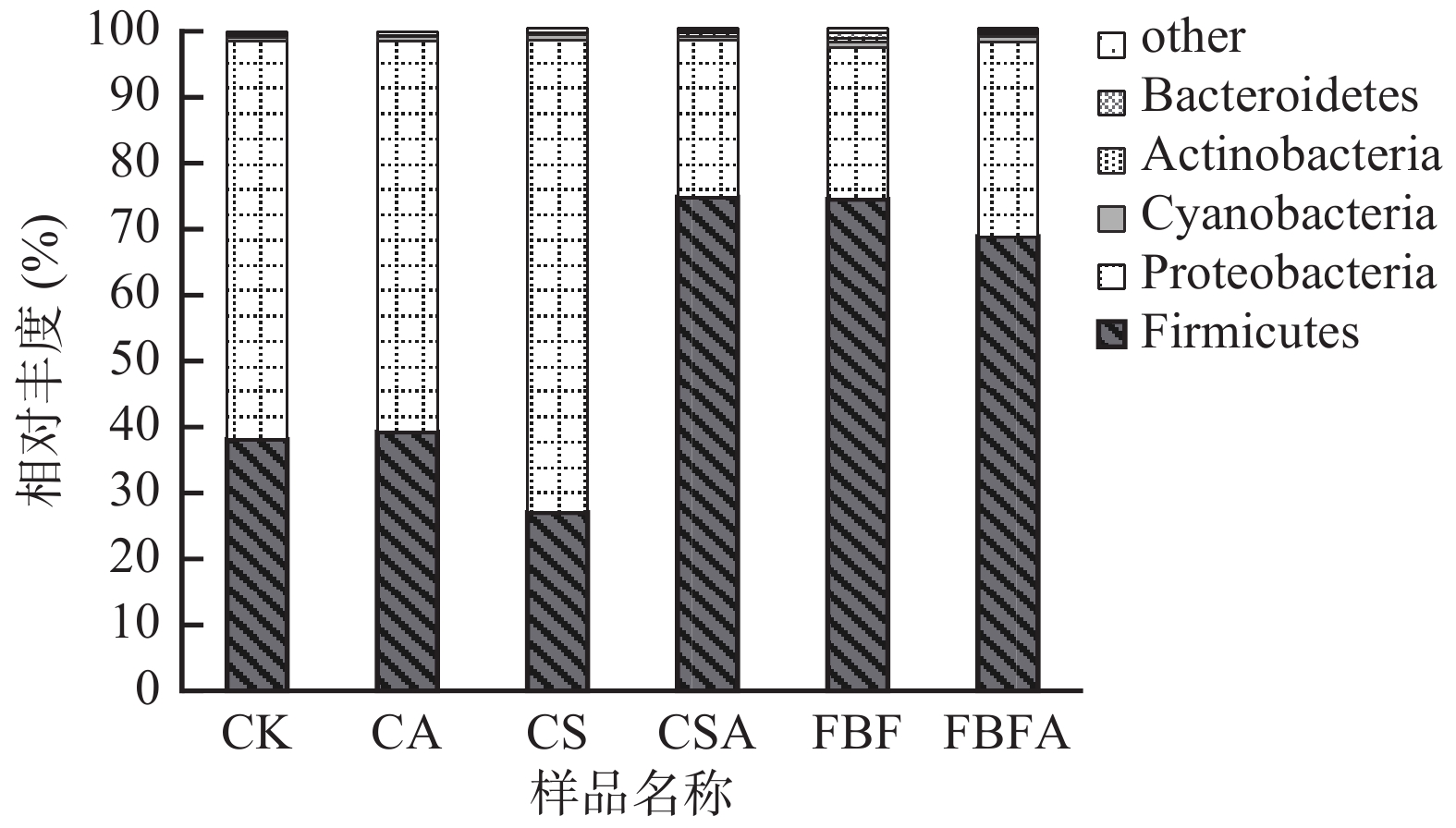
图2为6组风干肠成品在门水平上最大丰度排名前5的物种相对丰度所占比例。由图2可知,6组风干肠成品的微生物群落主要由5个门组成,分别为:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),各组基于门水平的微生物群落主要是由厚壁菌门和变形菌门组成,占比达到96%以上。进一步分析发现,CSA组、FBF组和FBFA组厚壁菌门所占的比例最大,分别为74.87%、74.51%、68.89%,变形菌门其次,分别为23.82%、22.99%、29.51%;相反,CK组、CA组、CS组变形菌门比例最高分别为60.34%、59.33%、71.64%,其次是厚壁菌门,占比分别为38.14%、39.25%、27.03%。
2.4 基于属水平的微生物群落结构分析
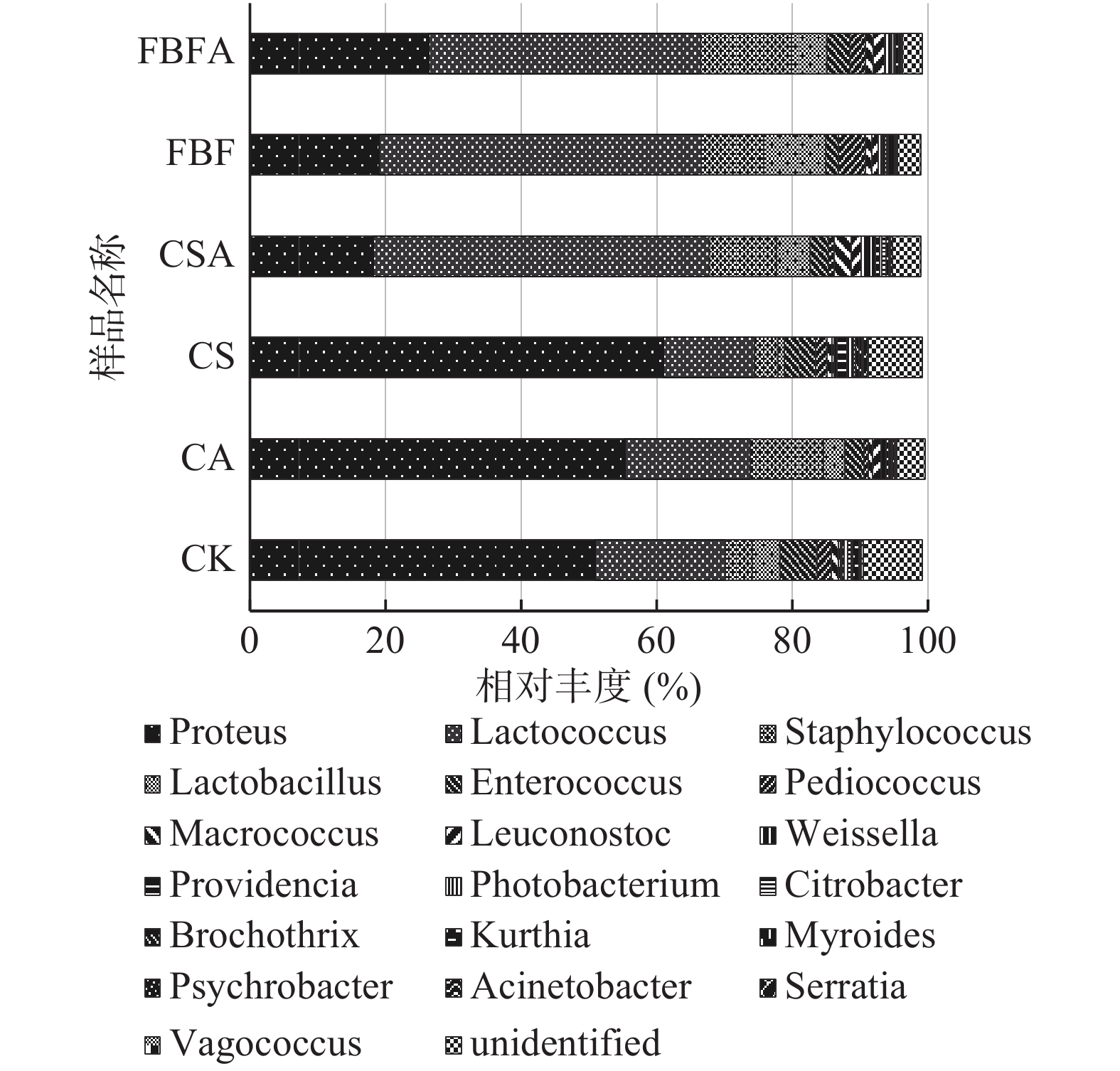
6组风干肠成品基于属水平的微生物群落结构组成及相对丰度分析结果见图3所示。由图3可以看出,除CSA组含有19个属水平的微生物群落组成,相对丰度为98.91%外,CK组、CA组、CS组、FBF组、FBFA组均包含20个属,相对丰度分别为99.19%、99.54%、99.17%、98.92%和99.21%,6组风干肠样品在属水平的群落结构组成基本一致,均以变形杆菌属、乳球菌属、葡萄球菌属、乳酸杆菌属、肠球菌属占主要部分,但相对丰度差异较大,CK、CA、CS组的优势菌属为变形杆菌属,其相对丰度分别为50.89%、55.33%、60.97%,其次为乳球菌属和葡萄球菌属;而CSA、FBF、FBFA组的优势菌属为乳球菌属,其相对丰度分别为49.57%、47.46%、40.09%,其次从高到低依次为变形杆菌属、葡萄球菌属、乳酸杆菌属。6组风干肠样品中乳酸杆菌属在FBF组中的相对丰度最大(9.08%),FBFA次之(5.24%),肠球菌属在CK组中的相对丰度最高(5.42%)。由此可以看出,外源抑制物CA、CS、CSA、FBF、FBFA均能影响风干肠中微生物群落结构的相对丰度,值得关注的是,CSA组、FBF组和FBFA组的乳球菌属为优势菌,说明这三组更有益于乳酸菌的生长繁殖。在发酵肉制品加工中,常接种乳酸菌发酵剂来形成产品独特的风味[27],抑制腐败菌的生长繁殖,延长保质期[28],在一定程度上提高了产品的安全性[29-30]。研究表明,乳酸菌在发酵过程中能产生多种抗菌物质和抗氧化产物[31-32],如Nisin细菌素[33]、乳酸乙酸等有机酸、过氧化氢、乙醇、乙醛、丁二酮等[34]。此外,大部分葡萄球菌对发酵肉制品风味的形成具有明显的促进作用,因为它们具有蛋白和脂肪水解酶活性,能对蛋氨酸、苯丙氨酸和一些支链氨基酸进行降解生成醛、醇和酸等前体风味物质[35-36]。本试验的6组样品中葡萄球菌属丰度的大小关系为FBFA>CA>CSA>FBF>CK>CS,这说明将FBF与CA复配添加到风干肠中能提高产品中葡萄球菌属的相对丰度。
3. 结论
随着风干时间的延长,6组风干肠样品中的微生物数量呈先升高后降低的趋势,FBFA能有效的控制成熟风干肠的乳酸菌和菌落总数,FBF对肠杆菌科的生长有明显抑制作用。微生物多样性分析表明,变形杆菌属、乳球菌属、葡萄球菌属、乳酸杆菌属和肠球菌属是风干肠中的主要微生物菌群,其中添加外源抑制物CSA、FBF、FBFA的风干肠有利于乳球菌属微生物的生长。因此,实验中筛选出的FBF、FBFA适合作为传统风干肠的天然抑菌剂,在一定程度上提高了风干肠的食用安全性,为传统风干肠天然抑菌剂研制提供了一定的实验基础。关于该抑菌剂在其他传发酵肉制品中的应用及与其他菌种结合开发复配抑菌剂还需进一步研究。
-
图 1 不同外源抑制物组风干肠在风干过程中乳酸菌总数、菌落总数和肠杆科菌数的变化
注:A:乳酸菌总数,B:菌落总数,C:肠杆菌科菌数;大写字母不同代表不同处理组间差异显著(P<0.05);小写字母不同代表同一处理组在不同风干时间内差异显著(P<0.05)。
Figure 1. Changes of total number of lactic acid bacteria, total number of colonies and the number of Enterobacteriaceae in air-dried sausages with different exogenous inhibitors
表 1 试验设计方案
Table 1 Scheme of experiment design
组别 外源抑制物种类 CA CS 2% FBF(以原料肉重计) CK − − − CA √ − − CS − √ − CSA √ √ − FBF − − √ FBFA √ − √ 表 2 6组风干肠成品的Alpha多样性指数
Table 2 Alpha diversity index of 6 groups of air-dried sausages products
指数 goods_coverage(%) chao1 observed_species shannon CK 99.85 175.4884 154.0000 2.8976 CA 99.84 159.0000 129.0000 2.5770 CS 99.86 149.7126 123.0000 2.4969 CSA 99.86 158.8087 137.0000 3.2227 FBF 99.84 175.2727 145.0000 3.1430 FBFA 99.86 147.1765 118.0000 3.0426 注:goods_coverage:样本中序列被测出的概率,其值越大被测出的概率越高;chao1:即菌种丰富度指数,用以估计群落中的OTU数目;observed_species:随测序深度的增加,实际观测到OTU的个数;shannon指数衡量物种的均匀度(evenness)即多样性,shannon越大,evenness越高。 -
[1] 于倩倩, 李聪, 周辉, 等. 发酵肉制品风味分析及形成途径研究[J]. 肉类工业,2019(11):52−58. doi: 10.3969/j.issn.1008-5467.2019.11.011 [2] Sameshima T, Magome C, Takeshita K, et al. Effect of intestinal Lactobacillus starter cultures on the behaviour of Staphylococcus aureus in fermented sausage[J]. International Journal of Food Microbiolg y,1998,41(1):1−7. doi: 10.1016/S0168-1605(98)00038-5
[3] 马菊, 孙宝忠, 郝永清. 国内外发酵肉制品历史及发展现状比较[J]. 肉类研究,2006,20(9):45−47. doi: 10.3969/j.issn.1001-8123.2006.09.019 [4] 王虎虎, 刘登勇, 徐幸莲, 等. 我国传统腌腊肉制品产业现状及发展趋势[J]. 肉类研究,2013,27(9):36−40. [5] 帅瑾. 传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D]. 雅安: 四川农业大学, 2013: 2−12. [6] 汪淼, 于海, 吴满刚, 等. 发酵肉制品风味形成研究进展[J]. 食品工业,2014,35(9):221−226. [7] 赵玲艳. 自然发酵辣椒微生物多样性及其宏转录组研究[D]. 长沙: 湖南农业大学, 2017. [8] 潘晓倩, 成晓瑜, 张顺亮, 等. 腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用[J]. 食品科学,2017,38(16):57−63. doi: 10.7506/spkx1002-6630-201716009 [9] 谭雅, 黄晴, 曹熙, 等. 发酵肉制品中常见有益微生物及其功能研究进展[J]. 食品工业技,2016,37(21):388−392. [10] Hu Y Y, Zhang L, Liu Q, et al. The potential correlation between bacterial diversity and the characteristic volatile flavour of traditional dry sausages from Northeast China[J]. Elsevier Ltd,2020:91.
[11] Chen J X, Hu Y Y, Wen R X, et al. Effffect of NaCl substitutes on the physical, microbial and sensory characteristics of Harbin dry sausage[J]. Meat Sci,2019,156:205−213. doi: 10.1016/j.meatsci.2019.05.035
[12] 熊凤娇, 马俪珍, 王洋. 二次回归正交设计优选阻断NDMA形成的亚硝化抑制剂[J]. 肉类研究,2018,32(6):29−34. [13] 陈文静, 姜皓, 杨华, 等. 复合香辛料亚硝化抑制剂对西式培根品质的影响[J]. 肉类研究,2020,34(2):13−19. [14] 樊晓盼, 刘静静, 李春萌, 等. 发酵牛肉调味基料替代亚硝酸盐在红肠中的应用[J]. 食品工业科技,2019,40(9):24−28, 33. [15] 李木子, 孔保华, 黄莉, 等. 弯曲乳杆菌对风干肠发酵过程亚硝胺降解及其理化性质的影响[J]. 中国食品学报,2016,16(3):95−102. [16] 陈文静, 杨华, 王洋, 等. 体外模拟亚硝化体系中优选阻断NDMA生成的香辛料精油复合抑制剂[J]. 食品工业科技,2020,41(2):127−132. [17] 樊晓盼, 施煜, 刘一鸣, 等. 天然牛肉调味基料的增稠工艺优化[J]. 食品研究与开发,2019,40(14):81−85. [18] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 乳酸菌检验: GB4789.35-2016[S]. 北京: 中国标准出版社: 2016. [19] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB4789.2-2016[S]. 北京: 中国标准出版社: 2016. [20] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 肠杆菌科检验: GB4789.41-2016[S]. 北京: 中国标准出版社: 2016. [21] 朱迎春, 王洋, 樊晓盼, 等. 基于宏基因组学技术分析不同贮藏条件下鲶鱼片中的菌相变化[J]. 中国农业科学,2017,50(5):913−923. doi: 10.3864/j.issn.0578-1752.2017.05.014 [22] 韦友兵, 吴香, 周辉, 等. 萨拉米发酵成熟过程中微生物菌群变化及对风味的影响[J]. 肉类研究,2018,32(12):48−54. [23] 吴晨燕, 马俪珍, 王洋, 等. 发酵牛肉调味基料对三株致病菌的抑菌作用及机理[J]. 食品工业科技,2020,41(3):206−211, 220. [24] Kos I, Maksimovic A Z, Zunabovc P M, et al. The influence of meat batter composition and sausage diameter on microbiota and sensory traits of artisanal wild boar meat sausages[J]. Food Technolgy and Biotechnolgy,2019,57(3):378−387. doi: 10.17113/ftb.57.03.19.6197
[25] 李家鹏, 田寒友, 邹昊, 等. 国外发酵肉制品微生物限量标准研究[J]. 肉类研究,2013,27(1):38−41. [26] 李成, 孔晓雪, 余炬波. 基于高通量测序分析蟹糊微生物菌群多样性[J]. 食品科学,2020,41(4):134−139. doi: 10.7506/spkx1002-6630-20180920-233 [27] Coppola R, Giagnacovo B, Iorizzo M, et al. Characterization of lactobacilli involved in the ripening of soppressata molisana, a typical southern Italy fermented sausage[J]. Food Microbiolgy,1998,15(3):347−353. doi: 10.1006/fmic.1997.0179
[28] López C, Medina L M, Priego R, et al. Behaviour of the constitutive biota of two types of Spanish dry-sausages ripened in a pilot-scale chamber[J]. Meat Science,2006,73(1):178−80. doi: 10.1016/j.meatsci.2005.10.014
[29] 景智波. 乳酸菌产脂肪酶特性研究及其在羊肉发酵香肠中的应用[D]. 呼和浩特: 内蒙古农业大学, 2019. [30] 张晓东. 发酵香肠菌种的筛选及对香肠理化性质的影响[D]. 长沙: 湖南农业大学, 2017. [31] Nyanhongo G S, Sygmund C, Ludwig R, et al. Enhancing the stress responses of probiotics for a lifestyle from gut to product and back again[J]. Microbial Cell Factories,2011,10(Suppl 1):S19. doi: 10.1186/1475-2859-10-S1-S19
[32] Pisano M B, Viale S, Conti S, et al. Preliminary evaluation of probiotic properties of Lactobacillus strains isolated from sardinian dairy products[J]. Journal of Biomedicine and Biotechnolg y,2014,2014(12):286390.
[33] Paula B, Mirian P, Francisco J B, et al. Antioxidant and antimicrobial activity of peptides extracted from meat by-products: A review[J]. Food Analytical Methods,2019,12(11):2401−2415. doi: 10.1007/s12161-019-01595-4
[34] 赵丽华. 羊肉发酵干香肠品质特性及挥发性风味变化及其形成机理研究[D]. 呼和浩特: 内蒙古农业大学, 2009. [35] Saranra J P, Naidu M A, Sivasakthivelan P. Lactic acid bacteria and its antimicrobial properties: A review[J]. International Journal of Pharmaceutics,2013,4(6):1124−1133.
[36] 杨洁, 赵丽华. 不同发酵剂对发酵肉制品风味物质的影响[J]. 食品工业,2016,37(6):235−238. -
期刊类型引用(6)
1. 韦啟球,王思思,梁柳春,闭爱艳,裴世成,伍善广,刘雪萍. 扛板归多糖对HepG2细胞增殖的体外抑制作用评价. 食品研究与开发. 2025(05): 10-15+37 .  百度学术
百度学术
2. 王冬晴,马长伟,王共明,刘芳,井月欣,赵云苹,张健,矫春娜,徐英江. 发酵技术在海藻功能性食品加工中的应用. 食品与发酵工业. 2024(12): 379-387 .  百度学术
百度学术
3. 韦啟球,黄敏怡,农秋冬,闭爱艳,裴世成,刘雪萍. 扛板归粗多糖抗氧化、抗炎、镇痛和抑菌活性研究. 食品工业科技. 2024(17): 57-64 .  本站查看
本站查看
4. 许波杰,闫培生. 褐藻多糖的提取及生物活性研究进展. 现代食品科技. 2024(07): 369-378 .  百度学术
百度学术
5. 赵迪,白淼,余萍,矫艳平,闵祥博,李丽娜,李晶,彭永振,陈雪. 决明子菊花本草酵素的制备及降血压作用研究. 食品与发酵科技. 2023(05): 64-70 .  百度学术
百度学术
6. 刘欣鑫,姚必君,刘昱宏,邵端阳,韩冠英. 碱蓬多糖长循环脂质体的制备. 锦州医科大学学报. 2023(05): 6-12 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:
