Flavor Analysis of Fermented Laminaria japonica Based on Gas Chromatograph-Ion Mobility Spectrometer (GC-IMS)
-
摘要: 为探讨海带发酵前后的风味变化,本研究使用乳酸菌、酵母菌及二者复合发酵共三种发酵方式,分别在4%、6%糖盐水中进行海带发酵,并以6种不同发酵条件下的海带样品为研究对象,利用气相-离子迁移谱(GC-IMS)联用技术,对海带发酵前后的挥发性风味有机物(VOCs)进行比较分析,建立不同条件下发酵海带的指纹图谱,同时对分离出的VOCs进行鉴别和分类,并采用主成分分析(PCA)比较不同样品间的差异。指纹图谱显示,不同发酵条件下的海带样品中VOCs差异明显。海带发酵样品中共鉴定出33种风味物质,包括醛类、醇类、酮类、羧酸类、酯类、醚类和芳香族化合物,以醛类、醇类、酮类物质为主,其中醛类物质含量最高,且酵母菌发酵后,低分子量醛如己醛、庚醛、戊醛含量明显降低,可能对降低海带的腥味起主要作用。PCA结果显示,前两个主成分累计贡献率为86.58%,可基本代表样品的绝大部分特征,且不同发酵条件下的海带样品得到了很好的区分。结果表明:发酵可有效降低海带中的腥味物质含量,是改善海带食品风味的加工方式;气相-离子迁移谱联用技术可较好地区分不同发酵条件的海带样品,对构建发酵海带VOCs的指纹图谱、数据库及其分类鉴别具有潜在的应用价值。Abstract: In this study, along with the addition of 4% and 6% sugar and salt, effect of lactic acid bacteria fermentation, yeast fermentation and both of them co-fermentation on Laminaria japonica (L.japonica) were investigated, thereafter the flavor changes of which were determined by gas chromatograph-ion mobility spectrometer (GC-IMS). The volatile organic compounds (VOCs) of L.japonica were identified and compared before and after fermentation, the fingerprint spectra were established, and the differences between different fermentation conditions were analyzed by principal component analysis (PCA). According to the results of the fingerprints, there were significant differences between the VOCs in the fermented samples under different conditions. Totally 33 VOCs were identified in the fermented samples, including aldehydes, alcohols, ketones, carboxylic acids, esters, ethers and aromatic compounds, of which aldehydes, alcohols, and ketones were main substances. The contents of aldehydes was the highest before fermentation, while after fermentation by yeast, the content of certain aldehyde of low molecular weight such as hexanal, heptanal, and pentanal were significantly reduced, which resulted in the reducing the fishy smell of L.japonica. PCA results showed that the contribution rate of the first two main components was 86.58%, which could represent the characteristics of the samples basically. In addition, samples under different fermentation conditions were well distinguished. According to this study, fermentation was an efficient way to reduce the fishery smell and thus improve the flavor of L.japonica. GC-IMS technology could be effectively applied to distinguish different fermented samples, and had potential application value for the construction of fingerprints and databases of VOCs of L. japonica.
-
海带(Laminaria japonica),又名纶布、江白菜、昆布,是一种生长于低温海域中的多年生大型食用藻类,隶属褐藻门(Phaeophyta)、海带科(Laminariaceae)海带属(Laminaria)[1]。在亚洲,尤其是我国、日本、韩国等国家,海带因其丰富的营养及独特的风味成为人们喜爱的食用藻类之一[2]。除了用作食品原料外,海带还具有较高的经济价值,能够作为工业上提取褐藻胶、甘露醇、碘的原料,其中褐藻胶作为广泛应用的食品添加剂被加入到各种食品中[3]。同时,海带中富含多种活性物质如褐藻胶、褐藻糖胶、海藻多酚等,这些活性物质使得海带有降血脂、降血糖、抗癌和提高免疫力等功效,在医药领域具有较大的潜力与价值[4]。
我国是全球海藻养殖及其加工利用规模最大的国家,海带产量约占世界产量的80%,位居世界首位[5]。我国海带产量虽逐年增长,但其加工程度低,主要以传统的初级产品为主[6]。由于海带细胞壁中存在大量如褐藻胶等的多糖,其水溶性较差,同时海带中的呈味物质以及功能因子被胶体紧密包裹,不易溶出和提取,因此海带中活性成分提取在很大程度上被制约[7]。可见,探索海带的深加工技术,是我国海带产业可持续发展的重要方向[8]。
发酵指的是在微生物的作用下,复杂的有机化合物被分解成比较简单的物质的一种生物氧化方式,其过程是微生物和酶所引起的一系列复杂的生化反应[9]。使用发酵方法加工食品的历史悠久且优点显著,如发酵可产生醇类、氨基酸、酯类和有机酸等物质使产品具有独特的风味及色泽。目前,大多数发酵的海洋食品是由鱼和虾等动物材料制成的,使用发酵方法加工的海藻类产品较少,还处于起步阶段,国内主要产品为海藻发酵酒、海藻发酵饮料、海藻发酵酱等[10]。
气相色谱-离子迁移谱联用(gas chromatography-ion mobility spectroscopy,GC-IMS)是一种将气相色谱和离子迁移谱结合的检测技术,用于分析样品中的挥发性化合物,首先利用气相色谱对待测样品进行预分离,然后通过离子迁移谱进行挥发性组分的分析[11]。该方法不但使得离子迁移谱的信号响应质量得到显著提高,又使得气相色谱分离后所得的化学信息更加丰富,充分发挥了两种技术各自的优点。该技术具有简单、快速、灵敏的优点,目前已广泛应用于食品风味分析、品质评价、环保安全等多个生命化学领域[12]。近年来,国内外利用GC-IMS进行食品风味的研究主要集中在植物油[13]、菌类[14]、肉制品[15]、鱼类[16]等风味丰富的物质。目前尚未见GC-IMS应用于发酵海带风味物质检测的报道。
本研究以不同条件下发酵后所得6个发酵海带样品及发酵前的海带样品为研究对象,采用GC-IMS的方式进行挥发性风味成分分析,探究其风味物质组成成分及相对含量的变化,将风味成分所发生的变化以可视化的方式表现出来。通过比较不同糖盐含量和不同菌种发酵前后海带风味所发生的变化,为促进海带的高值化利用、改善其风味提供新方法、新思路。
1. 材料与方法
1.1 材料与仪器
干海带 金鹏旗舰店,原料来自荣成海域;泡菜酸菜乳酸菌发酵粉 北京川秀科技有限公司;安琪高活性干酵母粉 安琪酵母股份有限公司;绵白糖 青岛华润泽食品有限公司;食盐 青岛盐海制盐有限公司。
LDZM-80L立式高压蒸汽灭菌器 上海申安医疗器械厂;DWP-9082电热恒温培养箱 上海精宏实验设备有限公司;SW-CJ-1FD洁净工作台 苏净集团苏州安泰空气技术有限公司;Flavour Spec® 风味分析仪 德国G.A.S公司;CTC-PAL自动顶空进样器 瑞士CTC Analytics公司;SE-54毛细管柱(规格:15 m×0.53 mm×1.0 μm) 德国CS-Chromatographie Service设备供应商。
1.2 实验方法
1.2.1 海带的预处理
干海带从中肋处对称分成两半,一半用于后续发酵处理,另一半作为未发酵的海带对照样品。将干海带洗净后于60 ℃复水2~3 h。复水后的海带沥水,切成约4 cm×4 cm方片状,置于灭菌锅中121 ℃灭菌20 min,灭菌完成后冷却备用。
1.2.2 菌种活化
1.2.2.1 乳酸菌活化
1 g乳酸菌菌粉(泡菜酸菜乳酸菌发酵粉,包括植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌)加入到100 mL灭菌水中,37 ℃培养活化12 h。
1.2.2.2 酵母菌活化
2 g酵母粉加入到50 mL灭菌2%糖水中,28 ℃活化培养1 h。
1.2.3 发酵实验
1.2.3.1 无菌糖盐水制备
将12 g绵白糖与12 g食盐加入300 mL超纯水中,即4%糖盐水;将18 g绵白糖与18 g食盐加入300 mL超纯水中,即6%糖盐水。将4%糖盐水、6%糖盐水置于灭菌锅中,121 ℃灭菌20 min,灭菌完成后冷却备用。
1.2.3.2 乳酸菌发酵
将200 g灭菌后的海带片分别与300 mL不同浓度(4%、6%)灭菌糖盐水在无菌操作台中混合,按菌种使用说明中1 g乳酸菌粉发酵1 kg样品的比例,每200 g海带样品中加入300 mL糖盐水及20 mL活化后的乳酸菌液,密封后于30 ℃发酵10 d。
1.2.3.3 酵母菌发酵
将200 g灭菌后的海带片分别与300 mL不同浓度(4%、6%)灭菌糖盐水在无菌操作台中混合,同时加入50 μL活化后的酵母菌液,密封后于30 ℃发酵10 d。
1.2.3.4 乳酸菌与酵母菌复合发酵
将200 g灭菌后的海带片分别与300 mL不同浓度(4%、6%)灭菌糖盐水在无菌操作台中混合,同时加入20 mL活化后的乳酸菌液和50 μL活化后的酵母菌液,密封后于30 ℃发酵10 d。
1.2.4 风味分析仪测定
1.2.4.1 样品处理
将发酵前及发酵后的海带样品分别取样,将海带片与水以1:2的比例混合、捣碎,准确称取0.5 g捣碎后的样品放入20 mL顶空进样瓶中,加盖,密封,待测。
1.2.4.2 顶空自动进样器条件
将密封好的顶空瓶放入顶空自动进样器,于50 ℃孵化10 min,采用振荡加热方式孵化后,进行自动进样测定。进样针吸取上层体积为500 μL的气体,于60 ℃条件下进样。
1.2.4.3 GC条件
设置气相色谱柱温度为40 ℃,测定过程中的载气为高纯N2;载气流速为海带风味物质分离最适流速:初流速为2 mL/min保持2 min,后升至10 mL/min保持3 min,再升至15 mL/min保持10 min,再升至50 mL/min保持5 min,最后升至150 mL/min保持5 min,总分析时间为25 min。
1.2.4.4 IMS 检测条件
设置IMS漂移管温度为45 ℃,测定过程中的漂移气为高纯N2,漂移气的流速保持150 mL/min不变;漂移管内的电离源为氘放射,即β射线,离子化模式为正离子模式。
1.3 数据处理
每个样品平行测定3次。利用GC-IMS自带的LAV分析软件对发酵海带的挥发性风味成分进行采集、指纹图谱的建立及PCA分析;通过GC×IMS Library Search 定性软件内置的NIST气相保留指数数据库和IMS迁移时间数据库对采集的VOCs进行定性分析;利用Origin软件对PCA分析数据进行统计与绘图。
2. 结果与分析
2.1 GC-IMS谱图分析
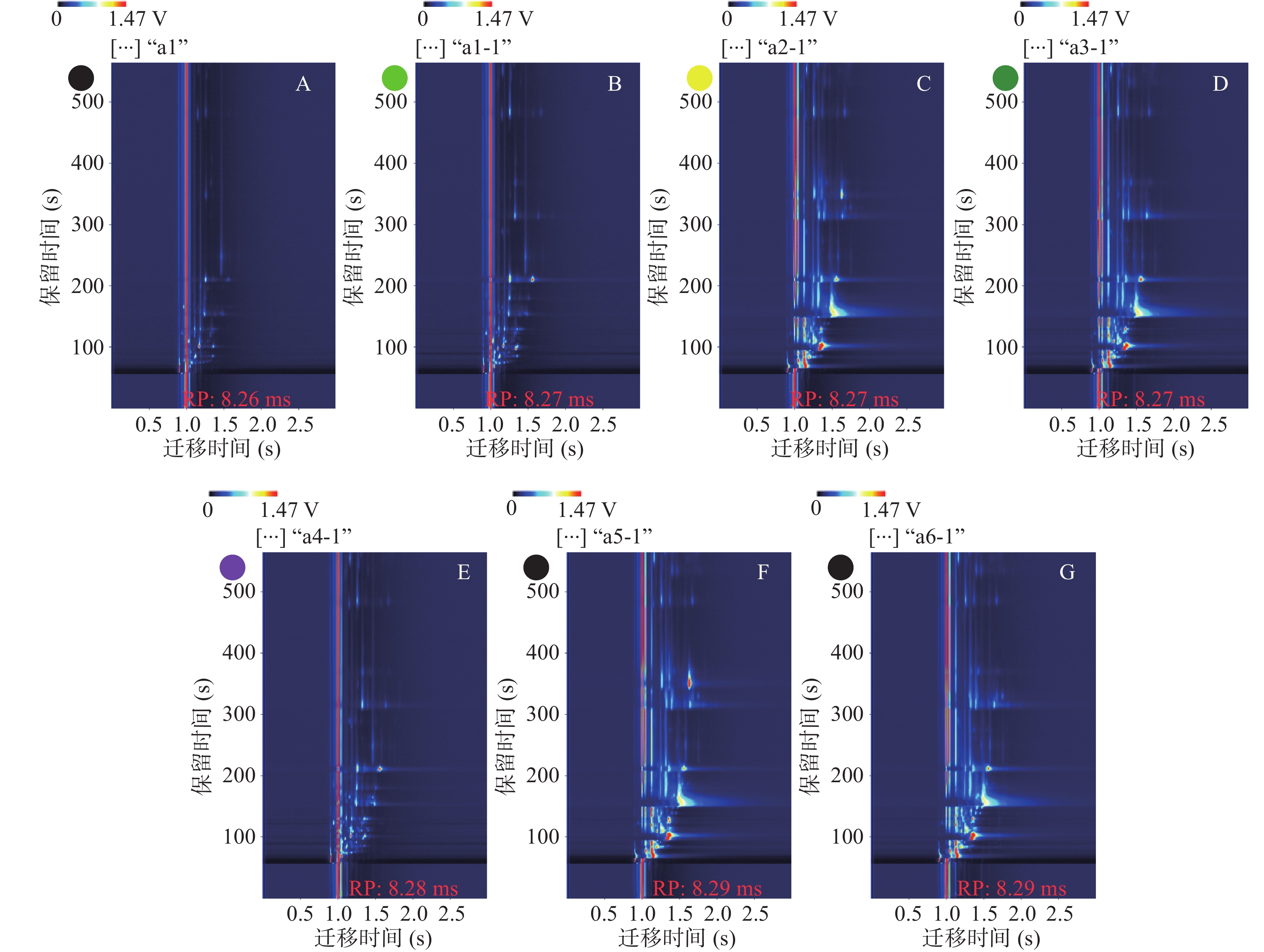
风味分析仪生成的数据是三维谱图,包括保留时间、迁移时间和峰强度,为便于观察,取俯视图进行差异对比。图1为海带发酵前后的GC-IMS谱图,横坐标1.0处红线表示反应离子峰(reaction ion peak,RIP)。RIP峰两侧的每一个点代表一种挥发性有机物,颜色越深表示该化合物的浓度越大[17]。从图1中可以看出,发酵后海带中的风味物质明显增多;C、D、F、G样品中因含有酵母菌,发酵产生乙醇,因此GC-IMS谱图RIP峰右侧出现两条红线为乙醇峰,由于酵母菌发酵后的样品中乙醇含量较高,该峰产生拖尾现象。除此之外,海带发酵前后样品中的挥发性有机物通过GC-IMS得到了较好的分离,且可直观比较不同发酵条件产生的VOCs间的差异。
为了更直观地比较不同条件下所得海带发酵前后所产生的VOCs间的差异,对发酵前后的海带样品GC-IMS谱图中的风味特征峰进行选取,根据VOCs保留时间及迁移时间对其进行定性分析,通过软件内置的NIST GC数据库及G.A.S的IMS数据库,确定了33种VOCs,其中浓度较高的物质会产生二聚体。根据VOCs的CAS号,可通过网站The Good Scents Company Information System(http://www.thegoodscentscompany.com/)确定其风味描述,以便更好地比较不同发酵条件对海带VOCs所产生的影响。
2.2 挥发性风味物质(VOCs)分析
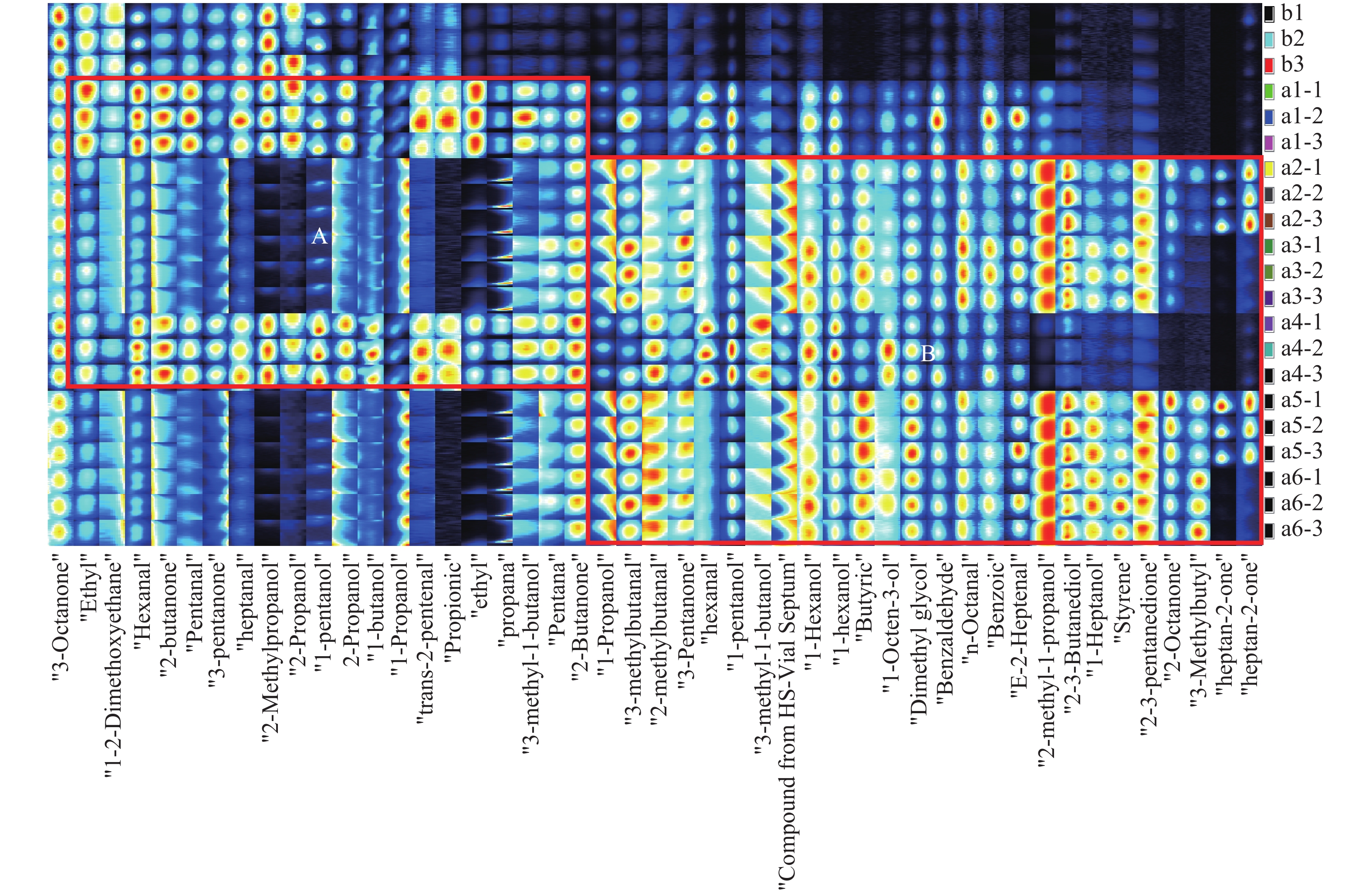
通过GC-IMS自带的LAV软件建立海带发酵前后VOCs的指纹图谱(图2),图谱每一行代表一个样品中选取的全部信号峰,每一列代表同一挥发性有机物在不同样品中的信号强度,每个样品平行测定3次,颜色越深表示物质含量越高[18]。从指纹图谱中可以看出每种样品的完整挥发性有机物信息以及样品之间挥发性有机物的差异。
由图2可知,利用GC-IMS在发酵海带样品可分离出47个特征峰,定性后得到33种VOCs,其中13种VOCs的含量较高,在分离时不但有单体的存在,还因其高含量产生二聚体,如表1所示。海带发酵前后所产生的VOCs共有7大类,其中包括10种醛类化合物、10种醇类化合物、6种酮类化合物、2种羧酸类化合物、3种酯类化合物、1种醚类化合物和1种芳香族化合物。由于烷烃物质的质子亲和力低于水,无法捕获水合质子的氢离子,因此GC-IMS无法检测烷烃物质。对比指纹图谱中VOCs的峰强度,发酵后海带样品中VOCs含量相对发酵前样品变化显著,大部分VOCs在发酵后含量增加,部分化合物在含有酵母菌条件下发酵后含量降低。由图2可知,A区域所示为乳酸菌发酵海带特征VOCs,而B区域所示为酵母菌发酵海带特征VOCs。
表 1 发酵海带挥发性风味物质的定性分析Table 1. Volatile compounds identified in fermented Laminaria japonica名称 名称 CAS号 风味描述[6,19-21] 保留指数RI 注 醛类 丙醛 Propanal 123-38-6 醚味,泥土,酒精,刺鼻 513.6 戊醛 Pentanal 110-62-3 发酵,面包,果浆 691.5 单体 689.9 二聚体 己醛 Hexanal 66-25-1 鱼腥味,青草,油脂,树叶,植物,果味,清新,木头 790.1 单体 788.7 二聚体 庚醛 Heptanal 111-71-7 鱼干,柑橘,青草,清新,脂肪,农药, 烟熏,腐臭,果味 898.8 反式-2-庚醛 (E)-2-heptenal 18829-55-5 刺鼻,青草,脂肪,油,果味 957.4 单体 955.7 二聚体 苯甲醛 Benzaldehyde 100-52-7 杏仁,果味,粉末,坚果,苦味 954.6 辛醛 Octanal 124-13-0 醛香,蜡香,脂肪,刺鼻,柑橘,青草 1004.9 3-甲基丁醛 3-methylbutanal 590-86-3 果味(桃子),腐臭,汗味,发酵,巧克力,青草,杏仁,坚果 644.3 反式-2-戊烯醛 (E)-2-pentenal 1576-87-0 刺鼻,青草,果味(苹果) 747.1 2-甲基丁醛 2-methylbutanal 96-17-3 霉味,巧克力,可可,咖啡,坚果,呋喃,麦芽和发酵 649.2 醇类 1-丙醇 1-propanol 71-23-8 酒精,发酵,杂醇,塑料,霉味,酵母,甜的果味 566.6 单体 529.2 二聚体 2-丙醇 2-propanol 67-63-0 酒精,霉味,木头 532.6 单体 536.1 二聚体 2-甲基丙醇 2-methylpropanol 78-83-1 醚味,酒味,果皮 622.9 单体 621.6 二聚体 正丁醇 1-butanol 71-36-3 杂醇油,甜味,香脂,威士忌 656.8 2-甲基-1-丁醇 2-methyl-1-butanol 123-51-3 杂醇油,香脂,酒精,刺鼻,白兰地,果味(香蕉),糖浆 730.2 单体 728.7 二聚体 正戊醇 1-pentanol 71-41-0 刺鼻,发酵,青草,蜡味,面包,酵母,杂醇油,酒味,油,甜味 760.6 单体 760 二聚体 正己醇 1-hexanol 111-27-3 刺鼻,扩散,杂醇油,油,果味,甜味, 酒味,青草 866.4 单体 866.6 二聚体 1-辛烯-3-醇 1-octen-3-ol 3391-86-4 鱼腥,青草,泥土,油,蘑菇 984.2 2,3-丁二醇 2,3-butanediol 513-85-9 果味,奶油,黄油,杂醇油 789.1 正庚醇 1-heptanol 111-70-6 霉味,刺鼻,清新,坚果,树叶,植物,果味(苹果和香蕉) 976.9 酮类 2-丁酮 2-butanone 78-93-3 扩散,干酪,丙酮,果味 590.8 单体 589 二聚体 3-戊酮 3-pentanone 96-22-0 扩散,丙酮 692.9 单体 690.8 二聚体 3-辛酮 3-octanone 106-68-3 霉味,蘑菇,酮,干酪,青草,发酵,植物 990.1 2-庚酮 2-heptanone 110-43-0 蓝纹奶酪,果味,酮,辛辣,青香蕉,奶油 887.7 单体 887.2 二聚体 2-辛酮 2-octanone 111-13-7 泥土,青草,肥皂,花香,霉味,酮,蓝纹奶酪,帕玛干酪 1006.3 2,3-戊二酮 2,3-pentanedione 600-14-6 黄油,坚果,烤制,焦糖,酮 692 羧酸 丙酸 Propionic acid 79-09-4 刺鼻,酸味,乳制品 737.1 丁酸 Butanoic acid 107-92-6 乳制品,干酪,黄油,果味 848.9 酯类 苯甲酸甲酯 Methyl benzoate 93-58-3 酚,樱桃核 1088 乙酸异戊酯 Isoamyl acetate 123-92-2 甜味,香蕉,清新,果味(酯) 875.1 乙酸乙酯 Ethyl acetate 141-78-6 果味(橙),醋,扩散,焦糖,甜味,黄油,刺鼻,葡萄,朗姆酒 607.1 单体 608.3 二聚体 醚类 乙二醇二甲醚 Ethylene glycol dimethyl ether 110-71-4 666.3 芳香族化合物 苯乙烯 Styrene 100-42-5 甜味,香脂,花香,塑料 899 由图2结合表1可知,3-辛酮在所有发酵前后海带样品中含量基本不变;乙酸乙酯、3-戊酮、2-丁酮、己醛、庚醛、戊醛、戊醇、2-甲基丙醇、2-丙醇这几种VOCs,在只有乳酸菌发酵后含量基本不变,但在酵母菌发酵后,含量明显降低;而辛醛、2,3-丁二醇、2-甲基-1-丁醇、正庚醇、2,3-戊二酮这几种VOCs,在乳酸菌发酵后含量基本不变,但酵母菌发酵后含量明显升高;乳酸菌发酵后,海带样品中反式-2-庚醛、正丁醇、丙酸含量均有所增加;不论是乳酸菌发酵还是酵母菌发酵,海带样品中苯甲醛、3-甲基丁醛、2-甲基丁醛、正己醇、1-辛烯-3-醇、3-戊酮、丁酸、乙二醇二甲醚含量均有所升高;而2-庚酮在只含酵母菌的发酵海带中含量升高。
据统计,海带中的醛类含量最高,由GC-IMS谱图也可以看出,醛类物质的特征峰颜色较深,表明其含量较高。在发酵前后的海带样品中,共确定了10种醛类物质。发酵后,苯甲醛、3-甲基丁醛、2-甲基丁醛含量均有所升高;乳酸菌发酵后,反式-2-庚醛含量升高;而酵母菌发酵后,己醛、庚醛、戊醛含量降低,辛醛含量升高。国内外相关研究表明,己醛和丁醛是黑海褐藻和红藻中最丰富的的醛类[22],而三水坛紫菜中己醛含量较高,可产生腥味[23];醛的链长主要影响气味阈值和气味特性,低分子量(<150 Da)的醛往往会产生难闻的气味[19],而高分子量的醛则具有甜味、水果味[24];海藻中的短链醛(C6~C9)和中链醛(C10)是由海藻中的脂肪酸(C20)形成的,而长链醛(C15~C17)是由脂肪酸通过形成相应的2-氢过氧酸进而形成的[25];羰基化合物和醛是造成各种气味的原因,例如乙醛的坚果味[26]和苯甲醛的杏仁味[27];直链和支链醛通常提供青草和刺鼻的风味,而不饱和醛则与蔬菜和鱼腥味有关[28]。有研究表明,鱼类中五种关键化合物,包括己醛、庚醛、壬醛、1-辛烯-3-醇和2,4-庚二烯醛具有腥味[20,,29]。本研究中,低分子量醛如己醛、庚醛和戊醛在酵母菌发酵后含量降低,可能在降低海带的腥味、提高海带的风味中起主要作用。
2.3 PCA分析
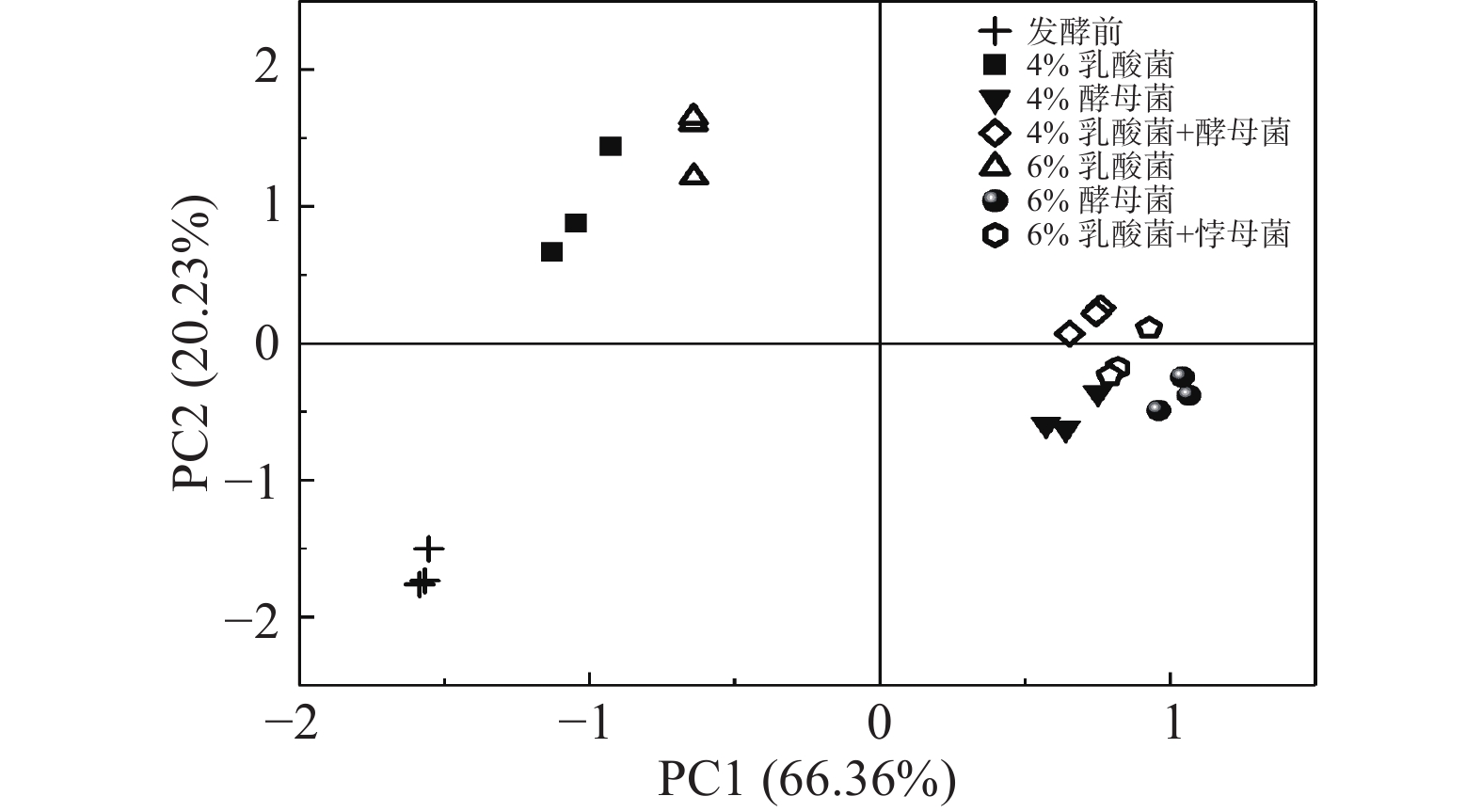
主成分分析(principal component analysis,PCA),是一种多元统计方法,是通过正交变换,将一组可能存在相关性的多个变量降维转换成一组线性不相关的、少数几项具有代表性的变量,转换后的变量叫做主成分[30]。当累计贡献率超过80%时,通常认为基本包含样品的信息。图3表示对选取的GC-IMS特征峰(峰强)作为其特征变量,进行主成分分析,图中横坐标轴PC1和纵坐标轴PC2分别表示PCA分析后各主成分的贡献率。其中第一主成分(PC1)的贡献率为66.36%,第二主成分(PC2)的贡献率为20.23%,前两个主成分的累计贡献率为86.58%,说明这两个主成分基本可以反映出发酵海带样品的绝大部分特征。从图3可以看出,PCA可将不同条件下发酵的海带样品根据其菌种不同区分开,且相互之间没有明显的重叠区域,说明不同发酵条件下的海带样品得到了很好的区分。
3. 结论
本研究首次利用GC-IMS联用技术探究发酵海带的风味变化,无需复杂的前处理及萃取过程,充分利用了GC高分离效率和IMS高灵敏度的优势,将数据以可视化的形式呈现在谱图中,更直观地展现出样品间的差异。根据GC-IMS数据库,对分离出的VOCs进行二维定性,并首次建立了发酵海带风味物质的指纹图谱与定性表格。定性结果显示,发酵海带样品中共分离出33种挥发性物质,包括醛类、醇类、酮类、酯类、醚类和芳香族化合物,以醛类物质为主,其中己醛、庚醛、戊醛等小分子量醛在酵母菌发酵后含量明显降低;指纹图谱结果表明,海带在不同发酵条件下所产生的风味物质差异明显,因此可根据未知样品的特征VOCs类型及其含量判断发酵菌种;PCA结果显示,第一主成分和第二主成分的累计贡献率可达到86%,表明选取的特征风味峰信息关键有效,且不同条件的样品可得到明显的区分。GC-IMS分析结果表明,对比分析不同发酵条件样品的挥发性有机物特征信息用于区分发酵菌种、识别发酵条件的方法是可行的。但由于GC-IMS技术起步较晚,手段较新,IMS数据库不够完善,部分VOCs无法进行定性,后期可将无法定性的VOCs用标准物质或其他手段进行验证,丰富海带发酵领域的VOCs数据库。
本研究通过探究不同菌种发酵过程对海带风味的影响,表明发酵是降低海带腥味、改善海带食品风味的有效加工方式,这为新型发酵海带产品的开发提供了思路。后期将进一步探索发酵机制,为发酵海带产品的开发提供更多的理论依据。
-
表 1 发酵海带挥发性风味物质的定性分析
Table 1 Volatile compounds identified in fermented Laminaria japonica
名称 名称 CAS号 风味描述[6,19-21] 保留指数RI 注 醛类 丙醛 Propanal 123-38-6 醚味,泥土,酒精,刺鼻 513.6 戊醛 Pentanal 110-62-3 发酵,面包,果浆 691.5 单体 689.9 二聚体 己醛 Hexanal 66-25-1 鱼腥味,青草,油脂,树叶,植物,果味,清新,木头 790.1 单体 788.7 二聚体 庚醛 Heptanal 111-71-7 鱼干,柑橘,青草,清新,脂肪,农药, 烟熏,腐臭,果味 898.8 反式-2-庚醛 (E)-2-heptenal 18829-55-5 刺鼻,青草,脂肪,油,果味 957.4 单体 955.7 二聚体 苯甲醛 Benzaldehyde 100-52-7 杏仁,果味,粉末,坚果,苦味 954.6 辛醛 Octanal 124-13-0 醛香,蜡香,脂肪,刺鼻,柑橘,青草 1004.9 3-甲基丁醛 3-methylbutanal 590-86-3 果味(桃子),腐臭,汗味,发酵,巧克力,青草,杏仁,坚果 644.3 反式-2-戊烯醛 (E)-2-pentenal 1576-87-0 刺鼻,青草,果味(苹果) 747.1 2-甲基丁醛 2-methylbutanal 96-17-3 霉味,巧克力,可可,咖啡,坚果,呋喃,麦芽和发酵 649.2 醇类 1-丙醇 1-propanol 71-23-8 酒精,发酵,杂醇,塑料,霉味,酵母,甜的果味 566.6 单体 529.2 二聚体 2-丙醇 2-propanol 67-63-0 酒精,霉味,木头 532.6 单体 536.1 二聚体 2-甲基丙醇 2-methylpropanol 78-83-1 醚味,酒味,果皮 622.9 单体 621.6 二聚体 正丁醇 1-butanol 71-36-3 杂醇油,甜味,香脂,威士忌 656.8 2-甲基-1-丁醇 2-methyl-1-butanol 123-51-3 杂醇油,香脂,酒精,刺鼻,白兰地,果味(香蕉),糖浆 730.2 单体 728.7 二聚体 正戊醇 1-pentanol 71-41-0 刺鼻,发酵,青草,蜡味,面包,酵母,杂醇油,酒味,油,甜味 760.6 单体 760 二聚体 正己醇 1-hexanol 111-27-3 刺鼻,扩散,杂醇油,油,果味,甜味, 酒味,青草 866.4 单体 866.6 二聚体 1-辛烯-3-醇 1-octen-3-ol 3391-86-4 鱼腥,青草,泥土,油,蘑菇 984.2 2,3-丁二醇 2,3-butanediol 513-85-9 果味,奶油,黄油,杂醇油 789.1 正庚醇 1-heptanol 111-70-6 霉味,刺鼻,清新,坚果,树叶,植物,果味(苹果和香蕉) 976.9 酮类 2-丁酮 2-butanone 78-93-3 扩散,干酪,丙酮,果味 590.8 单体 589 二聚体 3-戊酮 3-pentanone 96-22-0 扩散,丙酮 692.9 单体 690.8 二聚体 3-辛酮 3-octanone 106-68-3 霉味,蘑菇,酮,干酪,青草,发酵,植物 990.1 2-庚酮 2-heptanone 110-43-0 蓝纹奶酪,果味,酮,辛辣,青香蕉,奶油 887.7 单体 887.2 二聚体 2-辛酮 2-octanone 111-13-7 泥土,青草,肥皂,花香,霉味,酮,蓝纹奶酪,帕玛干酪 1006.3 2,3-戊二酮 2,3-pentanedione 600-14-6 黄油,坚果,烤制,焦糖,酮 692 羧酸 丙酸 Propionic acid 79-09-4 刺鼻,酸味,乳制品 737.1 丁酸 Butanoic acid 107-92-6 乳制品,干酪,黄油,果味 848.9 酯类 苯甲酸甲酯 Methyl benzoate 93-58-3 酚,樱桃核 1088 乙酸异戊酯 Isoamyl acetate 123-92-2 甜味,香蕉,清新,果味(酯) 875.1 乙酸乙酯 Ethyl acetate 141-78-6 果味(橙),醋,扩散,焦糖,甜味,黄油,刺鼻,葡萄,朗姆酒 607.1 单体 608.3 二聚体 醚类 乙二醇二甲醚 Ethylene glycol dimethyl ether 110-71-4 666.3 芳香族化合物 苯乙烯 Styrene 100-42-5 甜味,香脂,花香,塑料 899 -
[1] 姜雪, 刘楠, 孙永, 等. 荣成鲜海带及其干、盐制品的营养成分分析[J]. 食品安全质量检测学报,2018,9(8):1874−1880. doi: 10.3969/j.issn.2095-0381.2018.08.024 [2] 王文亮, 王守经, 宋康, 等. 中国海带资源的功能及其开发利用研究[J]. 农业工程技术(农产品加工业),2008(4):40−41. [3] 杨洁茹, 沈照鹏, 余俊红, 等. 酶法提取海带成分分析[J]. 食品科技,2019,44(7):277−282. [4] Cao Y, Hao Y, Li Z, et al. Antiviral activity of polysaccharide extract from Laminaria japonica against respiratory syncytial virus[J]. Biomedicine & Pharmacotherapy,2016,84:1705−1710.
[5] 郭云峰, 赵文武. 《中国渔业统计年鉴》[M]. 北京: 中国农业出版社, 2017: 3. [6] 吴海一, 王翔宇, 朱安成. 脆嫩-厚成期海带物质成分变化分析研究[J]. 海洋科学,2015,39(8):35−38. doi: 10.11759/hykx20150205003 [7] 姚骏, 张弘, 郭森, 等. 海带营养调味料的研究进展[J]. 食品研究与开发,2018,39(4):213−217. doi: 10.3969/j.issn.1005-6521.2018.04.039 [8] 岳昊, 孙英泽, 胡婧, 等. 中国海带产业及国际贸易情况分析[J]. 农业展望,2013,9(9):65−69. doi: 10.3969/j.issn.1673-3908.2013.09.015 [9] Park M, Han J. Protective effects of the fermented Laminaria japonica extract on oxidative damage in LLC-PK1 cells[J]. Preventive Nutrition and Food Science,2013,18(4):227−233. doi: 10.3746/pnf.2013.18.4.227
[10] 崔韵, 刘烨, 黄小芬, 等. 食用海藻发酵加工研究进展[J]. 粮食与食品工业,2010,17(1):31−33. doi: 10.3969/j.issn.1672-5026.2010.01.009 [11] Liedtke S, Seifert L, Ahlmann N, et al. Coupling laser desorption with gas chromatography and ion mobility spectrometry for improved olive oil characterisation[J]. Food Chemistry,2018,255:323−331. doi: 10.1016/j.foodchem.2018.01.193
[12] Arroyo-Manzanares N, Martin-Gomez A, Jurado-Campos N, et al. Target vs spectral fingerprint data analysis of Iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J]. Food Chemistry,2018,246:65−73. doi: 10.1016/j.foodchem.2017.11.008
[13] Mar Contreras M, Jurado-Campos N, Arce L, et al. A robustness study of calibration models for olive oil classification: Targeted and non-targeted fingerprint approaches based on GC-IMS[J]. Food Chemistry,2019,288:315−324. doi: 10.1016/j.foodchem.2019.02.104
[14] Li M, Yang R, Zhang H, et al. Development of a flavor fingerprint by HS-GC-IMS with PCA for volatile compounds of Tricholoma matsutake Singer[J]. Food Chemistry,2019,290:32−39. doi: 10.1016/j.foodchem.2019.03.124
[15] Martin-Gomez A, Arroyo-Manzanares N, Rodriguez-Estevez V, et al. Use of a non-destructive sampling method for characterization of Iberian cured ham breed and feeding regime using GC-IMS[J]. Meat Science,2019,152:146−154. doi: 10.1016/j.meatsci.2019.02.018
[16] Chen K, Yang X, Huang Z, et al. Modification of gelatin hydrolysates from grass carp (Ctenopharyngodon idellus) scales by Maillard reaction: Antioxidant activity and volatile compounds[J]. Food Chemistry,2019,295:569−578. doi: 10.1016/j.foodchem.2019.05.156
[17] 杨芳, 杨莉, 粟立丹. 基于电子鼻和气相-离子迁移谱对美人椒酱的风味分析[J]. 食品工业科技,2019,40(23):193−198. [18] 陈通, 谷航, 陈明杰, 等. 基于气相离子迁移谱对葵花籽油精炼程度的检测[J]. 食品科学,2019,40(18):312−316. doi: 10.7506/spkx1002-6630-20181012-102 [19] Vilar E G, O'Sullivan M G, Kerry J P, et al. Volatile compounds of six species of edible seaweed: A review[J]. Algal Research-Biomass Biofuels and Bioproducts,2020,45.
[20] Peinado I, Giron J, Koutsidis G, et al. Chemical composition, antioxidant activity and sensory evaluation of five different species of brown edible seaweeds[J]. Food Research International,2014,66:36−44.
[21] Mouritsen O G, Duelund L, Petersen M A, et al. Umami taste, free amino acid composition, and volatile compounds of brown seaweeds[J]. Journal of Applied Phycology,2019,31(2):1213−1232.
[22] Lopez-Perez O, Picon A, Nunez M. Volatile compounds and odour characteristics of seven species of dehydrated edible seaweeds[J]. Food Research International,2017,99:1002−1010.
[23] 曹荣, 刘楠, 王联珠, 等. 不同采收期坛紫菜的风味比较[J]. 上海海洋大学学报,2019,28(5):811−817. [24] Jelen H, Gracka A. Characterization of aroma compounds: Structure, physico-chemical and sensory properties[J]. Hoboken: John Wiley & Sons, Ltd,2016:126−153.
[25] Akakabe Y, Kajiwara T. Bioactive volatile compounds from marine algae: feeding attractants[J]. Journal of Applied Phycology,2008,20(5):661−664.
[26] Seo Y, Bae H, Eom S, et al. Removal of off-flavors from sea tangle (Laminaria japonica) extract by fermentation with Aspergillus oryzae[J]. Bioresource Technology,2012,121:475−479.
[27] Guichard E, Salles C. Retention and release of taste and aroma compounds from the food matrix during mastication and ingestion[J]. Flavor,2016:3−22.
[28] Giri A, Osako K, Ohshima T. Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J]. Food Chemistry,2010,120(2):621−631.
[29] Ganeko N, Shoda M, Hirohara I, et al. Analysis of volatile flavor compounds of sardine (Sardinops melanostica) by solid phase microextraction[J]. Journal of Food Science,2008,73(1):S83−S88.
[30] 葛含光, 温华蔚, 宋旭, 等. 离子迁移谱法检测蒸馏酒中4种风味成分[J]. 食品安全质量检测学报,2016,7(2):834−838. -
期刊类型引用(5)
1. 张根生,黄昕钰,李琪,李月明,韩冰,费英敏. 植物清蛋白的制备、功能特性及其在食品中的应用进展. 中国调味品. 2023(05): 202-207 .  百度学术
百度学术
2. 张宇涵,周靖萱,张南海,赵亮,张列兵,周峰. 胶原蛋白肽与弹性蛋白肽对改善皮肤光老化的研究进展. 食品研究与开发. 2023(11): 208-216 .  百度学术
百度学术
3. 王娟娟,刘勋,周学,罗欢,赵国建. 胶原蛋白的研究进展及其应用. 中国皮革. 2022(07): 1-7 .  百度学术
百度学术
4. 赵琼瑜,胡鉴,陈雨欣,李彩燕,宋伟. 中华鳖背甲脱钙工艺优化及其胶原蛋白结构表征. 食品与机械. 2022(10): 151-157+223 .  百度学术
百度学术
5. 赵琼瑜,胡鉴,李彩燕,徐树杰,宋伟. 超声波辅助鳖甲脱钙工艺优化及其对胶原蛋白生化特征的影响. 食品工业科技. 2022(22): 39-51 .  本站查看
本站查看
其他类型引用(6)





 下载:
下载:
 下载:
下载:



