Simultaneous Determination of Four Alkaloids in Betel Nut Seeds by Ultra Performance Liquid Chromatography-Triple Quadrupole Tandem Mass Spectrometry
-
摘要: 目的:采用超高效液相色谱-三重四极杆串联质谱(UPLC-MS/MS)建立槟榔籽中槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱含量的检测方法。方法:样品经45%乙醇水溶液提取,利用UPLC-MS/MS法进行检测。色谱条件:采用Waters Atlantis T3(2.1 mm×150 mm,5 μm)色谱柱分离,以0.1%甲酸水溶液-乙腈溶液为流动相进行梯度洗脱,流速0.5 mL·min−1,柱温40 ℃,进样量1 μL。质谱条件:采用电喷雾离子源(ESI+),检测方式多反应监测(MRM)模式扫描;外标法定量。结果:在50~500 ng/mL,槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱的质量浓度与峰面积都呈现良好的线性关系(R2>0.99);加样回收率均在规定范围70%~120%内,平均回收率在75.27%~96.70%,RSD<7.0%。结论:该方法的重复性、稳定性良好,仪器精密度较好。Abstract: Objective: A method was developed for the determination of arecoline, arecaidine, guvacoline and guvacine hydrochloride in areca nut seeds by ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS). Methods: The sample were extracted with 45% ethanol aqueous solution, and detected by UPLC-MS/MS method. Chromatographic conditions: Separated by Waters Atlantis T3 (2.1 mm×150 mm, 5 μm) column, eluted by gradient with 0.1% formic acid aqueous solution-acetonitrile solution as mobile phase, with flow rate of 0.5 mL·min−1, column temperature of 40 ℃, injection volume of 1 μL. Mass spectrometry conditions: Using electrospray ion source (ESI+), detection method multiple reaction monitoring (MRM) mode scanning, the quantitative analysis by external standard method. Results: In the range of 50~500 ng/mL, the mass concentration and peak area of arecoline, arecaidine, guvacoline and guvacine hydrochloride showed a good linear relationship (R2>0.99), and the sample recovery rates were all within the specified range of 70%~120%, the average recovery rate was 75.27%~96.70%, and the RSD was less than 7%. Conclusion: The method was good repeatability, stability, and instrument precision.
-
槟榔(Areca catechu L)是棕榈科植物槟榔的种子,位列中国四大南药之首。槟榔可作为鲜槟榔、干槟榔供人们食用[1],同时槟榔的药理价值也应用很广泛,具有降血压、促消化、抗过敏、抗氧化、抑菌、抗肿瘤等作用,对人体的消化系统、神经系统、心血管系统、内分泌系统均有一定影响。此外,槟榔也具有一定的毒性,如诱发口腔癌[2]。槟榔中含有许多化学成分,主要包括有生物碱类、酚酸类、氨基酸类、鞣质、黄酮类,还有花青素、皂苷等[3-5]。其中生物碱是槟榔中的主要活性成分,包括槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱、槟榔副碱和高槟榔碱等[6]。有研究表明槟榔籽中生物碱含量是槟榔壳中的两倍左右。不同产地槟榔咀嚼产品的生物碱含量存在显著差异[7]。
目前提取槟榔生物碱主要方法有加热回流提取法[8]、超声波提取法[9]、亚临界水提法[10-11]、超临界CO2流体萃取等[12];其生物碱含量的测定包括滴定法、分光光度法、薄层色谱扫描法(TCL)[13]、毛细管电泳法(CE)[14]、高效液相色谱法(HPLC)[15]、液相色谱-质谱联用法(LC-MS)[16]、超高效液相色谱飞行时间质谱仪(UPLC-Q-Tof-MS)等方法[17]。梁振纲利用高效液相色谱-串联质谱法测定食用槟榔中4种黄曲霉毒素的含量[18],结果表明4种黄曲霉素的质量浓度均在0.1~10.0 ug/L−1内和峰面积呈较好线性关系;Pan等[19]利用LC-MS/MS方法对大鼠血浆中碱及其它活性代谢产物测定含量;普义鑫[20]采用超高效液相色谱与质谱联用技术对槟榔中多酚化合物进行了结构鉴定,结果表明槟榔多酚中含有芦丁,绿原酸,没食子酸,表儿茶素等;李冰等[21]测定了血浆中氢溴酸槟榔碱的含量。Yu等[22]、Srimany等[23]采用ESI-MS及DESI-MS技术分别对槟榔不同成熟期槟榔种皮及种子部位生物碱含量变化进行了追踪,认为随着槟榔趋近成熟,种皮中4种生物碱的含量逐渐减小,至完全成熟时,种皮中仅含有槟榔次碱。这些研究均表明LC/MS技术在测定槟榔中化学成分具有较好的专属性和灵敏度。总体而言,利用超高效液相色谱-三重四极杆串联质谱法(UPLC-MS/MS)同时测定生物碱含量的相关报道很少,主要为滴定法或液相色谱分析,相较于这些传统的方法,串联质谱技术具有定性准确,抗干扰能力强,分离效果好,检测灵敏度高等优点。
本研究采用45%乙醇水提取,用UPLC-MS/MS进行分析,操作简捷,提取效率高,在5 min内即可完成槟榔籽中生物碱定性与定量检测。利用超高效液相色谱-三重四极杆串联质谱联用仪检测,建立了槟榔籽中4种生物碱含量的快速检测方法,为今后槟榔食用及药品中的安全性研究等提供参考。
1. 材料与方法
1.1 材料与仪器
鲜槟榔 市售;乙腈、甲醇、甲酸、乙酸乙酯 色谱纯;无水乙醇(分析纯);超纯水;槟榔碱对照品(HPLC≥98%)、槟榔次碱对照品(HPLC≥98%)、去甲槟榔碱对照品(HPLC≥98%)、去甲槟榔次碱对照品(HPLC≥95%) 上海源叶。
Triple Quad 6500+超高效液相色谱-三重四极杆串联质谱联用仪(UPLC-MS-MS) SCIEX 美国Waters;离心机 湖南凯达科学仪器有限公司;超声波清洗机 苏州迈弘电器有限公司。
1.2 实验方法
1.2.1 样品处理
取新鲜槟榔去皮,槟榔籽打浆,然后置冷冻干燥机冻干10 h,放置冰箱备用。称取槟榔籽冻干样品2.00 g至200 mL烧杯中,用45%乙醇水溶液提取,过滤,10000 r/min离心,5 min,将其上清液旋转蒸发至10 mL,用7:3甲醇水定容至50 mL,摇匀,过0.22 μm滤膜待上机。
1.2.2 色谱条件
色谱柱:Waters Atlantis T3(2.1 mm×150 mm,5 μm)流速:0.5 mL/min;柱温:40 ℃;进样量:1 μL;流动相A:0.1%甲酸水溶液;流动相B:乙腈;梯度洗脱程序:0~1 min,5% B;1~5 min,70% B;5~7 min,5% B。
1.2.3 质谱条件
离子化方式:电喷雾离子源(ESI);检测模式:多反应检测模式(MRM);扫描方式:正离子扫描(ESI+);气帘气(Curtain Gas):40 psi;碰撞气(Collision Gas)8 psi;离子喷雾电压(Ion Spray Vol-tage):5500 V;离子源温度(Temperature):550 ℃。优化后的化合物质谱参数见表1。
表 1 化合物质谱多反应监测参数Table 1. Monitoring parameters of multireaction spectra of compound mass编号 化合物 母离子(m/z) 子离子(m/z) 去簇电压(V) 碰撞能量(eV) 保留时间(min) 1 槟榔碱 156.20 113.00* 50 18.60 0.84 81.10 25.30 2 槟榔次碱 142.10 99.30* 28 19.00 0.75 53.00 36.50 3 去甲槟榔碱 142.10 113.10* 42 20.00 0.85 59.20 34.00 4 去甲槟榔次碱 128.10 53.20* 50 30.00 0.73 80.90 26.00 注:*为定量离子。 1.2.4 标准溶液配制
1.2.4.1 单个对照品溶液的配制
使用万分之一精密天平称取槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱对照品各5.00 mg,分别放置10 mL棕色容量瓶中,用纯甲醇溶解并稀释至刻度线,涡旋震荡摇匀。作为对照品储备液,置于0~4 ℃冷冻避光保存,备用。
1.2.4.2 混合对照品溶液的配制
精密吸取上述槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱对照品溶液各1.0 mL,置10 mL棕色容量瓶中,加甲醇溶解稀释至刻度线,即得4种生物碱混合对照品储备液,置于0~4 ℃冷冻避光保存,备用。
1.2.5 生物碱含量的计算
W(%)=c×D×Vm×100 式中:W表示生物碱含量,%;c表示混合标准品溶液质量浓度,mg/mL;D表示溶液稀释倍数;V表示供试品溶液体积,mL;m表示样品取样量,mg。
1.3 数据处理
采用Analyst Software软件进行采集数据;用SCIEX OS软件进行数据处理;采用Excel办公软件绘图分析。
2. 结果与分析
2.1 提取溶剂的选择
分别用三种不同溶剂(100%甲醇、水和乙醇)来提取槟榔籽中生物碱,每个水平平行3次,图1表明乙醇作为溶剂时提取含量最高,其次是水,提取含量最低的是甲醇,其中槟榔碱甲醇、水、乙醇提取含量的RSD分别为0.39%、0.52%、0.21%(n=3);槟榔次碱槟榔碱甲醇、水、乙醇提取含量的RSD分别为4.27%、2.87%、1.30%;去甲槟榔碱甲醇、水、乙醇提取含量的RSD分别为3.85%、2.15%、0.79%;去甲槟榔次碱甲醇、水、乙醇提取含量的RSD分别为3.28%、1.87%、1.08%。四种生物碱提取含量RSD结果均表明用乙醇作为提取溶剂的精密度和重复性较好,所以从该结果分析确定乙醇为槟榔籽中生物碱提取溶剂。
2.2 乙醇浓度的优化
称取冻干槟榔籽样品2.00 g,在固定的超声时间、功率条件下,用不同乙醇浓度来提取。图2可以看出,乙醇浓度在35%~95%之间四种生物碱的含量随着乙醇浓度的增加反而减小,当乙醇浓度为45%时提取生物碱的效果为最佳,其槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱含量的RSD(n=3)分别为1.54%、1.77%、3.36%、1.06%;乙醇浓度在55%以上时生物碱含量逐渐下降,但下降幅度不大,原因可能是高浓度的乙醇把其它脂溶性杂质成分提取出来,从而影响槟榔籽中生物碱的含量。
2.3 色谱条件的选择与优化
2.3.1 色谱柱的选择
分别选用不同类型的色谱柱Agilent Eclipse Plus C18(2.1 mm×50 mm,1.8 μm), Waters ACQUITY UPLC BEH HILIC(2.1 mm× 150 mm, 1.7 μm),Waters Atlantis T3(2.1 mm×150 mm, 5 μm),结果如图3所示。Waters Atlantis T3色谱柱对四种生物碱的分离效果较好,峰形对称尖锐。
2.3.2 流动相的选择
分别对甲醇−0.1%甲酸水、乙腈−0.1%氨水、乙腈−0.1%甲酸水作为流动相来考察对生物碱类化合物的响应分离效果,分析其结果如图4采用乙腈−0.1%甲酸水溶液作为流动相对生物碱分离效果优于其余三种。
2.4 质谱条件的优化
将4种生物碱标准品混合溶液以5.00 μL/min采用针泵流速连续注射,用正离子模式进行一级质谱扫描,确定该化合物母离子,然后再对母离子设置碰撞能量,在一定的条件下产生特定的子离子,在确定母离子的基础上选择两个以上的子离子,通过打碎该分子离子峰进行二级质谱扫描(子离子扫描),采集全扫描的二级质谱图,得到碎片离子信息,碰撞能量、去簇电压等参数进行优化,最后对其化合物分别选择相对丰度较高的一个离子作为定量离子,一个为定性离子。按照二级质谱图提供的碎片离子信息,选择每种化合物的定性和定量离子对,得到对照品和样品总离子谱图(TIC)见图5,提取离子谱图(XIC)如图6所示。
槟榔次碱和去甲槟榔碱的分子式完全相同,均是C7H11NO2,两者结构上存在差异在优化槟榔次碱、去甲槟榔碱质谱参数时,两种化合物的母离子质荷比均为142.1。槟榔次碱的二级碎片离子有53.0,71.1,81.1,99.3;去甲槟榔碱二级碎片离子有53.0,59.2,81.1,113.1;两种化合物有共同的碎片(m/z 53.0,81.1),为了避免互相干扰,再选择合适的色谱柱(Waters Atlantis T3)使二者在不同时间洗脱的基础上,进一步选择不同的子离子(表1),结果两种化合物得到了很好的分离且目标峰附近无干扰峰。去甲槟榔碱子离子选择113.1,59.2;槟榔次碱子离子选择99.3,53.0,前者作为定量离子,后者为定性离子,从图6中可以看出槟榔次碱和去甲槟榔碱两种化合物的峰形尖锐,保留时间分开,同时也能满足检测要求。
2.5 线性关系考察
精密吸取混合对照品溶液置10 mL容量瓶中,加入7:3甲醇水稀释定容至刻度线,混匀,制成4种生物碱含量为50~500 ng/mL的混合对照品溶液,进样分析。以浓度为横坐标,响应峰面积为纵坐标,绘制标准曲线,求得线性回归方程,见表2。结果表明4种生物碱在线性范围内线性关系较好(R2>0.99)。再将4种生物碱混合对照品溶液稀释,进行上机测定,以3倍的信噪比(S/N=3)为检出限,10倍的信噪比(S/N=10)为定量限,结果表明4种生物碱的检出限均为0.40 μg/kg,定量限均为1.50 μg/kg。
表 2 4种生物碱的线性回归方程、相关系数、样品含量、检出限和定量限(n=6)Table 2. Linear regression equation, correlation coefficient, detection limit and quantification limit of 4 alkaloids (n=6)化合物 线性范围(ng/mL) 线性回归方程 决定系数(R2) 实际样品含量(g/kg) 检出限(μg/kg) 定量限(μg/kg) SAM UIQI ERGAS CC EN STD STD 槟榔碱 50~500 y=1750.6x+3.2e4 0.99861 16.00 0.40 1.50 槟榔次碱 50~500 y=438.5x+16402.9 0.99905 9.40 0.40 1.50 去甲槟榔碱 50~500 y=1081.3x+6.6e4 0.99666 5.40 0.40 1.50 去甲槟榔次碱 50~500 y=117.4x+48.85 0.99432 5.20 0.40 1.50 2.6 方法学考察结果
2.6.1 精密度测定结果
精密吸取混合对照品溶液1.00 mL,连续进样6次,测定峰面积,槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱4种生物碱峰面积的相对标准偏差(RSD,n=6)分别为2.18%、3.52%、1.49%和3.72%,表明该方法的仪器精密度良好。
2.6.2 重复性测定结果
精密称取2.00 g槟榔样品6份,按照1.2.1项下方法进行提取,作为供试品溶液备用,按1.2项条件下色谱、质谱参数进行上机测定,计算各个化合物的RSD。结果槟榔样品中槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱4种生物碱峰面积的RSD分别为1.76%、2.95%、1.40%和3.08%(n=6),表明该方法的重复性较好。
2.6.3 稳定性测定结果
取同一瓶供试品溶液,于0、4、8、12、16、20、24 h按1.2项条件下色谱、质谱条件进行上机测定。结果槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱4种生物碱峰面积的RSD(n=6)分别为3.02%、2.62%、2.11%和1.99%。表明该方法的样品溶液在24 h内稳定性良好。
2.6.4 加标回收率测定结果
称取槟榔样品9份,加标水平分别为0.05、0.10、0.20 g/kg,每个加标水平做3个平行,按照1.2.1项下方法进行提取,制备,按1.2项条件下色谱、质谱参数进行上机测定,计算各个化合物的平均加标回收率(n=3)及RSD,结果见表3,4种生物碱在0.05、0.10和0.20 g/kg,3个水平下的平均加标回收率为75.27%~96.70%,RSD<7%。
表 3 4种生物碱的加标回收率及其相对标准偏差(n=3)Table 3. Recoveries of four alkaloids and their relative standard deviations (n=3)化合物 平均回收率(相对标准偏差RSD,%) 0.05 g/kg 0.10 g/kg 0.20 g/kg 槟榔碱 95.70±4.05 92.28±2.30 81.71±1.93 槟榔次碱 96.70±1.88 88.98±6.38 88.02±3.13 去甲槟榔碱 90.60±6.08 91.53±6.67 81.43±1.86 去甲槟榔次碱 80.20±1.09 75.27±4.05 76.01±4.85 2.7 样品含量测定结果
将3批槟榔样品按“1.2.1”项下方法制备供试品溶液,并按“1.2.2、1.2.3”项下色谱、质谱条件进行测定,得到槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱的峰面积值,计算4种生物碱含量,结果显示(见表2)3批槟榔样品的槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱平均含量为16.00、9.40、5.40、5.20 g/kg,2015年新版中国药典对槟榔中槟榔碱含量的要求为不少于0.20%,该实验结果槟榔碱的含量高于0.20%,符合药典要求。药典法其提取溶剂用的乙醚,毒性较大,过程也较为复杂[24];与药典相比,本实验操作简单,而且可以同时提取出槟榔次碱、去甲槟榔碱、去甲槟榔次碱。
3. 讨论与结论
本实验在前期样品处理过程中采用的提取方法是超声波提取,考察超声时间对四种生物碱含量提取率的影响,但从实验结果得出在不超声的情况下槟榔生物碱含量的提取率相对较高,随着超声时间的增加,提取生物碱的含量相对降低。原因可能是超声会导致温度升高,而槟榔碱类成分对高温敏感,当温度高于60 ℃提取槟榔生物碱可能会挥发损失[25]。所以综合考虑,高效、快速提取4种生物碱较高含量可以选择不超声。
近年来,液质联用技术在天然药物中活性成分快速分离和鉴定应用广泛[26-27]。目前槟榔中生物碱主要成分的含量测定大多部分是使用的高效液相色谱仪(HPLC),但也存在灵敏度低、分析时间长等问题[28-30]。而UPLC-MS/MS在分析技术上近年来使用的较多,其具有灵敏度高,分离效果较好,节省时间等优点。本实验首次建立了超高效液相色谱-串联质谱法同时测定槟榔籽中4种生物碱含量的分析测定方法,通过对色谱、质谱条件的优化以及色谱柱、流动相的选择,最终确定了合适的提取槟榔中生物碱的分离方法,样品经45%乙醇水溶液提取,利用UPLC-MS/MS法进行检测,采用Waters Atlantis T3(2.1×150 mm,5 μm)色谱柱分离,以0.1%甲酸水溶液-乙腈溶液为流动相进行梯度洗脱,采用电喷雾离子源(ESI+),多反应监测(MRM)模式扫描,外标法定量。在50~500 ng/mL,槟榔碱、槟榔次碱、去甲槟榔碱和去甲槟榔次碱的质量浓度与峰面积都呈现良好的线性关系(R2>0.99);加样回收率均在规定范围内,平均回收率在75.27%~96.70%,RSD<7%。该方法操作简单、可行性较好,灵敏度高,能有效的测定槟榔籽中4种生物碱的含量,为槟榔中生物碱类化合物的检测提供依据,同时也对研究槟榔的食用和药品中的安全性研究等提供参考。
-
表 1 化合物质谱多反应监测参数
Table 1 Monitoring parameters of multireaction spectra of compound mass
编号 化合物 母离子(m/z) 子离子(m/z) 去簇电压(V) 碰撞能量(eV) 保留时间(min) 1 槟榔碱 156.20 113.00* 50 18.60 0.84 81.10 25.30 2 槟榔次碱 142.10 99.30* 28 19.00 0.75 53.00 36.50 3 去甲槟榔碱 142.10 113.10* 42 20.00 0.85 59.20 34.00 4 去甲槟榔次碱 128.10 53.20* 50 30.00 0.73 80.90 26.00 注:*为定量离子。 表 2 4种生物碱的线性回归方程、相关系数、样品含量、检出限和定量限(n=6)
Table 2 Linear regression equation, correlation coefficient, detection limit and quantification limit of 4 alkaloids (n=6)
化合物 线性范围(ng/mL) 线性回归方程 决定系数(R2) 实际样品含量(g/kg) 检出限(μg/kg) 定量限(μg/kg) SAM UIQI ERGAS CC EN STD STD 槟榔碱 50~500 y=1750.6x+3.2e4 0.99861 16.00 0.40 1.50 槟榔次碱 50~500 y=438.5x+16402.9 0.99905 9.40 0.40 1.50 去甲槟榔碱 50~500 y=1081.3x+6.6e4 0.99666 5.40 0.40 1.50 去甲槟榔次碱 50~500 y=117.4x+48.85 0.99432 5.20 0.40 1.50 表 3 4种生物碱的加标回收率及其相对标准偏差(n=3)
Table 3 Recoveries of four alkaloids and their relative standard deviations (n=3)
化合物 平均回收率(相对标准偏差RSD,%) 0.05 g/kg 0.10 g/kg 0.20 g/kg 槟榔碱 95.70±4.05 92.28±2.30 81.71±1.93 槟榔次碱 96.70±1.88 88.98±6.38 88.02±3.13 去甲槟榔碱 90.60±6.08 91.53±6.67 81.43±1.86 去甲槟榔次碱 80.20±1.09 75.27±4.05 76.01±4.85 -
[1] 贾哲, 韩婷, 刘欢, 等. 基于多元统计分析的食用槟榔及药用槟榔主要化学成分的含量对比研究[J]. 中华中医药杂志,2017,32(11):5158−5161. [2] 孔丹丹, 李歆悦, 赵祥升, 等. 药食两用槟榔的国内外研究进展[J]. 中国中药杂志,2021,46(5):1053−1059. [3] 张丹, 李丹, 许启泰, 等. 槟榔提取物不同部位的抗氧化性比较及成分研究[J]. 食品工业科技,2015,36(2):102−104. [4] Chavan Y V, Singhal R S. Separation of polyphenols and arecoline from areca nut (Areca catechu L.) by solvent extraction, its antioxidant activity, and identification of polyphenols. Journal of the Science of Food and Agriculture, 2013, 93(10): 2580-2589.
[5] Tang S N, Zhang J, Liu D. et al. et al. Three new areca alkaloids from the nuts of areca catechu[J]. Journal of Asian Natural Products Research,2017,19(12):1155−1159. doi: 10.1080/10286020.2017.1307187
[6] 姚力. 对槟榔原籽果壳、果核槟榔碱含量进行测定[J]. 中小企业管理与科技(中旬刊),2014(7):308−309. [7] Meng R C, Ying K L, Han W Y, et al. Hplc-based qualitative and quantitative analyses of alkaloids in chewable areca products from different geographic regions[J]. Journal of AOAC International,2020(5):1−21.
[8] 罗士数, 张海德, 朱莉, 等. 槟榔中槟榔碱的乙醇回流提取工艺研究[J]. 食品科学,2010,31(20):106−110. [9] 唐敏敏, 陈华, 李瑞. 响应面法优化超声波提取槟榔多糖工艺及其抗炎活性[J]. 安徽农学通报,2019,25(9):21−24, 74. doi: 10.3969/j.issn.1007-7731.2019.09.009 [10] 聂安政, 高梅梅, 钞艳慧, 等. 槟榔药理毒理探讨与合理用药思考[J]. 中草药,2020,51(12):3329−3336. doi: 10.7501/j.issn.0253-2670.2020.12.027 [11] 康丽如, 符素芳, 曾广琳, 等. 响应面法优化亚临界水提取槟榔籽中槟榔碱的工艺研究[J]. 食品安全质量检测学报,2016,7(9):3773−3780. [12] 韩志萍, 黄茂芳, 朱德明, 等. 超临界CO2萃取槟榔碱工艺研究[J]. 食品科技,2009,34(10):187−190. [13] 易攀, 汤嫣然, 周芳, 等. 槟榔的化学成分和药理活性研究进展[J]. 中草药,2019,50(10):2498−2504. doi: 10.7501/j.issn.0253-2670.2019.10.034 [14] 杨雅蛟, 孔维军, 孙兰, 等. 槟榔化学成分和药理作用及临床应用研究进展[J]. 世界科学技术: 中医药现代化,2019(12):2583−2591. [15] 潘虹. 槟榔碱提取及分析方法研究进展[J]. 亚太传统医药,2019,15(4):188−191. [16] 梁振纲, 徐志伟, 孟茹, 等. 高效液相色谱-串联质谱法测定食用槟榔中4种黄曲霉毒素的含量[J]. 理化检验(化学分册),2018,54(10):1153−1157. [17] Jain V, Garg A, Parascandola M, et al. Analysis of alkaloids in areca nut-containing products by liquid chromatography-tandem mass-spectrometry[J]. Journal of the Agricultural and Food Chemistry,2017,65(9):1977−1983. doi: 10.1021/acs.jafc.6b05140
[18] Gheddar L, Ricaut F X, Ameline A, et al. Testing for betel nut alkaloids in hair of papuans abusers using UPLC-MS/MS and UPLC-Q-Tof-MS[J]. Journal of Analytical Toxicology,2019,44(1):41−48.
[19] Pan H, Li Y, Huang L, et al. Development and validation of a rapid LC-MS/MS method for simultaneous quantification of arecoline and its two active metabolites in rat plasma and its application to a pharmacokinetic study[J]. Journal of Pharmaceutical and Biomedical Analysis,2018,154:397−403. doi: 10.1016/j.jpba.2018.03.033
[20] 普义鑫. 槟榔多酚提取、纯化及组分分析[D]. 长沙: 中南林业科技大学, 2012. [21] 李冰, 周绪正, 杨亚军, 等. 高效液相色谱-串联质谱法测定血浆中氢溴酸槟榔碱的含量[C]//甘青宁色谱协作中心、甘肃省化学会色谱委员会: 甘肃省化学会, 2012: 287-290. [22] Yu H, Tang L, Wu H, et al. Determination of contents of four alkaloids inPericarpium arecae by quantitative analysis of multi-components by single-marker[J]. Pakistan Journal of Pharmaceutical Ences,2016,29(4):1269.
[23] Srimany A, George C, Naik H R, et al. Developmental patterning and segregation of alkaloids in areca nut (seed ofAreca catechu) revealed by magnetic resonance and mass spectrometry imaging[J]. Phytochemistry,2016,125:34−42.
[24] 国家药典委员会. 中华人民共和国药典[M]. 1版. 北京: 化学工业出版社, 2015: 365. [25] 高晓婷. 槟榔生物碱的分离纯化及其热处理工艺参数的优化设计[D]. 长沙: 湖南农业大学, 2016. [26] 屈文佳, 贾哲, 辛洁萍, 等. 高效液相色谱法同时测定槟榔中4种生物碱的含量[J]. 中南药学,2020,18(3):485−488. doi: 10.7539/j.issn.1672-2981.2020.03.030 [27] 李春燕, 张学敏, 岳璐, 等. HPLC法测定槟榔中槟榔碱和槟榔次碱的含量[J]. 中医药学报,2018,46(3):21−23. [28] 汤丽娟, 吴皓, 郁红礼. HPLC同时测定大腹皮中4种生物碱含量[J]. 中华中医药杂志,2014,29(11):3583−3586. [29] 毛春芹, 陆兔林, 季德, 等. 高效液相色谱法测定不同产地大腹皮中槟榔碱的含量[J]. 中国药学杂志,2013,48(11):909−911. [30] 张卫东, 戴国梁, 白永涛, 等. HPLC法同时测定四磨汤口服液中5种成分[J]. 中成药,2018,40(1):120−123. -
期刊类型引用(11)
1. 苏敏,李红丽,白亚敏,黄大亮,刘元,吴彦蕾. 基于液相色谱-串联高分辨质谱技术的食品中污染物检测技术研究进展. 食品安全质量检测学报. 2025(04): 44-52 .  百度学术
百度学术
2. 张君. 我国南方部分地区蓝莓种植过程中农药残留检测结果分析. 河北农机. 2024(03): 136-138 .  百度学术
百度学术
3. 张申平,秦宇,顾颖娟. QuEChERS-超高效液相色谱-四极杆/静电场轨道阱质谱法测定牛羊乳及其乳粉中21种兽药. 乳业科学与技术. 2024(02): 24-29 .  百度学术
百度学术
4. 李红洲,国果,李博岩,梁桂娟,李志远. 超高效液相色谱-四极杆-飞行时间-高分辨质谱法分析6种李果实中的代谢物差异性. 食品安全质量检测学报. 2024(11): 63-73 .  百度学术
百度学术
5. 刘宇航,于寒冰,杨红菊,马啸,温雅君,孙志伟,习佳林,熊慧勤,肖志勇. 高效液相色谱-四极杆-飞行时间质谱法快速筛查蔬菜中124种药物与个人护理品残留量. 食品安全质量检测学报. 2024(16): 175-184 .  百度学术
百度学术
6. 朱春雨,吴移山,郑景娇. 高效液相色谱-串联质谱法测定鸡蛋中地克珠利、妥曲珠利及其代谢物残留量. 食品安全质量检测学报. 2024(16): 211-218 .  百度学术
百度学术
7. 肖泳,曾小明,李政,袁列江,邓航,王淑霞,潘照. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定鸡蛋中94种农药残留. 食品与发酵工业. 2024(21): 333-340 .  百度学术
百度学术
8. 王颖怡,吴玉田,孟春杨,周贻兵,刘利亚. HPLC-MS/MS技术同时测定鸡蛋中5种抗球虫药. 食品工业. 2023(06): 291-294 .  百度学术
百度学术
9. 李晓慧,李建洪,王洪萍,金芬. 植物源性食品中化学性危害物质的色谱-质谱检测技术研究进展. 分析测试学报. 2023(10): 1357-1369 .  百度学术
百度学术
10. 周雪莼,胡婷婷,王佳慧,白静,杨颖,侯宇,张哲,张勋. 高效液相色谱-高分辨质谱法快速筛查动物源性药食同源产品中32种抗生素兽药残留. 吉林中医药. 2023(12): 1469-1474 .  百度学术
百度学术
11. 范轶欧,迟英欣,杨路平,焦燕妮. 高分辨质谱技术在环境和食品风险物质非靶向筛查检测中应用的研究进展. 预防医学论坛. 2023(12): 955-960 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
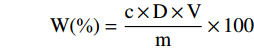






 下载:
下载:



