Identification and Enzymatic Properties of Chitosanase Producing Marine Paenibacillus chitinolyticus Strain CLT08
-
摘要: 目前用于制备壳寡糖的壳聚糖酶具有酶活性较低、酸稳定性较差等问题。本研究从连云港海州湾泥样中筛选产壳聚糖酶菌株,并对菌株进行鉴定、酸稳定性和酶学性质研究。结果表明,通过平板透明圈初筛和摇瓶发酵复筛,获得酸稳定性较好的壳聚糖酶产生菌株CLT08,随后利用形态学特征、生理生化测定及16S rDNA序列扩增与分析,鉴定菌CLT08为Paenibacillus chitinolyticus。菌株CLT08产壳聚糖酶最适温度为45 ℃,最适pH为4.0;Zn2+对酶有显著的激活作用,对Ba2+、Co2+、Fe2+有显著抑制作用。壳聚糖经CLT08壳聚糖酶水解后其聚合度≥6。此研究结果为该酶的进一步研究奠定了基础。
-
关键词:
- 壳聚糖酶 /
- Paenibacillus chitinolyticus CLT08 /
- 筛选 /
- 鉴定 /
- 酶学性质
Abstract: At present, chitosanase used to prepare chito-oligosaccharides has the disadvantage of low enzyme activity and poor acid stability. In this study, chitosanase-producing strain was screened from mud samples from Lianyungang Haizhou Bay, the highest chitosanase-producing strain was identified, and the acid stability and enzyme properties of the strain were studied. The screening was carried out by using the transparent zone method, and shaking flask fermentation. The chitosanase producing strain CLT08 was obtained. Then, the strain CLT08 was identified as Paenibacillus chitinolyticus with morphological characteristics, physiological and biochemical determination and 16S rDNA sequence amplification and analysis. The optimum temperature and pH for chitosanase production of strain CLT08 were 45 ℃ and pH4.0; Zn2+ had a significant activation effect on the enzyme, and Ba2+, Co2+, Fe2+ had significant effects inhibition. The degree of polymerization of chitosan was≥6 after being hydrolyzed by CLT08 chitosanase. The results of this study laid the foundation for further research on the enzyme.-
Keywords:
- chitosanase /
- Paenibacillus chitinolyticus CLT08 /
- screening /
- identification /
- enzymatic properties
-
壳聚糖是仅次于纤维素的第二大天然多糖,具有抗肿瘤和抗氧化等多种活性[1]。但由于分子量大不溶于水,使其应用受到限制[2]。而壳聚糖的衍生物—壳寡糖,其由2~20个氨基葡萄糖通过β-1,4糖苷键连接而成,分子量低于5 kDa,并且易溶于水,具有提高人体免疫力、抗肿瘤等生理活性[3],而被广泛应用于生物医药、种植业以及食品添加剂等方面。
目前,壳寡糖的制备方法有化学法、物理法、酶解法[4]。其中,化学法价格低廉,但对环境污染严重[5];物理法虽然污染性相对较小,但缺点是副反应较多[6];酶降解法污染小、反应温和,产物相对分子量容易控制,是工业制备壳寡糖最具有前景的方法[7]。壳聚糖酶是催化壳聚糖生成壳寡糖或氨基葡萄糖的专一性酶,根据其在底物上的切割位点不同分为内切酶和外切酶[8]。自然界中壳聚糖酶的存在非常广泛,许多微生物都可以产生壳聚糖酶[9]。其中主要存在于真菌和细菌中,少数来自于植物组织和病毒中[10]。目前,根据已研究发现结果,壳聚糖酶被分为7个糖基水解酶家族,其中GH46、GH75和GH80家族仅含有壳聚糖酶,而其他GH3、GH5、GH7和GH8等4个家族含有壳聚糖酶以及具有其他底物特异性的酶,例如纤维素酶和木聚糖酶[11]。近年来关于壳聚糖酶菌株的报道有很多,但现阶段获得的壳聚糖酶菌株存在产酶水平低、稳定性差等问题,适用于工业生产要求的菌株很少,无法满足生产需要[12]。如何获得产酶水平高、稳定性强、酶活性高的壳聚糖酶菌株是迄今为止仍待解决的问题。
壳聚糖酶催化壳聚糖水解是在pH3.0的条件下,目前,壳聚糖酶在此条件下半衰期较短成为制约酶法制备壳寡糖的瓶颈[13]。由于海洋环境的特殊性,以及其环境生长下的微生物与陆地上的生物有着很大的不同[14]。因此,本研究从海泥样品中筛选酸稳定性壳聚糖酶,对壳聚糖酶产生菌进行鉴定,并对壳聚糖酶的酶学性质进行研究,为酸稳定性壳聚糖酶制剂的开发奠定基础。
1. 材料与方法
1.1 材料与仪器
粉末壳聚糖(DD≥90%,水中溶解度≤10%),几丁质、琼脂粉、酵母提取物、蛋白胨、葡萄糖、NaCl、(NH4)2SO4、K2HPO4·3H2O、KH2PO4、MgSO4·7H2O(化学纯) 国药集团;可溶性壳聚糖(DD≥85%,水中溶解度≥95%) 青岛弘海生物技术有限公司;本实验中所用的海泥样品 均来自于连云港海州湾地区。
YXQ-LS-50SII高压蒸汽灭菌锅 上海博迅实业公司设备厂;Avanti J25/26/XP高速冷冻离心机 美国贝克曼库尔特有限公司;I Mark酶标仪 美国BIO-RAD公司;SW-CJ-1FD净化工作台 上海谱振生物科技有限公司;SHP-150生化微生物恒温培养箱 上海培因实验仪器制造有限公司;QHZ-123B振动培养箱 江苏盛蓝仪器制造公司。
1.2 实验方法
1.2.1 培养基配制
富集培养基(质量分数%):可溶性壳聚糖0.50%、KH2PO4 0.10%、K2HPO4·3H2O 0.20%、MgSO4·7H2O 0.07%、NaCl 0.10%、酵母提取物 0.05%,pH 5.0。
筛菌培养基(质量分数%):可溶性壳聚糖0.50%、KH2PO4 0.10%、K2HPO4·3H2O 0.20%、MgSO4·7H2O 0.07%、NaCl 0.10%、(NH4)2SO4 0.50%、琼脂粉2.0%,pH 5.0。
LB培养基(质量分数%):酵母提取物 0.5%、蛋白胨 1.0%、NaCl 1.0%、琼脂粉 2.0%。
种子培养基(质量分数%):酵母提取物0.3%、蛋白胨0.5%、葡萄糖0.3%、(NH4)2SO4 0.5%、 K2HPO4·3H2O 0.07%、KH2PO4 0.03%、NaCl 0.5%、MgSO4·7H2O 0.05%,pH 5.0。
发酵培养基(质量分数%):可溶性壳聚糖1.0%、(NH4)2SO4 1.0%、K2HPO4·3H2O 0.14%、NaCl 0.5%、MgSO4·7H2O 0.13%、KH2PO4 0.03%、酵母提取物0.3%,pH 5.0。
1.2.2 产壳聚糖酶菌株的筛选
称取1 g海泥样品于50 mL富集培养基中,于30 ℃、160 r/min培养7 d。梯度稀释后涂于筛选培养基,30 ℃培养7 d,观察菌落生长和透明圈产生情况。挑取形成透明圈菌株在LB培养基中三区划线纯化至单菌,点种至筛选平板,倒置培养。挑取产透明圈的单菌落接种至种子培养基摇瓶发酵复筛,于30 ℃、160 r/min培养1 d。以体积分数2%的接种量接种发酵培养基,30 ℃、160 r/min培养4 d,发酵液于8000×g离心10 min,上清液作为粗酶液,测定粗酶液酶活。
1.2.3 产壳聚糖酶CLT08菌株的鉴定
首先对菌株CLT08进行形态学观察和生理生化鉴定。再用灭菌的牙签挑取单菌落到加入20 µL裂解液的PCR管中,80 ℃裂解15 min后作为模板。采用通用引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492R:5’-TACGGCTACCTTGTTACGACTT-3’进行扩增,PCR反应体系(50 µL):PCR Premix Taq(25 µL),上下游引物(各1 µL),DNA模板(1 µL),ddH2O补足50 µL体系。PCR扩增过程:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,进行35个循环;72 ℃终延伸7 min。扩增产物送至擎科生物科技有限公司测序。测序结果提交NCBI的GenBank并对比序列的同源性,用MEGA 7.0软件进行16S rDNA序列对比分析,并构建系统发育树。
1.2.4 菌株CLT08酶活力测定
根据张凯琪[15]的酶活测定方法,采用DNS(3,5-二硝基水杨酸)法测定酶活。分别取粗酶液0.5 mL于离心管中,作为空白组和实验组。空白组沸水浴灭活10 min,加入0.5 mL质量分数3%的胶体壳聚糖,实验组则直接加入0.5 mL质量分数3%的胶体壳聚糖,将两组同时置于50 ℃的水浴锅中反应30 min后取出,沸水浴灭活10 min,8000 r/min离心10 min。取两组样液各1 mL于试管中,分别加入DNS试剂2 mL,沸水浴中准确煮沸5 min,流水冲洗或室温冷却加入9 mL的蒸馏水,测定其在540 nm处的吸光值,做平行实验三组取平均值,使其标准误差控制在5.0%以内。规定在上述条件下1 min产生1 µmol还原糖所需酶量为一个酶活力单位。
1.2.5 菌株CLT08壳聚糖酶酶学性质研究
1.2.5.1 温度对菌株CLT08壳聚糖酶酶活性和稳定性的影响
选取20、25、30、35、40、45和50 ℃作为反应温度,并固定在pH为7,以及粗酶液和质量分数1%的胶体壳聚糖按体积比1:1的比例中进行反应20 min,测定酶活力。在上述条件下孵育2 h,测定相对酶活,以最高酶活为100%。
1.2.5.2 pH对菌株CLT08壳聚糖酶酶活性和稳定性的影响
用缓冲液配制质量分数1%的胶体壳聚糖溶液,将其pH分别调至3.0、4.0、5.0、6.0、7.0、8.0和9.0,与粗酶液按体积比1:1的比例混合测定酶活力。在上述pH下孵育2 h,测定相对酶活,以最高酶活为100%。
1.2.5.3 金属离子对菌株CLT08壳聚糖酶酶活性的影响
分别选取Ba2+、Mn2+、Co2+、Ni2+、Na+、Mg2+、K+、Fe2+、Ca2+、Cu2+和Zn2+配制成20 mmol/L溶液,按体积比1:1的比例加入粗酶液,加入质量分数1%胶体壳聚糖,使其金属离子的终浓度达到1 mmol/L,室温放置20 min,测定反应体系的酶活力。
1.2.5.4 酶底物特异性
配制量分数1%的胶体壳聚糖、可溶性壳聚糖、粉末壳聚糖、几丁质、葡聚糖作为底物,按体积比1:1的比例加入底物和粗酶液,测定酶的底物特异性。
1.2.5.5 菌株CLT08壳聚糖酶酸水解壳聚糖过程测定
在预实验中已知其在酸性条件下具有较强的水解活性,现对其中活性最好的酸性环境做具体研究。分别取粗酶液5 mL于烧杯中,作为空白组和实验组。空白组粗酶液沸水浴灭活10 min,加入质量分数10%胶体壳聚糖(pH≤3.0)25 mL,实验组则直接加入质量分数10%胶体壳聚糖(pH≤3.0)25 mL,将两组同时置于45 ℃、160 r/min进行反应,直至完全水解。
1.2.5.6 菌株CLT08壳聚糖酶水解壳聚糖产物测定
分别取0.01 g粉末壳聚糖于离心管。对照组加入1 mL的去离子水,实验组加入0.5 mL的粗酶液,置于50 ℃的水浴锅中反应时间分别为15 min、1 h、4 h、8 h。反应完毕后,沸水浴10 min,8000×g离心10 min。取展层剂(正丁醇:乙醇:去离子水=5:2:3)在展开温度为常温下进行实验,将对照组和各实验组用移液枪点样于做好标记的层析板上,点好样品的铝箔板置于放有展层剂的层析缸中,展层剂深度为0.8 cm左右,当展层剂到铝箔板上端约2 cm时,冷风吹干。在通风条件下将显色液(二苯胺1 g、苯胺1 mL、丙酮50 mL、磷酸5 mL)均匀的洒在层析板上显色,85 ℃,10 min,直到颜色清晰为止,并记录结果。
1.3 数据处理
实验数据用IBM SPSS Statistics 2.0进行数据分析,数据均为3次平行。
2. 结果与分析
2.1 产壳聚糖酶菌株的筛选
通过透明圈初筛和摇瓶发酵复筛,获得5株菌株。比较发现:菌株CLT08是其中产壳聚糖酶活性最高的菌株,且在pH3.0孵育2 h后,其相对酶活高于另外4株菌株(表1)。因此从5株菌中选取菌株CLT08进行后续研究。并按照DNS试剂盒中的标曲绘制方法,得到葡萄糖标准曲线线性方程为:y=0.4306x+0.0071,R2为0.999,测定菌株CLT08酶液的酶活力为3.17 U/mL。
表 1 菌落及透明圈直径Table 1. Diameter of colonies and transparent circles菌株 菌落直径(mm) 透明圈直径(mm) 透明圈直径/菌落直径 酶活(U/mL) pH3.0孵育2 h后相对酶活(%) CLT03 5.12±0.24 9.34±0.43 1.8±0.2 1.18±0.01 88.73±4.32 CLT07 5.10±0.31 10.0±0.44 1.9±0.3 1.13±0.04 80.42±5.22 CLT08 4.24±0.14 8.48±0.23 2.0±0.1 3.17±0.04 95.56±5.16 CLT11 4.10±0.22 6.15±0.48 1.5±0.2 0.13±0.03 58.13±4.58 CLT12 4.56±0.23 6.43±0.31 1.4±0.1 0.07±0.01 61.22±4.76 2.2 菌株CLT08菌的鉴定
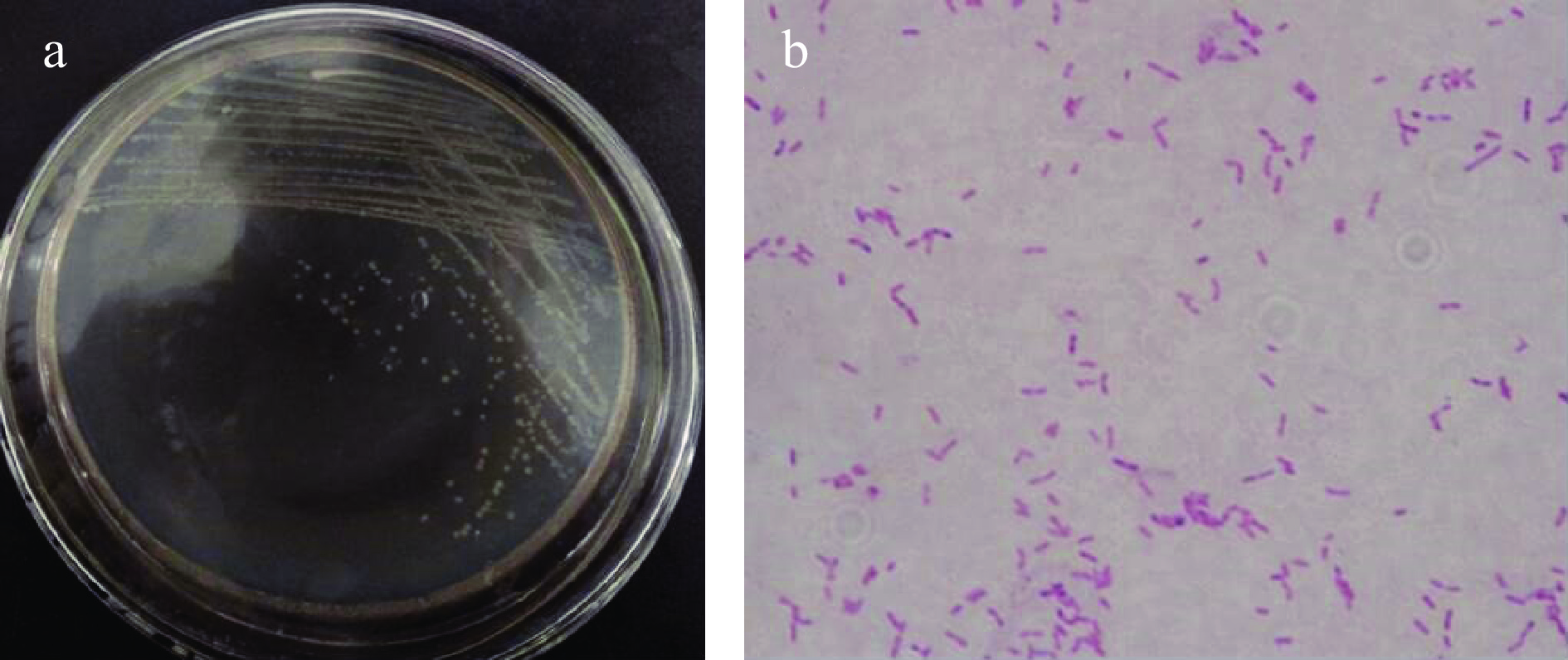
将菌株CLT08在30 ℃培养48 h后,观察发现其菌落形态呈圆形,中央扁平,表面光滑,颜色为不透明的乳白色,边缘规则无晕环,易挑起,直径为0.1~0.15 cm。革兰氏染色结果为阳性芽孢杆菌(图1)。
对菌株CLT08进行形态学观察和生理生化鉴定。由表2可知,菌株CLT08山梨醇、H2O2实验、麦芽糖、柠檬酸盐实验呈阳性,明胶液化实验、吲哚实验,葡萄糖、甘露醇、蔗糖、乳糖实验为阴性。
表 2 生理生化实验结果Table 2. Physiological and biochemical experimental results检测项目 特征 H2O2实验 + 明胶液化实验 − 吲哚实验 − 葡萄糖 − 山梨醇 + 甘露醇 − 麦芽糖 + 蔗糖 − 乳糖 − 柠檬酸盐 + 注:“+”表示反应呈阳性;“−”表示反应呈阴性。 菌株CLT08的16S rDNA扩增产物测序拼接后获得了1450 bp的序列,提交到GenBank,(登录号:MW478752),比对其同源性,发现与菌株Paenibacillus chitinolyticus 16S rDNA相似性最高,达到100%。用MEGA7.0软件进行16S rDNA序列的对比分析,并构建系统发育树,菌株CLT08与Paenibacillus chitinolyticus亲缘关系最近(见图2)。综合形态学、生理生化及16S rDNA序列分析,将菌株鉴定为Paenibacillus chitinolyticus。目前,报道Paenibacillus chitinolyticus水解几丁质报道较多,尚无该菌水解壳聚糖的报道[16]。
2.3 菌株CLT08壳聚糖酶酶学性质
2.3.1 温度对菌株CLT08壳聚糖酶酶活性和稳定性的影响
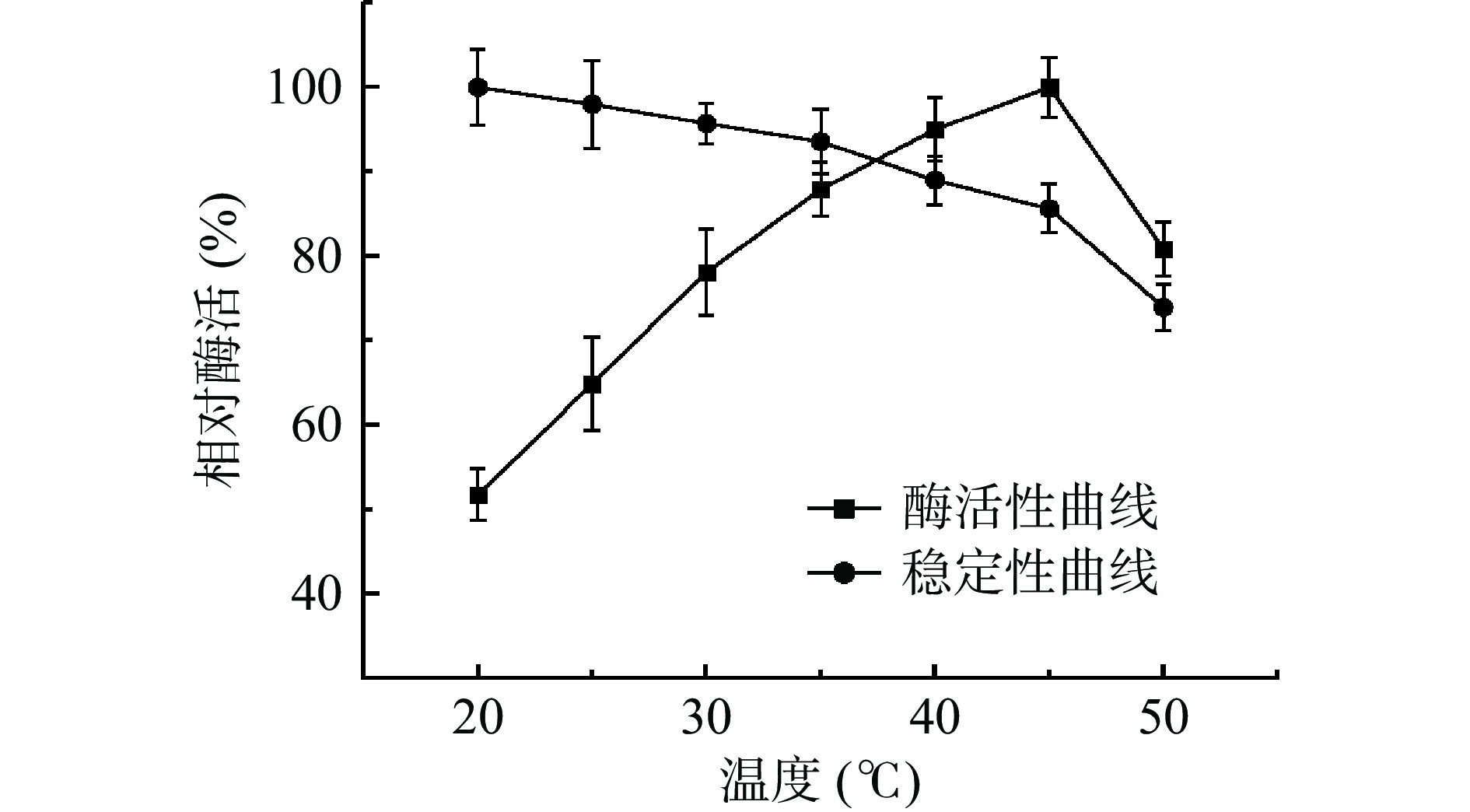
现阶段发现的壳聚糖酶其最适温度一般在30~60 ℃之间[17]。本实验研究不同温度对菌株CLT08壳聚糖酶酶活的影响,如图3所示其在30~50 ℃之间相对酶活较高,其相对酶活均在70%以上,符合大多数壳聚糖酶的特性。随着温度的升高在45 ℃达到最大值(图3)。此结果与张荣华等[18]在菌株KD03壳聚糖酶其最适温度为40 ℃研究结果相似;而与Gao等[19]最适温度为60 ℃、Wang等[20]最适温度为50 ℃不同。说明了不同的酶其最适温度虽有相似但也有一些细微差别。
在保温2 h后,随着温度的升高,相对酶活趋势都呈下降趋势,通过其温度趋势观察发现,在35 ℃之前下降较平缓,之后其下降幅度明显增大。故CLT08菌株的壳聚糖酶在较低温度条件下稳定性较高,热稳定性较差。与之前报道的大多数壳聚糖酶相似。说明其在此性质与其他壳聚糖酶并无大差异[21]。
2.3.2 pH对菌株CLT08壳聚糖酶酶活性和稳定性影响
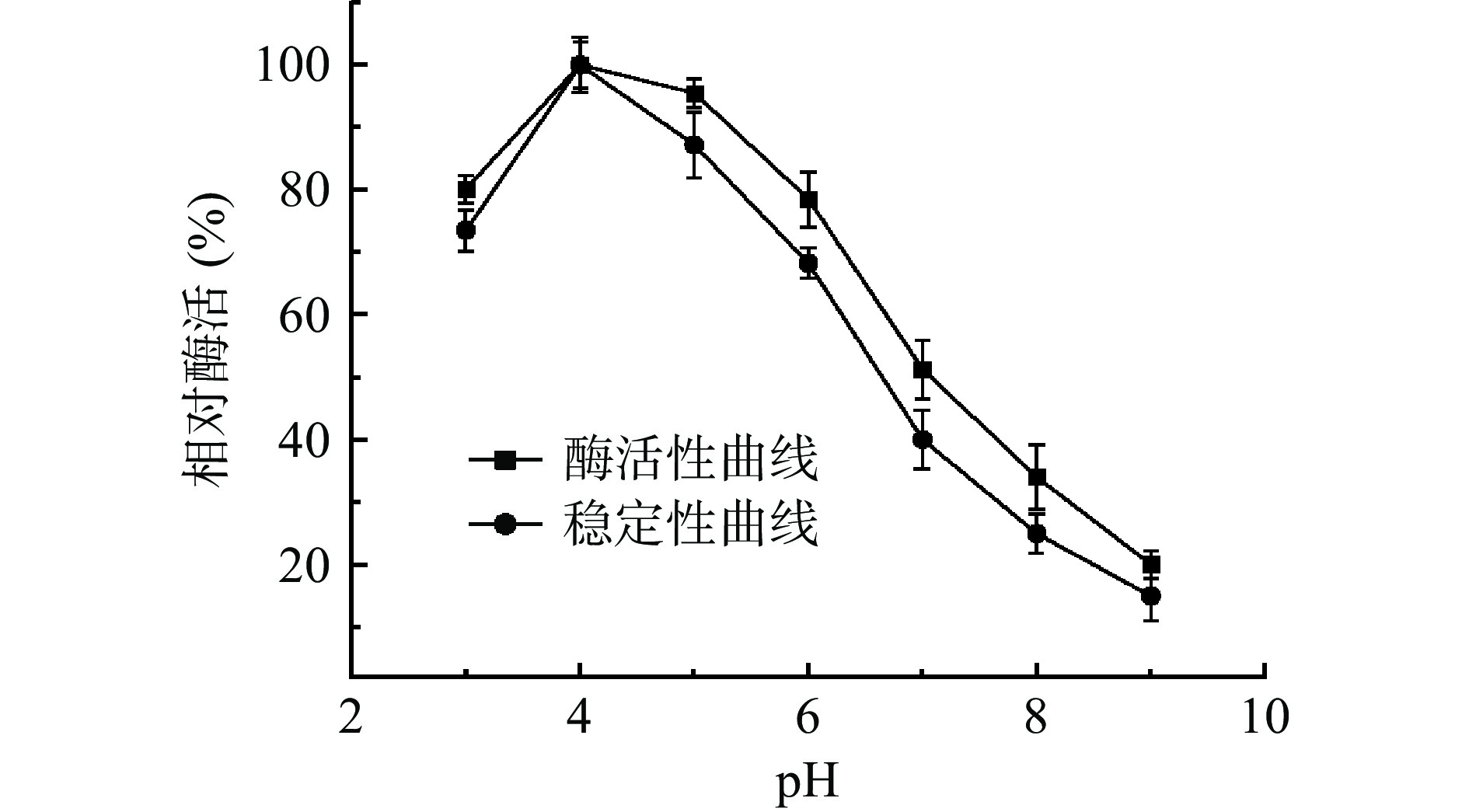
pH会影响酶的构象以及底物和酶分子活性部位有关基团的解离状态,影响酶的催化活性。因此酶的最适pH以及稳定性是酶应用价值的重要考察指标[22]。将CLT08菌株的粗酶液在不同的pH下保温20 min,发现其在pH3.0~6.0的范围内时酶活力相对较高,达到70%以上(图4),当pH>6.0时,酶活力开始急剧下降。pH4.0时,CLT08菌株的相对酶活达到最大值。与尹雅洁等[23]研究的壳聚糖酶最适pH为5.5,以及张翔等[24]研究的壳聚糖酶最适pH为5.6不同,这表明不同来源的壳聚糖酶的最适pH有一定差距。
在不同pH孵育2 h,测定剩余酶活,在pH 3.0~5.0剩余酶活在70%以上。当pH>5时,酶活力急剧下降。说明不同pH对菌株CLT08壳聚糖酶的活性中心的必需基团的影响较大,且其耐酸性较强。
2.3.3 金属离子对菌株CLT08壳聚糖酶酶活性影响
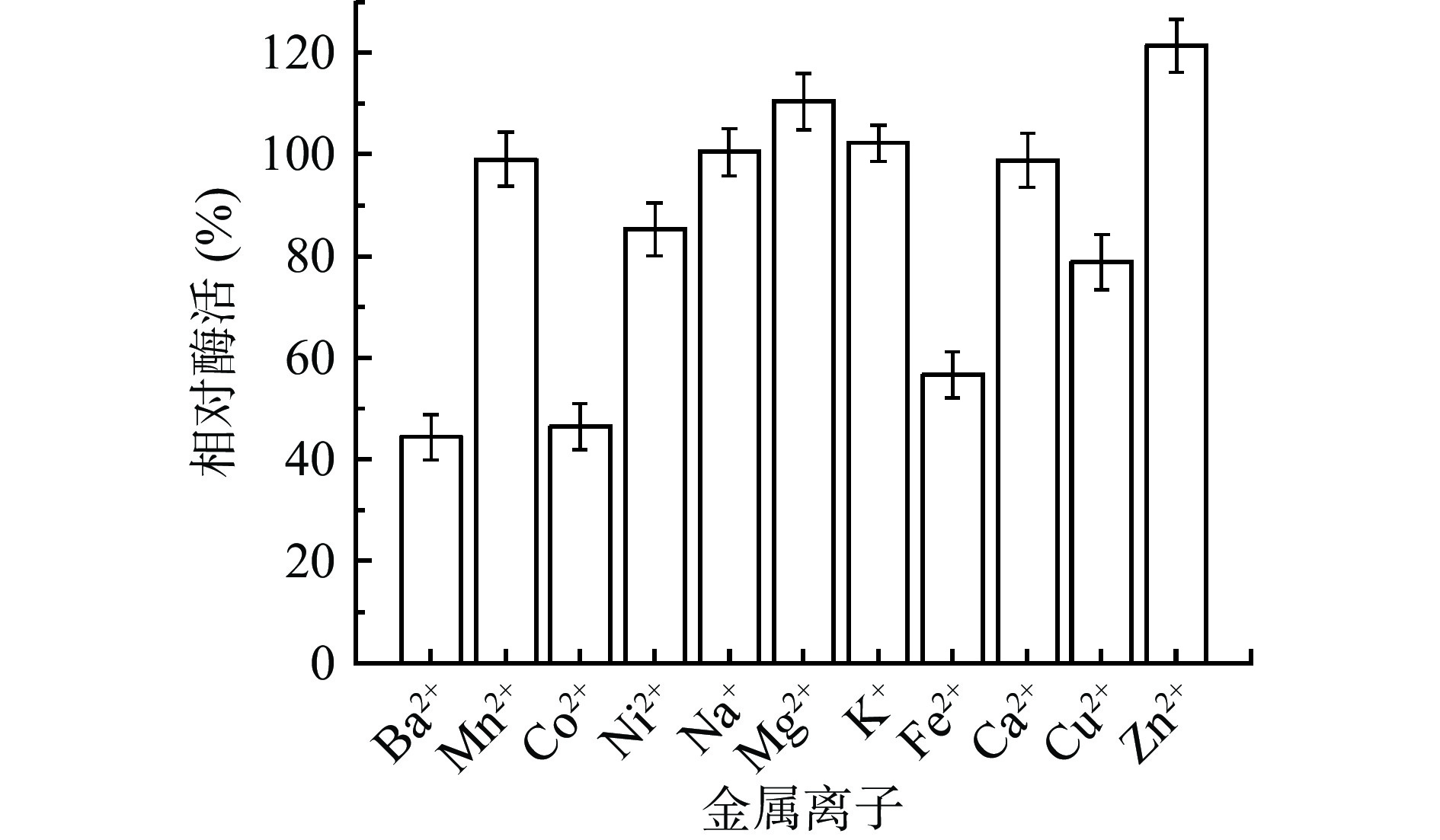
将CLT08菌株的粗酶液在不同的金属离子中反应20 min后,测其相对酶活,发现酶液在Mg2+和Zn2+中都对酶活有不同的激活作用,其中Zn2+的激活作用最大(图5)。而在Ba2+、Co2+、Fe2+中有明显的抑制作用。与周念波等[25]研究发现Zn2 +,Ca2 +对Bacillus sp.LS产的壳聚糖酶有一定的激活作用相似,但与阎贺静等[26]研究发现Zn2+对WHSW-C01壳聚糖酶具有抑制作用相反,与Cu2+对其具有一定的抑制作用相似。进一步表明不同来源的壳聚糖酶有一定的差异。
2.3.4 酶底物特异性的探究实验
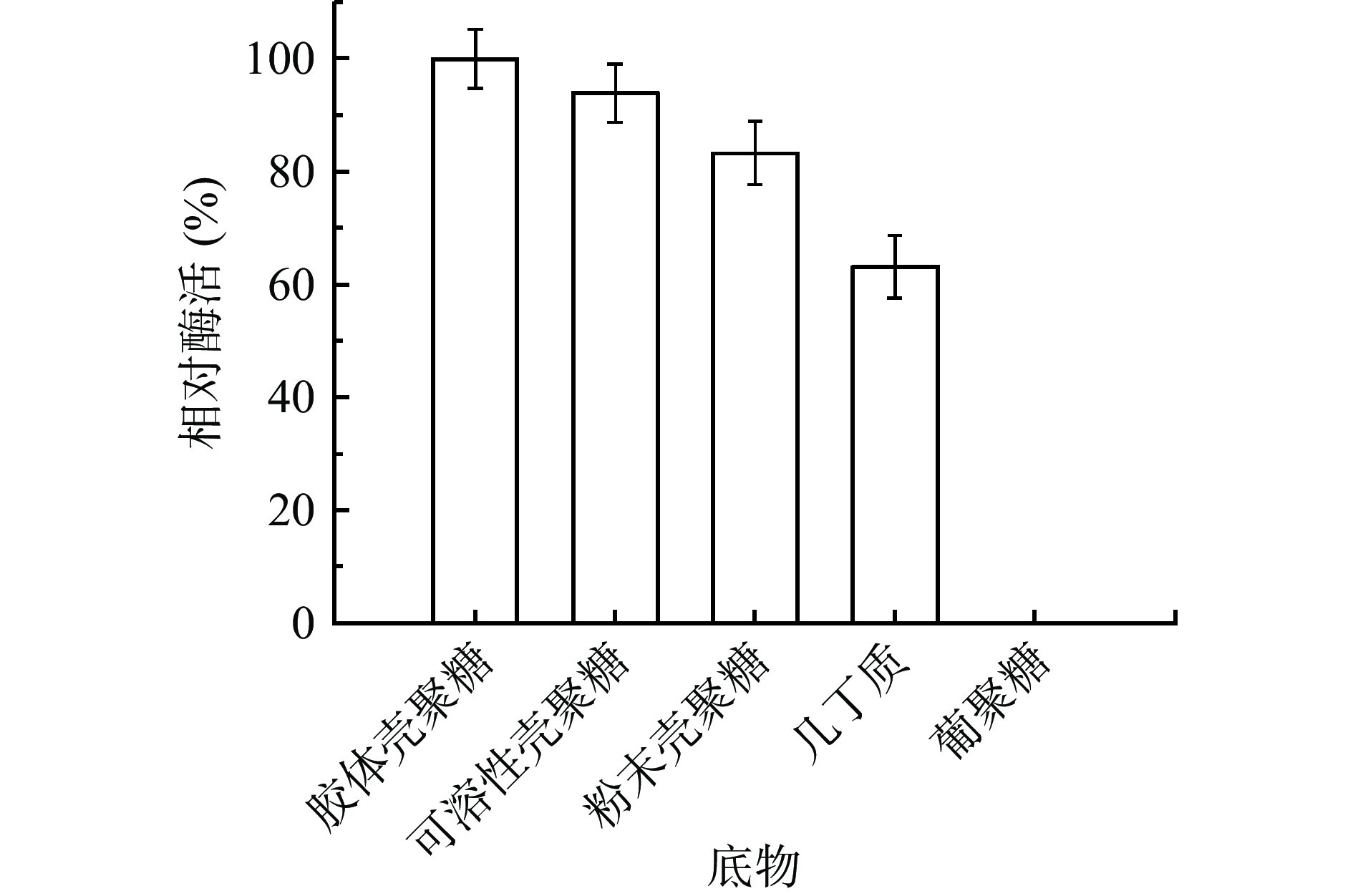
将CLT08菌株的粗酶液与不同的底物按照体积比1:1的比例反应20 min后,测其相对酶活,发现其在质量分数1%的胶体壳聚糖、可溶性壳聚糖、粉末壳聚糖、几丁质中的都有一定的酶解能力(图6),并且在质量分数1%的胶体壳聚糖中达到相对酶活最大值,其在几丁质中也具有一定的活性。一般壳聚糖酶大都专一性水解壳聚糖,但也有一些壳聚糖酶具有水解几丁质的能力[27]。通过底物特异性研究发现,菌株CLT08壳聚糖酶对几丁质的酶解>60%,具有一定的几丁质水解能力。
2.3.5 壳聚糖粗酶液在酸性条件下水解壳聚糖的结果
将粗酶液5 mL与25 mL 质量分数为10%的胶体壳聚糖(pH≤3.0)置于45 ℃、160 r/min的摇床中进行反应,观察其水解程度,发现在6 h时能够完全水解(图7)。工业中壳聚糖的获得方法为酸解法,这就使具备水解壳聚糖的酶具有一定的耐酸性,但在此条件下半衰期较短是制约酶法制备壳寡糖的瓶颈[28]。CLT08菌株在pH≤3.0的条件下具有较强的水解活性,并且在6 h内将胶体壳聚糖水解,具有一定的耐酸性。
2.3.6 菌株CLT08壳聚糖酶水解壳聚糖产物测定
通过TCL对酶解产物进行分析,如图8所示,菌株CLT08壳聚糖酶在不断地水解壳聚糖产生壳寡糖,最终的水解产物为聚合度≥6的壳寡糖溶液,其中最小酶解产物为壳六糖,并在水解过程中未出现单糖。且通过水解结果表明,随着时间推移,未出现单糖,证实CLT08壳聚糖酶具有内切型活性,而不具备外切型活性。与来自类芽孢杆菌属的一些壳聚糖酶被确认为内切型酶[29]。与芽孢杆菌属的一些早期的报道一致[8]。
3. 结论
本文从连云港海州湾地区的泥样中筛选出的产壳聚糖酶较强稳定性较好的菌株CLT08作为出发菌株,通过形态学、生理生化特征及16S rDNA序列测定与分析,鉴定为Paenibacillus chitinolyticus。其不只具有水解壳聚糖的能力,还具有水解几丁质的能力。菌株CLT08所产的壳聚糖酶最适作用温度为45 ℃,在低于35 ℃有较好的热稳定性,最适反应pH为4.0,pH在3~5之间时具有良好稳定性。Zn2+对壳聚糖酶有明显的激活作用,Ba2+、Co2+、Fe2+有明显的抑制作用。该酶在pH为3.0的条件下6 h左右可将胶体壳聚糖全部水解,说明该酶的耐酸性较强。该酶水解壳聚糖主要产物为聚合度≥6,最小酶解产物为壳六糖,具有工业应用潜力。
-
表 1 菌落及透明圈直径
Table 1 Diameter of colonies and transparent circles
菌株 菌落直径(mm) 透明圈直径(mm) 透明圈直径/菌落直径 酶活(U/mL) pH3.0孵育2 h后相对酶活(%) CLT03 5.12±0.24 9.34±0.43 1.8±0.2 1.18±0.01 88.73±4.32 CLT07 5.10±0.31 10.0±0.44 1.9±0.3 1.13±0.04 80.42±5.22 CLT08 4.24±0.14 8.48±0.23 2.0±0.1 3.17±0.04 95.56±5.16 CLT11 4.10±0.22 6.15±0.48 1.5±0.2 0.13±0.03 58.13±4.58 CLT12 4.56±0.23 6.43±0.31 1.4±0.1 0.07±0.01 61.22±4.76 表 2 生理生化实验结果
Table 2 Physiological and biochemical experimental results
检测项目 特征 H2O2实验 + 明胶液化实验 − 吲哚实验 − 葡萄糖 − 山梨醇 + 甘露醇 − 麦芽糖 + 蔗糖 − 乳糖 − 柠檬酸盐 + 注:“+”表示反应呈阳性;“−”表示反应呈阴性。 -
[1] SUN Huihui, YANG Guosong, CAO Rong, et al. Expression and characterization of a novel glycoside hydrolase family 46 chi-tosanase identified from marine mud metagenome[J]. Int J Biol Macromol,2020,159:904−910. doi: 10.1016/j.ijbiomac.2020.05.147
[2] ISMAIL S A, EL-SAYED H S, FAYED B. Production of prebiotic chitooligosaccharide and its nano/microencapsulation for the production of functional yoghurt[J]. Carbohydr Polym,2020,234:115−941.
[3] LIAQAT F, ELTEM R. Chitooligosaccharides and their biological activities: A comprehensive review[J]. Carbohydr Polym,2018,184:243−259. doi: 10.1016/j.carbpol.2017.12.067
[4] DUTTA J, TRIPATHI S, DUTTA P K. Progress in antimicrobial activities of chitin, chitosan and its oligosaccharides: A systematic study needs for food applications[J]. Food Science and Technology International,2012,18(1):3−34. doi: 10.1177/1082013211399195
[5] KACZMAREK M B, STRUSZCZYK-SWITA K, LI X, et al. Enzymatic modifications of chitin, chitosan, and chitooligosaccharides[J]. Front Bioeng Biotechnol,2019,7:243. doi: 10.3389/fbioe.2019.00243
[6] AFFES S, ARANAZ I, HAMDI M, et al. Preparation of a crude chitosanase from blue crab viscera as well as its application in the production of biologically active chito-oligosaccharides from shrimp shells chitosan[J]. Int J Biol Macromol,2019,139:558−569. doi: 10.1016/j.ijbiomac.2019.07.116
[7] LI Songlin, CHEN Liang, WANG Chen, et al. Expression, purification and characterization of endo-type chitosanase of Aspergillus sp. CJ22-326 from Escherichia coli[J]. Carbohydr Res,2008,343(17):3001−3004. doi: 10.1016/j.carres.2008.08.032
[8] DOAN C T, TRAN T N, NGUYEN V B, et al. Bioprocessing of squid pens waste into chitosanase by Paenibacillus sp. TKU047 and its application in low-molecular weight chitosan oligosaccharides production[J]. Polymers (Basel),2020,12(5):1163. doi: 10.3390/polym12051163
[9] CORD-LANDWEHR S, RICHTER C, WATTJES J, et al. Patterns matter part 2: Chitosan oligomers with defined patterns of acetylation[J]. Reactive and Functional Polymers,2020,151:104577. doi: 10.1016/j.reactfunctpolym.2020.104577
[10] SUN Huihui, CAO Rong, LI Laihao, et al. Cloning, purification and characterization of a novel GH46 family chitosanase, Csn-CAP, from Staphylococcus capitis[J]. Process Biochemistry,2018,75:146−151. doi: 10.1016/j.procbio.2018.09.021
[11] SUN Huihui, YANG Guosong, CAO Rong, et al. Characterization of a novel glycoside hydrolase family 46 chitosanase, Csn-BAC, from Bacillus sp. MD-5[J]. International Journal of Biological Macromol,2020,146:518−523. doi: 10.1016/j.ijbiomac.2020.01.031
[12] MOHAMMEDI Z. Chitosan and chitosan oligosaccharides: Applications in medicine, agriculture and biotechnology[J]. International Journal of Bioorganic Chemistry,2017,2(3):102−106.
[13] ZEVEDO M I G, OLIVEIRA S T, SILVA C F B, et al. Secretory production in Escherichia coli of a GH46 chitosanase from Chromobacterium violaceum, suitable to generate antifungal chitooligosaccharides[J]. Int J Biol Macromol,2020,165(Pt A):1482−1495.
[14] MA Chunrui, LI xiao, YANG kun, et al. Characterization of a new chitosanase from a
marineBacillus sp. and the anti-oxidant activity of its hydrolysate[J]. Mar Drugs,2020,18(2):126. doi: 10.3390/md18020126 [15] 张凯琪. 产壳聚糖酶菌株的筛选及发酵条件的优化[D]. 烟台: 烟台大学, 2020. ZHANG Kaiqi. Screening of chitosanase-producing strains and optimization of fermentation conditions[D]. Yantai: Yantai University, 2020.
[16] SONG Y S, SEO D J, KIM K Y, et al. Expression patterns of chitinase produced from Paenibacillus chitinolyticus with different two culture media[J]. Carbohydr Polym,2012,90(2):1187−1192. doi: 10.1016/j.carbpol.2012.06.016
[17] THADATHIL N, VELAPPAN S P. Recent developments in chitosanase research and its biotechnological applications: A review[J]. Food Chemistry,2014,150(1):392−399.
[18] 张荣华, 梅兴林, 屠洁. 壳聚糖酶高产菌株的筛选及其发酵产酶条件的研究[J]. 广西轻工业,2009,25(4):20−21. [ZHANG Ronghua, MEI Xinglin, TU Jie. Screening of chitosanase producing strain and its fermentation conditions[J]. Guangxi Journal of Light Industry,2009,25(4):20−21. doi: 10.3969/j.issn.1003-2673.2009.04.009 [19] GAO X A, JU W T, JUNG W J, et al. Purification and characterization of chitosanase from Bacillus cereus D-11[J]. Carbohydrate Polymers,2008,72(3):513−520. doi: 10.1016/j.carbpol.2007.09.025
[20] WANG S L, PENG J H, LIANG T W, et al. Purification and characterization of a chitosanase from Serratia marcescens TKU011[J]. Carbohydrate Research,2008,343(8):1316−1323. doi: 10.1016/j.carres.2008.03.030
[21] 马帅, 杨绍青, 刘翊昊, 等. 枯草芽孢杆菌壳聚糖酶在毕赤酵母中的高效表达及其酶解特性[J]. 食品科学,2019,40(14):99−106. [MA Shuai, YANG Shaoqing, LIU Yuhao, et al. High-efficiency expression of Bacillus subtilis chitosanase in Pichia pastoris and its enzymatic hydrolysis characteristics[J]. Food Science,2019,40(14):99−106. doi: 10.7506/spkx1002-6630-20180809-086 [22] 李佳茵, 王慧敏, 祖国仁. 一株产壳聚糖酶海洋真菌MF-08的分离鉴定及酶学性质研究[J]. 食品工业科技,2015,36(22):193−197. [LI Jiayin, WANG Huimin, ZU Guoren. Isolation, identification and enzyme characteristics of the chitosanase producing marine fungal MF-08[J]. Food Industry Science And Technology,2015,36(22):193−197. [23] 尹雅洁, 谭光迅, 胡远亮. Mitsraria sp. 1412产壳聚糖酶的分离纯化及性质研究[J]. 湖北师范大学学报(自然科学版),2019,39(1):70−75. [YIN Yajing, TAN Guangxun, HU Yuanliang. Purification and characterization of a chitosanase from the mutant Mitsraria sp. 1412[J]. Journal of Hubei Normal University (Natural Science),2019,39(1):70−75. [24] 张翔, 张彦昊, 刘孝永, 等. 产壳聚糖酶菌株NCPS116发酵条件优化及其酶学性质[J]. 化工进展,2018,37(6):2354−2363. [ZHANG X, ZHANG Y H, LI X Y, et al. Optimization of fermentation conditions of the chitosanase-producing strain NCPS116 and enzymatic properties of the chitosanase[J]. Chemical Industry and Engineering Progress,2018,37(6):2354−2363. [25] 周念波, 李轶群, 涂绍勇. Bacillus sp. LS壳聚糖酶的分离纯化及性质研究[J]. 食品科技,2008,33(2):4−7. [ZHOU Nianbo, LI Yiqun, TU Shaoyong. Purification and properties of chitosanase from Bacillus sp. LS[J]. Food Science and Technology,2008,33(2):4−7. doi: 10.3969/j.issn.1005-9989.2008.02.002 [26] 阎贺静, 周念波, 涂邵勇, 等. 壳聚糖酶生产菌筛选、鉴定及其酶学性质[J]. 广东农业科学,2012,39(24):161−164. [YAN Hejing, ZHOU Nianbo, TU Shaoyong, et al. Isolation, identification and enzyme characteristics of a strain producing chitosanase[J]. Guangdong Agricultural Sciences,2012,39(24):161−164. doi: 10.3969/j.issn.1004-874X.2012.24.050 [27] FAZLI Wahid, WANG Haisong, LU Yushi, et al. Preparation, characterization and antibacterial applications of carboxymethyl chitosan/CuO nanocomposite hydrogels[J]. International Journal of Biological Macromolecules,2017:690−695.
[28] SEVO M, DEGRASSI G, SKOKO N, et al. Production of glycosylated thermostable Providencia rettgeri penicillin G amidase in Pichia pastoris[J]. FEMS Yeast Research,2002,1:271−277.
[29] SINGH A K, MEHTA G, CHHATPAR H S. Optimization of medium constituents for improved chitinase production by Paenibacillus sp. D1 using statistical approach[J]. Lett Appl Microbiol,2009,49:708−714. doi: 10.1111/j.1472-765X.2009.02731.x
-
期刊类型引用(4)
1. 李红英,王静,李娜,姜琳琳,杨洋,胡宏远,张晓煜. 贺兰山东麓葡萄园不同方位摘叶对赤霞珠果实品质的影响. 中国农业气象. 2024(01): 23-32 .  百度学术
百度学术
2. 贾永华,马军,许泽华,李百云,侯克峰,李晓龙. 果园生草条件下介导果树适施外源钙剂引起的果实内源激素和品质变化特征. 北方园艺. 2024(07): 1-9 .  百度学术
百度学术
3. 李媛媛,王鲁泉,张栋. 我国葡萄酒产业竞争力提升路径探析. 中外葡萄与葡萄酒. 2022(03): 78-83 .  百度学术
百度学术
4. 任小彤,彭婧,韩晓,王军,何非. 贺兰山东麓产区不同地块酿酒葡萄果实类黄酮物质分析. 中外葡萄与葡萄酒. 2022(06): 32-41 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:



 下载:
下载:



