Optimization of Extraction Technology of Anthocyanidins from Daucus carota L. by Aqueous Two-phase System Based on Response Surface Methodology
-
摘要: 采用聚乙二醇(PEG)/硫酸铵双水相体系萃取纯化黑胡萝中的花青素。通过单因素实验考察了硫酸铵、PEG6000、粗提液的质量分数对花青素选择性系数和萃取率的影响,并以花青素的萃取率为响应值,结合响应面试验优化萃取工艺。结果表明,各因素对萃取率的影响程度由大到小依次为硫酸铵质量分数>粗提液质量分数>PEG6000质量分数。以双水相体系的总质量为基准,实验最佳萃取条件为:硫酸铵质量分数为20.0%、粗提液质量分数为12.0%、PEG6000质量分数为14.0%,黑胡萝卜红色素的平均萃取率为94.17%。此萃取方法得到的黑胡萝卜红色素具有一定的抗氧化活性,对DPPH自由基清除能力的IC50值为30.51 mg/L。Abstract: In this study, the anthocyanins in Daucus carota L. were extracted and purified by PEG/ammonium sulfate aqueous two-phase system. The mass content of ammonium sulfate, the mass content of PEG6000, and the mass content of crude extract were optimized by single factor experiment according to the selectivity coefficient and extraction ratio of anthocyanins. Based on the response surface experiment, with the extraction ratio of anthocyanins as the response value, the extraction process was optimized. The results showed that the influence order of various factors on anthocyanins extraction effect was as follows: the ammonium sulfate content>the crude extract content>the PEG6000 content. Based on the total mass of the aqueous two-phase system, the optimal extraction condition was as follows: the mass content of ammonium sulfate, crude extract and PEG6000 was 20.0%, 12.0% and 14.0%, respectively, and the average extraction ratio of black carrot red color was 94.17%. The black carrot red color extracted by this method had certain antioxidant activity, and the IC50 value of the DPPH free radical scavenging ability was 30.51 mg/L.
-
黑胡萝卜(Daucus carota L.),十字花科萝卜属,起源于土耳其、埃及和远东国家[1],近些年来在我国开始种植,但由于种植面积较小,产量较低,并未在市面上广泛流通。黑胡萝卜根部呈紫黑色,其中的花青素是自然界中广泛存在于植物中的天然水溶性色素,也是植物当中主要的呈色物质之一[2],同时也具有多种生理活性,例如清除自由基、抗氧化、抗癌等[3-5]。黑胡萝卜花青素作为一种新型的天然水溶性植物色素,因其含有酰化的基团,在弱酸性和中性条件下能够表现出更好的稳定性[6]。随着消费者对食品安全的关注度不断提高,天然植物提取的色素更易受到人们的青睐,因此,将黑胡萝卜红色素作为传统合成色素的替代品添加到食品当中具有十分广阔的市场前景[7-8]。
目前花青素的提取方法主要有溶剂提取法、超声波辅助提取法、超临界流体萃取等[9-10]方式,但存在提取液杂质过多、耗能较大,无法实现工业化生产的问题。大孔吸附树脂广泛应用于花青素的分离、纯化[11-12],可以实现色素与其糖类物质的分离,但生产周期较长,色素的稳定性差,容易导致色素产品的损失。双水相萃取作为一种新型、快速、低成本的操作方式,能够较好地保留目标产物的生物活性,且选择性强,易于工业放大[13-14],广泛应用于花青素的提取分离[15-16]。翟硕等[17]通过比较研究得出采用双水相萃取的方法提取黑豆皮花青素的效果最好,得率最高为2.81 mg/g;Liu等[18]利用响应面法优化双水相体系对紫甘薯花青素进行萃取,在最佳条件下花青素的得率可以达到90.02%。
本文以黑胡萝卜作为研究对象,使用PEG6000/硫酸铵双水相体系来实现黑胡萝卜红色素与糖类物质分离。根据先前的研究[19-20]优化对双水相萃取效果影响较大的三个因素(硫酸铵、PEG6000和粗提液的质量分数),并通过响应面分析法优化萃取工艺,为工业上快速提取黑胡萝卜红色素提供了参考。
1. 材料和方法
1.1 材料与仪器
黑胡萝卜 青岛鹏远康华天然产物有限公司;D-无水葡萄糖、硫酸铵(分析纯) 天津市致远化学试剂有限公司;硫酸、L(+)-抗坏血酸(分析纯) 国药集团化学试剂有限公司;苯酚(优级纯) 天津市科密欧化学试剂有限公司;PEG6000(分析纯) 无锡市亚泰联合化工有限公司;盐酸(分析纯) 莱阳经济技术开发区精细化工厂;DPPH(1.1-二苯基-2-苦肼基自由基)(分析纯) 如吉生物科技。
pH211酸度计 意大利哈纳公司;JYZ-V5PLUS榨汁机 杭州九阳小家电有限公司;GT10-2高速台式离心机 北京时代北利离心机有限公司;XW-80A漩涡混合器 海门市其林贝尔仪器制造有限公司;752S紫外可见分光光度计 上海棱光技术有限公司;AR1530分析天平 奥豪斯国际贸易(上海)有限公司。
1.2 实验方法
1.2.1 黑胡萝卜色素粗提液制备
取1000.0 g黑胡萝卜洗净、切碎,使用榨汁机榨取原汁,260目滤布过滤,3000 r/min离心30 min,取上层色素溶液使用1 mol/L HCl调节pH至3.0,于2~4 ℃冷藏保存。
1.2.2 构建双水相体系
固定体系质量为30.0 g,在50 mL离心管中分别加入一定质量的硫酸铵和400 g/L的PEG6000原液,加入一定质量的pH为3.0的色素粗提液,加入去离子水补至体系质量为30.0 g,置于漩涡混合器上于室温下混合25 min后取下,置于离心机中,4000 r/min离心10 min后取出,静置至上下相体积不再发生变化。
1.2.3 单因素实验设计
分别考察硫酸铵、PEG6000和色素粗提液的质量分数对选择性系数和萃取率的影响,具体方法如下:
固定体系质量为30.0 g,在离心管中加入质量分数为18.0%的PEG6000原液,加入质量分数为18.0%的色素粗提液,分别加入质量分数为16.0%、18.0%、20.0%、22.0%、24.0%的硫酸铵,剩余的质量由去离子水补充,考察不同质量分数的硫酸铵对选择性系数β和萃取率Y的影响。
固定硫酸铵的质量分数为上述实验优化值,其它条件不变,分别加入质量分为10.0%、12.0%、14.0%、16.0%、18.0%的PEG6000原液,考察不同质量分数的PEG6000对选择性系数β和萃取率Y的影响。
固定硫酸铵、PEG6000的质量分数为上述实验优化值,其它条件不变,分别加入质量分数为8.0%、10.0%、12.0%、14.0%、16.0%的色素粗提液,考察不同色素粗提液的质量分数对选择性系数β和萃取率Y的影响。
1.2.4 响应面分析法优化试验设计
在单因素实验的基础上,选取误差相对较小的萃取率Y为响应值,选择硫酸铵、PEG6000以及粗提液的质量分数为实验因素组成三因素三水平Box-Behnken试验,响应面试验设计如表1所示。
表 1 响应面试验设计Table 1. Design of response surface experiment水平 因素 A:(NH4)2SO4
质量分数(%)B:PEG6000
质量分数(%)C:粗提液质量
分数(%)−1 18 12 10 0 20 14 12 1 22 16 14 1.2.5 黑胡萝卜红色素抗氧化性评价
以VC作为阳性对照,分别对萃取前后的黑胡萝卜红色素进行DPPH自由基清除能力实验[21-22]。取1.0 mL不同浓度的样品溶液,加入0.4 mmol/L DPPH乙醇溶液0.50 mL,加水2.0 mL,混匀后暗处反应30 min,于517 nm处测定其吸光度值。根据公式(1)计算DPPH自由基的清除率。
DPPH自由基清除率(%)=[1−(A1−A2)/A0]×100 (式1) 式中:A0:空白对照的吸光度值;A1:加入样品反应后的吸光度值;A2:样品自身干扰的吸光度值。
1.2.6 总花色苷含量及总糖含量测定
黑胡萝卜红色素属于花色苷类化合物,采用示差法按公式(2)对其含量进行测定[23],以矢车菊-3-葡萄糖苷计。
总花色苷含量(mg/L)=A×M×D×10001×ε (式2) 式中:吸光度A = (A520 − A700)pH1.0 − (A520 − A700)pH4.5;M:矢车菊-3-葡萄糖苷的摩尔质量,449.2 g/mol;D:样品储备液的稀释倍数;1:光路长,cm,测试中采用1 cm光路长的比色皿;ε:26900,矢车菊-3-葡萄糖苷的摩尔消光系数,L·mol−1·cm−1;1000:由g换算成mg的转换系数。
采用苯酚-硫酸法对上下相中总糖含量进行测定[24]。分别精密吸取上下相样品稀释液1.0 mL于试管中,加入5%的苯酚溶液1.0 mL,迅速加入浓硫酸溶液5.0 mL,摇匀,放置10 min后于40.0 ℃水浴加热10 min[25],取出后冷却至室温,以相应试剂为空白,在490 nm处测定吸光度,得到回归方程为:y=8.5971x+0.0165,R2=0.9989,表明在0.00~0.10 mg/mL范围内,葡萄糖浓度与其吸光度呈现良好的线性关系。
1.2.7 选择性系数β及萃取率Y的计算
用注射器分别移取上下相溶液于试管中,读取上下相溶液体积,并根据示差法和苯酚硫酸法分别对上下相中花青素的含量和总糖含量进行测定,根据公式(3)、(4)和(5)分别计算相比R、选择性系数β和萃取率Y[26]。
R=VtVb (式3) β=K花K糖 (式4) Y(%)=RK花1+RK花×100 (式5) 其中:
K花=C上花C下花,K糖=C上糖C下糖 式中:Vt、Vb:分别为上、下相的体积,mL;K花、K糖:分别为花青素、糖类物质的分配系数;C上花、C下花:分别为上相、下相中花青素的浓度,mg/L;C上糖、C下糖:分别为上相、下相中糖类物质的浓度,mg/mL。
1.3 数据处理
采用Design-Expert V 8.0.6.1和Origin Pro 8.0进行响应面实验设计及数据处理,所有试验均重复3次,取平均值。
2. 结果与分析
2.1 单因素实验
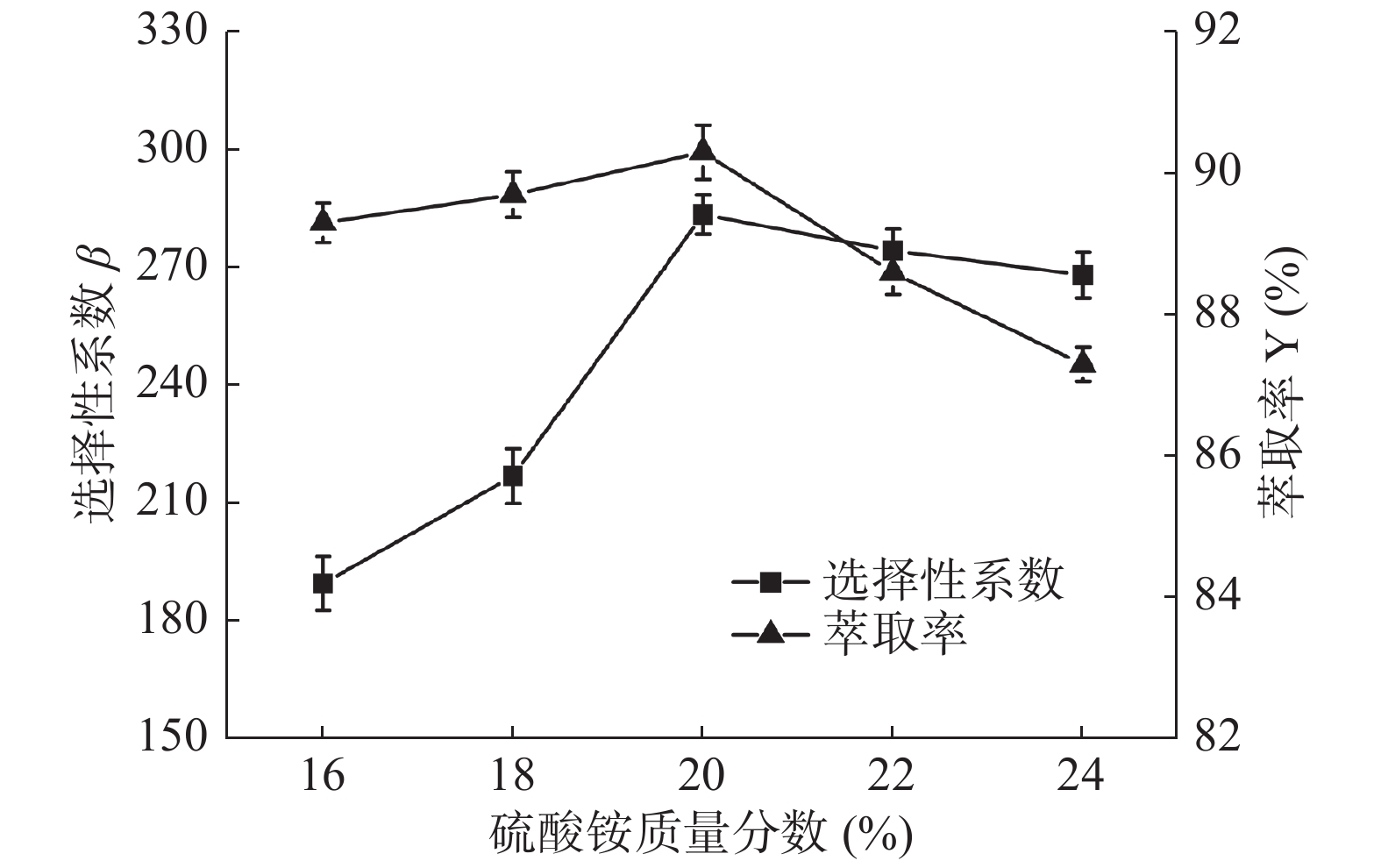
2.1.1 硫酸铵的质量分数对选择性系数和萃取率的影响
由图1可知,随着硫酸铵质量分数的增加,选择性系数β和萃取率Y先升高后降低,但选择性系数升高较快而后缓慢下降,萃取率升高较缓后快速下降。在硫酸铵质量分数为20.0%时两者达到最高值,分别为283.57和90.3%。这可能因为随着硫酸铵质量分数的增加,下相水合能力逐渐增强,加强了上下两相物质的分离效果,提高了上相中花青素的浓度[27],但硫酸铵的过量加入会存在于上相中,不利于色素的萃取[28]。因此,硫酸铵的质量分数选择为20%。
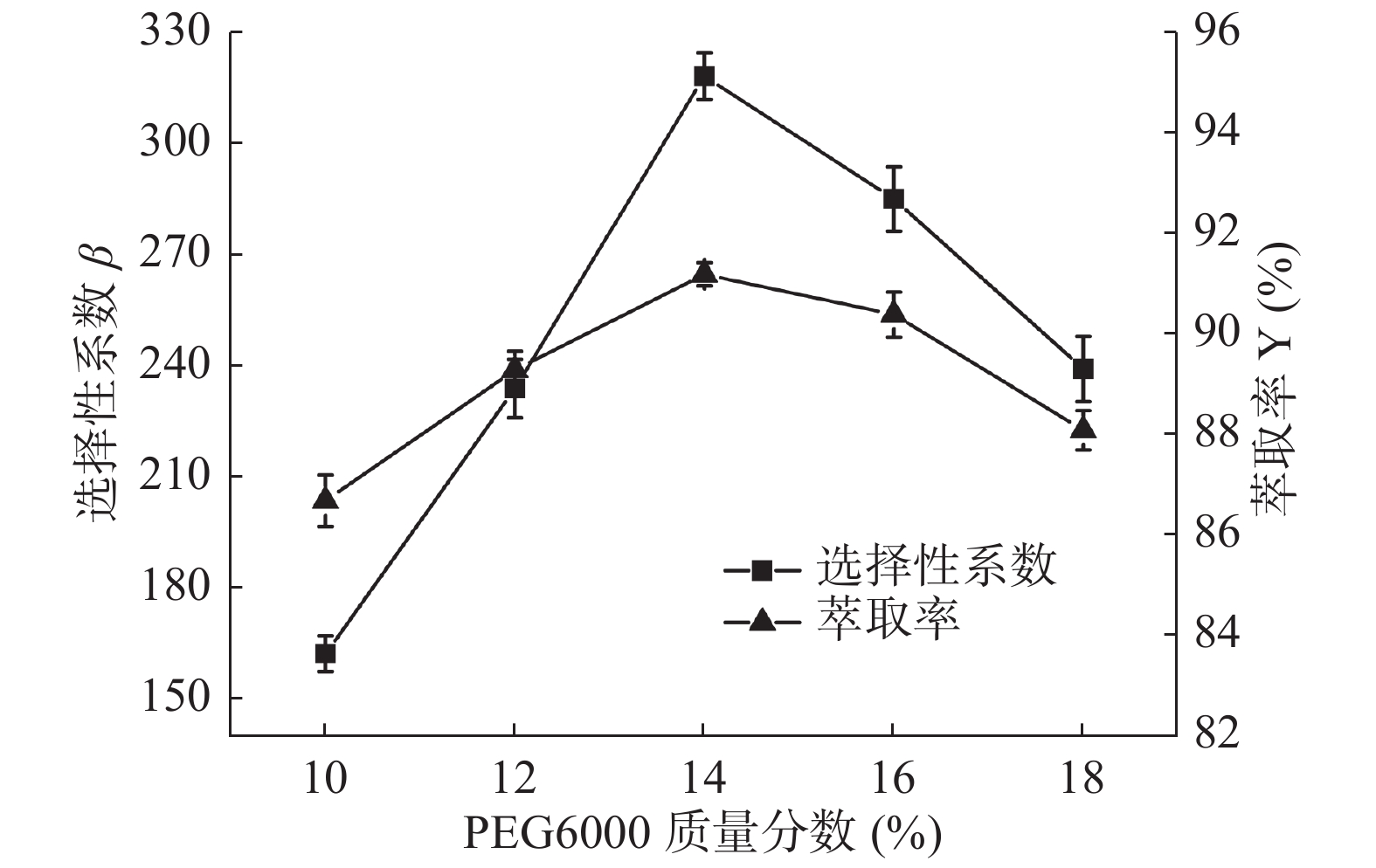
2.1.2 PEG6000的质量分数对选择性系数和萃取率的影响
由图2可知,随着PEG6000质量分数的增加,选择性系数β和萃取率Y大体呈现出相同的上升和下降的趋势,并在PEG6000质量分数为14.0%时两者达到最高值,分别为318.28和91.2%。在黑胡萝卜粗提液质量一定的情况下,PEG6000质量分数的提高可以增加对黑胡萝卜花青素的萃取效果。但随着PEG6000的继续加入使得整个体系黏度增加传质受阻[29],不利于花青素在上相中的分配,使β值出现下降趋势。因此,PEG6000的质量分数选择为14%。
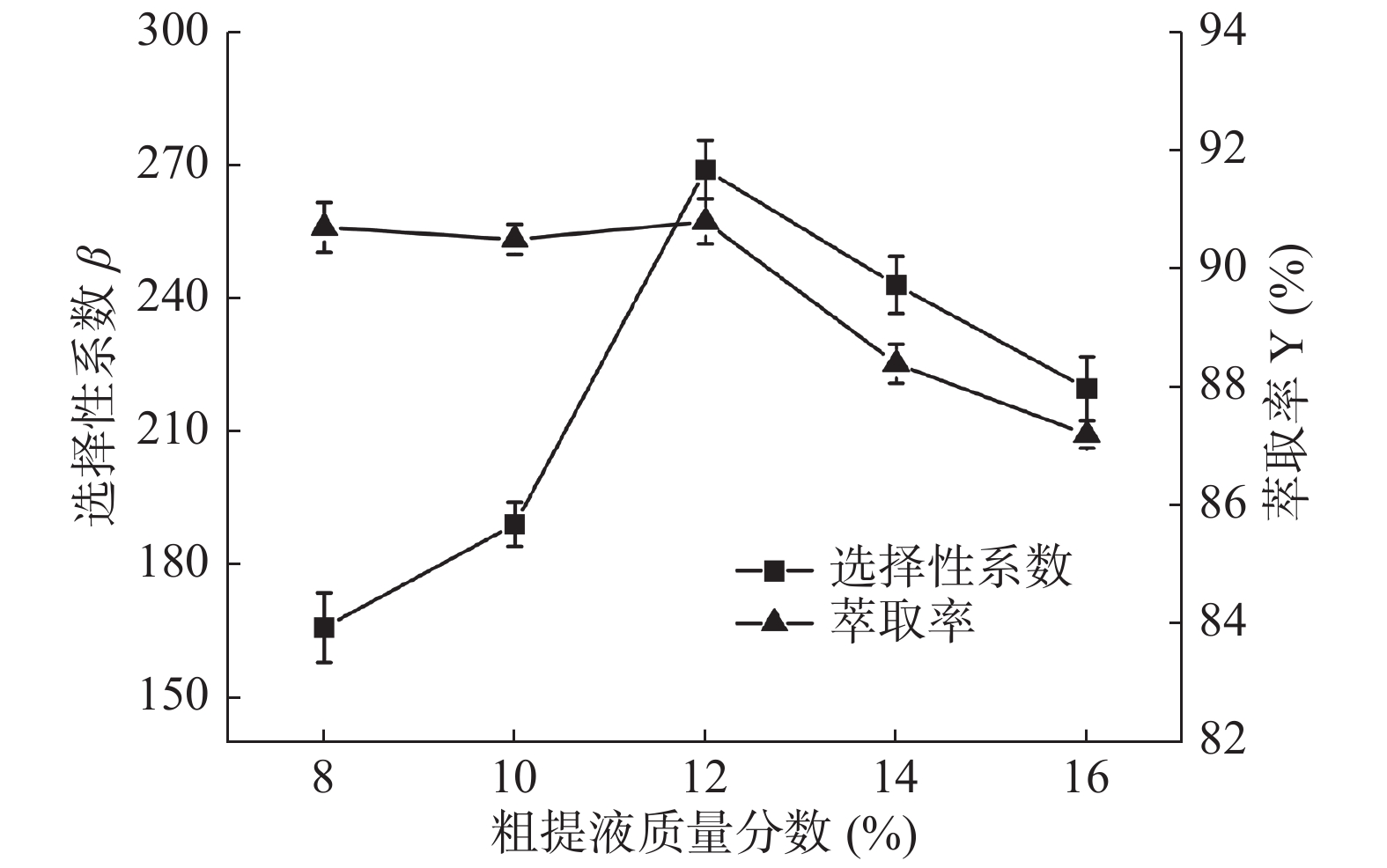
2.1.3 粗提液质量分数对选择性系数和萃取率的影响
图3可知,在粗提液质量分数在8.0%~12.0%范围内,随着粗提液质量分数的增高,选择性系数β也逐渐增加,而萃取率Y趋于平缓,在粗提液质量分数为12.0%时选择性系数和萃取率分别达到最大值269.01和90.8%。随着粗提液质量分数的继续增高,上相PEG对花青素的萃取能力趋近饱和,下相当中花青素的含量开始上升,选择性系数和萃取率均呈现出下降趋势。因此,粗提液的质量分数选择为12%。
2.2 响应面试验结果
2.2.1 响应面试验方案及结果分析
Box-Behnken响应面法对双水相萃取黑胡萝卜红色素中的硫酸铵质量分数、PEG6000质量分数以及粗提液的质量分数优化的结果如表2所示。
表 2 响应面试验结果Table 2. Results of response surface experiment试验号 因素 萃取率Y(%) A B C 1 1 0 −1 88.21 2 −1 −1 0 86.89 3 −1 1 0 87.79 4 1 0 1 88.27 5 1 −1 0 88.83 6 0 −1 −1 91.17 7 0 1 −1 90.07 8 0 0 0 92.23 9 −1 0 1 85.37 10 0 0 0 95.47 11 0 −1 1 89.51 12 0 0 0 93.73 13 1 1 0 88.62 14 0 0 0 95.28 15 −1 0 −1 86.73 16 0 0 0 94.82 17 0 1 1 89.24 采用Design-Expert V8.0对黑胡萝卜红色素的萃取得率Y进行数据分析得到各因素的回归拟合方程如下:
Y=94.31+0.94A−1.03B−0.47C−0.38AB+0.36AC+0.21BC−4.51A2−1.66B2−2.65C2 为证明此方程的有效性,对上述模型进行方差分析,结果如表3所示。由表3可知,模型中的A2和C2对黑胡萝卜红色素萃取率的影响极显著(P<0.01),A和B2对黑胡萝卜红色素萃取率的影响显著(P<0.05),而硫酸铵质量分数、PEG6000的质量分数以及粗提液的质量分数之间的两两交互作用的影响并不显著(P>0.05)。回归模型属于极显著水平(P = 0.0009<0.01);失拟项差异不显著(P = 0.9371>0.05);模型决定系数R2为0.9496,证明所选的二次回归模型是合理的,且所选模型的拟合程度较好,可以对双水相萃取黑胡萝卜红色素的结果进行分析和预测。根据回归方程和方差分析可知,各因素对黑胡萝卜红色素萃取率的影响程度由大到小依次为A>C>B,即硫酸铵质量分数>粗提液质量分数>PEG6000质量分数。
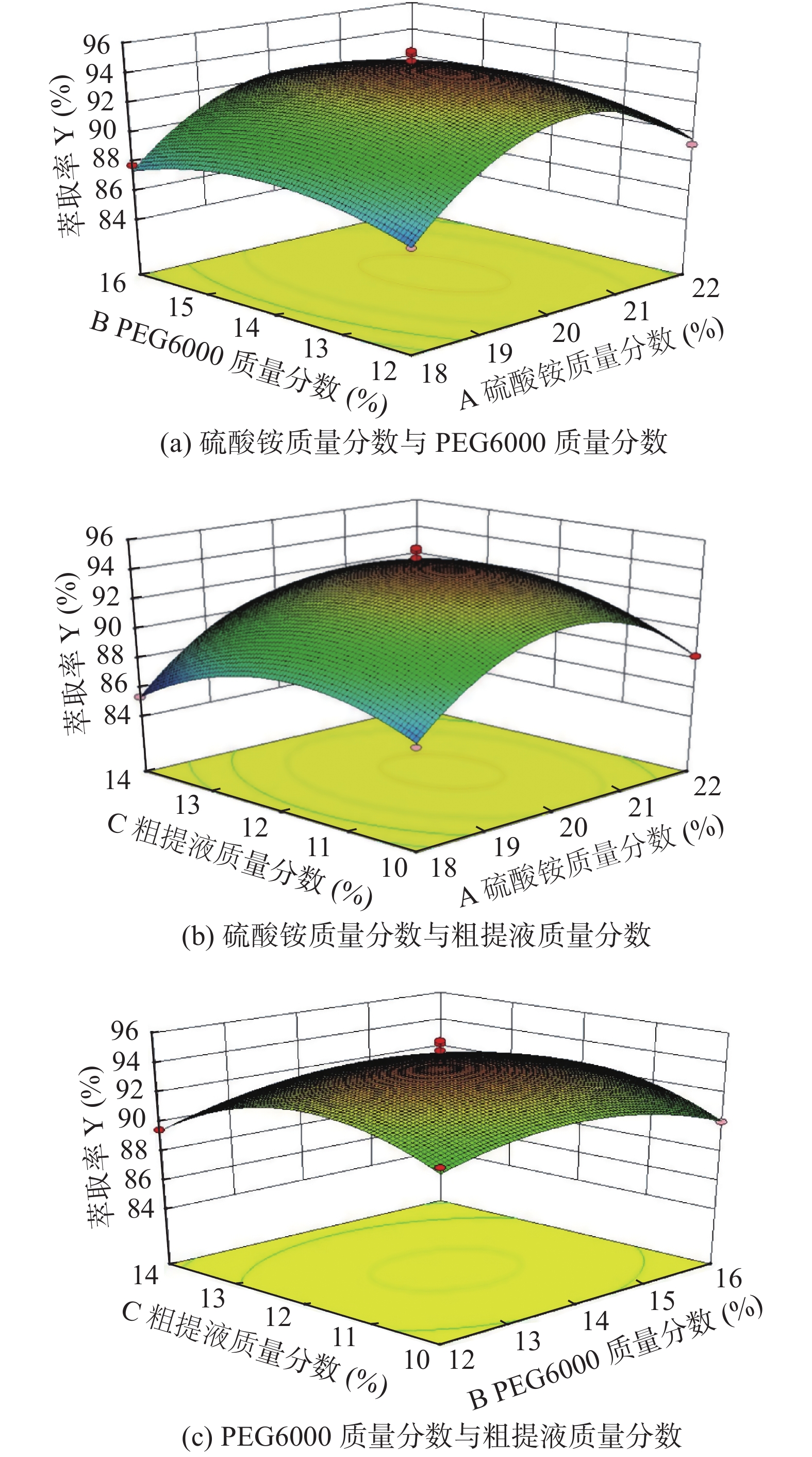
表 3 响应面试验方差分析结果Table 3. Results of analysis of variance of response surface experiment方差来源 均方和 自由度 均方 F值 P值 显著性 模型 149.17 9 16.57 14.66 0.0009 ** A 7.13 1 7.13 6.30 0.0404 * B 0.15 1 0.15 0.13 0.7301 C 1.8 1 1.80 1.59 0.2480 AB 0.57 1 0.57 0.5 0.5006 AC 0.5 1 0.50 0.45 0.5257 BC 0.17 1 0.17 0.15 0.7079 A2 85.76 1 85.76 75.85 <0.0001 ** B2 11.61 1 11.61 10.27 0.0150 * C2 29.52 1 29.52 26.11 0.0014 ** 残差 7.91 7 1.13 失拟项 0.7 3 0.23 0.13 0.9371 纯误差 7.21 4 1.8 总离差 157.08 16 注:*表示显著(P<0.05);**表示极显著(P<0.01)。 硫酸铵、PEG6000、粗提液质量分数之间相互作用的响应面曲线如图4所示。由图(a)和图(b)可以看出,响应面呈现一定程度的凸起,响应面图中硫酸铵质量分数曲线较陡,说明A(硫酸铵质量分数)对萃取率Y的影响较大;A(硫酸铵质量分数)和B(PEG6000质量分数),B(PEG6000质量分数)和C(粗提液质量分数)的交互作用不显著;由图(c)可以看出B(PEG6000质量分数)和C(粗提液质量分数)之间的交互作用不显著,但从曲线的陡峭程度可以看出,粗提液质量分数对萃取率的影响程度要高于PEG6000质量分数。
2.2.2 最佳工艺条件的预测及验证实验
根据响应面模型预测双水相萃取黑胡萝卜红色素的实验条件为:硫酸铵质量分数为20.21%、PEG6000质量分数为13.89%、粗提液质量分数为11.83%,理论黑胡萝卜红色素萃取率为94.38%。根据实验实际操作,将最佳工艺条件调整为:硫酸铵质量分数为20.0%、PEG6000质量分数为14.0%、粗提液质量分数为12.0%,在此工艺条件下进行验证实验,做重复试验3次,黑胡萝卜红色素的平均萃取率为94.17%,与模型预测值基本符合,表明所选模型合理,能够模拟和预测该双水相体系对黑胡萝卜红色素的萃取效果。
2.3 黑胡萝卜红色素抗氧化性评价DPPH自由基清除能力实验
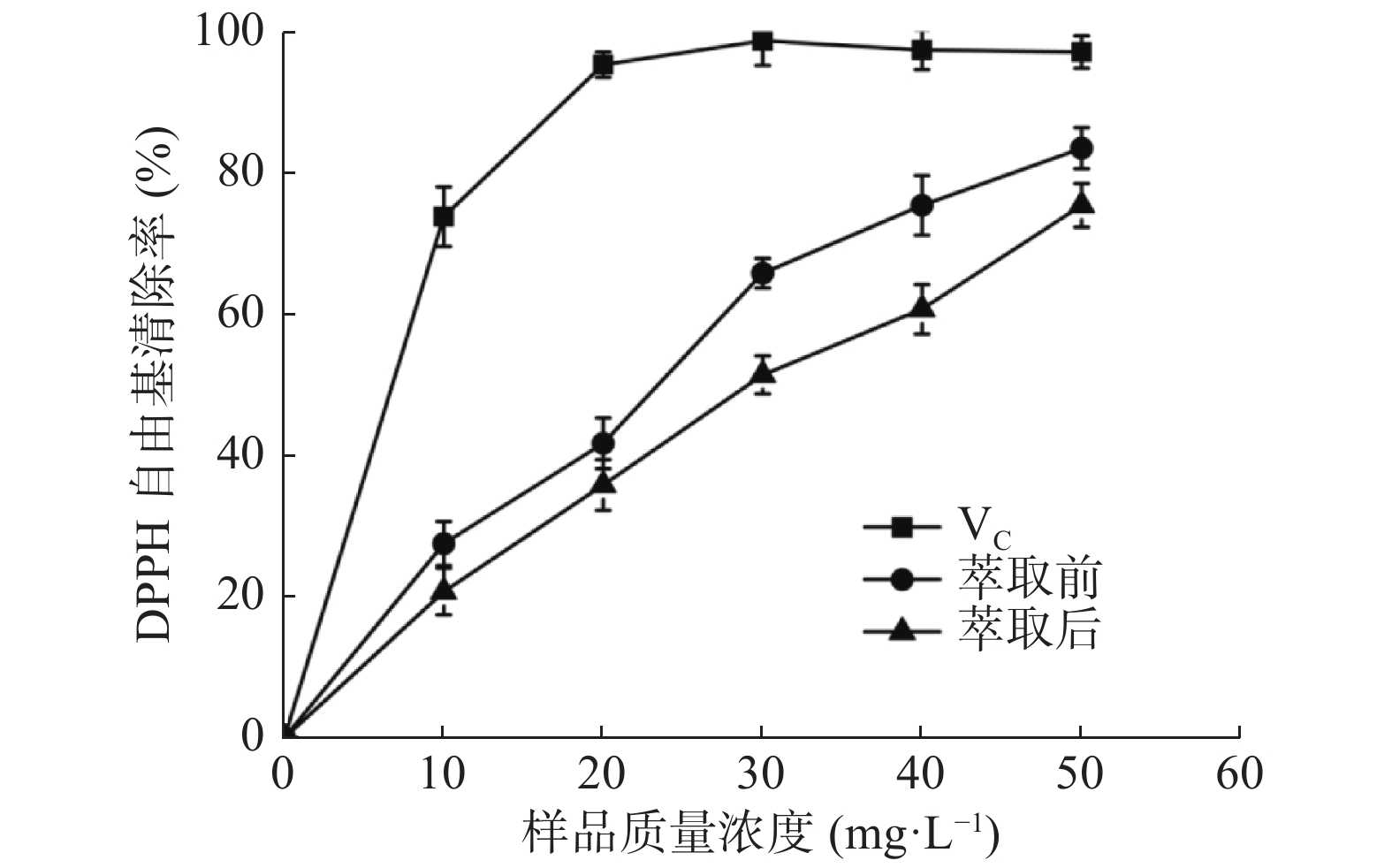
由图5可知,随着样品质量浓度的提高,萃取前后的黑胡萝卜红色素对DPPH自由基的清除能力也逐渐提升,且VC在质量浓度达到20.0 mg/L后出现平台期,对DPPH自由基的清除率均在95%以上。IC50值可以用来反映样品的抗氧化性,且数值越小,样品抗氧化的能力越强[30]。经计算,VC和萃取前、后黑胡萝卜红色素的IC50值分别为8.09、26.32、30.51 mg/L,可以看出萃取前、后的黑胡萝卜红色素均具有较好的抗氧化性,但都弱于VC。萃取后仍然保留了黑胡萝卜红色素的抗氧化能力,但有所下降,这可能是双水相萃取将糖类物质萃取到下相造成的。
3. 结论
研究了PEG6000/硫酸铵双水相体系萃取黑胡萝卜红色素的工艺条件,最佳工艺条件如下:硫酸铵质量分数为20.0%,PEG6000质量分数为14.0%,粗提液质量分数12.0%,黑胡萝卜花青素的平均萃取率为94.17%。对采用本方法得到的黑胡萝卜红色素进行抗氧化性实验,计算得到IC50值为30.51 mg/L,仍保留了其较好的清除DPPH自由基的效果。本研究为黑胡萝卜红色素的提取方法提供了参考,能够实现黑胡萝卜红色素与其糖类物质的有效分离,但对于实现企业生产而言,如何实现聚合物与花青素的分离,仍然需要进一步的研究。
-
表 1 响应面试验设计
Table 1 Design of response surface experiment
水平 因素 A:(NH4)2SO4
质量分数(%)B:PEG6000
质量分数(%)C:粗提液质量
分数(%)−1 18 12 10 0 20 14 12 1 22 16 14 表 2 响应面试验结果
Table 2 Results of response surface experiment
试验号 因素 萃取率Y(%) A B C 1 1 0 −1 88.21 2 −1 −1 0 86.89 3 −1 1 0 87.79 4 1 0 1 88.27 5 1 −1 0 88.83 6 0 −1 −1 91.17 7 0 1 −1 90.07 8 0 0 0 92.23 9 −1 0 1 85.37 10 0 0 0 95.47 11 0 −1 1 89.51 12 0 0 0 93.73 13 1 1 0 88.62 14 0 0 0 95.28 15 −1 0 −1 86.73 16 0 0 0 94.82 17 0 1 1 89.24 表 3 响应面试验方差分析结果
Table 3 Results of analysis of variance of response surface experiment
方差来源 均方和 自由度 均方 F值 P值 显著性 模型 149.17 9 16.57 14.66 0.0009 ** A 7.13 1 7.13 6.30 0.0404 * B 0.15 1 0.15 0.13 0.7301 C 1.8 1 1.80 1.59 0.2480 AB 0.57 1 0.57 0.5 0.5006 AC 0.5 1 0.50 0.45 0.5257 BC 0.17 1 0.17 0.15 0.7079 A2 85.76 1 85.76 75.85 <0.0001 ** B2 11.61 1 11.61 10.27 0.0150 * C2 29.52 1 29.52 26.11 0.0014 ** 残差 7.91 7 1.13 失拟项 0.7 3 0.23 0.13 0.9371 纯误差 7.21 4 1.8 总离差 157.08 16 注:*表示显著(P<0.05);**表示极显著(P<0.01)。 -
[1] Kammerer D, Carle R, Schieber A. Detection of peonidin and pelargonidin glycosides in black carrots (Daucus carota ssp. sativus var. atrorubens Alef.) by high-performance liquid chromatography/electrospray ionization mass spectrometry[J]. Rapid Communications in Mass Spectrometry,2003,17(21):2407−2412. doi: 10.1002/rcm.1212
[2] Ruiz A, Sanhueza M, Gómez F, et al. Changes in the content of anthocyanins, flavonols, and antioxidant activity in Fragaria ananassa var. Camarosa fruits under traditional and organic fertilization[J]. Journal of the Science of Food and Agriculture,2018:jsfa.9447. doi: 10.1002/jsfa.9447
[3] Belkacemi A, Ramassamy C. Anthocyanins protect SK-N-SH cells against acrolein-induced toxicity by preserving the cellular redox state[J]. Journal of Alzheimer's Disease,2016,50(4):981−998. doi: 10.3233/JAD-150770
[4] Kamiloglu S, Pasli A A, Ozcelik B, et al. Colour retention, anthocyanin stability and antioxidant capacity in black carrot (Daucus carota) Jams and marmalades: Effect of processing, storage conditions and in vitro gastrointestinal digestion[J]. Journal of Functional Foods,2015,13:1−10. doi: 10.1016/j.jff.2014.12.021
[5] Chang H, Yu B, Yu X P, et al. Anticancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J]. Nutrition and Cancer,2010,62(8):1128−1136. doi: 10.1080/01635581.2010.494821
[6] Sadilova E, Stintzing F C, Kammerer D R, et al. Matrix dependent impact of sugar and ascorbic acid addition on color and anthocyanin stability of black carrot, elderberry and strawberry single strength and from concentrate juices upon thermal treatment[J]. Food Research International,2009,42(8):1023−1033. doi: 10.1016/j.foodres.2009.04.008
[7] 熊玥, 孟余燕, 张伦, 等. 萝卜红色素的研究进展及未来展望[J]. 现代食品,2018(19):130−133, 136. [8] 吕晓玲, 刘楠. 黑胡萝卜色素精制工艺及其体外抗氧化性的研究[J]. 食品研究与开发,2008,29(12):74−78. doi: 10.3969/j.issn.1005-6521.2008.12.022 [9] 高攀峰, 侯金丽, 傅海燕, 等. 紫甘蓝花青素三种提取工艺对比研究[J]. 食品研究与开发,2015,36(12):36−40. doi: 10.3969/j.issn.1005-6521.2015.12.009 [10] Maran J P, Priya B, Manikandan S. Modeling and optimization of supercritical fluid extraction of anthocyanin and phenolic compounds from Syzygium cumini fruit pulp[J]. Journal of Food Science and Technology,2014,51(9):1938−1946. doi: 10.1007/s13197-013-1237-y
[11] 崔丽霞, 张志军, 李晓君, 等. 花青素提取、分离纯化技术研究进展[J]. 食品研究与开发,2017,38(20):195−199. doi: 10.3969/j.issn.1005-6521.2017.20.041 [12] Zhao Z L, Wu M, Zhan Y L, et al. Characterization and purification of anthocyanins from black peanut (Arachis hypogaea L.) skin by combined column chromatography[J]. Journal of Chromatography A,2017,1519:74−82. doi: 10.1016/j.chroma.2017.08.078
[13] 吴丁丁, 穆小静, 易小琦, 等. 双水相萃取技术的新发展[J]. 食品工业科技,2017,38(8):395−400. [14] Patil G, Raghavarao K S M S. Aqueous two phase extraction for purification of C-phycocyanin[J]. Biochemical Engineering Journal,2007,34(2):156−164. doi: 10.1016/j.bej.2006.11.026
[15] 胡佳钦, 向福, 吴伟, 等. 双水相萃取在天然产物提取中的应用[J]. 黑龙江畜牧兽医,2017(1):86−89. [16] Jampani C, Raghavarao K S M S. Process integration for purification and concentration of red cabbage (Brassica oleracea L.) anthocyanins[J]. Separation and Purification Technology,2015,141:10−16. doi: 10.1016/j.seppur.2014.11.024
[17] 翟硕, 张海悦, 于润美, 等. 响应面优化双水相提取黑豆皮花色苷工艺的研究[J]. 食品研究与开发,2017,38(24):24−31. doi: 10.3969/j.issn.1005-6521.2017.24.006 [18] Liu X L, Mu T H, Sun H N, et al. Optimisation of aqueous two-phase extraction of anthocyanins from purple sweet potatoes by response surface methodology[J]. Food Chemistry,2013,141(3):3034−3041. doi: 10.1016/j.foodchem.2013.05.119
[19] 李治城, 李靖靖, 潘晓静, 等. 双水相体系萃取纯化紫甘蓝色素[J]. 中国食品添加剂,2019(9):77−81. [20] Wu Y C, Wang Y, Zhang W L, et al. Extraction and preliminary purification of anthocyanins from grape juice in aqueous two-phase system[J]. Separation and Purification Technology,2014,124:170−178. doi: 10.1016/j.seppur.2014.01.025
[21] Shimada K, Fujikawa K, Yahara K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry,1992,40(6):945−948. doi: 10.1021/jf00018a005
[22] 王晗, 朱华平, 李文钊, 等. 桑葚提取物中花青素分析及其体外抗氧化活性研究[J]. 食品与发酵工业,2019,45(15):170−175. [23] Lee J, Durst R W, Wrolstad R E, et al. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study[J]. Journal of AOAC International,2005,88(5):1269−1278. doi: 10.1093/jaoac/88.5.1269
[24] DuBois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[25] 刘廷丹, 杨秀娟, 邓君明, 等. 苯酚-硫酸法测定蛤蚧酒中多糖含量[J]. 食品工业,2018,39(8):298−301. [26] 袁雷, 钟政昌, 刘瑜, 等. 响应面法优化血满草多糖双水相萃取工艺[J]. 安徽农业科学,2020,48(13):179−182, 234. doi: 10.3969/j.issn.0517-6611.2020.13.049 [27] 邵圣娟, 卫静莉. 聚乙二醇-硫酸铵双水相体系萃取松花粉中总黄酮的工艺研究[J]. 食品工业科技,2017,38(11):266−269, 275. [28] 杨利民, 吕金萍, 冯妍. 蒲公英总黄酮在聚乙二醇-硫酸铵双水相体系中的分配与提取[J]. 化工进展,2014,33(8):1992−1996, 2011. [29] 欧阳文, 王家坚, 熊利芝. 聚乙二醇-硫酸铵双水相体系分离纯化黄花蒿黄酮的研究[J]. 食品工业科技,2014,35(15):196−199. [30] 黄莉娟, 胡蝶, 张萍, 等. 柑橘的抗氧化活性研究[J]. 现代食品科技,2012,28(4):399−401. -
期刊类型引用(2)
1. 常逍柯,田潇凌,林顺顺,李梦琴,田争争,高恩红. 不同制粉方式对黑小麦全麦粉及饼干品质影响. 食品与发酵工业. 2024(21): 266-272 .  百度学术
百度学术
2. 王冬,任健,王志鹏,宋春丽. 酶预处理对黑珍珠糯玉米粉分散性的影响研究. 齐齐哈尔大学学报(自然科学版). 2023(05): 69-75 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:







 下载:
下载:



