Optimization of Extraction Technology and Storage Stability of Polyphenols from Pomegranate Peel
-
摘要: 目的:优化石榴皮中多酚的超声辅助法提取工艺;研究不同质量分数的蔗糖酯和单甘酯分别与食用油和水形成的乳化体系对多酚储藏稳定性的影响。以多酚含量为关键指标,通过单因素实验确定了多酚提取的最佳因素,通过正交试验确定了因素的主次和最佳组合,以多酚留存率为关键指标来评价两种乳化剂对多酚储藏稳定性的影响。结果:优化后的石榴皮中多酚超声辅助法提取工艺为:成熟程度为幼期,料液比为1:5,提取温度为20 ℃,提取时间为50 min,提取最佳多酚含量为11.47 mg/g。在0~4 ℃下储藏15 d后,1%蔗糖酯溶于水中与多酚粗提液形成的乳化体系多酚留存率为104.24%,储藏效果最佳。多酚留存率随着乳化剂质量分数的增加呈上升趋势,乳化剂溶解于水中的作用效果优于溶解于食用油中,蔗糖酯的作用效果优于单甘酯。Abstract: Objective: To optimize the ultrasonic assisted extraction technology of polyphenols from pomegranate peel and study the effect of the emulsification system of sucrose ester and monoglyceride with different mass fraction on the storage stability of polyphenols. The best factors of polyphenol extraction were determined by single factor experiment, and the primary and secondary factors and the best combination were determined by orthogonal experiment with the polyphenol content as the key index. The influence of two emulsifiers on the storage stability of polyphenols was evaluated with the retention rate of polyphenols as the key index. Results: The optimized ultrasonic assisted extraction process of polyphenols from pomegranate peel was as follows: The maturity was young, the solid-liquid ratio was 1:5, the extraction temperature was 20 ℃, the extraction time was 50 min, and the optimal extraction yield of polyphenols was 11.47 mg/g. After 15 days of storage at 0~4 ℃, the emulsification system formed by 1% sucrose ester dissolved in water and polyphenol crude extract has the best retention rate of polyphenols of 104.24%. The retention rate of polyphenols increased with the increase of emulsifier mass fraction, the effect of emulsifier in water was better than that in edible oil, and the effect of sucrose ester was better than that of monoglyceride.
-
Keywords:
- polyphenols /
- storage stability /
- emulsifier /
- extraction process optimization
-
石榴富含维生素、有机酸、糖类、蛋白质、脂肪,钙、磷、钾等矿物质[1],以及丰富的多酚类物质,具有抗菌、抗病毒、抗癌[2]和保护心脑血管[3]及止血[4]的药用价值。
目前,对于多酚的提取方法主要有溶剂提取法、微波辅助提取法、超声波辅助提取法和超临界流体萃取法,而相比较来说超声波辅助提取法能有效提高总多酚的提取速率,具有时间短、提取量高的优点。但是,不同的超声波工艺在实际应用方面效果存在一定差异。因此,需要进一步探究石榴多酚的最佳提取工艺。本研究首先进行了多酚最佳提取工艺的确定,为后续研究多酚储藏稳定性打下了基础。目前,针对多酚的研究主要集中在抑菌和抗氧化的功能上,对其储藏稳定性的研究却比较少见,而乳化剂可以提高食品品质[5]。及保存性质[6]。
本研究将石榴多酚与乳化剂复配后,来研究乳化剂对多酚储藏稳定性的影响,旨在解决多酚储藏时不稳定、暴露在空气中易被氧化的问题,以期为多酚类天然活性物质的储藏稳定性提供理论依据。首先,以80%甲醇作为提取剂,利用超声波辅助法[7],通过单因素和正交试验确定本探究中多酚的最佳提取工艺;由于乳化剂具有良好的保鲜及抗氧化[8]特性,利用这一特性将多酚与单硬脂酸甘油酯[9]和蔗糖脂肪酸酯两种乳化剂制成不同的乳化体系,加入到石榴多酚提取液中,通过实验确定石榴多酚的最佳保存方法,研究不同乳化体系对多酚提取液储藏稳定性的影响。
1. 材料与方法
1.1 材料与仪器
石榴 突尼斯软籽石榴;甲醇(色谱纯) 天津赛孚瑞科技有限公司、没食子酸(99%) 安徽酷尔生物工程有限公司、福林-酚试剂Ⅱ(1mol/L H+) 天津市光复精细化工研究所;无水碳酸钠(分析纯) 天津奥普升化工有限公司;单硬脂酸甘油酯(食品级) 河南千志商贸有限公司;SE-11蔗糖脂肪酸酯(食品级) 柳州爱格富食品科技股份有限公司。
KS-100B旋钮超声波清洗器 昆山洁力美超声仪器有限公司;ThermoHeraeus Multifuge X1R台式离心机 美国Thermo公司;PA3201B电子天平 上海天美天平仪器有限公司;HH2恒温水浴锅 上海博迅实业有限公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司;SK-1快速混匀器 金坛市科析仪器有限公司;TGL-18B台式高速离心机 上海安亭科学仪器厂
1.2 实验方法
1.2.1 石榴多酚提取工艺
采用齐迪[10]的提取方法并略有改动,取1 g新鲜石榴皮放入研钵研碎。加入80%的甲醇作为浸提剂,多次冲洗研钵将研碎的石榴皮转移到小烧杯中。然后放入超声波清洗器中,在不同条件下提取多酚,比较多酚含量,得出最优提取工艺。超声结束后将固体和液体转移到离心管中进行离心,离心条件为5 ℃、转速为10000 r/min,15 min。上清即为石榴皮多酚的提取液[11]。
1.2.2 石榴多酚提取单因素实验
设置超声波功率固定为160 W,80%的甲醇[12]作为浸提液,在条件相同下,以多酚含量为指标,分别考察成熟程度(幼期7~8月、成熟前期8~9月、成熟期9~10月、成熟后期10~11月)、料液比[13](1:5、1:10、1:15、1:20、1:25)、提取时间[14](10、20、30、40、50 min)、提取温度[15](10、20、30、40、50 ℃)、避光反应时间(10、20、30、40、50 min)5个因素影响。
1.2.3 多酚测定方法
样品测定:采用齐迪[10]的测定方法,并略有改动。将一定量的多酚粗提液稀释至100倍,取1 mL稀释液于试管中并分别加入福林-酚试剂Ⅱ 0.2 mL,水6 mL,10%碳酸钠1 mL。在室温下避光反应30 min,在A=765 nm下测定吸光值。用水做空白对照,每组三个平行。
以没食子酸标准溶液中溶质溶度(mg/mL)为X轴,吸光度A为Y轴,绘制标准曲线,标准曲线方程为:y=12.149x+0.0093,R2=0.9991。
式中,c:没食子酸浓度,mg/mL;m:石榴皮质量,g;v:稀释液体积,mL。
1.2.4 正交实验
在单因素实验的基础上,考察因素为成熟程度、料液比、提取温度、提取时间,以多酚含量为考察指标,对超声波辅助法提取石榴皮多酚的提取工艺进行研究。正交试验因素水平表如表1[16]所示。
表 1 正交实验因素表Table 1. Factors and levels table of orthogonal experiment水平 因素 A成熟程度 B料液比(g/mL) C提取温度(℃) D提取时间(min) 1 幼期 1:5 10 30 2 成熟期 1:10 20 40 3 成熟后期 1:15 30 50 1.2.5 不同乳化剂对多酚储藏稳定性的影响
本实验分别探究质量分数(乳化剂与粗提液质量比)为0.6%、0.8%、1%的蔗糖脂肪酸酯[17]和单硬脂酸甘油酯[17]溶解于食用油和水中对石榴皮多酚粗提液储藏稳定性的影响。共形成12种不同的乳化体系(蔗糖酯可做抗老化剂[18],探究储藏效果),设置不同的时间梯度,在765 nm下测定吸光值,以吸光值的变化率为储藏率指标。
制备方法:分别称取质量分数0.6%、0.8%、1%的两种乳化剂与2 mL的调和油和水分别混合,放入水浴锅中5 min(70 ℃左右),用快速混匀器辅助使其充分混合形成乳化体系,用石榴皮多酚的粗提液定容到10 mL(1:5)。再次放入水浴锅中3 min(70 ℃左右),使其与多酚粗提液充分混合,取部分液体于离心管中,10000 r/min离心3 min,取上清测定其吸光值。其余液体放入5 ℃左右的冰箱中储藏。
1.3 数据处理
所有试验平行测定3次,单因素实验、储藏稳定性试验数据处理及正交试验表格用Excel作图,用SPSS 20.0软件进行正交分析、方差分析,以P<0.05表示有统计学意义。
2. 结果与分析
2.1 单因素实验结果
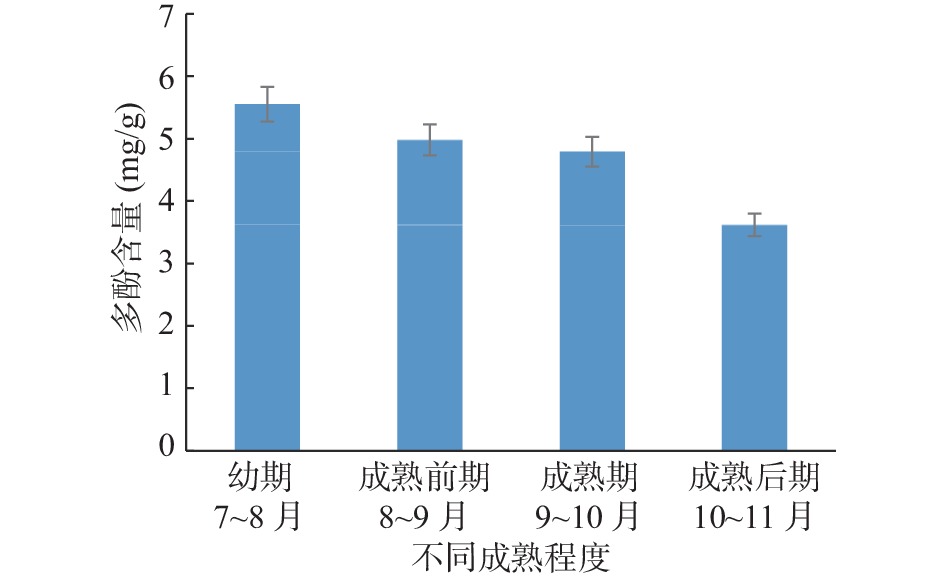
2.1.1 成熟程度对石榴多酚提取的影响
由图1可知,石榴的不同成熟程度对石榴皮多酚的提取存在较大的影响,石榴在生长7~8个月的幼期时,石榴皮多酚含量达到5.55 mg/g,石榴在生长10~11个月的成熟后期多酚含量最低,降至3.62 mg/g。在石榴整个生长过程中,石榴皮多酚含量变化率在53.3%左右,随着石榴的不断成熟,石榴皮多酚的含量逐渐下降,不同的时期石榴皮多酚含量存在明显差异,因此在石榴皮多酚提取的优化中,不同的成熟程度为重要单因素之一。原因可能是,随着石榴的生长,其石榴表皮细胞经历成熟、老化的生理过程,在这个过程中细胞内部生理代谢旺盛,需要消耗大量的有机物质及营养物质,且产生一些氧化物质,从而消耗部分多酚类物质参与细胞内的氧化过程,随着细胞的逐渐衰老,次级代谢产物的消耗大于积累,造成多酚含量逐渐降低。因此石榴皮多酚提取的最佳时期在幼期。
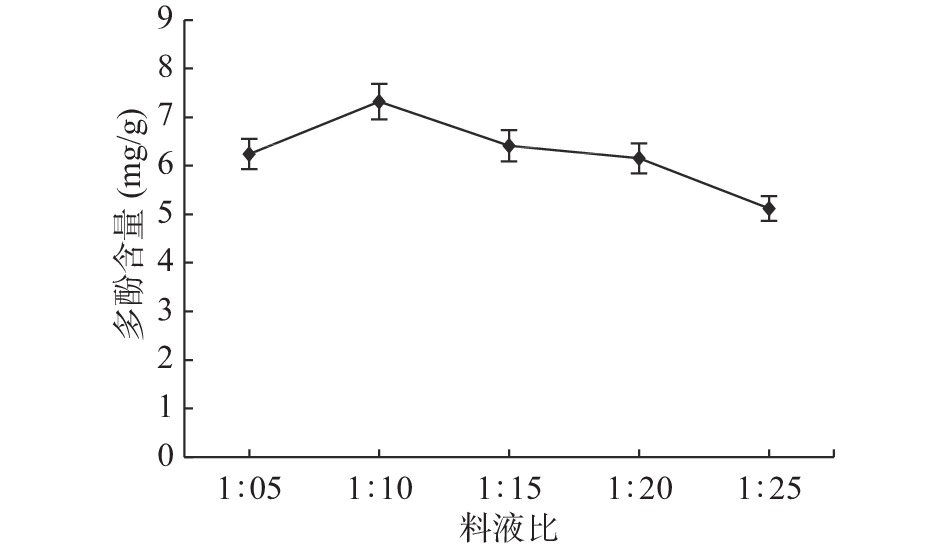
2.1.2 料液比对石榴多酚提取的影响
由图2可知,从料液比在1:5~1:10之间,多酚含量随之上升,当料液比为1:10时,多酚含量达到最大值7.3 mg/g,此时提取率达17.31%;当料液比大于1:10时,多酚含量逐渐降低。这是因为当料液比增大时,多酚等物质向细胞外扩散的浓度梯度逐渐增大,扩散速率加快,使得多酚能够更多地进入到溶液中,多酚含量逐渐升高[19]。但料液比达到一定程度以后,该扩散速率达到最大值,多酚得率不再升高,继续增加溶剂反而会稀释多酚提取液溶度[20]。因此,适宜的料液比为1:10。
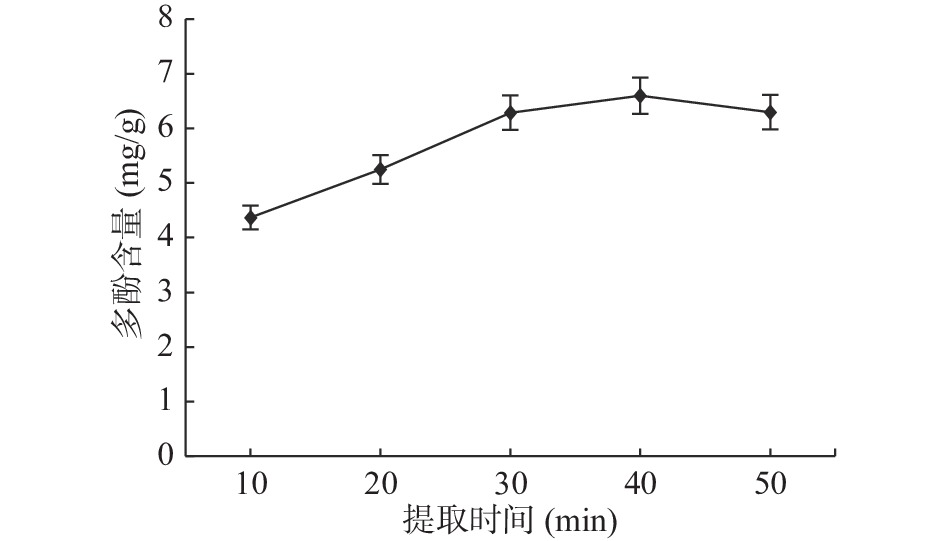
2.1.3 提取时间对石榴多酚提取的影响
由图3可知,提取时间由10~40 min之间多酚含量呈上升趋势,提取时间为40 min时,多酚含量达最大值为6.6 mg/g,提取率达33.79%,此后多酚含量出现下降趋势。如果多酚提取时间太短,胞内物质不易溶出,10 min时多酚含量仅为4.37 mg/g,提取率比较低;如果提取时间过长,多酚类物质结构容易遭到破坏,从而影响石榴皮多酚提取效果[21]。因此,适宜的提取时间为40 min。
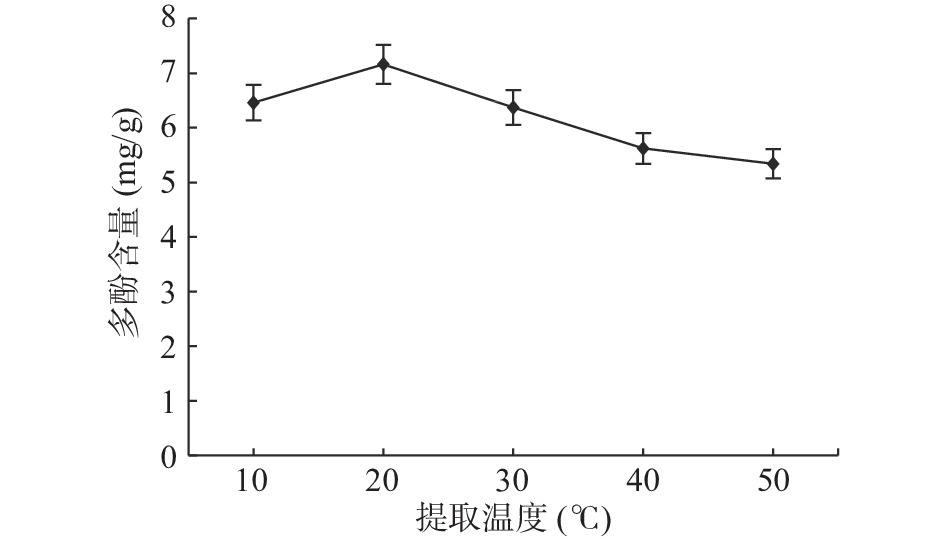
2.1.4 提取温度对石榴多酚提取的影响
由图4可知,在20 ℃时多酚含量达最大值为7.16 mg/g,在此之前,很可能是由于温度过低,导致多酚溶出速度过慢,效率比较低[22]。在20 ℃时达到最大值之后,随着温度的逐渐升高,多酚的提取量随之下降,是因为多酚类物质受热稳定性较差,过高的温度使得多酚结构容易被破坏,对多酚本身结构产生较大影响,从而导致多酚含量降低[23]。因此,适宜的提取温度为20 ℃左右。
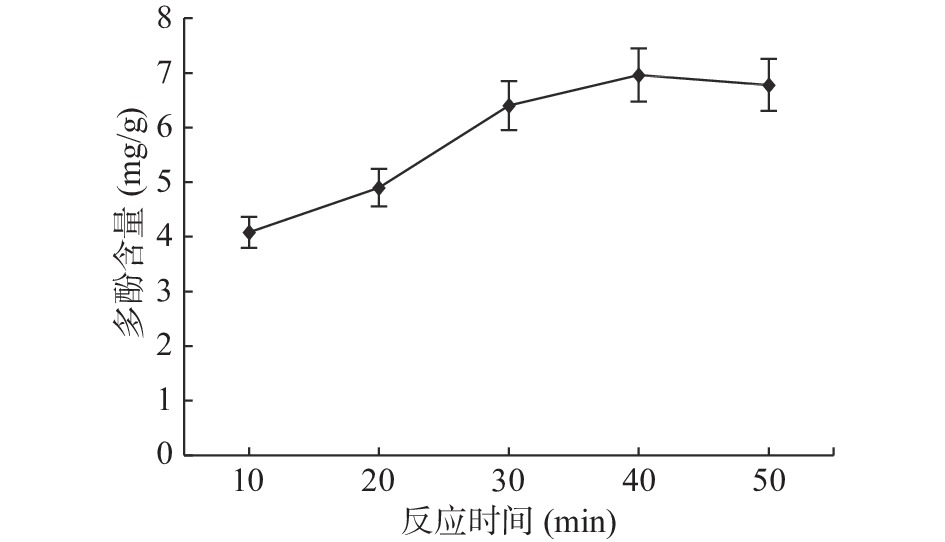
2.1.5 避光反应时间对石榴多酚提取的影响
由图5可知,避光反应时间在30~50 min之间时多酚含量趋于平稳,10、20 min时多酚含量明显低于30 min时的多酚含量,20 min时多酚含量为4.90 mg/g,与最高值相差42.04%,因此避光反应时间对多酚含量测定存在较大影响。原因可能是在30 min之前,该体系反应不完全,导致吸光值低。因此,适宜的反应时间为40 min。
因为避光反应时间在30~50 min范围内变化趋势不明显,因此不选做正交试验考察因素。综上,选取成熟度、料液比、提取时间、提取温度四个因素进行正交试验。
2.2 正交试验
为了进一步探究各因素对石榴皮多酚超声提取的影响,对表2中的数据进行方差分析,由于D因素的R值最小,将其作为空白列进行分析,结果如表3所示。
表 2 正交试验结果Table 2. Results of orthogonal experiment试验号 因素 多酚含量(mg/g) A B C D 1 1 1 1 1 10.27 2 1 2 2 2 8.66 3 1 3 3 3 5.51 4 2 1 1 1 10.74 5 2 2 2 2 5.83 6 2 3 3 3 4.24 7 3 1 1 1 4.59 8 3 2 2 2 7.03 9 3 3 3 3 4.45 k1 8.147 8.533 7.180 6.850 k2 6.937 7.173 7.950 5.830 k3 5.357 4.733 5.310 7.760 R 2.790 3.800 2.640 1.930 因素主次 B>A>C>D 最佳组合 A1B1C2D3 表 3 方差分析结果Table 3. Analysis results of variance方差来源 偏差平方和 自由度 F比 F临界值 显著性 A 11.745 2 2.100 19.000 B 22.243 2 3.977 19.000 C 11.059 2 1.977 19.000 误差 5.59 2 由表3可知,对石榴皮多酚超声波辅助法提取工艺优化试验中,所考察的四个因素对石榴皮多酚的提取均无显著性影响。由表2可知,表中最佳的为4组合A2B1C1D1,总多酚的含量为10.74 mg/g,由k值得到的最佳组合为A1B1C2D3。为验证结果,分别用A1B1C2D3和A2B1C1D1两种提取方法提取多酚,石榴皮多酚的含量分别为11.47 mg/g和10.11 mg/g。结果表明,石榴皮多酚提取的最佳工艺条件是:A1B1C2D3,即:成熟程度为幼期,料液比为1:5,提取温度为20 ℃,提取时间为50 min。
2.3 不同乳化体系对多酚提取液储藏稳定性的影响
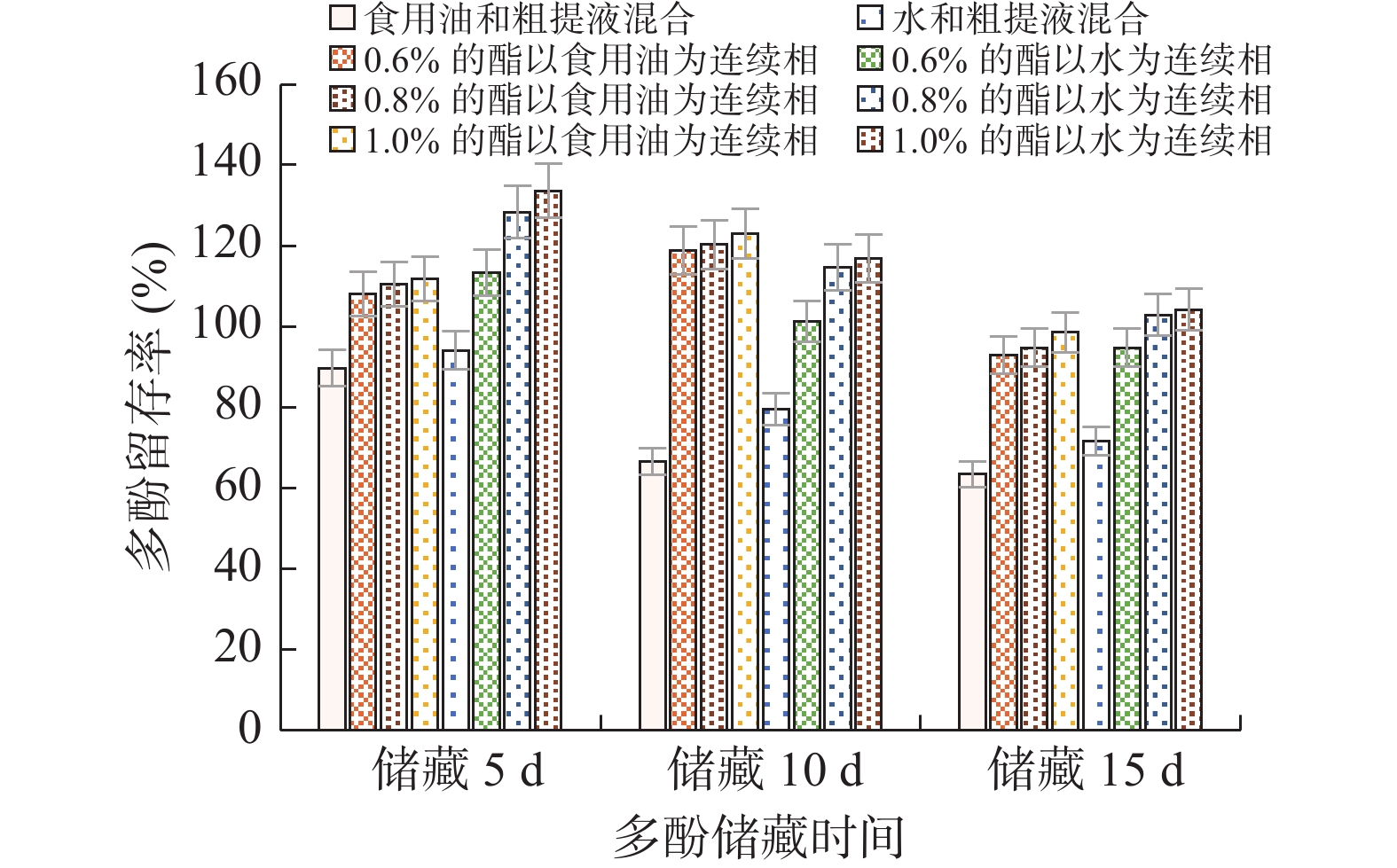
2.3.1 蔗糖脂肪酸酯对多酚粗提液稳定性影响
通过研究蔗糖酯分别以水和食用油为连续相形成的6种不同的乳化体系发现(图6),以食用油为连续相的实验组,没有以水为连续相时的留存率高。储藏15 d后,以食用油为连续相的实验组中,质量分数为1.0%的乳化体系多酚留存率最高,达98.58%,对照组仅为63.34%;以水为连续相的实验组中,质量分数为1.0%的乳化体系多酚留存率最高,达104.24%,对照组仅为71.62%,以水为连续相储藏效果优于以食用油为连续相。这是由于蔗糖酯是水溶性表面活性剂,在水相中具有更好的分散和稳定性[24]。但是,不管在油相还是水相中,随着蔗糖酯质量分数的增加,多酚留存率均呈上升趋势,说明蔗糖酯形成的乳化体系对多酚的储藏有积极作用,且在一定范围内与其质量分数呈正相关关系。
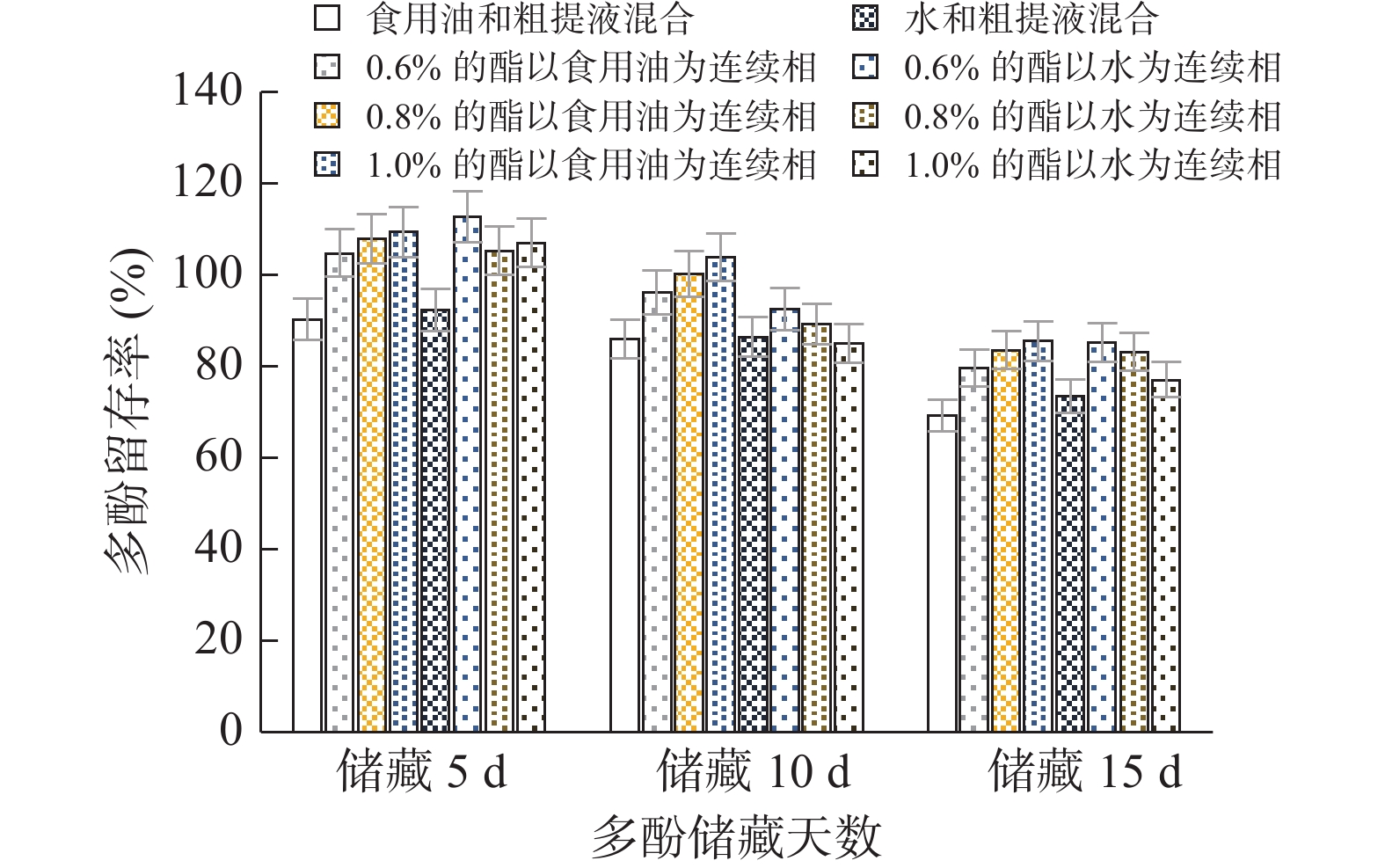
2.3.2 单硬脂酸甘油酯对多酚粗提液稳定性影响
由图7可知,以食用油为连续相的实验组,比以水为连续相时留存率高。储藏15 d后,以食用油为连续相的实验组中,质量分数为1.0%的乳化体系多酚留存率最高,达85.42%,对照组仅为69.24%;以水为连续相的实验组中,质量分数为0.6%的乳化体系多酚留存率最高,达85.14%,对照组仅为73.45%,说明单甘脂在以食用油为连续相时储藏效果优于以水为连续相。这是由于单甘脂为脂溶性表面活性剂,在油相中具有更好的分散和稳定性。但是,与蔗糖酯相比,单甘脂的保存效果仍然偏低,故对于石榴多酚储藏稳定性来说,质量分数为1.0%的蔗糖酯与水形成的乳化体系保存效果最佳。
3. 结论
首先采用单因素和正交试验的方法,得到了各因素对石榴皮多酚粗提液的影响大小:料液比>成熟程度>提取温度>提取时间。优化的石榴皮多酚超声辅助法提取工艺为:成熟程度为幼期,料液比为1:5,提取温度为20 ℃,提取时间为50 min,此时多酚最佳含量为11.47 mg/g。
在储藏稳定性实验中,蔗糖酯以水为连续相形成的乳化体系对石榴多酚储藏效果优于以食用油为连续相,而单甘酯则与之相反。这与两种表面活性剂的HLB值有关,亲水亲油性决定了它们形成复合体系的分散和稳定性,也决定了它们对多酚的保护作用。这两种不同的乳化剂相比,蔗糖酯对多酚储藏稳定性的作用效果优于单甘酯,且效果在一定范围内与蔗糖酯的添加量呈正相关关系。
-
表 1 正交实验因素表
Table 1 Factors and levels table of orthogonal experiment
水平 因素 A成熟程度 B料液比(g/mL) C提取温度(℃) D提取时间(min) 1 幼期 1:5 10 30 2 成熟期 1:10 20 40 3 成熟后期 1:15 30 50 表 2 正交试验结果
Table 2 Results of orthogonal experiment
试验号 因素 多酚含量(mg/g) A B C D 1 1 1 1 1 10.27 2 1 2 2 2 8.66 3 1 3 3 3 5.51 4 2 1 1 1 10.74 5 2 2 2 2 5.83 6 2 3 3 3 4.24 7 3 1 1 1 4.59 8 3 2 2 2 7.03 9 3 3 3 3 4.45 k1 8.147 8.533 7.180 6.850 k2 6.937 7.173 7.950 5.830 k3 5.357 4.733 5.310 7.760 R 2.790 3.800 2.640 1.930 因素主次 B>A>C>D 最佳组合 A1B1C2D3 表 3 方差分析结果
Table 3 Analysis results of variance
方差来源 偏差平方和 自由度 F比 F临界值 显著性 A 11.745 2 2.100 19.000 B 22.243 2 3.977 19.000 C 11.059 2 1.977 19.000 误差 5.59 2 -
[1] 周强, 赵欣欣, 孙静, 等. 石榴皮多酚的抗氧化性及其对PC12细胞增殖的影响[J]. 泰山医学院学报,2019,40(5):331−335. doi: 10.3969/j.issn.1004-7115.2019.05.004 [2] 李婕姝, 贾冬英, 姚开, 等. 石榴的生物活性成分及其药理作用研究进展[J]. 中国现代中药,2009,11(9):7−10. doi: 10.3969/j.issn.1673-4890.2009.09.003 [3] Qian Zhang, Dongying Jia, Kai Yao. Antiliperoxidant activity of pomegranate peel extracts on lard[J]. Natural Product Research,2007,21(3):211−216. doi: 10.1080/14786410601130422
[4] 王彩云. 石榴叶多酚的提取富集工艺及其药理作用研究[D]. 北京: 北京林业大学, 2013: 7−25. [5] Murray B S. Interfacial rheology of food emulsifiers and proteins-ScienceDirect[J]. Current Opinion in Colloid & Interface Science,2002,7(5):426−431.
[6] 王丽芳, 王修俊, 郑君花, 等. 复合磷酸盐食品添加剂对鲜切梨保鲜效果的研究[J]. 中国食品添加剂,2013(4):186−189. [7] 王妮, 高子怡, 范建凤, 等. 正交试验优化红芸豆多酚超声辅助提取工艺[J]. 粮食与油脂,2019,280(8):98−100. doi: 10.3969/j.issn.1008-9578.2019.08.026 [8] 朱蝶, 胡蓝, 汪师帅. 乳化剂分类、作用及在食品工业中应用[J]. 粮食流通技术,2019,5(9):7−10, 13. [9] 周路, 洪梅, 顾怡, 等. 单硬脂酸甘油酯的应用研究及其生产工艺现状[J]. 化工时刊,2013(5):45−46. [10] 齐迪. 不同品种石榴多酚提取工艺及其抗氧化活性的研究[D]. 杨凌: 西北农林科技大学, 2011: 6−13. [11] 陈建福, 林洵, 许商荣, 等. 超声波辅助法提取白兰叶多酚的工艺研究[J]. 中国食品添加剂,2016(7):150−156. doi: 10.3969/j.issn.1006-2513.2016.07.016 [12] 房玉林, 齐迪, 郭志君, 等. 超声波辅助法提取石榴皮中总多酚工艺[J]. 食品科学,2012,33(6):115−118. [13] 任亚梅, 李光辉, 许永涛. 石榴籽多酚的提取及其种壳种仁抗氧化活性研究[J]. 食品科学,2012,33(4):31−35. [14] 齐泊霖, 高尊, 谢春阳. 响应面法优化超声波辅助法提取稠李子多酚的工艺研究[J]. 食品研究与开发,2019,40(4):79−84. [15] 李国秀. 石榴多酚类物质的分类鉴定和抗氧化活性研究[D]. 西安: 陕西师范大学, 2008: 17−22. [16] 李利华. 正交实验法优选花椒多酚的超声波辅助提取工艺[J]. 中国调味品,2018,43(4):5−7, 31. [17] 穆谈航, 吴凤凤, 周戈, 等. 蔗糖酯和单甘酯对速冻韭菜水饺馅品质控制作用的比较[J]. 食品科学,2014,35(22):308−312. [18] 郑立夫, 叶妍悦. 蔗糖脂肪酸酯在食品加工中的应用研究[J]. 浙江化工,2019,50(8):14−15. doi: 10.3969/j.issn.1006-4184.2019.08.005 [19] 许汝, 王珊珊, 谷舞, 等. 石榴皮多酚提取工艺优化及抑菌活性研究[J]. 粮油食品科技,2016(6):87−92. doi: 10.3969/j.issn.1007-7561.2016.06.019 [20] Yang L, Jiang J G, Li W F, et al. Optimum extraction process of polyphenols from the bark of Phyllanthus emblica L. based on the response surface methodology[J]. Journal of Separation Science,2015,32(9):1437−1444.
[21] Zhang W M, Huang W Y, Chen W X, et al. Optimization of extraction conditions of areca seed polyphenols and evaluation of their antioxidant activities[J]. Molecules,2014,19(10):16416−16427. doi: 10.3390/molecules191016416
[22] 吴林秀, 胡荣康, 陈艺煊, 等. 竹荪中多酚提取工艺优化及其抗氧化活性研究[J]. 食品工业科技,2017,38(7):203−206. [23] Teng H, Lee W Y, Choi Y H. Erratum to: Optimization of ultrasonic-assisted extraction of polyphenols, anthocyanins, and antioxidants from raspberry (Rubus coreanus Miq.) using response surface methodology[J]. Food Analytical Methods,2015,7(7):1536−1545.
[24] 刘盼盼, 许苗苗, 祁文静, 等. 不同单硬脂酸甘油酯含量的大豆油油凝胶性能和微观结构分析[J]. 南京农业大学学报,2018,41(3):547−554. doi: 10.7685/jnau.201706046






 下载:
下载:
 下载:
下载:



